硝酸钠氯化钾生产硝酸钾工艺
硝酸钾生产工艺
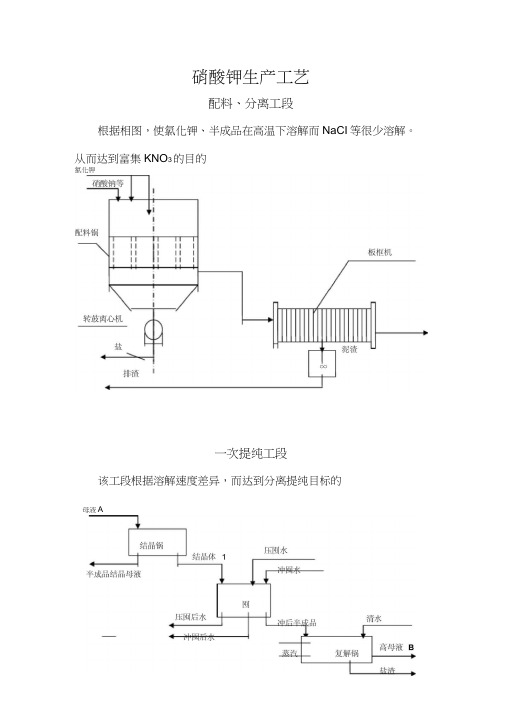
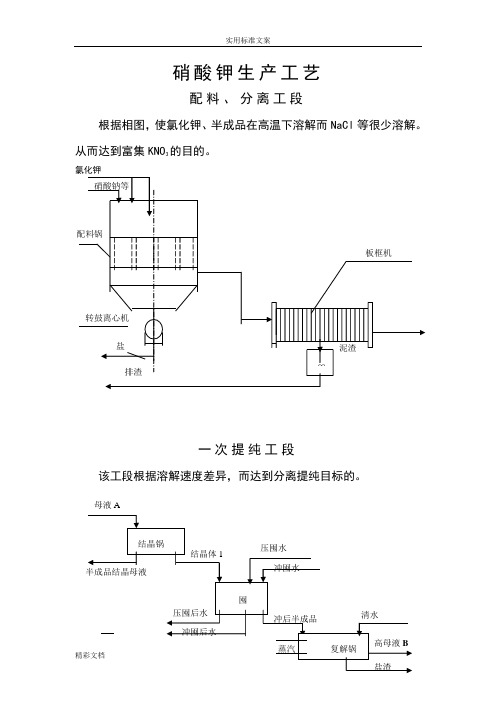
硝酸钾生产工艺配料、分离工段根据相图,使氯化钾、半成品在高温下溶解而NaCI等很少溶解。
从而达到富集KNO3的目的氯化钾一次提纯工段该工段根据溶解速度差异,而达到分离提纯目标的母液A二次提纯工段该工段是重复上一工段的重要部分, 再次提高产品质量,原理也 与上类同,为高温溶解,低温结晶 NaCI 溶解速度快等原理。
成品加工工段经以上工段主离子含量已达到合格, 而水份较高。
通过干燥器使 水份含量达到合格,产品粒度不均通过振动筛使之合格,装袋,即可 向外销售,而完成生产工序。
硝酸钾,分子式为 KN03无色透明棱柱晶体或粉末,溶于水、稀乙醇、甘油,不溶于无水乙醇和乙醚。
无嗅无毒,味咸辣有清凉感。
空气中不潮解。
在 334C 分解放出氧,400C 时分解放出氧气,生成亚硝酸钾,继续加热则生成氧化钾。
是强氧化剂,与易燃物,有机物接触能引起燃烧爆炸,并发生有毒和刺激性气体。
与炭或硫一起加热时,能发强光而燃烧。
一咼母液E离心水(同冲囤后水)蒸汽硝酸钾-主要用途医药工业主要用于生产青霉素钾盐、利福平和利尿、发汗、清凉的药剂。
食品工业用于配肉,并在午餐肉中起防腐剂作用。
机械工业用于热处理(金属淬火)作淬火之盐浴。
玻璃工业用于玻璃器皿生产,起耐温硬化玻料的作用,还用作玻璃澄清剂。
农业上用作农作物和花卉的复合肥料。
⑴分析试剂,用于锰、钠的微量分析。
复分解法硝酸钠与氯化钾经复分解反应得硝酸钾和氯化钠。
利用它们的不同溶解度可将其分离。
此法工业上应用较多。
先把硝酸钠溶于热水中,在搅拌下按硝酸钠:氯化钾=100:85的配料比逐渐加入氯化钾,经蒸发浓缩,当温度为119°C时,氯化钠结晶析出。
将分离氯化钠后的母液缓慢冷却,硝酸钾即结晶析出。
经过滤、洗涤和干燥即得产品。
危害性爆炸物危险特性:与有机物、硫磷等混合可爆储运特性:库房通风;轻装轻卸;与有机物、还原剂、木炭、硫磷易燃物分开存放可燃性危险特性:高热放出氧气;遇有机物、还原剂、木炭、硫、磷等易燃物可燃;燃烧产生有毒氮氧化物烟雾防护措施工程控制:生产过程密闭,加强通风。
硝酸钠氯化钾生产硝酸钾工艺

硝酸钠氯化钾生产硝酸钾工艺
一、配料
根据相图,使氯化钾、硝酸钠在高温下溶解而NaCl等很少溶解。
从而达到富集KNO3的目的。
提纯工段
该工段根据溶解速度差异,而达到分离提纯目标的。
母液A
提纯工段
该工段是重复上一工段的重要部分,再次提高产品质量,原理也与上类同,为高温溶解,低温结晶NaCl 溶解速度快等原理。
成品工段
经以上工段主离子含量已达到合格,而水份较高。
通过干燥器使水份含量达到合格,产品粒度不均通过振动筛使之合格,装袋,即可向外销售,而完成生产工序。
高母液B
离心水
螺旋输送机。
2022年上海市金山区高三最后一模化学试题含解析

2021-2022高考化学模拟试卷含解析注意事项:1.答题前,考生先将自己的姓名、准考证号码填写清楚,将条形码准确粘贴在条形码区域内。
2.答题时请按要求用笔。
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试卷上答题无效。
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折暴、不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
一、选择题(共包括22个小题。
每小题均只有一个符合题意的选项)1、下列实验能达到实验目的且符合安全要求的是()A.利用排空气法收集CO2B.收集氧气C.制备并检验氢气的可燃性D.稀释浓硫酸2、催化加氢可生成3-甲基戊烷的是A.B.C .D .3、用N A 表示阿伏加德罗常数的值。
下列叙述正确的是 A .N A 个Al(OH)3胶体粒子的质量为78g B .常温常压下,2.24L H 2含氢原子数小于0.2N AC .136gCaSO 4与KHSO 4的固体混合物中含有的阴离子的数目大于N AD .0.1mol •L -1FeCl 3溶液中含有的Fe 3+数目一定小于0.1N A 4、N A 为阿伏伽德罗常数的值,下列说法正确的是 A .1mol OH - 含有的电子数目为 N AB .1L 1 mol·L -1 Na 2CO 3 溶液中含有的 CO 32-数目为 N AC .0.5mol 苯中含有碳碳双键的数目为 1.5N AD .24 克 O 3 中氧原子的数目为 1.5N A5、工业酸性废水中的227Cr O -可转化为3Cr +除去,实验室用电解法模拟该过程,结果如下表所示(实验开始时溶液体积为27250mL,Cr O -的起始浓度、电压、电解时间均相同),下列说法中,不正确...的是( ) 实验 ① ② ③电解条件阴、阳极均为石墨阴、阳极均为石墨,滴加1mL 浓硫酸阴极为石墨,阳极为铁,滴加1mL 浓硫酸227Cr O -的去除率%0.922 12.7 57.3A .对比实验①②可知,降低pH 可以提高227Cr O -的去除率B .实验②中,227Cr O -在阴极放电的电极反应式是23272Cr O 6e 14H 2Cr 7H O --++++=+C .实验③中,227Cr O -去除率提高的原因是阳极产物还原227Cr O -D .实验③中,理论上电路中每通过3mol 电子,则有0.5mol 227Cr O -被还原6、下列有关NaClO 和NaCl 混合溶液的叙述正确的是( )A .向该溶液中加入浓盐酸,每产生21molCl ,转移电子约为236.0210⨯个B .该溶液中,++-33Ag K NO CH CHO 、、、可以大量共存C .滴入少量4FeSO 溶液,反应的离子方程式为:2+-+-3+22Fe +ClO +2H =Cl +2Fe +H OD .为验证ClO -的水解,用pH 试纸测该溶液的pH7、在加热条件下,乙醇转化为有机物R 的过程如图所示,其中错误的是A .R 的化学式为C 2H 4OB .乙醇发生了还原反应C .反应过程中固体有红黑交替变化的现象D .乙二醇(HO-CH 2-CH 2-OH )也能发生类似反应8、将一定体积的CO 2缓慢地通入V L NaOH 溶液中,已知NaOH 完全反应,若在反应后的溶液中加入足量石灰水,得到ag 沉淀;若在反应后的溶液中加入足量CaCl 2溶液,得到bg 沉淀,则下列说法正确的是 A .参加反应的CO 2的体积为0.224 aLB .若a=b ,则CO 2与NaOH 溶液反应的产物中盐只有Na 2CO 3C .b 可能等于a 、小于a 或大于aD .不能确定NaOH 溶液的物质的量浓度 9、下列说法正确的是A .离子晶体中可能含有共价键,但不一定含有金属元素B .分子晶体中一定含有共价键C .非极性分子中一定存在非极性键D .对于组成结构相似的分子晶体,一定是相对分子质量越大,熔沸点越高 10、化学与生活密切相关。
1.3 《硝酸钾晶体的制备》

垂直上移至曲线后不再变化
降低温度 沿曲线下移到C 水平左移至C再沿曲线下移
垂直下移
课外习题:溶解度概念计算
• 参照课本P15实验方案: 1、请计算析出的氯化钠固体和硝酸 钾固体的质量分别是多少克? 2、并计算KNO3产率。 (溶解度可参考P13数据)
抽滤: 得KNO3晶体
称重: 精品KNO3
3、产品纯度的检验
思考3:请设计一个实验来检验两种情况 下制备得到产品的纯度大小?
2滴 有白色 AgCl↓ 0.1g粗品 KNO3+2ml水 AgNO3 2滴 0.1g晶体 KNO3+2ml水 无白色 AgCl↓ AgNO3
小结:硝酸钾晶体的实验方案
1、实验原理: NaNO3 + KCl = 2、基本流程: 1)固体溶解 天平、烧杯、 玻璃棒、酒精灯 2)蒸发、热过滤 铁架台、铜质保温漏斗 得到NaCl 3)冷却、减压过滤 吸滤瓶、安全瓶、抽气泵、布氏漏斗
3、将一定浓度的硝酸钠和氯化钾混合溶液加热至沸腾, 有晶体析出。趁热过滤,分离出晶体A。将上述滤液 冷却至室温,又有晶体B析出。 (1)晶体A的主要成分是________,可能含有的少量杂质是 NaCl KNO3 _________ KNO3 (2)晶体B的主要成分是________,含有的少量杂质是 NaCl _________,要除去晶体 B中的少量杂质的方法是 _______________. 重结晶 (3)用少量热水淋洗晶体也是一种除去晶体中少量杂质的 方法,这种方法适用于晶体 ____(填A或B)除杂。 A
疑问:粗盐提纯过程中多次用到玻璃棒,分 别起什么作用?
步骤 操作 溶解 搅拌
硝酸钾

《盐化工工艺学》课程论文论文题目:硝酸钾学生姓名:**学号: ************ 专业:化学工程与工艺班级:2012级盐气化工任课教师:***完成时间:2014年12月目录1生产简史 (1)2硝酸钾的物化性质及用途 (1)2.1物理化学性质 (1)2.2硝酸钾的应用 (1)2.3质量规格 (2)3硝酸钾的生产方法 (2)3.1合成法 (2)3.2硝酸铵转化法(复分解法) (3)3.3吸收法 (3)3.4离子交换法 (3)3.5转化法 (3)4新工艺 (4)4.1新工艺原理与流程[4] (4)4.2主要设备选型及特点 (5)4.2.1配料槽 (5)4.2.2空气冷却结晶塔 (5)4.2.3离心机 (6)4.2.4溶解槽 (6)4.2.5卧式冷却结晶器 (6)4.2.6硝酸钾洗涤机 (6)4.2.7干燥机组 (6)4.2.8蒸发设备 (6)4.3新工艺装置特点 (7)4.4生产中应注意问题 (7)结束语 (8)致谢 (9)参考文献 (10)硝酸钾【摘要】介绍了硝酸钾产品的生产简史及其主要物化性质、用途、国家标准、生产方法、典型生产方法的基本原理、工艺条件、工艺流程图以及相关的设备等。
本文重点介绍一种硝酸钠转化法制取硝酸钾新工艺。
该工艺根据传统硝酸钠生产硝酸钾经验,通过进一步试验与研究,对传统工艺与设备进行改造创新,实现连续工业化生产。
1生产简史世界硝酸钾70%用于农业,以色列和美国产量最大,约占世界总量的四分之三,智利居第三位。
1995年世界硝酸钾总能力约90万吨年,其中直接法的产量约占75%,中国硝酸钾现有生产能力约6万吨年,在建能力亦为6万吨年,其中约80%硝酸钾用于工业部门。
2硝酸钾的物化性质及用途2.1物理化学性质硝酸钾(钾硝石)是无水的白色粉末,在空气中不潮解。
有时因带有杂质而显浅灰色。
密度为2.11g/cm3334℃熔融,高于338℃,分解为亚硝酸钾和放出氧气。
硝酸钾有两种晶体,即低温时,生成斜方形结晶;高温时生成菱形结晶。
转化法制备硝酸钾实验报告

一、实验目的1. 理解转化法制备硝酸钾的原理。
2. 掌握利用不同温度下盐类溶解度差异制备硝酸钾的方法。
3. 学习结晶和重结晶的一般原理及操作。
二、实验原理转化法制备硝酸钾的原理是利用氯化钠、氯化钾、硝酸钠和硝酸钾在高温和低温下溶解度的差异。
具体反应如下:NaNO3 + KCl → NaCl + KNO3在高温下,氯化钠和氯化钾的溶解度较大,而硝酸钾的溶解度较小,因此在高温下将反应混合物溶解,冷却后硝酸钾会从溶液中析出。
氯化钠的溶解度随温度变化不大,因此可以分离出纯净的硝酸钾晶体。
三、实验用品1. 实验器材:烧杯、玻璃棒、漏斗、布氏漏斗、抽滤瓶、蒸发皿、酒精灯、铁架台、温度计等。
2. 实验试剂:氯化钠、氯化钾、硝酸钠、硝酸钾、蒸馏水。
四、实验步骤1. 称取11g NaNO3和15g KCl,置于烧杯中。
2. 加入约17.5mL蒸馏水,用玻璃棒搅拌溶解。
3. 将烧杯置于酒精灯上加热,保持溶液微沸状态,直至溶液体积浓缩至约10mL。
4. 关闭酒精灯,让溶液自然冷却至室温。
5. 观察溶液中是否有硝酸钾晶体析出,如有,则用玻璃棒轻轻搅拌,使晶体充分析出。
6. 将溶液过滤,收集滤液,滤液中含有硝酸钾晶体。
7. 将滤液置于蒸发皿中,在酒精灯上加热蒸发,直至滤液浓缩至干燥。
8. 将蒸发皿置于烘箱中,烤干硝酸钾晶体,得到纯净的硝酸钾产品。
五、实验结果与分析1. 实验结果:通过转化法制备硝酸钾,得到了纯净的硝酸钾晶体。
2. 结果分析:实验过程中,通过控制溶液的浓度和温度,使硝酸钾晶体在冷却过程中充分析出。
在过滤过程中,注意过滤速度,避免滤液温度降低过快,影响晶体析出。
在蒸发过程中,注意控制加热温度,避免溶液过度浓缩导致晶体烧焦。
六、注意事项1. 在溶解过程中,注意搅拌速度,避免产生气泡。
2. 在加热过程中,注意溶液温度,避免过热导致晶体烧焦。
3. 在过滤过程中,注意过滤速度,避免滤液温度降低过快。
4. 在蒸发过程中,注意控制加热温度,避免溶液过度浓缩。
转化法制备硝酸钾相关问题及方案

KNO3实物分子式:KNO3分子量:101.11性状:硝酸钾为无色透明斜方晶体或粉末,有潮解性。
相对密度2.1109,熔点333℃,易溶于水,溶于乙醇和甘油,不溶于无水乙醇。
有强氧化性,与有机物接触、摩擦或撞击能引起燃烧或爆炸。
用途:用作分析试剂,如氧化剂、助熔剂。
用于合成钾盐、制造火药、火柴及玻璃生产。
还用于显像管生产及电镀行业。
包装:25公斤内塑外编袋包装,或按客户要求中学用结晶法制备和提纯晶体常用的方法有蒸发结晶,升温结晶、降温结晶和重结晶。
晶体的析出过程并非纯粹是一个简单的物理过程,还应考虑干燥过程中酸的挥发,结晶水的丢失,产品本身在高温时易产生的水解、分解或氧化问题。
硝酸钾晶体的制备步骤:和KCl晶体,加少量蒸馏水,小火加热使其中的盐全部溶解,再继续称取NaNO3饱和溶液并和NaCl晶体。
自小火加热蒸发至有较多晶体析出,趁热过滤,得KNO3然冷却晶体析出(大量的硝酸钾和极少量氯化钠结晶得KNO晶体,抽滤,用少3溶液淋洗晶体,晶体置于蒸发皿中烤干,重结晶(加适量水溶解,量饱和KNO3淋洗,在表面皿中水浴烘干)。
加热沸腾即止,冷却结晶,抽滤,用饱和KNO3[角度] 本实验都涉及哪些基本操作,应注意什么?1. 制备硝酸钾的原理?解析:NaNO3 + KCl = NaCl + KNO3因为随温度的变化,硝酸钾与氯化钠溶解度的变化不同,硝酸钾随温度升高,溶解度增加很多;而氯化钠随温度升高,溶解度变化很小。
所以混合液经蒸发、浓缩后,首先析出氯化钠,趁热过滤除去氯化钠,将已有晶体析出的滤液加沸水溶解,适当蒸发,冷却,析出硝酸钾。
2. 为什么小火加热蒸发?解析:溶液沸腾后,应调节火焰至小火,以防液体爆沸溅失。
3. 减压过滤(抽滤)和趁热过滤操作都使用的一种主要仪器及作用是什么?解析:仪器是布氏漏斗,抽滤:是一种快速过滤法,适用于易溶晶体的分离,若固体需要洗涤,将少量溶剂洒到固体上,静置片刻,再将其抽干。
实验十转化法制备硝酸钾

1、布氏漏斗及吸滤瓶的使用方法 布氏漏斗和吸滤瓶配套使用于减压过滤。 布氏漏斗上有许多小孔, 漏斗颈插入单 孔橡皮塞, 与吸滤瓶相接。 橡皮塞插入吸滤瓶内的部分不得超过塞子高度的 2/3, 漏斗管下方的斜口要对着吸滤瓶的支管口。
2、减压过滤的操作方法 ( 1) 按 1 装好仪器,滤纸放入布氏漏斗内(滤纸大小应小于漏斗内径并能将全 部小孔盖住为宜)。少量蒸馏水润湿滤纸,开启真空泵,抽气使滤纸紧贴在 漏斗上。 ( 2) 用倾析法先将上清液转移到漏斗上, 溶液量不应超过漏斗容量的 2/3,待溶 液快流尽时再转移沉淀。 ( 3) 如果吸滤瓶内液面高度快到支管时,拔掉吸滤瓶上的橡皮管,从吸滤瓶上 口倒出溶液,不能从支管口倒出溶液,以免弄脏溶液。 ( 4) 先拔掉橡皮管,用洗涤液润湿沉淀,然后重新接上橡皮管,尽量抽干,重 复此操作 2~3 次。 ( 5) 吸滤完毕,拔掉橡皮管,关闭真空泵,如需要的是沉淀,取下布氏漏斗, 将沉淀倒在滤纸上或表面皿上,适宜温度下烘干;如需要的是溶液,将溶
并对重结晶后的产品,进行纯度检验。
[实验中应注意事项 ]
①先用小火加热使固体全部溶解,然后用大火加热至沸腾,再用小火蒸发浓缩; ②漏斗用热水预热好后,如漏斗是冷的或不太热,硝酸钾就会析出影响产率; ③骤冷结晶过于细小;
④小火烤干(如晶体抽得比较干可省去此步骤)。
实验报告格式 (供参考 )
实验步骤(或流程)
( 3)趁热用热滤漏斗过滤,滤液盛于预先装有 1mL蒸馏水 ( 防止氯化钠析出 ) 的
小烧杯中。
( 4)待滤液冷却至室温后,进行减压过滤,得到较干燥的粗产品硝酸钾晶体,
称量。
(5)留下约 0.1g 粗产品,其余按粗产品与水的质量比为 2:1 混合,加热、搅
拌、待晶体全部溶解后停止加热,冷却至室温后抽滤,水浴烘干,称重。
人工培育硝酸钾的方法

人工培育硝酸钾的方法英文回答:To artificially cultivate potassium nitrate, also known as saltpeter, there are several methods that can be used. One common method is to mix potassium chloride (KCl) and sodium nitrate (NaNO3) together in a solution. The two compounds will react and form potassium nitrate (KNO3) and sodium chloride (NaCl). The potassium nitrate can then be separated from the solution through crystallization.Another method involves the reaction between potassium hydroxide (KOH) and nitric acid (HNO3). When these two substances are mixed, they undergo a neutralization reaction and produce potassium nitrate and water. The resulting potassium nitrate can be obtained by evaporating the water from the mixture.Additionally, potassium nitrate can also be produced by the reaction between ammonium nitrate (NH4NO3) andpotassium chloride. This reaction forms potassium nitrate and ammonium chloride (NH4Cl). The potassium nitrate can be separated by filtering out the ammonium chloride.It is important to note that these methods require careful handling of the chemicals involved, as they can be hazardous if not handled properly. Safety precautions, such as wearing protective gloves and goggles, should be taken when working with these substances.中文回答:人工培育硝酸钾,也被称为硝石,有几种常用的方法。
2024学年陕西省西安市秦汉中学高三化学试题下学期第一次模拟考试试题含解析

2024学年陕西省西安市秦汉中学高三化学试题下学期第一次模拟考试试题注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。
回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
一、选择题(每题只有一个选项符合题意)1、某学习小组设计如下装置进行原电池原理的探究。
一段时间后取出铜棒洗净,发现浸泡在稀硝酸铜溶液中铜棒变细,浓硝酸铜溶液中铜棒变粗。
对该实验的说法正确的是A.处于稀硝酸中的铜棒为电池的正极,电极反应为:Cu2+ +2e- =CuB.该装置可以实现“零能耗”镀铜C.配置上述试验所用硝酸铜溶液应加入适量的硝酸溶液使铜棒溶解D.铜棒上部电势高,下部电势低2、分别在三个容积均为2.0L的恒容密闭容器中发生反应:A(g)+B(g)⇌D(g)。
其中容器甲中反应进行至5min时达到平衡状态,相关实验数据如表所示:容器温度/℃起始物质的量/mol平衡物质的量/mol化学平衡常数n(A) n(B) n(D) n(D)甲500 4.0 4.0 0 3.2 K1乙500 4.0 a 0 2.0 K2丙600 2.0 2.0 2.0 2.8 K3下列说法不正确的是A.0~5min内,甲容器中A的平均反应速率v(A)=0.64mol·L-1·min-1B.a=2.2C.若容器甲中起始投料为2.0molA、2.0molB,反应达到平衡时,A的转化率小于80%D.K1=K2>K33、用下列实验方案及所选玻璃容器(非玻璃容器任选)就能实现相应实验目的的是A.A B.B C.C D.D4、常温下,下列各组离子能在指定环境中大量共存的是()A.c(Al3+)=0.1mol•L-1的溶液中:H+、NH4+、F-、SO42-B.水电离出的c(H+)=10-4mol•L-1的溶液中:Na+、K+、SO42-、CO32-C.与Al反应能放出H2的溶液中:Na+、K+、HSO3-、Cl-D.使甲基橙变红色的溶液中:Na+、K+、NO2-、Br-5、两份铝屑,第一份与足量盐酸反应,第二份与足量NaOH溶液反应,产生氢气的体积比为1∶2(同温同压下),则第一份与第二份铝屑的质量比为A.1∶1 B.1∶2 C.1∶3 D.2∶16、某芳香族化合物分子式为C l0H11ClO2,已知苯环上只有两个取代基,其中一个取代基为-Cl,且该有机物能与饱和NaHCO3溶液反应放出CO2,则满足上述条件的有机物甲的同分异构体(不考虑立体异构)数目有多少种A.5种B.9种C.12种D.15种7、某红色固体粉末可能是Cu、Cu2O、Fe2O3中的一种或几种。
硝酸钾生产方法

硝酸钾生产方法
宝子,今天咱来唠唠硝酸钾的生产方法呀。
一种常见的方法呢,是利用硝酸钠和氯化钾来制取硝酸钾。
就像是一场化学小魔术一样哦。
把硝酸钠和氯化钾放在一起,在一定的条件下,它们就会发生反应。
这个反应过程中呢,各种离子就像一群调皮的小精灵,互相交换舞伴,最后就生成了硝酸钾和氯化钠啦。
然后呢,再通过一些分离的手段,把硝酸钾从这个混合物里单独提取出来。
这就像是从一群小伙伴里,精准地找到我们想要的那个小伙伴一样有趣呢。
还有一种方法是用硝酸和氢氧化钾反应。
硝酸那可是很厉害的酸呢,氢氧化钾也是个很有个性的碱。
当它们俩碰到一起的时候,就像两个很有故事的人相遇,然后就会发生中和反应。
这个反应就直接生成了硝酸钾和水。
不过这个方法呢,成本可能相对高一些,因为硝酸和氢氧化钾都不是特别便宜的原料呢。
另外呀,在自然界中,也有一些地方能找到硝酸钾的踪迹哦。
比如说一些干旱地区的土壤里,或者是洞穴的壁上。
人们可以通过开采、提纯等一系列操作来得到硝酸钾。
这就像是在大自然这个超级大宝藏里寻找珍贵的小宝石一样。
不过从自然界获取的量可能比较有限,而且纯度也不一定能一下子就达到工业生产所需要的那么高。
硝酸钾的生产方法各有各的特点,就像每个人都有自己独特的性格一样。
不同的生产方法适用于不同的需求和情况。
不管是哪种方法,背后都有着化学家们的智慧和努力呢。
希望你对硝酸钾的生产方法有了一点小了解啦,嘻嘻。
实验十_转化法制备硝酸钾

实验十转化法制备硝酸钾[课时安排]4学时[实验目的]1、学习用转化法制备硝酸钾晶体;2、学习溶解、过滤、间接热浴和重结晶操作。
[实验原理介绍]本实验是采用转化法由NaN0 3和KCI来制备硝酸钾,其反应如下:NaN0 3+ KCI? NaCI + KNO 3该反应是可逆的。
根据氯化钠的溶解度随温度变化不大,而氯化钾、硝酸钠和硝酸钾在高温时具有较大或很大的溶解度而温度降低时溶解度明显减小(如氯化钾、硝酸钠)或急剧下降(如硝酸钾)的这种差别,将一定浓度的硝酸钠和氯化钾混合加热浓缩,当温度达118〜120 C时,由于硝酸钾溶解度增加很多,达不到饱和,不析出;而氯化钠的溶解度增加很少,随浓缩、溶剂的减少,氯化钠析出。
通过热过滤滤除氯化钠,将此溶液冷却至室温,即有大量硝酸钾析出,氯化钠仅有少量析出,从而得到硝酸钾粗产品。
再经过重结晶提纯,可得到纯品。
[基本操作与仪器介绍]1、布氏漏斗及吸滤瓶的使用方法布氏漏斗和吸滤瓶配套使用于减压过滤。
布氏漏斗上有许多小孔,漏斗颈插入单孔橡皮塞,与吸滤瓶相接。
橡皮塞插入吸滤瓶内的部分不得超过塞子高度的2/3,漏斗管下方的斜口要对着吸滤瓶的支管口。
2、减压过滤的操作方法(1)按1装好仪器,滤纸放入布氏漏斗内(滤纸大小应小于漏斗内径并能将全部小孔盖住为宜)。
少量蒸馏水润湿滤纸,开启真空泵,抽气使滤纸紧贴在漏斗上。
(2)用倾析法先将上清液转移到漏斗上,溶液量不应超过漏斗容量的2/3,待溶液快流尽时再转移沉淀。
(3)如果吸滤瓶内液面高度快到支管时,拔掉吸滤瓶上的橡皮管,从吸滤瓶上口倒出溶液,不能从支管口倒出溶液,以免弄脏溶液。
(4)先拔掉橡皮管,用洗涤液润湿沉淀,然后重新接上橡皮管,尽量抽干,重复此操作2~3次。
(5)吸滤完毕,拔掉橡皮管,关闭真空泵,如需要的是沉淀,取下布氏漏斗,将沉淀倒在滤纸上或表面皿上,适宜温度下烘干;如需要的是溶液,将溶液从吸滤瓶上口倒入盛接容器。
3、趁热减压过滤操作(1)将布氏漏斗热水浴中加热。
硝酸钾生产的实用工艺
根据所提供的溶解度曲线,回答下列问题:
1)20℃时饱和硝酸钠溶液中溶质的质量分数是
46.5%
(精确到0.1%).
(2)为了加速固体溶解,可采取的措施有
加热、搅拌、研细颗粒
.
(3)实验室进行蒸发浓缩操作时,将蒸发皿置于铁圈上,用酒精灯加热.取用蒸发皿应使用
工艺流程:
HNO3+KCl→反应器→结晶器→离心分离→干燥器→KNO3成品
离心分离母液→过滤→蒸发器→结晶器→离心机→2级KNO3成品
在反应器中加入硝酸和离心分离的母液,然后分批加入结晶氯化钾,硝酸过量15%,通直接蒸汽和压缩空气,使反应温度维持在75至85℃,反应器放出的水蒸气、热空气和反应气体包括部分盐酸都由空气喷射器抽出放空或送至吸收塔。反应约4小时内完成,制得的溶液的平均组成为:硝酸钾450至520g/L、硝酸35至65g/L、氯化氢120至140g/L.此溶液加以澄清、除去硅酸盐杂质后清液送入结晶器,冷却到25至30℃时析出硝酸钾晶体。离心分离洗涤去结晶中的氯化物,送入干燥器中干燥为成品,也可重结晶为较纯的产品,方法同上述。离心分离的母液和洗涤水混合,部分返回反应器,其大致组成为:硝酸钾90至110g/L、硝酸20至40g/L、氯化氢70至80g/L.部分送到中和器用苛性钾溶液中和,过滤后送入蒸发器浓缩到溶液密度1.5g/立方厘米去结晶器结晶,离心制得2至3级品。
硝酸钾直接法生产工艺:
利用氯化钾和硝酸为原料制取硝酸钾,避免采用苛性钾和碳酸钾,但长期以来由于材料腐蚀和硝酸损失量大一直无法工业化生产。
反应式:HNO3+KCl=KNO3+HCl
此外还发生副反应:3HCl+HNO3=NOCl+Cl2+H2O
硝酸钾生产工艺
硝酸钾生产工艺概述及复分解法存在的问题与对策

中图分类号 : T Q 1 3 1 . 1 3
文献标识码 : A
文章编号 : 1 0 0 6 — 4 9 9 0 ( 2 0 1 5 ) 0 5 — 0 0 0 4 — 0 5
S u mma r y o f p r o d u c t i o n p r o c e s s o f p o t a s s i m u n i t r a t e a n d e x i s t i n g p r o b l e ms a n d
摘
要: 概 述 了 国 内 外 生 产 硝 酸 钾 的 4种 主 要 工 艺 方 法 : 硝酸钠 与氯化 钾转化 法 、 硝 酸 铵 与 氯 化 钾 离 子 交 换
法、 硝 酸 与氯 化钾 溶剂 萃取 法 和 硝 酸 铵 与 氯 化 钾 复 分 解 循 环 法 , 并 比较 了 这 4种 不 同 生 产 工 艺 方 法 的特 点 。 其 中硝
无 机 盐 工 业
4
第4 7卷 第 5期
2 0 1 5年 5月
I N0RGANI C C HEMI C AL S I NDUS T RY
硝 酸 钾 生产 工 艺概 述 及 复分 解 法 存在 的 问题与对策水
段正 康 , 谢 帆。 张 涛。 李 晟。 闫建 华
( 湘潭大学化工学 院。 湖南湘潭 4 1 1 1 0 5 )
c h l o id r e, a n d c o mp l e x d e c o mp o s i t i o n c y c l e me t h o d o f a mmo n i u m n i t r a t e a n d p o t a s s i u m c h l o i r d e , o f p o t a s s i u m n i t r a t e b o t h i n C h i n a a n d a b r o a d we r e s u mma r i z e d . T h e c h a r a c t e r i s t i c s o f t h e s e f o u r d i f f e r e n t p r o d u c t i o n t e c h n o l o g i e s we r e c o mp a r e d . I n t h e f o u r k i n d s o f p r o d u c t i o n t e c h n o l o g i e s , c o mp l e x d e c o mp o s i t i o n c y c l e me t h o d o f a mmo n i u m n i t r a t e a n d p o t a s s i u m c h l o id r e i s
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
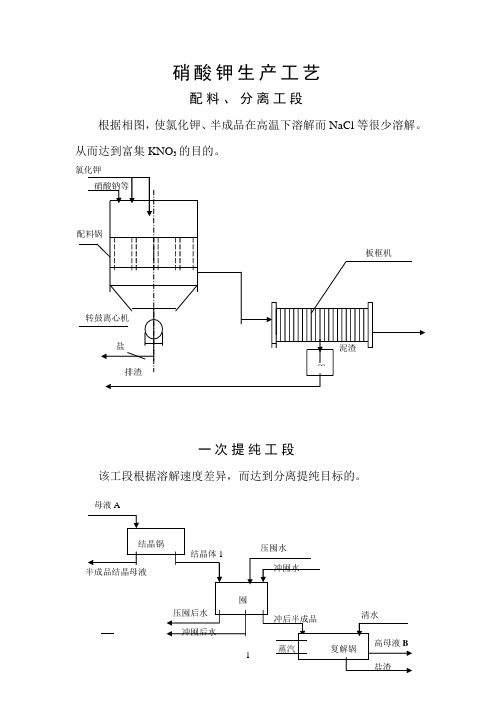
硝酸钠氯化钾生产硝酸钾工艺
一、配料
根据相图,使氯化钾、硝酸钠在高温下溶解而NaCl等很少溶解。
从而达到富集KNO3的目的。
提纯工段
该工段根据溶解速度差异,而达到分离提纯目标的。
母液A
2
提纯工段
该工段是重复上一工段的重要部分,再次提高产品质量,原理也与上类同,为高温溶解,低温结晶NaCl 溶解速度快等原理。
成品工段
经以上工段主离子含量已达到合格,而水份较高。
通过干燥器使水份含量达到合格,产品粒度不均通过振动筛使之合格,装袋,即可向外销售,而完成生产工序。
高母液B
离心水
螺旋输送机。
