25℃时NaCl-NH4Cl-H2O三元水盐体系相平衡的研究
氯化钠_过氧化氢_水三元体系的相平衡研究

氯化钠-过氧化氢-水三元体系的相平衡研究任保增1,雒廷亮1,赵红坤1,李 娟1,王鸿显2,刘国际1(1.郑州大学化工学院,河南 郑州 450002;2.南通师范学院化学系,江苏 南通 226007) 摘 要: 利用等温法,在10℃、15℃和20℃下测定了氯化钠-过氧化氢-水三元体系相平衡,得到了平衡液相组成的密度和折光率。
结果表明,氯化钠-过氧化氢-水是简单的三元体系,没有复盐的生成。
关键词: 氯化钠;过氧化氢;相图中图分类号:TQ01311 文献标识码:A 文章编号:1001-2214(2003)03-0001-03S tudy on the Phase E qu ilibrium of the T ernary Systemof Sodium Chloride -Hydrogen Peroxide -WaterRE N 2z eng 1,L UO T ing 2liang 1,ZH A O H ong 2kun 1,L I Ju an 1,W ANG H ong 2x ian 2,L IU G u o 2ji 1(1.Chemical Engineering C ollege ,Zhengzhou University ,Zhengzhou Henan 450002;2.Department of Chemistry ,Nantong Normal C ollege ,NanT ong Jiangsu 226007)Abstract : Using isothermic method ,the phase diagram of the ternary system of sodium chloride -hydrogen peroxide -water is plotted according to the experimental data that are deter 2mined at 10℃,15℃and 20℃.Furthermore ,the densities and refrangibilities of equilibrium liquid are obtained.Results show that the ternary system of sodium chloride -hydrogen peroxide -water is simple ,no adduct forms in the system.K ey w ords : sodium chloride ;hydrogen peroxide ;phase diagram收稿日期:2002-12-03基金项目:河南省科技厅科学研究计划项目(0124090444)及江苏省高校自然科学研究项目(02K JB150011)1 前言硫酸钠-过氧化氢-氯化钠加合物是一种新型的中性洗涤助剂在水溶液中的p H 值为6~8,故此加合物溶于水中时,生成的过氧化氢较稳定。
Na +,K +,Mg +∥NO3 -,Cl -,SO4 2-H2O体系25℃热力学模型和溶解度预测Ⅲ:四元体系K +,Mg 2+

l K M2 , g ∥S 4 ,O 一HO体 O N 3.2
系中的 Pzr ie 混合参数 t
根据 Pzr ie 离子相互 作用模 型, t 描述 四元 体系 K M /0 , 0 一H0热力学 性质 , 8 4 N 3 .2
收稿 日期 :07—1 —1 20 2 8
测定 。有关情况列在表 l 中。我们取表 l 中前
相平衡系列研究 , 我们曾于前两文中分别研究 了适 用 于 六 元 体 系 № , , g K M2 ∥ C一 1, 8 4 , O 一80的 Pzr 0 N 3 .2 ie参数【和 N , t j a K ∥
C一 N 3 .2 l ,O 一H 0体 系 的 Pt r 合 参 数 [ 及 其 ie 混 z 】 应 用 。根据 这些参 数预 测 的 四元 体 系 N , a K
∥C一 N 3 .2 l , 0 一8 0的相 图与 实验 值 很好 的吻
合 。本文我们介绍对另一个四元体系 K M 2 g ∥S 4 , 0 一H0的研究结果 , O N 3 .2 主要包括有关 的 Ptr ie 混合 参数 的研究 结果 及其 应用 。 z
曾进行过 这个 四元体 系 K , g+ o 一 M ∥s4 ,
20℃时NaCl-C2H5OH—H2O三元体系的相平衡研究

ae sn l pel e rrgeso to .T elmiaini o b ev d h ee ul ru sl h ・ td u igmut l i a e rsinmeh d h a n t n to s re .T q ib m oi p a i n o s ii d
s s a 0 e t2 a e a lNa .a o n w o o n s a e fu d. r C1 nd n e c mp u d r o n l
Ke r s s d u c l r e ;e h n l;tr a y s s m ;p a e e u l r m ;s l b l y y wo d :o i m h o d i ta o e n r y t e h s q ib u ii o u i t i
6 乙二胺乙酸( D A 、 H O、 E T )无水乙醇和二苯胺磺酸
钠 , 为 分 析 纯 试 剂 。 验 所 用 水 的 电 导 率 小 于 均 实
1 3×1 . 0一 S ・m 一 。
仪器 : K一2 H A超 级 恒 温 水 浴 , Y 一2 WA S数 字
争 对 M C: g 1在尿素一水混合体系中的互溶性及其 包 和液相的密度 、 折光率等物理化学性质进行 了研
我 国西 部 盐 湖 和海 洋 中 蕴 藏 着 丰 富 的钠 盐 资 篡它们 在 工农 业 生 产 中 有着 广 泛 应 用 。利 用 某 些 ,
1 实验部分
1 1 试 剂和 仪器 .
机溶剂的盐析作用 , 实现混合溶剂盐水体系 的结
、
分 离和 纯化 早 已引起 国内外科 学 工作 者的重 视 。 ( 临沂师范学院 ,山来自 临沂 2 60 ) 7 0 5
摘
高中试卷试题复习盐类的水解12例题解析

然顿市安民阳光实验学校盐的电离平衡与水解平衡例题解析一、选择题:( A )1. 常温时,将下列溶液等体积...混合后,所得混合液的pH小于7的是A. pH为2的醋酸溶液与pH为12的氢氧化钠溶液B. 0.0l mol·L-1 的醋酸溶液与0.01 mol·L-1的氢氧化钠溶液C. pH为2的硫酸溶液与pH为12的氢氧化钠溶液D. 0.010 mol·L-1的盐酸溶液与0.010 mol·L-1的氢氧化钡溶液(AC)2.下列物质能跟镁反应并生成氢气的是A.甲酸溶液 B.氢氧化钠溶液 C.氯化铵溶液 D.碳酸钠溶液(AB)3.50mL浓度为1mol/L的醋酸溶液与100mLNaOH溶液混合后,所得溶液的PH=7(常温下),则对该溶液的有关叙述正确的是A.c(Na+)==c(CH3COO—) B.c(CH3COO—)>c(OH—)C.原NaOH溶液的浓度为0.5mol/L D.NaOH溶液的浓度大于0.5mol/L (D )4.在常温下,将pH=11的某碱溶液与pH=3的某酸溶液等体积混合,下列说法正确的是A.若所得溶液呈中性,则生成的盐可能为强酸强碱盐B.若所得的溶液呈碱性,则可能是强碱与弱酸溶液反应C.若所得溶液呈酸性,则可能是强酸与弱碱溶液反应D.若所得溶液的PH=5,则可能强碱与弱酸溶液反应(AD)5.已知同温度,同物质的量浓度的NaX溶液的pH值大于NaY溶液的pH 值,据此,下列对两种对应酸(HX和HY)在相同温度和浓度下的比较中正确的是A.c(X—)<c(Y—) B.电离程度:HX>HYC.HY溶液的pH值>HX溶液的pH D.HY溶液中的c(H+)>HX溶液中的c(H+)(D )6.有五瓶溶液分别是:①10mL 0.60mol·L-1NaOH水溶液,②20mL0.50mol·L-1H2SO4水溶液,③30mL0.40mol·L-1HCl水溶液,④40mL 0.30mol·L -1HAc水溶液,⑤50mL 0.20mol·L-1蔗糖水溶液,以上各瓶溶液中所含离子、分子总数的大小顺序是A.①>②>③>④>⑤B.②>①>③>④>⑤C.②>③>④>①>⑤D.⑤>④>③>②>①( B )7.用水稀释0.1mol·L—1氨水时,溶液中随着水量的增加而减小的是A.c(OH—)/(NH3·H2O) B.c(NH3·H2O)/c(OH—)C.c(H+)和c(OH—)的乘积 D.OH—的物质的量(C )8.25℃时,将等体积的盐酸和氨水混合后,若混合液中c(NH4+)=c(Cl-),则溶液的pH值为A.大于7 B.小于7 C.等于7 D.无法确定( D )9.把三氯化铁溶液蒸干灼烧最后得到的固体产物是A.无水三氯化铁 B.氢氧化铁 C.氯化亚铁 D.三氧化二铁(A )10.0.1 mol·L-1的下列几种溶液:A. Na2CO3 B.CH3COONa C.NaClD.NaHCO3E. NH4Cl,其pH由大到小的顺序是A.A>D>B>C>E B.C> E>B>D>A C.A>B>D>E>C D.E>A>B>D>E( D )11.在FeCl3和Fe2(SO4)3的混合溶液中,若不计Fe3+的水解,当溶液中c(Fe3+)= c(SO42-)时,下列判断正确的是A.c(Fe3+)>c(Cl-) B.c(SO42-)>c(Cl-)C.c(SO42-)<c(Cl-) D.FeCl3和Fe2(SO4)3的物质的量相等(AD)12.有一种酸式盐AHB,它的水溶液显弱碱性,今有下列说法,其中正确的是A.同浓度的AOH溶液和H2B溶液,电离程度前者大于后者B.HB-的电离程度大于HB-的水解程度C.该盐的电离方程式为AHB === A++HB-D.在溶液中离子浓度大小顺序一般为:c(A+)>c(HB-)>c(OH-)>c(B2-)>c(H+)( A )13.20℃,两种一元弱酸的钠盐NaX和NaY,已知往NaX溶液中通入CO2只能生成HX和NaHCO3;往NaY溶液中通入CO2能生成HY和Na2CO3,下列说法正确的是A.酸性HX>HY B.溶液的碱性NaX>Na2CO3>NaY>NaHCO3C. 结合H+的能力:Y->CO32->X->HCO3- D.HX和HY酸性相同,但比H2CO3弱( C )14.NH4Cl溶于D2O中,反应生成的一水合氨与水合氢离子均正确的是A.NH2D·H2O和D3O+ B.NH3·D2O和HDO+C.NH3·HDO和D3O+ D.NH2D·H2O和H2DO+( D )15.若200mLc(H+)=10-3mol·L-1的某一元酸与100mLc(OH-)=10-3mol·L-1的某一元碱溶液相混合后,溶液呈碱性,所用的酸和碱应是A.等浓度的弱酸和强碱 B.稀的弱酸和浓的强碱C.稀的强酸和稀的强碱 D.稀的强酸和浓的弱碱( B )16.已知NaHSO4在水中的电离方程式为:NaHSO4==Na++H++SO42-。
NaCl_NH_4Cl_H_2O三元盐水体系相平衡研究

+
2 ×ln ( 1 + 1. 2 1. 2
7. 809 )
= - 1. 209 7. 809 ) 7. 809 ) = 0. 117 1 = 0. 170 6
1 I 2 f f′ + ln ( 1 + b I) ] ( 2 ) γ = γ = - A φ[ 2 1 +b I b
B ij =β ij B′ ij =
( 0)
湿渣组成
NH4 Cl 5. 99 7. 64 9. 74 3. 71 73. 37 76. 13 30. 71 25. 19 65. 24 62. 59 %
ZC l - ]
γ
类似可得 :
2 < < γ ln N aC l = Z f + m [B N aC l + ( 1 - y ) (B N H 4C l - B N aC l + 2 < θ KN a ) ] + m [ CN aC l + ( 1 - y ) ( CN H 4C l -
γ
=
γ
( - 1 ) 2 ] = 7. 809
图 2 40 ℃ 时 NaCl—NH4 Cl—H2 O 三元体系相图
2009 年 1 月 2. 3 验证计算
崔益顺 : NaC l—NH4 Cl—H2 O 三元盐水体系相平衡研究
y= m N aC l m N H 4C l + m N aC l
13
γ ln + m [ B N H 4C l + y ( B N aC l - B N H 4N a + N H 4C l = Z f
12
盐业与化工 第 38 卷第 1 期 据表 1 和表 2 数据绘制相图如图 1、 图 2。
0_时MgCl_2_LiCl_H_2O三元体系的相平衡研究_李进----------等温溶解法

湖卤水组成, 采用等温溶解平衡法研究了五元体系 + + - - Li , Na / / CO2 B 4 O2 Cl - - H2 O 在 298 K 下的 3 , 7 , 相平衡关系。 江蓉等 采用等温平衡方法研究了 + - K + / / Cl - , B 4 O2 - H2 O 在 298 K 四元交互体系 Li , 7 [3 ] 下的相关系及平衡液相物化性质。 张逢星等 对 MgCl2 在尿素 - 水混合体系中的互溶性及其饱和液 相的密度 、 折光率等物理化学性质进行研究 。 杨吉
Study on The Phase Equilibrium of MgCl2 - LiCl - H2 O Ternary System at 0 ℃
LI Jin ,YAN Jun ,ZHANG Feng - ping ,KONG Ling - kai ,YANG Ji - min ( Department of Chemistry and Chemical Engineering ,Linyi University, Lin Yi 276005 ,China ) Abstract: The equilibrium solubility of magnesium chloride - lithium chloride - water ( MgCl2 - LiCl - H2 O ) ternary system and the refractive index and density of saturated solution are investigated by isothermal equilibrium method at 0 ℃ . The ternary phase diagrams of MgCl2 - LiCl - H2 O ternary system at 0 ℃ are plotted, the phase diagram consists of three crystallization regions corresponding to the large area of LiCl·H2 O, the relative small area of LiCl·MgCl2 ·7H2 O and the smallest area of MgCl2 ·6H2 O obvithe system belongs to the simple eutectic type, and no solid solutions are found. The relations beously, refractive index and density of the saturated solution and the MgCl2 tween the saturated solubility of LiCl, content in the liquid phase are evaluated by multiple linear regression analysis algorithm. Aseries of phase equilibrium data of MgCl2 - LiCl - H2 O ternary system are given out,which not only provided basic thermodynamic data for solution chemistry,but also provided the foundation for purification and extraction of MgCl2 and LiCl. Key words: MgCl2 - LiCl - H2 O ternary system ; phase equilibrium ; solubility 我国是一个多盐湖的国家, 在西藏、 青海、 新疆、 内蒙古四省区分布着一千多个盐湖 。我国盐湖数量 多, 类型全, 蕴藏着极其丰富的矿产资源, 如石盐、 钾 盐、 镁盐、 锂盐和硼酸盐等, 还含有大量稀有元素, 是 我国重要的无机盐原料宝库。我国西部盐湖中蕴藏 着丰富的锂盐资源, 它们在电池材料等工农业生产 中有着广泛应用。 殷辉安等
氯化钠-氯化锶-水三元体系25℃相平衡研究

2 Ga u t U i rt, hns Aa e yo i cs . rd ae n e i C ie cdm S e e) v sy e f cn
氯化锶 间未 形成复盐或 固溶体 , 六水合氯化锶未发 生脱 水 , 系属 于简单 共饱型 。 体 关 键词 : 相平衡 ; 溶解度 ; 氯化钠 ; 氯化 锶 中图分 类号 :6 2 4 ; 5 1 0 4 .2 6 .2 4 文献标识码 : A 文章编号 :06— 9 0 2 1 6—00 10 4 9 (0 0 0 J 0 9一O 3
Absr c : h s q i b i h C 一S C 2一H2 tr ay s s m t2 C wa t d e yu i g ioh r l isl — t a t P a e e u l ra i t e Na 1 r 1 i n e n r y t a 5 o ssu id b sn t ema s ou 0 e s d t n e u l r m t o . n i n e r cie id x ec o h a a c d s l t n w r lo d tr n d P a e d a r m f i q i b i meh d De st a d r fa t n e t . ft e b ln e ou i e e a s e emie . h s i g a o o i u y v o Na 1 r 1 C 一S C 2一H2 e a y tm a lt d a c r i g t x e i n a aa D a r m a d p o n v r n on - tm r s se w sp o t c o dn e p r 0 y e o me tl t. i g a w sma e u f e i a i t i t d o n a p t o u ia a tc  ̄e - n wo cy t l z t n r go s o a 1 a d S C1 ・6 I h n a in o n , o o i o h w n v r n u s a d t r sal a i e in N C n r 2 i i o f H2 0. n t e i v r tp i t c mp st n o te a i f l u d p a e w sc n i d i e ma sfa t n o Na a . 0 a d ma sf ci n o S C1 w s2 . 2 ; n o r s o d i i h s a o f me , . . s c i q r r o f C1 s7 4 % n s r t f r 2 a 9 4 % a d c re p n — w a o ig b ln e o i h s s N C n r 1 ・ H2 Net e o b e s l o oi o uin ewe n t e o ii a C n n aa c d s l p a ewa a Ia d S C 2 6 d 0. i r d u l at n rs l s l t sb t e h r n l h s d o g Na 1a d S C 2・ H2 e e f u d; e y r t n o r 1 ・ H2 d d c u n t e s se ; n h y t m a i l u e t r 1 6 0 w r o n d h d ai f S C 2 6 0 in t o c r i h y tm a d t e s se w s a 解 平衡法 , 研究 了三元体系氯化钠 一氯化锶 一水 2 5℃时 的相平 衡 。同时测定 了平 衡溶液
水盐体系相平衡研究及硫酸钾的制备

四川大学化工专业实验报告实验名称:水盐体系相平衡研究及硫酸钾的制备学院:xxxx xxxxxxxxx 学生姓名:xxxx学号:xxxxxxxxxxxxx组号: 2——20 指导教师:xxxxx老师一、实验目的:1、通过在25℃下K+、Na+//C1-、SO4=-H2O体系的相平衡数据的测定、相图的绘制、工艺路线的分析以及实验方案的确定,最终制得K2SO4和NaCl。
2、掌握化工产品的开发过程和基本方法。
二、实验原理1、水盐体系相平衡数据的测定相平衡数据的测定方法很多,其中常用的方法的是等温法和多温法。
等温法:在某一恒定的温度下,使一定组成的系统在实验装置内达到相平衡,然后直接测定液相的组成并鉴定与液相呈平衡的固相情况,从而获得相平衡数据。
要测定一个未知多元体系的相平衡数据,应按照由二元、三元到多元,由简到繁的程序进行。
该法测定结果准确可靠,但过程比较麻烦和费时。
多温法:通过测定不同组成的体系在变温过程中发生相变时的温度,得到组成与相变温度的关系曲线,进而作图确定体系的相平衡数据。
多温法测定比较简单,只需配好各种组成的系统,进行冷却或加热,测定发生相变的温度即可。
但由于进程可能发生过冷现象,相变温度不易测准。
另外,多温法容易漏掉小的饱和面,导致测定结果不准确。
2、相图标绘和分析根据实际测定25℃和100℃相平衡数据,容易绘制出K+、Na+//C1-、SO4=-H2O体系的相图,如图1所示。
相图相图1显示,25℃时K+、Na+//C1-、SO4=-H2O体系存在6个结晶区间,分别是:AEGFA:Na2SO4·10H2O结晶区;FHRGF:Na2SO4结晶区;HRJKBH:NaCl结晶区;EGRJPME:Na2SO4·3K2SO4结晶区;KJPNCK:KCl结晶区;MPNDM:K2SO4的结晶区。
100℃时,存在5个结晶区,分别是:Na2SO4、Na2SO4·3K2SO4、KCl、K2SO4。
301.15K时KCl-NH4Cl-H2O三元水盐体系相平衡的研究

要 的应 用价值 。不 少无 机盐 工业 中无 机 盐 水溶 液 的排 放 中都 含 有 K c 一 N 离 子 等 , 处理 废 、 l 、 H 为 液 回收利用 , 需要 可靠 的 K I H C —H O三元 水 盐 体 系 的相平 衡 数 据 作 为 工艺 开 发 的依 据 “j C —N I 。 本文 主要研究 了 3 11K时 K 1 H C —H O三元 水 盐 体 系 的 固液 相 平 衡 关 系 , 定 出有关 的溶 0 .5 C 一N I : 测
水盐体 系是 自然 界 ( 水 、 湖 ) 海 盐 和无 机化 工 生 产 中 ( 料 、 盐 ) 肥 碱 常见 的反 应 体 系 。在无 机化 工
生产 中常 常要 将 可溶性 盐 或原 料溶 解在水 溶 液 中 , 者要 将某 种 盐从 水 溶 液 中结 晶 出来 。在 发 生溶 或
解 、 晶、 结 蒸发 、 却 、 离 等水 盐体 系 的相变 过程 中 , 先需 要 了解 盐类 的溶 解 度 规律 。将水 盐体 系 冷 分 首 在平衡 状态下 的溶 解 度数据 绘 制在 坐标 纸上 而得 到 的图形 即 为相 图 , 不 仅 能 给 出盐 类 的溶解 或结 它 晶顺序 、 名称 和组 成 , 能进 行 物料 的计算 , 能对 生产工 艺过 程及 其操 作条 件 , 至反应 器 的设计 提 还 并 乃
图 1 实验 装 置 图
13 实验 过程 .
1 )确定体 系相平衡 时 间 : 转动 4 从 h后开 始 , 隔半 小时取 一次 液相 用 阿贝折 射 仪分 析其组 成。 每 当液相组 成不再 发生变化 时 , 明体 系达 到相平衡 。经测定 , 说 本实验 此体 系的 相平衡 时间在 6 h左右 。 2 )配样 : 根据 文献 [ ~ ] 1 4 大致 画 出相 图形状 , 靠 近 固相线 附 近依 次选 取 体 系 总组成 点 , 用 在 并
25℃ NaNO3-H3BO3-H2O三元体系相平衡研究

u d we e d tc e . e u t s o e h t h e a y tm e o g d t i l trs l t r a y s se Ma sfa t n f i r ee t d R s l h w d t a e tr r s se b l n e o a smp e wae -a t e r y t m. s rc i so s t n y n o
摘 要 : 用 湿 渣 法 研 究 了 H B 。N N ,H2 体 系 在 2 时 的相 平 衡 关 系 , 检 测 了 平 衡 液 相 的 密 度 、 光 利 ,O一 a O 一 0 5 并 折 率 、 导率 和 p 等 主 要 物 化 性 质 。结 果 表 明 , 三 元 体 系 属 于 简 单 三元 水 盐 体 系 , 饱 和 溶液 中 H B N N 电 H 该 共 0 和 a O 质 量分数分别为 2 5 . %和 3 .% , 且 在 该 温 度 下 无 复 盐 和 水 合 物 生 成 。 经 验 公 式 对平 衡 液 相 的密 度 、 光 率 进 行 了 7 2 4 并 用 折 计 算 . 算 值 与 实 验 值 基 本 吻 合 计
关 键 词 : 酸 钠 ; 酸 : 元 体 系 : 平 衡 硝 硼 三 相
中图分类号 :62 2 0 4. 4 文 献 标 识 码 : A 文 章 编 号 :0 6 4 9 ( 0 2 0 — 0 1 0 10 — 9 0 2 1 )6 0 3 - 3
P a e e u l r u f NO3 H3 h s q i b im o i Na - BO3 H2 t r a y s se t 5 o - 0 n r y t m a e 2 C
为 分析 纯 . 苯二 甲酸 氢钾 为基 准试剂 .P 一 C数 字 式 酸 度 计 (/0 )D S l 110 , D —l A 型 电导仪 ; 比重瓶 (5mL 2 )7 1 紫外 分光 光 2 ,5o ;5 型 C 度计 ; A(WA ) WY 2 J 阿贝折射 仪 。
三元盐水系溶解度的测定实验报告四川理工学院

三元盐水系溶解度的测定实验报告四川理工学院一、实验目的水盐系是自然界(海水、盐湖)和无机化工生产中(肥料、碱、盐)常见的反应体系。
在无机盐生产中常常要将可溶性盐或原料溶解在水溶液中,或者需要将某种盐从水溶液种结晶出来。
在发生溶解、结晶、混合、蒸发、冷却、分离等水盐体系的相变化过程时,首先需要了解类的溶解度关系。
将水盐体系平衡状态下的溶解度实验数据标绘在坐标纸上而得到的图即为相图。
它不仅能给出盐类的溶解或结晶顺序、名称和组成,还能进行物料量的计算,并能对工艺过程及其操作条件乃至反应器的设计提供基本要求。
无机化工生产中最常用的是三三元水盐.体系,因此提出本实验。
二、实验原理与方法根据NaCl、 NH4Cl 在水中溶解度的不同,配制不同重量组成的一系列样品溶液,在恒温下搅拌一定时问后,对各饱和溶液进行分析,用所得数据在坐标纸上绘出一系列点。
同时,测定与饱和溶液相平衡的固相组成,以所得数据在图上绘出的点与相应的饱和溶液点相连即得相应的直线。
连接各饱和溶液即为该温度下的NaCl、NH4Cl溶解度山线。
至此,该三元水盐体系的等温相图的绘制即告结束。
三元水盐体系溶解度与相图实验测定有湿固相法、合成复合体法和物理化学分析法,本实验采用湿固相法。
湿固相法以连线规则为基础,当液固相达平衡后,分别取出饱和溶液和含饱和溶液的湿固相加以分析,所得的点可连成几条不同的直线,它们的交点就是这些饱和溶液所平衡的固相点。
如果交点正好落在代表-种盐的顶点,则为该盐的无水盐点;如果交点刚好落在两直线角边上,则固相点为水合物;如果交点落在直角三角形的斜边上,则固相为无水复盐;交点落在三角形内任一点,固相均为水合复盐。
另外,如果有两条或两条以上的相邻连线都从液相的同一点出发,则这液相点为两盐的共饱和点。
三、实验操作要点1.称量测定三元相图的溶解度要以二元系统的溶解度数据为基础。
由手册查得下列温度下NaCl与NH4C1在水中的溶解度数据。
25_时NaCl_NH_4Cl_H_2O三元水盐体系相平衡的研究

Abstract : By means of moist solid method , the phase equilibrium of NaCl2NH4Cl2H2O ternary system at 25 ℃ was studied1 The solubility data of NaCl and NH4Cl in water were obtained , and the phase diagram of the sys2 tem was drawn1 It is shown that there exist six phase regions in this system , i1e1 NaCl and NH4Cl pure phase region respectively , NaCl and NH4Cl dominated solid solution regions respectively , co2crystalline region of Na2 Cl and NH4Cl dominated solid solutions and unsaturated solution region1 Key words :NaCl ; NH4Cl ; Aqueous solution ; Phase diagram ; Solid solution
四元盐水体系热力学性质和相平衡的预测

四元盐水体系热力学性质和相平衡的预测翦立新;吴晓娅;谭雨齐;陈子芳;尹霞【摘要】应用Pitzer-Simonson-Clegg热力学模型,结合二元及三元模型参数计算了包含K+,Mg2+,Na+,Cl-和NO;离子的6个二元盐水体系和9个三元盐水体系的溶解度,模型参数分别拟合于相关体系的水活度、渗透系数及溶解度实验数据.在未考虑四元混合参数的情况下,较为准确的预测了四元盐水体系K+,Mg2+//Cl-,NO3--H2O,K+,Na+//Cl-,NO3--H2O,Mg2+,Na+//Cl-,NO3--H2O和K+,Na+,Mg2+//NO3--H2O在不同温度下的溶解度,同时预测K+,Na+//Cl-,NO3--H2O体系在278.15 K~323.15 K范围内饱和溶液的饱和蒸汽压,及其子体系KNO3-NaNO3-H2O和NaCl-NaNO3-H2O在363.15 K下饱和溶液的水活度,和KCl-KNO3-H2O体系在不同温度下共饱和点组成溶液的饱和蒸汽压,模型计算结果与文献数据吻合.【期刊名称】《湖南大学学报(自然科学版)》【年(卷),期】2014(041)012【总页数】8页(P75-82)【关键词】Pitzer-Simonson-Clegg模型;溶解度;四元体系;水活度;饱和蒸汽压【作者】翦立新;吴晓娅;谭雨齐;陈子芳;尹霞【作者单位】湖南大学化学传感与计量学国家重点实验室,湖南长沙410082;湖南大学化学传感与计量学国家重点实验室,湖南长沙410082;湖南大学化学传感与计量学国家重点实验室,湖南长沙410082;湖南大学化学传感与计量学国家重点实验室,湖南长沙410082;湖南大学化学传感与计量学国家重点实验室,湖南长沙410082【正文语种】中文【中图分类】O642.4我国新疆地区富含盐湖资源,主要成分包括Na+,Mg2+,K+,SO42-,Cl-和等,开展这些复杂体系相平衡及热力学性质的研究,对盐湖资源的充分利用具有重要应用价值和理论指导意义.这些复杂体系及其子体系的溶解度测定,需要大量细致繁杂的实验操作和较长的实验周期,而利用热力学模型并结合有限的实验数据,准确预测复杂盐水体系的相图则对丰富相平衡信息具有事半功倍的效果.曾德文等[1, 2]曾利用合适的热力学模型成功计算一系列盐水体系的完整相图.本文利用Pitzer Simonson Clegg模型(PSC模型)[3]对K+,Mg2+K∥∥∥和K+,Na+,Mg2+∥四个四元体系及其所包含的二元及三元子体系进行热力学计算和预测,并将计算结果与实验数据进行比较.1 模型方法为准确描述电解质溶液的热力学性质,Clegg和Pitzer等人[3]提出了一个用于计算任意多元电解质溶液由稀到浓的热力学性质的模型(简称PSC模型),该模型关于体系中各物种活度系数的计算公式较为复杂,基本形式如下:其中I是以质量摩尔浓度为基础的离子强度,为二元模型参数,本文中为三元模型相互作用参数,本研究中忽略四元混合模型参数Zcc′aa′, Xcc′c″a, Xaa′a″c.对于K+,Mg2+∥ H2O体系中所包含的二元及三元子体系PSC模型参数,利用文献报道的热力学数据(水活度,渗透系数或溶解度等),采用最小二乘法计算得到不同温度下的各参数.参数与温度T (K) 的关系式可表达为:A=a+bT,(A=Bca,WW,ca,UW,ca,VW,ca,Wijk,QW,ijk,Uijk)在计算三元体系及多元体系相图之前,需要知道体系中各固相的平衡常数.对任何给定的盐Mv+Xv-·nH2O,其溶解平衡可表示为:Mv+Xv-·nH2O=v+M++v-X-+nH2O达到平衡时,平衡常数K的表达式为:lnK=v+lnaM++v-lnaX-+nlnaH2OaM+,aX-和aH2O分别为M+,X-和水的活度.利用二元模型参数和二元体系的溶解度数据可计算出不同温度下的平衡常数K,并将其与温度关联成以下形式:lnK=A+B/T+CT+DlnT结合所获得的二元及三元模型参数以及不同温度下的平衡常数K,就可以计算三元和四元体系的溶解度.本文在模型计算中所用的程序均为作者用C语言自行编写.2 三元体系溶解度的计算2.1 三元体系溶解度的计算KCl-H2O体系的PSC模型参数采用Holmes等人[4]所提供的298.15 K和423.15 K时的渗透系数,KNO3-H2O体系的模型参数拟合于Zeng等人[5]及Barry[6]所给的298.15 K和425.5 K的水活度数据.对于MgCl2-H2O体系,本文用Rard等人[7]提供的298.15 K的水活度和Fanghänel等人[8]所给的373.45 K 的水活度拟合二元参数,Mg(NO3)2-H2O体系的二元参数拟合于298.15 K[9]和333.15 K[10]的水活度数据,NaCl-H2O体系的二元参数拟合于文献[11]所提供的298.15 K和348.15 K的水活度,NaNO3-H2O体系的二元参数采用Pearce等人[12]提供的298.15 K的水活度和Bobmann等人[13]提供的424.96 K的数据.所有二元参数与温度的关系式列于表1.利用表1中的参数,结合上述二元体系的溶解度数据,计算K+,Mg2+∥∥∥和K+,Na+,Mg2+∥体系中所包含的固相在不同温度下的平衡常数K,结果见表2.利用表1和表2中的参数,分别计算二元体系KCl-H2O,KNO3-H2O,MgCl2-H2O,Mg(NO3)2-H2O,NaNO3-H2O和NaCl-H2O的相图,并与实验值进行比较(见图1的(a)和(b)),计算值与实验值非常一致.表1 二元PSC模型参数Tab.1 The binary PSC model parametersElectrolyteBca+B1+B2TWW,ca=W1+W2TUW,ca=U1+U2TVW,ca =V1+V2TB1B2W1W2U1U2V1V2T /KSourceKCl 106.680.379 9 4.580.004 7 5.760.011 800298.15~423.15[4]KNO3 65.020.190 51.28 0.002 4 6.790.015 800298.15~425.5[5, 6]MgCl2 620.821.909 1 132.820.285 6 257.960.612 9167.20 0.423 3298.15~373.45[7, 8]Mg(NO3)2 1 346.904.773 6 72.860.168 5 166.070.469 5137.26 0.422 1298.15~333.15[9, 10]NaCl 4.710.055 538.150.096 9 73.840.209 135.32 0.105 3298.15~348.15[11]NaNO3517.391.756 5 3.060.008 1 7.860.023 88.11 0.027 2298.15~424.96[12, 13] 表2 四元体系中固相的ln K与温度T (K)的关系Tab.2 The parameters ln K of solid phases in the quaternary systemsSolidphaselnk=A+B/(T/K)+C(T/K)+Dln(T/K)ABCDSolubility sourceKCl9.839 3407.8 0.0145 7 0.000 [14]KNO31 366.210 40 957.90.369 17 236.448[14, 15]MgCl2·6H2O 1 322.29735 896.0 0.38015230.467[14]MgCl2·4H2O715.137 34 703.10.000 00104.915[16]Mg(NO3)2·6H2O1 510.945 42 009.10.457 81265.322[14]Mg(NO3)2·2H2O462.791-26 118.7-0.020 2 63.475[14]NaCl 48.2961 411.0 0.007 607.274[14]NaNO3-84.7341 317.80.0000013.137[14]KCl·MgCl2·6H2O 2 225.19354 552.4 0.670 59391.647[14]100 w100 w注:w为盐的质量分数图1 二元盐水体系相图的计算值与实验值[14, 15]比较Fig.1 Calculated phase diagram of the binary salt-water systems compared with experimental data lines:calculated values in thiswork;symbols:literature data2.2 三元盐水体系的热力学计算根据本组前期研究[2]可知,仅用PSC模型的二元参数难以准确计算三元体系的相图.为获得三元盐水体系的准确信息,用相关体系的溶解度数据分别拟合三元相互作用参数,所用实验数据来源及参数与温度的关系式见表3.结合表1~3中的二元及三元模型参数分别计算KCl-MgCl2-H2O,KNO3-Mg(NO3)2-H2O,KCl-KNO3-H2O,MgCl2-Mg(NO3)2-H2O,KNO3-NaNO3-H2O,MgCl2 -NaCl-H2O,Mg(NO3)2-NaNO3-H2O,KCl-NaCl-H2O和NaCl-NaNO3-H2O体系的相图,并与实验值对比,结果见图2~10.对于KCl-KNO3-H2O体系,预测了温度范围在273.15 K~364.15 K的共饱和线(图4(a)中的点划线),并与文献值[17](图4(a)中的符号)进行比较,发现二者完全吻合.同时计算了不同温度下共饱和点组成所对应的饱和溶液的水活度,并按式(4)换算成饱和蒸汽压,与实验值[17]进行对比(见图4(b)),结果发现计算值与实验值基本一致.aw(T)=p(T)/p*(T)式中p(T)和p*(T)分别为温度T时盐溶液和纯水的饱和蒸汽压.另外将预测的KNO3-NaNO3-H2O和NaCl-NaNO3-H2O体系在363.15 K时饱和溶液的水活度与实验值[18]对比,结果分别见图6(b)和图10(b)),预测值与实验值基本吻合,且误差在实验值所给误差范围内.图2 KCl-MgCl2-H2O体系溶解度的计算值与实验值[14]比较Fig.2 Predicted solubility of the system KCl-MgCl2-H2O compared with experimental datalines:calculated isotherms in this work; symbols: literature data图3 KNO3-Mg(NO3)2-H2O体系溶解度计算值与实验值[14]比较Fig.3 Predicted solubility of the system KNO3-Mg(NO3)2 -H2O compared with experimental data lines:calculated isotherms in this work; symbols: literature data图4 KCl-KNO3-H2O体系热力学计算值与实验值[14, 17, 18]比较Fig.4 Predicted values of the system KCl-KNO3-H2O compared with experimental data(a) phase diagram, -·-: predicted polytherm in this work, ——: calculated isotherms in this work; symbols: literature data (b) vapor pressures of saturated aqueous solution of invariant points图5 MgCl2-Mg(NO3)2-H2O体系溶解度的计算值与实验值[16]比较Fig.5 Predicted solubility of the system MgCl2 -Mg(NO3)2-H2O compared with experimental data lines:calculated isotherms in this work; symbols: literature data3 四元盐水体系溶解度的预测本文采用前文所拟合的二元及三元PSC模型参数,并且未引入四元模型参数,分别预测K+,Mg2+∥∥∥和K+,Na+,Mg2+∥NO3 H2O 4个四元盐水体系的干基图,用耶内克(Jänecke)指数表示,并与实验数据比较,结果见图11~14. 对于体系,预测的共饱和线及各固相的结晶区均与文献结果基本一致(见图11).图中A点和B点分别为文献[14 ,20, 21]提供的KCl-KNO3-H2O三元体系在298.1 K共饱和点的实验数据,预测值与A点有较大偏差,而与B点完全一致.图6 KNO3-NaNO3-H2O体系热力学计算值与实验值[14, 19]比较Fig.6Predicted values of the system KNO3-NaNO3-H2O compared with experimental data (a) phase diagram, (b) water activity of saturated aqueous solution at 363.15 K. lines: calculated isotherms in this work; symbols: literature data图7 MgCl2-NaCl-H2O体系溶解度的计算值与实验值[14]比较Fig.7 Predicted solubility of the system MgCl2-NaCl-H2O compared with experimental data图8 Mg(NO3)2-NaNO3-H2O体系溶解度的计算值与实验值[16]比较Fig.8 Predicted solubility of the system Mg(NO3)2 -NaNO3-H2O compared with experimental data图9 KCl-NaCl-H2O体系溶解度的计算值与实验值[14]比较Fig.9 Predicted solubility of the system KCl-NaCl-H2O compared with experimental data对于K+,Na+∥体系,不仅较为准确地预测了273.15 K,298.15 K和323.15 K的溶解度,而且预测该体系在278.15 K~323.15 K温度范围内饱和溶液的饱和蒸汽压,结果见表4,预测值与实验值[30]之间的平均相对误差在2.2%以内.本文预测了Mg2+,Na+∥体系在288.15 K,298.15 K和323.15 K的溶解度(见图13),在323.15 K时NaCl和NaNO3结晶区域的预测结果与实验值[16]略有偏差,其余两个温度的预测结果与实验数据[16, 24]基本一致.K+,Na+,Mg2+∥ H2O体系在298.15 K的溶解度预测结果见图14,与文献数据[25]基本一致.NaNO3 mole fraction (free water)图10 NaCl-NaNO3-H2O体系热力学计算值与实验值[14, 19]比较Fig.10 Predicted values of the system NaCl-NaNO3-H2O compared with experimental data (a) phase diagram, (b) water activity of saturated aqueous solution at 363.15 K.lines: calculatedisotherms in this work; symbols: literature data表3 三元PSC模型参数Tab.3 The ternary PSC model parametersSystemWijk=a+b(T/K)QW,ijkUijk=e+f(T/K)abcdefT/KSourceKCl-MgCl2-H2O 219.670.3484.71 0.113 3 7.390.078 7273~348[14]KNO3-Mg(NO3)2-H2O 83.760.060 9-0.150.0 84330.12 0.089 3298~323[14]KCl-KNO3-H2O8.13 0.026 7 2.110.004 6 0.550.001 8298~364[14]MgCl2-Mg(NO3)2-H2O45.7 0.16 34.20.1211.7 0.04298~323[17]KNO3-NaNO3-H2O1.28 0.008 2 4.970.016 700298~364[14]MgCl2-NaCl-H2O 75.4032.05209.20298[14]Mg(NO3)2-NaNO3-H2O 690.732.223 2487.12 1.617 6225.76 0.768 6298~323[16]KCl-NaCl-H2O 99.640.314 672.26 0.232 818.55 0.058 2298~353[14]NaCl-NaNO3-H2O39.27 0.124 0 39.030.118 20.190.058 1298~348[14]J(Mg2+)图11 298.16 K下K+,Mg2+∥体系干盐图的预测值与实验值[14, 20, 21]比较Fig.11 Predicted dry salt diagram of the system K+, Mg2+∥Cl-, at 298.16 K compared with experimental data图12 K+,Na+∥体系干盐图的预测值与实验值[22]比较Fig.12 Predicted dry salt diagram of the system K+, Na+∥ with experimental data图13 Mg2+,Na+∥体系干盐图的预测值与实验值[16]比较Fig.13 Predicted dry salt d iagram of the system Mg2+, Na+∥Cl-, compared with experimental data-·-, predicted data at 288.15 K; -, predicted data at 298.15 K; ---, predicted data at 323.15 K Nit: Mg(NO3)2·6H2O, Bis:MgCl2·6H2O图14 298.15 K时K+,Mg2+,Na+∥体系干盐图的预测值与实验值[25]比较Fig.14 Predi cted dry salt diagram of the system K+, Mg2+, Na+∥ at 298.15K compared with experimental data4 结论运用PSC模型,分别计算了和个四元盐水体系以及它们所包含的二元和三元子体系的溶解度.同时预测了KCl-KNO3-H2O体系在不同温度下二元共饱和点所对应的饱和溶液的蒸汽压,KNO3-NaNO3-H2O和NaCl-NaNO3-H2O体系在363.15 K时饱和溶液的水活度,以及体系在278.15 K~323.15 K温度范围内饱和溶液的饱和蒸汽压,预测结果与文献数据基本一致.表4 K+,Na+∥体系的饱和蒸汽压预测值与实验值[23]比较Tab.4 Predicted vapour pressures of the system K+,Na+∥ with experimentaldataT/Km/(mol·kg-1)p/kPaNaClKNO3experimentalPredictedRe(%)a278.156.502.570.6130.6051 .305283.156.502.730.8570.8500.817288.156.503.001.1811.1730.677293.156. 503.391.6051.5920.810298.156.503.892.1542.1281.207303.156.504.502.857 2.8061.785308.156.505.223.7453.6522.483313.156.506.054.8554.6973.2543 18.156.507.006.2315.9694.205323.156.508.067.9177.5025.242Average valueb 2.178所用的二元模型参数拟合于水活度或渗透系数实验值,三元模型参数通过拟合三元体系的溶解度实验数据得到.计算结果充分说明应用PSC模型,借助有限的二元及三元盐水体系的实验数据,可较为准确地预测复杂盐水体系的热力学性质,为工程应用提供可靠的理论指导. 参考文献[1]WANG W L, ZENG D W, YIN X, et al. Prediction and measurement of gypsum solubility in the systems CaSO4 + HMSO4 + H2SO4 + H2O (HM =Cu, Zn, Ni, Mn) at 298.15 K[J]. Industrial and Engineering Chemistry Research, 2012, 51: 5124-5134.[2]YIN X, CHEN Q Y, ZENG D W, et al. Phase diagram of the system KNO3 + LiNO3 + Mg(NO3)2 + H2O[J]. Calphad, 2011, 35: 463-472.[3]CLEGG S L, PITZER K S, BRIMBLECOMBE P. Thermodynamics of multicomponent, miscible, ionic solutions. Mixtures including unsymmetrical electrolytes[J]. J Phys Chem, 1992, 96(23): 9470-9479. [4]HOLMES H F, MESME R E. Thermodynamic properties of aqueous solutions of the alkall metal chlorides to 250 ℃[J]. J Phys Chem, 1983, 87: 1242-1255.[5]ZENG D W, WU Z D, YAO Y, et al. Isopiestic determination of water activity on the system LiNO3 + KNO3 + H2O[J]. J Sol Chem, 2010, 39: 1360-1376.[6]BARRY J C, RICHTER J, STICH E. Vapour pressures and ionic activity coefficients in the system KNO3 + H2O from dilute solutions to fused salts at 425 K, 452 K and 492 K[J]. Ber Bunsenges Phys Chem, 1988, 92: 1118-1122.[7]RARD J A, MILLER D G. Isopiestic determination of the osmotic and activity coeffic ients of aqueous magnesium chloride solutions at 25 ℃[J]. J Chem Eng Data, 1981, 26(1): 38-43.[8]FANGHANEL T, GRJOTHEIM K. Thermodynamics of aqueous reciprocal salt systems. Ⅲ. Isopiestic determination of osmotic and activity coefficients of aqueous MgCl2, MgBr2, KCl and KBr at 100.3 ℃[J]. Acta Chemica Scandinavica, 1990, 44: 892-895.[9]RARD J A, WIJESINGHE A M, WOLERY T J. Review of the thermodynamic properties of Mg(NO3)2(aq) and their representation with standard and extended ion-interaction (Pitzer) models at 298.15 K[J]. J Chem Eng Data, 2004, 49: 1127-1140.[10]EWING W W, KLINGER E, BRANDNER J D. Studies on the vapor pressure-temperature relations and on the heats of hydration, solution and dilution of the binary system magnesium nitrate-water[J]. J Am Chem Soc, 1934, 56: 1053-1057.[11]GIBBARD JR H F, SCATCHARD G, ROUSSEAU R A, et al. Liquid-vapor equilibrium of aqueous sodium chloride, from 298 to 373 K and from 1 to 6 mol·kg-1, and related properties[J]. J Chem Eng Data, 1974, 19: 281-288.[12]PEARCE J N, HOPSON H. The vapor pressures of aqueous solutions of sodium nitrate and potassium thiocyanate[J]. J Phys Chem, 1937, 41: 535-538.[13]BOBMANN E, RICHTER J, STARK A. experimental results and aspects of analytical treatment of vapour pressure measurements in hydrated melts at elevated temperature[J]. Ber Bunsenges Phys Chem, 1993, 97: 240-245.[14]LINKE W F, SEIDELL A. Solubilities: inorganic and metal-organic compounds[M]. 4th Ed. Washington DC: American Chemical Society, 1965.[15]FANGHANEL T H, KRAVCHUK K, VOIGT W, et al. Solid-liquid-phase equilibria in the system KCl-MgCl2-H2O at elevated temperatures. Ⅰ. The binary system MgCl2-H2O at 130-250 ℃[J]. Allg Chem, 1987, 547: 21-26.[16]SIEVERTS A, MULLER H Z. Reciprocal system MgCl2, Na2(NO3)2,H2O[J]. Anorg Allg Chem, 1930, 189: 241-257.[17]USPENSKYAa L N, BERGMAN A G. Solubility isotherms of the system Zhurmal Obshchei Khimii, 1955, 25: 2028-2038.[18]APELBLAT A , KORIN E. Temperature dependence of vapor pressures over saturated aqueous solutions at invariant of the NaCl + KCl + H2O, NaCl + NaNO3 + H2O, KCl + KBr + H2O, KCl + KI + H2O, KCl + KNO3 +H2O, and KCl + K2SO4 + H2O systems[J]. J Chem Eng Data, 2009, 54(5): 1619-1624.[19]CARROLL S, CRAIG L, WOLERY T. Deliquescence of NaCl-NaNO3, KNO3- NaNO3, and NaCl-KNO3 salt mixtures from 90 to 120 ℃[J]. J Geochim Trans, 2005, 6(2): 19-30.[20]李松菀, 黄雪莉, 马风云, 等. 298.16 K下,体系液固相平衡[J]. 化学通报, 2008,12:958-961.LI Song-wan, HUANG Xue-li, MA Feng-yun, et al. Phase equilibrium for the quarternary system Mg2+//Cl-, at 298.16 K[J]. Chemistry, 2008, 12: 958-961. (In Chinese)[21]宋彭生, 罗志农. 三元水盐体系25 ℃溶解度的预测[J]. 化学通报, 1983, 12: 13-19.SONG Peng-sheng, LUO Zhi-nong. Prediction of solubiltiy of the ternary salt-water system at 25 ℃[J]. Chemistry(Huaxue Tongbao), 1983, 12: 13-19. (In Chinese)[22]REINDERS W Z. The reciprocal system KCl + NaNO3 = KNO3 + NaCl and the preparation of nitrate[J]. Anorg Allgem Chem, 1915, 93: 202-212.[23]APELBLAT A, KORIN E. Temperature dependence of vapor pressuresover saturated aqueous solutions at invariant points of the NaCl + KNO3 + H2O, NaCl + Na2CO3 + H2O, and NaCl + Na2SO4 + H2O systems[J]. J Chem Eng Data, 2011, 56: 988-994.[24]黄雪莉, 朱丽娟, 梁涛, 等. 298.16 K Na+, K+, Mg2+//Cl-, NO3- -H2O五元体系的相平衡研究[J]. 化学学报, 2007, 65: 798-802.HUANG Xue-li, ZHU Li-juan, LIANG Tao, et al. Study on the phase equilibrium for the quinary system Na+, K+, Mg2+//Cl-, at 298.16 K[J]. Chinese Acta Chimica Sinica, 2007,65: 798-802. (In Chinese)[25]HUANG X L, LI S W. Liquid-solid equilibria in quinary system Na+, K+, Mg2+//Cl-, -H2O at 25 ℃[J]. Thermodynamics and Chemical Engineering Data, 2011, 19: 101-107.。
第三章 水盐相图1
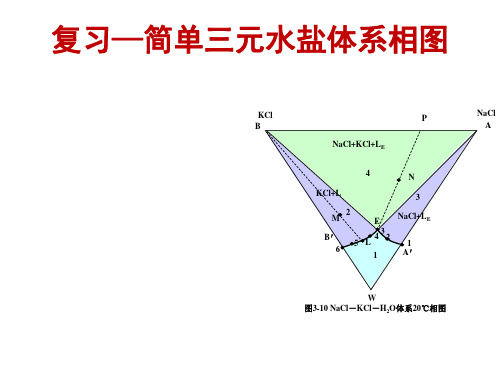
E1
B' M7
1 A' E2 E1 2 3
B'
H
NiCl2· 2 H2 O a' b'
4 5 c d
e B ( NH4Cl )
A(Na2SO4) (a)
B ( MgSO4 )
A(NiCl2) ( b)
图3-25 复杂相图两例
二、共饱点性质的判断 共饱点的相应三角形: 在三元等温图中,与共饱点所代表的 液相平衡的两个固相点及水点所构成 的三角形。 共饱点分类: 相称共饱点—在相应三角形内 不相称共饱点—在相应三角形外/边上
水合物转溶, 绝不是干点
除右边的两情况
异成分复盐
水合物Ⅱ型
三、变温过程分析
t(℃) 100 E100
B ( NaNO3 )
80 60
E75
N100 N75 N25 E25 E75 E100
Ex 40 E25 20
M
A(KNO3) E100 E75
W
Ex
E25
W(H2O) K25
K75
K100
A ( K NO3 )
S10脱水转溶 Na2SO4 Na2SO4+NaCl 为Na2SO4析出 析出 共析 3→4 4→5 5→6
W(H2O) 1 Q 2 B' A' 3 E 4 S10
1→2
2→Q Q(不是干点) Q→E
E(干点)
5
——
S10
S10→B
B
B→6
A(NaCl) 图3-21 水合物Ⅱ型 6
B(Na2SO4)
二、各类相图的等温蒸发过程
2.复杂三元水盐体系蒸发过程分析 (3)同成分复盐
阶段
过程情况
一
浓缩阶段
氯化钠-硫酸钠-水三元体系相平衡

氯化钠-硫酸钠-水三元体系相平衡
任保增;雒廷亮;赵红坤;李娟;刘国际
【期刊名称】《中国井矿盐》
【年(卷),期】2003(034)005
【摘要】采用等温法,在15℃和20℃下测定了氯化钠和硫酸钠在水中的相互溶解度数据,得到了平衡液相组成的密度和折光率.
【总页数】2页(P24-25)
【作者】任保增;雒廷亮;赵红坤;李娟;刘国际
【作者单位】郑州大学化工学院,河南,郑州,450002;郑州大学化工学院,河南,郑州,450002;郑州大学化工学院,河南,郑州,450002;郑州大学化工学院,河南,郑
州,450002;郑州大学化工学院,河南,郑州,450002
【正文语种】中文
【中图分类】TQ013.1
【相关文献】
1.硫酸钠-过氧化氢-水三元体系相平衡研究 [J], 王鸿显;赵红坤;李娟;刘国际
2.硫酸钠-过氧化氢-水三元体系液固相平衡的神经网络模拟 [J], 刘国际;赵红坤
3.氯化钠-氯化锶-水三元体系25 ℃相平衡研究 [J], 丁秀萍;孙柏;时历杰;阳海棠;宋彭生
4.氯化钠-四硼酸钠-水三元体系288K介稳相平衡 [J], 杨利娟;林陈晓;王士强;郭亚飞;邓天龙;
5.氯化钠-四硼酸钠-水三元体系288K介稳相平衡 [J], 杨利娟;林陈晓;王士强;郭亚飞;邓天龙
因版权原因,仅展示原文概要,查看原文内容请购买。
三元体系

F=C-P+1=4-P
当P=1时,自由度最大为3;当F=0时,最大相数为4。恒温恒压时,最大相 数为3,自由度最大为2。
第一节 三元体系相图的组成表示方法及基本规则
简单三元水盐体系: 由具有共同离子的两种盐和水构成的体系。
NaCl KCl H 2O Na2 SO4 ( NH 4 ) 2 SO4 H 2O
一、三组分系统相图
对三组分系统,由相律 : f = 3-P+1 = 4 -P
1P4,0f3 当f=3时,这三个独立的强度变量分别是T 及两种
盐的组成。需用三维坐标才能表达该体系的相图。三个 坐标轴分别是T 及两种盐的组成,构成立体相图,但立 体相图对我们考虑问题及处理相图都比较麻烦。因此我 们通常固定T ,讨论其余两个变量之间的关系,于是可
一、各类相图的等温蒸发过程
1.简单相图的蒸发 这种相图的特征是,图中只有无水盐的溶解度曲 线。图3-19 蒸发过程可分为三个阶段:MN-NQ-QS
简单相图蒸发过程
2.水合物I型 这类相图的特征是图中没有相应无水盐的溶解度曲线,只有水 合盐的溶解度曲线。蒸发路线:1→2→3→4→5,图3-20
固溶体),查去并计算它们的组成。
2.确定坐标系:用正三角或直角三角型坐标系判断复
盐的性质。
3.标点:按序号和组成将液相点逐一标于图中。 4.连溶解度曲线:连线原则:具有一个共同平衡固相
的液相点连接。
5.划分相区
NaCl-KCl-H2O体系
液相组成 Wt%
NaCl 1 2 26.4 23.7 KCl 0 5.0
根据复盐的组成,可在三角形坐标中标出其 位置,例如光卤石(Car)、白钠镁矾(Ast)及 无水钠镁矾(Van)
三角形中,连接水顶点与复盐组成点的直线叫做 “复盐射线” 复盐按其加水时的反应不同分为两种。 复盐分成两种:1、加水时只溶解不分解,叫稳定复 盐或相称复盐、同成分复盐,如白纳镁矾。 2、另一种复盐加水时不但溶解而且发生分解,叫不 稳定复盐或不相称复盐、异成分复盐,如光卤石
298K时NaCl_NH_4_2SO_4_H_2O三元水盐体系相平衡研究

水盐体系相平衡测定及硫酸钾制备实验报告

化学工程学院本科生专业实验报告题目水盐体系相平衡测定及硫酸钾制备学生姓名毛书林学号1043084006实验组号 2 - 12组员毛书林高雅琴尤乾坤指导教师金央2013年11月11日一、 实验目的本实验通过在25℃下K +、Na +、C1-、SO 42-和H 2O 体系的相平衡数据的测定、相图的绘制、工艺路线的分析以及实验方案的确定,最终制取K 2SO 4和NaCl 。
使实验者掌握化工产品的开发过程和基本方法。
二、实验原理实验室常用等温法测定相平衡数据。
即在某一恒定的温度下,使一定组成的系统在实验装置内达到相平衡,然后直接测定液相的组成,并鉴定与液相呈平衡的固相组成,从而获得相平衡数据。
1.相图标绘和分析等温等压条件下,K +、Na +、C1-、SO 42-、H 2O 体系相律公式为:p p C F -=-=4 其复分解反应方程式为24242KCl Na SO K SO 2NaCl+=+K 2Cl 2Na 2SO 4K 2SO 4Na 2Cl 2BCE K NM g M'K'图1 K +、Na +、C1-、SO 42-、H 2O 体系相图——25℃等温溶解度线 ----100℃等温溶解度线 —·—工艺分析线段 AEGFA :Na 2SO 4·10H 2O 结晶区 FHRGF :Na 2SO 4结晶区 HRJKBH :NaCl 结晶区EGRJPME :Na 2SO 4·3K 2SO 4结晶区 KJPNCK :KCl 结晶区 MPNDM :K 2SO 4的结晶区K 2Cl 2Na 2SO 4Na 2Cl 220406080100020406010080=2++4K 2SO 4K 2图2 四元体系相图坐标K 2Cl 2Na 2SO 4K 2SO 4Na 2Cl 2A BCDEKNM图3 四元体系25℃相图2相平衡体系的建立K+、Na+、C1-、SO42-、H2O体系存在着化学平衡和相平衡,反应物固盐硫酸钠和氯化钾溶解进入液相,在液相中离解为K+、Na+、C1-、SO42-四种离子,这些离子相互发生化学作用,生成产物硫酸钾和氯化钠,并从溶液中结晶出来,最终达到化学平衡和相平衡状态。
25℃和35℃时NH4Cl-CO(NH2)2-H2O三元体系相平衡研究

文 章 编 号 : 1 0 -0 52 0 )50 6 -5 0 39 1(0 70-8 40
2 " ̄ 5(时 N C . o N 2 一 2 三元体 系相平衡研 究 5( 1 " 2 3 2 H4 I ( H ) H 0 C 2
曹吉林, 刘秀伍 , 薛丽静, 马明磊 ( 河北工业 大学 化 工学院, 天津 303) 0 10
P ae ul r m f h e n r CI h s ib i o e r a)- y tm 2 H2
a 51 n 5 t " a d3 ℃ 2 2
C OJ l , LU X uw , X EL-n , MA n — i A -n ii I i—u U ii jg Mi l ge
维普资讯
第 2 卷 第 5期 1
20 年 1 07 0月
高
校
化
学
工 程
学 报
NO 5 、0 1 ,l 2 Oc . t 2 0 07
J u n l fCh mi a o r a e c l o Eng n e i g o i e eUni r i e i e rn fCh n s ve st s i
摘 要 : 为 了 确 定 尿 素 和 氯 化 铵 两 种 肥 料 形 成 加 合 物 的 条 件 和 性 质 , 采 用 等 温 法 分 别对 2 ℃ 和 3 ℃ 下 5 5
25℃和35℃时NH4Cl-CO(NH2)2-H2O三元体系相平衡研究

25℃和35℃时NH4Cl-CO(NH2)2-H2O三元体系相平衡研究曹吉林;刘秀伍;薛丽静;马明磊【期刊名称】《高校化学工程学报》【年(卷),期】2007(021)005【摘要】为了确定尿素和氯化铵两种肥料形成加合物的条件和性质,采用等温法分别对25℃和35℃下NH4Cl-CO(NH2)2-H2O三元体系相平衡进行了研究,测定了溶解度数据,并绘制了完整的相图.得出实验条件下,氯化铵与尿素能形成摩尔比为1:1的加合物;该体系相图存在NH4Cl、CO(NH2)2、CO(NH2)2·NH4Cl三个纯固相结晶区,和NH4Cl与CO(NH2)2·NH4Cl及CO(NH2)2与CO(NH2)2·NH4Cl两个共结晶区.对氯化铵与尿素的加合物及其两者组成混合物进行红外、热稳定性、X 衍射等分析表征可知,NH4Cl与CO(NH2)2形成的加合物没有产生新的共价健,但加合物的红外特征峰相对于纯物质发生小量的位移,加合物热稳定性比混合物稍低.【总页数】5页(P864-868)【作者】曹吉林;刘秀伍;薛丽静;马明磊【作者单位】河北工业大学,化工学院,天津,300130;河北工业大学,化工学院,天津,300130;河北工业大学,化工学院,天津,300130;河北工业大学,化工学院,天津,300130【正文语种】中文【中图分类】O642.42;TQ441.41;TQ441.13【相关文献】1.五元体系K2+2,Mg2+∥Cl2-2,SO2-4-CO(NH2)2-H2O及其边界四元体系MgSO4-MgCl2-CO(NH2)2-H2O在25 ℃时的等温溶度研究 [J], 张逢星;魏小兰;李珺2.CuSO4(ZnSO4)-CO(NH2)2-H2O三元体系在30℃时的等温溶度研究 [J], 张逢星;赵霈;杨琴;郭利娟;史启祯3.三元体系MgCl2-CO(NH2)2-H2O在25℃时的等温溶度与新相研究 [J], 张逢星;魏小兰;郭志箴;史启祯4.三元体系KH2PO4-CO(NH2)2-H2O在283.15 K的固液相平衡测定与关联 [J], 黄林川;李天祥;杨家敏;王肖丽;欧健;朱静5.三元体系PEG4000-Cs_2SO_4H_2O在25,35和45℃时的相平衡研究 [J], 翟全国;胡满成;张晓蕾;刘志宏;夏树屏;高世扬因版权原因,仅展示原文概要,查看原文内容请购买。
