有机合成课件3章(还原反应)
《还原反应》PPT课件
CH2 CHCH2Ph + 2
PhCH=CHCO2H + 2
H Ph +2
Ph H
Pd 120h
Pd 64h
CH3CH2CH2Ph 85%
PhCH2CH2CO2H 90%
Pd 17h
PhCH2CH2Ph
100%
PhC CPh + 2
Pd 23h
PhCH2CH2Ph 100%
CH CO2H + 2 CH CO2H
PhCH=CHCHO H2/Raney Ni
PhCH2CH2CH2OH
酮羰基的氢化要比醛羰基的氢化困难。
CH3COCH3 PhCOCH3
H2/ R-Ni, 0.1~0.3MPa 25~30℃, 38min
CH3CH(OH)CH 3
100%
H2/ Ni-NaH,EtOH, 0.1MPa 25℃, 2.5h
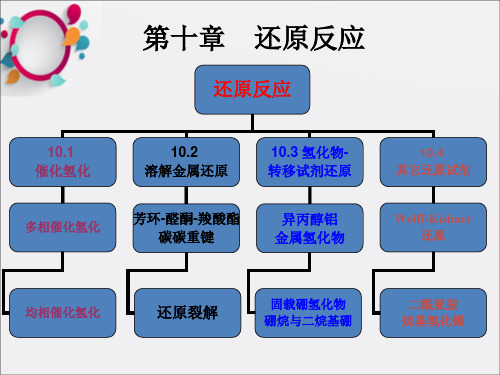
多相催化氢化分为催化加氢、催化氢解、催化转移氢化三类。
① 催化加氢反应:碳—碳重键的加氢反应
◆ 碳—碳重键在钯、铂、镍的作用下催化加氢成为饱和键。
CHCO2H CHCO2H
+ H2
CH2CO2H CH2CO2H
亚油酸酯 CH3(CH2)4CH=CHCH2CH=CH(CH2)7CO2R
H2/Ni
CH3(CH2)7CH=CH(CH2)7CO2R + CH3(CH2)4CH=CH(CH2)10CO2R
OH OH
H H
OH
OH 86%
◆催化加氢反应是合成顺式取代乙烯衍生物的重要方法。使用Lindlar催化剂可 使叁键变为双键,不影响其它双键。
RC CR'
H2
Lindlar催化剂
还原—催化加氢反应类型(有机合成课件)

精精细细有有机机合合成技成术技术
烷基还化原反反应应
醛或酮在酸性催化剂存在下,能与一分子醇发生加 成,生成半缩醛(酮)。半缩醛(酮)很不稳定,一般 很难分离出来,它可与另一分子醇继续缩合,脱水形成 缩醛(acetal)或酮。
精精细细有有机机合合成技成术技术
烷基还化原反反应应
醛加氢时生成的醇会与醛缩合成半缩醛及醛缩醇。
此反应的选择性只能达到70%,有大量的副产物饱和醇生成。
精精细细有有机机合合成技成术技术
烷基还化原反反应应
第二节 催化加氢
如果要得到不饱和醇,应选用金属氧化物催化剂,但
是反应时有可能发生氢转移生成饱和醛,因此必须采用较
为缓和的加氢条件。
不饱和双键与羰基同时加氢比较容易实现。可用金属 或金属氧化物催化剂,反应条件可以较为激烈,只要避免 氢解反应即可。
多烯烃的加氢也有类似过程。即每一个双键可吸收一分子氢,直 至饱和。如果选择合适的催化剂和反应条件,就可以对多烯烃进行部 分加氢,保留一部分双键。
精精细细有有机机合合成技成术技术
烷基还化原反反应应
环烯烃与直链烯烃的加氢反应采用相同的催化剂,双 键上有取代基时可减慢加氢反应速度。另外,环烯烃的加 氢有发生开环副反应的可能,因此要得到环状产物则需要 控制反应条件。通常五元环和六元环较稳定。
因此,苯加氢很难形成分步加氢的中间产物,即苯加氢通常只能得 到环己烷。
苯的同系物加氢速度比苯慢,说明含有取代基会对加氢反应产生活 性降低的影响。
精精细细有有机机合合成技成术技术
烷基还化原反反应应
稠环芳烃在加氢时会分步发生反应。如萘加氢时会有多种中间产物。
芳烃加氢时,也有可能发生氢解,产生侧键或芳环断裂。 工业生产中最常用的芳烃加氢是环己烷的生产。生产环己烷的主要工 艺是苯的催化加氢。
有机化学课件
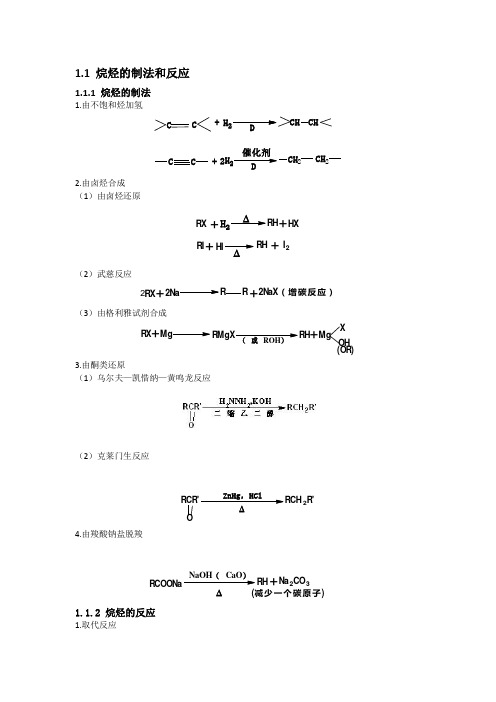
1.1 烷烃的制法和反应1.1.1 烷烃的制法1.由不饱和烃加氢C C+H 2CHCHCC+H 22D DCH 2CH 22.由卤烃合成 (1)由卤烃还原RX+H 2RHHX +RI HI+∆RH +I 2∆(2)武慈反应R X2+2N aRR2N aX (增碳反应)+ (3)由格利雅试剂合成RX+MgRMgX(或ROH )RH +MgX OH (OR)3.由酮类还原(1)乌尔夫—凯惜纳—黄鸣龙反应(2)克莱门生反应RCR'O2R'4.由羧酸钠盐脱羧NaOH (CaO )∆RH +Na 2CO 3(减少一个碳原子)1.1.2 烷烃的反应1.取代反应RH +X2光RX +HX (反应活性3'H>2'H>1'H>CH 4)例CH 3CH 2CH 3Cl 2光CH 3CH CH 3Cl+CH 3CH 2CH 2Cl(57%)(43%)2.氧化反应 (1)完全氧化CH 4+2O CO 2+2H 2O +热能(2)部分氧化RCH 2CH 2O 2,锰盐RCOOH +R'COOH (可制肥皂)4CH 4+O 21500C CH CH+2CO +7H 2O(3)裂化反应CH 3CH 2CH 2CH 3C H 2CH 2+C H 3CH 3+CH 3CH 2CH=CH 2+H 2+CH 4+CH 2CH 3(4)异构化反应CH 3CH 2CH 2CH 3AlBr 3 HBrCH 3CHCH 3CH 320%80%1.2 烯烃的制法和反应1.2.1烯烃的制法1 烷烃脱氢C C H H催化剂∆-H2C C (适合于简单烯烃,通常得混合物)CH3CH2CH2CH3Pt,500C CH3CH2CH=CH2+CH3CH3HH+CH3CH3H H+CH2=CHCH=CH2+H22.卤烷脱卤化氢C CX碱,热-HXC CHHHCl(CH3)3CO-K+3.醇脱水4.霍夫曼消除5.由炔烃加氢6.魏梯希反应1.2.2烯烃的反应1.烯烃的亲电加成(2)加水直接水合间接水合以上都符合马氏规律硼氢化-氧化反应(3)加卤素(4)加次卤酸2.烯烃的催化氢化CH3CH2H2,Pt CH3CH2CH33与碳烯加成CC+CC CC (X,Y=H,Cl,Br,I 或COOEt)+CHCl 3(CH 3)3COK+Cl4烯烃的氧化(1) 烯烃的环氧化C C+21O2CC OCH 2CH 2+21O 2O环氧丙烷C C+RCOOH C C O+RCOHCH 3CH CH 2+CH3OCH 2H 3CHCO+CH 3COOH(2) 高锰酸钾氧化C C稀KMnO OH C C (或OsO 4,H 2O 2)RCHCH KMnO R CO +CO 2+H 2OCH 3CH 2CH CH 2KMnO CH 3CH 2C O+CO 2+H 2OCR O+CR'OHORC RR C R'KMnOCH 3CHCCH 3CH 3KMnO 4CH 3COHO+CH 3CH 3O5烯烃的臭氧化反应C RR C R'+O 3OO COC RRR'H H 2ORO +CR'H ORCH 3CHCH CH 32Zn ,H 2OCH 3CHO +CH 3CH 3O6聚合反应nCH 2CH2>100℃,100MPaCH 2CH 2nn>100nCH 3CH CH 2烷基铝-三氧化钛50℃,1MPaCH3CH 2n7烯烃的a 氢原子反应(1) 卤代C Ha 氢+X 2C X+HX(或NBS)+NBSBr(2) 氧化烯烃的a氢易被氧化,在不同条件下,得到不同产物:CH 3CHCH 2+O 2CuO 370℃CH 2CHCHOCH 3CH CH 2+23O 磷钼酸铋 0.7~1.4MPa CH 2CHCOOHCH 3CHCH 2+NH 3+23O 2磷钼酸铋470℃2CHCN +3H 2O1.3 炔烃的制法和反应1.3.1 炔烃的制法1.金属炔化合物与卤烷反应RCC -Na ++R'XS N 2RCCR'+X -(1。
有机化学有机合成ppt课件

合成路线:
浓 HNO3
浓H2SO4
Br
H2 Fe NO2
NH2 Br
Br2
NaNO2 H3PO2
Br
Br H2SO4 H2O
Br
Br
NH2
17
例四:用苯和二个或二个碳以下的有机原料和无机试剂合成:
OH + N Cl-
逆合成分析:
OH + N Cl-
O
N
OH N
O + HCHO + HN(CH3)2
H+
CH2OH
32
例十一 用苯,苯甲酸和五个碳以下的简单有机原料合成:
Ph O
O Ph
33
逆合成分析:
Ph O
O
Ph CHO
+ PhCH2CH2MgBr
OH Ph
CH2OH
PhCH2CH2Br
Br + CH2O
PhCH2CH2OH
O PhMgBr +
34
合成路线:
Br2
Mg Br anhydrous
7
(3) 碳架的重组;
碳架重组的反应是各种重排反应,包括: *1 Wegner-Meerwein 重排; *2 频哪醇 (Pinacol) 重排; *3 异丙苯氧化重排; *4 Bechmann 重排; *5 Favosky 重排; *6 Baeyer-Villiger 氧化重排; *7 Hofmann 重排; *8 联苯胺重排; *9 Benzilic acid重排;
H2O OH
Br Mg/I2
无水醚
H+
O CH3I O
O
OH
23
例七 用不超过二个碳的简单有机原料或苯合成下列化合物: O
还原反应课件

•
Fe和酸(HCl、H2SO4、CH3COOH)
共存,或在盐类电解质(FeCl2、NH4Cl)
水溶液中,对于硝基是一种强还原剂。
• 用途:将硝基或其他含N基团(如亚硝基、
羟胺基)还原成相应氨基,对卤基、烯基、 羰基等无影响,是一种选择性还原剂。
• 铁屑在电解质溶液中还原硝基是一种 古老旳工艺,是1854年Bechamp发觉旳。
5.2.2.1 被还原物旳构造 环上取代基不同,反应活性不同。 比较:
O2N
COOCH3
O2N
OH
O
O
O
N
C
N
R
O
O-R
O
① 吸电子基? 硝基N上电子云密度降低,亲电能力增
强,还原反应易进行,反应温度可降低。
② 供电子基? 亲电能力降低,还原反应难进行,反应
温度较高,一般在沸腾回流下进行。
O2N
• 优点: 铁屑价格低廉,工艺简朴、合用范围
广,生产较易控制,产品质量好,副反应 少,对设备要求低。
在诸多旳还原措施中占有主要地位。
应用范围? 生产吨位较小旳芳胺,尤其是含水溶
性基团旳芳胺,如二甲苯胺、间氨基苯磺 酸及某些萘系胺类中间体。
• 缺陷: 生成大量含芳胺旳氧化铁铁泥废渣、
含胺废水,必须净化处理,废渣旳处理十 分困难。
• 铁粉是电子旳供给者。 6-2 6-3
• 被还原物旳某个原子→得到电子(铁粉 表面)→负离子自由基→得到质子(质子供 给体H2O)→还原产物。 6-4 6-5 6-6
副反应?
5.2.2 影响原因
影响原因
被 还 原 物 结 构铁Leabharlann 粉 质 量 和 用 量介 质
第三章 第四节 第2课时有机合成的过程

第2课时 逆合成分析法[学习目标定位] 熟知有机合成遵循的基本规律,学会设计合理的有机合成路线和逆合成分析方法,学会有机合成推断题的解答方法。
一 有机合成路线的设计1.烃和烃的衍生物转化关系如图所示:(1)将有机反应类型填在横线上。
(2)若以乙醇为原料合成乙二酸(HOOC —COOH),则依次发生反应的类型是消去反应、加成反应、水解(或取代)反应、氧化反应、氧化反应。
2.某有机物A 由C 、H 、O 三种元素组成,在一定条件下,A 、B 、C 、D 、E 之间的转化关系如下:已知C 的蒸气密度是相同条件下氢气的22倍,并可发生银镜反应。
(1)写出下列物质的结构简式:A________;B________;C________。
(2)写出下列变化的化学方程式:A →B :________________________________________________________________________;C 与银氨溶液反应: ________________________________________; A +D →E :______________________________________________。
答案 (1)C 2H 5OH CH 2===CH 2 CH 3CHO (2)C 2H 5OH ――→浓硫酸170℃CH 2===CH 2↑+H 2OCH 3CHO +2Ag(NH 3)2OH ――→△CH 3COONH 4+2Ag ↓+3NH 3+H 2O CH 3CH 2OH +CH 3COOH 浓硫酸△CH 3COOCH 2CH 3+H 2O 解析 分析题目所给五种物质之间的转化关系:由A ――→氧化C ――→氧化D ,且C 可发生银镜反应,可知C 为醛,则A 为醇,D 为羧酸,E 应是酯。
再根据题意,C 的蒸气密度是相同条件下氢气的22倍,可得M r (C)=44g·mol -1,所以C 为乙醛。
3.5.2有机合成——官能团转化及合成分析 课件 高二下学期化学人教版(2019)选择性必修3

示例分析:由乙烯合成二乙酸乙二酯
逆合成分析法
⑤
目标化合物
H2C OH
②
H2C OH CH3COOH ④
H2C
Cl
①
H2C Cl
CH2 CH2
C2H5OH ③
中间体
CH2 CH2
基础原料
同学们,如何合成二乙酸乙二酯?
路线一 CH2=CH2
加成 直接氧化
酯化
路线二
CH2=CH2
O2 催化剂,△
H2O 加压,△
官能团的保护 醇羟基的保护
可先将羟基转化为醚键,使醇转化为在一般反应条件下比较稳 定的醚。待相关合成反应结束后,再在一定条件下脱除起保护作 用的基团(保护基),恢复羟基。
【任务】
以HOCH2-CH=CH-CH2OH为原料合成HOOC-CH=CH-COOH的路线为
HOCH2-CH=CH-CH2OH
A HOCH2-CHCl-CH2-CH2OH B
CH3C OH NH4Cl
⑤苯的同系物氧化反应
R CH
R′
KMnO4 H+
COOH
二、官能团的引入
【小结1】常见官能团的引入
官能团
引入方法
碳碳双键 ①卤代烃的消去 ②醇的消去 ③炔烃的不完全加成
①醇(酚)的取代 ②烯烃(炔烃)的加成 碳卤键
③烷烃(苯及苯的同系物)的取代
羟基 ①烯烃与水的加成 ②卤代烃的水解 ③醛的还原 ④酯的水解
C=C +HX
—C—C—
NaOH/醇 △
XH
C=C
C=C +H2O
—C—C— OH H
浓硫酸 △
C=C
四、官能团的转化
官能团的保护
高等有机化学PPT课件

CH3CONHNH2 HNO2 CH3CON3
CH3NCO
X
O
C=NOH
CH3NCO
X
O
O
C N O C NHCH3
乃春在芳环邻位是不饱和支链时,极易环化成五元环,这一 性质对杂环的合成具有重要意义:
AX B
H N:
A BX
N
H
第三节:自由基
自由基是共价键发生均裂,每个碎片各保留一个电子,是带 单电子的三价碳的化合物。
2004年1版 6、洪琳编《有机反应活性中间体》高等教育出版社1999.6第一版 7、斯图尔特.沃伦著《有机合成――切断法探讨》丁新腾译,上海科学
技术文献出版社1986年1月第一版 8、黄宪、吴世晖、徐汉生《有机合成》(上、下)
第一章 有机反应活泼中间体及在合成上的应用
在有机反应中,经常出现的活泼中间体是卡宾、乃春、自由基、碳正离子、 碳负离子(包括苯炔、叶立德)
第一章 有机反应活泼中间体 及在合成上的应用
第一节:卡宾(碳烯)(Carbene) 第二节: 乃春 第三节:自由基 第四节:碳正离子 第五节、碳负离子(Carbenion)(活泼亚甲基
化合物)和叶立德
第二章 官能团的选择性互变
第一节 还原反应 第二节 氧化反应
第三章 官能团的保护
第一节: 羟基的保护(醇、酚羟基的保护) 第二节:烯键的保护 第三节:羰基的保护(用醇保护) 第四节:羧基的保护-酯化 第五节:胺基的保护-酰化或成盐
(六)生物有机化学( Bioorganic Chemistry) (七)元素和金属有机化学(Element and Metal Organic Compounds Chemistry) (八)有机化学中的一些重要应用研究
有机合成完整版课件PPT

中202约1/3/1070%以上是有机化合物。
5
第四节 有机合成
2021/3/10
6
用化学方法人工合成物质
复写自然物质
HO
O O
HO
HO
OH
2021/3/10
7
用化学方法人工合成物质
修饰自然物质
解热镇痛药物——阿司匹林 难溶于水。
修饰
COONa
阿司匹林的钠盐,易溶于水,
CH3CH2Br合成CH3COOCH2CH3
4.有机合成的任务 (1)目标化合物分子碳链骨架的构建 (2)官能团的转化和引入
2021/3/10
13
5、有机合成的设计思路:
6、关键:
设计合成路线,即碳骨架的构建、官能团的引
入和转化 。 2021/3/10
14
【知识复习】
1、有机反应的类型
1)取代反应:甲烷、苯、醇的卤代,苯的硝化、 磺化,醇与活泼金属反应,醇的分子间脱水,酯 化反应,酯的水解反应等。
11
3.有机合成的过程
基础原料
副产物 中间体1
副产物
中间体2
目标化合物
辅助原料
辅助原料
辅助原料
有机合成过程示意图
这种按一定顺序进行的一系列反应就构成了合成路线
2021/3/10
12
【合作探究2】
观察探讨1中基础原料和目标产物的结构发生了 哪些变化?思考有机合成的任务是什么?
②卤代烃水解 水
C2H5Br +NaOH △ C2H5OH + NaBr
③醛/酮加氢
催化剂
CH3CHO +H2 Δ CH3CH2OH
④酯的水解
稀H2SO4
4 还原反应

应用这类还原剂进行的还原反应均为电子得失的过程。金属在还原反 应中的作用是供给电子,所需的氢由水、醇(乙醇、正丁醇、叔丁醇 等)、酸(有机酸、无机酸)等“质子供给剂”提供。例如:
Fe
2+
e
Fe
3+
Sn
2+
2e
Sn
4+
通常,金属与质子供给剂的反应越剧烈,其还原效果也越差,因 为生成的质子迅速形成氢气而逸出反应体系。金属钠与盐酸等无机酸 不能用作还原剂概属此理。 还原机理,以羰基化合物用金属还原为例:
OH O H 3C CH CH CCH(CH3)2 H 3C
2.以C3以下的有机物为原料合成
OH O
(提示:经已二酸二乙酯合成该化合物)
(4) 腈还原为伯胺
Na-EtO H
PhCH2CN
PhCH2CH2NH2
1.用甲苯为原料合成PhCH2CH2NH2 2.用乙烯为原料合成CH3CH2CH2NH2
H 3C 3.以丙酮为原料合成 H C C CH2NH2 3 OH
4.2金属还原剂
4.2.1 概述
活泼金属与其合金,以及某些金属的盐类是应用十分广泛的一类还 原剂。活泼金属包括: 碱金属(Li、Na、K)。 碱土金(Ca、Zn、Mg),以及A1、Sn、Fe等在电动势系列中处于氢 以上的金属。 金属与汞的合金谓汞齐,如钠汞齐、锌汞齐、镁汞齐、铝汞齐等。 钠汞齐的活泼性不及金属钠,而铝汞齐的活泼性则超过铝。 一般说来,汞齐可使高活泼性金属的活泼性降低,使低活泼性金 属的活泼性提高。汞齐的另一作用是增加流动性以便于操作。 常用作还原剂的金属盐有FeSO4、SnCl2等,其有效的还原剂实际 上是Fe2+、Sn2+等金属离子。
人教版化学《有机合成》精美课件

13
人 教 版 选 修 五有机 化学第 三章-第 四节有 机合成 56张
• 2、通过加成(加H)或氧化(加O)消除醛基
催化剂
H3CHC=O+H2 Δ
CH3CH2OH
催化剂
2CH3CHO+O2 Δ 2CH3COOH
• 3、通过消去或氧化或酯化等消去羟基
浓硫酸△
CH3CH2OH
CH2=CH2+H2O
Cu △
5
思考与交流
(一)常见引入官能团的方法
1、怎样在有机化合物中引入碳碳双键?
(1)炔烃与氢气 1:1 加成
(2)卤代烃的消去 (3)醇的消去
三种方法
2、怎样在有机化合物中引入羟基?
(1)烯烃与水加成 (2)卤代烃水解
(3)醛/酮加氢 (4)酯的水解
四种方法
6
人 教 版 选 修 五有机 化学第 三章-第 四节有 机合成 56张
2CH3CH2OH+O2
2CH3CHO+2H2O
浓硫酸△
CH3OH+HCOOH HCOOCH3+H2O
人 教 版 选 修 五有机 化学第 三章-第 四节有 机合成 56张
14
人 教 版 选 修 五有机 化学第 三章-第 四节有 机合成 56张
【思考与交流】
【例1】以BrCH2-CH=CH-CH2Br为原料合成药物 CH3OOC-CH=CH-COOCH3的路线为:
官能团的性质
类别
醇
酚 醛 羧酸 酯
官能团 通式
代表物
主要化学性质
—OH
—OH —CHO —COOH —COO—
R—OH CnH2n+2O
CnH2n-6O R—CHO CnH2nO R—COOH CnH2nO2 RCOOR` CnH2nO2
有机合成(公开课)课件

有机合成设计的基本原则
选择性
在合成过程中,应尽可能 选择具有高选择性的反应 条件和试剂,以获得单一 的产物。
高效性
合成路线应尽可能短、步 骤少,以提高效率和减少 副产物的产生。
实用性
合成方法应具有实际应用 价值,能够在实验室或工 业生产中实现。
03
有机合成的基本单元操作
氧化反应
总结词
通过氧化反应可以将有机物中的氢原子替换为氧原子,或使碳碳双键转化为碳 碳三键。
组合合成
通过使用微反应器、固相载体或液相微流控技术 ,实现高通量、高效率的有机合成。
有机合成在药物研发中的应用
1 2
新药发现
有机合成在药物发现过程中发挥关键作用,通过 合成具有生物活性的小分子化合物,筛选出具有 潜在治疗作用的候选药物。
药物优化
在药物研发后期,有机合成可用于对先导化合物 进行结构优化,以提高药效和降低副作用。
化合物。
04
有机合成的策略与技巧
逆合成分析法
逆合成分析法是一种通过将目标 分子进行逆向拆分,寻找可利用
的原料和合成步骤的方法。
在逆合成分析过程中,需要选择 合适的切断点,以得到尽可能简 单、易得的原料,同时要考虑合
成步骤的经济性和可行性。
逆合成分析法需要熟练掌握各种 官能团的转化和反应机理,以及 各种试剂和催化剂的性质和应用
取代反应
总结词
取代反应是有机化合物中的某一基团被另一基团取代的反应 。
详细描述
取代反应通常是在有机化合物中某一基团(如氯、溴、硝基 等)被另一基团(如羟基、氨基、烷基等)所取代。这些反 应在有机合成中非常常见,可以用于制备各种类型的有机化 合物。
加成反应
总结词
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H CO
O
H3C ArCH3
TICl3/K THF
CH3 H3C Ar
还有一个还原关环的方法:
CO2Me
H3C CH3
CH2CO2Me
H3C CH3
Na, NH3(L) H3C
CH3 H3C
OH O
CH3
第三章 还原反应
4.镁:镁与甲醇的混合物可选择性还原α. β-不饱和酯,酰
胺和腈。镁和NH4Cl的混合物可还原酮:
不需加压。
NO2
NH2NH2
NH2
NO2
Pd - C
NH2NH2
NH2
CN Rancy-Ni 98%
CN
H C CH CO2H
NH2NH2
Rancy-Ni 85%
H2 CH2 C CO2H
第三章 还原反应
3.三价磷化合物:
三价磷化合物,Ph3P, (C2H5O)3P 常用于脱氧及脱硫反应:
HH Ph C C COOC2H5
收率高。
OH
OH
NO2 Na2S2O4-OH-
NH2
Cl
Cl
第三章 还原反应
NN OH
SO3H Na2S2O4-OH-
NH2 NH2 OH
2. 肼:
C O NH2NH2
OHC N NH2
CH3 OH
NH2NH2 KOH
CH3 OH
98% CHO
CH3
CH2
SO3H
N2
第三章 还原反应
在Pd-C、或Raney-Ni等催化下,肼的还原更快、
第三章 还原反应
TiCl3可把α,β-不饱和酮的碳碳双键还原:
O CH3-C-CH=CH-CO2C2H5
TiCl3.H2O THF
O CH3-C-CH2CH2-CO2C2H5
O
O
TiCl3.H2O THF
O
O
O
CHO
CH3 ?
O
CHO CH3
O
O
第三章 还原反应
四. 非金属还原剂:
1.含硫还原剂:
Mg CH3COCH3
NH4Cl
CH3CHCH3 OH
HgCl2, Mg在苯中回流形成镁汞齐,镁汞齐可还原酮得醇或
片呐醇:
CH3COCH3
Mg, HgCl2 苯
CH3CHCH3 +
CH3
CH3 CH3 C C CH3
OH
OH OH
第三章 还原反应
5.铁: 铁是还原-NO2化合物的常用还原剂:
CH3 Fe+HCl
第三章 还原反应
⑷ NaBH4-H2SO4体系: 此体系是还原氨基酸常用的方法:
H R C CO2H
NH2
H R C CH2OH
NH2
第三章 还原反应
⑸KBH4-ZnCl2-甲苯: ZnO和KBH4在室温下反应2h,再加入反应物和甲苯:
Ph CH2CONH2 Ph CO2H Ph CO2C2H5
如:
H3C H3C
Br
. CH3 n-Bu3Sn
CH3
H3C H3C
.
. CH3
H
CH3
H3C H3C
H
CH3 CH3
Br
Br
H3C H3C
. CH3 n-Bu3Sn
CH3
H3C H3C
.
Br
Br
. CH3 H H3C
CH3
H3C
H
CH3 CH3
O Cl
n-Bu3Sn
O
H
OH
O
第三章 还原反应
5.醇铝还原剂(氧化剂?)
ROH+Na CHO
CH2OH
CO
ROH+Na
CH OH 和
CC
ROH+Na CO2R
OH OH
CH2OH
ROH+Na CN
CH2NH2
第三章 还原反应
ROH+Na CONH2 PhCH2CN ROH+Na
CH2OH PhCH2CH2NH2
羧酸和酰胺的羰基较难还原,常用Na+Hg:
CO2H
Na-Hg
O
Ph3P
PhCH CH COOC2H5
O CS
(C2H5O)3P
O
O Ph3P
O
Br CH3CHBr CHBr COOC2H5
Ph3P
CH3CH CH COOC2H5
第三章 还原反应
五,催化氢化:
➢ 催化氢化是在催化剂作用下进行分子氢的加成作用。根据 反应体系可分为均相体系和非均相体系.
1. 非均相催化氢化:(顺式加成产物) ➢ 很多金属催化剂需要附载在多孔性物质如活性炭、CaCO3、 BaSO4、AlCl3上,而这些复合催化剂难溶于有机溶剂中,因 此多为非均相催化氢化,反应发生在催化剂表面。 ➢ 常见的金属催化剂为Pd、Pt、Cu、Ni 等。
第三章 还原反应
③在碱性介质中:
Zn(OH-) O2N
Zn(过 量)
NN H
NH N
NaOH, Zn
Ph2CO
Ph2CHOH
④ 锌和α-卤代酮作用得到锌试剂:
O Br Zn, 苯
O ZnBr
OZnBr RCHO
H CR OH O
第三章 还原反应
3.钛:TiCl3用K或LiAlH4 还原得金属钛。 钛可把两个羰基还原关环:
TiCl4/Mg-Hg
O
K2CO3
OH
O
TiCl2
CHO
O
OH
第三章 还原反应
2. TiCl4-LiAlH4-Et3N可还原α,β-不饱和酯为饱和酯:
CO2C2H5 TiCl4-LiAlH4-Et3N CO2C2H5
CO2C2H5 CO2C2H5
C2H5O2C
CO2C2H5 TiCl4-LiAlH4-Et3N C2H5O2C
CBr3CH=O (CH3)2CHOH CBr3CH2OH
O2N
OH C CH2OH NHCOCH3
Al[OCH(CH3)2]3 (CH3)2CHOH
O2N
OHH C CH2OH
H NHCOCH3
氯霉素原料
第三章 还原反应
三,低价金属盐作还原剂:
1. TiCl2 TiCl4与Mg作用生成TiCl2,它可把羰基化合物还原为 邻二醇:
有机合成化学
第三章 还原反应
H3CO2C HOH2C OHC H3CO2C
C4H9 C4H9
O
O
C4H9 C4H9
O
O
C4H9 C4H9
O
O
C4H9
CO2CH3
CH2OH CHO C4H9
O
O
H3CO2C
C4H9 O
C4H9 O
第三章 还原反应
一,金属还原剂
1.碱金属还原剂
①Na 所用溶剂为醇、液氨、苯、甲苯、THF等
R CH2CH2R R CH2NH2 R CH2OH
第三章 还原反应
酰胺比酯易被BH3还原:
CO2CH3
ON
B2H6
CH2Ph
CO2CH3
N CH2Ph
B2H6与C=C作用时有很高的立体选择性。如:
CH3
B2H6
C2H5
C
C H
CH3
CH3 C2H5 CH CH CH3
HBH
第三章 还原反应
H3C C C OC2H5
H3C
H
B2H6
CH3
B2H6
C CH3
C H
OCOCH3
H3C H2 H3C C C OC2H5
H BH
H3C H3C
CH
H C OCOCH3 B
有机硼化合物用醋酸处理得到烷烃:
B2H6 n-C4H9CH CH2
(n-C4H9CH2CH2)3B
CH3CO2H n-C4H9CH2CH3
第三章 还原反应
PhCH2NH2 NaBH4/I2 PhCH2CH2OH
NaBH4/I2
CH3(CH2)8CH2OH
第三章 还原反应
⑶ KBH4-AlCl3-THF体系: KBH4的还原能力比NaBH4还弱,但 KBH4-AlCl3-THF还原能力较强:
COOH KBH4-AlCl3-THF
COOH
CH2OH CH2OH
CH3
NO2
NH2
6.锡:锡及SnO2是还原-NO2化合物的常用还原剂,还原能 力比Fe强。
C2H5O
NN
OC2H5 SnCl2+HCl
C2H5O
NH N H
O
O
NH SnCl2,HCl
O2N
H2N
O
NH O
OC2H5
第三章 还原反应
二. 金属氢化物
1. LiAlH4:
强 CO
H C OH
CN R NO2
CH2NH2 R NH2
CO2R CONR2
CHBr
CH2OH
CH2NR2 CH2
弱C C
CH C OH
CH2OSO2Ar
CH3
O
LiAlH4的还原能力强,需要无质子溶剂。
第三章 还原反应
2. NaBH4:
⑴NaBH4还原能力比LiAlH4弱,它有较好的选择性:
第三章 还原反应
NC
O NaBH4
Ph CH2CH2NH2 Ph CH2OH Ph CH2OH
第三章 还原反应
⑹NaBH4-H2O: 该体系常用于氨基酸酯:
H3C CH CO2C2H5 NH2
CH3CH CH2OH NH2
