植物淀粉含量试剂盒(分光光度法)使用说明
直链淀粉含量检测试剂盒说明书 微量法

直链淀粉含量检测试剂盒说明书微量法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
货号:BC4265规格:100T/96S产品简介:直链淀粉是D-葡萄糖基以α-(1,4)糖苷键链接的多糖链,直链淀粉含量影响着食品的食用品质和外观品质,与食品安全息息相关。
直链淀粉和碘形成蓝色络合物,利用乙醇分开样品中的可溶性糖和淀粉,再用碘与其反应得到直链淀粉含量。
试验中所需的仪器和试剂:可见分光光度计/酶标仪、天平、台式离心机、微量玻璃比色皿/96孔板、可调式移液枪、研钵/匀浆器、乙醚、无水乙醇、EP管。
产品内容:试剂一:液体110mL×1瓶,4℃保存;试剂二:乙醚100mL×1瓶,自备;试剂三:液体55mL×1瓶,4℃保存;O=9mL:91mL混匀,现用现配,4℃保存半年。
试剂四:将试剂三:H2试剂五:液体0.5mL×1支,4℃保存;粉剂一:粉剂×1瓶,4℃保存;粉剂二:粉剂×1瓶,4℃保存;试剂六的配制:将粉剂一倒入粉剂二,用蒸馏水定容至10mL,4℃避光保存一个月。
标准品:10mg直链淀粉×1支,4℃避光保存。
临用前加入0.1mL无水乙醇和0.9mL试剂三,混匀后封口膜封口,沸水浴至溶解,即10mg/mL的直链淀粉。
吸取0.1mL加入0.9mL蒸馏水配制为1mg/mL的标准溶液待用。
操作步骤:一、直链淀粉的提取:称取0.005g烘干样本于研钵中研碎,加入1mL试剂一,充分匀浆后转移到EP管中,80℃水浴提取30min,3000g,25℃离心5min,弃上清,留沉淀,加入1mL试剂二(乙醚)振荡5min,3000g,25℃离心5min,弃上清,留沉淀,加入5mL试剂四充分溶解,90℃水浴10min,冷却后3000g,25℃离心5min,取上清待测。
二、测定步骤:1、分光光度计/酶标仪预热30min以上,调节双波长至550nm和485nm,蒸馏水调零。
淀粉检验操作规程

淀粉检验操作规程淀粉是广泛存在于植物中的一种碳水化合物,是植物储存能量的主要形式。
淀粉的存在对人类起着重要的作用,因此淀粉的检验也显得十分重要。
下面是淀粉检验的操作规程。
1.实验材料与试剂准备:(1)实验材料:需要检验的淀粉样品(2)试剂:1%碘酒溶液、1%淀粉酶溶液、蒸馏水2.实验仪器准备:显微镜、试管架、试管夹、移液管、显微镜玻片、滴管、可调光显微镜等。
3.操作步骤:(1)取一小段透明的淀粉样品,放置在显微镜盒中。
(2)在显微镜盒中加入适量的蒸馏水,用移液管充分搅拌溶解。
(3)加入一滴1%碘酒溶液,再次充分搅拌。
(4)然后观察淀粉颗粒的表现情况,通过在显微镜下进行观察淀粉颗粒的颜色和形态来判断样品中是否含有淀粉。
(5)如果样品中含有淀粉,那么淀粉颗粒会呈现出蓝色、黑色或紫色。
而纯净的蒸馏水不会变色。
(6)如果初步检验结果显示样品中含有淀粉,可以进一步进行淀粉的酶解试验。
(7)取一部分检验样品,加入适量的1%淀粉酶溶液,同时在控制组中加入相同体积的蒸馏水作为对照。
(8)将试管放置在37℃恒温箱中,保持恒温1-2小时。
(9)取出试管,加入适量的碘酒溶液进行观察。
(10)观察结果显示,如果样品中的淀粉被完全酶解,那么样品会变成无色,而对照组中的样品仍然呈现淀粉的蓝色。
4.结果分析与结论:(1)如果观察结果显示样品中的颗粒呈现蓝色、黑色或紫色,可以判断样品中含有淀粉。
(2)如果样品经过酶解试验后呈现无色,说明淀粉已经被酶解,不存在于样品中。
(3)结合实验结果和观察现象,可以得出对样品中是否含有淀粉的结论。
通过以上的操作规程,可以较准确地对淀粉样品进行检验,从而判断样品中是否含有淀粉。
这对于食品行业、农业、医药等领域的品质检验具有重要意义。
分光光度计 总淀粉测定方法

分光光度计总淀粉测定方法
分光光度计在总淀粉的测定中起到了关键作用。
以下是基于分光光度计的总淀粉测定方法:
原理:淀粉颗粒与碘反应可生成深蓝色的络合物,在波长660nm 处具有最大光吸收峰。
根据生成络合物颜色的深浅,用分光光度计测定吸光度值,对照标准曲线,可以计算出淀粉的含量。
材料:马铃薯、香蕉、苹果、葡萄等。
仪器及试剂:
仪器:刻度试管(25mL)、电子天平、容量瓶(100mL)、漏斗、滤纸、试管、电炉、刻度吸管(或移液器)、水浴锅、分光光度计、记号笔。
试剂:0.5%碘液。
步骤:
取不少于20g去壳种子磨粉,磨至95%的粉样通过0.25mm筛。
称取1g粉样,精确到1mg,放入20ml刻度试管中。
加入5ml 0.33mol/L盐酸溶液,振荡混匀后,继续加入5ml
0.33mol/L盐酸溶液。
将试管置于沸水中煮沸10min。
取出冷却后,加入0.5ml 30%(m/V)硫酸锌溶液,振荡混匀,释出蛋白质。
加入0.5ml15%(w/v)亚铁氰化钾溶液,振荡混匀(如有泡沫加几滴95%乙醇)。
定容至20ml刻度处,摇匀后过滤。
在20~25℃环境中,用空白液调整旋光仪的零点,测定样品液的旋光度。
注意事项:
盐酸的浓度必须控制在0.31~0.33mol/L内。
蛋白质含量高的作物应适当增加硫酸锌溶液的用量。
淀粉的比旋度因不同作物略有差异。
结果计算:通过分光光度计测得吸光度值后,可以对照标准曲线计算出淀粉的含量。
请注意,此方法仅供参考,具体操作请根据实际情况和实验室条件进行调整。
植物 β-淀粉酶(β-amylase,β-AL)试剂盒使用说明

植物β-淀粉酶(β-amylase,β-AL)试剂盒使用说明分光光度法正式测定前务必取2-3个预期差异较大的样本做预测定货号:BC2040规格:50管/24样产品内容:试剂一:50mL×1瓶,常温保存,若有黄色晶体析出,需90℃加热溶解后再用;试剂二:40mL×1瓶,4℃保存。
若有沉淀析出,需70℃加热溶解后再用。
产品说明:淀粉酶负责水解淀粉,主要包括α-淀粉酶和β-淀粉酶。
β-淀粉酶(EC 3.2.1.2)可随机地作用于淀粉中的α-1,4-糖苷键,生成葡萄糖、麦芽糖、麦芽三糖、糊精等还原糖。
还原糖还原3,5-二硝基水杨酸生成棕红色物质。
α-淀粉酶不耐酸,β-淀粉酶不耐热。
根据上述特性,钝化其中之一,就可测出另一种淀粉酶的活力。
需自备的仪器和用品:可见分光光度计、恒温水浴锅、离心机、可调式移液器、玻璃比色皿、研钵和蒸馏水。
操作步骤:一、粗酶液提取:称取0.1~0.2g样本(建议称取约0.1g样本),加入1mL蒸馏水,研磨匀浆;将匀浆倒入离心管中,提取液在室温下放置提取15min,每5min振荡1次,使其充分提取;3000g,25℃离心10min,取上清液加蒸馏水定容至10mL,摇匀,即淀粉酶原液。
吸取上述淀粉酶原液1mL,加入4mL蒸馏水,摇匀,即为淀粉酶稀释液,用于(α+β)淀粉酶总活力的测定。
二、测定步骤:1.分光光度计预热30min以上,调节波长到540nm,蒸馏水调零。
2.试剂一或试剂二40℃预热10min。
3.测定操作表:α-淀粉酶活力测定总淀粉酶活力测定试剂名称(μL)对照管测定管对照管测定管淀粉酶原液25025070℃水浴15min左右,冷却淀粉酶稀释液250250蒸馏水250250试剂二25025040℃恒温水浴中保温5min试剂一500500500500混匀,95℃水浴5min,冷却,在540nm下测定吸光度,从左到右分别记为A1、A2、A3和A4。
三、酶活性计算:1、标准条件下测定回归曲线为y=3.7215x-0.1778;x为标准品浓度(mg/mL),y为吸光值。
直链淀粉含量检测试剂盒

直链淀粉含量检测试剂盒说明书(货号:NM-W-0214 微量法100T/96S)一、产品简介:直链淀粉是D-葡萄糖基通过α-(1,4)糖苷键以直链状结构连接而成的大分子物质。
直链淀粉的含量是影响食品感官品质和加工特性的一个重要因素,并且与淀粉的特性密切相关,其含量测定对食品营养价值评价、粮食的合理加工,淀粉的合理利用和农业育种等具有重要意义。
直链淀粉与碘能够形成蓝色络合物,通过测定605 nm 和435 nm 处吸光值的变化即可定量检测直链淀粉的含量。
二、试剂盒组分与配制:三、需自备的仪器和用品:酶标仪、96孔板、台式离心机、恒温水浴锅/培养箱、研钵/匀浆器、天平、60目筛、可调式移液器、乙醚、蒸馏水。
四、操作步骤:建议正式实验前选取2个样本做预测定,了解本批样品情况,熟悉实验流程,避免实验样本和试剂浪费!1、预实验样本制备℃ 将样本烘干后充分研磨,准确称取0.01g样本至2mL的EP管中,加入1mL试剂一,充分匀浆,80℃水浴提取30min,冷却至室温,4000g,25℃离心5min,弃上清,留沉淀(尽量保留沉淀)。
℃ 向沉淀中加入1mL试剂二,混匀并振荡5min,4000g,25℃离心5min,弃上清,留沉淀(尽量保留沉淀)。
℃ 向上步沉淀中,加入1mL试剂三,混匀(使样本全部浸在液体中),封口,90℃水浴10min(密封以防止水分散失)。
℃ 冷却至室温,将EP管中全部液体转移至10mL EP管中(用1mL蒸馏水冲洗EP管,全部转至10mL EP管中,重复三次),再加蒸馏水准确定容至10mL,混匀,4000g,25℃离心5min,取上清液作为待测样本。
2、标准溶液的配制:把10mg/mL的标准品母液用试剂四稀释成2、1、0.5、0.25、0.125、3、预实验上机操作:℃ 酶标仪预热30min以上,调节双波长至605 nm 和435 nm。
℃ 操作表:4、正式实验:℃ 若预实验测定吸光值超出标准吸光值线性范围:高于最高值建议将待测样本用试剂四适当稀释后再进行测定,低于最低值建议适当增加样本质量W后再进行测定,并将改变后的D和W代入公式计算;℃ 确定好最适实验条件后,正式实验样本制备同预实验样本制备;℃ 正式实验按照预实验上机操作步骤进行(标准管和空白管预实验已做,正式实验可选做)。
结合态淀粉合成酶(GBSS)活性检测试剂盒说明书 紫外分光光度法

结合态淀粉合成酶(GBSS)活性检测试剂盒说明书紫外分光光度法注意:正式测定前务必取2-3个预期差异较大的样本做预测定。
货号:BC3290规格:50T/48S25T/24S产品内容:提取液:液体100mL×1瓶,4℃保存;试剂一:液体40mL×1瓶,4℃保存;试剂二:粉剂×2瓶,4℃保存;临用前每支加入7mL试剂一。
试剂三:粉剂×2瓶,-20℃保存;试剂四:粉剂×2瓶,-20℃保存;临用前每支加入5mL试剂一。
试剂五:粉剂×2瓶,-20℃保存;临用前每支加入8mL试剂一。
试剂六:粉剂×2支,-20℃保存;临用前加入416μL双蒸水,充分溶解备用,用不完的试剂4℃保存;试剂七:液体250μL×3支,-20℃保存;试剂八:液体12.5μL×2瓶;每支临用前加入溶解好的4mL试剂四反应液Ⅰ的配制:临用前在试剂二中加入7mL试剂一,缓慢加热,逐渐升温使其溶解,冷却后加入试剂三混合溶解。
这样可以分两批配制并且测定。
产品说明:GBSS(EC 2.4.1.21)以束缚态存在于淀粉体中,催化淀粉链的加长反应,主要负责直链淀粉的合成。
GBSS催化ADPG与淀粉引物(葡聚糖)反应,将葡萄糖分子转移到淀粉引物上,同时生成ADP;进一步通过反应体系中添加的丙酮酸激酶、己糖激酶和6-磷酸葡萄糖脱氢酶依次催化NADP+还原为NADPH,其中NADPH 生成量与前一步反应生成的ADP数量呈正比,通过340nm下测定NADPH的增加量,可以计算GBSS活性。
需自备的的仪器和用品:紫外分光光度计、水浴锅、台式离心机、可调式移液器、1mL石英比色皿、研钵、冰和蒸馏水。
操作步骤:一、粗酶液制备称取约0.1g组织加入1mL提取液,冰浴中匀浆。
10000g,4℃离心10min,弃上清,在沉淀中加入1mL 提取液充分混匀,置冰上待测。
二、测定步骤试剂名称(μL)测定管样本200反应液Ⅰ270混匀,30℃保温20min,置沸水浴中1min(盖紧,防止水分散失),冰浴冷却试剂八150混匀,30℃保温30min,置沸水浴中1min(盖紧,防止水分散失),冰浴冷却,10000g常温离心10min,取上清液。
直链 支链 总淀粉含量(酶法)试剂盒说明书
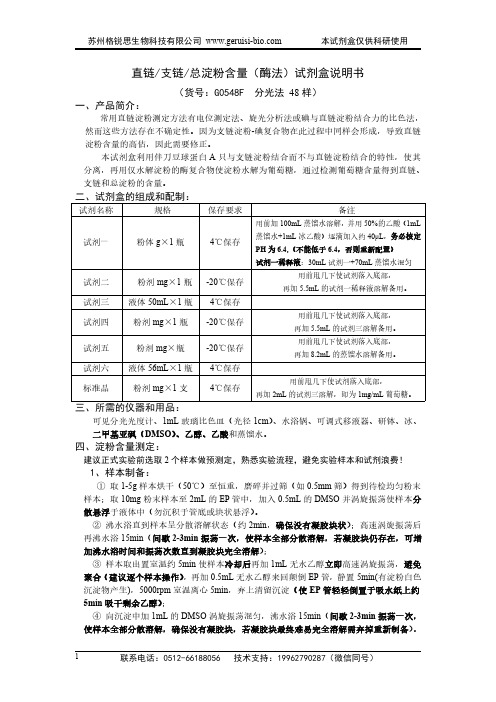
直链/支链/总淀粉含量(酶法)试剂盒说明书(货号:G0548F分光法48样)一、产品简介:常用直链淀粉测定方法有电位测定法、旋光分析法或碘与直链淀粉结合力的比色法,然而这些方法存在不确定性。
因为支链淀粉-碘复合物在此过程中同样会形成,导致直链淀粉含量的高估,因此需要修正。
本试剂盒利用伴刀豆球蛋白A只与支链淀粉结合而不与直链淀粉结合的特性,使其分离,再用仅水解淀粉的酶复合物使淀粉水解为葡萄糖,通过检测葡萄糖含量得到直链、支链和总淀粉的含量。
二、试剂盒的组成和配制:试剂名称规格保存要求备注试剂一粉体g×1瓶4℃保存用前加100mL蒸馏水溶解,并用50%的乙酸(1mL 蒸馏水+1mL冰乙酸)逐滴加入约40μL,务必核定PH为6.4,(不能低于6.4,否则重新配置)试剂一稀释液:30mL试剂一+70mL蒸馏水混匀试剂二粉剂mg×1瓶-20℃保存用前甩几下使试剂落入底部,再加5.5mL的试剂一稀释液溶解备用。
试剂三液体50mL×1瓶4℃保存试剂四粉剂mg×1瓶-20℃保存用前甩几下使试剂落入底部,再加5.5mL的试剂三溶解备用。
试剂五粉剂mg×瓶-20℃保存用前甩几下使试剂落入底部,再加8.2mL的蒸馏水溶解备用。
试剂六液体56mL×1瓶4℃保存标准品粉剂mg×1支4℃保存用前甩几下使试剂落入底部,再加2mL的试剂三溶解,即为1mg/mL葡萄糖。
三、所需的仪器和用品:可见分光光度计、1mL玻璃比色皿(光径1cm)、水浴锅、可调式移液器、研钵、冰、二甲基亚砜(DMSO)、乙醇、乙酸和蒸馏水。
四、淀粉含量测定:建议正式实验前选取2个样本做预测定,熟悉实验流程,避免实验样本和试剂浪费!1、样本制备:①取1-5g样本烘干(50℃)至恒重,磨碎并过筛(如0.5mm筛)得到待检均匀粉末样本;取10mg粉末样本至2mL的EP管中,加入0.5mL的DMSO并涡旋振荡使样本分散悬浮于液体中(勿沉积于管底或块状悬浮)。
支链淀粉含量检测试剂盒说明书 微量法

支链淀粉含量检测试剂盒说明书微量法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
货号:BC4275规格:100T/96S产品简介:支链淀粉又称胶淀粉,一般由几千个葡萄糖残基组成,淀粉中直链淀粉和支链淀粉的比例和含量对淀粉产品的加工、物化特性、糊化温度等有着直接的影响。
支链淀粉和碘形成红紫色络合物,利用乙醇分开样品中的可溶性糖和淀粉,再用碘与其反应得到支链淀粉含量试验中所需的仪器和试剂:可见分光光度计/酶标仪、天平、台式离心机、微量玻璃比色皿/96孔板、可调式移液枪、研钵/匀浆器、乙醚、无水乙醇、EP管。
产品内容:试剂一:液体110mL×1瓶,4℃保存;试剂二:乙醚100mL×1瓶,自备;试剂三:液体55mL×1瓶,4℃保存;O=9mL:91mL混匀,现用现配,4℃保存半年。
试剂四:将试剂三:H2试剂五:液体2mL×1瓶,4℃保存;粉剂一:粉剂×1瓶,4℃保存;粉剂二:粉剂×1瓶,4℃保存;试剂六的配制:将粉剂一倒入粉剂二,用蒸馏水定容至10mL,4℃避光保存一个月。
标准品:10mg支链淀粉×1支,4℃避光保存。
临用前加入0.1mL无水乙醇和0.9mL试剂三,混匀后封口膜封口,沸水浴至溶解,即10mg/mL的支链淀粉。
吸取0.1mL加入0.9mL蒸馏水配制为1mg/mL的标准溶液待用。
操作步骤:一、支链淀粉的提取:称取0.005g烘干样本(建议称取约0.01g)于研钵中研碎,加入1mL试剂一,充分匀浆后转移到EP 管中,80℃水浴提取30min,3000g,25℃离心5min,弃上清,留沉淀,加入1mL试剂二(乙醚)振荡5min,3000g,25℃离心5min,弃上清,留沉淀,加入5mL试剂四充分溶解,90℃水浴10min,冷却后3000g,25℃离心5min,取上清待测。
二、测定步骤:1、分光光度计/酶标仪预热30min以上,调节双波长至530nm和755nm,蒸馏水调零。
植物淀粉酶(Amylase)ELISA试剂盒说明书

本试剂盒只能用于科学研究,不得用于医学诊断植物(Plant)淀粉酶(Amylase)ELISA检测试剂盒使用说明书检测原理试剂盒采用双抗体一步夹心法酶联免疫吸附试验(ELISA)。
往预先包被淀粉酶(Amylase)抗体的包被微孔中,依次加入标本、标准品、HRP标记的检测抗体,经过温育并彻底洗涤。
用底物TMB显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的淀粉酶(Amylase)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),计算样品活性。
样品收集、处理及保存方法1.样本不能含叠氮钠(NaN3),因为叠氮钠(NaN3)是辣根过氧化物酶(HRP)的抑制剂。
2.标本采集后尽早进行提取,提取按相关文献进行。
3.植物萃取液或其它相关样本:请1000x g离心20分钟,取上清即可检测。
4.保存:如果样本收集后不及时检测,请按一次用量分装,冻存于-20℃,避免反复冻融,在室温下解冻并确保样品均匀地充分解冻。
自备物品1.酶标仪(450nm)2.高精度加样器及枪头:0.5-10uL、2-20uL、20-200uL、200-1000uL3.37℃恒温箱操作注意事项1.试剂盒保存在2-8℃,使用前室温平衡20分钟。
从冰箱取出的浓缩洗涤液会有结晶,这属于正常现象,水浴加热使结晶完全溶解后再使用。
2.实验中不用的板条应立即放回自封袋中,密封(低温干燥)保存。
3.浓度为0的S0号标准品即可视为阴性对照或者空白;按照说明书操作时样本已经稀释5倍,最终结果乘以5才是样本实际浓度。
4.严格按照说明书中标明的时间、加液量及顺序进行温育操作。
5.所有液体组分使用前充分摇匀。
试剂盒组成名称96孔配置48孔配置备注微孔酶标板12孔×8条12孔×4条无标准品0.3mL*6管0.3mL*6管无样本稀释液6mL3mL无检测抗体-HRP10mL5mL无20×洗涤缓冲液25mL15mL按说明书进行稀释底物A6mL3mL无底物B6mL3mL无终止液6mL3mL无封板膜2张2张无说明书1份1份无自封袋1个1个无注:标准品(S0-S5)浓度依次为:0、250、500、1000、2000、4000U/L试剂的准备20×洗涤缓冲液的稀释:蒸馏水按1:20稀释,即1份的20×洗涤缓冲液加19份的蒸馏水。
分光光度计 总淀粉测定方法

分光光度计总淀粉测定方法分光光度计是一种用于测定物质浓度或物质的吸收、发射、透射等光学特性的仪器。
在化学分析中,分光光度计广泛应用于各种测定方法中,包括总淀粉的测定。
总淀粉是指在植物中所含的淀粉总量,通过使用分光光度计进行总淀粉测定,可以帮助我们了解样品中淀粉的含量,对于农业、食品加工等领域具有重要的意义。
本文将介绍分光光度计在总淀粉测定方法中的应用及相关步骤。
一、仪器和试剂准备1. 分光光度计:确保分光光度计处于正常工作状态,光源和检测器都处于正常工作范围内。
2. 样品制备:将待测样品进行适当的加工和制备,确保含有足够的淀粉供测定。
3. 乙醇:用于提取淀粉的试剂,浓度为80%左右。
二、样品制备1. 取适量的样品(例如植物组织)进行粉碎和加工,以便提取其中的淀粉。
2. 将粉碎后的样品置于乙醇中进行浸泡,溶解其中的淀粉成分。
3. 使用离心机等设备加速样品中淀粉的沉淀,获得淀粉样品。
三、操作步骤1. 使用分光光度计进行基准校准:将纯水设置为基准,调整光度计使其读数为零。
2. 将提取得到的淀粉样品溶液放入分光光度计样品池中,测定其吸光度。
3. 进行标准曲线的制备:分别取不同浓度的标准淀粉溶液进行测定,绘制吸光度与浓度的标准曲线。
4. 通过标准曲线计算样品中淀粉的浓度:根据样品的吸光度值,结合标准曲线,计算出样品中淀粉的浓度。
四、结果分析1. 将测得的样品淀粉浓度与实际情况进行比对,得出样品中淀粉的含量。
2. 根据测定结果,可以对不同样品进行比较,了解它们之间淀粉含量的差异,为相关领域的研究提供数据支持。
分光光度计在总淀粉测定方法中起着重要作用,通过准确测定样品中淀粉的含量,帮助我们了解样品的化学组成和特性。
在农业、食品科学、生物化学等领域的研究和生产中,分光光度计总淀粉测定方法具有广泛的应用前景。
实验25植物组织中淀粉含量的测定要点

实验25植物组织中淀粉含量的测定要点实验25:植物组织中淀粉含量的测定引言:淀粉作为植物体内的主要贮存物,在植物的生长与发育过程中起着重要作用。
因此,准确测定植物组织中的淀粉含量对于研究植物生理生化过程以及植物的生长状况具有重要意义。
本实验旨在探究测定植物组织中淀粉含量的方法与要点。
材料与试剂:1.植物样品:可选取含有丰富淀粉的植物部位,如种子、根茎或块茎等。
2.无水乙醇3.碘酒溶液4.95%乙醇5.硫酸(浓度为0.1N)6.氢氧化钠固体7.0.1%淀粉溶液8.0.1N硝酸仪器与设备:1.电子天平2.研钵与研杵3.离心机4.蒸发皿5.煮沸水浴6.pH计7.高速离心机8.分光光度计方法:1. 提取淀粉:将植物样品称取一定量,用去离子水冲洗去表面污染物。
然后将样品放入研钵中,加入少量无水乙醇,使用研杵将样品研磨至状况良好的浆状物。
将浆状物转移到离心管中,并以4000 rpm的速度离心5分钟,使淀粉沉淀于离心管底部。
2.淀粉沉淀的处理:将上述离心管中的上清液弃去,并加入适量的去离子水进行洗涤。
重复上述步骤3次,以去除残余的杂质。
接着,将离心管中的淀粉沉淀置于蒸发皿中,在煮沸水浴中加热蒸发至干燥,得到干燥的淀粉样品。
3.碘酒着色:将干燥的淀粉样品加入适量的碘酒溶液中,使其完全浸润。
待样品中的淀粉颜色变为蓝色后,与一个含有相同浓度淀粉溶液的空白对照样品一同测定吸光度。
使用分光光度计在650纳米波长进行测定。
4.构建标准曲线:通过制备一系列浓度已知的淀粉标准溶液,使用相同的方法测定其吸光度。
根据测得的吸光度值,绘制淀粉浓度与吸光度之间的标准曲线。
5.淀粉含量的计算:根据样品的吸光度值,在标准曲线上找出相应的淀粉含量。
将其与样品的重量或体积比例进行换算,得到植物组织中的淀粉含量。
注意事项:1.实验过程中,所有试剂和设备应保持洁净,以避免污染导致实验结果的误差。
2.在将样品置于离心机前,应确保样品密封良好,以避免样品的溢出和污染。
直链淀粉含量检测试剂盒说明书 可见分光光度法

直链淀粉含量检测试剂盒说明书可见分光光度法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
货号:BC4260规格:50T/48S产品简介:直链淀粉是D-葡萄糖基以α-(1,4)糖苷键链接的多糖链,直链淀粉含量影响着食品的食用品质和外观品质,与食品安全息息相关。
直链淀粉和碘形成蓝色络合物,利用乙醇分开样品中的可溶性糖和淀粉,再用碘与其反应得到直链淀粉含量。
试验中所需的仪器和试剂:可见分光光度计、天平、台式离心机、1mL玻璃比色皿、可调式移液枪、研钵/匀浆器、乙醚、无水乙醇、EP管。
产品内容:试剂一:液体60mL×1瓶,4℃保存;试剂二:乙醚50mLmL×1瓶,自备;试剂三:液体30mL×1瓶,4℃保存;O=9mL:91mL混匀,现用现配,4℃保存半年。
试剂四:将试剂三:H2试剂五:液体1.5mL×1支,4℃保存;粉剂一:粉剂×1瓶,4℃保存;粉剂二:粉剂×1瓶,4℃保存;试剂六的配制:将粉剂一倒入粉剂二,用蒸馏水定容至10mL,4℃避光保存一个月。
标准品:10mg直链淀粉×1支,4℃避光保存。
临用前加入0.1mL无水乙醇和0.9mL试剂三,混匀后封口膜封口,沸水浴至溶解,即10mg/mL的直链淀粉。
吸取0.1mL加入0.9mL蒸馏水配制为1mg/mL的标准溶液待用。
操作步骤:一、直链淀粉的提取:称取0.005g烘干样本于研钵中研碎,加入1mL试剂一,充分匀浆后转移到EP管中,80℃水浴提取30min,3000g,25℃离心5min,弃上清,留沉淀,加入1mL试剂二(乙醚)振荡5min,3000g,25℃离心5min,弃上清,留沉淀,加入5mL试剂四充分溶解,90℃水浴10min,冷却后3000g,25℃离心5min,取上清待测。
二、测定步骤:1、分光光度计预热30min以上,调节双波长至550nm和485nm,蒸馏水调零。
可溶性淀粉合成酶(SSS)活性检测试剂盒说明书 紫外分光光度法

可溶性淀粉合成酶(SSS)活性检测试剂盒说明书紫外分光光度法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
货号:BC1850规格:50T/48S产品内容:提取液:液体50mL×1瓶,4℃保存。
试剂一:液体40mL×1瓶,4℃保存。
试剂二:粉剂×2瓶,4℃保存。
试剂三:粉剂×2瓶,-20℃保存。
试剂四:粉剂×2瓶,-20℃保存;临用前每支加入5mL试剂一。
试剂五:粉剂×2瓶,-20℃保存;临用前每支加入8mL试剂一。
试剂六:粉剂×2支,-20℃保存;临用前每支加入416μL双蒸水,充分溶解备用,用不完的试剂4℃保存。
试剂七:液体250μL×3支,-20℃保存,可分装后-20℃保存,不可反复冻融。
试剂八:液体12.5μL×2瓶,4℃保存;每支临用前加入溶解好的4mL试剂四。
反应液Ⅰ的配制:临用前在试剂二中加入7mL试剂一,缓慢加热,逐渐升温使其溶解,冷却后加入试剂三混合溶解。
这样可以分两批配制并且测定。
产品说明:SSS(EC 2.4.1.21)通常以游离态存在于质体基质中,催化淀粉链延长,主要负责支链淀粉的合成。
SSS催化ADPG与淀粉引物(葡聚糖)反应,将葡萄糖分子转移到淀粉引物上,同时生成ADP,在反应体系中添加的丙酮酸激酶、己糖激酶和6-磷酸葡萄糖脱氢酶依次催化NADP+还原为NADPH,NADPH生成量与前一步反应中ADP生成量呈正比,340nm下测定NADPH增加量即可计算SSS活性。
需自备的的仪器和用品:紫外分光光度计、水浴锅、台式离心机、可调式移液器、1mL石英比色皿、研钵、冰和蒸馏水。
操作步骤:一、粗酶液制备称取约0.1g组织加入1mL提取液,冰浴中匀浆。
10000g,4℃离心10分钟,取上清,置冰上待测。
二、测定步骤1、紫外分光光度计预热30min以上,调节波长至340nm,蒸馏水调零。
植物组织中淀粉含量的测定

植物组织中淀粉含量的测定一、原理淀粉是由葡萄糖残基构成的多糖,在酸性条件下加热使其水解成葡萄糖,然后在浓硫酸的作用下,使单糖脱水生成糠醛类化合物,利用蒽酮试剂与糠醛化合物的显色反应,即可进行比色测定。
二、实验材料、试剂与仪器设备(一)实验材料任何植物材料。
(二)试剂浓硫酸(比重1.84)。
9.2mol/lhclo4。
2%蒽酮试剂,同实验24。
(三)仪器设备电子天平,容量瓶。
100ml4个、50ml2个,漏斗,小试管若干支,电炉,刻度吸管0.5ml1支、2.0ml3支、5ml4支,分光光度计,记号笔。
三、实验步骤1.标准曲线制作取小试管11支从0~10编号,按表24-3加入溶液与蒸馏水。
下列步骤按苯酚法或者蒽酮法均可,见方法一或者方法二,绘制相应的标准曲线。
表24-3各试管加入标准液与蒸馏水量管号01~23~45~67~89~10淀粉标准液(ml)00.40.81.21.62.0蒸馏水(ml)2.01.61.20.80.40淀粉含量(mg)040801201602002.样品提取称取50~100mg粉碎过100目筛的烘干样品,置于15ml刻度试管中,加入6~7ml80%乙醇,在80℃水浴中提取30min,取出离心(3000rpm)5min,收集上清液。
重复提取两次(各10min)同样离心,收集三次上清液合并于烧杯,置于85℃恒温水浴,使乙醇蒸发至2~3ml,转移至50ml容量瓶,以蒸馏水定容,供可溶性糖的测定。
向沉淀中加蒸馏水3ml,搅拌均匀,放入沸水浴中糊化15min。
冷却后,加入2ml冷的9.2mol/l高氯酸,不时搅拌,提取15min 后加蒸馏水至10ml,混匀,离心10min,上清液倾入50ml容量瓶。
再向沉淀中加入2ml4.6mol/l高氯酸,搅拌提取15min后加水至10ml,混匀后离心10min,收集上清于容量瓶。
然后用水洗沉淀1~2次,离心,合并离心液于50ml容量瓶用蒸馏水定容供测淀粉用。
植物可溶性糖含量检测试剂盒使用说明(可见分光光度法)

植物可溶性糖含量检测试剂盒使用说明可见分光光度法货号:BC0030规格:50T/48S产品内容:试剂一:粉剂×2瓶,4℃避光保存;试剂二:10ml×1瓶,4℃保存;标准品:粉剂×1支,4℃保存,含10mg无水葡萄糖(干燥失重<0.2%),临用前加入1ml蒸馏水溶解,配制成10mg/ml葡萄糖溶液备用,4℃可保存1周,或者用饱和苯甲酸溶液溶解,可保存更长时间。
标准品准备:将标准品用蒸馏水稀释至0.3、0.2、0.1、0.05、0.025、0.0125、0mg/ml。
产品说明:糖类物质是构成植物体的重要组成成分之一,也是新陈代谢的主要原料和贮存物质。
总糖是指样品中的还原单糖及在本法测定条件下能水解成还原单糖的蔗糖、麦芽糖和可部分水解为葡萄糖的淀粉。
检测原理为蒽酮比色法。
可用于可溶性单糖、寡糖和多糖的含量测定,具有灵敏度高﹑简便快捷﹑适用于微量样品的测定等优点。
试验中所需的仪器和试剂:可见分光光度计、水浴锅、可调式移液器、1ml玻璃比色皿、浓硫酸、研钵和蒸馏水。
操作步骤:一、样品中可溶性糖的提取:称取约0.1~0.2g样本,加入1ml蒸馏水研磨成匀浆,倒入有盖离心管中,沸水浴10min(盖紧,以防止水分散失),冷却后,8000g,常温离心10min,取上清液于10ml试管中,用蒸馏水定容至10ml,摇匀备用。
二、测定操作表:1.分光光度计预热30min以上,调节波长至620nm,蒸馏水调零。
2.调节水浴锅至95℃。
3.工作液的配制:在试剂一中加入5ml试剂二,充分溶解后使用,如较难溶解,可加热搅拌。
4.加样表(在EP管中反应):试剂(μl)空白管测定管标准管样本200标准液200蒸馏水400200200工作液100100100浓硫酸100010001000混匀,置95℃水浴中10min(盖紧,以防止水分散失),冷却至室温后,于620nm处,分别读取空白管和测定管吸光值,ΔA=A测定管-A空白管。
淀粉总量检测试剂盒

Megazyme淀粉总量检测试剂盒产品编号:K-TSTA(100次)(淀粉葡糖苷酶/α-淀粉酶方法)AOAC法996.11 /AACC法76.13改进版1.简介淀粉测定方法分为酸水解法和酶分析法。
酸水解只能应用于纯淀粉样品。
酶分析方法在前处理步骤,淀粉凝胶化、液化和糊化,糊精水解成葡萄糖、葡萄糖测定步骤等方面存在不同。
AACC 76-11法采用淀粉在高压蒸汽灭菌锅中及含水的条件下凝胶化,并用淀粉葡糖苷酶将淀粉转化为葡萄糖,再测定葡萄糖含量。
采用AACC 76-11法会导致许多样品和材料中(包括高直链淀粉玉米淀粉和谷物制品)淀粉含量检测结果偏低。
目前,许多方法采用在淀粉凝胶化结束后立即加入耐热α-淀粉酶处理。
对于难以凝胶化的样品如高直链淀粉玉米淀粉,用氢氧化钠或DMSO处理。
在膳食纤维的测定方法中为确保淀粉完全溶解,Englyst和Cumming(1988)加入了淀粉脱支化酶,普鲁兰酶。
为了满足极端样品中总淀粉含量定量测定的需要,Megazyme公司研发出一种使用耐热α-淀粉酶和淀粉葡糖苷酶的淀粉总量检测试剂盒。
该方法已被AOAC和AACC采用。
近来,我们将检测方法进行了改进,使耐热α-淀粉酶和淀粉葡糖苷酶可以在相同的pH(pH 5.0)下进行孵育,这样简化了测定步骤,并将麦芽酮糖生成的可能性降到最低。
Megazyme淀粉总量试剂盒可测定大部分食品、饲料、植物和谷物制品(天然或加工过的)。
对于大部分样品(如小麦粉),样品中的淀粉在孵育中(大约100℃,并加入耐热α-淀粉酶)会完全溶解。
含有大量抗性淀粉的样品(如高直链玉米淀粉),需用2M KOH或热DMSO进行预溶解。
含有可溶性淀粉或麦芽糊精的样品,不需要用耐热α-淀粉酶处理。
2.产品性能●特异性:可用于测定α-葡聚糖(包括淀粉、糖原、植物糖原和非抗性麦芽糊精)。
●灵敏度:最小吸光度差异为0.10吸光度单位。
这相当于当样品体积为1.00 mL时,D-葡萄糖的浓度为1.0mg/L或淀粉浓度为0.9 mg/L。
植物淀粉含量试剂盒说明书

植物淀粉含量试剂盒说明书植物淀粉含量试剂盒说明书微量法100管/96样注意:正式测定前务必取23个预期差异较大的样本做预测定测定意义:淀粉是植物中糖的主要储存形式,其含量测定对于评价食品营养价值和调查植物体内糖代谢都有重要意义。
测定原理:利用80%乙醇可以把样品中可溶性糖与淀粉分开,进一步采用酸水解法分解淀粉为葡萄糖,采用蒽酮比色法测定葡萄糖含量,即可计算淀粉含量。
需自备的仪器和用品:可见分光光度计/酶标仪、水浴锅、可调式移液器、微量石英比色皿/96孔板、研钵、冰、浓硫酸(不允许快递)和蒸馏水。
试剂的组成和配制:试剂一:液体100mL×1瓶,4℃保存;试剂二:液体105mL×1瓶,4℃保存;试剂三:粉剂×1瓶,4℃保存;淀粉提取:1、称取0.1~0.2g新鲜样本(建议称取约0.1g新鲜样本)于研钵中研碎,加入1mL试剂一,充分匀浆后转移到EP管中,80℃水浴提取30min,3000g,25℃离心5min,弃上清,留沉淀。
2、沉淀中加入0.5mL蒸馏水,放入95℃水浴中糊化15min (盖紧,以防止水分散失)。
3、冷却后,加入0.35mL试剂二,25℃常温提取15min,振荡35次。
4、加入0.85mL蒸馏水,混匀,3000g,25℃离心10min,取上清液待测。
注意:如样本为淀粉含量较高的干样,为保证充分提取,可适当减小取样量,如称取0.01g~0.02g干样,加入1mL试剂一,其余提取步骤同上。
测定步骤:1、分光光度计或酶标仪预热30min以上,调节波长至620nm,蒸馏水调零。
2、调节水浴锅至95度。
3、工作液的配制:临用前在试剂三中加入 3.75mL蒸馏水后,缓慢加入21.25mL浓硫酸,不断搅拌,充分溶解,待用;用不完的试剂4℃保存一周;4、样本测定:取50μL样本和250μL工作液至EP管中,95度水浴10 min(盖紧,防止水分散失),自然冷却至室温,取200uL至微量石英比色皿或96孔板中,在620 nm 波长下记录测定吸光度值A。
植物可溶性糖含量试剂盒(可见分光光度法)使用说明

植物可溶性糖含量试剂盒(可见分光光度法)使用说明货号:SH103规格:50管/48样产品简介:糖类物质是构成植物体的重要组成成分之一,也是新陈代谢的主要原料和贮存物质。
总糖是指样品中的还原单糖及在本法测定条件下能水解成还原单糖的蔗糖、麦芽糖和可部分水解为葡萄糖的淀粉。
检测原理为蒽酮比色法。
可用于可溶性单糖、寡糖和多糖的含量测定,具有灵敏度高﹑简便快捷﹑适用于微量样品的测定等优点。
试验中所需的仪器和试剂:可见分光光度计、沸水浴、可调式移液器、1mL玻璃比色皿、浓硫酸、研钵和蒸馏水。
产品内容:试剂一:粉剂×2瓶,4℃避光保存;试剂二:10mL×1瓶,4℃保存;工作液的配制:临用前在每瓶试剂一中加入2.5mL试剂二。
充分溶解后使用,如较难溶解,可加热搅拌。
操作步骤:一、样品中可溶性糖的提取:称取约0.05g样本,加入0.5mL蒸馏水研磨成匀浆,倒入有盖离心管中,沸水浴10分钟(盖紧,以防止水分散失),冷却后,8000g,常温离心10min,取上清液于10ml试管中,用蒸馏水定容至10ml,摇匀备用。
二、测定操作表:试剂(µL)空白管测定管样本200蒸馏水400200工作液100100浓硫酸10001000混匀,置沸水浴中10min(盖紧,以防止水分散失),冷却至室温后,用空白管调零,在620nm波长下读取吸光值。
注意:由于浓硫酸具有强腐蚀性,请谨慎操作。
可溶性糖含量计算:1、标准条件下测定的回归方程为y=1640x-0.07;x为标准品浓度(mg/mL),y为吸光值。
2、可溶性糖(µg/g鲜重)=(A测定管+0.07)÷8.55÷样本鲜重(g/mL)。
3、可溶性糖(µg/mg蛋白)=(A测定管+0.07)÷8.55÷蛋白浓度(mg/mL)。
植物总酚(TP)含量检测试剂盒说明书__可见分光光度法UPLC-MS-4293

植物总酚(TP)含量检测试剂盒说明书可见分光光度法货号:UPLC-MS-4293规格:50T/24S产品组成:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系工作人员。
试剂名称规格保存条件提取液液体60mL×1瓶(自备)常温保存试剂一液体20mL×1瓶2-8℃保存试剂二液体25mL×1瓶2-8℃保存标准品粉剂×1支2-8℃保存溶液的配制:1、提取液:自备60%乙醇,常温保存。
2、标准品:5mg没食子酸。
临用前加入1mL蒸馏水,50℃加热溶解,配制成5mg/mL的标准溶液,2-8℃保存两周。
产品说明:植物酚类物质具有清除自由基,抗氧化抗衰老的作用,具有较高的营养价值和医疗保健作用而广泛应用于化妆品、食品、医药等领域。
在碱性条件下,酚类物质将钨钼酸还原,产生蓝色化合物,在760nm处有特征吸收峰,测760nm处的吸光值,即可得样本总酚含量。
Total Polyphenols+Folin-Ciocalteu OH-Blue Compound(760nm)技术指标:最低检出限:0.0012mg/mL线性范围:0.0024-0.156mg/mL注意:实验之前建议选择2-3个预期差异大的样本做预实验。
如果样本吸光值不在测量范围内建议稀释或者增加样本量进行检测。
需自备的仪器和用品:可见分光光度计、1mL玻璃比色皿、天平、烘箱、粉碎仪/研钵、30-50目筛、超声清洗仪、60%乙醇、台式离心机、蒸馏水。
操作步骤:一、样本处理(可适当调整待测样本量,具体比例可以参考文献)将样本烘干至恒重,粉碎,过30-50目筛之后,称取约0.1g,加入2.5mL提取液,用超声提取法进行提取,超声功率300W,温度60℃,提取30min。
12000rpm,25℃,离心10min,取上清,用提取液定容至2.5mL,待测。
二、测定步骤1.分光光度计预热30min以上,调节波长至760nm,蒸馏水调零。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
植物淀粉含量试剂盒(分光光度法)使用说明
货号:BC0700
规格:50管/48样
产品内容:
试剂一:液体50mL×1瓶,4℃保存;
试剂二:液体20mL×1瓶,4℃保存;
试剂三:粉剂×1瓶,4℃保存。
产品说明:
淀粉是植物中糖的主要储存形式,其含量测定对于评价食品营养价值和调查植物体内糖代谢都有重要意义。
利用80%乙醇可以把样品中可溶性糖与淀粉分开,进一步采用酸水解法分解淀粉为葡萄糖,采用蒽酮比色法测定葡萄糖含量,即可计算淀粉含量。
需自备仪器和试剂:
可见分光光度计、水浴锅、可调式移液器、玻璃比色皿、研钵、冰、浓硫酸和蒸馏水。
操作步骤:
一、淀粉提取:
1、称取0.1g-0.2g样品(建议称取约0.1g样本)于研钵中研碎,加入1mL试剂
一,充分匀浆后转移到EP管中,80℃水浴提取30min,3000g,常温离心5min,弃
上清,留沉淀。
2、沉淀中加入0.5mL蒸馏水,放入沸水浴中糊化15min(盖紧,以防止水分散失)。
3、冷却后,加入0.35mL试剂二,常温提取15min,振荡3-5次。
4、加入0.85mL双蒸水,混匀,3000g,常温离心10min,取上清液待测。
二、测定操作:
1.分管光度计预热30min以上,调节波长至620nm,蒸馏水调零。
2.调节水浴锅至95度。
3.工作液的配制:临用前在试剂三中加入7.5mL蒸馏水后,缓慢加入42.5mL浓
硫酸,不断搅拌,充分溶解,待用。
用不完的试剂4℃保存一周。
4.样本测定:取0.2mL样本和1mL工作液至EP管中,95度水浴10min(盖紧,
放置水分散失),自然冷却至室温,在620nm波长下记录测定吸光值A。
淀粉含量计算:
标准条件下测定的回归方程为y=5.872x-0.0295;x为标准品浓度(g/mL),y为吸光值。
1、按照蛋白浓度计算
淀粉含量(mg/mg prot)=﹝(A+0.0295)×V1﹞÷5.872÷(V1×Cpr)=0.17×(A+0.0295)÷Cpr
2、按样本鲜重计算
淀粉含量(mg/g鲜重)=﹝(A+0.0295)×V1﹞÷(W×V1÷V2)=0.289×(A+0.0295)÷W V1:加入反应体系中样本体积,0.2mL;V2:加入提取液体积,1.7mL;Cpr:样本蛋白质浓度,mg/mL;W:样本质量,g。
注意事项:
1.由于工作液具有强腐蚀性,请谨慎操作。
2.若吸光值大于1,请将样本用提取液稀释后再测定,计算公式中乘以相应的稀
释倍数。
3.提取液的配置:0.35mL试剂二+1.35mL水。
用多少按照此比例配多少。
