脐带间充质干细胞制备操作规程
脐带间充质干细胞制备操作规程

1.制备:使用生理盐水充分洗涤脐带,并剪成小段。
去除动脉和静脉,撕取华通胶至少8ml。
充分剪碎后平分至4瓶已加25ml完全培养基的175cm2培养瓶中。
静置培养7天。
第8天根据生长情况,进行换液、传代。
2.换液:根据细胞生长情况与培养基颜色决定全量换液或半量换液。
用去头移液管吸弃半量或全量旧培养基,更换移液管,于培养瓶的非细胞培养面缓慢加入等量新培养基。
3.传代:每瓶加0.25%胰酶3ml,待细胞变圆后轻拍瓶壁,每瓶加终止液(2%FBS+a-MEM)10ml,吸出细胞悬液至2支50ml离心管中,各培养瓶每瓶加10ml 生理盐水,吹洗汇入50ml离心管中。
1200rpm,离心6min,弃上清。
合并沉淀至1管,加40ml生理盐水再次离心洗涤,沉淀用10ml完全培养基重悬,经细胞筛过滤,5ml完全培养基冲洗筛网,计数。
根据细胞数量铺瓶,使细胞浓度为1~2×104/ml,置37℃、5%CO2培养箱中培养。
4.收获:每瓶加入3ml0.25%胰酶,37℃消化1min,加入终止液10ml/瓶,收集所有液体到50ml离心管中,再每瓶加10ml生理盐水,轻柔吹打后汇入50ml离心管中。
1200转/min离心6min,弃上清,细胞沉淀用16ml生理盐水悬浮,混匀取1ml做计数和流式检测。
加生理盐水至40ml,取500μl上清做内毒素检测,1200rpm,离心6min。
弃上清,离心沉淀用2.5mlFBS悬浮,再缓慢加入2.5ml 冻存母液,混匀后分装到冻存管中,每管1ml。
冻存细胞数应控制在2~5×106/ml 范围内。
利用程序降温盒放置-80℃医用冰箱中过夜后转至液氮罐。
脐带间充质干细胞培养操作细则

脐带间充质干细胞分离培养操作细则一、样本接收1.观察运输箱的温度是否符合要求,采集瓶有无渗漏。
2.查看客户信息是否与交接表一致。
3.样本采集瓶外表面喷酒精擦拭消毒,并粘贴样本编码,填写样本接收记录,传入洁净区准备制备。
二、脐带间充质干细胞分离与接种1)准备耗材试剂:10cm培养皿、15ml离心管、50ml离心管、离心管架、10ml 移液管、T75培养瓶、离心管架、无尘布、50ml注射器针头、封口膜、灭菌止血钳、灭菌镊子、灭菌剪刀、废液缸、无血清干细胞培养基(常温复温)、生理盐水、75%酒精(已过滤)。
2)仪器设备准备及预热:电动移液枪、生物安全柜、离心机3)将75%酒精喷到台面,用无尘布擦拭台面,包括侧面及玻璃。
4)将生物安全柜开紫外30min通风10min,样本喷酒精擦拭,放入生物安全柜中,电动移液枪、移液管、离心管、离心管架喷酒精擦拭放入生物安全柜中,无菌棉球放入到广口瓶中加75%酒精放入生物安全柜中。
50ml、15ml离心管放到离心管架上,10cm皿5-7个。
将装有灭菌器械的灭菌盒喷酒精擦拭放入生物安全柜中。
5)取5个10cm皿依次摆开,1,2,4,5号皿依次加入适量的生理盐水,3号皿加入适量的已过滤的75%酒精。
拿出灭菌盒中已灭菌的止血钳,将脐带从保存瓶中取出放到第一个皿里,并取适量样本保存液留样送检支原体。
使用两个止血钳将脐带在第一个皿里清洗尽量去除脐带外表面的血污以及动静脉的血液和血凝块,将脐带转移至2号皿中,同样的方法再次清洗一次并测量其长度。
6)将清洗干净的脐带转移到装有已过滤75%酒精的3号皿中浸泡1min左右(不要超过两分钟),计时结束后,将脐带转移至4号皿中,同样的洗涤方法去除酒精。
清洗结束后将脐带剪成1-2cm短节,放入5号皿中,再次洗涤尽量去除血管内的血污。
再次拿两个10cm皿,加入适量的生理盐水,去一皿的盖子加少许盐水湿润底部及可。
7)将1-2cm的脐带小段转移到新的皿里,用带齿口的镊子取一段脐带,将脐带展开,再按血管走势剔除脐带的两条动脉,一条静脉。
脐血间充质干细胞的培养

脐血间充质干细胞的培养
一、试剂:
胰酶、DMEM/F12培养基、胎牛血清、冻存管及二甲基亚砜(DMSO)、淋巴细胞分离液( 比重1.077g/cm3 ) 。
二、人脐血MSCs 分离和培养
1、无菌条件下采集脐带血,每份40~100 ml,肝素抗凝(20 U/ ml),所有标本要求在6 h 内分离接种。
2、将人脐血沿离心管壁缓慢加到淋巴细胞分离液(比重1. 077 g/ cm3 )上,2000 r/min 离心20 min (离心半径15 cm),取中间白膜层,PBS 洗涤2 次。
3、取洗涤后细胞1×107个接种于含30 % FBS 的DMEM/F12培养基中,置37 ℃、5 %CO2培养箱中培养,7d 后全量换液,去除未贴壁细胞,以后每隔2d 全量换液1次。
4、当MSCs 达到80 %融合时,1 ∶2 常规消化传代。
三、人脐血MSCs 的冻存和复苏
1、冻存
取第3 代1 ×106个MSCs 加入1 ml 含10 % DMSO 和90 %FBS 的冻存液,吹打均匀后移入冻存管,采用非程序性降温液氮冻存法进行细胞冻存,冻存管依次置于4 ℃冰箱20 min,- 20 ℃冰箱30 min 和- 80 ℃冰箱过夜,第2 d 移入- 196 ℃液氮中冻存。
2、冻存4周后复苏细胞,即从液氮中取出冻存管立即置于37 ℃水浴并轻轻摇动,1 min 内迅速解冻;冻融后的MSCs 加入含30 % FBS 的DMEM/F12 培养基洗涤2次,然后接种到含30 % FBS 的DMEM/F12 培养基中,置37 ℃、5 % CO2培养箱中培养,第2 d 全量换液。
脐带间充质干细胞原代分离

脐带间充质干细胞原代分离
Protocol
1.获得脐带组织
2.将脐带组织用含有双倍双抗的PBS漂洗,把血块洗净。
3.将脐带组织剪成3-5cm小段。
4.横向夹住脐带组织,明显可见2条脐动脉和1条脐静脉。
5.纵向剖开脐带,露出血管,将血管从周围组织分离出来。
6.将脐带组织漂洗干净,用眼科剪将组织剪碎。
7.加1mg/ml的胶原酶I,没过组织块即可,37℃摇床消化1h小时左右,看见基本没大
的组织块。
8.加成纤维细胞培养液终止,并加入DNAase,过40um细胞筛。
9.离心,1500rpm,15min
10.弃上清,根据获得的细胞量接种细胞即可,一般一根脐带可接种1个10cm皿。
11.4天左右可以传代。
12.注意事项
1、注意原材料的新鲜与保鲜。
一般取来的材料都是当天来做,而且取材时最好是放在
含有双抗的PBS里,用冰盒运输。
2、取材时要保持严格的无菌操作
3、将组织漂洗干净,不要残留血块和毛发。
4、取材时要选用锋利的手术器械,防止损伤组织。
5、消化时间要掌握好,控制在大的组织块刚刚完全消化完。
6、要标记好细胞的品系,周龄,雌雄等信息。
7、注意要用胶原酶I,而且消化时要加入DNA酶,防止粘稠。
实验所需试剂。
脐带MSCs培养操作规程

脐带MSCs培养操作规程
1 无菌收集脐带,浸没于含1%双抗(青链霉素)的PBS中,玻璃容器密封送回实验室;
2 超净台上剪取约2cm长的脐带,剖开动静脉,用PBS洗净血污;
3 将脐带剪碎成肉糜状,转移到离心管中,可按以下两种方法分离脐带间充质干细胞:①加入4ml的消化液(含0.25%胰酶,200~400U 胶原酶Ⅱ/ml的PBS液),混匀,37℃中消化1小时,每隔10分钟振摇一次;②加入4ml消化液(200~400U胶原酶Ⅱ/ml的PBS液),混匀,37℃中消化过夜;
4 吸取消化上清,转移到25cm2细胞培养瓶中,加入DMEM/F12培养基(含10~15%胎牛血清),37℃、5%CO2孵箱培养;
5 约三天左右能在显微镜下观察到贴壁细胞,半量换液后继续培养,三天后换液,细胞已经能稳定生长。
每三天换液一次,至细胞生长铺满瓶底(约10天左右),即可进行传代;
6传代时去除培养基,用PBS洗涤贴壁细胞一次,加入3 ml的消化液(含0.25%胰酶的PBS液),37℃条件下作用10min左右,加入等体积含血清的培养基中止消化,吸管轻吹贴壁细胞,使其从瓶壁上脱落下来形成细胞悬液;将细胞悬液转移到15 ml离心管中,800rpm离心5min,弃上清,用适量DMEM/F12培养基重悬细胞,传代比例为1:2,接种量为5ml/瓶,置于37℃、5%CO2孵箱中培养。
7 细胞冻存时,按传代的操作步骤获得细胞沉淀,用冻存液(90%FBS +10%二甲基亚砜)重悬细胞,调整细胞浓度为1×108/ ml,将细胞悬液转移到冻存管中,1ml/管,用程控降温仪降温后转移到液氮中冻存。
间充质干细胞制备流程

间充质干细胞制备流程摘要:本文详尽阐述了间充质干细胞(MSCs)的制备流程,涵盖了从供者选择、血清学检测、活检、分离、生物样品处理、体外扩增、细胞鉴定、包装直至放行等一系列关键步骤。
间充质干细胞凭借其独特的生物学特性,在再生医学和细胞治疗领域展现了巨大的应用潜力。
文章伊始,便对间充质干细胞的基本特性及其临床应用前景进行了深入探讨,随后,对制备流程中的每个环节进行了细致的描述,包括了严格的技术要求和质量控制标准。
通过对这些流程的深入分析和详尽说明,本文意在为科研人员和临床医生提供一份科学、翔实的间充质干细胞制备指南,以期促进相关领域的研究进展和临床应用。
关键词:间充质干细胞;制备流程;再生医学;细胞治疗Abstract: This article comprehensively describes the preparation process of mesenchymal stem cells (MSCs), covering a series of key steps from donor selection, serological testing, biopsy, isolation, biosample processing, in vitro expansion, cell identification, packaging to release. Mesenchymal stem cells, with their unique biological characteristics, have shown great potential for application in the fields of regenerative medicine and cell therapy. At the beginning of the article, an in-depth discussion is conducted on the basic characteristics of mesenchymal stem cells and their clinical application prospects. Subsequently, each step in the preparation process is described in detail, including strict technical requirements and quality control standards. Through in-depth analysis and detailed explanation of these processes, this article aims to provide researchers and clinicians with a scientific and detailed guide for the preparation of mesenchymal stem cells, in the hope of promoting research progress and clinical applications in related fields.Keywords: Mesenchymal stem cells; Preparation process; Regenerative medicine; Cell therapy一、引言1.1 间充质干细胞的定义与特性间充质干细胞(Mesenchymal Stem Cells, MSCs)是一类具有独特生物学特性的多能干细胞,起源于胚胎发育的中胚层。
间充质干细胞流程

间充质干细胞流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by the editor. I hope that after you download them, they can help yousolve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, our shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts,other materials and so on, want to know different data formats and writing methods, please pay attention!间充质干细胞(MSCs)是一类具有多重潜能的成体细胞,在干细胞领域具有重要的应用前景。
一种人脐带间充质干细胞的制备方法

一种人脐带间充质干细胞的制备方法人脐带是新生儿和胎儿连接母体的管道,内部含有丰富的干细胞,包括造血干细胞、免疫干细胞和间充质干细胞等。
其中,间充质干细胞是一种可以分化成多种不同类型的细胞,具有广泛的应用前景。
本文将介绍一种人脐带间充质干细胞的制备方法。
1.制备人脐带间充质干细胞的前期准备从分娩后的脐带中收集脐血,并将脐血中的红细胞和白细胞去除。
去除白细胞的方法有多种,常用的方法是采用不同浓度的低分子量明胶,使白细胞黏附于明胶上被去除。
脐血中包含的间充质干细胞比较少,因此需要进行进一步的扩增培养。
在扩增培养前,需要将获得的间充质干细胞进行鉴定,选择细胞表面标志物为CD29、CD44、CD90、CD73等呈阳性的细胞,且表面标志物CD34、CD45等呈阴性,以确保所选取的细胞圆形度好、生长正常并且快。
2.间充质干细胞的扩增培养将选定的间充质干细胞进行扩增培养,常用的培养基为DMEM/F12配合10%胎牛血清。
在扩增过程中,需要注意控制细胞密度,避免细胞过于密集造成细胞发生选代性缺失等问题,同时需要定期更换培养基和处理细胞的碎片等细胞代谢产物。
3.间充质干细胞的纯化在细胞培养达到稳定后,可以通过多种方法对间充质干细胞进行纯化。
浓差梯度离心把细胞移至无细胞半透膜,可使用巨噬细胞捕获或磁珠法,也可以使用化学方法如葡聚糖(PHA)等选择性粘附。
(需要具体结合实验条件选择对应的纯化方法)4.稳定存储间充质干细胞将纯化后的间充质干细胞存储在液氮中,或者进行低温保存。
在液氮中保存时,需要将细胞培养基中添加10% DMSO均匀混合。
存储前需要领到细胞的质量,包括鉴定细胞表面标志物、存放条件及能否继续生长。
总之,人脐带间充质干细胞制备方法主要包括前期准备、细胞扩增培养、细胞纯化和稳定存储。
进行干细胞的制备过程需耐心、谨慎、负责,可为干细胞研究提供有利载体。
脐带间充质分离制备

脐带间充质分离制备1. 引言脐带间充质(Wharton’s Jelly)是一种存在于脐带中的富含干细胞的非骨骼组织。
脐带间充质具有多能性和自我更新能力,被广泛应用于再生医学领域。
为了利用脐带间充质的潜在价值,制备纯净的脐带间充质细胞是必要的。
本文将介绍脐带间充质分离制备的方法和步骤,包括脐带的收集、组织处理、细胞分离和培养等。
2. 方法和步骤2.1 脐带的收集脐带的收集是脐带间充质分离制备的第一步。
脐带可以从新生儿的脐带血管中获得,通常在分娩后不久进行。
收集脐带时,需要遵循相关的伦理规定,并征得相关人员的同意。
2.2 组织处理脐带收集后,需要进行组织处理以获取脐带间充质。
首先,将脐带放入含有生理盐水的离心管中,用剪刀将脐带切成小段。
然后,将脐带小段转移到含有酶解液的离心管中,进行酶解处理。
常用的酶解液包括胶原酶、DNA酶和透明质酸酶等。
酶解液的浓度和处理时间需要根据实验需求进行调整。
2.3 细胞分离经过酶解处理后,脐带组织中的细胞被释放出来。
接下来,需要进行细胞分离以获得纯净的脐带间充质细胞。
常用的细胞分离方法包括离心法和负选择法。
离心法是通过离心将不同种类的细胞分离开来。
将酶解后的细胞悬液进行离心,将上清液中的脐带间充质细胞收集下来。
离心过程中,需要根据细胞的大小和密度进行合适的离心条件的选择。
负选择法是通过特定的抗体和磁珠来分离目标细胞。
将酶解后的细胞悬液与特定的抗体和磁珠进行结合,然后用磁场将非目标细胞分离出来,从而得到脐带间充质细胞。
2.4 细胞培养脐带间充质细胞分离后,需要进行细胞培养以增殖和扩大细胞数量。
将脐带间充质细胞接种到含有适当培养基的培养皿中,然后将培养皿放入培养箱中进行培养。
常用的培养基包括DMEM/F12和α-MEM等,其中添加适量的胎牛血清和生长因子可以促进细胞的增殖和生长。
定期观察细胞的形态和生长情况,及时更换培养基,并进行细胞传代以保持细胞的活性和纯度。
3. 结论脐带间充质分离制备是获得纯净的脐带间充质细胞的关键步骤。
小鼠脐间带充质干细胞培养方法

小鼠脐间带充质干细胞培养方法引言充质干细胞(me se nc h ym al st em ce ll s,M SC s)是一类具有多向分化潜能的多能干细胞,具有广泛的应用前景。
在生物医学领域,小鼠脐间带充质干细胞是一种重要的来源之一。
本文将介绍小鼠脐间带充质干细胞的培养方法,帮助研究人员更好地利用这一珍贵的细胞资源。
原料与试剂准备1.小鼠脐带组织2.DM EM/F12培养基3.胎牛血清(F BS)4.细胞培养袋5.1×PB S缓冲液步骤1.小鼠脐带的处理(1)准备一个无菌操作台,并在工作区上喷洒酒精消毒剂,手套等工具也需要经过灭菌处理。
(2)取出小鼠脐带组织,置于无菌的1×P BS缓冲液中,用剪刀剪碎细胞片段。
(3)将小鼠脐带组织片段转移到细胞培养袋中。
(4)加入适量的DME M/F12培养基,保证组织片段被完全浸润。
(5)将细胞培养袋密封,并置于37°C恒温培养箱中,进行消化和悬浮培养,时间约为4-6小时。
2.细胞的收获和培养(1)将消化后的细胞悬液通过100μm的细胞滤网过滤,去除大颗粒残渣。
(2)将滤液离心,去除上清液,沉淀的细胞用DM EM/F12培养基洗涤。
(3)将洗涤后的细胞沉淀用适量的D MEM/F12培养基重新悬浮。
(4)将细胞悬液转移到细胞培养瓶中,每瓶加入适量的培养基和10%的F BS。
(5)将细胞培养瓶放置于37°C恒温培养箱中,进行培养。
(6)每2-3天更换一次培养基,保持细胞的健康生长。
3.细胞的传代与冻存(1)当细胞达到80-90%的密度时,将培养瓶内的细胞用1×P BS缓冲液洗涤。
(2)用胰酶对细胞进行消化,停止细胞的生长。
(3)加入适量的DME M/F12培养基,将细胞悬液转移到新的细胞培养瓶中。
(4)将细胞培养瓶放置于恒温培养箱中继续培养。
4.脐带间充质干细胞的鉴定(1)使用流式细胞仪对培养的小鼠脐带间充质干细胞进行免疫鉴定。
人脐带间充质干细胞操作规范

人脐带间充质干细胞操作规范一、人脐带间充质干细胞的分离和培养1. 准备4~5个培养皿,打开放在超净台中,将消毒过的平剪×1,弯剪×2,有齿镊子×4,放入超净台,紫外照射30 min,通风10 min;2. 在1#、3#和4#号培养皿倒入25 ml生理盐水,在2#培养皿倒入25 ml酒精;3. 将盛放脐带的器皿用酒精消毒外表面后放入超净台,用弯嘴钳取出脐带放入1#培养皿,清洗残留血渍,用第2把弯嘴钳配合挤出脐带血管内的积血; 4. 将脐带转移至2#培养皿,完全浸泡,计时1 min;5. 将脐带转移至3#培养皿,用平剪剪成3 cm左右的小段,清洗脐带内的积血(如果积血较多,可再次转入另一加盐水的培养皿);6. 用有齿镊子分离2根动脉和1根静脉,剥离华尔通氏胶,放入4#培养皿;7. 将剥离的胶体转移至50 ml离心管中,2000 rpm离心5 min;8. 弃上清液,将胶体倒入干净的培养皿中,用小剪刀将其剪成糊状并转移至50 ml离心管中;9. 以0.5 ml/瓶的量将胶体组织块接种至T75培养瓶,每瓶加入4 ml脐带有血清培养液(DMEM/F12 + 10% FBS + 1% L-Glutamine + 1% MEM NEAA + 10 ng/ml bFGF),水平摇晃培养瓶使组织块分布均匀;10. 第2天观察是否有污染,每3天换一次液,并观察细胞爬出情况(过程中须注意平稳地拿放培养瓶,避免组织块发生移动);11. 培养14天左右,倒去上清培养液,加生理盐水(3 ml/瓶)洗涤,用0.25%胰酶(2 ml/瓶)消化下爬出细胞及组织块,并用上清培养液(1 ml/瓶)终止消化;12. 收集细胞及组织块悬液,2000 rpm离心5 min;13. 弃上清液,加入适量生理盐水混匀,用70 μm滤网过滤去除组织块,即得到P0代脐带间充质干细胞;614. 细胞计数,按10/瓶接种,每瓶加入10 ml脐带无血清培养液(UltraCULTURE + 2% Ultroser G + 1% Glutamine + 1% MEM NAA),每3天换一次液; 15. 细胞融合率达到80%左右时,加胰酶消化,按1: 3传代。
人脐带间质干细胞分离培养方案

准备工作:
高压眼科剪、镊子等器材、大皿(可重复利用)、小皿、PBS、抗生素、营养液
1.经胎儿父母同意后取无菌新鲜脐带,尽快于6 h内用磷酸盐缓冲液
(PBS)反复冲洗以除去其表面附着的血液。
2.剔除脐带内部包裹的血管(包括2根脐动脉与1根脐静脉)后,
将剩余的脐带基质组织(含华通胶)浸泡于含100 U/ml青霉素和100 μg/ml链霉素的PBS溶液中约15 min。
3.将脐带组织剪碎为约1 mm3大小的组织块,并直接贴附于不含任
何营养液的35 mm培养皿中,放置37℃、5% CO2、饱和湿度孵箱中以增强组织块的粘附力。
4.30 min后,取出含组织块培养皿,加入含10%胎牛血清(fetal
bovine serum, FBS) 的低糖DMEM,并置于37℃、5% CO2、饱和湿度孵箱继续培养。
5.3~4天后首次换液,去除未贴壁细胞,以后每3天换液一次。
大
约培养10天左右,贴壁细胞开始从组织块中长出,待形成融合层时,剔除小皿中组织块,并用0.25%胰酶- EDTA-Na2溶液消化传代,接种于细胞培养瓶中以利于大量扩增。
待培养至第4代时,即可用于实验。
脐带间充质干细胞制备原理

脐带间充质干细胞制备原理导言随着干细胞研究的不断深入,脐带间充质干细胞作为一种重要的干细胞资源,受到了广泛关注。
本文将为大家介绍脐带间充质干细胞的制备原理,探讨其在生物医学领域的应用前景。
什么是脐带间充质干细胞脐带间充质干细胞(Wharton’s jelly-derived mesenchymal stem cells,WJ-MSCs)是一种存在于脐带Wharton’s jelly(韧带)中的间充质干细胞。
它们具有多能性,可以分化为多种细胞类型,如成骨细胞、软骨细胞和脂肪细胞等。
脐带间充质干细胞的制备过程脐带间充质干细胞的制备过程主要包括以下几个步骤:步骤一:脐带收集和处理1.选择健康的孕妇,并取得其同意,对脐带进行收集。
2.清洗脐带,去除表面的血液和细胞残留物。
3.将脐带剪成适当的大小,并用理化方法处理,以消除可能的微生物感染。
步骤二:组织析出1.将处理后的脐带放入离心管中。
2.使用适当的消化酶(如胶原酶)进行组织的分解,使细胞从基质中解离出来。
3.离心管离心,获得细胞和基质的沉淀。
步骤三:细胞培养1.用培养基悬浮细胞沉淀,并接种到培养器皿中。
2.提供适当的培养环境,如培养基、温度和湿度,以促进细胞的生长和增殖。
3.定期检查和观察细胞的形态和倍增情况。
步骤四:细胞鉴定和扩增1.使用细胞表面标记物的抗体进行免疫细胞化学染色,以确定细胞的纯度和特异性。
2.使用流式细胞术等技术,对细胞进行进一步的鉴定和排序。
3.如果需要,进行细胞扩增,以获取足够数量的干细胞用于后续的实验和应用。
脐带间充质干细胞的应用前景脐带间充质干细胞具有以下几个优点,使其在生物医学领域有着广阔的应用前景:优点一:丰富的源头脐带是产妇和胎儿之间的纽带,获得脐带间充质干细胞不需要借助捐赠,因此更加容易获取,资源丰富。
优点二:低免疫原性脐带间充质干细胞表面的HLA-ABC 分子表达较低,导致其具有较低的免疫原性,在移植过程中不易被宿主免疫系统识别和攻击。
脐带间充质干细胞制备工艺流程图
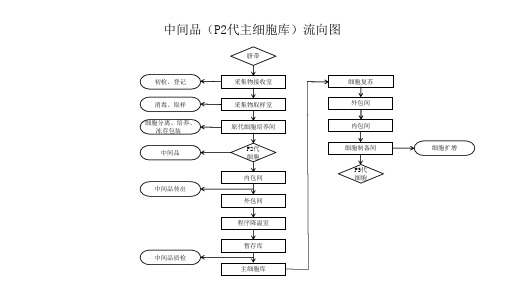
脐带
初检、登记 消毒、取样 细胞分离、培养、 冻存包装
中间品
中间品传出
中间品质检
采集物接收室 采集物取样室 原代细胞培养间
P2代 细胞 内包间 外包间 程序降温室 暂存库 主细胞库
细胞复苏 外包间
内包间
细胞制备间 P5代 细胞
细胞扩增
原材料(P5代工作细胞库)流向图
半成品传入
无菌衣传入
废弃物打包 化学消毒 分时段转运 分时段转运
废弃物流向图
制备间 消毒间 危废暂存间 危废暂存仓库 处置单位转运
放行检测 成品传出
P5代 细胞 细胞复苏 外包间
内包间
细胞制备间 终末 制剂
内包间
外包间
无 菌 衣 进
无菌衣传入
穿无菌外衣 穿洁净内衣
手消毒 穿/脱外衣
更鞋 男更入口
人员流向图
洁净走廊
缓冲间
脱
脱
洁
洁
净
净
衣衣消毒间污传出进更路线: 退更路线:
穿无菌外衣 穿洁净内衣
手消毒 穿/脱外衣
更鞋 女更入口
无 菌 衣 进
人脐带间充质干细胞成脂诱导分化培养基操作手册说明书

产品描述人脐带间充质干细胞成脂诱导分化培养基操作手册产品规格:400mL产品货号:PD-019人脐带间充质干细胞成脂诱导分化培养基专门为人脐带间充质干细胞成脂诱导分化而开 发,针对人脐带间充质干细胞的特性优化分化试剂的配方,可增加人脐带间充质干细胞的成脂 分化效果。
本产品含血清成分,仅用于科研用途,不可用于诊断、治疗、临床及其他用途。
培养基组成成分●人脐带间充质干细胞成脂诱导分化培养基 ADP1:成分名称添加体积175 mL 20 mL 2 mL 2 mL 400μL 200μL 200μL 人脐带间充质干细胞成脂诱导分化诱导基础培养基 ADP1FBS谷氨酰胺 Glutamine青链霉素 Pennicillin-Streptomycin胰岛素 InsulinIBMX罗格列酮 Rosiglitazone地塞米松A Dexamethasone 200μL●人脐带间充质干细胞成脂诱导分化培养基 ADP2(维持培养基)成分名称添加体积人脐带间充质干细胞成脂诱导分化基础培养基 ADP2175 mL FBS20 mL 谷氨酰胺 Glutamine2 mL 青链霉素 Pennicillin-Streptomycin2 mL 胰岛素 Insulin 400μL油红-O 染色液 10 m L操作流程一、人脐带间充质干细胞成脂诱导分化培养基的准备注:各成分请根据试剂管上标签标示温度保存。
地塞米松A和地塞米松B浓度不同,不能混用。
染色液1.本产品为试剂盒型,使用前需将试剂盒内各成分试剂混匀。
(请勿将 ADP1 与 ADP2混淆)2.使用前,请将血清置于4℃解冻,直至血清完全溶解;待血清完全溶解后,将所有添加物置于室温溶解。
待试剂完全溶解后,轻轻摇晃使试剂混合均匀(低于 500μL 体积的试剂无需此操作)。
注:为了保证微量试剂的使用效果,请将低于 200μL 的试剂管进行短暂离心,使试剂能全部收集至管底。
3.按上述两个成分表,将表一 ADP1 中的 FBS、青链霉素、谷氨酰胺、胰岛素、IBMX、罗格列酮、地塞米松A等试剂按体积大小先后加入到诱导基础培养基中;混合均匀后做好标识,培养基即可使用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.制备:使用生理盐水充分洗涤脐带,并剪成小段。
去除动脉和静脉,撕取华通胶至少8ml。
充分剪碎后平分至4瓶已加25ml完全培养基的175cm2培养瓶中。
静置培养7天。
第8天根据生长情况,进行换液、传代。
2.换液:根据细胞生长情况与培养基颜色决定全量换液或半量换液。
用去头移液管吸弃半量或全量旧培养基,更换移液管,于培养瓶的非细胞培养面缓慢加入等量新培养基。
3.传代:每瓶加0.25%胰酶3ml,待细胞变圆后轻拍瓶壁,每瓶加终止液(2%FBS+a-MEM)10ml,吸出细胞悬液至2支50ml离心管中,各培养瓶每瓶加10ml 生理盐水,吹洗汇入50ml离心管中。
1200rpm,离心6min,弃上清。
合并沉淀至1管,加40ml生理盐水再次离心洗涤,沉淀用10ml完全培养基重悬,经细胞筛过滤,5ml完全培养基冲洗筛网,计数。
根据细胞数量铺瓶,使细胞浓度为1~2×104/ml,置37℃、5%CO2培养箱中培养。
4.收获:每瓶加入3ml0.25%胰酶,37℃消化1min,加入终止液10ml/瓶,收集所有液体到50ml离心管中,再每瓶加10ml生理盐水,轻柔吹打后汇入50ml离心管中。
1200转/min离心6min,弃上清,细胞沉淀用16ml生理盐水悬浮,混匀取1ml做计数和流式检测。
加生理盐水至40ml,取500μl上清做内毒素检测,1200rpm,离心6min。
弃上清,离心沉淀用2.5mlFBS悬浮,再缓慢加入2.5ml 冻存母液,混匀后分装到冻存管中,每管1ml。
冻存细胞数应控制在2~5×106/ml 范围内。
利用程序降温盒放置-80℃医用冰箱中过夜后转至液氮罐。
