离子交换柱层析分离核苷酸
实验四离子交换层析分离单核苷酸

将单核苷酸样品加到离子交换柱 的适当位置,确保样品均匀分布 在离子交换剂上。
洗脱与收集
01
02
03
洗脱液的选择
根据目标单核苷酸的电荷 性质,选择合适的洗脱液 进行洗脱。
洗脱速度的控制
控制洗脱速度,确保单核 苷酸在离子交换柱上得到 充分分离。
收集洗脱液
将洗脱液收集到适当容器 中,以便后续检测与鉴定。
03 实验步骤
离子交换柱的准备
离子交换柱的清洗
平衡离子交换柱
使用去离子水清洗离子交换柱,确保 无杂质残留。
使用适当的缓冲液平衡离子交换柱, 确保达到最佳分离效果。
选择合适的离子交换剂
根据目标单核苷酸的电荷性质,选择 合适的离子交换剂填充离子交换柱。
单核苷酸的点样
准备单核苷酸样品
将待分离的单核苷酸样品溶解在 适当的缓冲液中。
改进和完善。未来可以探索更多的分离方法,提高分离效率和准确性。
02 03
应用领域拓展
离子交换层析分离单核苷酸在生物、医学、农业等领域有着广泛的应用 前景。未来可以进一步拓展其应用领域,为相关领域的研究和应用提供 有力支持。
深入研究机理
离子交换层析分离单核苷酸的机理涉及到多个方面,如离子交换剂的选 择、洗脱液的组成等。未来可以对这些方面进行深入研究,进一步揭示 其分离机理和规律。
准备实验材料和设备
根据实验需求,准备所需的试 剂、离子交换柱、层析缓冲液 等。
离子交换层析操作
将离子交换剂装入柱中,调整 流速和pH值等参数,上样、 洗脱和收集各组分。
实验结果分析
对实验数据进行处理和分析, 评估分离效果,优化实验条件。
了解实验注意事项
保证实验操作环境的清洁度,以避免 污染。
戴安公司AS11-HC阴离子交换分离柱

戴安公司IonPac AS11和AS11-HC介绍IonPac AS11/AS11-HC 阴离子交换分离柱用NaOH或KOH做淋洗液,用于无机阴离子和有机酸阴离子的快速分离,包括:无机阴离子;一价,二价,三价脂肪酸;Kreb’s循环酸;高电荷阴离子,如多聚磷酸盐,多聚硫酸盐,多聚碳酸盐;疏水性离子如I-,SCN-,S2O32-和ClO4-;核苷酸。
有机溶剂可匹配性方便阴离子交换选择性的控制,以及复杂基质分析后的清洗。
柱:IonPac AG11-HC,AS11-HC,4mm 检测器:抑制型电导,ASRS-ULTRA,淋洗液A:KOH 自动抑制外加水模式淋洗液B:NaOH 峰:1 奎尼酸55.0 mg/L 梯度: 1 mM from 0 to 8min 2 F- 0.8 to 30mM at 28min 3 乳酸根46.2to 60mM at 38min 4 半乳糖醛酸根60.0甲醇:10% from 0-38min 5 Cl- 1.0流速: 1.5 mL/min 6 NO3-0.6进样体积:10 uL 7 戊二酸根0.7温度:30℃8 琥珀酸根 1.0样品制备:1:10去离子水稀释9 苹果酸根116.0图 2 KOH梯度淋洗,在AS11-HC柱上分析葡萄汁10 丙二酸根/酒石酸根190.011 马来酸根 2.012 SO42- 5.013 草酸根12.914 PO43-27.015 柠檬酸根80.016 异柠檬酸根 1.0柱:IonPac AS11,AG11,4mm 流速:2.0 mL/min淋洗液:KOH 进样体积:25uL0.5 mM 等度2.5min 检测器:抑制型电导,ASRS,to 5 mM at 6min, to 38 mM at 18min 自动抑制循环模式淋洗液发生器:EG40峰:1 山梨酸根10.5 mg/L样品制备:1:1000去离子水稀释图 3 KOH梯度淋洗,在AS11柱上分析蛋糕霜糖中的山梨酸酯柱:IonPac AG11,AS11 样品:60%过氧化氢(试剂级别,C1)淋洗液:1.5 mM NaOH 1:50稀释3min 1.5-40 mM NaOH 峰:1 Chloride 0.42 mg/L梯度,13min 2 Nitrate 22.0 流速:1 mL/min 3 Sulfate 0.74进样体积:750 uL 4 Phosphate 170.0检测器:抑制型电导,ASRS, 5 Pyrophosphate 33.0自动抑制循环模式图 4 用AS11柱测定60%稳定的过氧化氢溶液中的阴离子柱:IonPac AS11,4mm 检测器:抑制型电导,ASRS , 淋洗液:45 mM NaOH ,在40%甲醇中 自动抑制外加水模式 流速: 1 mL/min 峰: 1 Fluoride 2 mg/L进样体积:25 uL 2 Chloride 2图 5 用AS11柱分离常见无机阴离子及I -,ClO 4-,SCN -和S 2O 32离子。
离子交换层析讲解

三、离子交换剂的种类和性质 1.离子交换剂的基质
• 其中:聚苯乙烯离子交换剂(又称为聚苯乙烯树脂)是以
苯乙烯和二乙烯苯合成的具大、流速快。但它与 水的亲和力较小,具有较强的疏水性,容易引起蛋白的变 性。故一般常用于分离小分子物质,如无机离子、氨基酸、 核苷酸等。 以纤维素(Cellulose)、球状纤维素(Sephacel)、葡聚 糖(Sephadex)、琼脂糖(Sepharose)为基质的离子交 换剂都与水有较强的亲和力,适合于分离蛋白质等大分子 物质,葡聚糖离子交换剂一般以Sephadex G-25和G-50 为基质,琼脂糖离子交换剂一般以Sepharose CL-6B为基 质。关于这些离子交换剂的性质可以参阅相应的产品介绍。
离子交换层析
原理及应用
一、简介
• 1、定义:
离子交换层析(Ion Exchange Chromatography简称为IEC)是以离子交换 剂为固定相,依据流动相中的组分离子与交 换剂上的平衡离子进行可逆交换时的结合力 大小的差别而进行分离的一种层析方法
2、发展历程
• 1848年,Thompson等人在研究土壤碱性物质交
二、基本原理 阴离子交换
• 通过选择合适的洗脱方式和洗脱液,如增加离子
强度的梯度洗脱。随着洗脱液离子强度的增加, 洗脱液中的离子可以逐步与结合在离子交换剂上 的各种负电基团进行交换,而将各种负电基团置 换出来,随洗脱液流出。 与离子交换剂结合力小的负电基团先被置换出来, 而与离子交换剂结合力强的需要较高的离子强度 才能被置换出来,这样各种负电基团就会按其与 离子交换剂结合力从小到大的顺序逐步被洗脱下 来,从而达到分离目的。
X+ Y-↔ A-
二、基本原理
• 从上面的反应式中可以看出,如果A离子与离子交 •
反义寡核苷酸药物的高效液相色谱大规模纯化技术

反义寡核苷酸药物的高效液相色谱大规模纯化技术
反义寡核苷酸药物已成功应用于肿瘤治疗,具有多种有益的属性,但其纯化技术受到了很多限制,进一步的研究可以提高效率并降低成本。
本文提出了一种高效的液相色谱大规模纯化技术,用于纯化反义寡核苷酸药物。
该技术主要包括三个步骤:第一步是将物质通过活性炭进行吸附,以去除非结构性杂质,如脂肪酸和蛋白。
第二步是强离子交换柱层析,以结构性组分与不同的离子解离。
最后一步是使用电泳层析,以根据反义寡核苷酸药物的不同充电性质对其进行分离。
这种高效的液相色谱大规模纯化技术实现了快速、低成本的分离和纯化,它还可用于其器件的分离和纯化以确保其质量。
该技术通过活性炭和强离子交换柱层析技术可以有效清除杂质,进而提高不是最终产品的活性物质和密度。
此外,该技术还确保了所有关键步骤都是可重复性的,这就使得获得高纯度的药物更加容易。
从而,上述技术的实施,可实现反义寡核苷酸药物的快速、低成本的大规模纯化,为实现高纯度研究产品的有效开发提供了重要依据。
自溶法生产呈味核苷酸
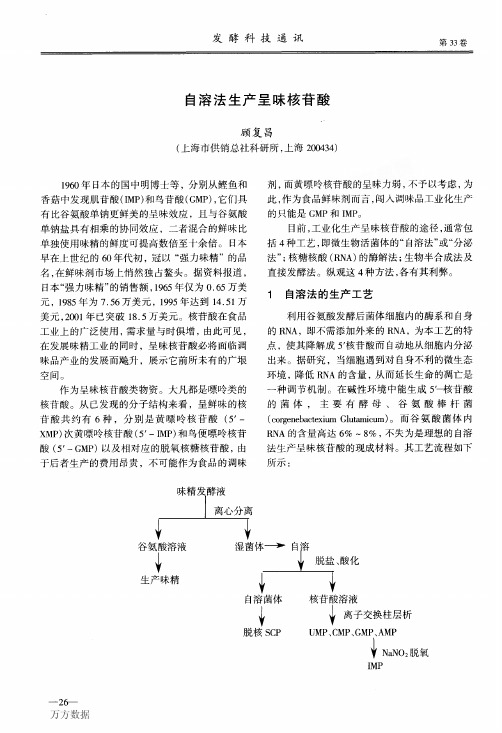
发酵科技通讯第33卷自溶法生产呈昧核苷酸顾复昌(上海市供销总社科研所,上海200434)1960年日本的国中明博士等,分别从鲣鱼和香菇中发现肌苷酸(IMP)和鸟苷酸(GMP),它们具有比谷氨酸单钠更鲜美的呈味效应,且与谷氨酸单钠盐具有相乘的协同效应,二者混合的鲜味比单独使用味精的鲜度可提高数倍至十余倍。
日本早在上世纪的60年代初,冠以“强力味精”的品名,在鲜味剂市场上悄然独占鳌头。
据资料报道,日本“强力味精”的销售额,1965年仅为0.65万美元,1985年为7.56万美元,1995年达到14.5l万美元,2001年已突破18.5万美元。
核苷酸在食品工业上的广泛使用,需求量与时俱增,由此可见,在发展味精工业的同时,呈味核苷酸必将面临调味品产业的发展而飚升,展示它前所未有的广垠空间。
作为呈昧核苷酸类物资。
大凡都是嘌呤类的核苷酸。
从已发现的分子结构来看,呈鲜味的核苷酸共约有6种,分别是黄嘌呤核苷酸(57一XMP)次黄嘌呤核苷酸(57一IMP)和鸟便嘌呤核苷酸(57一GMP)以及相对应的脱氧核糖核苷酸,由于后者生产的费用昂贵,不可能作为食品的调味谷氨酸溶液湿菌山生产味精剂,而黄嘌呤核苷酸的呈味力弱,不予以考虑,为此,作为食品鲜味剂而言,闯入调味品工业化生产的只能是GMP和IMP。
目前,工业化生产呈味核苷酸的途径,通常包括4种工艺,即微生物活菌体的“自溶法”或“分泌法”;核糖核酸(RNA)的酶解法;生物半合成法及直接发酵法。
纵观这4种方法,各有其利弊。
1自溶法的生产工艺利用谷氨酸发酵后菌体细胞内的酶系和自身的RNA,即不需添加外来的RNA,为本工艺的特点,使其降解成57核苷酸而自动地从细胞内分泌出来。
据研究,当细胞遇到对自身不利的微生态环境,降低RNA的含量,从而延长生命的凋亡是一种调节机制。
在碱性环境中能生成5L核苷酸的菌体,主要有酵母、谷氨酸棒杆菌(corgenebactexiumGlutamicum)。
OD

OD值1. 朗伯——比尔(Lambert-beer)光吸收定律:A=-lgT=εb cA——吸光度,又称光密度“O.D”。
T——透光度,T=I / I。
,I。
——为照射到吸收池上的光强,I——为透过吸收池的光强。
ε——摩尔吸光系数或克分子吸光系数(L•mol-1•cm-1)。
b——样品光程(cm),通常使用1.0cm 的吸收地,b=1cm。
C——样品浓度(mol/L)。
由上式可以看出:吸光度A与物质的吸光系数“ε”和物质的浓度“C”成正比。
2. DNA和RNA的OD值2.1 原理嘌呤碱和嘧啶碱具有共轭双键,使碱基、核苷、核苷酸和核酸在240~290nm的紫外波段有一强烈的吸收峰,因此核酸具有紫外吸收特性。
DNA钠盐的紫外吸收在260nm附近有最大吸收值(图3-25),在230nm处为吸收低谷,其吸光率(absorbance)以A260表示,A260是核酸的重要性质,RNA钠盐的吸收曲线与DNA无明显区别,蛋白质在280nm处有最大的吸收峰,盐和小分子则集中在230nm处,对于纯的核酸溶液,测定A260,即可利用核酸的比吸光系数计算溶液中核酸的量,核酸的比吸光系数是指浓度为1μg/mL的核酸水溶液在260nm处的吸光率,天然状态的双链DNA的比吸光系数为0.020,变性DNA和RNA的比吸光系数为0.022。
据朗波-比尔光吸收定律A=-lgT=εbc知,c=A/εb,而b通常为1cm,所以,通常以1OD值相当于50μg/mL双螺旋DNA,或40μg/mL单螺旋DNA(或RNA),或20μg/mL 寡核苷酸计算。
2.2 纯度DNA和RNA的纯度可以通过测定260nm,230nm和280nm的紫外吸收值来测定,纯的DNA OD260/280在1.8-1.9,OD260/230应大于2.0,纯的RNA OD260/280在1.9-2.0,如果DNA比值高于1.8-1.9,可能有RNA没有去除干净,如果DNA比值小于1.8-1.9,可能含有酚或者蛋白质(RNA中含有酚或者蛋白质比值也会降低),若OD260/230小于2.0说明有残存的盐或小分子杂质污染。
离子交换柱层析原理

离子交换层析介质得应用离子交换层析分离纯化生物大分子得过程,主要就是利用各种分子得可离解性、离子得净电荷、表面电荷分布得电性差异而进行选择分离得。
现已成为分离纯化生化制品、蛋白质、多肽等物质中使用最频繁得纯化技术之一。
离子交换层析(IonExchangeChromatography简称为IEC)就是以离子交换剂为固定相,依据流动相中得组分离子与交换剂上得平衡离子进行可逆交换时得结合力大小得差别而进行分离得一种层析方法。
离子交换层析就是目前生物化学领域中常用得一种层析方法,广泛得应用于各种生化物质如氨基酸、蛋白、糖类、核苷酸等得分离纯化。
1、离子交换层析得基本原理:ﻫ离子交换层析就是通过带电得溶质分子与离子交换层析介质中可交换离子进行交换而达到分离纯化得方法,也可以认为就是蛋白质分子中带电得氨基酸与带相反电荷得介质得骨架相互作用而达到分离纯化得方法。
离子交换层析法主要依赖电荷间得相互作用,利用带电分子中电荷得微小差异而进行分离,具有较高得分离容量。
几乎所有得生物大分子都就是极性得,都可使其带电,所以离子交换层析法已广泛用于生物大分子得分离、中等纯化及精制得各个步骤中。
由于离子交换层析法分辨率高,工作容量大,并容易操作,因此它不但在医药、化工、食品等领域成为独立得操作单元,也已成为蛋白质、多肽、核酸及大部分发酵产物分离纯化得一种重要得方法。
目前,在生化分离中约有75%得工艺采用离子交换层析法。
2、离子交换层析介质:离子交换层析得固定相就是离子交换剂,它就是由一类不溶于水得惰性高分子聚合物基质通过一定得化学反应共价结合上某种电荷基团形成得。
离子交换剂可以分为三部分:高分子聚合物基质、电荷基团与平衡离子。
电荷基团与高分子聚合物共价结合,形成一个带电得可进行离子交换得基团。
平衡离子就是结合于电荷基团上得相反离子,它能与溶液中其它得离子基团发生可逆得交换反应。
平衡离子带正电得离子交换剂能与带正电得离子基团发生交换作用,称为阳离子交换剂;平衡离子带负电得离子交换剂与带负电得离子基团发生交换作用,称为阴离子交换剂。
武汉大学生科院张楚富教授--学习指导及习题解答

武汉大学生科院武汉大学生科院张楚富教授等原作!非常感谢!第二章氨基酸和蛋白质的一级结构基本内容蛋白质含有20种标准氨基酸,这些氨基酸在它们的α碳原子上分别含有一个氨基、一个羧基和一个侧链基团(或称R基团)。
除甘氨酸外,所有其它氨基酸的α碳原子都是一个不对称的碳原子,即手性碳原子。
蛋白质中的所有氨基酸都是L-型的。
20种标准氨基酸可以根据它们侧链的结构分为含脂肪烃基的氨基酸、含芳香基的氨基酸、含硫的(或含羟基的、或含酰胺基的)氨基酸。
如果根据它们的侧链极性(或在生理pH下的解离),可分为侧链非极性氨基酸、侧链不带电荷的极性氨基酸和侧链解离带正电荷或负电荷的氨基酸。
氨基酸侧链的性质对于决定蛋白质的性质、结构和功能来说是很重要的。
氨基酸的α-氨基和α-羧基都是可解离的基团,它们的解离取决于介质的pH。
在生理pH下,α-氨基解离带正电荷(–NH3+),α-羧基解离带负电荷(–CO O–);侧链可解离基团的解离取决于它们的pK值和介质的pH。
氨基酸的解离性质是建立分离和分析氨基酸的方法的基础,它们的解离也影响蛋白质的性质、结构和功能。
分离分析氨基酸的主要方法是离子交换法以及电泳法。
蛋白质是由氨基酸借肽键连接而成多聚物。
在蛋白质多肽链中,肽键是唯一的共价键,由一个氨基酸的α-羧基和相邻氨基酸的α-氨基脱水缩合而成。
在多肽链中,氨基酸残基的顺序称为蛋白质的一级结构。
蛋白质是生物大分子,虽然它们具有与氨基酸相似的解离性质,但这一性质却比氨基酸复杂。
蛋白质的许多重要的性质,例如,溶解性、极性、带电性质、分子大小以及配体亲和性等,是构成分离分析它们的方法的基础。
离子交换法、凝胶过滤法、亲和层析法、超速离心法以及各种电泳法是常用的方法。
蛋白质一级结构的测定通常采用这样的程序,即纯净样品的末端分析、氨基酸组成分析、专一性酶或化学试剂进行部分水解、Edman降解法测定肽碎片的氨基酸残基的顺序以及片段重叠。
末端分析常有丹磺酰氯法和二硝基氟苯法;肽链的部分水解一般是有胰蛋白酶法、胰凝乳蛋白酶法以及溴化氰法。
离子交换柱层析分离核苷酸

离子交换柱层析分离核苷酸来源:互联网 作者:未知 发布时间:2006-08-06一、实验目的本实验以酵母RNA 为材料,将RNA 用碱水解成单核苷酸,再用离子交换柱层析进行分离,最后采用紫外吸收法进行鉴定。
同时通过测定各单核苷酸的含量,可以计算出酵母RNA 的碱基组成。
本实验的目的是:1. 了解掌握RNA 碱水解的原理和方法2. 掌握离子交换柱层析的分离原理和方法3. 熟练掌握紫外吸收分析方法二、实验原理1. RNA 的碱水解实验室制备单核苷酸一般用化学水解法(酸、碱水解)和酶解法。
RNA 用酸水解可得到嘧啶核苷酸和嘌呤碱基;用碱水解可得到2’一核苷酸和3’一核苷酸的混合物;用5’一磷酸二酯酶或3’一磷酸二酯酶水解则分别可得到5’一核苷酸或3’一核苷酸。
RNA 用碱水解,经过2’、3’一环核苷酸中间物,而后水解生成2’一核苷酸和3’一核苷酸。
如下图所示。
碱水解一般采用0.3M 的KOH ,37℃保温18~20小时就能水解完全(也可以用1M KOH ,80℃水解60min 或0.1M KOH 100℃水解20min )。
水解毕,用2M HClO4中和并逐滴调节至pH=2左右,生成的KClO4沉淀,离心去除之。
上清液即为各单核苷酸的混合液。
然后根据所选离子交换剂的类型,将上清液调至适当的pH 值,作样品液备用。
一般用阳离子交换剂,pH 调至1.5左右,用阴离子交换剂,pH 调至8 ~ 9(逐滴)。
此处用KOH 是为了便于除去钾离子以降低样品溶液中的离子强度。
2. 单核苷酸的离子交换柱层析分离离子交换层析是根据各种物质带电状态(或极性)的差别来进行分离的。
电荷不同的物质对离子交换剂有不同的亲和力,因此,要成功地分离某种混合物,必须根据其所含物质的解离性质,带电状态选择适当类型的离子交换剂,并控制吸附和洗脱条件(主要是洗脱液的离子强度和pH 值),使混合物中各组分按亲和力大小顺序依次从层析柱中洗脱下来。
离子交换层析

液。平衡缓冲液的离子强度和pH的选择首先要保证各个待分 离物质如蛋白质的稳定。其次是要使各个待分离物质与离子 交换剂有适当的结合,并尽量使待分离样品和杂质与离子交 换剂的结合有较大的差别。
一般是使待分离样品与离子交换剂有较稳定的结合。尽量使
杂质不与离子交换剂结合或结合不稳定。在一些情况下可以 使杂质与离子交换剂牢固地结合,而样品与离子交换剂结合 不稳定,也可以达到分离的目的。
离子交换层析的基本操作
(1) 层析柱
离子交换层析要根据分离的样品量选择合适的层析柱,
离子交换用的层析柱一般粗而短,不宜过长。直径和 柱长比一般为1:10到1:50之间,层析柱安装要垂直。装 柱时要均匀平整,不能有气泡。
装柱用于平衡离子交换柱的缓冲
■ 胶体的组成与外型:
Pharmacia (1991) Ion Exchange Chromatography – Principles and Methods p.24
Cellulose Sephcel Monobead
Pharmacia (1980) Separation News: 5
离子交换剂的选择、处理和保存
Buffer: 0.01 M Tris-HCl, pH 8.0
mg / mL gel
Adapted from Pharmacia (1991) Ion Exchange Chromatography – Principles and Methods p.64
影响交换容量的因素很多,主要可分为两个方面。
换剂上的样品组份洗脱下来。
柱效
通过柱子分离得到窄而对称的洗脱峰的能力(分辨率)
装柱的质量
树脂颗粒的大小
正确的洗脱条件
生物化学实验课程教学大纲

生物化学实验课程教学大纲课程名称:生物化学实验课程编码:0830531英文名称:Experiment of Biochemistry学时:64 其中必做:64 学分: 2开课学期: 3适用专业:生物技术/生物工程课程类别:必修课程性质:专业基础课先修课程:化学实验教材:生物工程与技术专业基础实验教程一、课程性质及任务《生物化学实验》是和《生物化学》课程同时开设的实验课程,是理论教学的深化和补充,具有较强的实践性,是一门重要的技术基础课,可作为生物技术、生物科学、生物工程药学专业学生的必修课。
生命学院的学生应该掌握生物化学实验的基本知识和基本技术技能,包括生物化学分离、制备、分析和鉴定技术(如滴定、比色、层析、电泳技术),同时掌握各种仪器的使用。
随着生物化学的飞速发展,新的实验方法和技术不断出现。
还要掌握一些较新的和实用的技术技能,如一些分子生物学的基础实验等。
通过该课程的学习,使学生巩固和加深生物化学理论知识,通过实践进一步加强学生分析问题和解决问题的能力及设计和创新能力的培养,培养学生一定的科学研究能力和严谨的科学态度,为学生进入更高层次的生物化学乃至分子生物学实验打下基础。
二、课程的教学要求实验课程内容分三个层次:基础实验、综合设计性实验和设计性实验。
基础实验是一些加强学生基本实验技能训练的传统实验。
综合设计实验包括一些新近发展起来的生化实验技术。
设计性实验由学生自拟题目,自选仪器,独立设计实验。
并对一些实验内容进行系统的优化组合。
经过多层次的训练后,学生应达到下列要求:1.进一步巩固和加深对生物化学基本知识的理解,掌握生物化学实验的基本知识和基本操作技能。
如生物化学分离、制备、分析和鉴定技术。
2.提高观察问题、分析问题和解决问题的能力。
通过独立思考,深入钻研有关问题,具有初步解决生物化学实验问题的能力。
3.能正确使用仪器设备,掌握仪器操作原理。
4.能独立设计实验,利用所学知识准确分析实验结果。
离子交换层析

离子交换层析在各方面的应用离子交换层析(Ion Exchange Chromatography简称为IEC)是以离子交换剂为固定相,依据流动相中的组分离子与交换剂上的平衡离子进行可逆交换时的结合力大小的差别而进行分离的一种层析方法。
离子交换层析技术已广泛用于各学科领域。
在生物化学及临床生化检验中主要用于分离氨基酸、多肽及蛋白质,也可用于分离核酸、核苷酸及其它带电荷的生物分子。
【2】2009年方希修,王冬梅等人应用平板式膜超滤技术与DEAE高子交换层析法对卵黄免疫球蛋白(IgY)进行分高纯化,经DEAE离子交换层析得到高纯度的IgY。
【4】2010年马江涛、陈昕等人使用Bio—Rad的DiaSTAT糖化血红蛋白检测系统(LPLC)和Biosystem.S.A的微柱离子交换层析法分别测定糖化血红蛋白,并进行精密度、网收率、干扰闪素及相关性的比较分析,证明了离子交换层析法测定糖化血红蛋白的方法适合临床常规应用。
【5】2010年蒋超,张或等人用超滤、阳离子交换层析方法从热钙法处理过的干酪乳清中分离纯化乳铁蛋白,其纯度达93.6%。
近年来,随着合成技术的发展和生产的需要,人工合成的刚性材料被陆续开发出来,这也是未来离子交换介质发展的一个趋势。
1.层析分离纯化家兔血清PONl条件的优化代恒、赵敏等人报道,Paraoxonase(PONl)是--个钙离子依赖的酯酶,它可以水解包括有机磷类,芳香酯类在内的多种化合物。
作为一种生物酶,PONl 可以在普通的生物环境下将有机磷类毒剂迅速水解,使之分解为无毒或低毒的化合物。
存在于血清中的PONl,可达到在有机磷毒物到达它的生物受体之前将其清除的目的。
在本研究中,使用Cibacron Blue F3GA琼脂糖的假亲和层析得到初步分离富含PONl的Cibacron流分,选定DEAE Sepharose Fast Flow为离子交换层析介质,通过AKTA purifier全自动层析仪,在PH值分别为7.0,7.5,8.0,8.5,9.0,9.5条件下对Cibacron流分进行离子交换层析。
离子交换柱层析原理

离子交换层析介质得应用离子交换层析分离纯化生物大分子得过程,主要就是利用各种分子得可离解性、离子得净电荷、表面电荷分布得电性差异而进行选择分离得。
现已成为分离纯化生化制品、蛋白质、多肽等物质中使用最频繁得纯化技术之一。
离子交换层析(IonExchange Chromatography简称为IEC)就是以离子交换剂为固定相,依据流动相中得组分离子与交换剂上得平衡离子进行可逆交换时得结合力大小得差别而进行分离得一种层析方法。
离子交换层析就是目前生物化学领域中常用得一种层析方法,广泛得应用于各种生化物质如氨基酸、蛋白、糖类、核苷酸等得分离纯化。
1、离子交换层析得基本原理:离子交换层析就是通过带电得溶质分子与离子交换层析介质中可交换离子进行交换而达到分离纯化得方法,也可以认为就是蛋白质分子中带电得氨基酸与带相反电荷得介质得骨架相互作用而达到分离纯化得方法.离子交换层析法主要依赖电荷间得相互作用,利用带电分子中电荷得微小差异而进行分离,具有较高得分离容量。
几乎所有得生物大分子都就是极性得,都可使其带电,所以离子交换层析法已广泛用于生物大分子得分离、中等纯化及精制得各个步骤中。
由于离子交换层析法分辨率高,工作容量大,并容易操作,因此它不但在医药、化工、食品等领域成为独立得操作单元,也已成为蛋白质、多肽、核酸及大部分发酵产物分离纯化得一种重要得方法.目前,在生化分离中约有75%得工艺采用离子交换层析法。
2、离子交换层析介质:离子交换层析得固定相就是离子交换剂,它就是由一类不溶于水得惰性高分子聚合物基质通过一定得化学反应共价结合上某种电荷基团形成得。
离子交换剂可以分为三部分:高分子聚合物基质、电荷基团与平衡离子.电荷基团与高分子聚合物共价结合,形成一个带电得可进行离子交换得基团。
平衡离子就是结合于电荷基团上得相反离子,它能与溶液中其它得离子基团发生可逆得交换反应。
平衡离子带正电得离子交换剂能与带正电得离子基团发生交换作用,称为阳离子交换剂;平衡离子带负电得离子交换剂与带负电得离子基团发生交换作用,称为阴离子交换剂。
离子交换层析分离核苷酸的实验方法

离子交换层析分离核苷酸的实验方法胡晓倩;钟长明;陈来同【摘要】This article introduces the reform, innovation and practice on the traditional ion-exchange chromatography method used for single nucleotide isolation by fully using of laboratory instruments and equipment.Utilizing strong base anion exchange resin and eluting with different ways, including gradient elution and stepwise elution, and according to standard parameters of nucleotide, the nucleotides in the chromatographic peak from the hydrolyzate of yeast RNA could be identified. By the different experimental ways about ion-exchange chromatography separation of single nucleotide, it not only enables students to completely learn the technique of ion-exchange chromatography, but also raises a simple experiment of isolation and purification into a higher level of research about characterization of nucleotide samples, therefore effectively promotes the students' interest and enthusiasm in learning and markedly increases their comprehensive experimental ability.%对传统的离子交换层析分离单核苷酸实验方法进行改革和创新.以强碱型阴离子交换树脂、采用梯度洗脱和阶段洗脱对酵母RNA水解液进行分离,利用标准核苷酸的参数确定层析峰的核苷酸种类.不但可以使学生全面掌握离子交换层析技术,而且经过对标准核苷酸性质的研究及核苷酸的鉴定,还可将原有实验内容从一个简单的分离纯化实验提升为研究性实验,从而有效凋动了学生的学习兴趣和学习热情,明显提高了学生的综合实验能力.【期刊名称】《实验技术与管理》【年(卷),期】2011(028)003【总页数】4页(P32-35)【关键词】核苷酸;强碱型阴离子交换树脂;阶段洗脱;梯度洗脱【作者】胡晓倩;钟长明;陈来同【作者单位】北京大学生命科学学院,北京,100871;北京大学生命科学学院,北京,100871;北京大学生命科学学院,北京,100871【正文语种】中文【中图分类】Q5-33Abstract:This article introduces the reform,innovation and practice on the traditional ion-exchange chromatography method used for single nucleotide isolation by fully using of laboratory instruments and equipment. Utilizing strong base anion exchange resin and eluting with different ways,including gradient elution and stepwise elution,and according to standard parameters of nucleotide,the nucleotides in the chromatographic peak from the hydrolyzate of yeast RNA could be identified.By the different experimental ways about ion-exchange chromatography separation of single nucleotide,it not only enables students to completely learn the technique of ion-exchange chromatography,but also raises a simple experiment of isolation and purification into a higher level of research about characterization ofnucleotide samples,therefore effectively promotes the students’interest and enthusiasm in learning and markedly increases their comprehensive experimental ability.Key words:nucleotide;strongly alkaline anion exchange resin;fractional elution;gradient elution核苷酸是核糖核酸及脱氧核糖核酸的基本组成单位。
离子交换层析分离核苷酸的实验方法

mo/ lL甲酸 ; . 1mo/ 甲酸一. 5 mo/ 甲酸钠 溶 0 0 lL 0 0 lL
液 ( H4 4 ) 0 1mo/ 甲 酸一. lL 甲酸 钠 溶 液 p . 4 ;. lL 0 1mo/ ( H3 7 ) 0 2mo/ 甲 酸 一. lL 甲 酸 钠 溶 液 。 p . 4 ;. lL 0 2mo/ 化 学试剂 均为分 析纯 。
了学 生 的综 合 实验 能力 。 关键词 : 核苷 酸 ; 碱 型 阴离 子交 换 树 脂 ;阶段 洗 脱 ; 度洗 脱 强 梯
中 图分 类 号 :Q53 —3 文 献标 志 码 :B 文 章 编 号 :1 0 —9 6 2 1 ) 3 0 2 4 0 24 5 ( 0 1 0 —0 3 —0
内容 。
物 , 们 在 医药得 到 了广 泛 的 应 用 [ 1 1 。核 苷 酸 的 生 产 方 法 有 很 - 2
多 r , 子 交 换 层 析 法 是 普 遍 应 用 中 的 主 要 分 离 纯 3 离 ] 化 方 法 。 离子交换 层析法是 分离生物 大分子有 效而 常用 的
Iv siaino h x ei na to b u n e c a g n et t ftee p r g o me tl meh da o ti -x h n e o
c rmao rp yfri lt gn c oie ho tga h oai u l t s o s n e d
( 京 大 学 生 命 科 学 学 院 ,北 京 1 0 7 ) 北 0 8 1
摘
要: 对传 统 的离 子 交换 层 析 分 离 单 核苷 酸实 验 方 法进 行 改 革 和 创 新 。以强 碱 型 阴 离 子 交 换 树 脂 、 用 梯 采
离子交换柱层析分离核苷酸

离子交换柱层析分离核苷酸
离子交换层析是一种常用的分离技术之一,它可以广泛应用于复杂混合物中目标物质
的纯化和富集。
离子交换层析技术基于样品分子与固定在柱子上的反离子之间相互作用的
原理。
在这种方法中,样品分子与反离子之间的强相互作用导致样品分子被吸附在柱子上,从而达到分离纯化的目的。
离子交换层析技术可以用于核苷酸的分离和纯化。
核苷酸由核苷酸碱基、磷酸基和五
碳糖基组成。
这些分子中的磷酸基具有负电荷,因此可以与柱子表面固定的正离子相互作用。
根据样品的特性,离子交换材料可以选择具有阴离子或阳离子基团。
对于核酸的分离
和纯化,通常选择具有阴离子基团的离子交换材料。
离子交换层析技术的关键之处在于适当的选择离子交换柱和缓冲液。
离子交换柱通常
是由高孔径的硅胶或纳米孔径的聚合物粒子制成。
缓冲液的选择要考虑到柱子的pH范围,通常选择pH较低的缓冲液。
同时,缓冲液中离子浓度应该足够高,以保证相互作用的强度。
核苷酸的离子交换层析分离过程可分为样品加载、洗脱和再生三个步骤。
样品加载的
过程可以通过重力流或高压流的方式将核苷酸样品加入柱中。
柱中的缓冲液通过柱子向下
流动,带走未结合的杂质和空载的核苷酸。
洗脱的过程是通过逐渐增加无机盐浓度或改变
缓冲液pH进行的。
再生的过程是使离子交换柱恢复原始状态的过程,以便下一次使用。
总的来说,离子交换层析技术是一种可靠有效的核苷酸分离和纯化方法。
在选择适当
的离子交换柱和缓冲液的情况下,可以实现高效的分离和富集,为后续的多种技术提供良
好的样品准备。
用阳离子交换树脂分离核苷酸时

1、用阳离子交换树脂分离核苷酸时,核苷酸被洗脱的先后顺序是UMP→GMP→CMP→AMP 而不是UMP→GMP→AMP→CMP。
为什么?解答:用离子交换树脂分离核苷酸主要是根据它们与树脂上相反电荷的静电结合力的不同以及核苷酸疏水的碱基环与树脂骨架之间非极性吸附力的差异。
本来,用阳离子交换树脂分离这四种核苷酸时,按照它们解离的差异,应该是AMP在CMP之前被洗脱下来。
但是,由于嘌岭环比嘧啶环同交换树脂的非极性吸附力大三倍,抵消了它们之间的电荷差异,故出现上面的冼脱顺序。
2、在中性pH下,ApGpUpC应带什么电荷?为什么?其净电荷数是多少?解答:在中性pH条件下,ApGpUpC应带负电荷。
因为第一磷酸基在此pH条件下完全解离而带负电荷,其净电荷数为-3。
3、DNA双螺旋模型的主要特征是,一条链上的碱基与另一条链上的碱基在同一个平面上配对。
Watson和Crick提出,腺嘌呤只与胸嘧啶配对,鸟嘌呤只与胞嘧啶配对。
出于什么样的结构考虑,使他们确定这样的配对方案?解答:DNA分子的Watson-Crick模型是以两条多核苷酸链的糖-磷酸骨架呈有规律的螺旋结构为特征。
这种螺旋结构有两个限制:①一条链上的碱基必须与另一条互补链的碱基形成氢键;②使碱基与糖-磷酸骨架相连接的糖苷键必须保持大约1.1nm的间隔。
A与T、G与C的配对符合这种限制。
若A与G或G与T配对,其间隔太大,以至不适合这种螺旋(即糖苷键间的间隔大于1.1nm),产生不稳定的膨胀结构,若T与C配对,其间隔太小,若A与C 配对,在空间限制范围内不能形成氢键。
只有A与T、G与C互补配对,才能保持其间隔约为 1.1nm,也才能在碱基对之间有效地形成氢键,Watson-Crick螺旋结构才稳定。
4、假定一闭合环状双股DNA由100个C和G交替出现的碱基对组成,当把它转移到高盐溶液中时,经受有B-型向Z-型转换。
它的缠绕数、连环数以及超螺旋数会发生什么样的变化?解答:在由B-型向Z-型转换时,B-DNA每个右手螺旋10.5bp转变成Z-DNA的每个左手螺旋12bp。
提取rna有哪些方法

提取rna有哪些方法
提取RNA的方法有以下几种:
1. 酚/氯仿提取法:加入酚溶液和氯仿,使细胞裂解,并使RNA萃取至有机相中。
然后使用异丙醇和盐沉淀RNA,最后用乙醇洗涤和脱水。
2. 链霉亲和纯化法:利用链霉素结合特定序列(例如poly A序列)的能力,通过链霉素磁珠或石蜡树脂来纯化多聚A尾的mRNA。
3. 柱层析法:使用离子交换柱、凝胶层析柱或亲和层析柱(例如,根据RNA与硅胶柱或根据RNA酶的抗体选择性地结合)来分离和纯化RNA。
4. 总RNA提取法:将细胞或组织裂解,使用一种提取试剂(如TRIzol试剂)来提取总RNA。
总RNA中包含mRNA、rRNA和tRNA等各种类型的RNA。
5. 过滤提取法:通过使用尺寸排除膜或滤波器来去除细胞碎片和DNA,然后使用过滤盘或纤维膜纯化RNA。
需要根据实验需求和样品性质选择适合的RNA提取方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
离子交换柱层析分离核苷酸摘要本实验技术以酵母RNA为材料,将RNA用碱水解成单核苷酸,再用离子交换柱层析进行分离,最后采用紫外吸收法进行鉴定。
同时通过测定各单核苷酸的含量,可以计算出酵母RNA的碱基组成。
目录••••••一、实验原理(一) RNA的碱水解实验室制备单一般用化学水解法(酸、碱水解)和酶解法。
RNA用酸水解可得到嘧啶和嘌呤碱基;用碱水解可得到2’一核苷酸和3’一核苷酸的混合物;用5’一磷酸二酯酶或3’一磷酸二酯酶水解则分别可得到5’一核苷酸或3’一核苷酸。
RNA用碱水解,经过2’、3’一环核苷酸中间物,而后水解生成2’一核苷酸和3’一核苷酸。
如下图所示。
碱水解一般采用0.3M的KOH,37℃保温18~20小时就能水解完全(也可以用1M KOH,80℃水解60min或0.1M KOH 100℃水解20min)。
水解毕,用2M HClO4中和并逐滴调节至pH=2左右,生成的KClO4沉淀,离心去除之。
上清液即为各单核苷酸的混合液。
然后根据所选离子交换剂的类型,将上清液调至适当的,作样品液备用。
一般用阳离子交换剂,pH调至1.5左右,用阴离子交换剂,pH调至8 ~ 9(逐滴)。
此处用KOH是为了便于除去钾离子以降低样品溶液中的离子强度。
(二) 单核苷酸的层析分离离子交换层析是根据各种物质带电状态(或极性)的差别来进行分离的。
电荷不同的物质对离子交换剂有不同的亲和力,因此,要成功地分离某种混合物,必须根据其所含物质的解离性质,带电状态选择适当类型的离子交换剂,并控制吸附和洗脱条件(主要是洗脱液的离子强度和),使混合物中各组分按亲和力大小顺序依次从层析柱中洗脱下来。
在离子交换层析中,分配系数或平衡常数(Kd)是一个重要的参数:Kd = Cs / Cm式中:Cs是某物质在固定相(交换剂)上的摩尔浓度,Cm是该物质在流动相中的摩尔浓度。
可以看出,与交换剂的亲和力越大,Cs越大,Kd值也越大。
各种物质Kd值差异的大小决定了分离的效果。
差异越大,分离效果越好。
影响Kd 值的因素很多,如被分离物带电荷多少,空间结构因素,离子交换剂的非极性亲和力大小,温度高低等。
实验中必须反复摸索条件,才能得到最佳分离效果。
核苷酸分子中各基团的解离常数(pK)和等电点p I 值见表1。
表 1 四种核苷酸的解离常数(pK)和等电点pI值*注:pI = (pKa1 pKa3) / 2由表1可见,含氮环亚氨基的解离常数(pK )值相差较大,它在离子交换分离四种核苷酸中将起决定作用。
用离子交换树脂分离核苷酸,可通过调节样品溶液的pH值使它们的可解离,带上正电荷或负电荷。
同时减少样品溶液中除核苷酸外的其它离子的强度。
这样,当样品液加入到层析柱时,核苷酸就可以与离子交换树脂相结合。
洗脱时,通过改变pH值或增加洗脱液中竞争性离子的强度,使被吸附的核苷酸的相应电荷降低,与树脂的亲和力降低,结果使核苷酸得到分离。
混合核苷酸可以用阳离子或阴离子交换树脂进行分离。
采用阳离子交换时,控制样品液pH值在1.5,此时UMP带负电,而AMP、CMP、GMP带正电,可被阳离子树脂吸附。
然后通过逐渐升高pH值,将各核甘酸洗脱下来,次序是UMP-GMP-CMP-AMP。
AMP与CMP洗脱位置的互换,是由于聚苯乙烯树脂母体对嘌呤碱基的非极性吸附力大于对嘧啶碱基的吸附力造成的。
本实验采用聚苯乙烯一二乙烯苯三甲胺季铵碱型粉末阴离子树脂(201×8)分离四种核苷酸。
首先使RNA碱水解液中的其它离子强度降至0.02以下,然后调pH值至6以上,使样品核苷酸都带上负电荷,它们都能与阴离子交换树脂结合。
结合能力的强弱,与核苷酸的pI 值有关,pI 越大,与阴离子交换树脂的结合力越弱,洗脱时越易交换下来。
由表1可见,当用含竞争性离子的洗脱液进行洗脱时,洗脱下来的次序应该是CMP、AMP、GMP和UMP。
由于本实验所用的树脂的不溶性基质是非极性的,它与嘌呤碱基的非极性亲和力大于与嘧啶碱基的非极性亲和力。
所以,实际洗脱下来的次序为:CMP、AMP、UMP和GMP。
对于同一种核甘酸的不同异构体而言,它们之间的差别仅在于磷酸基位于核糖的不同位置上,2’—磷酸基较3’—磷酸基距离碱基更近,因而它的负电性对碱基正电荷的电中和影响较大,其pK 值也较大。
例如2’-胞苷酸的pK1=4.4,3’-胞苷酸的pK1 = 4.3 ,因此2’一核苷酸更易被洗脱下来。
应注意的是,样品不易过浓,洗脱的流速不宜过快,洗脱液的pH值要严格控制。
否则将使吸附不完全,洗脱峰平坦而使各核苷酸分离不清。
(三) 核苷酸的鉴定由于核苷酸中都含有嘌呤与嘧啶碱基,这些碱基都具有共轭双键(—C=C—C=C—),它能够强烈地吸收250~280毫微米波段的紫外光,而且有特征的紫外吸收比值。
因此,通过测定各洗脱峰溶液在220~300毫微米波长范围内的紫外吸收值,作出紫外吸收光谱图,与下图所示的标准吸收光谱进行比较,并根据其吸光度比值(250nm/260nm,280nm/260nm, 290nm/260nm)以及最大吸收峰与下页“表2”所列标准值比较后,即可判断各组分为何种核苷酸。
根据各组分在其最大吸收波长(lmax)处总的吸光度(总Amax )以及相应的摩尔消光系数(E260 nm),可以计算出RNA中四种核苷酸的微摩尔数和碱基摩尔数百分组成。
四种核苷酸在pH = 2 ~ 4时的紫外吸收光谱曲线四种核苷酸在pH = 2 ~ 4时的紫外吸收光谱曲线,溶液的pH值对核苷酸的紫外吸收光度值影响较大,故测定时需要调至一定的pH值。
二、试剂与器材(一) 试剂1. 酵母RNA2. 强碱型阴离子交换树脂201×8,聚苯乙烯一二乙烯苯一三甲胺季铵碱型,全交换量大于3毫摩尔/克干树脂,粉末型100~200目3. 1M甲酸:21.4ml 88%甲酸定容至500ml4. 1M甲酸钠:34.15g纯甲酸钠(注意结晶水问题)用蒸餾水溶解,定容至500ml5. 0.3 M KOH:1.68g KOH用蒸餾水溶解定容至100ml6. 2 M过氯酸HClO4:17ml 过氯酸( 70~72 % )定容至100ml7. 2 M NaOH (50ml),0.5 M NaOH (100ml)8. 1M HCl(100ml)9. 1% AgNO3溶液(二) 器材1. 层析柱2. 梯度洗脱器,电磁搅拌器3. 恒流泵4. 自动部分收集器5. 酸度计6. 紫外分光光度计7. 旋涡混合器8. 核酸蛋白检测仪9. 台式离心机三、操作步骤(一) RNA的碱水解称取20mg酵母RNA,置于刻度离心试管中,加2ml新配制的0.3 M KOH,用细玻璃棒搅拌溶解,于37℃水浴中保温水解20小时。
然后用2M HClO4(过氯酸)调水解液pH至2以下(要少量多次,只需几滴即可)。
由于核苷酸在过酸的条件下易脱嘌呤,所以滴加HClO4时需用旋涡混合器迅速搅拌,防止局部过酸,再以4000转/分的转速离心15分钟,置冰浴中10分钟,以沉淀完全。
将清液倒入另一刻度试管中,用2 M NaOH逐滴将清液pH值调至8~9,作上样样品液备用。
样品液上柱前,取0.1ml稀释到500倍,测定其在260nm波长处的光吸收值,用以最后计算层析的回收率。
(二)离子交换树脂的预处理取201×8粉末型强碱型阴离子交换树脂8克(湿),先用蒸馏水浸泡2小时,浮选除去细小颗粒,同时用减压法除去树脂中存留的气泡,然后用四倍树脂量的0.5M NaOH溶液浸泡1小时,除去树脂中的碱溶性杂质。
用去离子水洗至近中性后,再用四倍量1M HCl浸泡半小时,以除去树脂中酸溶性杂质。
接着用蒸馏水洗至中性(可以上柱洗),此时阴离子交换树脂为氯型。
(三)离子交换层析柱的装柱方法离子交换层析柱可使用内径约1cm、长10 cm的层析柱,柱下端有烧结上的垂熔滤板,柱上端使用橡皮塞,塞子中间打一小孔。
紧紧插入一根细聚乙烯管,层析柱夹在铁架台上,调成垂直,柱下端细胶管用螺旋夹夹紧,向柱内加入蒸馏水至2/3柱高,再用滴管将经过预处理的离子交换树脂加入柱内,使树脂自由沉降至柱底,放松螺旋夹,使蒸馏水缓慢流出,再继续加入树脂,使树脂最后沉降的高度约为6~7cm。
注意在装柱和以后使用层析柱的过程中,切勿干柱,树脂不能分层,树脂面以上要保持一定高度的液面(不能太高,约1cm),以防气泡进入树脂内部,影响分离效果。
(四)的转型处理树脂的转型处理就是使树脂带上洗脱时所需要的离子。
本实验需要将阴离子交换树脂由氯型转变为甲酸型,先用200ml 1M 甲酸钠洗柱,用1%AgNO3检查柱流出液,直至不出现白色AgCl沉淀为止。
然后改用约200ml 0.2M甲酸继续洗柱,测定流出液的A260≤ 0.020为止。
最后用蒸馏水洗柱,直至流出液的pH值接近中性(或与蒸馏水的pH相同)。
(五) 加入样品并淋洗除去不被树脂吸附的组分加样就是将RNA碱水解产物转移到离子交换层析柱内,使其被离子交换树脂吸附。
先将柱内液体用滴管轻轻吸去,使液面下降到刚接近树脂表面。
旋紧下端螺旋夹,用滴管准确移取1.0 ml RNA碱水解样品液,沿柱壁小心加到树脂表面,然后松开下端螺旋夹,使样品液面下降至树脂表面,接着用滴管加入少量蒸馏水,当水面降至树脂表面时,再用约200ml 蒸馏水洗柱,将不被阴离子交换树脂吸附的嘌呤及嘧啶碱基,核苷等杂质洗下来。
检查流出液在260nm波长处的吸光度,直至低于0.020为止。
关恒流泵,旋紧柱下端螺旋夹。
(六) 梯度洗脱在梯度洗脱器的混合瓶内加入300ml蒸馏水,贮液瓶中加入300ml 0.20M甲酸—0.20M甲酸钠混合液(注意:梯度洗脱器底部的连通管要事先充满蒸馏水,赶尽气泡)。
洗脱器出口与恒流泵入口用细塑料管相连,打开两瓶之间的连通伐和出口伐,打开电磁搅拌器,松开柱下端螺旋夹,开启恒流泵,控制流速为5ml / 管/ 10分,开启部份收集器,分管收集流出液。
以蒸馏水为对照,测定各管在260nm波长下的A260值,,给各管编号,并标出最高峰的收集管。
(七) 核苷酸的鉴定分别测定最高峰管内液体在230nm ~ 300nm之间,每相差5nm间隔的光吸收值。
其中包括有250、260、280,290nm 各点(注意:液体均要保留,切勿倒掉。
测量时用石英杯)。
由于在小于250nm时,甲酸(HCOOH )具有很强的光吸收值,因此测定时所用参比对照液近似为:第一个峰用0.05M甲酸—0.05M 甲酸钠第二个峰用0.10M甲酸—0.10M甲酸钠第三个峰用0.15M甲酸—0.15M甲酸钠第四,五两峰用0.20M甲酸—0.20M甲酸钠也可以根据最高峰所在位置,计算甲酸、甲酸钠的浓度选择参比液。
(八) 测定各种核苷酸的含量和总回收率分别合并(包括最高峰管在内)各组份洗脱峰管内的洗脱液,用量筒测出溶液总体积,然后测定其A260值,参比对照液同上。
