青岛科技大学基础化学B
2025届湖南天壹名校联盟“长宁浏”高三10月大联考化学试题+答案

2025届高三10月联考化学注意事项:1.答题前,考生务必将自己的姓名、准考证号填写在本试卷和答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应的答案标号涂黑,如有改动,用橡皮擦干净后,再选涂其他答案;回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H1C12N14O16P31Cl355Co59.一、选择题:本题共14小题,每小题3分,共42分,在每小题给出的四个选项中,只有一个选项符合题目要求。
1.枞菌是松枞树下长出的菌子,是湘西特产之一,具有丰富的抗瘟、抗辐射、抗衰老的药物功效。
枞菌除富含蛋白质、糖类、脂肪外,还含有铁、磷、钙、钾等多种矿物质元素。
下列说法正确的是( ) A .枞菌中的蛋白质与鸡肉中的蛋白质水解的最终产物相同 B .糖类中纤维素与淀粉水解的最终产物相同 C .23Fe O 和34Fe O 常用于磁性材料 D .CaO 和25P O 常用于食品干燥剂2.近日,大连化物所江凌研究员团队采用自主研制的基于大连相干光源的气溶胶质谱实验方法,研究了α−蒎烯与x NO 和3NH 的光氧化反应过程,揭示了二次有机气溶胶(SOA)的形成机制。
下列叙述错误的是( )A .生活中常见的烟和雾均属于气溶胶B .羟基自由基·OH ()中的氧元素显1-价C .3NH 和x NO (氮的氧化物)在一定条件下很难反应D .汽车和工厂排放的22SO CO NO 、、均为人为污染物 3.下列化学用语表述正确的是( )A .异丁烷的键线式:B .HClO 的空间填充模型:C .2H 还原CuO 反应中电子的转移:D .用电子式表示2H S 的形成过程:4.24N H 可直接还原4HAuCl 制备具有荧光效应的纳米Au ,反应为2442N H HAuCl Au N HCl +→++(未配平)。
设A N 为阿伏加德罗常数的值,下列叙述正确的是( ) A .375.6LH Cl 中含中子数目为A 5N B .1241mol L N H −⋅溶液中氮原子数目为A 2N C .该反应生成4molHCl ,转移电子数目为A 3N D .2432gN H 中含有共用电子对的数目为A 6N5.下列有关离子方程式或电极反应式书写正确的是( ) A .2Fe(OH)溶于稀硝酸:2H OH H O +−+=B .Fe 粉投入4CuSO 溶液:232Fe 3Cu 3Cu 2Fe ++=++C .减性锌锰干电池的负极反应式:2Zn 2OH 2e Zn(OH)−−+−=D .向漂白粉溶液通入过量22223CO :Ca 2ClO CO H O CaCO 2HClO +−+++=↓+ 6.下列实验操作能达到相应实验目的的是( )A .钠的燃烧B .验证氯气是否具有漂白性C .分离3Fe(OH)胶体和NaCl 溶液D .比较Mg Al 、金属性的强弱A .AB .BC .CD .D7.下列物质混合后,因发生氧化还原反应使溶液pH 减小的是( ) A .向浓盐酸中滴加少量的“84”消毒液 B .向NaHS 溶液中滴加少量的4CuSO 溶液 C .向3FeCl 溶液中通入2SO ,溶液棕黄色变浅D .向4NaHSO 溶液中滴加等体积等浓度的3NaHSO 溶液8.短周期主族元素X Y Z W 、、、的原子序数依次增大,Y 与W X 、与Z 的价电子数分别相等,X 与Z 两种元素能组成离子化合物M Y Z W 、、、三种元素能组成化合物N,N 的结构如图所示。
青岛科技大学2005-2006年度第二学期期末考试试卷之基础化学(下)08A

2007-2008 2 基础化学原理(A 卷)化学院孙雪梅07应化,化学,海科等王卫,张召香(答案写在答题纸上,写在试题纸上无效)一填空(共36分,每空1分)1. 某元素的主量子数n = 4,在n = 3,l = 2的轨道上有5个电子,原子的最外层电 子数为2,原子的核外电子排布式为,该元素属______区, 为。
其+2氧化态离子属电子构型。
2. O 22+的分子轨道表达式为,键级为,磁距为。
3. CO 2分子中中心C 原子采取的杂化方式的类型是,分子的空间构型 为,价键结构式为,其分子中的大π键表示为。
4. 在极性溶剂中,若溶质和溶剂间存在氢键,则会使溶质的溶解度(增大/减小)5. 配合物PtC14·2NH 3的水溶液中加入硝酸银不产生沉淀,滴加强碱也无氨放出,所 以它的化学式是,命名为,配位数是。
6. 当[Ni(NH 3)4]2+的磁矩大于零,按价键理论中心离子的杂化方式是,离子的空 间构型是。
7. Co 2+的价电子构型为,根据晶体场理论Co 2+ 与强场配体形成(低/高)自旋配合物,在八面体场中中心离子d 轨道的电子排布方式为, 单电子数为;晶体场稳定化能CFSE 为 Dq 。
8. 已知θθBiYPbY lg 27.94lg 18.04==,K K ,当△pM =±0.3,t 0.5%E =±时,能否 用控制酸度的方法用EDTA 对0.010 mol·L -1的Bi 3+,Pb 2+进行分别滴定?, 原因是;应先滴定哪种物质?,如何确定滴定该物质适合的pH ? 9. HgS 溶于王水的主要原因一是由于王水中的具有氧化性,二是由于具有配位作用,从而使化学平衡向溶解方向移动。
10. 由于效应,使得铋酸钠在酸性条件下具有很强的氧化性。
11. 向HgCl 2溶液中加入氨水可生成白色沉淀,这种沉淀的化学式为。
12. 写出鉴定下列离子所用的试剂名称Co 2+;Ni 2+;Zn 2+; PO 43-;NH 4+;Pb 2+ 。
青岛科技大学621有机化学考试大纲

621有机化学考试大纲有机化学课程考试大纲一、本有机化学考试大纲适用于报考青岛科技大学化学化工类类专业的硕士研究生入学考试。
二、考试内容(一)、基本知识1、命名与结构式(1)系统命名烷、烯、炔、二烯、脂环(环烷、环烯、螺环和桥环)、芳烃、卤代烃、醇、酚、醚、醛、酮、羧酸、羧酸衍生物、胺、杂环化合物(音译法)、碳水化合物(2)了解以上各类化合物的习惯命名、简单有机化合物的衍生物命名和常见化合物的俗名。
(3)写结构式:根据命名写结构式。
2. 理解下列名词的意义(1) 碳原子杂化:sp3、sp2、sp杂化;(2) 共价键:σ键,π键。
(3) 键长、键角、键能、键的极性。
(4) 离域轨道、定域轨道。
(5)共轭体系,共振论,芳香性。
(6) 构造、构型、构象、相对构型、绝对构型。
(7) 旋光度,比旋光度。
(8) 手性(手性中心)、手性碳原子。
(9) 对映体、外消旋体、内消旋体、差向异构体。
(10) 屏蔽效应,去屏蔽效应,化学位移,偶合常数,等性氢原子,δ值,τ值。
(11) 亲核试剂,亲电试剂。
(12) 元素有机化合物,金属有机化合物。
3. 理解各类有机化合物的涵义。
4. 了解重要有机化合物的物理状态和来源。
(二)、基本概念和规律1. 掌握下列各类化合物的结构特征烷、烯、炔、共轭二烯、环烃(大、中、小环)、芳烃、苯、萘、醇、酚、醚、醛、酮、羧酸及其衍生物、胺、重氮化合物、杂环(五元、六元);糖:单糖(Fischer投影式、氧环式、哈沃斯式、椅式、α,β构型);双糖(哈沃斯式和椅式构象式);多糖。
氨基酸,肽键,多肽结构的测定方法,蛋白质一级、二级、三级结构,核酸(核苷酸与核酸的结构表示法)。
2. 有机化合物与无机化合物的区别。
3. 研究有机化合物的一般方法。
4. 结构与物理性质的关系:熔点、沸点、溶解度的解释。
5. 马尔柯夫尼柯夫定则,过氧化物效应,扎依采夫规则,霍夫曼规则,芳烃取代规律,次序规则。
(三)、掌握熔沸点的测定,蒸馏,分馏,重结晶,萃取,水蒸气蒸馏,减压蒸馏的基本原理和操作方法。
青岛科技大学基础化学B

.选择题(单选, 共27分每空1.5分)1. 下列说法正确的是( )A.体系的焓等于恒压反应热。
B. 体系的焓等于体系的热量C. 体系的焓变等于恒压反应热。
D. 最稳定单质的焓值等于零.2. 在标准状态下热力学数据不为零的是( )A. (Al(s))B. ( Al(s))C. (Br2 (l))D. (Br2 (l))3. 一个能在低温下自发,而在高温下非自发的反应,则△H , △S的值应是()A. △H <0, △S<0B. △H >0, △S>0C. △H< 0, △S>0D. △H >0, △S<04. 反应A(g)+2B(g) →2C(g), △H<0,若想提高A(g)的转化率采用的方法有()A. 高温高压B. 低温低压C. 低温高压D. 高温低压5. 判断下列各过程中,哪种情况的△U最大( )A. 体系放出60 kJ的热,并对环境做了40 kJ的功B. 体系吸收60 kJ的热,环境对体系做了40 kJ的功C. 体系吸收60 kJ的热,并对环境做了40 kJ的功D. 体系放出60 kJ的热,环境对体系做了40 kJ的功6. 下列叙述正确的是:( )A. 催化剂可提高化学反应的转化率。
B. 反应的活化能越大,在一定温度下反应速率越大C. 反应速率常数只取决于温度,与反应物,生成物浓度无关。
D. 在任何情况下,反应速率在数值上等于反应速率常数7. 下列物质中能用酸碱滴定法直接准确滴定的是( )A. NaF(HF的=6.31×10-4 )B. H3BO3 ( = 5.7×10-10)C. 苯酚钠(苯酚的=1.1×10-10)D. NH4Cl ( NH3水的=1.8×10-5)8. 已知在1mol/l的H2SO4溶液中,= 1.45v, = 0.68v,在此条件下,用KMnO4标准溶液滴定Fe2+,其化学计量点的电位值是( )A. 0.38 VB. 0.73 VC. 0.89 VD. 1.32 V10. 在下述情况下计算溶液pH值时应采用的最简式是:1)用NaOH 标准溶液滴定HAc至终点时( ) 2)用HCl 标准溶液滴定Na2CO3至甲基橙变色时( )3)用NaOH 标准溶液滴定H3PO4至甲基橙变色时( )4)10.0ml 0.1mol/ L HAc与15.0 ml 0.1 mol/ L NaAc混合时()A. [H+] =B. [H+] =C. [H+] =D. [H+]=Ka?C酸/C碱E. [H+] =F. [H+] =11. 下列电对中,标准电极电势(??)最大的是( )A. Ag+/AgB. [Ag(NH3)2]+/AgC. AgI/AgD. AgBr/Ag二填空题(共33分每空1分)1. 化学反应等温方程为___________________, 当__________时反应正向进行。
青岛科技大学《基础化学试题》 (18)

2005~2006 2 基础化学原理(B) A 卷化学院 李明华应化,材化,化学,海科,环工 解从霞,王凤英 (答案写在答题纸上,写在试题纸上无效)一. 判断(每题1分,共5分)1.氧族元素氢化物的沸点高低次序为H 2O>H 2S>H 2Se>H 2Te 。
( )2.电子亲和能大的元素,电离能也大。
( )3.配合物形成体的配位数是指直接和中心原子(或离子)相连的配体总数。
( )4. 极性分子中只含极性共价键。
( )5.硼酸为三元中强酸。
( )二. 选择(每题1.5分,共30分)1.下列几种酸中,酸性最强的是 ( )A. HClO B .H 3BO 3 C .HCl D .HClO 42. 下列硫化物中不溶于盐酸可溶于硝酸的是( )A. Ag 2SB. ZnSC. CdSD. PbS3. 现用EDTA 滴定含有Al 3+、Fe 3+、Zn 2+的溶液中的Zn 2+。
若用二甲酚橙(XO)做指示剂,Al 3+、Fe 3+对XO 有封闭作用,为消除Al 3+、Fe 3+的干扰,可以哪种掩蔽方式掩蔽( )A. 沉淀掩蔽B.氧化还原掩蔽C. 配位掩蔽D. 控制酸度掩蔽4. 基态Mn 原子的价电子构型是( )A. 3d 7B. 3d 74s 2C. 3d 54s 2D. 3d 95. 一个阳离子使另一个阴离子变形能力增大的特性是( )A 电荷高,半径大 B. 电荷高,半径小 C. 电荷大,半径大 D. 电荷低,半径小 6 .用硝酸盐的热分解来制备NO 2时,应选择( )课程考试试题学期 学年 拟题人:校对人: 拟题学院(系): 适用 专 业:A. Pb(NO 3)2B. NaNO 3C. KNO 3D. NH 4NO 37 实验室中用CaCO 3标定EDTA 溶液的浓度时,通常选用的指示剂是:( )A .酚酞B .淀粉KIC .钙指示剂D .甲基橙8. 水分子中氧原子的杂化轨道是( ) A .sp B .sp 2 C .sp 3 D .dsp 29.下列分子偶极距为零的是( ) A .SO 2 B .CS 2 C .NH 3 D .CHCl 310. 下列原子第一电离能最大的是( ) A .B B .C C .Al D .Si11.下列配离子具有平面正方形空间构型的是( )A . [Ni(NH 3)4]2+ , μ= 3.2 B.M.B .[CuCl 4]2- , μ= 2.0 B.M.C . [Zn(NH 3)4]2+ ,μ= 0 B.M. D .[Ni(CN)4]2- , μ= 0 B.M. 12. 原子序数为33的元素,其原子在n = 4, l = 1, m = 0的轨道上的电子数为( )A .1B .2C .3D .413. 下列分子或离子中含有43π键的是( ) A .H 2O B .SO 2 C .-3NO D .NH 3 14. 下列物质在酸性介质能共存的是( )A .NO 2- ,I -,K +B .Sn 2+, Hg 2+,Cl -C .Ni 2+,Fe 3+, Cr 2O 72-D .ClO 3-, I -,Na +15. 用来鉴定NH 4+的试剂是( )A .K 4[Fe(CN)6].3H 2OB .KSCNC .AgNO 3D . [HgI 4]2-+OH -16. AgI 在下列相同浓度的溶液中,溶解度最大的是( )A .KCNB .Na 2S 2O 3C .NH 3D .KBr17.多电子原子中,各电子具有下列量子数,其中能量最高的电子是( )A .2,1,-1,1/2B .2,0,0,-1/2C .3,1,1,-1/2D .3,2,-1,1/218.O 2+的分子轨道表达式中能级最高的轨道是( )A .px 2σB .py 2πC .*s 2σD .*py 2π19.下列物质的熔点高低次序正确的是( )A .Au> CO 2>CsClB .Si>NaCl>N 2>NH 3C .W>SiC>MgCl 2> HFD .H 2Se>H 2S > H 2O20.[Co(NH 3)6]3+为内轨型配合物,则中心离子的杂化方式为( )A .d 2sp 3B .sp 3d 2C .dsp 2D .sp 3三.填空(每题1分,共35分)1. 元素原子的最外层有一个电子,电子的量子数是 n = 4、l = 0 、m = 0、m s = +1/2,次外层d 轨道为全充满,则该元素是_______;其价电子构型是__________;在周期表中位于第____周期,第_____族,______区。
2005年山东青岛科技大学有机化学考研真题B卷

2005年山东青岛科技大学有机化学考研真题B卷一、选择题(每小题1分,共10分) 1、 下列化合物沸点最低的是:3CH 2CH 2OH3C OCH 33CH 2CH 2NH 23CH 2CH 2CH 32、 下列化合物的酸性递减的顺序是:a. CH 3CH 2CH 2COOH ;b. CH 3CH 2CH(Cl)COOH ;c. CH 3CH(Cl)CH 2COOH ;d. CH 2(Cl)CH 2CH 2COOHA. b >c >d >aB. a >d >b >cC. a >c >b >dD. d >a >c >b 3、 下列化合物进行S N 2反应速度递减的顺序是:(a )CH 3CH 2CH 2CH 2Cl (b )CH 3CH 2CH(CH 3)Cl (c )(CH 3)3CCl A. a >b >c B. b >a >c C. c >b >a D. c >a >b 4、下列化合物进行亲电取代反应的活性由强到弱的顺序是:NH 2COCH 3NHCOCH 3a.b c d ...A. a >b >c >dB. a >d >c >bC. a >c >b >dD. d >a >c >b 5、下列化合物在碱性条件下水解反应速率递减的顺序是:CH 3COOCH3CH 3COOC 2H 5CH 3COOCH(CH 3)2HCOOCH 3a. b. c. d.A. d >a >b >cB. a >d >c >bC. c >b >a >dD. d >a >c >b 6、下列化合物无芳香性的是:A. B. C. D.-7、下列化合物为非手性分子的是:ClCH3CH3CH3CH3ClHCHCH3HOHCH3CHCH2CH3ClA. B. C. D.8、下列四种正碳离子稳定性递减的顺序为:CH2CH2CHCH3C(CH3)2CHCH3a. b. c.d.++++A. a>b>c>dB. a>d>b>cC. d>c>b>aD. d>a>c>b9、下列化合物的碱性递减的顺序是:NNH2CNH2NHOa. b. c. d.A. a>b>c>dB. a>d>b>cC. d>c>b>aD. d>a>c>b10、下列化合物能与水混溶的是:CH3CH2Cl CH3COOH CH3CH2OCH2CH3CH3CH3A. B. C. D.二、完成下列反应式:(每空1.5分,共33分)CH3CH2C CHCH3CH2CH2CH2COOHBr2NaOHCH3CH2CH=CH2KMnOH(CH)C=CHH+25AlCl31.( 1 )2.HBr Mg干醚( 4 ) 5 ( 6)( 7 )( 8 )( 2 )( 3 )+3CH3CH3OHC2H5OHKMnO4+HBr( 10 )( 11 )( 12 )-3.-O3Zn,H2O( 14 )( 15 )4.NaOHCHOOCH3MgBrCH3CH2COOC2H5COOC2H5NaOC H5.( 16 )( 17 )+40%6.( 18 )( 19 )( 21 )( 22 ) 7.干醚H2O+H2O+(1)(2)三、解释下列实验现象(每小题3分,共9分)1、羟基乙酸的酸性比乙酸强,而对羟基苯甲酸的酸性比苯甲酸弱。
青岛科技大学《基础化学试题》 (19)

2005~20062 基础化学原理(B) B 卷化学院李明华应化,材化,化学,海科,环工解从霞,王凤英 (答案写在答题纸上,写在试题纸上无效)一判断题(每题1分,共5分)1. 配离子的电荷数等于中心离子的电荷数。
()2. 酸效应系数越大,配合滴定的pM 突跃越大。
( )3. 金属与硝酸的反应产物取决于金属的活泼性和硝酸浓度。
()4. 在多电子原子中,电子的能量只取决于主量子数。
()5. 离子型化合物中不可能含有共价键。
()二填空:(每空1分, 共35分)1. 元素原子的最外层仅有一个电子,该电子的量子数是 n = 4、l = 0 、m = 0、m s =+1/2,次外层d 轨道为半充满,则该元素是_______;其价层电子排布式是__________;在周期表中位于第____周期,第_____族,______区。
2. [Ni(NH 3)4]2+ 和[Ni(CN)4]2-都是Ni 2+的配合物,已知前者的磁矩大于零,后者的磁矩等于零,则前者的空间构型是______,中心离子的杂化方式是_______;后者的空间构型是______,中心离子的杂化方式是_______。
3. 某紫色晶体溶于水得绿色溶液,此溶液与适量NaOH 反应生成灰绿色沉淀A, A 可溶于过量NaOH ,得到亮绿色溶液B ,在B 中加入H 2O 2并微热,得到黄色溶液C ,在C 中加入BaC12溶液得到黄色沉淀D, D 可溶于盐酸得到橙红色溶液E 。
请写出A~E 各为何种化合物或离子:A :B :C :D :E :4. 已知:lgK BiY = 27.94,lgK PbY = 18.04,pH = 1时,lg αY(H) = 18.01,能否在pH = 1的条件下用EDTA 准确滴定0.01mol.L -1的Bi 3+ ?。
可用控制酸度的方法分别滴定Bi 3+、Pb 2+的原因是(二者浓度均为0.01 mol.L -1)。
5. -2N 的分子轨道表达式为______,键级为,磁性为顺磁性还是抗磁性?_______6.V /A θϕ:Cu 2+158.0 Cu +522.0Cu ,Cu +能否发生歧化反应?___;反应进行的程度课程考试试题 学期学年 拟题学院(系):适 用 专 业:以平衡常数表示为多少?θK =______。
青岛科技大学化学专业实验
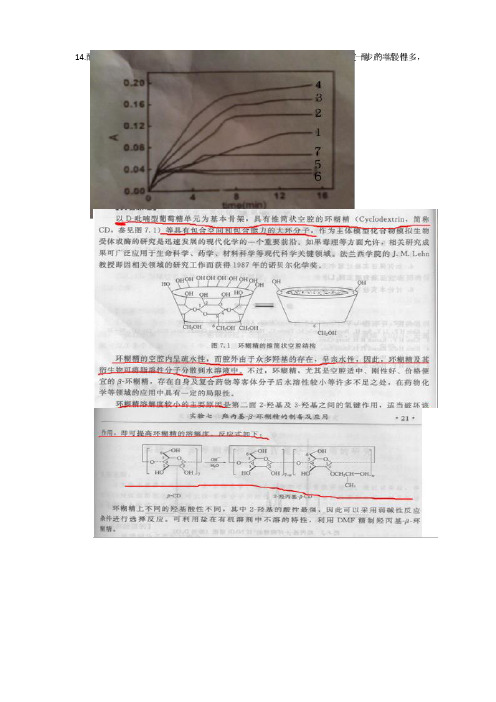
(3)图6为0.4ml加入硫代硫酸钠溶液后的酪氨酸酶提取液于10ml比色管中进行上述实验。随着时间的延长,吸光度基本不变(2分);这是因为酪氨酸酶经过硫代硫酸钠还原后,失去活性,后续反应不能进行,因此吸光度不变(3分)。
该方法不会引入杂质,所以能制备高纯度的Ti02粉体,水解反应一般在常温下进行,设备简单,能耗少。
S-G法有以下优点: (1)粉末粒径均匀; (2)由于原料的纯度高且溶剂在烧结过程中被除去,因此制得粉末的纯度高; (3)反应过程易于控制,可有效抑制副反应; (4)工艺操作较简单,易于操作。
18.制备光催化纳米二氧化钛时,温度为什么要控制在500-550摄氏度?
15.实验二中,提纯异构体[Co(en)3]I3H2o时,要用KI洗涤。这样可以防止生成的[Co(en)3]I3H2o晶体溶于洗涤液而造成产品的损失,同时也可以使一些未以[Co(en)3]I3H2o的形式沉淀出来的产品沉淀出来,提高产率。
16.三乙二胺合钴配离子的旋光异构体实验中。只有不具有对称中心、对称面和反轴(但可以有对称轴)的分子才可以光学异构。光学异构体的化学性质相同,用普通的方法不能直接制得光学异构体,而总是得到它们的外消旋混合物。通过外消旋体的离析,可以将外消旋混合物分开,得到纯的对应体。通常使用混合物的外消旋离子与另一种带相反电荷的光学活性化合物反应得到非对应异构体,由于它们的溶解度不同,选择适当的溶剂可以用分步结晶的方法把它们分开,得到某一种纯的非对应体,然后用光学不活性物质处理,可使一对光学活性盐恢复原来的组成。
高等有机化学(山东联盟)智慧树知到答案2024年青岛科技大学

高等有机化学(山东联盟)青岛科技大学智慧树知到答案2024年第一章测试1.下列关于EPM法的描述错误的是()A:EPM法推测的机理是反应的真实机理B:电子推动箭头可以从电子云密度高的区域指向电子云密度低的区域C:应首先寻找合理的正负电性反应中心,从而完成电子的推动D:EPM法推测反应机理的方法可以预测新体系的产物答案:A2.用EPM法推测反应机理时,形成四元环过渡态反应比较容易发生()A:错 B:对答案:A3.在用EPM法推测反应的机理时,酸性条件下不应该出现碳负离子,也不能用HO–或RO–等作进攻试剂()A:错 B:对答案:B4.在用EPM法推测反应机理时,碱性条件下可以用H+或其它正离子作进攻试剂()A:错 B:对答案:A5.用同位素标记的化合物,其化学性质会发生改变()A:对 B:错答案:B6.下列对同位素标记的说法中正确的是()A:有助于弄清化学反应的详细过程B:可以发现许多通常条件下很难观察到的现象C:用同位素标记的化合物,其化学性质不变D:可以用同位素追踪物质运行和变化的过程答案:ABCD7.可以用下列哪种方法证明氯苯和KNH2在液氨下反应生成了苯炔中间体()A:哈密特方程B:分离中间体C:14C标记D:同位素效应答案:C8. K H/K D = 4.0,说明霍夫曼消除反应的决速步骤中发生了碳氢键断裂()A:错 B:对答案:B9.在苯的硝化反应中,测得K H/K D = 1.0,说明决速步骤中未出现碳氢键断裂()A:错 B:对答案:B10.次级同位素效应的值很小,最高只有()A:1 B:1.5 C:3 D:2答案:B第二章测试1.下列物质中能发生付克酰基化反应的是()A:硝基苯B:苯甲醚C:甲苯D:吡啶答案:BC2.下列对付克酰基化反应描述正确的是()A:产物可继续发生酰基化B:是典型的亲核取代反应C:可以生成重排产物D:生成产物芳酮答案:D3.付克酰基化反应与烷基化类似,反应只需要催化量的AlCl3()A:对 B:错答案:B4.利用付克酰基化反应可以在芳环上引入直链烷烃()A:对 B:错答案:A5.当苯环的β-位有离去基团时,可以发生邻基参与得到苯鎓离子中间体()A:错 B:对答案:B6.反应过程中如果得到构型保持的产物,该反应可能发生了()A:S N1反应B:邻基参与C:S N2反应D:芳香亲核取代反应答案:B7.卤素中,邻基参与能力最强的是哪一个()A:氟B:溴C:氯D:碘答案:D8.芳香亲核取代反应的决速步骤发生了碳卤键的断裂()A:对 B:错答案:B9.下列关于芳香亲核取代反应机理的描述正确的是()A:协同机理B:消除加成机理C:加成消除机理D:自由基机理答案:C10.对于芳香亲核取代反应,活性最高的离去基团是()A:碘B:氯C:氟D:溴答案:C第三章测试1.狄尔斯-阿尔德反应的机理是()A:碳负离子机理B:协同机理C:自由基机理D:碳正离子机理答案:B2.狄尔斯-阿尔德反应是立体专一性的顺式加成反应,加成产物仍保持亲双烯体原来的构型()A:错 B:对答案:B3.维悌希反应是亲核加成反应,经历了四元环状中间体()A:对 B:错答案:A4.下列化合物发生维悌希反应,活性最高的是()A:乙酸乙酯 B:甲醛 C:丙酮 D:苯甲醛答案:B5.稳定的叶立德发生维悌希反应时,主要得到哪种构型的产物()A:Z型 B:Z, E构型混合物 C:E型 D:外消旋体答案:C6.瑞福尔马斯基反应使用的有机锌试剂较格氏试剂稳定,不与下列哪个化合物反应()A:环戊酮 B:乙酸甲酯 C:乙醛 D:丙酮答案:B7.醛、酮与α-卤代酯的有机锌试剂生成β-羟基酯的反应称为瑞福尔马斯基反应()A:对 B:错答案:A8.瑞福尔马斯基试剂除了与醛酮反应,还可以与酰氯、亚胺等亲电试剂发生反应()A:错 B:对答案:B9.铃木反应的机理经历了哪些过程()A:转金属 B:配体交换 C:还原消除 D:氧化加成答案:ABCD10.铃木反应过程中催化剂金属钯的化合价没有发生变化()A:对 B:错答案:B第四章测试1.罗宾逊环化可用于合成α, β-不饱和环酮()A:对 B:错答案:A2.在碱性条件下,丙二酸二乙酯与丙烯醛会发生()A:曼尼希反应 B:羟醛缩合反应 C:迈克尔加成反应 D:达村斯反应答案:C3.下列不能发生曼尼希反应的化合物是()A:甲胺 B:六氢吡啶 C:二甲胺 D:苯胺答案:D4.曼尼希反应的机理首先生成的是亚胺正离子中间体()A:对 B:错答案:A5.带有活泼α-氢的醛、酮与叔胺,以及不能发生烯醇化的醛或酮生成β-酮胺的反应称为曼尼希反应()A:对 B:错答案:B6.达村斯反应的机理是()A:负离子机理 B:协同机理 C:自由基机理 D:正离子机理答案:A7.在乙醇钠作碱的条件下,苯甲醛和α-溴代乙酸乙酯发生的是瑞福尔马斯基反应()A:对 B:错答案:B8.在碱性条件下,环戊酮与α-氯代乙酸乙酯反应生成()A:α, β-环氧酯B:β-羟基酯C:α-羟基酯D:α, β-不饱和酯答案:A9.狄克曼缩合是分子间的克莱森缩合反应()A:对 B:错答案:B10.下列化合物中,能发生相同克莱森酯缩合反应的是()A:丙酸乙酯 B:苯甲酸乙酯 C:甲酸乙酯 D:甲酸苯酯答案:A第五章测试1.频哪醇重排一般发生在()A:碱性条件 B:中性条件 C:酸性条件 D:上述条件都可以答案:C2.频哪醇重排中,迁移基团与离去基团处于反式的基团优先迁移()A:对 B:错答案:A3.发生频哪醇重排时,基团的迁移顺序是烷基>吸电子芳基>芳基>供电子芳基()A:错 B:对答案:A4.克莱森重排是协同机理的[3,3]迁移反应()A:错 B:对答案:B5.克莱森重排经过六元环船式过渡态,是立体专一性的反应()A:对 B:错答案:B6.酚醚也可以发生克莱森重排,如苯环邻位被占据,会发生第二次重排,得到烯丙基重排到对位的产物()A:错 B:对答案:B7.N-原子取代1,5-二烯的重排称为()A:氮杂克莱森重排 B:氮杂科普重排 C:霍夫曼重排 D:频那醇重排答案:B8.霍夫曼重排过程中形成了异氰酸酯中间体()A:对 B:错答案:A9.霍夫曼重排在碱性条件下进行,底物酰胺中不能带有对酸敏感的官能团()A:错 B:对答案:A10.霍夫曼重排经历了异氰酸酯中间体,如加入胺,反应得到的产物是()A:酰胺 B:氨基甲酸酯 C:伯胺 D:脲答案:D第六章测试1.邻二醇可被HIO4或者Pb(OAc)4氧化,断裂碳碳键,生成醛或酮()A:错 B:对答案:B2.环戊烯臭氧化(O3)后,经还原水解可以得到()A:环戊烯酮 B:戊二酸 C:环氧化物 D:戊二醛答案:D3.下列能将烯烃氧化成顺式邻二醇的是()A:四氧化锇B:酸性高锰酸钾 C:过氧化氢 D:臭氧化答案:A4.斯文氧化的副产物有哪些()A:一氧化碳 B:二甲基硫醚 C:二氧化碳 D:水答案:ABC5.斯文氧化是将伯醇氧化为酸,仲醇氧化为酮的好方法()A:错 B:对答案:A6.戴斯-马丁氧化反应完成后,体系中碘的化合价不会发生变化()A:对 B:错答案:B7.下列化合物不能发生戴斯-马丁氧化的是()A:烯丙醇 B:乙醇 C:叔丁醇 D:异丙醇答案:C8.β-氨基醇经戴斯-马丁氧化,得到产物ɑ-氨基醛()A:错 B:对答案:B9.巴顿脱氧反应的机理是()A:自由基机理 B:协同机理 C:碳正离子机理 D:碳负离子机理答案:A10.醇经黄原酸酯,然后通过自由基断裂得到脱羟基产物的反应称为巴顿-麦康比脱氧反应()A:错 B:对答案:B第七章测试1.不对称合成的方法有哪些()A:其余三个方法都是 B:使用手性源 C:使用手性辅基 D:使用手性催化剂答案:A2.利用下列哪种方法进行不对称合成时,原子利用率较高()A:使用手性源 B:使用手性催化剂 C:外消旋体的拆分 D:使用手性辅基答案:B3.使用手性源进行不对称合成时,一般直接从光学纯的原料出发合成对映体纯的产物,不容易发生消旋化()A:对 B:错答案:B4.假设某化合物的合成需要五步,且每步产率均为90%,分别采用线性合成路线和收敛路线时,哪个方法得到的最终产物收率更高()A:前者大于后者 B:前者等于后者 C:无法确定 D:前者小于后者答案:D5.在合成麻醉剂苯佐卡因时,由对氨基苯甲酸倒推为对硝基苯甲酸,采用的逆合成分析策略是官能团添加()A:对 B:错答案:B6.在对1,6-二羰基化合物进行逆合成分析时,通常采用的策略是将其倒推为环己烯()A:对 B:错答案:A7.在对目标分子进行逆合成分析时,一般选取分子中有官能团的地方进行切断()A:错 B:对答案:B8.下列反应可以用来构筑1,5-二羰基化合物的是()A:瑞福尔马斯基反应 B:迈克尔加成反应 C:铃木反应 D:维悌希反应答案:B9.在用环戊酮合成环戊基甲醛的过程中用到达村斯反应,该反应的原料通常是()A:醛、酮和α-卤代酯的有机锌试剂 B:具有α-H的醛、酮和α, β-不饱和化合物 C:醛、酮和α-卤代酸酯 D:具有α-氢的酮和酯答案:C10.下列哪个反应可以合成环状β-酮酸酯()A:瑞福尔马斯基反应 B:羟醛缩合 C:狄克曼缩合 D:曼尼希反应答案:C。
青岛科技大学《基础化学试题》 (1)

2007-2008 1 基础化学原理(B 卷) 化学院 孙雪梅应化,化学,海科等 许泳吉(答案写在答题纸上,写在试题纸上无效)一. 判断题:对者打“√”,错者打“×”(共10分,每题1分)1. 同一反应的反应进度因选用计算物质的不同而不同。
( )2. 热力学第三定律规定,在绝对零度时,任何理想晶体的熵值为零。
( )3. 金刚石比石墨稳定,所以金刚石的标准生成焓等于零 ( )4. 在定温定容下,反应NH 4Cl (s)NH 3 (g) + HCl (g)达平衡,加入惰性气体平衡不移动。
( )5. 速率方程式中浓度的指数与化学计量系数一致,则反应一定为基元反应。
( )6. 在酸碱滴定终点时,指示剂呈其酸式色或其碱式色。
( )7. 沉淀能否转化及转化的程度,取决于两种沉淀溶度积的相对大小。
类型相同时,sp θK 大的沉淀容易转化成sp θK 小的沉淀。
( )8. 标准氢电极的电池符号可以表示成:H + (0.1 mol·L -1)│H 2(101.325 kPa ),Pt (+) ( )9. 因为2θCl /Cl 1.36V -=ϕ,22θMnO /Mn 1.23V +=ϕ, 由此说明MnO 2不能氧化HCl 而生成Cl 2。
( )10. 氧化还原指示剂的变色范围为pH=0.059n'±ϕ ( ) 二. 填空题(共30分,每空1分):1. 已知AgBr 的标准摩尔生成焓为-100.4 kJ·mol -1,请写出热化学反应方程式 。
2. 已知反应 C (石墨,s) + O 2 (g) = CO 2 (g) θr m ΔH (1) = –393.5 kJ·mol -1CO (g) + 1/2 O 2 (g) = CO 2 (g) θr m ΔH (2) = –283.0 kJ·mol -1求反应C (石墨,s) + 1/2 O 2 (g) = CO (g)的θr m ΔH =3. 化学反应速率的大小,首先取决于反应物的本性,除此之外,反应速率还与反应物的 , 与 等因素有关。
《基础化学Ⅱ》课程标准

《基础化学Ⅱ》课程标准课程代码:B0300103 课程类别:专业基础课授课系(部):制药与环境工程系学分学时: 82学时一、课程定位与作用1.课程的定位:《基础化学Ⅱ》是工业分析技术、药品质量与安全、食品营养与检测、食品生物技术等专业学生的一门重要的专业基础课程,主要研究有机化合物。
本课程以有机化合物的基本知识、基本理论和基本技能为主线,阐述了烃类、卤代烃、醇、酚、醚、醛、酮、羧酸及其衍生物等有机物的结构和性质。
2.课程的作用:通过本课程的教学,要求学生掌握与专业相关的有机化学基础理论知识和基本操作技术、从事化工、药品、食品等生产工作必需的基本知识和操作技能,确立正确的“有机”的理念,提高学生分析和解决问题的能力,培养实事求是的科学态度和认真细致的工作作风,为学习后续课程或实际工作打下良好的基础。
3.与其他课程的关系:《基础化学Ⅱ》的前导课程是《基础化学Ⅰ》,后续课程有工业分析技术专业的《有机产品分析》、药品质量与安全专业的《药物化学》、《药物分析》、《药物合成技术》、食品营养与检测专业、食品生物技术专业的《食品营养与检测》等。
二、课程目标通过对《基础化学Ⅱ》课程的学习,使学生获得从事化工、药品、食品等生产工作必需的有机化学基本理论、基础知识,注重培养学生的基本技能,应用所学的知识分析和解决化工、药品、食品等生产中的实际问题,为学习专业课和毕业后从事相关工作,打下坚实的基础。
1.知识目标(1)学习有机化合物的特性及其结构的特点,掌握其系统命名法。
(2)掌握各类有机化合物的结构与性质的内在关系及其变化规律。
(3)熟悉自由基取代、亲电加成、亲电取代、亲核取代、亲核加成反应机理,并能运用电子效应、空间效应理解有机化合物的变化规律。
(4)熟知进行有机化合物的制备的基本思路和确定合成路线的原则。
(5)熟悉立体化学的基本知识、糖类等天然有机化合物的性质。
2.能力目标(1)学生能进行简单的物质推断,写出结构简式。
青岛科技大学 化学期末

是(±K = ℉ − 32 x 5 9 + 273.15). 2)根据(同离子)效应可制成缓冲溶液, 缓冲溶液能抵抗外加少量酸、 碱或稀释对溶液的影响, 并使其 pH 基本保持不变。 3)理想溶液指(无限稀溶液)。饱和溶液指溶剂和溶质之间达到(动态)平衡的溶液。 4)布朗特酸通常作为质子( 给体),布朗特碱通常作为( 受体)。 5)化学反应等温方程式( Δ FGm =-RTln Kβ+RTln J), 若 J<K'表示( 化学反应正常进行), J=K' 表示( 化学反应动态平衡),J>K'表示( 化学反应逆向进行 )。 6 考)所谓状态函数的变化仅取决于(系统的起始状态和终止状态) 。 7 考)已知 CO2(g)+C(s)=2CO(g),Δ H>0,如果压力、体积不变,降低温度则 Kθ (减小) , 反应移动方向 ( 逆向 ) , 反应正向速率 ( 减小 ) , 如果温度不变增大总压则 Kθ( 不变 ) , 反应移动方向( 逆向 ) ,反应正向速率( 减小 ) 。 8)通常情况下,沉淀溶解平衡满足三个条件①( 液态)相平衡②对立溶液是( 饱和溶液)③液 固相界面必须达到沉淀过程和溶解过程的( 动态平衡)。 9 考) 根据酸碱质子理论: (凡是能给出质子) 的物质是酸, (凡是能接受质子) 的物质是碱。 10 考)在实际气体的范德华数学方程中,若体积修正一项为 b,则压力修正项为( 2 ) 。 ������ 11)根据化学反应动力学规定,催化剂的存在并不改变反应历程,而仅仅降低( 反应的活 化能 ) 13 考)根据反应 3A→B→2C,生成 1mol 物质 C 时的反应进度为( δ(c)=0.5mol ) 14 考 ) 在 沉 淀 平 衡 中 , 所 谓 完 全 沉 淀 平 衡 的 条 件 是 指 对 应 阳 离 子 浓 度 必 须 小 于 ( 1.0x10-5mol ) 。 15)对于任意化学变化,恒压热效应为 Q=Δ rH,恒容热效应 Q=Δ mol·L-1 的 Na2CO3 写出质子条件式 电荷平衡:[Na+]+[H2O-]=[OH-]+[HCO3-]+2[CO32-] 物料平衡:[H2CO3]+[HCO3-]+[CO32-]=c und [Na+]=2c
青岛科技大学化学工程与工艺专业材料清单

青岛科技大学化学工程与工艺专业材料清单青岛科技大学化学工程与工艺专业资料清单教员近5年编写出版的教材清单1. 化工原理学习指点唐继国2001.10 陆地大学出版社2. 化工原理赵文2001.9 石油大学出版社3. 物理化学实验滕虹霓2002.8 化学工业出版社4. 基础无机化学〔化工专业〕杨丰科2001.9 化学工业出版社近5年教员出版的专著清单1.化学化工物性数据手册〔无机卷〕董殿权2002.4 化学工业出版社2.进程系统工程词典韩方煜2002.4 中国石化出版社3.工业水回用及废水最小化〔译〕项曙光2001.12 中国石化出版社4.固体酸催化剂与精细化工于世涛2006.4 化学工业出版社教员近5年宣布的主要教学研讨论文清单1.殷树梅, 改良专业课教学方式,培育创新型科技人才,2001中国现代教育论坛,89-902.王晓红等,基于MATLAB的化工单元操作图形演示模块开发,计算机与运用化学,2001,18〔4〕:373-3763.王晓红等,基于PowerBuilder 的化工原理查询软件的开发与完成,青岛化工学院学报,2001,22〔3〕:2394.叶臣等,化工原理多媒体课件的开发及运用,初等文科教育,2002,〔教育教学研讨专集〕156-1575.赵文等,化工类专业CAI课程体系的研讨,化工初等教育,2002,1:82-836.周传光等,化学工程与工艺课程体系树立的探求与实际,化工初等教育,2002,2:22-257.岳学海等,化工专业CAI系统的研讨与开发,青岛化工学院学报,2002,3:85-888.王犇等,选修课中的探求式教学形式的研讨,现代教学与管理,2003,3〔11〕:8-99.岳学海等,课堂教学CAI体系的构建与实施,航空教育,2004,1:105-10810.岳学海等,MATLAB在化工计算CAI中的运用,实验室研讨与探求,2003,3:78-7911.田文德等,化工原理精馏进程的计算机辅佐计算,计算机与运用化学,2005,10:925-92812.田文德等,化工原理实验装置的数据采集,化工初等教育〔已接受〕13.王许云等,深化化工原理课程革新的实际,高教研讨〔已接受〕近5年承当的省、部级教学革新项目清单1.陈学玺等,化学工程与工艺教学革新试点专业2001年山东省教育厅2.王晓红等,化工原理教学革新试点课程2001年山东省教育厅近5年教员在中心期刊宣布的主要论文清单说明: 局部教员的论文没有统计在内。
基础化学准研究性实验——BaCl2·2H2O中钡的质量分数及硫酸钡溶度积常数的测定

基础化学准研究性实验——BaCl22H2O中钡的质量分数及硫酸钡溶度积常数的测定解从霞;于莹;张振英;王小燕;张书圣【摘要】准研究性实验是指在教师指导下的研究性实验.开设准研究性实验有利于培养学生的创新能力.在BaCl2·2H2O中钡的质量分数wBa的测定(重量法)实验中,就沉淀条件对生成的硫酸钡(BaSO4)的沉淀的状态、wBa以及进一步测定BaSO4的溶度积常数(Kθsp,BaSO4)的影响进行了相关性研究.该实验集化学分析和仪器分析于一体,可作为基础化学(无机及分析化学)实验准研究性实验开设.【期刊名称】《实验技术与管理》【年(卷),期】2010(027)012【总页数】4页(P151-153,157)【关键词】基础化学实验;准研究性实验;综合性实验【作者】解从霞;于莹;张振英;王小燕;张书圣【作者单位】青岛科技大学,化学与分子工程学院,山东,青岛266042;青岛科技大学,化学与分子工程学院,山东,青岛266042;青岛科技大学,化学与分子工程学院,山东,青岛266042;青岛科技大学,化学与分子工程学院,山东,青岛266042;青岛科技大学,化学与分子工程学院,山东,青岛266042【正文语种】中文【中图分类】G642.423Abstract:The quasi-research experiment is a kind of research experiments under the guidance of teachers.Establishment of quasi-research experiments is beneficial to cultivation of students’creativity.With regard to determinatio n of barium mass fraction(wBa)of BaCl2·2H2O by means of gravimetric method,the effect of precipitation conditions on the state of generated barium sulfate(BaSO4)precipitation,wBaand further determination of solubility product constant of BaSO4(Kθsp,BaSO4)i s correlatively studied.This experiment gathers chemical analysis and instrumental analysis in integral whole and can be established as a quasi-research experiment of basic chemistry experiment(including inorganic and analytical chemistry).Key words:basic chemistry experiment;quasi-researchexperiment;comprehensive experiment教育部在《关于进一步加强高等学校本科教学工作的若干意见》中指出:“积极推动研究性教学,提高大学生的创新能力”,“要增加综合性与创新性实验”,“引导大学生了解多种学术观点并开展讨论,追踪本学科领域最新进展,提高自主学习和独立研究的能力”[1]。
化学类专业及院校介绍

化学类专业及院校介绍1.化学主干学科:化学主要课程:无机化学、分析化学(含仪器分析)、有机化学、物理化学(含结构化学)、化学工程基础等。
包括生产实习、毕业论文等,一般安排10~20周。
培养目标本专业培养具备化学的基础知识、基本理论和基本技能,能在化学及与化学相关的科学技术和其它领域从事科研、教学、技术及相关管理工作的高级专门人才。
培养要求本专业学生主要学习化学方面的基础知识、基本理论和基本技能与方法,受到科学思维和科学实验的训练,具有一定的科学研究、应用研究及科技管理的能力。
就业方向1.掌握数学、物理等方面的基本理论和基本知识;2.掌握无机化学、分析化学(含仪器分析)、有机化学、物理化学(含结构化学)及化学工程的基础知识、基本原理和基本实验技能;3.了解相近专业的一般原理和知识;4.了解国家关于科学研究、化学相关产业的政策,国内外知识产权等方面的法律法规;5.了解化学某些领域的理论前沿、应用前景和最新发展动态以及化学相关产业发展状况:6.掌握中外文资料查询、文献检索及运用现代信息技术获取相关信息的基本方法;具有一定的实验设计,创造实验条件,归纳、整理、分析实验结果,撰写论文,参与学术交流的能力。
开设院校[北京]清华大学[广东]中山大学[上海]复旦大学[北京]北京理工大学[北京]中国人民大学[河南]郑州大学[吉林]吉林大学[江苏]苏州大学[天津]南开大学[湖南]湖南大学[重庆]西南大学[山东]中国海洋大学[四川]成都理工大学[山东]青岛科技大学[北京]北京师范大学[广东]广州大学[北京]中国农业大学[上海]华东师范大学[甘肃]兰州大学[陕西]西北大学[河北]河北大学[辽宁]辽宁大学[安徽]安徽大学[四川]西南石油大学[辽宁]大连大学[河南]河南大学[北京]中央民族大学[江苏]扬州大学[天津]天津师范大学[四川]四川师范大学[广东]华南师范大学[湖北]华中师范大学[浙江]宁波大学[湖南]湘潭大学[山东]山东师范大学[江苏]南京工业大学[江苏]江苏大学[湖南]湖南师范大学[上海]上海师范大学[江苏]南京师范大学[云南]云南大学[广西]广西大学[黑龙江]黑龙江大学[吉林]东北师范大学[浙江]浙江师范大学[陕西]陕西师范大学[新疆]石河子大学[陕西]陕西科技大学[黑龙江]东北林业大学[浙江]杭州师范大学2.应用化学主干学科:化学主要课程:无机化学、分析化学(含仪器分析)、有机化学、物理化学(含结构化学)、化学工程基础及化工制图。
青岛科技大学试题分析化学

考生答题须知1.所有题目(包括填空、选择、图表等类型题目)答题答案必须做在考点发给的答题纸上,做在本试题册上无效。
请考生务必在答题纸上写清题号。
2.评卷时不评阅本试题册,答题如有做在本试题册上而影响成绩的,后果由考生自己负责。
3.答题时一律使用蓝、黑色墨水笔或圆珠笔作答(画图可用铅笔),用其它笔答题不给分。
4.答题时不准使用涂改液等具有明显标记的涂改用品。
一.选择题(本大题共25个小题,每题2分,共计50分)1.下列情况所引起的误差中,不属于系统误差的是----------------------------------------( )。
A 、移液管转移溶液后残留量稍有不同;B 、称量时使用的砝码锈蚀;C 、天平的两臂不等长;D 、试剂里含有微量的被测组分2.测定次数一定时,置信度越高,则平均值的置信区间-----------------------------------( )。
A 、越宽;B 、越窄;C 、不变;D 、不一定3.国产化学试剂有四个等级标准,表示分析纯试剂的符号是-----------------------------( )。
A 、G.R.;B 、C 、P .; C 、A 、R.;D 、L.R.4.采用无水碳酸钠基准物质标定HCl 溶液浓度的计算式为c NaOH =(0.1073210625.67⨯⨯⨯1000)mol ⋅L -1。
其结果(单位:mol ⋅L -1)正确的是(已知231106Na CO M g moL -=⋅ ) ------------------------( )。
A 、0.079;B 、0.0789;C 、0.07887;D 、0.85.用EDTA 滴定Ca 2+,Mg 2+时,为消除Fe 3+的干扰,应选用的掩蔽剂是------------------------( )。
A 、KCN 或抗坏血酸;B 、盐酸羟胺或三乙醇胺;C 、三乙醇胺或KCN ;D 、盐酸羟胺或抗坏血酸6.用K 2Cr 2O 7做基准物质标定Na 2S 2O 3溶液浓度是基于K 2Cr 2O 7与KI 反应,析出的I 2用Na 2S 2O 3滴定。
青岛科技大学2015年硕士研究生招生专业目录_文彦考研

或 202 俄语或 203 日语或 245 德 物化学②造纸原理与工程或微
成与应用 05 造纸湿部化学 06 加工纸与特种纸 07 微生物发酵 15 语 B③302 数学二④835 化工原理 生物复试笔试科目:制浆原理与
与生化工程 08 生物制药 09 生物技术在食品中的应用 10 酿酒科
或 839 植物纤维化学或 837 发酵 工程或生物制药工艺学或分子
080502 材料学 01 表面工程技术 02 功能纳米材料的开发与应 用 03 金属材料的腐蚀与防护 04 复合镀技术 05 高性能复合材料 5 的制造与性能研究 06 金属基复合材料
①101 思想政治理论②201 英语一 同等学力加试:工程材料性能
或 202 俄语或 203 日语或 245 德 学、工程力学复试笔试科目:工
语 B③302 数学二 ④821 高分子 笔试科目:高分子材料加工基础 先进成型加工技术
化学与物理
085204 材料工程(专业学位) 01 高分子材料与工程
①101 思想政治理论②202 俄语或
同等学力加试:橡胶工艺学、塑
203 日语或 204 英语二或 245 德语
35
料成型工艺学、;复试笔试科目:
或 202 俄语或 203 日语或 245 德
10
试科目:工程材料学 06 方向:
的合成及合成设备的研制技术 06 模具技术 07 材料加工设备
语 B③302 数学二④825 材料力学
同等学力加试:同 080200 复试
及其自动化
或 827 金属学与热处理
笔试科目:机械原理
080700 动力工程及工程热物理 01 强化传热新技术及其设备
成
语 B③624 药物化学综合④--无 生物制药工艺学
青岛科技大学《基础化学试题》 (15)

A2,1,–1, ;B2,0,0,– ;C3,1,1,– ;D3,2,–1, .
2.基态电子构型如下的原子中,原子半径最大的是()
A1s22s2;B 1s22s22p5;C1s22s22p1;D1s22s22p63s2.
3.下列对物质晶格能U大小的描述正确的是()
15.实验室中通常用棕色环反应鉴定NO3-,方法是向溶液中加入少量FeSO4,小心加入.在溶液的界面上会出现棕色环。
16.
17.由于Sb3+很容易,因此在配制其盐溶液时,要加足量相应的酸以抑制上述副反应的发生。
17.有一无色硝酸盐溶液A,具有下列性质:1)加入氨水,生成白色沉淀B;2)滴加KI溶液,先生成桔红色沉淀C,当KI过量,则桔红色沉淀消失,生成无色溶液D,在D溶液中加入浓KOH溶液与物质E反应可生成特殊的红棕色沉淀,通常用此方法来鉴定E。请写出A~E各为何种化合物:
0.5分
1分
1分
1分
7.金属指示剂的作用原理是其酸式色和碱式色显著不同。()
8.吸光光度法中选择最大吸收波长的原因是有色物质只在最大吸收波长处有吸收。()
9.气相色谱法的速率理论认为,涡流扩散项与载气的性质、线速度和组分无关。()
10.在气相色谱图的色谱峰上,半峰宽度就是峰底宽度的一半。()
二.选择题(共30分,每题1.5分)
A同种元素形成的化学键,正负电荷重心重合,属极性键;
B极性分子内不一定有极性键;
C当溶质和溶剂分子间形成氢键时,溶质的溶解度会增大;
D色散力只存在于非极性分子之间。
6.下列晶体中熔点最高的是()
A干冰;B NaCl;C金刚石;D Fe.
7.下列分子中,有极性的分子是()
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
选择题(单选, 共27分每空1.5分)1. 下列说法正确的是( )A.体系的焓等于恒压反应热。
B. 体系的焓等于体系的热量C. 体系的焓变等于恒压反应热。
D. 最稳定单质的焓值等于零.2. 在标准状态下热力学数据不为零的是( )A. (Al(s))B. ( Al(s))C. (Br2 (l))D. (Br2 (l))3. 一个能在低温下自发,而在高温下非自发的反应,则△H , △S的值应是()A. △H <0, △S<0B. △H >0, △S>0C. △H< 0, △S>0D. △H >0, △S<04. 反应A(g)+2B(g) →2C(g), △H<0,若想提高A(g)的转化率采用的方法有()A. 高温高压B. 低温低压C. 低温高压D. 高温低压5. 判断下列各过程中,哪种情况的△U最大( )A. 体系放出60 kJ的热,并对环境做了40 kJ的功B. 体系吸收60 kJ的热,环境对体系做了40 kJ的功C. 体系吸收60 kJ的热,并对环境做了40 kJ的功D. 体系放出60 kJ的热,环境对体系做了40 kJ的功6. 下列叙述正确的是:( )A. 催化剂可提高化学反应的转化率。
B. 反应的活化能越大,在一定温度下反应速率越大C. 反应速率常数只取决于温度,与反应物,生成物浓度无关。
D. 在任何情况下,反应速率在数值上等于反应速率常数7. 下列物质中能用酸碱滴定法直接准确滴定的是( )A. NaF(HF的=6.31×10-4 )B. H3BO3 ( = 5.7×10-10)C. 苯酚钠(苯酚的=1.1×10-10)D. NH4Cl ( NH3水的=1.8×10-5)8. 已知在1mol/l的H2SO4溶液中,= 1.45v, = 0.68v,在此条件下,用KMnO4标准溶液滴定Fe2+,其化学计量点的电位值是( )A. 0.38 VB. 0.73 VC. 0.89 VD. 1.32 V10. 在下述情况下计算溶液pH值时应采用的最简式是:1)用NaOH 标准溶液滴定HAc至终点时( )2)用HCl 标准溶液滴定Na2CO3至甲基橙变色时( )3)用NaOH 标准溶液滴定H3PO4至甲基橙变色时( )4)10.0ml 0.1mol/ L HAc与15.0 ml 0.1 mol/ L NaAc混合时()A. [H+] =B. [H+] =C. [H+] =D. [H+]=Ka?C酸/C碱E. [H+] =F. [H+] =11. 下列电对中,标准电极电势(??)最大的是( )A. Ag+/AgB. [Ag(NH3)2]+/AgC. AgI/AgD. AgBr/Ag二填空题(共33分每空1分)1. 化学反应等温方程为___________________, 当__________时反应正向进行。
2. 已知反应N2 (g) +2O2 (g) = 2NO2 (g) , = 66.36 kJ/mol , 则NO2 (g)的= ______。
3. 所谓基元反应是指_____________________,若aA + bB →xX + yY是基元反应, 则动力学方程为_________________。
加入催化剂可加快反应速率,这是因为___________________。
4. 在298K 标准状态下,氢气和碘蒸汽反应生成1mol 碘化氢气体吸收26.5KJ热量,其热化学方程为____________________________。
5. 已知= 0.54v , = 1.36v , = 1.07v ,其中最强的氧化剂是____最强的还原剂是_______,将氯水慢慢加入含Br-, I-溶液中,首先析出的是_________。
6. 反应+5Fe2+ + 8H+ ? Mn2+ + 5Fe3+ + 4H2O(已知=1.51v, = 0.771v), 反应方向是________进行,将上述反应设计成原电池,电池符号是____________,在298K, [H+] = 10.0mol/ L,其他离子浓度都为1.0 mol/ L时,该电池的电动势是__________。
7. H2C2O4( = 10-2, = 10-5)不能分步滴定的原因是_______________,可用标准溶液直接滴定到第二化学计量点的原因是_________________,可选__?________做指示剂。
8. 在氧化还原滴定中,为了加快反应速率,常采取的方法是_______,_______,_________。
9. 间接碘法可测定具有_____性的一类物质,以K2Cr2O7为基准物标定Na2S2O3标准溶液的反应方程式为___________________ ,_______________________。
13. 酸碱指示剂的理论变色点为pH = ________,变色范围为pH = _________,指示剂的选择原则是________________________。
12. 要配制pH = 9.0的缓冲溶液,最适宜的缓冲对是( )A. HCOOH―HCOO-(=1.0×10?4 )B. HAc―Ac- ( = 1.8×10?5 )C. NH3―NH4+ ( =1.8×10?5 )D. HPO42-―PO43-( = 4.8×10?13 )13. 重量法测定铝时,将铝沉淀为氢氧化铝,经高温灼烧得Al2O3称其重量, 则铝的换算因数为( )A. B. C. D.14. 欲以氧化剂滴定还原剂, 滴定反应为Ox1 + Red2 = Red1 + Ox2 (假设n1 = n2 =1), 若要求反应完全程度在99.9%以上,则平衡常数最小应为( )A. 108B. 6C. 105D. 10615. 某混合碱溶液,先以酚酞为指示剂,用HCl标准溶液滴定,耗去V1ml,继以甲基橙为指示剂,又耗去V2ml,若V1 <V2,则混合碱组成是( )A. NaOH, Na2CO3B. Na2CO3, NaHCO3 C NaOH, NaHCO3 D KOH, NaOH三解答下列问题(共10分每小题2分)1. 完成并配平下列方程式(在酸性溶液中)①+ Mn2+ + CO2②I2 + ClO-+ Cl-③H3PO2 + H3PO4 + Cr3+2. Br2在碱性介质中的电位图为:??B/V: BrO-0.45 Br2 1.066 Br-①计算= ?②判断哪种物质能发生歧化反应,写出配平的反应方程式。
四计算题(30分,1、3题8分;2、4题7分)1. 在100 ml 0.20 mol/L MnCl2溶液中加入等体积的含有NH4Cl 的1.0 ×10-2mol/L NH3?H2O,问在此氨水溶液中需含多少克NH4Cl,与MnCl2溶液混合时才不致产生Mn(OH)2沉淀?(已知=1.9×10-13,=1.80×10-5,)2. NH3(g)的标准摩尔生成吉布斯函数= -16.45 kJ/mol, 判断反应N2(g) +H2(g) ? 2NH3(g)在298K标准状态下能否自发进行(通过计算说明原因)。
并计算在298K时该反应的标准平衡常数Kθ。
3.为了测定PbSO4的溶度积常数,设计下列两个电对组成的原电池:-) Pb, PbSO4(s)∣(1.0 mol/ L)‖Sn2+(1.0 mol/ L )∣Sn (+ ,在298K时测得该原电池的Eθ= 0.22v, 求。
(已知= - 0.138v, = - 0.126v )4. 0.5000g 铬铁矿样品,经处理将铬转化成,加入0.1200 mol/L的(NH4)2Fe(SO4)2标准溶液50.00 ml后,剩余的Fe2+用K2Cr2O7滴定,用去15.00 ml,已知= 0.006000 g/ml,计算样品中Cr 的百分含量?(已知MCr= 52.00, MFe= 55.85) 一. 判断题:对者打“√”,错者打“×”(共10分,每题1分)1.同一反应的反应进度因选用计算物质的不同而不同。
()2.热力学第三定律规定,在绝对零度时,任何理想晶体的熵值为零。
()3.金刚石比石墨稳定,所以金刚石的标准生成焓等于零()4.在定温定容下,反应NH4Cl (s) NH3 (g) + HCl (g)达平衡,加入惰性气体平衡不移动。
()5.速率方程式中浓度的指数与化学计量系数一致,则反应一定为基元反应。
()6.在酸碱滴定终点时,指示剂呈其酸式色或其碱式色。
()7.沉淀能否转化及转化的程度,取决于两种沉淀溶度积的相对大小。
类型相同时,大的沉淀容易转化成小的沉淀。
()8.标准氢电极的电池符号可以表示成:H+ (0.1 mol?L?1)│H2(101.325 kPa),Pt(+)()9.因为, , 由此说明MnO2不能氧化HCl而生成Cl2。
()10..氧化还原指示剂的变色范围为pH= ()二. 填空题(共29分,每空1分):1. 已知AgBr的标准摩尔生成焓为-100.4 kJ?mol-1,请写出热化学反应方程式。
2. 已知反应C (石墨,s) + O2 (g) = CO2 (g) (1) = –393.5 kJ?mol-1CO (g) + 1/2 O2 (g) = CO2 (g) (2) = –283.0 kJ?mol-1求反应C (石墨,s) + 1/2 O2 (g) = CO (g)的=3. 化学反应速率的大小,首先取决于反应物的本性,除此之外,反应速率还与反应物的,与等因素有关。
4. 化学平衡具有的两个特点一是平衡,二是平衡。
5. 已知H2S 的两级离解常数分别是NiS的溶度积常数为,反应Ni2+ + H2S = NiS↓+ 2 H+ 的平衡常数。
6. 精密度的好坏用来衡量,测定SiO2 的质量分数,得到,其平均值为,则相对平均偏差= 。
7. 衡量弱酸酸性强弱的常数是,当该常数的数值越大,说明该酸的酸性越(强或弱)。
8. 写出NH4HCO3水溶液的质子条件式:。
9. 已知H3PO4的= 2.16, = 7.21,= 12.32。
则的。
用0.1000 mol?L-1 NaOH 滴定等浓度的H3PO4有个滴定突跃,第一化学计量点的pH= 。
10.取一定量的混合碱试样(NaOH、NaHCO3、Na2CO3或其混合物),用HCl标准溶液滴定,用酚酞作指示剂,终点时消耗HCl溶液V mL;另取一份等量试样用甲基橙作指示剂,终点时消耗HCl溶液2 V mL。
则混合碱的组成为。
11.重量法测Al的含量,已知MAl =26.98,101.96,则铝的换算因数F= 。
