《缩合反应实例》PPT课件
合集下载
第二章酸催化缩合反应PPT课件

(CH3)2C CH2
FeCl3
C(CH3)3 89%
2.2.1芳烃的Friedel-Crafts烷基化反应
是合成烷基苯的一种重要方法。芳香族化合物在三 氯化铝或其他Lewis酸催化下,可与卤代烷发生 烷基化反应。
.
8
R'
+ RXAlCl3 R'
+R
X AlCl3
H
R'
R + X -AlCl3 -H R'
(CH3)2N CH2
.
2
C+稳定性大小取决于所带电荷的分散程度, C+的正电荷愈分散,其结合电子的能力就愈
弱,也就愈显得稳定。稳定性由大到小:
CH3 < CH3CH2 < CH3 CH CH3 < C(CH3)3
由于碳正离子缺电子,它所进行的一些反应都是为C+提供一 对电子,使它满足8偶体的结构,反应有:
CH2 CH3 ZnO 600℃
C H
CH2
例1 以浓硫酸为催化剂,2-甲基-3-氯丙烯 在室温下与苯反应可顺利生成烷基化产物。
Cl
+
H2SO4
Cl 70%~73%
.
16
2.2.3Friedel-Crafts酰基化反应
芳烃及其衍生物通过酰基化反应可以制得酮、醛、 羧酸、胺等,但主要用于醛、酮的合成。它在形成 新碳键的同时,将酰基引入到了芳环上。
丙烯与苯反应,合成重要的工业原料乙苯、
异丙苯等。
C2H4 + C6H6
AlCl3 40~100 ℃
C6H5CH2CH3
C3H6 + C6H5
AlCl3 40~100 ℃
第三章缩合反应CondensationReaction课件

8
(2) 酸催化的反应机理: (酸催化应用不多)
O RH2C C R' + HA
RH2C
OH C R'
OH RH2C C R' + A
OH -H
RH2C C R'
OH RHC C R'
OH RHC C R'
RH2C
OH C R' + RHC
限速步骤
OH C R'
OH
OH
RH2C C HC C R'
O
慢
C H + OH
O
O
CH CH2 C H
O
CH2 C H
快
+O
CH3 C H
+ 快
H2O
OH
O
CH3 CH CH2 C H + OH
H2O
O
CH3CH CH2 CH
3
4
5
对于活性醛,反应温度 较高或催化剂的碱性较 强,有利于进行消除脱
水得α, β-不饱和醛
NaOH 25℃
OH CHO
CHO
H3CO
H3CO OCH3
Ph OCH3
OCH3 OCH3
30
二、不饱和烃的α-羟烷基化反应(Prins反应)
1、定义与反应过程
在酸催化下,甲醛(等其它醛)和烯烃加成得到1,3-二醇 或进一步和甲醛反应生成环状缩醛(1,3-二氧六环)的反应称 为Prins(甲醛-烯加成)反应。
CH2O + H
CH2OH
13
CH3CH2CHO + (CH3)2CHCHO
NaOH 25 oC
CH3 H3CH2CHC C CHO
(2) 酸催化的反应机理: (酸催化应用不多)
O RH2C C R' + HA
RH2C
OH C R'
OH RH2C C R' + A
OH -H
RH2C C R'
OH RHC C R'
OH RHC C R'
RH2C
OH C R' + RHC
限速步骤
OH C R'
OH
OH
RH2C C HC C R'
O
慢
C H + OH
O
O
CH CH2 C H
O
CH2 C H
快
+O
CH3 C H
+ 快
H2O
OH
O
CH3 CH CH2 C H + OH
H2O
O
CH3CH CH2 CH
3
4
5
对于活性醛,反应温度 较高或催化剂的碱性较 强,有利于进行消除脱
水得α, β-不饱和醛
NaOH 25℃
OH CHO
CHO
H3CO
H3CO OCH3
Ph OCH3
OCH3 OCH3
30
二、不饱和烃的α-羟烷基化反应(Prins反应)
1、定义与反应过程
在酸催化下,甲醛(等其它醛)和烯烃加成得到1,3-二醇 或进一步和甲醛反应生成环状缩醛(1,3-二氧六环)的反应称 为Prins(甲醛-烯加成)反应。
CH2O + H
CH2OH
13
CH3CH2CHO + (CH3)2CHCHO
NaOH 25 oC
CH3 H3CH2CHC C CHO
有机合成课件6章(缩合反应)
OH
2CH3COCH3 Ba(OH)2 CH3COCH2C(CH3)2 I2 CH3COCH=C(CH3)2
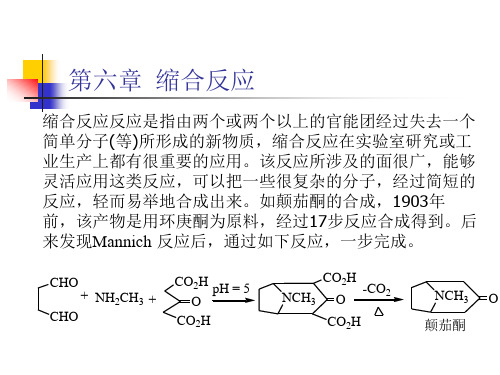
第六章 缩合反应
甲醛和苯甲醛不含α-H,可以和含活泼α-H的醛或酮缩合:
O
HC-O + CH3CHO
[HOCH2CH2CHO]
CH2=CH-CHO
Ph CH=O + CH3COCH3
HO Ph-C=C-C-CH3
NaOC2H5 NaOC2H5
PhCH CO2C2H5 CHO
PhCH(CO2C2H5)2 86%
如果把醛或酮滴加入不含活泼α-氢的酯溶液中,由于酯本身 不能自身缩合,而醛(酮)本身浓度很小,自身缩合的机会很 小,此时仍能得到较高收率的缩合产物。
第六章 缩合反应
如: PhCO2C2H5 + CH3COPh
O
PhCOCl H2N CH2CO2H
PhCONH CH2CO2H -H2O
O
N
PhCHO
Ph CH
O O
还原
H2 Ph C
O O
Ph
CH3CO2K
N Ph
Ph CH2 C CO2H NH
PhCH
O H2O Ph CH2 C CO2H
N
Ph
H2O C CO2H
H2O
NH2
PhCH2CH CO2H
NH COPh
CHO (CH3CO)2O KOCOCH3
CH=CH CO2H
这是制备肉桂酸的基本方法。能发生类似反应的还有其它醛。
(CH3CO)2O O CH O KOCOCH3
O CH=CH CO2H 65~70%
第六章 缩合反应
O2O2N 80%
(12)缩合反应ppt课件

该类反应需在缩合剂或催化剂酸、碱、盐、金属、醇钠等存在下才能顺利进行, 这里我们选择一些重要的缩合反应进行讨论。 12.1 醛酮缩合反应 12.1.1 羟醛缩合( Aldol缩合、醇醛缩合)
含有活泼氢的醛或酮在碱或酸的催化下生成β-羟基酮的反应称为Aldol缩合反应, 即醛醇缩合反应,包括醛-醛缩合、酮-酮缩合、醛-酮交叉缩合三大类。
O
OH
RCH+OH 亲 核 加 成 RCH
Cannizzaro反应也可发生在两个不同的无α-氢的醛分子间,O当其中之一为甲醛时,
总是O H 甲醛被氧化δ O ,-而另一醛被还原成醇。 O H H R C H + R C H 氢 转 移 ,亲 核 加 成 R C + R C H
O N a H R C + R C H
发生交叉缩合反应,它可能生成四种产物,但是通过可逆平衡可以主要生成一种 产物。如:
10
9
O
O
OH O
碱 催 化
CH3 C + CH3 C CH2CH3
CH3 C CH2 C CH2CH3
CH3
CH3
O
O
3)醛消 醛除 酮酮脱 交缩水 叉合缩C 合H既3 可C CH 以3得CH 到βC -羟基CH 醛2,CH 又3可催 以化 得加 到氢 β-羟CH 基3酮C ,C H H 不3易CH 得2到C 单一C 产H2 物C,H3
H
C
C
H COCH3
COC6H5
H2SO4
COCH2C6H5
11
C6H5
C6H5
O
12
O
+ CH3 C CH3
O
C HO
N a O H /H 2 O C HO
含有活泼氢的醛或酮在碱或酸的催化下生成β-羟基酮的反应称为Aldol缩合反应, 即醛醇缩合反应,包括醛-醛缩合、酮-酮缩合、醛-酮交叉缩合三大类。
O
OH
RCH+OH 亲 核 加 成 RCH
Cannizzaro反应也可发生在两个不同的无α-氢的醛分子间,O当其中之一为甲醛时,
总是O H 甲醛被氧化δ O ,-而另一醛被还原成醇。 O H H R C H + R C H 氢 转 移 ,亲 核 加 成 R C + R C H
O N a H R C + R C H
发生交叉缩合反应,它可能生成四种产物,但是通过可逆平衡可以主要生成一种 产物。如:
10
9
O
O
OH O
碱 催 化
CH3 C + CH3 C CH2CH3
CH3 C CH2 C CH2CH3
CH3
CH3
O
O
3)醛消 醛除 酮酮脱 交缩水 叉合缩C 合H既3 可C CH 以3得CH 到βC -羟基CH 醛2,CH 又3可催 以化 得加 到氢 β-羟CH 基3酮C ,C H H 不3易CH 得2到C 单一C 产H2 物C,H3
H
C
C
H COCH3
COC6H5
H2SO4
COCH2C6H5
11
C6H5
C6H5
O
12
O
+ CH3 C CH3
O
C HO
N a O H /H 2 O C HO
有机反应反应机理缩合反应PPT课件

O CH3CCH3
Ba(OH)2
OHO (CH3)2CCH2CCH 3
O
-H2O
(CH3)2C=CHCC3H
第4页/共21页
碱催化下的反应机理
CH3CH=O
-B: 烯醇化
CH2CH=O
CH3CH=O 亲核加成
O- O CH3CHC2H CH H2O
酸碱反应
OH O CH3CHC2HCH
-H2O
CH3CH=CHCHO
R'
R'
取代的氨甲基
具有活泼氢的化合物、甲醛、胺同时缩合,活 泼氢被氨甲基或取代氨甲基取代的反应,称为曼尼 期 (Mannich, C.)反应,生成的产物称为曼氏碱。
第11页/共21页
反应机理
R
H +
C2H =O
N
C2H =OR H '
HR N
R'
H+转移
-2 C OH H
H
R N
-C 2-O H2H-H 2O
醛、酮与α-卤代酸酯在强碱(RONa, NaNH2, (CH3)3COK)催化作用下互相作用, 生成α,β-环氧酸酯的反应称为达参(Darzen, G.)反应。
C=B O * 2 C r 2 E C O + N o t r H R O - 2 aN C βC α H C H 2 E O t O
α,β-环氧酸酯
第13页/共21页
反应机理
(C3C O H 2C ) 2 H Et-(O C3C O H 2C ) H C2H =CH-CH=O O
(C3H C2)CH-C 2-C HH=C-H-O EtO(H C 3 O C H 2 C ) H 2 --C CH H=互 C 变 异 构 H-OH
第十七章 缩合反应 Microsoft PowerPoint 演示文稿

含α-活泼氢原子的二羰基化合物在催化量的碱的 作用下,可发生分子内的羟醛缩合反应,生成五、六 元环状化合物,因此,该法常用于成环反应。
O LDA O
O O
OH O
C H2 C HO C H2 C H2 C H2 C O C H 3
OH
dil. OH
△ , H2O
CO CH 3
CO CH 3
O
= =
结构式
pKa
酮 式 烯 醇 式 互 变 异 构
胺 式 亚 胺 式 互 变 异 构
脂肪代谢过程中所产生的中间产物——乙酰 乙酸在酶的作用下被还原成β-羟基丁酸。
NADH+H+ CH3COCH2COOH β -羟基丁酸脱氢酶 NAD
+
CH3CHCH2COOH OH
乙酰乙酸可在酶催化下脱羧生成丙酮。
乙酰乙酸乙酯
FeCl3
紫色
OH CH3C O CH C OCH2CH3
说 明 有 烯 醇 式 结 构 存 在
OH CH3C
O CH C OCH2CH3
Br 2
OH CH3C Br O CH C Br OCH2CH3
-HBr
O OCH2CH3
O CH3C
CH C Br
O CH3C CH2
O C OCH2CH3 93%
Keto Form
OH CH3C O CH C OCH2CH3 7%
Enol Form
HO H3 C C CH
OCH 2CH3 C=O
π-π共轭体系
O H H3C C CH
O COCH 2CH3
分子内氢键
一般烯醇式不稳定,而乙酰乙酸乙酯的烯醇式 较稳定存在:
(1)酮式中亚甲基上的氢原子同时受羰 基和酯基的影响很活泼,很容易转移到羰 基氧上形成烯醇式。 (2)烯醇式中的双键的π键与酯基中的 π键形成π-π共轭体系,使电子离域,降 低了体系的能量。 (3)烯醇型可形成分子内氢键,构成稳定 性更大的环状螯合物。
O LDA O
O O
OH O
C H2 C HO C H2 C H2 C H2 C O C H 3
OH
dil. OH
△ , H2O
CO CH 3
CO CH 3
O
= =
结构式
pKa
酮 式 烯 醇 式 互 变 异 构
胺 式 亚 胺 式 互 变 异 构
脂肪代谢过程中所产生的中间产物——乙酰 乙酸在酶的作用下被还原成β-羟基丁酸。
NADH+H+ CH3COCH2COOH β -羟基丁酸脱氢酶 NAD
+
CH3CHCH2COOH OH
乙酰乙酸可在酶催化下脱羧生成丙酮。
乙酰乙酸乙酯
FeCl3
紫色
OH CH3C O CH C OCH2CH3
说 明 有 烯 醇 式 结 构 存 在
OH CH3C
O CH C OCH2CH3
Br 2
OH CH3C Br O CH C Br OCH2CH3
-HBr
O OCH2CH3
O CH3C
CH C Br
O CH3C CH2
O C OCH2CH3 93%
Keto Form
OH CH3C O CH C OCH2CH3 7%
Enol Form
HO H3 C C CH
OCH 2CH3 C=O
π-π共轭体系
O H H3C C CH
O COCH 2CH3
分子内氢键
一般烯醇式不稳定,而乙酰乙酸乙酯的烯醇式 较稳定存在:
(1)酮式中亚甲基上的氢原子同时受羰 基和酯基的影响很活泼,很容易转移到羰 基氧上形成烯醇式。 (2)烯醇式中的双键的π键与酯基中的 π键形成π-π共轭体系,使电子离域,降 低了体系的能量。 (3)烯醇型可形成分子内氢键,构成稳定 性更大的环状螯合物。
第四章 缩合反应.ppt

OH
CH3COOC2H5
+
LiN[Si(CH3)3]2
THF -78℃
LiCH2COOC2H5 + HN[Si(CH3)3]2
C6H5CHO + LiCH2COOC2H5 THF
应用
a.合成-羟基羧酸酯
O C
CH2CH3 + BrCH2COOCH3
1)Zn,Et2O
+
2) H3O
OH C CH2CH3 CHCOOCH3
O
O
O
Al(t-BuO)4
+
OH
O H3PO4
不对称酮:反应主要发生在羰基α位上取代基 较少的碳原子上
C6H5N(CH3)MgBr/PhH/Et2O 2 CH3CH2COCH3
CH3 CH3CH2COCH2C CH2CH3
OH
60%~67%
B、应用:
巴豆醛的合成
20-25℃ 2CH3CHO NaOH
c.醛、酮结构的影响 活性:酮<醛
O
O
Ba(OH)2
CH3 C + H2C C CH3
CH3 H
H3C
CH3 C CH2
O C
CH3
I2或H3PO4
OH CH3 O
H3C C CH C CH3
OHC
(CH2)3
CH
CHO
H2O 115℃
C3H7
CHO C3H7
Ba(OH)2 丙酮
Soxhlet抽提器
R3
R5
R4
R2
R4
R5
O
1) CH3(CH2)2 C H
2) H3O
C3H7C CH2 CH(CH2)2CH3
克莱森缩合反应ppt课件

:
碳负离子越稳定,α-氢的酸性越强。
1〕吸电子效应的影响:
总的吸电子才干越强,α-氢的酸性越强。
2〕电子离域的影响:
O
O
O
O
O
RCH2碳CX负离RCH子2C的H 离R域CH范2CR围' 越RC大H2,CαOR-' 氢R的CH酸2CN性越RC强H2。CNH2
3〕羰基化合物α-H活性顺序
Mechanism
反响机理
2.碳负离子对另一分子羧酸酯的羰基进展亲核进攻,得到中 间体,随后脱去醇负离子而得到产物β-羰基羧酸酯。
β-C β-羰基羧酸酯
Mechanism
反响机理
3.产物的α-氢与两个羰基临近,因此有较强的酸性,会与 反响物中的强碱反响而以共轭碱的方式存在。
O
共轭碱 α-H
Mechanism
反响机理
Claisen Condensation
——克莱森缩合反响
Contents
1. 定义 2. 反响机理 3. 反响类型 4. 运用 5. 近期文献报道
Definition
定义
定义 是指含活泼H的两分子酯或者一分子酯与一分 子羰基化合物,在强碱催化下缩合,失去一分 子醇生成一分子β-酮酸酯或者1,3-二酮的反响 。 反响条件
Types
类型
迪克曼环化反响 二元酸酯假设分子中的酯基被四个以上的碳原子隔开时,就发生分子 内酯缩合反响,构成五元环或更大环的酯。
双酯分子内的克莱森缩合反响,得到β-环酮酯。
Application
运用
1.乙酰乙酸乙酯和乙酰丙酮的合成 这两种化合物是有机合成的重要中间体。
O ( 1 ) E t O N a , E t O H OO 2 C H 3 C O E t ( 2 ) C H 3 C O O H , H 2 O C H 3 C C H 2 C O E t + E t O H
药物合成反应讲义缩合反应课件

13
(a) 烯醇盐法 立体化学 i. 动力学控制
14
ii. 热力学控制
15
16
17
(b) 烯醇硅醚法(Mukaiyama羟醛缩合)
Lewis acids: TiCl4, BF3, 四烃基铵氟化物等 反应机理:
18
19
(C) 亚胺法
特点(1)避免了醛的自身缩合; (2)亚胺锂盐具有较大的亲核性,有利于进行缩合反应。
酮的反应活性较 醛低,因此,某 些酮的自身缩合 需用特殊方法, 如索氏抽提器。
6
碱催化的不对称酮的缩合,反应主要发生在羰 基-位上取代基较少的碳原子上。
7
(2)芳醛与含有α-活性氢的醛酮之间的缩合 (Claisen-Schimidt 反应) 芳醛和脂肪族醛、酮在碱催化下缩合而成α,β-不饱和醛、 酮的反应称为Claisen-Schimidt反应。
甲醛或 其它醛
仲胺或 伯胺
-氨基酮衍生物
(Mannich碱)
51
Mechanism:
52
53
Notes (1). 活性氢化合物有醛、酮、酸、酯、腈、硝基烷、炔、 酚及某些杂环化合物。
54
(2). 所用的胺可以是伯胺、仲胺或氨,芳香胺也可发生 该反应。
(3). 当使用胺或伯胺时,若活性氢化合物与甲醛过量,所 有氨上的氢均可参与缩合反应。同理,当反应物具有 两个或两个以上活性氢时,则在甲醛、胺过量的情况 下生成多氨甲基化产物。
33
NaCN剧毒,可用噻唑鎓盐、咪唑鎓盐等代替
34
Mechanism
35
4. 有机金属化合物的-羟烷基化反应
(1) Reformatsky反应 定义:醛或酮与α-卤代酸酯在金属锌粉作用下缩合,
(a) 烯醇盐法 立体化学 i. 动力学控制
14
ii. 热力学控制
15
16
17
(b) 烯醇硅醚法(Mukaiyama羟醛缩合)
Lewis acids: TiCl4, BF3, 四烃基铵氟化物等 反应机理:
18
19
(C) 亚胺法
特点(1)避免了醛的自身缩合; (2)亚胺锂盐具有较大的亲核性,有利于进行缩合反应。
酮的反应活性较 醛低,因此,某 些酮的自身缩合 需用特殊方法, 如索氏抽提器。
6
碱催化的不对称酮的缩合,反应主要发生在羰 基-位上取代基较少的碳原子上。
7
(2)芳醛与含有α-活性氢的醛酮之间的缩合 (Claisen-Schimidt 反应) 芳醛和脂肪族醛、酮在碱催化下缩合而成α,β-不饱和醛、 酮的反应称为Claisen-Schimidt反应。
甲醛或 其它醛
仲胺或 伯胺
-氨基酮衍生物
(Mannich碱)
51
Mechanism:
52
53
Notes (1). 活性氢化合物有醛、酮、酸、酯、腈、硝基烷、炔、 酚及某些杂环化合物。
54
(2). 所用的胺可以是伯胺、仲胺或氨,芳香胺也可发生 该反应。
(3). 当使用胺或伯胺时,若活性氢化合物与甲醛过量,所 有氨上的氢均可参与缩合反应。同理,当反应物具有 两个或两个以上活性氢时,则在甲醛、胺过量的情况 下生成多氨甲基化产物。
33
NaCN剧毒,可用噻唑鎓盐、咪唑鎓盐等代替
34
Mechanism
35
4. 有机金属化合物的-羟烷基化反应
(1) Reformatsky反应 定义:醛或酮与α-卤代酸酯在金属锌粉作用下缩合,
缩合反应 ppt课件

ห้องสมุดไป่ตู้
O C3H (H C 3 )2 CC H C C -O - 2 C 2 H 5
C3H
只有一个α-H,必须用强碱作催化剂,才能使反应进行。
39
在强碱作用下酯缩合的反应机制
O
- (C H 3 )2 CHCO
2C 2H 5 Ph3C -
(C H 3 ) 2 C H C O C 2 H 5
(C H 3 ) 2 CC O 2 C 2 H 5
练习:p667,15-8
18
第五节 氨甲基化反应 一 、定义
具有活泼氢的化合物、甲醛、胺同时缩合,活 泼氢被氨甲基或取代氨甲基取代的反应,称为曼尼 希 (Mannich, C.)反应,生成的产物称为曼氏碱。
O
RH +
O
R
C 3 -H C 2 -H -C +2 H OC+ H H C 3 -N H C 2 -C -2 C N H H
O
CH +C O H 3 C C H 3
2 C3 C HH CH CH= 3 C
O
OH-
PhCHO + CH3CC(CH3)3
OH O
--H2O
O
PhCHCH2CC(CH3)3
PhCH=CHCC(CH3)3
17
3、定向缩合(了解) 硅醚:用于固定烯醇的双键; LDA:大体积强碱,易于形成动力学烯醇负离子。
第11节 Knoevenagel反应
第12节 Darzen反应
第13节 安息香缩合反应
5
第一节 氢碳酸的概念和α氢的酸性
R3C H
R3C-
H+ pKa = -logKa
判断氢碳酸的酸性强弱,可以判断其共轭碱-碳负离子 的稳定性:碳负离子越稳定,氢碳酸的酸性越强。
O C3H (H C 3 )2 CC H C C -O - 2 C 2 H 5
C3H
只有一个α-H,必须用强碱作催化剂,才能使反应进行。
39
在强碱作用下酯缩合的反应机制
O
- (C H 3 )2 CHCO
2C 2H 5 Ph3C -
(C H 3 ) 2 C H C O C 2 H 5
(C H 3 ) 2 CC O 2 C 2 H 5
练习:p667,15-8
18
第五节 氨甲基化反应 一 、定义
具有活泼氢的化合物、甲醛、胺同时缩合,活 泼氢被氨甲基或取代氨甲基取代的反应,称为曼尼 希 (Mannich, C.)反应,生成的产物称为曼氏碱。
O
RH +
O
R
C 3 -H C 2 -H -C +2 H OC+ H H C 3 -N H C 2 -C -2 C N H H
O
CH +C O H 3 C C H 3
2 C3 C HH CH CH= 3 C
O
OH-
PhCHO + CH3CC(CH3)3
OH O
--H2O
O
PhCHCH2CC(CH3)3
PhCH=CHCC(CH3)3
17
3、定向缩合(了解) 硅醚:用于固定烯醇的双键; LDA:大体积强碱,易于形成动力学烯醇负离子。
第11节 Knoevenagel反应
第12节 Darzen反应
第13节 安息香缩合反应
5
第一节 氢碳酸的概念和α氢的酸性
R3C H
R3C-
H+ pKa = -logKa
判断氢碳酸的酸性强弱,可以判断其共轭碱-碳负离子 的稳定性:碳负离子越稳定,氢碳酸的酸性越强。
药物合成反应-缩合反应PPT课件

用
在抗生素药物合成中的应用
总结词:广泛使用
详细描述:缩合反应在抗生素药物合成中应用广泛,例如通过酯化、胺化等缩合 反应合成大环内酯类、四环素类抗生素。这些反应能够将不同官能团结合在一起 ,形成具有生物活性的复杂结构。
在生物碱类药物合成中的应用
总结词:关键步骤
详细描述:生物碱是一类天然产物,具有抗肿瘤、抗菌、抗病毒等生物活性。在生物碱类药物合成中,缩合反应常常是关键 步骤,用于将不同的碳架结构连接起来,形成目标分子。
02
在药物合成中,缩合反应是一种 常见的反应类型,用于构建复杂 的有机分子结构。
缩合反应的类型
醛酮缩合反应
醛和酮在催化剂的作用 下,通过加成反应形成 新的碳-碳键,生成β-羟
基酮或烯醇。
酯化反应
酸和醇通过酯化反应生 成酯,同时失去一分子
水。
羟醛缩合反应
醛和醇在弱碱的作用下, 发生羟醛缩合反应,生
成β-羟基醛或酮。
酯的醇解反应
在酸或碱催化下,酯与醇进行反应生 成酯和醇的过程。
氨基化合物缩合反应
曼尼希反应
在甲醛或含甲醛的物质存在下,氨基化合物与含有活泼氢的化合物进行缩合, 生成亚甲基化合物的过程。
施密特反应
在甲醛或含甲醛的物质存在下,氨基化合物与羧酸进成中的应
05
缩合反应的发展趋势与展望
缩合反应的研究现状与进展
01
缩合反应在药物合成中的重要性
缩合反应是药物合成中的重要反应类型之一,对于获得目标分子、提高
药物产量和纯度具有重要意义。
02 03
缩合反应的研究进展
随着科学技术的不断进步,缩合反应的研究也在不断深入。目前,研究 者已经开发出多种新型的缩合反应催化剂和反应条件,提高了反应效率 和选择性。
在抗生素药物合成中的应用
总结词:广泛使用
详细描述:缩合反应在抗生素药物合成中应用广泛,例如通过酯化、胺化等缩合 反应合成大环内酯类、四环素类抗生素。这些反应能够将不同官能团结合在一起 ,形成具有生物活性的复杂结构。
在生物碱类药物合成中的应用
总结词:关键步骤
详细描述:生物碱是一类天然产物,具有抗肿瘤、抗菌、抗病毒等生物活性。在生物碱类药物合成中,缩合反应常常是关键 步骤,用于将不同的碳架结构连接起来,形成目标分子。
02
在药物合成中,缩合反应是一种 常见的反应类型,用于构建复杂 的有机分子结构。
缩合反应的类型
醛酮缩合反应
醛和酮在催化剂的作用 下,通过加成反应形成 新的碳-碳键,生成β-羟
基酮或烯醇。
酯化反应
酸和醇通过酯化反应生 成酯,同时失去一分子
水。
羟醛缩合反应
醛和醇在弱碱的作用下, 发生羟醛缩合反应,生
成β-羟基醛或酮。
酯的醇解反应
在酸或碱催化下,酯与醇进行反应生 成酯和醇的过程。
氨基化合物缩合反应
曼尼希反应
在甲醛或含甲醛的物质存在下,氨基化合物与含有活泼氢的化合物进行缩合, 生成亚甲基化合物的过程。
施密特反应
在甲醛或含甲醛的物质存在下,氨基化合物与羧酸进成中的应
05
缩合反应的发展趋势与展望
缩合反应的研究现状与进展
01
缩合反应在药物合成中的重要性
缩合反应是药物合成中的重要反应类型之一,对于获得目标分子、提高
药物产量和纯度具有重要意义。
02 03
缩合反应的研究进展
随着科学技术的不断进步,缩合反应的研究也在不断深入。目前,研究 者已经开发出多种新型的缩合反应催化剂和反应条件,提高了反应效率 和选择性。
《缩合反应 》课件

高分子材料在合成过程中经常使用缩合反应,例 如聚酯和聚酰胺等高分子材料的合成。
纳米材料合成
在纳米材料合成中,缩合反应也扮演着重要角色 ,例如金属氧化物的合成就可以通过缩合反应实 现。
陶瓷材料合成
陶瓷材料的合成过程中也涉及到缩合反应,例如 硅酸盐陶瓷的合成过程中就涉及到硅酸盐的脱水 缩合反应。
05
CATALOGUE
04
CATALOGUE
缩合反应的应用领域
有机合成
合成醇类
01
缩合反应可以用于合成醇类化合物,例如醛和酮可以通过醇的
脱水反应生成相应的醇。
合成羧酸
02
通过醛或酮与羧酸之间的缩合反应,可以合成羧酸类化合物。
合成胺类
03
胺类化合物的合成也可以通过缩合反应实现,例如醛和氨之间
的反应可以生成亚胺,进一步处理可以得到胺类化合物。
药物合成
合成药物中间体
许多药物在合成过程中需要经过缩合反应来得到关键的中间体。
合成生物碱
生物碱类化合物的合成往往涉及到缩合反应,例如氨基酸和有机酸 之间的缩合反应可以生成生物碱。
合成激素
激素的合成过程中也经常使用到缩合反应,例如雌性激素的合成过 程中就涉及到酯的缩合反应。
材料科学
1 2 3
高分子合成
缩合反应的发展趋势与展望
新反应类型的发现与探索
1
不断探索新的反应类型,以满足不断发展的化学 工业需求。
2
深入研究反应机理,提高反应的效率和选择性。
3
开发高效、环保的催化剂体系,降低生产成本。
绿色化学在缩合反应中的应用
开发绿色、环保的合成方法,减少对环境的污 染。
优化反应条件,降低能耗和资源消耗。
纳米材料合成
在纳米材料合成中,缩合反应也扮演着重要角色 ,例如金属氧化物的合成就可以通过缩合反应实 现。
陶瓷材料合成
陶瓷材料的合成过程中也涉及到缩合反应,例如 硅酸盐陶瓷的合成过程中就涉及到硅酸盐的脱水 缩合反应。
05
CATALOGUE
04
CATALOGUE
缩合反应的应用领域
有机合成
合成醇类
01
缩合反应可以用于合成醇类化合物,例如醛和酮可以通过醇的
脱水反应生成相应的醇。
合成羧酸
02
通过醛或酮与羧酸之间的缩合反应,可以合成羧酸类化合物。
合成胺类
03
胺类化合物的合成也可以通过缩合反应实现,例如醛和氨之间
的反应可以生成亚胺,进一步处理可以得到胺类化合物。
药物合成
合成药物中间体
许多药物在合成过程中需要经过缩合反应来得到关键的中间体。
合成生物碱
生物碱类化合物的合成往往涉及到缩合反应,例如氨基酸和有机酸 之间的缩合反应可以生成生物碱。
合成激素
激素的合成过程中也经常使用到缩合反应,例如雌性激素的合成过 程中就涉及到酯的缩合反应。
材料科学
1 2 3
高分子合成
缩合反应的发展趋势与展望
新反应类型的发现与探索
1
不断探索新的反应类型,以满足不断发展的化学 工业需求。
2
深入研究反应机理,提高反应的效率和选择性。
3
开发高效、环保的催化剂体系,降低生产成本。
绿色化学在缩合反应中的应用
开发绿色、环保的合成方法,减少对环境的污 染。
优化反应条件,降低能耗和资源消耗。
缩合—醛酮与醇的缩合(有机合成课件)

α-氰基丙烯酸-1,2-异丙叉甘油酯(CAG)是一种新 型医用快速生物降解的止血剂和组织粘合剂。CAG的止 血作用优于目前所用的25号止血粉、云南白药、止血纤 维及明胶油绵等。
精细有机合成技术
缩缩合合反反应应
精细有机合成技术
缩缩合合反反应应
工艺过程:将甘油和丙酮按1:2.4(摩尔比)的配比,在 高分子Lewis酸载体催化剂PSSF作用下,进行共沸回流 反应(苯为共沸剂),反应结束后滤出催化剂,并回收 苯及过量丙酮后减压蒸馏,收集82~83℃/1733Pa馏分, 即得产物缩酮。
精精精细细细有有有机机机合合合成成成技技技术术术
目
录
醛酮与醇的缩合
缩缩合合反应应
醛酮与醇的缩合反应及特点 1
Contents
应用实例 2
精细有机合成技术
醛酮与醇的缩合应用实例
缩缩合合反反应应
1.聚乙烯醇缩醛粘合剂的合成
聚乙烯醇与醛类进行缩醛化反应即可得到聚乙烯醇 缩醛。反应如下:
精细有机合成技术
精细有机合成技术
缩缩合合反反应应
• 再将氰基乙酸和缩酮按1:2(摩尔比)的配比,在对甲基苯磺 酸催化下、以为苯为共沸剂进行共沸回流反应;待反应完全 后,将反应混合液冷至室温,用无水醋酸钠处理反应液,回 收大部分苯后用Na2CO3-NaCl饱和溶液调节pH值至7左右; 分出有机相,干燥;回收剩余苯后,减压回收过量缩酮,收 得148~149℃/213.3Pa馏分,得中间产物氰乙酸酯。
缩缩合合反反应应
1.聚乙烯醇缩醛粘合剂的合成
聚乙烯醇与醛类进行缩醛化反应即可得到聚乙烯醇 缩醛。反应如下:
精细有机合成技术
缩缩合合反反应应
• 工业中应用最多的缩醛品种是聚乙烯醇缩丁醛和聚乙烯 醇缩甲醛。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H3C
O C OEt
t-C4H9OK
Ph C CH
H3C O
O
1)OH-/H2O
C OEt
2)H3O+
RO R' C C R''
H
_ CO2
Ph O CH C H
H3C
5. Stobbe反应
定义:醛(酮)在碱的催化下与丁二酸酯的反应。 反应式如下:
R CO +
R'
O CH2 C OEt
CH2 C OEt O
的作用类似,从而可避免使用剧毒的氰化物。如:
2 Ph
O CH
vitamin B1
Ph
OH O C C Ph
H
O 2 CH3(CH2)4 C H
N C12H25Br S
HO CH3(CH2)4 C C (CH2)4CH3
OH
4. Darzens反应
定义:α-卤代酸酯在碱的作用下形成α-C负离子,进 攻醛(酮)的羰基碳原子,再脱去卤素负离子的反应。
O CH CHCOOH
显然,用K2CO3代替相应的羧酸钾有CO2生成,有利于平衡 右移,会缩短反应时间。
3. 安息香(benzoin)缩合反应
芳醛在KCN或NaCN的催化下,自身缩合成α-羟基芳酮 的反应称为安息香缩合反应。
O
2 Ar C H
CN
反应历程:
O Ar C H + CN
O Ar C CN
RCH2COOK
R ArCH C COO
+ RCH2COOH
反应历程:
O
RCH2 C OH
O
RCH2
O C
O
O C
CH2R
RCH2
C
O
OO RCH C O C CH2R
O Ar C H
OHO O Ar C C C O C CH2R
HR
RCH2COOH
OH H O O Ar C C C O C CH2R
OH-
Ph
O
C C C Ph
0℃
H OH
也可用α-卤代 酮反应
α,β-环氧酸酯在碱性条件下水解、酸化、脱羧可 得到比原来的醛(酮)多一个碳原子的醛(酮)。
R
R''
CC
R' O C OEt
O
1) OH2) H3+O
R
R''
CC R' O C O
OH
CO2 R
R''
CC
R' O H
如:
Ph C O + ClCH2
一、碱催化缩合
1. 羟醛缩合反应
醛(酮)的α - H ,在碱的作用下形成α - C 负离子,
进而进攻另一分子醛(酮)缺电子的羰基碳原子,生成β –羟基醛
酮的反应 。
例:
OH
H CH2CHO
HOH CH2CHO
O CH2 CH
O H3C C H
CH2 CHO
O CH3CHCH2CHO
HOH
稍微加热则失水:
CH3CHCH2CHO OH
稀碱 CH3CHO + CH3CH2CHO
CH3CH2CHCHCHO OHCH3
CH3 CH3CHCHCHO
OH
CH3CH2CHCH2CHO OH
例:
C6H5CHO + CH3COCH3
OH 100℃
C6H5CHO + CH3COC6H5
OH 20℃
CHO
+
CH3COCH3
CH2
OEt
R R'
O C OEt CO
O
O H C OEt
C C
CH2 O
C O
EtO R
EtOH
R'
O
O
H O
C C OEt
CH2 C OEt O EtOH
EtO
O C C C OEt
O CH2 C OH
从形式上看,该反应的特点是:醛(酮)的羰基碳与丁 二酸酯的一个酯基的α-C形成C=C,同时另一个酯基被水解成酸。
如:
O
O
CH2 C OEt
H3C C CH3 + CH2 C OEt
O
O
EtO
H
H3C C C
C OEt
H3C
CH2 C OH O
O
O
CH2 C OEt
C2H5ONa C2H5OH,-5℃
C6H5HC CHCOCH3 4-苯基-3-丁烯-2-酮
70%
C6H5HC CHCOC6H5
85% O
柠檬醛A
假紫罗兰酮 49%
O H3C
CH3 O
KOH, HOH
CH3 CH3
O
“酮进攻醛” 分子内Aldol反应
2. Perkin反应
ArCHO + (RCH2CO)2O
HR
OO Ar C C C O C CH2R
H2O
O
O
Ar C C C OH + HO C CH2R
HR
HR
特点:酸酐的α-H与芳醛的羰基形成C=C,同时酸酐水解成酸。
C6H5CHO + (CH3CO)2O CH3COOK
C6H5 CH CHCOOH
肉桂酸
60%
O
+ CHO
(CH3CO)2O
K2CO3
H
HO Ar C C Ar
OH
OH Ar C CN
O Ar C H
OH O Ar C C Ar
CN H
O OH Ar C C Ar
CN H
O OH Ar C C Ar + CN
H
CN–在该反应中主要有三个作用:
(1)作为亲核试剂进攻醛基;
(2)其吸电子性有利于碳负离子的生成;
(3)在最后一步作为好的离去基团离去。 维生素B1、噻唑的季铵盐等也可以催化此反应,其与CN-
R4 R1
H2O
O R3 C C C R2
R4 R1
该反应的特点是:一分子醛(酮)的α – C形成负 离子,进攻另一分子醛(酮)的羰基碳原子,被进攻的羰基 氧原子变为羟基,受热容易失水形成α,β-不饱和醛(酮)。
羟醛缩合反应的历程同时体现了羟基化合物的两大 特性:α-H的酸性和羰基的亲核加成。
一种有α-H,另一种无α-H的醛酮才有合成的意义。如 果使用两种不同的带α-H的醛进行羟醛缩合,则反应复杂化, 至少生成四种产物,如:
(1) 碱 (2) H
R CC R'
O C OEt
CH2 C OH O
反应历程:
CH2 CH2
R C
R' O
O
C OEt
EtOH CH
EtO
O C OEt
R
O
R'
R C R'
C
C OEt O
R R'
O C OEt C CH2 C
CH2 C O
O H C OEt
C C
CH2 O
C O OEt
R CC R'
R CO
+
R'
反应历程:
R"CH CO2Et X
R
R''
R' O CO2Et
H R''HC C CO2Et B
X
HB
R CO
R
X R''
R''C C OEt R' XO
CC
R' O
CO2Et
RHale Waihona Puke R''CC R' O CO2Et
该反应常用的催化剂有强碱、醇钠、氨基钠、叔丁醇钾等。
例:
O
O
Ph C H + ClCH2C Ph
: O:
CH3CHCH2CHO
OH
OH
H3C CHCH2CHO
OH
OH
-HOH
CH3CHCH2CHO
βα
H3CCH CHCHO 2-丁烯醛
反应通式为:
O
B
R1CH2 C R2
HB O
R1CH C R2
O
O R1CH C R2
R3 C R4
OHO
R3 C C C R2
HB
R4 R1
OH H O R3 C C C R2
O C OEt
t-C4H9OK
Ph C CH
H3C O
O
1)OH-/H2O
C OEt
2)H3O+
RO R' C C R''
H
_ CO2
Ph O CH C H
H3C
5. Stobbe反应
定义:醛(酮)在碱的催化下与丁二酸酯的反应。 反应式如下:
R CO +
R'
O CH2 C OEt
CH2 C OEt O
的作用类似,从而可避免使用剧毒的氰化物。如:
2 Ph
O CH
vitamin B1
Ph
OH O C C Ph
H
O 2 CH3(CH2)4 C H
N C12H25Br S
HO CH3(CH2)4 C C (CH2)4CH3
OH
4. Darzens反应
定义:α-卤代酸酯在碱的作用下形成α-C负离子,进 攻醛(酮)的羰基碳原子,再脱去卤素负离子的反应。
O CH CHCOOH
显然,用K2CO3代替相应的羧酸钾有CO2生成,有利于平衡 右移,会缩短反应时间。
3. 安息香(benzoin)缩合反应
芳醛在KCN或NaCN的催化下,自身缩合成α-羟基芳酮 的反应称为安息香缩合反应。
O
2 Ar C H
CN
反应历程:
O Ar C H + CN
O Ar C CN
RCH2COOK
R ArCH C COO
+ RCH2COOH
反应历程:
O
RCH2 C OH
O
RCH2
O C
O
O C
CH2R
RCH2
C
O
OO RCH C O C CH2R
O Ar C H
OHO O Ar C C C O C CH2R
HR
RCH2COOH
OH H O O Ar C C C O C CH2R
OH-
Ph
O
C C C Ph
0℃
H OH
也可用α-卤代 酮反应
α,β-环氧酸酯在碱性条件下水解、酸化、脱羧可 得到比原来的醛(酮)多一个碳原子的醛(酮)。
R
R''
CC
R' O C OEt
O
1) OH2) H3+O
R
R''
CC R' O C O
OH
CO2 R
R''
CC
R' O H
如:
Ph C O + ClCH2
一、碱催化缩合
1. 羟醛缩合反应
醛(酮)的α - H ,在碱的作用下形成α - C 负离子,
进而进攻另一分子醛(酮)缺电子的羰基碳原子,生成β –羟基醛
酮的反应 。
例:
OH
H CH2CHO
HOH CH2CHO
O CH2 CH
O H3C C H
CH2 CHO
O CH3CHCH2CHO
HOH
稍微加热则失水:
CH3CHCH2CHO OH
稀碱 CH3CHO + CH3CH2CHO
CH3CH2CHCHCHO OHCH3
CH3 CH3CHCHCHO
OH
CH3CH2CHCH2CHO OH
例:
C6H5CHO + CH3COCH3
OH 100℃
C6H5CHO + CH3COC6H5
OH 20℃
CHO
+
CH3COCH3
CH2
OEt
R R'
O C OEt CO
O
O H C OEt
C C
CH2 O
C O
EtO R
EtOH
R'
O
O
H O
C C OEt
CH2 C OEt O EtOH
EtO
O C C C OEt
O CH2 C OH
从形式上看,该反应的特点是:醛(酮)的羰基碳与丁 二酸酯的一个酯基的α-C形成C=C,同时另一个酯基被水解成酸。
如:
O
O
CH2 C OEt
H3C C CH3 + CH2 C OEt
O
O
EtO
H
H3C C C
C OEt
H3C
CH2 C OH O
O
O
CH2 C OEt
C2H5ONa C2H5OH,-5℃
C6H5HC CHCOCH3 4-苯基-3-丁烯-2-酮
70%
C6H5HC CHCOC6H5
85% O
柠檬醛A
假紫罗兰酮 49%
O H3C
CH3 O
KOH, HOH
CH3 CH3
O
“酮进攻醛” 分子内Aldol反应
2. Perkin反应
ArCHO + (RCH2CO)2O
HR
OO Ar C C C O C CH2R
H2O
O
O
Ar C C C OH + HO C CH2R
HR
HR
特点:酸酐的α-H与芳醛的羰基形成C=C,同时酸酐水解成酸。
C6H5CHO + (CH3CO)2O CH3COOK
C6H5 CH CHCOOH
肉桂酸
60%
O
+ CHO
(CH3CO)2O
K2CO3
H
HO Ar C C Ar
OH
OH Ar C CN
O Ar C H
OH O Ar C C Ar
CN H
O OH Ar C C Ar
CN H
O OH Ar C C Ar + CN
H
CN–在该反应中主要有三个作用:
(1)作为亲核试剂进攻醛基;
(2)其吸电子性有利于碳负离子的生成;
(3)在最后一步作为好的离去基团离去。 维生素B1、噻唑的季铵盐等也可以催化此反应,其与CN-
R4 R1
H2O
O R3 C C C R2
R4 R1
该反应的特点是:一分子醛(酮)的α – C形成负 离子,进攻另一分子醛(酮)的羰基碳原子,被进攻的羰基 氧原子变为羟基,受热容易失水形成α,β-不饱和醛(酮)。
羟醛缩合反应的历程同时体现了羟基化合物的两大 特性:α-H的酸性和羰基的亲核加成。
一种有α-H,另一种无α-H的醛酮才有合成的意义。如 果使用两种不同的带α-H的醛进行羟醛缩合,则反应复杂化, 至少生成四种产物,如:
(1) 碱 (2) H
R CC R'
O C OEt
CH2 C OH O
反应历程:
CH2 CH2
R C
R' O
O
C OEt
EtOH CH
EtO
O C OEt
R
O
R'
R C R'
C
C OEt O
R R'
O C OEt C CH2 C
CH2 C O
O H C OEt
C C
CH2 O
C O OEt
R CC R'
R CO
+
R'
反应历程:
R"CH CO2Et X
R
R''
R' O CO2Et
H R''HC C CO2Et B
X
HB
R CO
R
X R''
R''C C OEt R' XO
CC
R' O
CO2Et
RHale Waihona Puke R''CC R' O CO2Et
该反应常用的催化剂有强碱、醇钠、氨基钠、叔丁醇钾等。
例:
O
O
Ph C H + ClCH2C Ph
: O:
CH3CHCH2CHO
OH
OH
H3C CHCH2CHO
OH
OH
-HOH
CH3CHCH2CHO
βα
H3CCH CHCHO 2-丁烯醛
反应通式为:
O
B
R1CH2 C R2
HB O
R1CH C R2
O
O R1CH C R2
R3 C R4
OHO
R3 C C C R2
HB
R4 R1
OH H O R3 C C C R2
