有机波谱分析_第三版课后习题及答案
有机波谱习题及答案分析

8. 下列四种波数的电磁辐射,哪一个属于可见区?(B) A. 2.0×105 cm-1; B. 980 cm-1;
C. 2.0 cm-1; D. 50.0 cm-1 9. 可见光的能量是在下列那个范围内?(D)
11. 波谱分析法通常获得其他分析方法不能获得的那些信息? (B) A. 组成信息; B. 原子或分子结构信息; C. 化合物存在形态; D. 化合物极性大小
12. 激光拉曼光谱属于(D) A. 吸收光谱; B. 发射光谱; C. 原子光谱; D. 分子光谱
13. 有机波谱分析方法和仪器分析法的主要不足是(B) A. 样品用量大; B. 相对误差大; C. 选择性差; D. 重现性低
3.可见光区、紫外光区、红外光区、无线电波区四个电磁波 区域中,能量最大和最小的区域分别是(A) A. 紫外光区和无线电波区; B. 紫外光区和红外光区; C. 红外光区和无线电波区; D. 可见光区和红外光区
4. 频率为1×107 MHz的电磁辐射是处在哪一个光区(A) A. 红外光区; B. 紫外光区; C. 无线电波区;D. 可见光区
A. GC-MS; B. LC-MS; C. ICP-MS; D. GC-IR 19. 下列那种简写代表核磁共振波谱?(B)
A. UV; B. NMR; C. IR; D. MS 20. 下列有机波谱分析法中,哪种谱图的横轴不表示光或电磁
波的能量?(D) A. 紫外-可见光谱; B. 红外吸收光谱; C. 核磁共振波谱; D. 质谱
14.原子发射光谱的产生是由于(B) A. 原子次外层电子在不同能级间的跃迁; B. 原子外层电子在不同能级间的跃迁; C. 原子内层电子在不同能级间的跃迁; D. 原子外层电子的振动和转动;
有机波谱分析考试题库及答案

第二章:紫外吸收光谱法一、选择1. 频率(MHz)为4.47×108的辐射,其波长数值为(1)670.7nm (2)670.7μ(3)670.7cm (4)670.7m2. 紫外-可见光谱的产生是由外层价电子能级跃迁所致,其能级差的大小决定了(1)吸收峰的强度(2)吸收峰的数目(3)吸收峰的位置(4)吸收峰的形状3. 紫外光谱是带状光谱的原因是由于(1)紫外光能量大(2)波长短(3)电子能级差大(4)电子能级跃迁的同时伴随有振动及转动能级跃迁的原因4. 化合物中,下面哪一种跃迁所需的能量最高(1)σ→σ*(2)π→π*(3)n→σ*(4)n→π*5. π→π*跃迁的吸收峰在下列哪种溶剂中测量,其最大吸收波长最大(1)水(2)甲醇(3)乙醇(4)正己烷6. 下列化合物中,在近紫外区(200~400nm)无吸收的是(1)(2)(3)(4)7. 下列化合物,紫外吸收λmax值最大的是(1)(2)(3)(4)二、解答及解析题1.吸收光谱是怎样产生的?吸收带波长与吸收强度主要由什么因素决定?2.紫外吸收光谱有哪些基本特征?3.为什么紫外吸收光谱是带状光谱?4.紫外吸收光谱能提供哪些分子结构信息?紫外光谱在结构分析中有什么用途又有何局限性?5.分子的价电子跃迁有哪些类型?哪几种类型的跃迁能在紫外吸收光谱中反映出来?6.影响紫外光谱吸收带的主要因素有哪些?7.有机化合物的紫外吸收带有几种类型?它们与分子结构有什么关系?8.溶剂对紫外吸收光谱有什么影响?选择溶剂时应考虑哪些因素?9.什么是发色基团?什么是助色基团?它们具有什么样结构或特征?10.为什么助色基团取代基能使烯双键的n→π*跃迁波长红移?而使羰基n→π*跃迁波长蓝移?11.为什么共轭双键分子中双键数目愈多其π→π*跃迁吸收带波长愈长?请解释其因。
12.芳环化合物都有B吸收带,但当化合物处于气态或在极性溶剂、非极性溶剂中时,B吸收带的形状有明显的差别,解释其原因。
有机波谱分析考试题库与答案

第二章:紫外吸收光谱法一、选择1. 频率(MHz)为4.47×108的辐射,其波长数值为(1)670.7nm (2)670.7μ(3)670.7cm (4)670.7m2. 紫外-可见光谱的产生是由外层价电子能级跃迁所致,其能级差的大小决定了(1)吸收峰的强度(2)吸收峰的数目(3)吸收峰的位置(4)吸收峰的形状3. 紫外光谱是带状光谱的原因是由于(1)紫外光能量大(2)波长短(3)电子能级差大(4)电子能级跃迁的同时伴随有振动及转动能级跃迁的原因4. 化合物中,下面哪一种跃迁所需的能量最高(1)σ→σ*(2)π→π*(3)n→σ*(4)n→π*5. π→π*跃迁的吸收峰在下列哪种溶剂中测量,其最大吸收波长最大(1)水(2)甲醇(3)乙醇(4)正己烷6. 下列化合物中,在近紫外区(200~400nm)无吸收的是(1)(2)(3)(4)7. 下列化合物,紫外吸收λmax值最大的是(1)(2)(3)(4)二、解答及解析题1. 吸收光谱是怎样产生的?吸收带波长与吸收强度主要由什么因素决定?2. 紫外吸收光谱有哪些基本特征?3. 为什么紫外吸收光谱是带状光谱?4. 紫外吸收光谱能提供哪些分子结构信息?紫外光谱在结构分析中有什么用途又有何局限性?5. 分子的价电子跃迁有哪些类型?哪几种类型的跃迁能在紫外吸收光谱中反映出来?6. 影响紫外光谱吸收带的主要因素有哪些?7.有机化合物的紫外吸收带有几种类型?它们与分子结构有什么关系?8. 溶剂对紫外吸收光谱有什么影响?选择溶剂时应考虑哪些因素?9. 什么是发色基团?什么是助色基团?它们具有什么样结构或特征?10.为什么助色基团取代基能使烯双键的n→π*跃迁波长红移?而使羰基n→π*跃迁波长蓝移?11. 为什么共轭双键分子中双键数目愈多其π→π*跃迁吸收带波长愈长?请解释其因。
12. 芳环化合物都有B吸收带,但当化合物处于气态或在极性溶剂、非极性溶剂中时,B吸收带的形状有明显的差别,解释其原因。
有机化合物波谱解析-有机波谱分析-课后习题答案-xu

第二章 质谱习题及答案1、化合物A 、B 质谱图中高质荷比区的质谱数据,推导其可能的分子式解:分子离子峰为偶数62=•+M表明不含氮或含有偶数个氮。
对于A ,1:3)(:)2(≈+M RI M RI ,所以分子中含有一个Cl 原子,不可能含氮。
则根据8.41.1100)()1(==⨯+x M RI M RI ,得3,2==y x ,所以A 分子式C 2H 3Cl ,UN=1合理;对于B ,4.4)2(=+M RI ,所以分子中可能含有一个S 原子,不可能含氮。
则根据8.38.01.1100)()1(=+=⨯+z x M RI M RI ,6,2==y x ,所以B 分子式C 2H 6S ,UN=0合理。
2、化合物的部分质谱数据及质谱图如下,推导其结构解:1:6:9)4(:)2(:)(≈++M RI M RI M RI ,所以分子中含有两个Cl ,m/z=96为分子离子峰,不含氮。
根据4.21.1100)()1(==⨯+x M RI M RI ,2,2==y x ,分子式为C 2H 2Cl 2,UN=1,合理。
图中可见:m/z 61(M-35),RI(100)为基峰,是分子离子丢失一个Cl 得到的; m/z=36, 为HCl +;m/z=26(M-Cl 2), RI(34),是分子离子丢失Cl 2得到的,相对强度大,稳定,说明结构为CHCl=CHCl 。
解:分子离子峰m/z 185为奇数表明含有奇数个氮。
基峰m/z 142=M 43,丢失的碎片可能为(C 3H 7,CH 3CO ),若丢失碎片为(CH 3CO),则来源于丁酰基或甲基酮,结合分子中含氮元素,很有可能为酰胺类物质,那么就应该有很强的分子离子峰,而m/z 185峰较弱,所以,丢失的中性碎片应该是(C 3H 7),来源于长链烷基,谱图中有而则m/z 29,43,57的烷基m/z 142=A 的组成, C x H y N z O w S S3.1037.01.1100)()1(=+=⨯+z x A RI A RI ,设z=1,则x=,若z=3,则x=,不合理。
有机波谱分析考试题库与答案

第二章:紫外吸收光谱法一、选择1. 频率(MHz)为4.47×108的辐射,其波长数值为(1)670.7nm (2)670.7μ(3)670.7cm (4)670.7m2. 紫外-可见光谱的产生是由外层价电子能级跃迁所致,其能级差的大小决定了(1)吸收峰的强度(2)吸收峰的数目(3)吸收峰的位置(4)吸收峰的形状3. 紫外光谱是带状光谱的原因是由于(1)紫外光能量大(2)波长短(3)电子能级差大(4)电子能级跃迁的同时伴随有振动及转动能级跃迁的原因4. 化合物中,下面哪一种跃迁所需的能量最高(1)σ→σ*(2)π→π*(3)n→σ*(4)n→π*5. π→π*跃迁的吸收峰在下列哪种溶剂中测量,其最大吸收波长最大(1)水(2)甲醇(3)乙醇(4)正己烷6. 下列化合物中,在近紫外区(200~400nm)无吸收的是(1)(2)(3)(4)7. 下列化合物,紫外吸收λmax值最大的是(1)(2)(3)(4)二、解答及解析题1. 吸收光谱是怎样产生的?吸收带波长与吸收强度主要由什么因素决定?2. 紫外吸收光谱有哪些基本特征?3. 为什么紫外吸收光谱是带状光谱?4. 紫外吸收光谱能提供哪些分子结构信息?紫外光谱在结构分析中有什么用途又有何局限性?5. 分子的价电子跃迁有哪些类型?哪几种类型的跃迁能在紫外吸收光谱中反映出来?6. 影响紫外光谱吸收带的主要因素有哪些?7.有机化合物的紫外吸收带有几种类型?它们与分子结构有什么关系?8. 溶剂对紫外吸收光谱有什么影响?选择溶剂时应考虑哪些因素?9. 什么是发色基团?什么是助色基团?它们具有什么样结构或特征?10.为什么助色基团取代基能使烯双键的n→π*跃迁波长红移?而使羰基n→π*跃迁波长蓝移?11. 为什么共轭双键分子中双键数目愈多其π→π*跃迁吸收带波长愈长?请解释其因。
12. 芳环化合物都有B吸收带,但当化合物处于气态或在极性溶剂、非极性溶剂中时,B吸收带的形状有明显的差别,解释其原因。
最新孟令芝-有机波谱分析-第三版课后习题及答案

第一章绪论第二章质谱习题及答案 第三章紫外习题及答案第四章 红外课后习题及答案 第五章核磁课后习题及答案 第一章绪论第二章质谱习题及答案1 一由化合物质谱图中高质荷比区的质谱数据,推导其可能的分子式。
A :用厶 60(5.8)61(8.7)62(:IOO)M +,63(4.8)64(31)65(0.71)B :加〃 60(9,0) 61(19.0) ' 63(3.8) 64<4.4) 65(0.09)解:A 、C 2H 3CI , B 、C 2H 6S分子离子峰为偶数表明含有偶数个氮或不含氮。
C x H y N z O w S s不含氮含氮RI(M+1) 4.8 A 、 100=1.1x 0.37z 100,设 z=1,则 x=4.02 , C 4N 分子量〉62,不RI(M) 100合理。
所以无氮元素。
同理B ,设z=1,则x=3.11 , C 3N 分子量〉62,不合理。
所以无氮元素。
同位素相对丰度表,p26表2.3。
解:C 2H 2CI 2, ClCH=CHClm/z=98分子离子峰,M : (M+2)=6:1 ,有两个氯。
同位素相对丰度表, p26表2.3。
M-35=98-CI , M-36=98-HCI , M-37=98-HCI-H 3,化合樹的质谱图如下,制%142(100) ,143(10.3),^4其可能结构*RI(M+1) 100=1.1x 0.37z 0.8sRI(M)RI(M+2)2“c (1.1x)2cc ,,100 0.2w 4.4sRI(M) 200RI(M+1) RI(M) RI(M+2)RI(M) 100 =1.1x 0.37z 0.8s100 二 (1.1x)2200 0.2w 4.4s 对于A , RI 相对丰度, M : (M+2)=3:1,则A 中有氯原子,推断其分子式为 CH 2=CHCl对于A , RI 相对丰度,M : (M+2)=25:1 ,则A 中有硫原子,推断其分子式CH 3CH 2SHIUKJ251563 32 2G6T7.0972 4 $0 24 创4351』00 99 10 62工9IQ07.010060-30 -26 4V«|60mfx2.比昔物的曲分应iff 数括矗宏if 图如下,拄导并第伺.ye300解:m/z 142=M-43(C3H7), m/z 142=C9H2o N , (n-C4H9)3N,分子离子峰为奇数表明含有奇数个氮。
有机化合物波谱解析_有机波谱分析 课后习题答案参考

第二章 质谱习题及答案1、化合物A 、B 质谱图中高质荷比区的质谱数据,推导其可能的分子式解:分子离子峰为偶数62=•+M表明不含氮或含有偶数个氮。
对于A ,1:3)(:)2(≈+M RI M RI ,所以分子中含有一个Cl 原子,不可能含氮。
则根据8.41.1100)()1(==⨯+x M RI M RI ,得3,2==y x ,所以A 分子式C 2H 3Cl ,UN=1合理;对于B ,4.4)2(=+M RI ,所以分子中可能含有一个S 原子,不可能含氮。
则根据8.38.01.1100)()1(=+=⨯+z x M RI M RI ,6,2==y x ,所以B 分子式C 2H 6S ,UN=0合理。
2、化合物的部分质谱数据及质谱图如下,推导其结构解:1:6:9)4(:)2(:)(≈++M RI M RI M RI ,所以分子中含有两个Cl ,m/z=96为分子离子峰,不含氮。
根据4.21.1100)()1(==⨯+x M RI M RI ,2,2==y x ,分子式为C 2H 2Cl 2,UN=1,合理。
图中可见:m/z 61(M-35),RI(100)为基峰,是分子离子丢失一个Cl 得到的; m/z=36, 为HCl +;m/z=26(M-Cl 2), RI(34),是分子离子丢失Cl 2得到的,相对强度大,稳定,说明结构为CHCl=CHCl 。
解:分子离子峰m/z 185为奇数表明含有奇数个氮。
基峰m/z 142=M -43,丢失的碎片可能为(⋅C 3H 7,CH 3CO ⋅),若丢失碎片为(CH 3CO ⋅),则来源于丁酰基或甲基酮,结合分子中含氮元素,很有可能为酰胺类物质,那么就应该有很强的分子离子峰,而m/z 185峰较弱,所以,丢失的中性碎片应该是(⋅C 3H 7),来源于长链烷基,谱图中有而则m/z 29,43,57的烷基m/z 142=A 的组成, C x H y N z O w S S 3.1037.01.1100)()1(=+=⨯+z x A RI A RI ,设z=1,则x=9.0,若z=3,则x=8.35,不合理。
有机波谱分析习题(最新)

有机波谱分析习题第一章电子辐射基础(一)判断题1.现代分析化学的任务是测定物质的含量。
( )2.测定某有机化合物中C、H、O、N元素含量的方法属于定性分析。
( )3.测定某有机化合物中是否含有羰基属于有机结构分析。
( )4.利用物质分子吸收光或电磁辐射的性质,建立起来的分析方法属于吸收光谱分析。
( )5.物质被激发后,利用物质跃迁至低能态或基态时发光的性质建立起来的分析方法属于发射光谱分析。
( )6.根据Franck-condon原理,在电子能级发生跃迁时,必然伴随振动能级和转动能级的变化。
( ) 7.紫外吸收光谱、红外吸收光谱、核磁共振波谱和质谱是有机结构分析的四种主要的有机光波谱分析方法,合称为四大谱。
( )8.电磁辐射的波长越长,能量越大。
( )9.有机波谱分析方法和仪器分析方法的灵敏度和准确度都要比化学分析法高得多。
( )10.一般来讲,分子光谱远比原子光谱复杂,原子光谱通常为线状光谱,而分子光谱为带状光谱。
( ) 11.吸收定律偏离线性完全是由于仪器因素引起的。
( )12.电子能级间隔越小,跃迁时吸收光子的频率越大。
( )13.分子光谱是由于电子的发射而产生的。
( )14.分子荧光也叫二次光,都属吸收光谱的畴。
( )15.ICP可用于测定F、Cl、Br、C、H、N、O、S等非金属元素。
( )(一)判断题答案1.×2.×3.√4.√5.√6.√7.√8.×9.×l0.√11.×l2.×13.×l4.×l5.×(二)单选题1.光或电磁辐射的二象性是指( )。
A.电磁辐射是由电矢量和磁矢量组成;B.电磁辐射具有波动性和电磁性;C.电磁辐射具有微粒性和光电效应;D.电磁辐射具有波动性和微粒性。
2.光量子的能量与电磁辐射的哪一个物理量成正比?( )A.频率;B.波长;C.周期;D.强度3.可见光区、紫外光区、红外光区、无线电波四个电磁波区域中,能量最大和最小的区域分别为( )。
孟令芝有机波谱分析后习题及答案

第一章 绪论第二章 质谱习题及答案 第三章 紫外习题及答案 第四章 红外课后习题及答案 第五章 核磁课后习题及答案第一章 绪论第二章 质谱习题及答案解:A 、C 2H 3Cl ,B 、C 2H 6S分子离子峰为偶数表明含有偶数个氮或不含氮。
C x H y N z O w S S不含氮 含氮22RI(M+1)100 1.10.370.8RI(M)RI(M+2)(1.1)1000.2 4.4RI(M)200x z sx w s ⨯=++⨯=++22RI(M+1)100 1.10.370.8RI(M)RI(M+2)(1.1)1000.2 4.4RI(M)200x z sx w s⨯=++⨯=++A 、RI(M+1) 4.8100 1.10.37100RI(M)100x z ⨯=+=⨯,设z=1,则x=4.02,C 4N 分子量>62,不合理。
所以无氮元素。
同理B ,设z=1,则x=3.11,C 3N 分子量>62,不合理。
所以无氮元素。
同位素相对丰度表,p26表2.3。
对于A ,RI 相对丰度,M :(M+2)=3:1,则A 中有氯原子,推断其分子式为CH 2=CHCl 对于A ,RI 相对丰度,M :(M+2)=25:1,则A 中有硫原子,推断其分子式CH 3CH 2SH解:C 2H 2Cl 2,ClCH=CHClm/z=98分子离子峰,M :(M+2)=6:1,有两个氯。
同位素相对丰度表,p26表2.3。
M-35=98-Cl ,M-36=98-HCl ,M-37=98-HCl-H解:m/z 142=M -43(⋅C 3H 7),m/z 142=C 9H 20N ,(n-C 4H 9)3N, 分子离子峰为奇数表明含有奇数个氮。
C x H y N z O w S SRI(M+1)10100 1.10.37100RI(M)100x z ⨯=+=⨯,设z=1,则x=8.75,若z=3,则x=8.08,不合理。
有机波谱分析习题(最新)

有机波谱分析习题第一章电子辐射基础(一)判断题1.现代分析化学的任务是测定物质的含量。
( )2.测定某有机化合物中C、H、O、N元素含量的方法属于定性分析。
( )3.测定某有机化合物中是否含有羰基属于有机结构分析。
( )4.利用物质分子吸收光或电磁辐射的性质,建立起来的分析方法属于吸收光谱分析。
( )5.物质被激发后,利用物质跃迁至低能态或基态时发光的性质建立起来的分析方法属于发射光谱分析。
( )6.根据Franck-condon原理,在电子能级发生跃迁时,必然伴随振动能级和转动能级的变化。
( ) 7.紫外吸收光谱、红外吸收光谱、核磁共振波谱和质谱是有机结构分析的四种主要的有机光波谱分析方法,合称为四大谱。
( )8.电磁辐射的波长越长,能量越大。
( )9.有机波谱分析方法和仪器分析方法的灵敏度和准确度都要比化学分析法高得多。
( )10.一般来讲,分子光谱远比原子光谱复杂,原子光谱通常为线状光谱,而分子光谱为带状光谱。
( ) 11.吸收定律偏离线性完全是由于仪器因素引起的。
( )12.电子能级间隔越小,跃迁时吸收光子的频率越大。
( )13.分子光谱是由于电子的发射而产生的。
( )14.分子荧光也叫二次光,都属吸收光谱的范畴。
( )15.ICP可用于测定F、Cl、Br、C、H、N、O、S等非金属元素。
( )(一)判断题答案1.×2.×3.√4.√ 5.√ 6.√ 7.√8.×9.×l0.√11.×l2.×13.×l4.×l5.×(二)单选题1.光或电磁辐射的二象性是指( )。
A.电磁辐射是由电矢量和磁矢量组成;B.电磁辐射具有波动性和电磁性;C.电磁辐射具有微粒性和光电效应;D.电磁辐射具有波动性和微粒性。
2.光量子的能量与电磁辐射的哪一个物理量成正比?( )A.频率;B.波长;C.周期;D.强度3.可见光区、紫外光区、红外光区、无线电波四个电磁波区域中,能量最大和最小的区域分别为( )。
有机化合物波谱解析-有机波谱分析-课后习题答案-xu

第二章 质谱习题及答案1、化合物A 、B 质谱图中高质荷比区的质谱数据,推导其可能的分子式解:分子离子峰为偶数62=•+M表明不含氮或含有偶数个氮。
对于A ,1:3)(:)2(≈+M RI M RI ,所以分子中含有一个Cl 原子,不可能含氮。
则根据8.41.1100)()1(==⨯+x M RI M RI ,得3,2==y x ,所以A 分子式C 2H 3Cl ,UN=1合理;对于B ,4.4)2(=+M RI ,所以分子中可能含有一个S 原子,不可能含氮。
则根据8.38.01.1100)()1(=+=⨯+z x M RI M RI ,6,2==y x ,所以B 分子式C 2H 6S ,UN=0合理。
2、化合物的部分质谱数据及质谱图如下,推导其结构解:1:6:9)4(:)2(:)(≈++M RI M RI M RI ,所以分子中含有两个Cl ,m/z=96为分子离子峰,不含氮。
根据4.21.1100)()1(==⨯+x M RI M RI ,2,2==y x ,分子式为C 2H 2Cl 2,UN=1,合理。
图中可见:m/z 61(M-35),RI(100)为基峰,是分子离子丢失一个Cl 得到的; m/z=36, 为HCl +;m/z=26(M-Cl 2), RI(34),是分子离子丢失Cl 2得到的,相对强度大,稳定,说明结构为CHCl=CHCl 。
解:分子离子峰m/z 185为奇数表明含有奇数个氮。
基峰m/z 142=M 43,丢失的碎片可能为(C 3H 7,CH 3CO ),若丢失碎片为(CH 3CO),则来源于丁酰基或甲基酮,结合分子中含氮元素,很有可能为酰胺类物质,那么就应该有很强的分子离子峰,而m/z 185峰较弱,所以,丢失的中性碎片应该是(C 3H 7),来源于长链烷基,谱图中有而则m/z 29,43,57的烷基m/z 142=A 的组成, C x H y N z O w S S3.1037.01.1100)()1(=+=⨯+z x A RI A RI ,设z=1,则x=,若z=3,则x=,不合理。
课后答案】有机波谱分析(孟令芝,第三版

课后答案】有机波谱分析(孟令芝,第三版第1章绪论1.1 有机波谱分析的基本概念1. 有机波谱分析是指利用波谱技术对有机化合物的结构和性质进行定性和定量分析的一种方法。
2. 有机波谱分析的原理是利用分子的不同振动和旋转运动所引起的吸收或发射电磁波来分析物质的结构和性质。
3. 有机波谱分析的分类包括红外光谱分析、核磁共振波谱分析、质谱分析等。
1.2 红外光谱分析1. 红外光谱是指波长范围为0.8~1000 μm的电磁辐射。
2. 红外光谱分析利用化合物中不同化学键的振动和变形所吸收的红外辐射来分析物质的结构和性质。
3. 红外光谱的谱图通常分为三个区域:近红外区、中红外区和远红外区,对应的波数范围为12000~4000 cm-1、4000~400 cm-1和400~10 cm-1。
4. 红外光谱的谱图可通过化合物中的官能团、分子结构和化学键的性质来进行解释和分析,常见的化学键包括C-H、O-H、N-H、C=O、C=C、C≡C等。
1.3 核磁共振波谱分析1. 核磁共振波谱是指当核磁矩和外磁场相互作用时反应出的光谱。
2. 核磁共振波谱分析利用化合物中含有氢、碳等元素的核磁共振信号来分析物质的结构和性质。
3. 核磁共振波谱分析中的化学位移指的是核磁共振信号所对应的频率与参考标准物质的频率差值,常用的参考标准物质包括TMS、CDCl3等。
4. 核磁共振波谱的谱图可通过分析化合物中的化学位移、峰形、耦合常数等来对化合物的结构和性质进行解释和分析。
1.4 质谱分析1. 质谱分析是指将化合物分解为不同的离子,并在磁场中进行分离、聚集和检测,从而得到物质的结构和性质信息的一种方法。
2. 质谱分析的过程包括化合物的分子离化、离子加速、离子分离和离子检测等。
3. 质谱分析中常用的离子化方法包括电子轰击法、化学离子化法等。
4. 质谱分析的谱图可通过分析离子碎片的质荷比、相对丰度等来对化合物的结构和性质进行解释和分析。
第2章红外光谱分析2.1 基本原理和仪器1. 红外光谱是指物质分子在红外辐射下吸收、散射和反射的现象。
波谱分析_习题集参考答案_

第一章紫外光谱一、单项选择题1. 比拟以下类型电子跃迁的能量大小( A)Aσ→σ* > n→σ* > π→π* > n →π*Bπ→π* > n →π* >σ→σ* > n→σ*Cσ→σ* > n→σ* > > n →π*> π→π*Dπ→π* > n→π* > > n→σ*σ→σ*2、共轭体系对λmax的影响( A)A共轭多烯的双键数目越多,HOMO与LUMO之间能量差越小,吸收峰红移B共轭多烯的双键数目越多,HOMO与LUMO之间能量差越小,吸收峰蓝移C共轭多烯的双键数目越多,HOMO与LUMO之间能量差越大,吸收峰红移D共轭多烯的双键数目越多,HOMO与LUMO之间能量差越大,吸收峰蓝移3、溶剂对λmax的影响(B)A溶剂的极性增大,π→π*跃迁所产生的吸收峰紫移B溶剂的极性增大,n →π*跃迁所产生的吸收峰紫移C溶剂的极性减小,n →π*跃迁所产生的吸收峰紫移D溶剂的极性减小,π→π*跃迁所产生的吸收峰红移4、苯及其衍生物的紫外光谱有:(B)A二个吸收带B三个吸收带C一个吸收带D没有吸收带5. 苯环引入甲氧基后,使λmax(C)A没有影响B向短波方向移动C向长波方向移动D引起精细构造的变化6、以下化合物可以通过紫外光谱鉴别的是:(C)二、简答题1〕发色团答:分子中能吸收紫外光或可见光的构造2〕助色团本身不能吸收紫外光或可见光,但是与发色团相连时,可以使发色团的吸收峰向长波答:方向移动,吸收强度增加。
3〕红移答:向长波方向移动4〕蓝移答:向短波方向移动5〕举例说明苯环取代基对λmax的影响答:烷基〔甲基、乙基〕对λmax影响较小,约5-10nm;带有孤对电子基团〔烷氧基、烷氨基〕为助色基,使λmax红移;与苯环共轭的不饱和基团,如CH=CH,C=O等,由于共轭产生新的分子轨道,使λmax显著红移。
6〕举例说明溶剂效应对λmax的影响答:溶剂的极性越大,n →π*跃迁的能量增加,λmax向短波方向移动;溶剂的极性越大,π→π*跃迁的能量降低,λmax向长波方向移动。
波谱分析习题答案
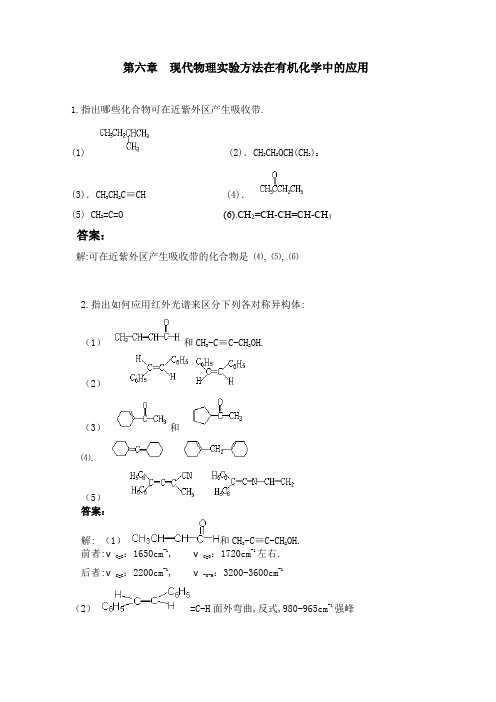
第六章 现代物理实验方法在有机化学中的应用1.指出哪些化合物可在近紫外区产生吸收带.(1) (2).CH 3CH 2OCH(CH 3)2(3).CH 3CH 2C≡CH (4).(5) CH 2=C=O (6).CH 2=CH-CH=CH-CH 3答案:解:可在近紫外区产生吸收带的化合物是 ⑷, ⑸, ⑹2.指出如何应用红外光谱来区分下列各对称异构体:(1) 和CH 3-C≡C -CH 2OH.(2)(3) 和⑷.(5)答案:解: (1)和CH 3-C≡C -CH 2OH.前者:νC=C :1650cm -1, νC=O :1720cm -1左右.后者:νC=C:2200cm -1, ν-O-H:3200-3600cm -1(2) =C-H 面外弯曲,反式,980-965cm -1强峰=C-H面外弯曲,顺式,730-650峰形弱而宽.⑶. 和,在共轭体系中,羰基吸收波数低于非共轭体系的羰基吸收.⑷. 中的C=C=C伸缩振动1980cm-1. 中的C=C 伸缩振动1650cm-1.(5)吸收波数νC≡N >νC=C=N,νC≡N在2260-2240cm-1左右.在C=C-H的面外弯曲振动910-905cm-1 3.预计下列每个化合物将有几个核磁共振信号?⑴.CH3CH2CH2CH3(2)(3).CH3-CH=CH2(4)反-2-丁烯(5)1,2-二溴丙烷(6)CH2BrCl(7)(8)2-氯丁烷答案:解:⑴. 2个⑵.4个(必须是高精密仪器,因有顺反异构)⑶.4个(有顺反异构)⑷.2个⑸.3个⑹.1个⑺.3个⑻.4个4.定出具有下列分子式但仅有一个核磁共振信号的化合物结构式.(1) C5H12(2) C3H6(3)C2H6O (4) C3H4(5) C2H4Br2(6) C4H6(7)C8H18(8)C3H6Br2答案:解:(1)(2) (3) CH 3-O-CH 3(4) CH 2=C=CH 2 (5) BrCH 2-CH 2Br (6) CH 3-C≡C -CH 3(7) (8)5. 某化合物的分子式为C 4H 8O ,它的IR 谱在1715cm -1有强吸收峰;1HNMR 谱有一个单峰(3H),一个四重峰(2H)和一个三重峰(3H)。
有机波谱分析考试题库与答案

第二章:紫外吸收光谱法一、选择1. 频率(MHz)为4.47×108的辐射,其波长数值为(1)670.7nm (2)670.7μ(3)670.7cm (4)670.7m2. 紫外-可见光谱的产生是由外层价电子能级跃迁所致,其能级差的大小决定了(1)吸收峰的强度(2)吸收峰的数目(3)吸收峰的位置(4)吸收峰的形状3. 紫外光谱是带状光谱的原因是由于(1)紫外光能量大(2)波长短(3)电子能级差大(4)电子能级跃迁的同时伴随有振动及转动能级跃迁的原因4. 化合物中,下面哪一种跃迁所需的能量最高(1)σ→σ*(2)π→π*(3)n→σ*(4)n→π*5. π→π*跃迁的吸收峰在下列哪种溶剂中测量,其最大吸收波长最大(1)水(2)甲醇(3)乙醇(4)正己烷6. 下列化合物中,在近紫外区(200~400nm)无吸收的是(1)(2)(3)(4)7. 下列化合物,紫外吸收λmax值最大的是(1)(2)(3)(4)二、解答及解析题1. 吸收光谱是怎样产生的?吸收带波长与吸收强度主要由什么因素决定?2. 紫外吸收光谱有哪些基本特征?3. 为什么紫外吸收光谱是带状光谱?4. 紫外吸收光谱能提供哪些分子结构信息?紫外光谱在结构分析中有什么用途又有何局限性?5. 分子的价电子跃迁有哪些类型?哪几种类型的跃迁能在紫外吸收光谱中反映出来?6. 影响紫外光谱吸收带的主要因素有哪些?7.有机化合物的紫外吸收带有几种类型?它们与分子结构有什么关系?8. 溶剂对紫外吸收光谱有什么影响?选择溶剂时应考虑哪些因素?9. 什么是发色基团?什么是助色基团?它们具有什么样结构或特征?10.为什么助色基团取代基能使烯双键的n→π*跃迁波长红移?而使羰基n→π*跃迁波长蓝移?11. 为什么共轭双键分子中双键数目愈多其π→π*跃迁吸收带波长愈长?请解释其因。
12. 芳环化合物都有B吸收带,但当化合物处于气态或在极性溶剂、非极性溶剂中时,B吸收带的形状有明显的差别,解释其原因。
有机波谱分析复习参考含答案
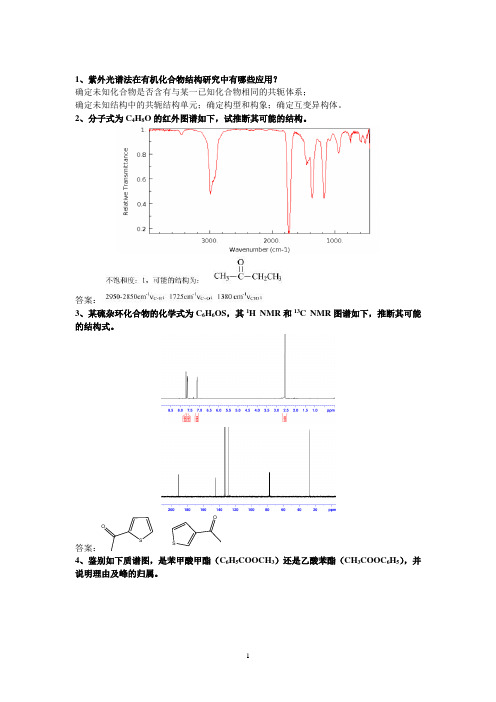
1、紫外光谱法在有机化合物结构研究中有哪些应用?确定未知化合物是否含有与某一已知化合物相同的共轭体系;确定未知结构中的共轭结构单元;确定构型和构象;确定互变异构体。
2、分子式为C4H8O的红外图谱如下,试推断其可能的结构。
答案:3、某硫杂环化合物的化学式为C6H6OS,其1H NMR和13C NMR图谱如下,推断其可能的结构式。
答案:SOSO4、鉴别如下质谱图,是苯甲酸甲酯(C6H5COOCH3)还是乙酸苯酯(CH3COOC6H5),并说明理由及峰的归属。
答案:C 6H 5COOCH 35、某化合物的紫外光谱:OH H C m ax 52λ 262nm (m ax ε15);红外光谱:3330~2500cm -1间有强宽吸收,1715 cm -1处有强宽吸收;核磁共振氢谱:δ11.0处为单质子单峰,δ2.6处为四质子宽单峰,δ2.12处为三质子单峰,质谱如图所示。
参照同位素峰强比及元素分析结果,分子式为C 5H 8O 3,试推测其结构式。
答案:CH 3COCH 2CH 2COOH1、紫外光谱在有机化合物结构鉴定中的主要贡献是什么?答:在有机结构鉴定中,紫外光谱在确定有机化合物的共轭体系、生色团和芳香性等方面有独到之处2、红外光谱产生必须具备的两个条件是什么?答:一是红外辐射的能量应与振动能级差相匹配,即E 光=△E ν,二是分子在振动过程中偶极矩的变化必须不为零。
3、核磁共振谱是物质内部什么运动在外部的一种表现形式?答:是具有核磁矩的原子核的自旋运动在外部的一种表现形式。
4、解释什么是碳谱的γ-效应答:当取代基处在被观察的碳的γ位,由于电荷相互排斥,被观察的碳周围电子云密度增大,δC 向高场移动。
6、根据图 6-1~图6-4推断分子式为C 11H 20O 4未知物结构答案:1.当体系的共轭双键增多时,紫外光谱图会发生什么变化?阐明发生变化的原因。
答:当体系的共轭双键增多时,吸收光会向长波方向移动,即发生红移现象。
有机化合物波谱解析_有机波谱分析课后习题答案参考

第二章质谱习题及答案1、化合物A 、B 质谱图中高质荷比区的质谱数据,推导其可能的分子式A : WA 60(5 8)61(8.7)62(100)M +'63( ∣.S) G4(31) 65(0-71)B : m 心 60(9.0) 61(19.0) 52( J(W)M 4* 63(3∙8) 64(4.4) 65(0.09)解:分子离子峰为偶数=62表明不含氮或含有偶数个氮。
对于A , Rl(M + 2): RI(M )心3:1 ,所以分子中含有一个Cl 原子,不可能含氮。
则根据CW + I)XlOO=I.Lv = 4.8 ,得X = 2』=3 J 所以 A 分子式 C 2H 3Cl f UN=I 合理; RI(M)对于B , Rl(M +2) = 4.4 ,所以分子中可能含有一个S 原子,不可能含氮。
则根据RHM + I)X loo = 1. Lv + 0.8z = 3.8 , x = 2, y = 6 .所以 B 分子式 C2I‰S fUN=O 合理。
RI (M)2、化合物的部分质谱数据及质谱图如下,推导其结构解:RI(M): RI(M + 2): RI(M + 4) ≈ 9:6:1 ,所以分子中含有两个Cl, n√z =96为分子离子峰,不含氮。
根据"W +hχl00 = 1」x = 2.4 # x = 29y = 2 f 分子式为 C 2H 2Cl 2 f UN=I .合理。
Rl(M)图中可见:n√z61(M -35), Rl(IOO)为基峰,是分子离子丢失一个Cl 得到的;m∕z=36,为HCI +; n√z=26(M -Ch), RI(34),是分子离子丢失Cb 得到的,相对强 度大,稳定,说明结构为CHCl=CHCI O961003•化合物的质谱图如下w儿U5<M+∖>1l42(lOO)l L43(iO 3),推导其可能结构。
分子离子峰n√z 185为奇数表明含有奇数个氮。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章 质谱习题及答案
解:A 、C 2H 3Cl,B 、C 2H 6S
分子离子峰为偶数表明含有偶数个氮或不含氮。
C x H y N z O w S S
不含氮 含氮
2
2
RI(M+1)
100 1.10.370.8RI(M)
RI(M+2)(1.1)100
0.2 4.4RI(M)200x z s
x w s ⨯=++⨯=++
2
2
RI(M+1)
100 1.10.370.8RI(M)
RI(M+2)(1.1)
1000.2 4.4RI(M)200x z s
x w s
⨯=++⨯=++
A 、
RI(M+1) 4.8
100 1.10.37100RI(M)100
x z ⨯=+=⨯,设z=1,则x=4、02,C 4N 分子量>62,不合理。
所以无氮元素。
同理B,设z=1,则x=3、11,C 3N 分子量>62,不合理。
所以无氮元素。
同位素相对丰度表,p26表2、3。
对于A,RI 相对丰度,M:(M+2)=3:1,则A 中有氯原子,推断其分子式为CH 2=CHCl 对于A,RI 相对丰度,M:(M+2)=25:1,则A 中有硫原子,推断其分子式CH 3CH 2SH
解:C 2H 2Cl 2,ClCH=CHCl
m/z=98分子离子峰,M:(M+2)=6:1,有两个氯。
同位素相对丰度表,p26表2、3。
M-35=98-Cl,M-36=98-HCl,M-37=98-HCl-H
解:m/z 142=M -43(⋅C 3H 7),m/z 142=C 9H 20N,(n-C 4H 9)3N, 分子离子峰为奇数表明含有奇数个氮。
C x H y N z O w S S
RI(M+1)10
100 1.10.37100RI(M)100
x z ⨯=+=⨯,设z=1,则x=8、75,若z=3,则x=8、08,不合理。
M:(M+1)=10:1,表明不含有卤素与氧硫。
m/z 44=CH 2=N +HCH 3,m/z 100=142-42(C 3H 6) m/z 57=M -43(⋅C 3H 7),
m/z 44=57-13(CH 3),CH 2=N +HCH 3,
第四章 红外课后习题及答案
间、邻、对硝基甲苯
第三章紫外习题及答案
核磁共振氢谱习题解答
孟令芝_有机波谱分析_第三版课后习题及答案
“核磁共振氢谱”部分习题参考答案
1. CH 3CH 2COOCH 3 , 2、CH 3CH 2OCOCH(NO 2)CH 3
3. (a) C 6H 5CH(CH 3)OCOCH 3 , (b)C 6H 5CH 2CH 2OCOCH 3, (c) p -CH 3C 6H 4COOCH 2CH 3
4、 HOCH 2CH 2CN ,
5、 CH 3CH 2OCOCH 2N(CH 3)2 6. CH 3CH 2OCOCH=CHCOOCH 2CH 3 , 7、 略, 8、 CH 3CH 2CH 2COOCH=CH 2 OCH 3OCH 3
NH 2c
a b 9.
δa 6.35ppm, (1H, dd, Jac=8Hz, Jab=2Hz)δb 6.56ppm, (1H, d, Jab=2Hz)
δc 6.85ppm, (1H, dd, Jca=8Hz) 9. (a) 2-乙基吡啶,(b) 3-乙基吡啶
“核磁共振碳谱”部分习题参考答案
3、 CH 3COOCH=CH 2
4、 p -N ≡CC 6H 4COOH
5、 p -ClC 6H 4COCH 3
6、 CH 3CH 2OCOCH 2CH 2COOCH 2CH 3
7. (CH 3CH 2CO)2O 8、 a: C 6H 5CH 2COCH 3 , b: C 6H 5COCH 2CH 3
8. C 6H 5OCH 2CH 2OCOCH 3。
