蛋白质结构分析及三维可视化bisbioinformaticsserver
第5章蛋白质化学-蛋白质的三维结构ppt课件

具有独立三级结构的多肽链单位,称为亚基 或亚单位(subunit),亚基可以相同,亦可以不同。 四级结构的实质是亚基在空间排列的方式。
(二)亚基的缔合
血红蛋白(Hb)是四个亚基缔合而成,聚合动力:疏 水作用(主要),二硫键,离子键,氢键等。
纤维状蛋白质是结构蛋白,含大量的α-螺旋, β-折叠片,整个分子呈纤维状,广泛分布于脊椎和 无脊椎动物体内,起支架和保护作用。角蛋白来 源于外胚层细胞,包括皮肤以及皮肤的衍生物:发, 毛,鳞,羽,翮,甲,蹄,角,爪,啄等.角蛋白可分为α-角 蛋白和β- 角蛋白。
α-角蛋白,如毛发中主要蛋白质。β-角蛋白, 如丝心蛋白。
结构域间的裂缝,常是酶的活性部位,也是反应物的 出入口
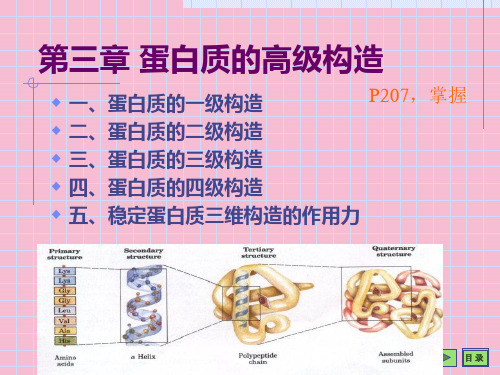
三、蛋白质三级结构
(一).三级结构的特点 (二). 肌红蛋白(Mb)的构象 (三). 一级结构与三级结构的关系 (四).维持三级结构的作用力
(一)三级结构的特点
一条多肽链中所有原子在三维空间的整 体排 布,称为三级结构,是包括主、侧链在内的空间 排列。大多数蛋白质的三级结构为 球状或近似球 状。在三级结构中,大多数的亲水的R侧基分布 于球形结构的表面,而疏水的R侧基分布于球形 结构的内部,形成疏水的核心。
三级结构形成后,生物学活性必需基团靠近,形成活 性中心或部位,即蛋白质分子表面形成了某些发挥生物学 功能的特定区域。
(三) 一 级 结 构 与 三 级 结 构 的 关 系
四、寡聚蛋白的四级结构
(一)寡聚蛋白的概念 (二)亚基的聚合 (三)亚基的空间排布 (四)血红蛋白(Hb)的构象
(一) 寡聚蛋白的概念
主要的化学键 包括:疏水键、 离子键、氢键 和 范德华力等。
蛋白质三维结构解析方法

蛋白质三维结构解析方法蛋白质三维结构解析是研究蛋白质以及其功能与途径的重要方法之一。
蛋白质是生物体内最基本的分子之一,它们在生物体内扮演着重要的功能角色,如催化化学反应、传递信号和提供结构支持等。
为了理解蛋白质的功能和机制,科学家们必须了解其三维结构。
本文将介绍常用的蛋白质三维结构解析方法,包括X射线晶体学、核磁共振(NMR)和电子显微镜(EM)等。
1. X射线晶体学X射线晶体学是最常用的蛋白质结构解析方法之一。
它利用X射线穿过蛋白质晶体后的衍射图案来确定蛋白质的原子位置。
首先,科学家需要获取蛋白质的晶体。
然后,通过将晶体暴露在X射线的束中,X 射线会通过晶体并在检测器上产生衍射图案。
最后,利用衍射图案进行计算和建模,可以得到蛋白质的高分辨率结构。
X射线晶体学可以解析蛋白质的原子级细节,包括氨基酸残基和键的位置、各种结构域的排列和相互作用等。
2.核磁共振(NMR)核磁共振是另一种常用的蛋白质结构解析方法。
它利用蛋白质中的核自旋对外加磁场和脉冲磁场作出响应的原理来确定蛋白质的结构。
在NMR实验中,蛋白质样品通常以溶液形式存在。
通过对样品施加一个强磁场,并用脉冲序列引发核磁共振,可以得到关于蛋白质构象的信息。
通过收集多组核磁共振信号并进行处理,科学家可以恢复蛋白质的结构信息。
3.电子显微镜(EM)电子显微镜是一种高分辨率的显微镜技术,可以直接观察蛋白质样品的形状和结构。
与传统光学显微镜不同,电子显微镜使用电子束而不是光束来成像。
对于蛋白质结构解析,电子显微镜通常与冷冻电镜技术结合使用。
在冷冻电镜中,蛋白质样品被快速冷冻在液氮中,以保持其自然结构。
然后,使用电子显微镜将样品成像,并通过多幅图像的拍摄和处理来重建蛋白质的三维结构。
4.结合模型构建和模拟计算除了实验方法外,结合模型构建和模拟计算也是蛋白质三维结构解析的一部分。
通过结合蛋白质样品的化学、物理和生物信息学知识,可以利用计算模型和算法来预测和模拟蛋白质的结构。
-蛋白质的三维结构ppt课件
两个肽键衍生而来
目录
影响螺旋构成的要素〔P208,熟习〕
(1) R侧链对α-螺旋的影响
R侧链的大小和带电性决议了能否构成α-螺旋以及 构成的α-螺旋的稳定性。
① 多肽链上延续出现带同种电荷基团的氨基酸残基, (如Lys,或Asp,或Glu),那么由于静电排斥,不能 构成链内氢键,从而不能构成稳定的α-螺旋。如多聚 Lys、多聚Glu。而当这些残基分散存在时,不影响α螺旋稳定。
目录
β-凸起(了解)
β-凸起是一种小片的非反复性构 造,能单独存在,大多数经常作 为反平行β-折叠片中的一种不规 那么情况而存在。 β-凸起可以为是β-折叠股中额外 插入的一个残基,它使得在两个 正常氢键之间、在凸起折叠股上 是两个残基,而另一侧的正常股 上的一个残基。 β-凸起可引起多肽链方向的改动, 但改动的程度不如β-转角。
目录
〔1〕超二级构造〔掌握〕
在蛋白质分子中,由假
αα
设干相邻的二级构造单元组
合在一同,彼此相互作用,
构成有规那么的、在空间上
能识别的二级构造组合体。
几种类型的超二级构造:
ββ
αα;ββ;βαβ;
★超二级构造在构造层
次上高于二级构造,但没有
聚集成具有功能的构造域.
βαβ
目录
〔2〕构造域〔P222,掌握〕 多肽链在二级构造或超二级构造的根底 上构成三级构造的部分折叠区,它是相对 独立的严密球状实体,称为构造域。 *对于那些较小的蛋白质分子或亚基来说, 构造域和三级构造是一个意思,也就是说 这些蛋白质或亚基是单构造域的,如红氧 还蛋白、肌红蛋白等; *对于较大的球状蛋白质或亚基,其三级 构造往往由两个或多个构造域缔合而成也
我国1965年在世界上第一个用化学方法人工合成 的蛋白质就是这种牛胰岛素。
蛋白质的三维结构

§1.8 蛋白质的三维结构P197 第5章蛋白质三维结构由氨基酸序列决定,且符合热力学能量最低要求,与溶剂和环境有关。
①主链基团之间形成氢键。
②暴露在溶剂中(水)的疏水基团最少。
③多肽链与环境水(必须水)形成氢键。
(一)研究蛋白质构象的方法(1)X-射线衍射法:是目前最明确揭示蛋白质大多数原子空间位置的方法,为研究蛋白质三维结构最主要的方法。
步骤为:蛋白质分离、提纯→单晶培养→晶体学初步鉴定→衍生数据收集→结晶解析→结构精修→结构表达。
(2)其他方法:NMR、紫外差光谱、荧光和荧光偏振、圆二色性、二维结晶三维重构。
(二)稳定蛋白质三维结构的作用力(1)弱相互作用(或称非共价键,或次级键)1. 氢键2. 疏水作用(熵效应)3. 范德华力4. 离子键(盐键)(2)共价二硫键(三)酰胺平面和二面角P 205 图5-11(1)酰胺平面(肽平面):肽键上的四个原子和相连的Cα1和Cα2所在的平面。
(2)两面角:每个氨基酸有三个键参与多肽主链,一个肽键具有双键性质不易旋转,另两个键一个为Cα1与羰基形成的单键,可自由旋转,角度称为ψ,另一个为NH与Cα2形成的单键也可自由旋转,角度称为φ,ψ和φ称为二面角或构象角,原则上可取-1800~+1800之间任意值(实际受立体化学和热力学因素所限制),肽链构象可用两面角ψ和φ来描述,由ψ和φ值可确定多肽主链构象。
(四)二级结构 P207多肽链折叠的规则方式,是能量平衡和熵效应的结果。
主链折叠由氢键维持(主要),疏水基团在分子内,亲水基团在分子表面。
常见的二级结构元件:α-螺旋,β-折叠片,β-转角和无规卷曲。
(1)α-helix:蛋白质含量最丰富的二级结构。
肽链主链围绕中心轴盘绕成螺旋状紧密卷曲的棒状结构,称为α-螺旋。
1.两面角ψ和φ分别在-570和-470附近(φ:从Cα向N看,顺时针旋转为正,逆时针为负;ψ:从Cα向羰基看,顺时针为正,逆时针为负。
)2.每圈螺旋含约3.6个氨基酸残基,由H键封闭的环中原子数为13,此种α-螺旋又称3.613-螺旋,每周螺距为0.54nm,R基均在螺旋外侧,P208图5-14。
蛋白质结构的三维显示与分析

蛋白质结构的三维显示与分析蛋白质是生命体中最重要的大分子。
它们具有非常多种多样的结构与功能,从而构成了生物体中各种生命过程的基石。
而要了解蛋白质的结构,我们需要借助于三维显示与分析技术。
一、蛋白质的结构蛋白质是由氨基酸组成的大分子,它们的结构可以分为四个层次:一级结构、二级结构、三级结构和四级结构。
一级结构是由一系列氨基酸残基组成的线性链结构,它决定了蛋白质的基本序列。
氨基酸残基的种类、数量和排列顺序决定了蛋白质的特定结构和功能。
二级结构是由多个氨基酸残基之间的氢键和离子键组成,这些键能使得氨基酸残基在空间上形成一些稳定的二面角结构。
常见的二级结构有α-螺旋和β-折叠。
三级结构指的是蛋白质链的立体构造,包括折叠成特定的三维空间形状。
这种结构的形成是由各个氨基酸残基之间相互作用、分子间相互作用所决定的。
四级结构指的是由多个亚单位组成的大分子。
通常来说,蛋白质的四级结构是非常重要的,因为它可以决定蛋白质的生物活性和功能。
二、蛋白质的三维显示技术了解蛋白质的空间结构非常重要,因为不同结构的蛋白质会在生命体中发挥不同的功能。
蛋白质的三维显示技术可以通过计算机模拟、X射线晶体学、核磁共振等方法来实现。
计算机模拟比较直观,通常是通过计算机模拟蛋白质的构建来实现。
这种方法通常需要先确定蛋白质的氨基酸序列,然后通过计算可得到氨基酸在空间中的位置。
但是由于蛋白质的构建非常复杂,因此计算机模拟需要比较高的计算能力,同时对于大型蛋白质的模拟也比较困难。
核磁共振可以通过检测蛋白质中氢、碳、氮等核磁共振现象来实现。
这种方法的优点在于它可以非常直观地显示出蛋白质的结构,同时可以检测蛋白质在溶液中的构型变化。
由于核磁共振需要设备非常昂贵,因此它的应用范围比较有限。
X射线晶体学是一种比较常用的蛋白质结构解析方法。
通过对晶体样品反射的X射线进行测量,可以推算出其分子结构。
这种方法的优点在于它可以处理的晶体样本比较多,而且可以获得非常高的分辨率,可以得到非常准确的蛋白质结构。
美国科学家已经绘制出三维蛋白质组形状图

美国科学家已经绘制出三维蛋白质组形状图
佚名
【期刊名称】《食品科学》
【年(卷),期】2007(28)7
【摘要】美国加州伯克利大学的科研小组宣布,已绘制出三维蛋白质组形状图,有关研究成果已发表在美国国家科学院院刊上。
生物学界认为,这是在蛋白质组图绘制工作中迈出的重要一步。
伯克利科研小组绘制的三维蛋白质组形状图,可显示构成生命的成千上万个蛋白质形状的相同与不同之处。
它让科学家对蛋白质的形状与构成结构有了直观地了解,其中包括蛋白质各种不同形式的卷曲、转向以及它们的演变等情况。
【总页数】1页(P241-241)
【关键词】美国科学家;蛋白质组;形状;三维;美国加州;研究成果;绘制工作;科学院【正文语种】中文
【中图分类】Q51
【相关文献】
1.科学家绘制出毛白杨基因组序列框架图 [J],
2.美绘制出三维蛋白质组形状图 [J], 无
3.美科学家绘制出小鼠大脑中5-羟甲基胞嘧啶随基因组变化的分布图 [J],
4.我国科学家绘制出毛白杨基因组序列框架图 [J],
5.德国科学家首次用中子绘制出三维磁场图 [J],
因版权原因,仅展示原文概要,查看原文内容请购买。
生物化学第5章蛋白质的三维结构

二、稳定蛋白质三维 结构的作用力
稳定蛋白质三维结构的作用力主要是一些
所谓弱的相互作用,或称非共价键和次级键,
包括氢键、范德华力、疏水作用和盐键(离子
键)。这些弱的相互作用也是稳定核酸构象、 生物膜结构的作用力。此外,共价的二硫键在 稳定某些蛋白质的构象方面也起着重要的作用。
稳定蛋白质三维结构 的作用力图示
十、亚基缔合和四级结构
一、研究蛋白质构象的方法
(x 射线衍射法)
用 x 射线衍射(x ray diffraction )研究
蛋白质的构象时,蛋白质必须结晶。用波长
很短的 x 射线照射蛋白质晶体,发生散射,底 片曝光后,得到衍射图,再经计算机处理, 绘出电子密度图,从中构建出三维分子图像。
抹香鲸肌红蛋白三维结构的 x射线衍射研究
①盐键 ②氢键 ③ 疏水作用 ④范德华力 ⑤二硫键
稳定蛋白质三维结构 的几种键的键能
键 键能(kJ / mol)
氢键 范德华力
疏水作用 盐键 二硫键
13~30 4~8
12~20 12~30 210
氢 键
由电负性强的原子与氢形成的基团如 N - H和
O-H具有很大的偶极矩,成键电子云分布偏向电
负性大的原子,氢原子核周围的电子分布就少,正 电荷的氢核在外侧裸露。这一正电荷氢核遇到附近 一个电负性强的原子时,就产生静电吸引,即是氢 键。氢键有两个重要的特征,一是方向性,受体 y
荧光变化,可知与荧光探针结合的部位处于何
种微环境。
圆二色性Ⅰ
两个波长和振幅相等的平面偏振光,当它们 的偏振面互相垂直,且相位相差90度时,可以合 成为圆偏振光。圆偏振光有两种,一种是左圆偏
振光,一种是右圆偏振光。当朝向光源方向看时,
蛋白质的三维结构

主要的作用力
?
数Hale Waihona Puke 巨大三、多肽主链折叠酰胺平面与α (一)酰胺平面与α-碳原子的二面角
肽平面键长和键角一定 肽键的原子排列呈反式构型 相邻的肽平面构成两面角
O C
O
C N
¨N
+
共振形式
肽键中C 肽键中C-N键具有部分双键性质 ——组成酰胺的原子处于同一平面 组成酰胺的原子处于同一平面 组成
绕Ca-N键轴旋转的二 键轴旋转的二 面角( 面角(C-N-Ca-C)称 ) 为Φ ,绕Ca-C键轴旋 键轴旋 转的二面角( 转的二面角(N-Ca-CN)称为Ψ。 )称为Ψ
1、 复绕 螺旋(αα结构 ) 、 复绕α-螺旋 螺旋( 结构 由两股或三股右手α-螺旋彼此缠绕而成的 左手超螺旋。 存在于α-角蛋白,肌球蛋白,原肌球蛋白 和纤维蛋白原中。
帽化(helix capping) 帽化(
• 给末端裸露的 给末端裸露的N-H和C=O提供氢键配偶体 和 = 提供氢键配偶体 • 折叠蛋白质其它部分 ——促成与末端非极性残基的疏水作用 促成与末端非极性残基的疏水作用
2 、α-螺旋的特点
(3)α螺旋的手性 • 左/右手螺旋都由 右手螺旋都由L-AA残基构成 残基构成 ——不是对映体 不是对映体 • 右手α螺旋空间位阻较小,构象稳定 右手α螺旋空间位阻较小, 在肽链折叠中容易形成。 在肽链折叠中容易形成。
1952年诺贝尔物理学奖 布洛赫 年诺贝尔物理学奖:布洛赫(Felix Bloch ) & 珀赛尔 (Edward 年诺贝尔物理学奖
Purcell)因发展了核磁精密测量的新方法及由此所作的发现 因发展了核磁精密测量的新方法及由此所作的发现——核磁共振。 核磁共振。 因发展了核磁精密测量的新方法及由此所作的发现 核磁共振
理学蛋白质的三维结构PPT学习教案

▪ 维系力有氢键、疏水键、离子 键和范德华力等。
▪ 转弯的氨基酸残基(脯,苏、 甘和丝的精确位置)。
▪ 根据结构域的类型分为:
第24页/共55页
2021年8月16日星期一
25
球状蛋白质三维结构的特点
❖ 分子内各种侧链基团相互作用 的结果❖ 含有多种二级结来自单元第49页/共55页
2021年8月16日星期一
50
导致变性的因素:热、紫外线照射、高压、表面张力、搅
拌、有机溶剂、脲(尿素)、胍、酸、碱等。
常用的变性剂:尿素和十二烷基硫酸钠(SDS) 尿素:与多肽主链竞争氢键;增加非极性侧链在水中的溶解
度,从而降低疏水相互作用。
O(NH ) C
第50页/共55页
2021年8月16日星期一
不同的间隙可以表现不同的功能。 3. 多结构域蛋白质的活性是不同结构域的活性的总和,
但绝不是机械的加和。 4. 结构域的相互作用会导致整个蛋白质分子的变构效
应。
第23页/共55页
2021年8月16日星期一
24
(二) 三级结构与球状蛋白质
▪ 指由二级结构元件、超二级结 构和结构域构成的总的三维结 构,包括相距较远的肽段之间 的几何相互关系和侧链在三维 空间中彼此间的相互关系。
11
3. -转角(- 弯曲)-turn
在-转角部分,由四个氨基酸残基组成;含有相当比例的 极性残基;主要存在于球状蛋白分子表面。
显示一定的刚性;又有柔性。 甘氨酸和脯氨酸常出现在转角中
第11页/共55页
2021年8月16日星期一
12
4.Ω环形
-凸起
▪ 这类肽段的外形和希腊字母“Ω”相似,故称为Ω环形。从 形式上看,Ω环形可以看成是转角的延伸。
蛋白质结构分析及三维可视化

/pdb/home/home.do
蛋白结构可视化
课堂练习
1. 人类肌红蛋白(3rgk)和抹香鲸肌红蛋白(1mbn)差异比较 2.从数据库中下载感兴趣的pdb文件观察其蛋白结构模型
Pymol
• Pymol: python + molecule • 开源 • 产生高质量三维结构图像
❖ SCOP (Structural classification of proteins) 英国医学研究会(MRC)剑 桥分子生物学实验室开发的蛋白质结构分类数据库。包含描述蛋白质域 的家族、超家族、折叠、等级等信息。/scop
❖ /browse.jsp?datatype=Structure
结构预测
❖ 同源建模
已有同源序列的结构信息
❖ 从头预测 ❖ CASP(Critical Assessment of Techniques for
Protein Structure Prediction)
蛋白质结构数据库
❖ PDB Protein DataBank
❖ MMDB (Molecular Modelling DataBase),包含了从PDB获取的实验确 定的生物高聚物结构分子模型数据库
考虑氨基酸理化性质时注意的主要因素:侧链基团的大小, 和疏水性。常根据氨基酸侧链的疏水性进行分类
From wikipedia
❖ 蛋白质的生物功能由蛋白质的结构所决定
❖ 确定蛋白质结构方法:
实验方法
❖X-射线衍射 ❖核磁共振 ❖冷冻电镜
预测方法
❖同源建模 ❖从头预测
X射线衍射
❖ 测定蛋白质结构最精确的方法,目前80%已 知的结构是通过这种技术测定的
❖ 蛋白质溶液样品必须有足够高的浓度和纯度, 并在合适条件下形成晶体
第5章蛋白质的三维结构

不溶性蛋白:角蛋白、胶原蛋白、弹性蛋白等; 可溶蛋白:肌球蛋白、血纤蛋白原等。
1. 角蛋白(keratin) 源于外胚层细胞,包括皮肤及皮肤的衍生物(发、毛、
鳞、羽、甲、蹄、角、爪、丝等)。 α-角蛋白和β角蛋白两大类。
βαβ单元
βαβαβ
3.ββ结构:反平行的β-折叠片。球状蛋白质中多是一段肽链 的若干段β-折叠片反平行组合而成,短回环连接。
β发夹结构:最简单的。
β曲折:由三条(以上)相邻的反平行式的β-折叠链通过 紧凑的β-转角连接而成的超二级结构:
五、结构域(structural domain,domain)
结构域:也指功能域, 在二级结构或超二级结构的基础 上,多肽链进一步卷曲折叠,组装成相对独立的、紧密 球状实体的三级结构的局部折叠区。
结构域的结构特点:
结构域是球状蛋白的独立折叠单位;常见的结构域一 般有100-200氨基酸残基。
β-折叠两种形式(按多肽主链中N C的指向): 平行式:所有参与β-折叠的肽链的N端均在同一侧。 反平行式:即肽链的N末端一顺一反的排列着。
在纤维状蛋白质中β-折叠主要是反平行式,氢键主要是在肽 链之间形成;在球状蛋白质中反平行和平行两种方式都存 在。 β-折叠既可在肽链间形成,也可在同一肽链的不同部 分间形成。
(1)α-角蛋白(毛发)
主要由α-螺旋结构组成,三股 右手α-螺旋向左缠绕形成初原 纤维,初原纤维排列成“9+2” 的电缆式结构称微原纤维,成百 根微原纤维结合成大原纤微。
角蛋白的二硫键
-角蛋白的伸缩性能很好,当-角蛋白被过度-拉伸时,则 氢键被破坏而不能复原。此时-角蛋白转变成-折叠结构, 称为-角蛋白。
03-蛋白质的三维结构

蛋白质分子由于物理或化学因素导致 的生物活性丧失, 溶解度降低, 的生物活性丧失 , 溶解度降低 , 物理化学 常数发生变化的过程 实质:分子中次级键破坏, 实质:分子中次级键破坏,共价键不变 特征: 特征:生物活性丧失
32
变性剂: 变性剂:使蛋白质分子变性的物质
12
三、二级结构
螺旋( helix) 1、α-螺旋(α-helix) 螺旋
肽链主链围绕中心轴盘绕成 螺旋状紧密卷曲的棒状结构 结构特征 1)ψ和φ约为 °和-47° 约为-57° ) ° 2)每圈螺旋约含 个氨基酸 )每圈螺旋约含3.6个氨基酸 残基, 螺距0.54nm,R基 残基, 螺距 , 基 在螺旋外侧
在β-折叠股中额外插入 折叠股中额外插入 一个残基,可引起肽链方向 一个残基, 稍有改变
4、无规卷曲(random coil) 、无规卷曲
受侧链相互作用影响较 大。常构成酶的活性部位和 蛋白质的功能部位
18
四、超二级结构
概念
若干相邻的二级结构单元彼此相互作 形成种类不多、 用,形成种类不多、有规则的二级结构组 合或二级结构串,在多种蛋白质中充当三 合或二级结构串, 级结构的构件
脂锚钩的作用: 脂锚钩的作用: 锚定蛋白 调节蛋白活性 在真核细胞中控 制信号传导途径
30
七、膜蛋白的结构
脂锚定结构有四种类型
1)酰胺-连接的豆 )酰胺蔻酰锚钩 2)硫酯-连接的脂 )硫酯肪酰锚钩 3)硫醚-连接的异 )硫醚戊二烯基锚钩 4)酰胺-连接的糖 )酰胺基脂酰肌醇锚钩
31
八、蛋白质的变性
34
九、氨基酸序列规定 蛋白质的三维结构
蛋白质的三维结构由氨基酸序列所规 二级结构决定于短程相互作用, 定,二级结构决定于短程相互作用,三级 结构决定于长程相互作用, 结构决定于长程相互作用,二硫桥对蛋白 质构象具有稳定作用
蛋白质结构预测网址

蛋白质结构预测网址
下面是比较常见的蛋白质结构预测网站:
1. Protean3D:这是一个用于蛋白质结构预测的非常流行的网站,有一个易于使用的图形用户界面,可以使用免费的计算机资源来进行模拟。
它还提供了许多有用的工具,如标准化的序列比对,位点推理等。
2.I-TASSER:这是一个专为蛋白质结构预测而设计的软件包,它使用动力学模拟来模拟蛋白质的结构形态。
I-TASSER可以根据蛋白质序列生成三维结构,并可以检查构象的稳定性。
3. FoldX:这是一个蛋白质结构预测工具,准确度比较高,可以用于模拟蛋白质的结构形态,特别是用于分析和预测蛋白质突变和热稳性之间的关系。
4. RaptorX:这是一个基于深度学习(deep learning)技术的蛋白质结构预测工具,可以从蛋白质序列中推断出三维结构。
RaptorX可以预测蛋白质组装,蛋白质相互作用以及蛋白质热稳定性的变化。
5.CASTp:这是一个蛋白结构分析工具,主要用于计算蛋白质接口的热力学参数,以及蛋白质组装热力学稳定性和构象的动力学性质。
6. ProSight:这是一款用于预测蛋白质结构的软件,它可以以统计学的方式预测蛋白质结构,并得到极高的准确率。
蛋白质可视化分析

蛋白质序列可视化摘要DNA和蛋白质是生命中的两大核心物质,研究DNA和蛋白质序列对人类生命有重大意义。
首先本文了一份关于DNA可视化工作方面的科学报告,从中阐述了它的工作原理和说明了它对研究DNA结构的影响和意义。
其次对于蛋白质序列可视化方面,我们画出其在3D空间的曲线图(曲线的x、y轴坐标由Randic方法得到,z轴坐标由蛋白质序列中氨基酸的的累计个数得到),通过3D图形比较我们得出了蛋白质序列间的相同点和不同蛋白质之间序列的异同点。
再次对于区别两类不同的蛋白质序列,我们画出第一、二类序列的3D曲线,取它的几何中心作为该序列的数值特征(3维向量),通过比较序列数值特征的欧式距离,我们来判断蛋白质的分类。
在判断过程中,我们分别取第一、二类蛋白质前八个序列为学习样本,后三、四个序列为检验样本,通过比较前八个学习样本数值特征的平均值与检验样本数值特征间的欧式距离来判断蛋白质的分类。
最后,本文对模型改进方面提出了些建议。
关键词:蛋白质序列可视化欧式距离一 问题的重述生物信息学是一个较新的学科领域,它涵概了对基因组信息的多个研究过程,通过综合运用生物学、信息学、统计学、数学等工具和手段,来阐明和理解生物数据,使之成为具有明确生物意义的生物信息,并通过对生物信息的查询、检索、比较和分析,从中获取基因编码、基因调控、核酸和蛋白质结构功能及其相互关系。
蛋白质是生命体赖以生存的营养要素,是细胞组织的重要组成部分,几乎所有的生物过程都与蛋白质发生某种联系。
根据蛋白质序列的排列顺序和序列信息确定蛋白质的功能成为生物学研究重点。
它的主要研究方法可分为两大类,其一是利用实际实验的方法来预测,包括X 光绕射和核磁共振;其二则是利用理论计算的方法,包括同源建模法、折叠识别法以及从头预测法三种。
虽然用实验的方法较为准确,但花费的时间长,而且很多蛋白质难以结晶,因而实验结果也受到技术和设备上的制约;相对而言,用理论计算的方法则可以避免这些缺点,所以发展基于蛋白质序列对结构和功能进行预测的模型成为必要。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
课程工具
• 下载地址:
• (扩展名改) • (扩展名改)
课程内容
• 蛋白质结构简介 • 常见的蛋白质相关数据库 • 三维结构可视化练习()
蛋白质结构与功能预测
. 从氨基酸组成辨识蛋白质 . 蛋白质二级结构预测 . 蛋白质的三维结构
考虑氨基酸理化性质时注意的主要因素:侧链基团的大小, 和疏水性。常根据氨基酸侧链的疏水性进行分类
预测准确率超过的第一个软件是基于神经网络的系统
通过对多种蛋白质结构分析发现各种氨基酸在不同二级结构中出现具有偏好:
α 螺旋 :具有长侧链的氨基酸如、、和 β 折叠:β 碳原子处有分支的侧链如,,和 在螺旋和折叠中出现都不适宜 也很少出现在螺旋和折叠中 和常出现在β 转角中 通过蛋白质的氨基酸序列预测二级结构可以达到%的准确率
• 蛋白质的生物功能由蛋白质的结构所决定 , 蛋白质结构预测成为了解蛋白质功能的重 要途径
• 蛋白质结构预测分为: • 二级结构预测 • 空间结构预测
二级结构预测
在一定程度上二级结构的预测可以归结为模式识别问题
在二级结构预测方面主要方法有: 立体化学方法 图论方法 统计方法 最邻近决策方法 基于规则的专家系统方法 分子动力学方法 人工神经网络方法
类数据库。包含描述蛋白质域的家族、超家族、折叠、等级等信息。
数据库
收集了全世界利用核磁共振,衍射实验,理论模拟出来的蛋白质和的 三维立体结构
是全球最重要的蛋白质结构资料来源,主要提供的信息有:原子的空间坐标, 引用文献,形成的α和β的氨基酸序列,二硫键连接模式,与蛋白结合 的,参与生化功能的
课堂练习
.以人类的血红蛋白亚基为例的展示实验 .从数据库中下载感兴趣的文件观察其蛋白结构模型
•: • 开源 • 产生高质量三维结构图像
获取序列
选择序列格式显示
获取格式序列
2019/9/1
复旦大学图书馆文献检索 教研室
进入日内瓦大学生物分子学网站
选择同源建模服 务器
同源建模服务器建模
自动模式 联盟模式
项目模式
自动模式建模
将以上获取的序列的
重新建模
* 预测模型 *与相似的已知结构蛋白的列表
蛋白质功能预测
• 例:对正常hemoglobin的序列修改后并预测 其功能
• MVHLTPVEKSAVTALWGKVNVDEVGGEALGRLLVVYPWTQRFFES FGDLSTPDAVMGNPKVKAHGKKVLGAFSDGLAHLDNLKGTFATLS ELHCDKLHVDPENFRLLGNVLVCVLAHHFGKEFTPPVQAAYQKVV AGVANALAHKYH
蛋白质结构分析及三维可视化
以镰刀型红细胞贫血症为例
正常成人血红蛋白是由两条α链和两条β链相互结 合成的四聚体,α链和β链分别由和个氨基酸顺序 连结构成。镰状细胞贫血患者因β链第位氨基酸谷 氨酸被缬氨酸所代替,形成了异常的血红蛋白 ( ,),取代了正常血红蛋白(),在氧分压下 降时分子间相互作用,成为溶解度很低的螺旋形 多聚体,使红细胞扭曲成镰状细胞(镰变)。
蛋白质的三维结构
•: •:
蛋白质序列数据库
• (瑞士日内瓦大学)蛋白质序列数据库 • 内容包括序列及功能信息、蛋白识别、蛋白
质结构预测及其他功能 • 蛋白质数据库 包括所有蛋白质序列,及其翻
译产物序列 • 蛋白质序列库
• ,美国国家实验室管理生物大分子三维空间结构原子坐标数据库 • ( ),包含了从获取的实验确定的生物高聚物结构分子模型数据库 • ( ) 英国医学研究会()剑桥分子生物学实验室开发的蛋白质结构分
