ERF转录因子
erf转录因子结合位点

erf转录因子结合位点
ERF(Ethylene Responsive Factor)转录因子是一类在植物中广泛存在的转录因子,它们能够响应乙烯信号并调节下游基因的表达。
ERF 转录因子通常具有一个保守的DNA 结合结构域,称为ERF 结构域,该结构域能够识别并结合特定的DNA 序列。
ERF 转录因子结合位点通常是一段特定的DNA 序列,该序列包含一个或多个ERF 结构域结合位点。
这些结合位点通常具有特定的碱基组成和排列方式,能够与ERF 转录因子的ERF 结构域相互作用,从而调节下游基因的表达。
ERF 转录因子结合位点的具体序列和结合方式可能因不同的ERF 转录因子而异。
一些常见的ERF 转录因子结合位点包括GCC-box、DRE (Dehydration Responsive Element)和CRT(C-repeat Element)等。
研究ERF 转录因子结合位点对于理解植物对乙烯信号的响应机制以及植物生长发育和胁迫响应的调控机制具有重要意义。
通过鉴定和研究ERF 转录因子结合位点,可以深入了解ERF 转录因子如何调节下游基因的表达,并为植物基因工程和育种提供重要的靶点。
ERF转录因子研究进展

ERF转录因子研究进展高浩;竺锡武【摘要】ERF(Ethylene-responsive factor)转录因子是AP2/ERF大家族中的一个大的亚家族,仅含1个AP2/ERF结构域,每个成员都含有1个由大约60个氨基酸组成的非常保守的DNA结合域.有研究表明,每种植物有100种以上ERF转录因子,其功能各不相同,分别具有调节植物生长发育、抗生物胁迫和非生物胁迫的作用等.本文就ERF转录因子的研究现状及发展趋势进行分析,以期为ERF转录因子的应用提供参考.【期刊名称】《现代农业科技》【年(卷),期】2017(000)008【总页数】3页(P130-131,134)【关键词】ERF转录因子;功能;作用机理【作者】高浩;竺锡武【作者单位】湖南人文科技学院,湖南娄底 417000;湖南人文科技学院,湖南娄底417000【正文语种】中文【中图分类】Q943随着环境条件的恶化,植物在生长发育过程中受到的非生物因素和生物因素影响会更多,如高温、低温、干旱、盐碱、病虫害等。
在不断适应环境和进化过程中,植物形成了复杂有效的逆境胁迫应答体系,可以调节植物使其能够适应新的生长环境。
其中,在转录水平的调控过程中转录因子发挥了非常重要的作用[1]。
转录因子又称反式作用因子,是一群能与真核基因启动子区域中的顺式作用元件发生特异性结合,从而保证目的基因以特定的强度、在特定的时间与空间表达的蛋白质分子[2]。
AP2/ERF家族转录因子对植物非常重要,可以调控植物整个生命周期的生长发育和逆境[3-7]。
根据AP2结构域的数目和结构特点,AP2/ERF家族转录因子可分为4个亚族(ERF、DREB、AP2、RAV)和单独成员(Soloist)[4-5,8]。
ERF(Ethylene-responsive factor)转录因子是 AP2/ERF大家族中的一个大的亚家族,仅含1个AP2/ERF结构域,在结构域序列的第14位和第19位分别是丙氨酸和天冬氨酸。
ERF转录因子cDNA的分离及表达载体的构建的开题报告

大白菜推定AP2/ERF转录因子cDNA的分离及表达载体的构建的开题报告一、背景与意义:AP2/ERF(Apetala2/ethylene-responsive factor)是一类植物特有的转录因子,它对植物的生长和发育、逆境响应和抗病性具有重要作用。
大白菜(Brassica napus L.)是全球重要的油料作物之一,其营养价值高且繁殖能力强,在我国原油缺乏的情况下,开发大白菜的深加工与利用具有重要的经济意义。
因此探究大白菜AP2/ERF的分子特性,并进一步研究其在逆境响应、生长发育和抗病防治中的作用,对推动大白菜的优良品种选育和农业可持续发展具有重要的理论和实际意义。
二、研究内容:本研究拟使用RT-PCR技术从大白菜中分离得到AP2/ERF转录因子的cDNA全长序列,并通过构建含有目标基因的表达载体来进一步研究其在大白菜中的表达特性。
研究具体流程如下:1、总RNA提取:从大白菜幼苗中提取总RNA。
2、逆转录反应:利用M-MLV逆转录酶逆转录RNA为cDNA。
3、AP2/ERF基因特异性引物的设计:根据靶标序列,设计特异性引物。
4、PCR扩增:采用特异性引物扩增目的基因。
5、克隆与测序:将PCR产物克隆到克隆载体pEASY-T1中,转化大肠杆菌进行测序。
6、序列分析:使用软件工具对序列进行分析和构建结构预测模型。
7、表达载体构建:将目标基因克隆到表达载体中,构建表达载体。
8、质粒转化:将表达载体转化到大白菜中。
9、PCR验证表达:采用基因特异性引物对转化的大白菜进行PCR检测,验证表达载体的构建是否成功。
三、研究意义与创新点:该研究通过分离大白菜中的AP2/ERF转录因子,在分子层次上揭示其生长发育、逆境响应和抗病性机制,为大白菜的品种选育提供新的理论参考和实践指导。
同时,建立含有目标基因的表达载体,为基因工程育种提供新的手段与途径,为农业生产的可持续发展做出贡献。
《花椰菜乙烯受体转录因子(ERF)的克隆及其在逆境应答中的功能研究》

《花椰菜乙烯受体转录因子(ERF)的克隆及其在逆境应答中的功能研究》摘要:本文旨在研究花椰菜乙烯受体转录因子(ERF)的克隆过程,并探讨其在逆境应答中的功能。
通过分子生物学技术,成功克隆了花椰菜ERF基因,并对其表达模式进行了分析。
研究结果表明,该基因在逆境条件下具有重要调控作用,对植物抗逆性具有潜在的应用价值。
一、引言乙烯是植物生长和发育过程中的重要激素之一,其信号转导途径在植物逆境应答中发挥着关键作用。
乙烯受体转录因子(ERF)作为乙烯信号转导途径的关键组成部分,在植物应对环境胁迫时起着重要的调控作用。
因此,研究花椰菜乙烯受体转录因子(ERF)的克隆及其在逆境应答中的功能具有重要意义。
二、材料与方法1. 材料准备实验所用材料为花椰菜组织,实验中所用的引物、试剂等均为市售高品质产品。
2. 方法(1)基因克隆:采用PCR技术,以花椰菜基因组DNA为模板,扩增ERF基因。
(2)序列分析:对克隆得到的ERF基因进行序列分析,确定其编码序列及结构特征。
(3)表达分析:采用实时荧光定量PCR技术,分析ERF基因在花椰菜不同组织及逆境条件下的表达模式。
(4)功能研究:通过转基因技术,研究ERF基因在植物逆境应答中的功能。
三、实验结果1. 基因克隆与序列分析通过PCR技术成功克隆了花椰菜ERF基因,序列分析表明该基因编码一个含有AP2结构域的转录因子。
该基因具有典型的ERF家族特征,表明其可能参与乙烯信号转导途径。
2. 表达分析实时荧光定量PCR结果显示,ERF基因在花椰菜不同组织中均有表达,且在逆境条件下表达量明显上升。
其中,在受到病原菌侵染、干旱、高温等逆境条件时,ERF基因的表达量显著增加。
3. 功能研究通过转基因技术,研究了ERF基因在植物逆境应答中的功能。
结果表明,过表达ERF基因的植物在逆境条件下的抗性明显增强,表现出更强的生长恢复能力和抗病能力。
这表明ERF基因在植物逆境应答中具有重要调控作用。
《ERF转录因子亚家族基因在甜瓜果实发育中的功能》范文

《ERF转录因子亚家族基因在甜瓜果实发育中的功能》篇一摘要:本文着重探讨了ERF(Ethylene Response Factor)转录因子亚家族基因在甜瓜果实发育过程中的功能。
通过实验手段,对相关基因的表达模式及对果实发育的调控机制进行了深入探究,以期为甜瓜种植与遗传改良提供理论支持。
一、引言甜瓜作为一种重要的果蔬作物,其果实的品质与产量的提升一直是农业生产研究的重点。
近年来,随着分子生物学技术的发展,越来越多的研究开始关注基因在果实发育过程中的作用。
ERF转录因子亚家族基因作为植物生长发育的重要调控因子,其在甜瓜果实发育中的作用及调控机制值得深入探讨。
二、ERF转录因子概述ERF转录因子是植物中广泛存在的一类转录调控因子,其能够通过与靶基因的启动子区域结合,进而调控基因的表达。
该亚家族基因在植物的生长、发育及对环境胁迫的响应中发挥着重要作用。
三、ERF基因在甜瓜果实发育中的表达模式本研究通过实时荧光定量PCR技术,对甜瓜果实发育过程中ERF基因的表达模式进行了分析。
结果显示,ERF基因在甜瓜果实的不同发育阶段表达量存在显著差异,尤其在果实成熟期表达量达到峰值。
这表明ERF基因在甜瓜果实发育过程中起到了重要的调控作用。
四、ERF基因对甜瓜果实发育的调控机制通过对ERF基因的过表达及抑制表达实验,我们发现该基因能够通过调控与果实发育相关的其他基因的表达,从而影响果实的品质及产量。
具体而言,ERF基因能够促进果实的成熟和糖分的积累,同时还能提高果实的抗逆能力。
此外,该基因还能通过调控果皮色泽、果肉质地等性状,进一步影响果实的品质。
五、讨论与展望本研究表明,ERF转录因子亚家族基因在甜瓜果实发育过程中发挥了重要的调控作用。
通过对该基因的表达模式及调控机制的研究,我们可以更好地了解甜瓜果实发育的遗传机制,为甜瓜种植与遗传改良提供理论支持。
然而,关于ERF基因在甜瓜果实发育中的具体作用机制仍有待进一步研究。
ERF植物转录因子与植物抗逆研究

酵母单杂交方法—体内分析转录因子与DNA结合特性或转录激活活性
(3)同源克隆 同源克隆的优点是在植物材料的基因信息未知的情况下,通过已知
(3)泛素介导的蛋白降解途径是翻译后调控转录因子蛋 白水平的另一个机制。
4、转录因子研究方法
4.1 克隆转录因子的方法
基于转录因子具有表达丰度低、与顺式元件特异性结合且DNA结合序 列保守等特点。目前,分离克隆转录因子常用的方法主要有以下几种:
(1)转座子标签法与RNA差异显示法 相结合的克隆方法
1、转录因子的结构特征
转录因子的三维结构中,N端通常含有与顺式作用元件 相结合的关键结构域。在转录调控过程中,转录因子通过 其 DNA结合域与靶序列特异结合,来实现对靶基因的精确 调控。
转录因子一般由4个功能区域组成: DNA结合区(DNA binding domain) 转录调控区(Transcription regulation domain)
(5)规模化分离、鉴定转录因子超家族成员 随着基因组测序技术的迅猛发展,多种植物的基因组已经测序完毕。
因此,利用生物信息学方法从全基因内分离、鉴定家族基因已成为研究 热点。这有助于全面系统深入解析基因的功能,在拟南芥、水稻、大豆 及其他一些作物的基因组中系统分析AP2/ERF家族基因已有报道。
总之,上述五种克隆转录因子的方法并不是孤立的, 需要结合实 验材料、实验目的等实际情况,综合采用上述一种或多种方法克隆目 的基因。
ERF植物转录因子研究与植物抗逆
转录因子在植物防卫反应和逆境胁迫应答过程中扮演着非 常重要的角色。在植物抗逆反应过程中,当植物受到外界环境 胁迫后,植物通过其信号传导途径有效地调控体内相关功能基 因的表达,进而引发一系列生理、生化反应,形成高效有序的 信号调控网络,以降低或消除给植株带来的危害。
ERF转录因子

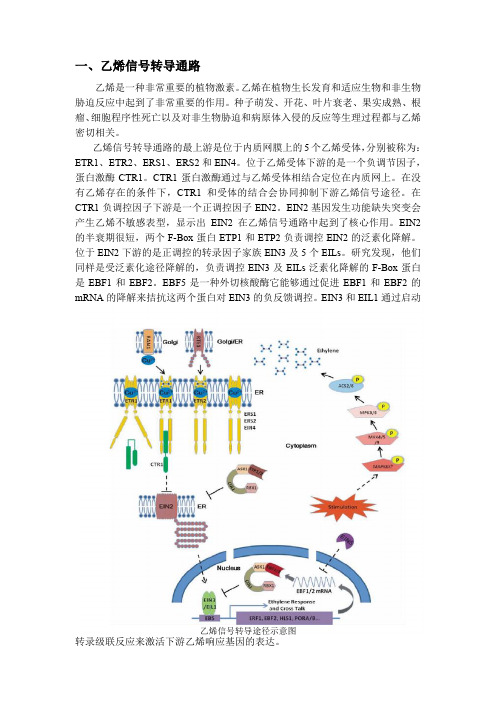
一、乙烯信号转导通路乙烯是一种非常重要的植物激素。
乙烯在植物生长发育和适应生物和非生物胁迫反应中起到了非常重要的作用。
种子萌发、开花、叶片衰老、果实成熟、根瘤、细胞程序性死亡以及对非生物胁迫和病原体入侵的反应等生理过程都与乙烯密切相关。
乙烯信号转导通路的最上游是位于内质网膜上的5个乙烯受体,分别被称为:ETR1、ETR2、ERS1、ERS2和EIN4。
位于乙烯受体下游的是一个负调节因子,蛋白激酶CTR1。
CTR1蛋白激酶通过与乙烯受体相结合定位在内质网上。
在没有乙烯存在的条件下,CTR1和受体的结合会协同抑制下游乙烯信号途径。
在CTR1负调控因子下游是一个正调控因子EIN2。
EIN2基因发生功能缺失突变会产生乙烯不敏感表型,显示出EIN2在乙烯信号通路中起到了核心作用。
EIN2的半衰期很短,两个F-Box蛋白ETP1和ETP2负责调控EIN2的泛素化降解。
位于EIN2下游的是正调控的转录因子家族EIN3及5个EILs。
研究发现,他们同样是受泛素化途径降解的,负责调控EIN3及EILs泛素化降解的F-Box蛋白是EBF1和EBF2。
EBF5是一种外切核酸酶它能够通过促进EBF1和EBF2的mRNA的降解来拮抗这两个蛋白对EIN3的负反馈调控。
EIN3和EIL1通过启动乙烯信号转导途径示意图转录级联反应来激活下游乙烯响应基因的表达。
二、乙烯响应因子(ethylene response factor、ERF)的结构特点及生物信息学分析ERF基因家族是一个很大的转录因子家族,属于AP2/ERF转录因子超家族。
Ohme-Takagi和Shinshi研究发现,GCC box是植物乙烯响应的DNA序列元件;同时他们在烟草(Nicotiana tabacuum)中发现了能特异性结合GCC box元件的数个乙烯响应元件结合蛋白(EREBPs),并发现,EREBPs同GCC元件相结合的结构域是59个保守的氨基酸残基。
乙烯响应转录因子

乙烯响应转录因子1 什么是乙烯响应转录因子?乙烯响应转录因子(Ethylene Response Factor,ERF)是一类重要的转录因子,参与了植物对乙烯的响应和植物生长发育过程中的调控。
ERF家族成员普遍存在于植物的各个组织中,在组织发生、花期调控、抗逆应答等方面发挥着重要的作用。
2 ERF基本结构ERF家族成员具有相似的结构,其N端包含一个DNA结合结构域(DNA binding domain,DBD),中间部分是一个高度保守的ERF域,可与ETA(ethylenes responsive element-binding factors,返应乙烯元件结合因子)结合。
C端是一段富含甘氨酸和丝氨酸残基的多聚性蛋白结构。
ERF家族成员的结构具备特异性并对相应靶基因起到最好的激活作用。
3 ERF功能与调控根据ERF家族成员不同的功能特点,可将其分为两大类:一类参与逆境响应,如干旱、高盐、低温等胁迫,并参与植物的抗性与适应性的调控,例如耐盐基因CNgene1(CsERF006)在盐胁迫情况下表达受到激活。
另一类参与植物的生长发育调控,例如ETS基因调控花器官发展以及EDF1/2基因与叶片衰老有关。
其中,ERF基因在植物的逆境胁迫响应中具有重要的作用。
许多实验表明,逆境胁迫条件下,ERF基因表达水平得到显著提升。
大量的分子生物学实验表明,在剧烈逆境条件下启动ERF基因以应对各种胁迫是与植物生存的关键因素之一。
4 ERF研究进展目前,ERF家族成员系统、深度的研究得到了越来越多的关注,ERF家族成员的生物学功能不断地被发掘和研究。
许多研究利用生物技术手段,成功地定位了ERFs在染色体上的位置,鉴定了其启动子和蛋白质互作网络,为进一步研究ERFs序列和功能研究提供了基础性的实验数据。
在逐渐加深对ERF家族成员功能的认识的同时,目前很多研究也关注于ERFs家族成员与植物异烟酸酯信号通路的交叉关系。
ERF家族成员的研究不仅对于揭示植物生长发育的基本调控机制有着重要意义,同时也为了基因工程改良植物抗旱、抗寒、耐盐等重要胁迫条件提供了一定的参考。
ERF类转录因子的结构与功能

Ab ta t T e E r n c p in fco s ae k o o b n q e i ln s T e me e so i fmi a e aCo s r c : h RF t s r t a tr r n wn t e u i u n p a t h mb r ft s a l h v mmo e — a i o h y n la
t r n s u tr u e i t cu e:alt e me es c n an o e c n ev d DN —b n i g d man ,w ih C n ito b u 0 a n cd . r l h mb r o t i n o s r e A i d n o i s h c o s f a o t6 mio a i s s E rn c i t n f cos e itc mmo l n p a t ,a d t e r n ov d i r wt ,d v lp n n in lta s u t n RF ta s r i a t r x s o p o n y i l ns n h y we e i v le n go h e e o me t d s a r n d ci a g o i n h soo ia n ic e c r c s e . I h sr v e w il n r d c e p o e si e sr c u e a d f n — n ma y p y i lgc a d b o h mia p o e s s n t i e iw e man y i t u e t rg s n t t t r n u c l l o h r h u t n o h F t n c i t n f co . i f e ER a s rp i a tr o t r o s K e r s E y wo d : RF; r n c i t n f co T a s r i a t r p o s
ERF转录因子
一、乙烯信号转导通路乙烯是一种非常重要的植物激素。
乙烯在植物生长发育和适应生物和非生物胁迫反应中起到了非常重要的作用。
种子萌发、开花、叶片衰老、果实成熟、根瘤、细胞程序性死亡以及对非生物胁迫和病原体入侵的反应等生理过程都与乙烯密切相关。
乙烯信号转导通路的最上游是位于内质网膜上的5个乙烯受体,分别被称为:ETR1、ETR2、ERS1、ERS2和EIN4。
位于乙烯受体下游的是一个负调节因子,蛋白激酶CTR1。
CTR1蛋白激酶通过与乙烯受体相结合定位在内质网上。
在没有乙烯存在的条件下,CTR1和受体的结合会协同抑制下游乙烯信号途径。
在CTR1负调控因子下游是一个正调控因子EIN2。
EIN2基因发生功能缺失突变会产生乙烯不敏感表型,显示出EIN2在乙烯信号通路中起到了核心作用。
EIN2的半衰期很短,两个F-Box蛋白ETP1和ETP2负责调控EIN2的泛素化降解。
位于EIN2下游的是正调控的转录因子家族EIN3及5个EILs。
研究发现,他们同样是受泛素化途径降解的,负责调控EIN3及EILs泛素化降解的F-Box蛋白是EBF1和EBF2。
EBF5是一种外切核酸酶它能够通过促进EBF1和EBF2的mRNA的降解来拮抗这两个蛋白对EIN3的负反馈调控。
EIN3和EIL1通过启动乙烯信号转导途径示意图转录级联反应来激活下游乙烯响应基因的表达。
二、乙烯响应因子(ethylene response factor、ERF)的结构特点及生物信息学分析ERF基因家族是一个很大的转录因子家族,属于AP2/ERF转录因子超家族。
Ohme-Takagi和Shinshi研究发现,GCC box是植物乙烯响应的DNA序列元件;同时他们在烟草(Nicotiana tabacuum)中发现了能特异性结合GCC box元件的数个乙烯响应元件结合蛋白(EREBPs),并发现,EREBPs同GCC元件相结合的结构域是59个保守的氨基酸残基。
小麦ERF_亚族转录因子参与逆境胁迫的研究进展

㊀山东农业科学㊀2024ꎬ56(2):176~180ShandongAgriculturalSciences㊀DOI:10.14083/j.issn.1001-4942.2024.02.024收稿日期:2023-03-05基金项目:国家自然科学基金项目(32001545)ꎻ山东省农业良种工程项目(2021LZGC013)ꎻ山东省农业科学院农业科技创新工程项目(CXGC2023A01)ꎻ农业农村部黄淮北片小麦种质资源精准鉴定项目作者简介:崔德周(1987 )ꎬ男ꎬ山东惠民人ꎬ博士ꎬ助理研究员ꎬ主要从事小麦种质资源与遗传育种研究ꎮE-mail:dezhoucui@126.com王丽丽(1989 )ꎬ女ꎬ山东郓城人ꎬ山东大学人居环境研究中心特约研究员ꎬ主要从事植物种质资源研究ꎮE-mail:565993570@qq.com∗同为第一作者ꎮ通信作者:樊庆琦(1978 )ꎬ男ꎬ山东郓城人ꎬ博士ꎬ研究员ꎬ主要从事小麦种质创新研究ꎮE-mail:fanqingqi@163.com小麦ERF亚族转录因子参与逆境胁迫的研究进展崔德周1ꎬ王丽丽2∗ꎬ陈祥龙3ꎬ李永波1ꎬ黄琛1ꎬ隋新霞1ꎬ楚秀生1ꎬ樊庆琦1(1.山东省农业科学院作物研究所/小麦玉米国家工程研究中心/农业农村部黄淮北部小麦生物学与遗传育种重点实验室/山东省小麦技术创新中心/济南市小麦遗传改良重点实验室ꎬ山东济南㊀250100ꎻ2.山东省林草种质资源中心ꎬ山东济南㊀250102ꎻ3.山东鲁研农业良种有限公司ꎬ山东济南㊀250100)㊀㊀摘要:小麦是中国三大粮食作物之一ꎬ其生长发育过程中会受到多种逆境胁迫的影响ꎮAP2/EREBP是植物特有的一个庞大的转录因子超家族ꎬ普遍参与生长发育和逆境胁迫应答等生物学进程ꎮERF类转录因子是AP2/EREBP转录因子超家族的一个亚族ꎮ本研究结合国内外相关研究进展ꎬ简要综述了小麦ERF亚族转录因子的结构特征与分布ꎬ重点阐述近年来小麦ERF亚族转录因子响应高盐㊁干旱㊁低温㊁重金属㊁病原菌侵染等逆境胁迫的功能和机制研究进展ꎬ最后展望了ERF亚族转录因子的研究方向和应用前景ꎮ关键词:小麦ꎻERF亚族ꎻ转录因子ꎻ胁迫响应ꎻ研究进展中图分类号:S512.1㊀㊀文献标识号:A㊀㊀文章编号:1001-4942(2024)02-0176-05AdvancesinResearchonFunctionofWheatERFTranscriptionFactorSubfamilyinStressResponseCuiDezhou1ꎬWangLili2∗ꎬChenXianglong3ꎬLiYongbo1ꎬHuangChen1ꎬSuiXinxia1ꎬChuXiusheng1ꎬFanQingqi1(1.CropResearchInstituteꎬShandongAcademyofAgriculturalSciences/NationalEngineeringResearchCenterofWheatandMaize/KeyLaboratoryofWheatBiologyandGeneticsandBreedinginNorthernHuang ̄HuaiRiverPlainꎬMinistryofAgricultureandRuralAffairs/ShandongTechnologyInnovationCenterofWheat/JinanKeyLaboratoryofWheatGeneticImprovementꎬJinan250100ꎬChinaꎻ2.ShandongProvincialCenterofForestandGrassGermplasmResourcesꎬJinan250102ꎬChinaꎻ3.ShandongLuyanAgriculturalCo.ꎬLtd.ꎬJinan250100ꎬChina)Abstract㊀WheatisoneofthethreemajorgraincropsinChinaꎬbutitsgrowthanddevelopmentmightbeaffectedbymultipleadversestresses.AP2/EREBPisasuperfamilyofplantspecifictranscriptionfactorswhicharewidelyinvolvedinbiologicalprocessesessuchasgrowthꎬdevelopmentandstressresponse.TheERFtranscriptionclassisasubfamilyoftheAP2/EREBPsuperfamily.Hereꎬthestructuralcharacteristicsanddis ̄tributionsofERFsubfamilytranscriptionfactorsinwheatwerebrieflyintroduced.Andtherecentresearchpro ̄gressesofthefunctionsandmechanismsofERFsubfamilytranscriptionfactorsinwheatwasemphasizedinre ̄sponsetostressessuchashighsaltꎬdroughtꎬlowtemperatureꎬheavymetalandpathogeninfection.FinallyꎬtheresearchdirectionandapplicationprospectofERFsubfamilytranscriptionfactorswereprospected.Keywords㊀WheatꎻERFsubfamilyꎻTranscriptionfactorꎻStressresponseꎻResearchprogress㊀㊀小麦(TriticumaestivumL.)是世界上最重要的粮食作物之一ꎬ是全球三分之一以上人口的主食ꎮ中国是世界上最大的小麦生产国和消费国ꎬ小麦的高产稳产对保障国家粮食安全至关重要ꎮ小麦生长发育周期长ꎬ期间干旱㊁盐碱㊁低温㊁高温㊁重金属㊁病虫害等生物㊁非生物胁迫都会不同程度地威胁小麦的高产稳产ꎮ近年来ꎬ得益于小麦基因组学的飞速发展ꎬ小麦响应逆境胁迫的分子调控网络被逐步阐明ꎬ转录因子在功能基因表达调控中的关键作用进一步凸显[1-4]ꎮ根据DNA结合域的特性ꎬ转录因子可分成若干家族ꎬ包括MYB㊁WRKY㊁bZIP㊁NAC㊁AP2/EREBP等[5-7]ꎮAP2/EREBP转录因子是植物特有的一类转录因子ꎬ广泛参与小麦逆境胁迫应答[8-10]ꎮERF转录因子是AP2/EREBP转录因子超家族的一个亚族ꎬ最早从烟草中分离得到[11]ꎮ本研究综述小麦ERF亚族转录因子在逆境胁迫应答中的作用及可能机制ꎬ以期为深入研究小麦ERF亚族的分子功能及其抗逆遗传改良提供参考ꎮ1㊀ERF亚族转录因子的特征AP2/EREBP是一个庞大的基因家族ꎬ因含有60~70个氨基酸组成的AP2/EREBP结构域而得名[12]ꎮ在拟南芥中ꎬSakuma等[13]根据序列相似性和AP2/EREBP结构域的数量ꎬ将其分为5个亚族 ERF亚族㊁DREB亚族㊁RAV亚族㊁AP2亚族和其他ꎮAP2亚族含有2个AP2/EREBP结构域ꎬ主要在细胞生长发育过程中发挥调控作用[14-15]ꎻRAV亚族含有1个AP2/EREBP结构域和1个B3结构域ꎬ在乙烯㊁油菜素内酯和胁迫响应过程中发挥重要作用[14ꎬ16-17]ꎻDREB亚族和ERF亚族均属于EREBP型转录因子ꎬ都仅含1个AP2/EREBP结构域ꎬ在调控植物细胞发育及对病原菌㊁干旱㊁高盐㊁低温㊁激素等胁迫的应答反应中发挥作用[14ꎬ18-22]ꎬ但AP2/EREBP结构域的第14位和第19位氨基酸存在差异ꎬDREB亚族分别是缬氨酸和谷氨酸ꎬ而ERF亚族则分别是丙氨酸和天冬氨酸ꎮERF亚族转录因子还可与乙烯诱导顺式作用元件GCC-box结合ꎬ抵御植物逆境胁迫[23-26]ꎮ2㊀小麦ERF亚族转录因子鉴定分析目前正式命名的小麦ERF亚族转录因子基因只有8个ꎬ而从全基因组水平分析ꎬ符合ERF亚族特征的基因则有上百个之多[27-28]ꎮZhuang等[29]在全基因组水平鉴定到47个小麦ERF亚族转录因子成员ꎬ根据拟南芥和水稻同源基因分类ꎬ将其分为B1㊁B2㊁B3㊁B4和B6五个亚组ꎮ随着二代测序技术及小麦基因组学研究的飞速发展ꎬRiaz等[30]鉴定到138个ERF亚族转录因子成员ꎬ分为6个亚组ꎬ主要定位于细胞核ꎻMagar等[2]鉴定到238个成员ꎬ其中ꎬ174个基因不含内含子㊁3个基因含3个内含子ꎬ鉴定数量有了质的飞跃ꎮ李世姣等[31]利用隐马尔可夫模型文件检索中国春数据库ꎬ筛选到229条小麦ERFsꎬ通过分析A/B/D同源关系ꎬ将其归为96个ERF亚族成员ꎮ此外ꎬFaraji等[32]在硬粒小麦中鉴定到185个ERF亚族成员ꎮ3㊀小麦ERF亚族转录因子参与逆境胁迫的分子机制3.1㊀非生物胁迫越来越多的研究表明ꎬ大部分小麦ERF亚族成员在对高盐㊁干旱㊁低温㊁重金属等非生物胁迫抗性调控中发挥重要作用(表1)ꎮ位于小麦7A染色体上的TaERF1ꎬ通过结合GCC-box和DRE/CRT元件㊁激活启动子区含GGCC-box的PR蛋白(pathogenesisrelatedpro ̄teinꎬ病程相关蛋白)㊁磷酸化TaMAPK1等方式ꎬ参与干旱㊁高盐㊁低温等代谢途径ꎬ过表达TaE ̄RF1可显著提高转基因拟南芥对干旱㊁高盐和低温的耐受能力[33]ꎮTaERF2基因受干旱㊁高盐㊁低温和湿害强烈诱导ꎬ过表达后可提高转基因拟南芥对干旱㊁低温等非生物胁迫的抗性[34-35]ꎮTaERF3通过特异结合GCC-boxꎬ正向调控LEA3㊁GST6等抗逆相关基因表达ꎬ过表达TaERF3可增加叶片脯氨酸㊁叶绿素含量ꎬ降低过氧化氢含量ꎬ增强小麦对高盐㊁干771㊀第2期㊀㊀㊀㊀㊀㊀崔德周ꎬ等:小麦ERF亚族转录因子参与逆境胁迫的研究进展旱胁迫的耐受能力ꎻ而经病毒诱导基因沉默(VIGS)干扰后的小麦植株则表现为盐和干旱敏感[36]ꎮTaERF4是一个具有EAR基序的转录抑制因子ꎬ过表达TaERF4抑制AtNHX1㊁AtNHX2等钠离子转运相关基因的表达ꎬ通过非ABA依赖的信号通路降低拟南芥耐盐性[37]ꎮTaERF5受高盐㊁渗透胁迫㊁乙烯㊁ABA和茉莉酸甲酯诱导表达ꎬ遗传学证据显示ꎬTaERF5-B过表达增强了转基因水稻的耐盐性[38]ꎮ叶片TaERF7表达受温度和日照调控ꎬ进而影响小麦百农不育系育性[27]ꎮTaE ̄RF8-2D的表达受高盐胁迫诱导持续上调ꎬ其分子机制有待进一步研究[39]ꎮZhu等[40]研究发现ꎬTaPIEP1/TaPIE1通过激活乙烯合成基因ꎬ增强小麦对冷害胁迫的抗性ꎮTaERFL1a受低温㊁高盐㊁干旱㊁ABA等胁迫诱导表达ꎬVIGS干扰该基因降低小麦对干旱胁迫的抗性[41]ꎮDu等[42]研究表明ꎬTaERF87通过与Ta ̄AKS1互作ꎬ协同增强TaP5CS1和TaP5CR1的表达ꎬ提高脯氨酸的生物合成ꎬ进而增强小麦抗旱性ꎮ此外ꎬ在硬粒小麦(TriticumturgidumL.sub ̄sp.durum)中ꎬTdERF1响应高盐和干旱胁迫[43-44]ꎬTdSHN1受高盐㊁干旱㊁低温㊁ABA和重金属胁迫强烈诱导表达ꎬ过表达TdSHN1可显著提高酵母对非生物胁迫的耐受性[45-46]ꎮ㊀㊀表1㊀参与非生物胁迫的小麦ERF亚族转录因子基因结合元件分子功能参考文献TaERF1GCC-box/DRE/CRT提高拟南芥对干旱㊁高盐和低温的耐受能力[33]TaERF2GCC-box/ERE提高拟南芥对干旱㊁低温的耐受能力ꎬ响应小麦湿害胁迫[34-35]TaERF3GCC-box提高小麦对高盐㊁干旱胁迫的耐受能力[36]TaERF4 降低拟南芥对高盐胁迫的耐受能力[37]TaERF5 提高水稻对高盐胁迫的耐受能力[38]TaERF6 与TdERF1高度同源[47]TaERF7GCC-box/DRE/CRT控制百农不育系小麦育性[27]TaERF8-2D 高盐胁迫下持续上调表达[39]TaPIEP1/TaPIE1GCC-box提高小麦对冷害胁迫的耐受能力[40]TaERFL1a 提高小麦对干旱胁迫的耐受能力[41]TaERF87GCC-box/E-box提高小麦对干旱胁迫的耐受能力[42]TdERF1GCC-box/DRE响应高盐和干旱胁迫[43-44]TdSHN1GCC-box/DRE提高酵母对高盐㊁干旱㊁重金属胁迫的耐受能力[45-46]3.2㊀生物胁迫小麦生育期遭遇的生物胁迫主要包括病原菌侵染和植食性害虫啃食ꎬ而小麦响应生物胁迫的转录因子研究主要集中在前者ꎮ研究表明ꎬERF亚族转录因子可以提高小麦对病原菌的抗性(表2)ꎮTaERF1的表达受白粉病菌侵入的诱导ꎬ过表达TaERF1可提高转基因拟南芥对真菌㊁细菌病害的抗性[33]ꎮ病原菌侵染下ꎬTaERF3可激活防御基因表达ꎬ其中ꎬ在白粉病菌侵染早期主要通过水杨酸途径ꎬ而在镰刀菌㊁纹枯病菌侵染晚期主要通过乙烯/茉莉酸途径[48]ꎮ过表达TaPIEP1/TaPIE1可大量激活下游防卫基因的表达ꎬ进而提高小麦对纹枯病㊁根腐病的抗性[40ꎬ49]ꎮChen等[50]从中间偃麦草中分离了一个新的ERF基因TiERF1ꎬ该基因主要通过依赖乙烯的信号转导途径激活病程蛋白相关基因的表达ꎬ提高转基因小麦对纹枯病的抗性ꎮ㊀㊀表2㊀参与生物胁迫的小麦ERF亚族转录因子基因结合元件分子功能参考文献TaERF1GCC-box/DRE/CRT提高拟南芥对真菌㊁细菌病害的抗性[33]TaERF3GCC-box参与对小麦白粉病菌㊁镰刀菌㊁纹枯病菌的防卫[48]TaPIEP1/TaPIE1GCC-box提高小麦对纹枯病㊁根腐病的抗性[40ꎬ49]TiERF1GCC-box提高小麦对纹枯病的抗性[50]871山东农业科学㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀第56卷㊀4㊀展望近年来ꎬ极端天气频发ꎬ低温㊁干旱㊁高盐等非生物胁迫及病原菌侵染等生物胁迫严重制约小麦的安全生产ꎬ给粮食安全带来了严峻挑战ꎮ作为AP2/EREBP转录因子超家族的一个亚族ꎬERF类转录因子连接上游信号和下游功能基因ꎬ在小麦抵御逆境胁迫中具有关键作用ꎮ基因组学分析表明ꎬ小麦ERF亚族基因有200余个ꎬ但目前只克隆鉴定了部分基因ꎬ并且已经投入育种应用的转基因材料也鲜有报道ꎬ后续仍需进一步深入挖掘具有重要抗逆功能的ERF亚族基因ꎮ此外ꎬ目前的研究多集中在转录因子基因的克隆及转录调节功能的鉴定分析上ꎬERF亚族转录因子自我调节的模式及其同其他转录因子间的相互作用关系尚未完全了解ꎮ相信随着基因组学㊁分子生物学技术的发展ꎬ对小麦ERF亚族转录因子的抗逆网络解析会更加深入ꎬ从而为小麦抗逆遗传改良提供更坚实的理论依据和更强有力的基因工具ꎮ参㊀考㊀文㊀献:[1]㊀GahlautVꎬJaiswalVꎬKumarAꎬetal.Transcriptionfactorsinvolvedindroughttoleranceandtheirpossibleroleindevelo ̄pingdroughttolerantcultivarswithemphasisonwheat(Tritic ̄umaestivumL.)[J].Theor.Appl.Genet.ꎬ2016ꎬ129(11):2019-2042.[2]㊀MagarMMꎬLiuHꎬYanGJ.Genome ̄wideanalysisofAP2/ERFsuperfamilygenesincontrastingwheatgenotypesrevealsheatstress ̄relatedcandidategenes[J].Front.PlantSci.ꎬ2022ꎬ13:853086.[3]㊀XiaoJꎬLiuBꎬYaoYYꎬetal.Wheatgenomicstudyforgenet ̄icimprovementoftraitsinChina[J].Sci.ChinaLifeSci.ꎬ2022ꎬ65(9):1718-1775.[4]㊀解亚蒙ꎬ赵晓蕾ꎬ白菁华ꎬ等.小麦NF-Y家族基因TaNF-YA1介导植株耐旱功能研究[J].河北农业大学学报ꎬ2023ꎬ46(1):1-9.[5]㊀丰锦ꎬ陈信波.抗逆相关AP2/EREBP转录因子研究进展[J].生物技术通报ꎬ2011(7):1-6ꎬ11.[6]㊀王淑叶ꎬ伍国强ꎬ魏明.WRKY转录因子调控植物逆境胁迫响应的作用机制[J].生物工程学报ꎬ2024ꎬ40(1):35-52. [7]㊀JavedTꎬShabbirRꎬAliAꎬetal.Transcriptionfactorsinplantstressresponses:challengesandpotentialforsugarcaneim ̄provement[J].Plantsꎬ2020ꎬ9(4):491.[8]㊀YuYꎬYuMꎬZhangSXꎬetal.TranscriptomicidentificationofwheatAP2/ERFtranscriptionfactorsandfunctionalcharac ̄terizationofTaERF ̄6 ̄3Ainresponsetodroughtandsalinitystresses[J].Int.J.Mol.Sci.ꎬ2022ꎬ23(6):3272. [9]㊀KaramiMꎬFatahiNꎬLohrasebiTꎬetal.RAVtranscriptionfactorregulatoryfunctioninresponsetosaltstressintwoIranianwheatlandraces[J].J.PlantRes.ꎬ2022ꎬ135(1):121-136. [10]洪林ꎬ杨蕾ꎬ杨海健ꎬ等.AP2/ERF转录因子调控植物非生物胁迫响应研究进展[J].植物学报ꎬ2020ꎬ55(4):481-496.[11]Ohme ̄TakagiMꎬShinshiH.Ethylene ̄inducibleDNAbindingproteinsthatinteractwithanethylene ̄responsiveelement[J].PlantCellꎬ1995ꎬ7(2):173-182.[12]刘建光ꎬ王永强ꎬ张寒霜ꎬ等.ERF转录因子在植物抗逆境胁迫的研究进展[J].华北农学报ꎬ2013ꎬ28(增刊):214-218.[13]SakumaYꎬLiuQꎬDubouzetJGꎬetal.DNA ̄bindingspecific ̄ityoftheERF/AP2domainofArabidopsisDREBstranscriptionfactorsinvolvedindehydration ̄andcold ̄induciblegeneexpres ̄sion[J].Biochem.Biophys.Res.Commun.ꎬ2002ꎬ290(3):998-1009.[14]张计育ꎬ王庆菊ꎬ郭忠仁.植物AP2/ERF类转录因子研究进展[J].遗传ꎬ2012ꎬ34(7):44-56.[15]WangYYꎬSunLLꎬWangRꎬetal.TheAP2transcriptionfactorsTOE1/TOE2conveyArabidopsisageinformationtoeth ̄ylenesignalinginplantdenovorootregeneration[J].Plantaꎬ2022ꎬ257(1):1.[16]FuMꎬKangHKꎬSonSHꎬetal.AsubsetofArabidopsisRAVtranscriptionfactorsmodulatesdroughtandsaltstressresponsesindependentofABA[J].PlantCellPhysiol.ꎬ2014ꎬ55(11):1892-1904.[17]LuoYXꎬChenSKꎬWangPDꎬetal.Genome ̄wideanalysisoftheRAVgenefamilyinwheatandfunctionalidentificationofTaRAV1insaltstress[J].Int.J.Mol.Sci.ꎬ2022ꎬ23(16):8834.[18]于志晶ꎬ蔡勤安ꎬ刘艳芝ꎬ等.拟南芥抗逆基因DREB2A转化大豆的研究[J].大豆科学ꎬ2013ꎬ32(5):606-608. [19]ZhangXXꎬTangYJꎬMaQBꎬetal.OsDREB2Aꎬaricetran ̄scriptionfactorꎬsignificantlyaffectssalttoleranceintransgenicsoybean[J].PLoSONEꎬ2013ꎬ8(12):e83011.[20]刘坤ꎬ李国婧ꎬ杨杞.参与植物非生物逆境响应的DREB/CBF转录因子研究进展[J].生物技术通报ꎬ2022ꎬ38(5):201-214.[21]ChengCꎬAnLKꎬLiFZꎬetal.Wide ̄rangeportrayalofAP2/ERFtranscriptionfactorfamilyinmaize(ZeamaysL.)developmentandstressresponses[J].Genesꎬ2023ꎬ14(1):194.[22]阮航ꎬ多浩源ꎬ范文艳ꎬ等.AtERF49在拟南芥应答盐碱胁迫中的作用[J].生物技术通报ꎬ2023ꎬ39(1):150-156. [23]MüllerMꎬMunné ̄BoschS.Ethyleneresponsefactors:akeyregulatoryhubinhormoneandstresssignaling[J].PlantPhys ̄iol.ꎬ2015ꎬ169(1):32-41.[24]DebbarmaJꎬSarkiYNꎬSaikiaBꎬetal.Ethyleneresponse971㊀第2期㊀㊀㊀㊀㊀㊀崔德周ꎬ等:小麦ERF亚族转录因子参与逆境胁迫的研究进展factor(ERF)familyproteinsinabioticstressesandCRISPR ̄Cas9genomeeditingofERFsformultipleabioticstresstoler ̄anceincropplants:areview[J].Mol.Biotechnol.ꎬ2019ꎬ61(2):153-172.[25]赵曾强ꎬ郭文婷ꎬ张析ꎬ等.棉花抗枯萎病相关基因GhERF5 ̄4D的克隆及功能分析[J].生物技术通报ꎬ2022ꎬ38(4):193-201.[26]才晓溪ꎬ胡冰霜ꎬ沈阳ꎬ等.GsERF6基因过表达对水稻耐盐碱性的影响[J].作物学报ꎬ2023ꎬ49(2):561-569. [27]李紫良ꎬ张建朝ꎬ李政ꎬ等.小麦转录因子基因TaERF7的克隆及其表达分析[J].西北植物学报ꎬ2020ꎬ40(2):210-217.[28]ZhangLꎬLiuPꎬWuJꎬetal.IdentificationofanovelERFgeneꎬTaERF8ꎬassociatedwithplantheightandyieldinwheat[J].BMCPlantBiol.ꎬ2020ꎬ20(1):263.[29]ZhuangJꎬChenJMꎬYaoQHꎬetal.Discoveryandexpres ̄sionprofileanalysisofAP2/ERFfamilygenesfromTriticumaestivum[J].Mol.Biol.Rep.ꎬ2011ꎬ38(2):745-753. [30]RiazMWꎬLuJꎬShahLꎬetal.ExpansionandmolecularcharacterizationofAP2/ERFgenefamilyinwheat(TriticumaestivumL.)[J].Front.Genet.ꎬ2021ꎬ12:632155. [31]李世姣ꎬ张晓军ꎬ乔麟轶ꎬ等.小麦盐胁迫响应相关ERF基因的分离和初步验证[J].核农学报ꎬ2021ꎬ35(5):1039-1047.[32]FarajiSꎬFilizEꎬKazemitabarSKꎬetal.TheAP2/ERFgenefamilyinTriticumdurum:genome ̄wideidentificationandex ̄pressionanalysisunderdroughtandsalinitystresses[J].Genesꎬ2020ꎬ11(12):1464.[33]XuZSꎬXiaLQꎬChenMꎬetal.Isolationandmolecularchar ̄acterizationoftheTriticumaestivumL.ethylene ̄responsivefac ̄tor1(TaERF1)thatincreasesmultiplestresstolerance[J].PlantMol.Biol.ꎬ2007ꎬ65(6):719-732.[34]宋桂成ꎬ周淼平ꎬ余桂红ꎬ等.小麦乙烯转录因子TaERF2响应湿害胁迫的表达分析[J].核农学报ꎬ2022ꎬ36(5):876-884.[35]徐兆师.小麦抗逆相关DREB/ERF转录因子基因的克隆与鉴定[D].北京:中国农业科学院ꎬ2005:114-121. [36]RongWꎬQiLꎬWangAYꎬetal.TheERFtranscriptionfactorTaERF3promotestolerancetosaltanddroughtstressesinwheat[J].PlantBiotechnol.J.ꎬ2014ꎬ12(4):468-479. [37]DongWꎬAiXꎬXuFꎬetal.IsolationandcharacterizationofabreadwheatsalinityresponsiveERFtranscriptionfactor[J].Geneꎬ2012ꎬ511(1):38-45.[38]张蕾.小麦盐胁迫应答相关基因TaERF5的功能研究[D].北京:中国农业科学院ꎬ2013:32-34.[39]崔德周ꎬ李永波ꎬ隋新霞ꎬ等.小麦盐胁迫持续上调转录因子基因TaERF8 ̄2D的克隆及其分析[J].山东农业科学ꎬ2021ꎬ53(5):32-37.[40]ZhuXLꎬQiLꎬLiuXꎬetal.Thewheatethyleneresponsefac ̄tortranscriptionfactorpathogen ̄inducedERF1mediateshostresponsestoboththenecrotrophicpathogenRhizoctoniacerealisandfreezingstresses[J].PlantPhysiol.ꎬ2014ꎬ164(3):1499-1514.[41]GaoTꎬLiGZꎬWangCRꎬetal.FunctionoftheERFL1atranscriptionfactorinwheatresponsestowaterdeficiency[J].Int.J.Mol.Sci.ꎬ2018ꎬ19(5):1465.[42]DuLYꎬHuangXLꎬDingLꎬetal.TaERF87andTaAKS1synergisticallyregulateTaP5CS1/TaP5CR1 ̄mediatedprolinebiosynthesistoenhancedroughttoleranceinwheat[J].NewPhytol.ꎬ2023ꎬ237(1):232-250.[43]MakhloufiEꎬYousfiFEꎬMarandeWꎬetal.Isolationandmo ̄lecularcharacterizationofERF1ꎬanethyleneresponsefactorgenefromdurumwheat(TriticumturgidumL.subsp.durum)ꎬpotentiallyinvolvedinsalt ̄stressresponses[J].J.Exp.Bot.ꎬ2014ꎬ65(22):6359-6371.[44]MakhloufiEꎬYousfiFEꎬPirrelloJꎬetal.TdERF1ꎬanethyl ̄eneresponsefactorassociatedwithdehydrationresponsesindu ̄rumwheat(TriticumturgidumL.subsp.durum)[J].PlantSignalandBehav.ꎬ2015ꎬ10(10):e1065366.[45]DjemalRꎬKhoudiH.IsolationandmolecularcharacterizationofanovelWIN1/SHN1ethylene ̄responsivetranscriptionfactorTdSHN1fromdurumwheat(TriticumturgidumL.subsp.du ̄rum)[J].Protoplasmaꎬ2015ꎬ252(6):1461-1473. [46]DjemalRꎬKhoudiH.Theethylene ̄responsivetranscriptionfactorofdurumwheatꎬTdSHN1ꎬconferscadmiumꎬcopperꎬandzinctolerancetoyeastandtransgenictobaccoplants[J].Protoplasmaꎬ2022ꎬ259(1):19-31.[47]HaghirSꎬAlemzadehA.Cloningandmolecularcharacteriza ̄tionofTaERF6ꎬageneencodingabreadwheatethylenere ̄sponsefactor[J].Mol.Biol.Res.Commun.ꎬ2018ꎬ7(4):153-163.[48]ZhangZYꎬYaoWLꎬDongNꎬetal.AnovelERFtranscriptionactivatorinwheatanditsinductionkineticsafterpathogenandhormonetreatments[J].J.Exp.Bot.ꎬ2007ꎬ58(11):2993-3003.[49]DongNꎬLiuXꎬLuYꎬetal.OverexpressionofTaPIEP1ꎬapathogen ̄inducedERFgeneofwheatꎬconfershost ̄enhancedresistancetofungalpathogenBipolarissorokiniana[J].Funct.Integr.Genomic.ꎬ2010ꎬ10(2):215-226.[50]ChenLꎬZhangZYꎬLiangHXꎬetal.OverexpressionofTiERF1enhancesresistancetosharpeyespotintransgenicwheat[J].J.Exp.Bot.ꎬ2008ꎬ59(15):4195-4204.081山东农业科学㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀第56卷㊀。
ERF转录因子在农作物中的研究进展

农业资讯NONGYEZIXUN农业信息ERF转录因子在农作物中的研究进展林珊珊(福建省种子管理总站,福建福州 350000)摘 要 ERF转录因子是调控乙烯信号转导途径的转录因子,参与植物对生物和非生物胁迫的响应机制,在植物的生长发育过程中起到不可或缺的作用。
因此,阐述ERF转录因子的结构特征以及在抗逆性方面上的研究进展,能够为培育农作物抗逆新品种提供重要的参考依据,对改进农作物抗逆性具有指导意义。
关键词 ERF转录因子;转基因;抗逆性植物的萌芽、生长发育及其繁殖极易受到外界环境的影响,因此,植物通过在生理和生化水平上进化出各种响应环境机制来适应环境。
ERF蛋白最初是在与逆境响应基因的启动区相结合的转录因子中鉴定出来的,诸多研究表明ERF基因能够响应生物胁迫及非生物胁迫。
ERF转录因子是参与乙烯信号转导途径的乙烯响应因子,可通过对乙烯响应基因进行正负调控影响乙烯水平,从而应对外界环境的刺激。
此外,与胁迫相关的激素如茉莉酸和脱落酸等也能够诱导ERF基因表达[1]。
因此接下来介绍ERF转录因子在抗逆基因工程方面的研究进展,为农作物抗逆基因的筛选范围提供了一个大方向。
1 ERF转录因子的结构特征ERF转录因子是AP2/ERF转录因子超家族中最主要的家族成员,仅包含一个非常保守的AP2/ERF结构域,普遍分布在所有农作物中[2],目前已经在水稻、小麦、番茄等农作物中得到功能上的验证。
ERF转录因子根据其激活或阻遏特定靶基因的转录功能分成激活因子和抑制因子两大类。
大多ERF抑制因子都含有EAR结构域,这些包含EAR结构域的转录因子都具有转录抑制活性。
但是去除EAR结构域的ERF转录因子则表现出转录激活活性,例如ERF3基因去除EAR结构域编码区后在番茄的过量表达能够激活抗病基因表达,从而提高植物的抗病性[3]。
然而植物转录因子的激活域并没有特定的保守序列,往往是集中在富含酸性氨基酸的区域。
2 ERF转录因子对生物抗性的作用诸多研究表明,ERF转录因子可通过对农作物中的抗病基因表达的正负调控来提高作物对病菌和病毒的抗性[3-4]。
根据 ERF 转录因子的结构特征可以将其分为四个亚类

根据ERF 转录因子的结构特征可以将其分为四个亚类。
第I 亚类:AP2/ERF结合域由59 个保守的氨基酸组成,位于蛋白的中部,转录调控域位于蛋白N 端;第II 亚类:AP2/ERF 结合域由58 个保守的氨基酸组成,位于蛋白的N 端,蛋白的C 末端存在一个EAR 基序;第III 亚类:AP2/ERF 结合域也由58 个氨基酸组成,其N 和C 两端各有一个酸性激活域,蛋白C 末端还有一个MAPK 作用位点。
第IV 类:AP2/ERF 结合域同样由58 个保守的氨基酸组成,位于蛋白的N 端,转录调控域位于C 端,此外N 末端还具有一个保守的MCGGAI(I/L)元件[68]ERFs类转录因子可以受到多种胁迫的诱导表达,同时参与不同胁迫信号转导途径的交叉应答,所以它在非生物胁迫中有十分重要的调控作用番前的?STE/JF/基因可以提高番莉根系发育过程中的耐盐性,还可以在转基因植株中表现较高的相对含水量和较低的丙二酸含量及电解质外渗,同时可以积累游离脯氨酸和可溶性糖含量,此外还调节抗逆相关基因、P5CS、DREB3】、的激活表达(Lu et al.,2011)。
Gao等(Gao et al.,2008)将番燕基因转入水稻,经过干旱和高盐处理后,同对照相比转基因植株的抗旱以及耐盐能力增强,并积累了脯氨酸含量,降低了叶片的水分流失。
另外,基因不仅可以影响含有GCC-box或DRE/CRT顺式元件的Z//>5、Wcor413L OsPrx和等胁迫相关的功能基因表达,还影响Os-CDP欠7、OsCDPKlS和OsCDP欠/9等调节基因的表达。
ERF类基因WXPl和WXP2可以使叶蜡积累并提高拟南芥的抗旱性(Zhangetal.,2007)。
己有许多研宄表明胁迫相关基因可以受外源的诱导表达,也有-?些基因虽然ABA对其表达无影响,但是确可以受到干早和低温等的诱导,这就又涉及到ABA依赖和ABA非依赖的非生物胁迫的信号转导途径,Zhu等(Zhu ct al.,2010)通过EMSA试验证明RAP2.6可以与CE丨顺式元件结合,进而可以调控AtABI4等ABA相关基因的特异表达。
erf转录因子结合的顺式作用元件

erf转录因子结合的顺式作用元件下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!一、概述erf转录因子是一类重要的植物转录因子,在植物的生长发育过程中起着关键作用。
e2f转录因子作用

e2f转录因子作用你知道吗?在细胞这个微观的小世界里啊,有一种特别神奇的东西叫e2f转录因子。
这e2f转录因子啊,就像是细胞里的一个小指挥官。
细胞里面的事儿可复杂啦,就像一个超级大的工厂,每个部分都有自己的工作。
这e2f转录因子呢,它主要管的就是基因表达这块儿。
基因就像是工厂里的各种设计图纸,e2f转录因子的作用就像是一个拿着指挥棒的人,告诉那些基因什么时候该工作,怎么工作。
比如说,有些基因是负责制造细胞生长所需要的各种蛋白质的,这e2f转录因子就像个闹钟,到了合适的时候就把这个基因叫醒,让它开始生产蛋白质。
那这个e2f转录因子是怎么做到的呢?这就有点像开锁匠开锁。
基因周围有一些特定的结构,就像锁一样。
e2f转录因子呢,它有特殊的结构,就像钥匙一样,正好能和基因周围的这些结构匹配上。
一旦匹配成功了,就像钥匙插进锁里一转,基因就被激活了,然后就开始按照它的“设计图纸”进行工作啦。
你可别小看这个过程啊。
如果把细胞比作一个小社会,基因就是社会里的各个岗位的工作人员,e2f转录因子就像人事部门,调配着这些工作人员什么时候上班。
要是e2f转录因子出了问题,就好比人事部门乱了套,该上班的工作人员没被通知到,那这个小社会就会出大问题。
比如说细胞可能就不能正常生长了,或者可能会出现一些病变。
而且啊,e2f转录因子还和细胞的周期有关系呢。
细胞周期就像是细胞的一生,从出生到成长,再到分裂繁殖,最后到衰老死亡。
e2f转录因子在这个过程中就像一个导航仪,指引着细胞在每个阶段该做什么。
在细胞准备分裂的时候,e2f转录因子就会活跃起来,指挥那些和细胞分裂有关的基因开始工作,就像在筹备一场盛大的庆典,每个工作人员(基因)都要在导航仪(e2f转录因子)的指挥下做好自己的事情,这样细胞才能顺利地分裂。
再说说这个e2f转录因子和癌症的关系吧。
癌症啊,就像是细胞这个小社会里的一群叛逆分子,它们不受控制地疯狂生长和分裂。
有时候呢,就是因为e2f转录因子这个小指挥官出了岔子。
ERF转录因子亚家族基因在甜瓜果实发育中的功能

ERF转录因子亚家族基因在甜瓜果实发育中的功能甜瓜(Cucumis melo L.)是全世界广泛栽培的一种重要的经济类瓜果作物,贮藏性是甜瓜经济价值最重要的影响因素之一。
乙烯在甜瓜果实成熟过程中发挥重要作用,而ERF又是乙烯信号转导途径中重要的转录因子,然而ERF在甜瓜果实发育过程中的功能仍然未知。
本研究利用生物信息学方法分析了甜瓜ERF转录因子亚家族64个成员蛋白序列特性及其基因的启动子元件。
以甜瓜品种河套蜜瓜为试材,使用实时定量PCR的方法构建了该亚家族成员在不同组织和不同发育时期果实中的表达谱,获得了 8个在果实发育中高表达的候选基因。
利用瞬时表达的方法分析了候选基因的功能,进一步用候选基因的过表达、RNAi和基因编辑载体进行稳定遗传转化甜瓜,分析其在果实发育过程中的功能。
主要结果如下:1.生物信息学分析发现甜瓜64个ERF蛋白的分子量介于14.00 kDa~46.62 kDa;40个蛋白的理论等电点小于7;预测所有蛋白均为亲水性蛋白;除CmERFIV-5,其他蛋白都是不稳定蛋白;58个蛋白定位于细胞核内、1个蛋白位于细胞质、5个蛋白定位于叶绿体;28个蛋白含有信号肽;64个基因获得83种启动子元件,其中包含赤霉素、茉莉酸、生长素、水杨酸、脱落酸和乙烯的不同应答元件,还包括厌氧、低温、热、干旱、创伤和真菌胁迫的不同应答元件;进化分析发现ERF在不同物种间相对保守;64个基因在12条染色上呈不均匀分布。
2.实时定量PCR检测64个CmERFs在根、茎、叶,9 d、18 d、27 d、36 d、呼吸跃变期和跃变后期果实中的表达量,发现8个基因在呼吸跃变期高表达,且在跃变期和跃变后期的表达量存在显著差异,其中(CmERFⅠ-15、CmERⅡ-9、CmERF Ⅳ-2、CmERFⅣ-3在呼吸跃变后期的表达量显著高于根、茎、叶中的表达量。
3.利用瞬时表达分析8个基因在果实发育中的功能,发现过表达CmERFⅠ-15、CmERF Ⅱ-9、CmERFⅢ-1、CmERFⅣ-2、CmERFⅣ-3、CmERFⅤ-4促进成熟,RNAi抑制其表达则延迟成熟;过表达CmERFI-18和CmERFⅢ-13延迟成熟,RNAi抑制其表达则促进成熟。
水稻erf 结构域

水稻erf 结构域
水稻中的ERF(Ethylene Responsive Factor)结构域是一个重要的转录因子结构域,通常与植物的乙烯响应有关。
乙烯是一种植物激素,对植物的生长发育、逆境响应等多个方面发挥重要作用。
ERF结构域是一个AP2/ERF超家族的一部分,包含一个或多个AP2/ERF域,这些域通常由约60个氨基酸组成,包含一个由18个氨基酸组成的β-折叠和一个由α-螺旋组成的C端。
在水稻中,ERF结构域通常由多个基因编码,这些基因被划分为不同的亚族。
这些基因可以通过与乙烯响应元件(ERE)结合来调控植物对乙烯的响应。
ERF转录因子可以通过与ERE结合来激活或抑制乙烯响应基因的表达,从而调控植物的生长发育、逆境响应等方面。
除了乙烯响应外,ERF结构域还可能参与其他生物过程的调控,例如植物对病原菌的响应、对干旱和盐碱等逆境的适应等。
因此,对水稻中ERF结构域的研究不仅有助于深入了解植物对乙烯响应的分子机制,还有助于揭示植物适应环境的复杂机制。
小麦ERF亚族转录因子参与逆境胁迫的研究进展

小麦ERF亚族转录因子参与逆境胁迫的研究进展
崔德周;王丽丽;陈祥龙;李永波;黄琛;隋新霞;楚秀生;樊庆琦
【期刊名称】《山东农业科学》
【年(卷),期】2024(56)2
【摘要】小麦是中国三大粮食作物之一,其生长发育过程中会受到多种逆境胁迫的影响。
AP2/EREBP是植物特有的一个庞大的转录因子超家族,普遍参与生长发育和逆境胁迫应答等生物学进程。
ERF类转录因子是AP2/EREBP转录因子超家族的一个亚族。
本研究结合国内外相关研究进展,简要综述了小麦ERF亚族转录因子的结构特征与分布,重点阐述近年来小麦ERF亚族转录因子响应高盐、干旱、低温、重金属、病原菌侵染等逆境胁迫的功能和机制研究进展,最后展望了ERF亚族转录因子的研究方向和应用前景。
【总页数】5页(P176-180)
【作者】崔德周;王丽丽;陈祥龙;李永波;黄琛;隋新霞;楚秀生;樊庆琦
【作者单位】山东省农业科学院作物研究所/小麦玉米国家工程研究中心/农业农村部黄淮北部小麦生物学与遗传育种重点实验室/山东省小麦技术创新中心/济南市小麦遗传改良重点实验室;山东省林草种质资源中心;山东鲁研农业良种有限公司【正文语种】中文
【中图分类】S512.1
【相关文献】
1.ERF转录因子在植物抗逆境胁迫的研究进展
2.一个小麦AP2/ERF转录因子家族单独亚族基因的克隆及分析
3.棉花中ERF亚族转录因子抗逆育种潜力的研究进展
4.番茄2个ERF-B1亚族转录因子基因的克隆及其对生物和非生物胁迫响应
5.水稻AP2/ERF转录因子参与逆境胁迫应答的分子机制研究进展
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、乙烯信号转导通路乙烯是一种非常重要的植物激素。
乙烯在植物生长发育和适应生物和非生物胁迫反应中起到了非常重要的作用。
种子萌发、开花、叶片衰老、果实成熟、根瘤、细胞程序性死亡以及对非生物胁迫和病原体入侵的反应等生理过程都与乙烯密切相关。
乙烯信号转导通路的最上游是位于内质网膜上的5个乙烯受体,分别被称为:ETR1、ETR2、ERS1、ERS2和EIN4。
位于乙烯受体下游的是一个负调节因子,蛋白激酶CTR1。
CTR1蛋白激酶通过与乙烯受体相结合定位在内质网上。
在没有乙烯存在的条件下,CTR1和受体的结合会协同抑制下游乙烯信号途径。
在CTR1负调控因子下游是一个正调控因子EIN2。
EIN2基因发生功能缺失突变会产生乙烯不敏感表型,显示出EIN2在乙烯信号通路中起到了核心作用。
EIN2的半衰期很短,两个F-Box蛋白ETP1和ETP2负责调控EIN2的泛素化降解。
位于EIN2下游的是正调控的转录因子家族EIN3及5个EILs。
研究发现,他们同样是受泛素化途径降解的,负责调控EIN3及EILs泛素化降解的F-Box蛋白是EBF1和EBF2。
EBF5是一种外切核酸酶它能够通过促进EBF1和EBF2的mRNA的降解来拮抗这两个蛋白对EIN3的负反馈调控。
EIN3和EIL1通过启动乙烯信号转导途径示意图转录级联反应来激活下游乙烯响应基因的表达。
二、乙烯响应因子(ethylene response factor、ERF)的结构特点及生物信息学分析ERF基因家族是一个很大的转录因子家族,属于AP2/ERF转录因子超家族。
Ohme-Takagi和Shinshi研究发现,GCC box是植物乙烯响应的DNA序列元件;同时他们在烟草(Nicotiana tabacuum)中发现了能特异性结合GCC box元件的数个乙烯响应元件结合蛋白(EREBPs),并发现,EREBPs同GCC元件相结合的结构域是59个保守的氨基酸残基。
AP2/ERF转录因子超家族的共同特征是都具有保守的AP2/ERF结构域。
根据AP2/ERF结构域的个数以及是否含有其他的结构域,将AP2/ERF转录因子超家族分为三个家族:AP2家族,含有两个重复的AP2/ERF结构域;ERF家族,只含有一个AP2/ERF结构域;RA V家族,除了含有一个AP2/ERF结构域以外,还有另外的一个B3结构域。
另外,根据AP2/ERF 结构域保守氨基酸的不同,又将ERF转录因子家族分为ERF亚家族和CBF/DREB亚家族。
Sakuma等根据DNA结合结构域的序列相似性将CBF/DREB 亚家族分为6个group:A-1~A-6,将ERF亚家族分为6个group:B-1~B-6。
ERF转录因子能够识别两种DNA序列顺式作用元件,即GCC box和CRT/DRE 元件。
GCC box的保守序列为AGCCGCC。
ERF转录因子的N端的59个氨基酸残基是识别GCC box所必须的。
Allen等研究了ERF结构域的3D结构,发现ERF结构域中有一个三条链的反向平行的β折叠和一个α螺旋,通过β折叠与DNA顺式元件相结合。
Hao等发现,GCC box的第一个G、第四个GERF结构域的三级结构和第六个C是ERF结构域识别所必须的;同时,N端的侧翼序列是ERF结构域结合GCC box所必须的。
CRT/DRE元件的保守序列为A/GCCGAC,在DREB蛋白的AP2/ERF结构域中,β折叠中的第14位缬氨酸和19位谷氨酸是结合顺式元件所必需的;而在ERF蛋白中,丙氨酸和天冬氨酸占据了同样的位置。
这两个氨基酸位于AP2/ERF结构域中的β折叠上。
Nakano等在拟南芥基因组中共发现了147个基因属于AP2/ERF超家族,其中有122个基因属于ERF基因家族。
对ERF家族的122个成员进行AP2/ERF结构域的氨基酸序列的多重比对分析发现,GLY-4、Arg-6、Glu-16、Trp-28、Leu-29、Gly-30和Ala-38完全保守,而Arg-8、Gly-11、Ile-17、Arg-18、Arg-26、Ala-39、Asp-43和Asn-57存在于超过95%的ERF家族成员中。
Nakano等对其中115个成员进行了系统发育分析,建立了系统发育树,并根据intron和extron结构和额外的结构域特征将115个ERF基因家族成员分成了12个group:group I - group X、group VI-L和group Xb-L。
同时,又对水稻基因组进行了分析,共发现有139个基因属于ERF基因家族。
对这些水稻基因进行系统发育分析,将其分成了15个group,其中11个group和拟南芥相同。
ERF基因家族在植物中广泛存在。
到目前为止已经有许多物种进行了全基因组或转录组的ERF基因家族筛选,并分别进行了系统发育分析。
结果如下表(不同的研究结果分别采用了Sakuma和Nakano的分类方法):Family Group 拟南芥水稻高粱玉米烟草葡萄白菜橡胶树Arabidopsis thaliana OryzasatavaSorghum Zea maysNicotianatabacuumVitisviniferaBressica rapaHeveabrasiliensisERF I 10 9 5 1512 II 15 16 8 297III 23 27 22 3911IV 9 6 5 223V 5 8 11 115VI 8 6 5 135VII 5 15 3 1623VIII 15 15 11 2715IX 17 18 40 2319X 8 12 10 99VI-L 4 3 2 66Xb-L 3 10 0 90合计122 145 105 151 239 122 236141部分AP2/ERF结构域26 RA V 6 5 4 2 6 144AP2 18 29 16 31 35 20 3025 Soloist 1 1 1 1 1 13总计147 180 126 185 149 281173 Family Group拟南芥水稻杨树大豆葡萄小麦番茄Arabidopsis thaliana OryzasatavaPopulustricocarpaGlycine max Vitis viniferaTriticumaestivumLycopersicumesculentumDREB subfamily A1 6 10 6 7 39A2 8 4 18 4 5A3 16 1 2 0 0A4 16 15 26 13 1A5 16 13 14 7 4A6 10 9 2 5 8总57 52 77 36 36 5748ERF subfamily B1 15 16 19 7 7B2 5 16 6 3 19B3 18 18 35 37 8B4 7 9 7 4 4B5 8 6 8 4 0B6 12 14 16 18 9总65 79 91 62 73 4777单个不完全的AP2/ERF结构域22AP2 18 26 26 26 18 918RA V 6 7 5 2 4 33 Soloist 1 0 1 1 1总计147 164 200 148 132 117146三、ERF转录因子的功能ERF转录因子最初发现是在烟草中,作为转录因子同乙烯响应元件GCC box 相结合,参与乙烯信号途径,因此被命名为乙烯响应元件结合蛋白(Ethylene response element binding factor、EREBP),后又被重新命名为Ethylene response factor(ERF)转录因子。
然而后来的研究过程中发现,ERF家族的成员很多,如拟南芥和水稻中分别共有122和145个,并且不都参与乙烯反应,且DNA结合元件并不直接接受乙烯信号刺激。
DREB亚家族成员通常会和CRT/DRE元件(保守序列为A/GCCGAC)结合,参与ABA信号途径和干旱、低温胁迫等反应;而ERF亚家族成员通常会结合GCC box(保守序列为AGCCGCC),参与乙烯信号途径、低氧胁迫反应、病原体胁迫反应、伤害反应等过程。
1.ERF转录因子在植物生长发育过程中的作用在AP2/ERF转录因子超家族中,AP2类的转录因子主要在调节发育过程中起作用,如花发育、果实成熟、种子发育等过程;而ERF转录因子家族主要参与环境胁迫和激素刺激的过程,如低温胁迫、干旱胁迫、低氧胁迫以及病原体侵染过程。
在拟南芥中,AP2-13、AP2-05和AP2-09分别调节花的生长和卵细胞的发育。
在水稻中,AP2/ERF转录因子家族成员SNORKELs在水淹条件下会对乙烯作出反应,诱导节间伸长,使水稻逃离水淹的低氧环境。
几个AP2/ERF基因的异常的表达会影响植株的形态建成。
如在拟南芥中,TINYT、ERF1和DREB1的异常表达会导致矮化表型的产生;DREB2的表达会延缓植株的生长。
Xueping Li等从番木瓜(Carica papaya)中克隆到了4个ERF 基因(cpERF1-4),并进行了分析,研究了在不同发育阶段中这四个基因的表达模式。
结果发现,在果实成熟过程中,cpERF1和cpERF2的转录水平增加,而cpERF3和cpERF4相反,在果实成熟过程中转录水平下降。
同时,他们发现,cpERF1、cpERF3和cpERF4的表达量被1-MCP诱导,而cpERF2的表达量被1-MCP抑制;乙烯会诱导cpERF2的表达,抑制cpERF1、cpERF3和cpERF4的表达。
结果说明,cpERF2的表达和番木瓜果实的成熟呈正相关,而cpERF1、cpERF3和cpERF4的表达和番木瓜果实成熟呈负相关。
Ying Zhou等从棉花中分离到了一个ERF基因,即GhERF12基因。
将这一基因在拟南芥中过表达,发现转基因植株生长的更慢,且出现了矮化的现象。
进一步研究发现,许多乙烯相关基因和生长素相关基因快速上调表达,因此推测GhERF12作为转录因子通过激活保守的乙烯响应和生长素生物合成及信号转导来调节植物的生长和发育。
2.ERF转录因子在植物非生物胁迫中的作用研究发现,DREB1/CBF(A-1)亚组成员与冷胁迫响应相关。
拟南芥DREB1亚组由6个成员组成,其中DREB1A/CBF3、DREB1B/CBF1和DREB1C/CF2在冷胁迫反应中被快速诱导。
过度表达的转基因拟南芥植株表现出抗性明显提高,而DREB1A/CBF3和DREB1B/CBF1活性的抑制会导致冷胁迫忍耐性的降低。
许多冷胁迫诱导的基因被上调表达。
与之相对,DREB2亚组的大多数成员于干旱和热激胁迫反应相关。
拟南芥DREB2A和DREB2B被干旱、高盐和热诱导表达,DREB2C、DREB2D和DREB2F被高盐诱导表达,DREB2E被ABA诱导表达。
