同工酶实验宁波大学参考PPT
植物同工酶分析技术-幻灯片(1)

过氧化氢酶
过氧化物酶广泛存在于植物体中,是活性较高的一种酶。它与呼吸作用、 光合作用及生长素的氧化等都有关系。在植物生长发育过程中它的活性不 断发生变化。一般老化组织中活性较高,幼嫩组织中活性较弱。这是因为 过氧化物酶能使组织中所含的某些碳水化合物转化成木质素,增加木质化 程度,而且发现早衰减产的水稻根系中过氧化物酶的活性增加,所以过氧 化物酶可作为组织老化的一种生理指标。此外,过氧化物同工酶在遗传育 种中的重要作用也正在受到重视。
电泳 缓冲液
加在槽中的样品
夹在两块玻璃 板之间的凝胶
电泳 缓冲液
电 泳 示 意 图
电源
分子量大 分子量小
6、染色 将完整的胶块置于染色器皿中,加 入染色液,浸泡整块凝胶,室温下染色 20—30min,呈现酶带后取出胶块,用水 漂洗以终止染色。
7、对带型清楚的胶应做摄影记录或做扫描 测定,胶晾干后做永久保存。
速度越慢,反之越快; 5、电场强度:电场强度越小,电泳速度越慢,反之越快; 6、离子强度:离子强度越大,电泳速度越慢,反之越快; 7、电渗现象:电场中,液体相对于固体支持物的相对移动; 8、支持物筛孔大小:孔径小,电泳速度慢,反之则快。
聚丙烯酰体的一种区带电泳。这 种凝胶是由丙烯酰胺单体(Acr)和交联剂N,N’-甲叉 双丙烯酰胺(Bis)在催化剂作用下聚合而成的,Acr和 Bis在具有自由基团体系时,就会聚合。引发产生自由基 的方法有两种:(1)化学法:引发剂是过硫酸铵(AP), 催化剂N、N、N’、N’-四甲基乙二胺(TEMED), 它的碱基催化AP产生自由硫酸基,其氧原子激活丙烯酰 胺单体形成单体长链。化学聚合形成的凝胶孔径较小, 且重复性好,用来制备分离胶;(2)光聚合法:光聚 合法的催化剂是核黄素(VB2),光聚合形成的凝胶孔 径较大,且不稳定,适于制备大孔径的浓缩胶。
酶的相关实验课件.ppt
为验证pH对唾液淀粉酶活性的影响,实验如下:
(1)操作步骤:
①在1-5号试管中分别加入0.5%淀粉液2 mL。
②加完淀粉液后,向各试管中加入相应的缓冲液3.00mL, 使各试管中反应液的 pH依次稳定在6.00,6.40, 6.80,7.20,7.60。
③分别向 l-5号试管中加入0.5%唾液1mL,然后放入 37℃恒温水浴中。
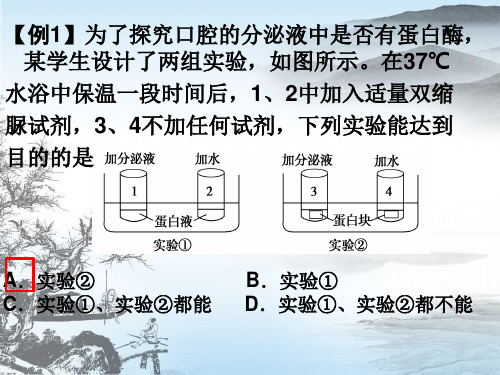
【例1】为了探究口腔的分泌液中是否有蛋白酶, 某学生设计了两组实验,如图所示。在37℃
水浴中保温一段时间后,1、2中加入适量双缩 脲试剂,3、4不加任何试剂,下列实验能达到 目的的是
A.实验②
B.实验①
C.实验①、实验②都能 D.实验①、实验②都不能
试管及操作
1号 2号 3号 4号
H2O2溶液(mL) 2
④ 观察实验现象并记录实验结果
。
(3)结果预测 砖红色沉淀 无砖红色沉淀 无砖红色沉淀 砖红色沉淀。
4、探究温度对酶活性的影响
组别 步骤
实验操 作内容
试管1 试管2
1
淀粉溶液
2 mL
2 mL
2
控制不同 温度条件
60℃热水 沸水 (5分钟) (5分钟)
3
淀粉酶溶液
1 mL
1 mL
(5分钟) (5分钟)
2
2
2
FeCl3溶液(滴) — — 2 —
鲜肝研磨液(滴) — 2 — 2
HCl溶液
————
NaOH溶液
————
蒸馏水(滴)
2 ———
保持温度(℃) 37 37 37 0
(1)1号和2号试管对比得出的结论是 酶具有催化作用 (2) 2号和3号试管对比得出的结论是 酶具有高效性 (3) 2号和4号试管对比得出的结论是酶的活性受温度影响
实验四 同工酶分析
四、实验步骤
• 凝胶制备:
聚丙烯酰胺凝胶配方
成分
含量
N液(29.2%Acr-0.8%Bis) 5mL
L液(Tris)
5mL
蒸馏水
10mL
TEMED
20μL
10% AP
100μL
作用
交联剂 缓冲液
加速剂
催化剂
4℃储存,用量可 适量调整
现用现配,用量 可适量调整
15
四、实验步骤
• 样品制备:
称 取 0.5g 植 物 幼 苗 , 放 入 研 钵 内 , 加 入 1mL样品提取液(pH8.0),于冰浴中研成匀 浆,全部转入1.5mL离心管中,10000r/min离 心 10min , 吸 取 100μL 上 清 液 至 新 离 心 管 中 , 加入等量的上样缓冲液,混匀,即为样品液。
➢ 浓缩效应:凝胶为不连续系统(凝胶层、pH、电位梯 度均不连续),从而使样品浓缩在一个极窄的起始区带 ,即所谓浓缩效应,提高了条带分辩率。(只有不连续 凝胶具有此效应)
10
11
二、实验原理
➢ 过氧化物同工酶及活性染色
(1)同工酶是指能催化同一种化学反应,但其酶蛋白本身 的分子结构及其理化性质不同的一组酶。同功酶是机体调节 酶活性的一种方式,在各种生物体中广泛存在。
19
五、实验结果与分析
1 2
需要说明:
1、同工酶的数量。
3
2、同工酶的分子量大小。
4
3、同工酶的含量大小。
20
六、思考题
1、简述过氧化物同工酶丙烯酰胺电泳的原理。 2、请说明本实验过程中的注意事项。 3、简述丙烯酰胺电泳的操作要点。 4、上样缓冲液中蔗糖和溴酚蓝的作用是什么?
同工酶实验报告(3篇)

第1篇一、实验目的1. 理解同工酶的概念及其在生物体中的生物学意义;2. 掌握同工酶电泳技术的基本原理和方法;3. 通过同工酶电泳实验,观察和分析同工酶在样品中的分布情况。
二、实验原理同工酶是指具有相同催化功能,但氨基酸序列和分子结构不同的酶。
同工酶电泳技术是一种分离和鉴定同工酶的方法,其原理是利用同工酶在电场中的迁移速率差异,将其分离。
三、实验材料1. 实验样品:植物叶片、动物组织等;2. 电泳试剂:琼脂糖、溴酚蓝、丙烯酰胺、甲叉双丙烯酰胺等;3. 电泳仪器:电泳槽、电泳仪、凝胶成像系统等;4. 其他:移液器、吸管、剪刀、镊子等。
四、实验方法1. 样品制备:将实验样品研磨,加入适量提取液(如Tris-HCl缓冲液),在冰浴中匀浆,离心取上清液;2. 电泳凝胶制备:按照电泳试剂的配方,制备琼脂糖凝胶;3. 电泳样品制备:将提取液加入适量的丙烯酰胺和甲叉双丙烯酰胺,混合均匀后,加入适量的样品,制成样品胶;4. 电泳:将制备好的样品胶放入电泳槽中,加入电泳缓冲液,接通电源,进行电泳;5. 成像与分析:电泳结束后,取出凝胶,用凝胶成像系统拍照,分析同工酶的分布情况。
五、实验结果1. 通过电泳实验,观察到样品中存在多种同工酶;2. 不同样品的同工酶分布情况存在差异,说明同工酶在生物体中具有特异性;3. 同工酶的迁移速率与酶的分子量有关,分子量较小的酶迁移速率较快。
六、实验结论1. 同工酶在生物体中具有重要作用,其生物学意义包括催化、调控、信号传递等;2. 同工酶电泳技术是一种有效的分离和鉴定同工酶的方法;3. 本实验成功分离和鉴定了样品中的同工酶,为后续研究提供了基础。
七、实验讨论1. 实验过程中,样品制备和电泳操作应注意无菌操作,以避免污染;2. 电泳条件的选择对同工酶的分离效果有较大影响,应根据实验目的和样品特点进行优化;3. 同工酶的研究有助于揭示生物体的遗传、变异和进化规律。
八、实验总结本实验通过同工酶电泳技术,成功分离和鉴定了样品中的同工酶,验证了同工酶在生物体中的生物学意义。
同工酶测定

保护酶(SOD、POD、CAT、APX)同工酶分析酶液提取:称取1g样品鲜叶,在冰浴条件下加酶提取液(0.1 mol·L-1 Tris-HCl 缓冲液pH8.0(每100ml内含半胱氨酸0.073g、抗坏血酸0.105g、EDTANa20.075g、甘油10ml、1mol·L-1HCl 5.84ml)2ml,研磨至匀浆,然后在低温冷冻离心机中4℃、13000r·min-1离心20min,上清液极为酶提取液。
电泳(邹琦,2000):采用垂直平板聚丙烯酰胺凝胶电泳(PAGE)进行同工酶分析,分离胶浓度POD、CAT为7.5%,SOD、APX为10%,浓缩胶浓度为3%(配方如表1)。
电泳时采用稳流控制,SOD、POD、CAT电泳浓缩胶为15mA/板,分离胶20mA/板;APX电泳浓缩胶、分离胶均为30mA/板,电泳缓冲液中加入2mmol·L-1抗坏血酸,上样前预电10min。
电泳至溴酸蓝标志到达凝胶前沿为止。
酶谱染色:根据酶反应的专一性,采用不同的染色方法,进行同工酶酶谱分析。
SOD同工酶的染色方法:采用四氮唑蓝(NBT)法(胡能书,1985)染色。
电泳完毕后,取下胶片,用无离子水冲洗干净,然后依次浸入下述染色液中:(1)把电泳完毕后的胶片放在A液(2.45mmol·L-1 NBT溶液)中于黑暗下浸20min;(2)在B液(含有28μmol·L-1核黄素、2.8mmol·L-1四甲基乙二胺的36mmol·L-1 pH7.8 磷酸缓冲液)中于黑暗下浸15min;(3)在C液(含10mmol·L-1 EDTA的0.05mol·L-1 pH7.8 磷酸缓冲液)中浸泡并于40W日光灯下照光至出现清晰透明的SOD同工酶谱带。
染色后的胶片洗掉浮色后,可保存在7%的醋酸溶液中,供分析、照相、亦可制成干板永久保存。
表1聚丙烯酰胺凝胶电泳胶板配置方法Table 1 Gel and dyeing solution compounds药剂分离胶10% 分离胶7.5% 浓缩胶3%30%Acr 9.75 ml 7.3 ml 1 ml1%Bis 7.50 ml 5.6 ml 1 ml 分离胶缓冲液 3.75 ml 3.75 ml浓缩胶缓冲液 2.5 ml 蒸馏水8.80 ml 13.15 ml 5.43 mlPOD 同工酶电泳染色:采用联苯胺溶液染色法(邹琦,2000)。
实验十-同工酶分析

实验四同工酶分析同工酶概述酶是以蛋白质为主要成分的生物催化剂。
在生物体内,有一些酶催化相同的反应,但其结构不同。
它们对底物的浓度、pH、温度等的最适要求不同,酶活力的调控反应及其所在的细胞分布也不一样。
把催化相同反应而结构和理化性质不同的酶的分子类型称为同工酶(isozyme)。
同工酶概念的提出,揭示了不同生物、同一生物不同器官和不同组织起源的酶可作用于同一底物,催化相同的反应,但在其他性质方面可以不尽相同。
大量研究表明,同工酶在生物界是广泛存在的。
在动植物和微生物体中、同一物种的不同个体、同一个体的不同器官、组织和细胞、同一细胞的不同部位、生长发育的不同阶段、不同的代谢条件下,都有不同的同工酶分布。
现在已发现的酶中,有一半以上的酶已经发现有同工酶存在。
可以进行同工酶分析的酶已有100多种。
不同同工酶可以根据电泳迁移率予以区别和编号,以向阳极方向泳动最快的编为同工酶1。
从分子结构上看,同工酶的形成有以下学说或原因:(一)亚单位结构学说亚单位结构学说是研究同工酶理论并对作用机理阐述的较为透彻的学说之一。
该学说认为同工酶是由不同亚基按不同方式结合而成的。
这个学说有广泛的实验证据。
如已经证明乳酸脱氢酶(LDH)是由A、B两个亚基,按不同比例结合成的四聚体,所以有5种同工酶:LDH1(A4)、LDH2(A3B1)、LDH3(A2B2)、LDH4(A1B3)、LDH5(B4)。
(二)不同基因编码由不同的基因或等位基因编码会形成一级结构完全不同或有个别氨基酸残基不同的多肽链。
因而产生同工酶。
由不同基因引起的同工酶存在于同一物种的所有个体中,而由等位基因引起的同工酶以一定比率存在于同一族中。
(三)单一亚单位聚合程度不同有些同工酶的亚单位是完全相同的,如胆碱脂酶(ChE),但不同的酶分子中,亚基数目不同,这就形成分子量不同的5种同工酶。
经研究发现,目前发现的100多种同工酶,其组成比例不同,但以单体(26%)、二聚体(52%)、四聚体(20%)较多,三聚体极少。
血清LDH同工酶测定课件

LDH同工酶的种类与分布
LDH同工酶有五种,分别为LDH1、LDH2、LDH3、LDH4和LDH5,它们在人体 内的分布具有差异性。
LDH1主要分布在心肌、红细胞和肾脏,LDH2主要分布在血小板和白细胞, LDH3主要分布在肺、脾和淋巴结,LDH4和LDH5则广泛分布于人体各个组织。
LDH同工酶的生物学功能
质量控制记录
记录实验过程中的质量控制情况, 以便进行追溯和改进。
06 血清LDH同工酶 测定的发展趋势 与展望
新技术与新方法的应用
自动化技术
利用自动化仪器和设备,实现血清LDH同工酶测 定的快速、准确和高效。
免疫学方法
利用抗体技术,提高血清LDH同工酶测定的特异 性和灵敏度。
分子生物学技术
利用基因测序和蛋白质组学技术,深入了解血清 LDH同工酶的分子结构和功能。
THANKS
感谢观看
01
LDH同工酶参与糖酵解和糖异生 过程,其中LDH1和LDH2催化乳 酸与丙酮酸之间的氧化还原反应,
02 而LDH3、LDH4和LDH5则参与
其他代谢过程。
LDH同工酶还参与细胞凋亡和坏 死等细胞死亡过程,以及免疫应 答和肿瘤发生等生物学过程。
LDH同工酶的代谢特点
LDH同工酶的代谢特点与它们的分布和生物学功能密切相关。 例如,LDH1和LDH2主要参与糖酵解和糖异生过程,其代谢 特点是快速周转和高效能量转换;而LDH3、LDH4和LDH5 则具有较慢的周转速度和较低的能量转换效率。
临床意义与价值
临床意义
血清LDH同工酶测定对于鉴别诊断心 肌梗死与其他原因引起的胸痛、评估 肝病的严重程度、监测恶性肿瘤的病 情发展等方面具有重要价值。
价值
血清LDH同工酶测定不仅有助于疾病 的早期发现和诊断,还能为临床医生 制定治疗方案提供依据,提高疾病的 治疗效果和患者的生存率。
基础生物化学实验课件PPT-植物叶片过氧化物同工酶的PAGE分析

化学名称 丙烯酰胺 甲叉双丙烯酰胺 过硫酸铵 四甲基乙二胺 三羟甲基氨基甲烷 十二烷基硫酸钠
作用 单体 交联剂 催化剂 加速剂 缓冲配对离子 变性剂
2. 原理
2.1 生物大分子性质 生物大分子如蛋白质、核酸、多糖等常以颗粒分散在
溶液中,它们的净电荷取决于介质的H+浓度或与其它大分 子的相互作用。在电场中,带电颗粒向阴极或阳极迁移, 迁移方向取决与它们带电的符号。 纸电泳、琼脂糖电泳、聚丙烯酰胺凝胶电泳、毛细管电泳
7.5%分离胶和2.5%浓缩胶的配方
试剂用量(ml) 分离胶缓冲液(PH8.8)
30%分离胶贮液 浓缩胶缓冲液(PH6.7)
10%浓缩胶贮液 ddH2O
0.14% 过硫酸胺(AP)
TEMED
7.5%分离胶 1.5 3.0
1.5 6.0 0.004
2.5%浓缩胶
0.5 1.0 0.5 2.0 0.002
(1)凝胶性能与总浓度及交联度的关系:
T%(Acr和Bis总浓度)= (a+b)/m× 100 C% (交联剂百分比) = b/(a+b) × 100 其中,a= Acr克数,b= Bis克数,m=缓冲液体积(ml) 欲制备完全透明而又有弹性的凝胶, 应控制a/b=30左右。 经验公式: C = 6.5 - 0.3 T
聚丙烯酰胺凝胶电泳(Polyacryamide
gel electrophoresis PAGE)
分离植物过氧化物酶同工酶
1. 目的要求
(1)了解聚丙烯酰胺凝胶电泳原理。 (2)掌握聚丙烯酰胺凝胶垂直板电泳的操作技术。 (3)了解同工酶研究在理论和实践中的重要意义。
PAGE实验中用到的试剂:
简称 Acr Bis AP TEMED Tris SDS
浙科版生物选修一《生物技术实践 》《乳酸脱氢酶同工酶的分离》讲授课件-新版

不连续电泳的四个不连续性
凝胶浓度的不连续性; 缓冲液离子成分的不连续性; 缓冲液PH梯度的不连续性; 电位梯度的不连续性。
(3)蛋白质在净电荷聚丙烯酰胺凝胶电泳中的
分离因素:
电荷因素:蛋白质分子性状和大小相同,所带电 荷性质和数量不同 分子大小:蛋白质分子性状和所带电荷和数量相
根据五种同工酶分子结构以及理化性质的不同 PI 各
不相同,在同一 SDS-PAGE 中,在电场中移动速度不
同,可用电泳法将其分离。
(3)生理及临床意义:
a.在代谢调节上起着重要的作用。 b.用于解释发育过程中阶段特有的代谢特征。 c.同工酶谱的改变有助于对疾病的诊断。 d.同工酶可以作为遗传标志,用于遗传分析研究。
C.肽链的多少
D.分子形状的差异
3.电泳是指带电粒子在电场的作用下向着与其所 带电荷( B )的电极移动。 A.相同 B.相反 C.相对 D.相向
4.缓冲液的作用是:在一定范围内,抵制外界
的影响来维持( B )基本不变。 A.温度
退 出
B.pH
C.渗透压
D.氧气浓度
(1)原理:
是由单体丙烯酰胺( Acr )和交联剂 N , N , - 亚甲基 丙烯酰胺(Bis)在催化剂过硫酸铵(AP)和加速剂
N , N , , N, - 四甲基乙二胺( TEMED )作用下聚合交
联而成的三维网状结构的凝胶。 TEMED 催化 AP 生成硫酸自由基:以 AP 为催化剂,以 TEMED为加速剂。
硫酸自由基的氧原子激活Acr单体并形成单体长链:
Bis将单体长链间连成网状结构:
(2)聚丙烯酰胺凝胶类型:
1.连续系统:是指电泳系统采用相同孔径的凝胶 缓冲系统等条件下进行区带电泳,是利用蛋白质 分子的电荷效应进行分离,凝胶的分子筛效应不 明显,一般只用于分离一些比较简单的样品,缺 点是分辨力不高。
遗传学实验

• 实验报告:
绘制所观察到的分散较好的唾液腺染色 体图像。
实验四:核型分析
• 实验目的:
掌握骨髓细胞染色体标本的制备技术; 了解和掌握染色体核型分析的方法。
• 实பைடு நூலகம்原理:
秋水仙素是一种生物碱,它能抑制细胞分裂时 纺锤体的形成,使染色体不走向两极而被阻止在分 裂中期,这样细胞就不能继续分裂,从而产生染色 体数目加倍的核。若染色体加倍的细胞继续分裂, 就能形成多倍性的组织。通过一定的方法,将染色 体制成片子,就能在显微镜下观察和鉴定染色体的 数目。
后期II: 着丝粒纵裂,姐妹染色单体分开。
末期:染色体解旋,核膜重建等。
实验报告
• 根据你所观察的结果绘制蝗虫精巢减数分
裂过程中的染色体图像
实验二:果蝇杂交实验
1、果蝇培养及主要性状观察
一、遗传学实验常用的五个果蝇品系:
• 品系
• • • • •
体色 翅形
眼色
刚毛
野生型: 灰身、长翅(翅过体)、 红眼、 直刚毛
1.非显带染色体的识别 1968年以前,不通过带纹,而从染色体整体分析。 1960年,丹佛会议上,提出了人类有丝分裂染色 体命名标准体制草案,为以后的所有命名报告奠定了 基础。 1963年,伦敦会议上,正式批准Patan 提出的A、 B、C、D、E、F、G七个字母表示七组染色体的分类 法。 1966年,芝加哥会议上,提出人类染色体组和畸变速 记符号的标准命名体制。
煮沸后加约1毫升丙酸(抑菌),待稍冷却后 再加入C,搅拌均匀后分装。
三、果蝇培养基的配制
(三)注意事项:
• 配制培养基前先要对指管及棉塞进行消毒处理,
121℃ 25分钟;
• 分装时培养基不要碰到管壁; • 酵母粉可以等到玉米粉煮沸后再加,这样可以避免
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电 泳 示 意 图
电源
移的规律,小分子走在前头,大分 子滞后。电泳凝胶相当于凝胶过滤中的一个带孔胶粒。
电泳方向
混合样品 电泳
大分子
带孔胶
小分子
按分子 15 大小分离
乳酸脱氢酶染色剂的配制
乳酸钠 0.5ml NAD 25mg PMS 2mg NBT 15mg 0. 2M Tris-Hcl溶液(PH8.0)10ml 去离子水定容至50ml
3
乳酸脱氢酶
用电泳方法将LDH同工酶分离,分析其酶谱,发现脊椎动物各组 织中有五条酶带。每条酶带的酶蛋白都是由四条肽链组成的四聚 体,LDH有两类肽链,A(M)或B(H),各有不同 同工酶的 免疫性质,按排列组合可形成符合于电泳酶带数的五种同工酶。 LDH1及LDH5分别由纯粹的4条B链(B4)和4条A链(A4)形 成,称为纯聚体;而LDH2、LDH3和LDH4都是由两类肽链杂交 而成的,分别可写成AB3、A2B2、A3B,称为杂交体
8
样品制备
取材: 大黄鱼若干条,解剖取1.肠、2.眼睛、3.鳃、4.肌 肉、5.脾、6.鳍、7.肝、8.心脏 放入冰箱保存。
提取酶:取不同组织块,加入提取缓冲液Tris-Hcl(pH=7.0) 此溶液需4℃预冷,组织重量(g)与缓冲液体积(mL)之 比为1:5,用研钵研磨充分。浆液4℃离心约30分钟,1 5000转/分钟。
加入少量电泳缓冲液,小心拔出样品梳(两端同时向外拔),再注满缓 冲液备用。
11
点样
加样
样品迁 移方向
12
电泳
➢ 电压和电流:浓缩胶电压100v,分离胶电压180V. 电流流18-30mA
➢ 溴酚蓝跑至分离胶末端,电泳结束。大约2-3个小时
13
电泳 缓冲液
加在槽中的样品
夹在两块玻璃 板之间的凝胶
80ml,调节pH到
B储备液 : pH6.7 Tris~HCl缓冲液:1 M HCl 48ml,5.98g Tris,加双蒸水到80ml,调节pH到6.7 定容到100ml。
C储备液: 分离胶储备液(30% Acr/Bis):30g Acr,0.8g Bis,用双蒸水定容到100ml,备用, 4℃存放可以保存1个月。
垂直电泳分离同工酶
(活性染色鉴定法)
1
实验目的:
理解同工酶的概念及遗传学意义 学习聚丙烯酰胺凝胶电泳原理 掌握聚丙烯酰胺凝胶电泳操作技术 掌握乳酸脱氢酶同工酶及酶活性染色
2
1. 同工酶是指能够催化相同的化学反应,但酶
分子结构、理化特性乃至免疫学性质不同的一 组酶。 它们是由遗传体系决定的在不同组织中 表达的蛋白质作用相同,但分子结构、理化特性 等不同. 2. 由于同工酶存在蛋白结构及理化性质的不同, 在电泳时条带略有差异,因此可用电泳将它们分 离开来。 3. 本实验做的是乳酸脱氢酶的分离鉴定
10ul
20
10
浓缩胶的制备
储备液 B储备 液
用量
1.25
(ml)
D储备 液
0.8
配方表
E储备液 F储备液 双蒸水
TEMED 总体积
60ul
5
2.9
16ul
10
TEMED最后一个加入,轻轻混匀。移液枪吸取加入约2.0CM左右高度 的浓缩胶液,然后插入样品梳,注意不要产生气泡。当浓缩胶上出现水 层后表明聚合完成。再放置30-60min后可以使用。
4
聚丙烯酰胺凝胶电泳分离蛋白质的原理
净电荷聚丙烯酰胺凝胶电泳是对 天然状态生物大分子进行的电泳,利 用蛋白质分子中所带净电荷、分子质 量、形状的差异,而在电场中泳动的 速度和方向不同,达到分离的目的。
5
实验器材:
夹心式垂直板电泳槽,梳子,直流稳 压电源(电压300-600V,电流50100mA),移液枪(各种量程),烧杯 (100mL),培养皿,
D储备液: 浓缩胶储备液:10g Acr,2.5g Bis,用双蒸水定容到100ml,备用,4℃可以保存1个月。
E储备液: 10% Aps(W/V):1g定容到10ml,-20℃保存。
F储备液: 40%蔗糖:40g蔗糖溶解到60ml双蒸水中。
TEMED
2.电泳缓冲液: Tris6.0g,28.8gGly 加双蒸水到900ml调节pH到8.3,定容到1000ml,使用时稀释10倍。
取上清液至新管,吸取其中150ul样品,加100ul 甘油 和10ul溴酚蓝,混匀之后即可点样。
9
分离胶的制备
将需要的凝胶储备液从冰箱中取出,放置备
用。取一100ml烧杯,按表比例混匀之后 使用。
配方表
储备液
A储备液 C储备液 E储备液 双蒸水
TEMED 总体积
用量(ml) 2.5
3.75
0.1
13.75
16
染色与观察
将胶从中间切成2块,各自切去一个小 角(作为标记),去离子水轻轻从玻 璃板上吹下, 置于大培养皿中,去离子水浸洗之后 倒入染 染色剂浸没,避光于37度摇床中染色 30min。 观察拍照
17
18
思考题:
根据实验过程的体会,总结如何做好 聚丙烯酰胺凝胶垂直板电泳?哪些是 关键步骤?哪些过程中是 为什么要在样品中加入少许溴酚蓝和 甘油溶液?分别有何用途?
6
实验流程
试剂的配制 仪器的准备 动物组织的样品的获取 分离胶(30分钟) 浓缩胶(30分钟) 电泳(2-3小时) 染色(30分钟) 观察结果
7
一、试剂:
1.凝胶储备液: A储备液: pH8.9 Tris~HCl缓冲液:1 M HCl 48ml,36.6g Tris,加双蒸水到 8.9定容到100ml。
19
谢谢
20
