气固多相反应动力学基础
气固相催化反应本征动力学

a
6
➢固体催化剂的特殊结构,造成化学反应 主要在催化剂的内表面进行。
➢催化剂的表面积绝大多数是内表面积。
a
7
气固相催化反应的七个步骤
1. 反应物由气流主体扩散到催化剂外表面
2. 反应物由催化剂外表面扩散到内表面
3. 反应物在催化剂表面活性中心上吸附
4. 吸附在活性中心的反应物进行化学反应
5. 产物在催化剂表面活性中心上脱附
子发生反应的原子,以符号σ表示。
➢吸附式可以表示为如下型式:
A+ σ → A σ ➢A-反应物, σ-活性中心, A σ-吸附
了反应物的活性中心
a
20
吸附率:
A
被 A组分覆盖的活性中心数 总活性中心数
如果有多种组分被吸附
,则有
,
B
,
C
,等等
D
空位率:
未被覆盖的活性中心数
V
总活性中心数
自然有 n I V 1 i1
r ra rd 0
k
a
0
exp
Ea RT
p
A
V
k
d
0
exp
Ed RT
A
平衡常数 K A :
KA
ka0 kd0
exp Ed Ea RT
a
11
助催化剂
➢本身不具活性或活性很小,但能改变 催化剂的部分性质
➢加入的量小,增加催化活性,增加选 择性,延长催化剂寿命
Example:合成氨的铁触媒里,常加入少 量铝和钾的氧化物,以使铁的催化活 性增大10倍,并延长寿命。
a
12
载体
➢以多孔物质为主,如硅藻土、三氧化二 铝等。
2-1气固相催化反应本证及动力学

吸附等温方程
动力学(理论)方程 实验室反应器
动力学方程 化学化工学院
[例1] 设一氧化碳与水蒸气在铁催化剂上的催化反应机理如下 (1) (2) (3)
化学工学院
1、过程为单组分反应物的化学吸附控制
设催化反应速率为rA 若催化反应过程为A的化学吸附所控制。A的化学吸附为控制 步骤,其它各步均已达到平衡。催化反应速率等于A的化学 吸附速率,则有 化学化工学院
将上述各参数代入
化学化工学院
化学化工学院
2、过程为表面化学反应控制
若反应中有惰性组分I,且组分I 被吸附。催化反应速率 按质量作用定律可表示为:
P A
设气体A在催化剂内表面上被吸附。 化学吸附是一个可逆过程,可表示为:
A ( )
A
A
ra
( A)
rd ra是吸附速率,rd是脱附速率,吸附 净速率为 r=ra-rd
化学化工学院
1.影响吸附速率
的因素
1)单位表面上的气体分子碰撞数 在单位时间内气体分子和表面的碰撞次数越多,被吸 附的可能越大。由气体分子运动论,碰撞次数Z为:
p
p
(1 )
m
t
化学化工学院
3. 孔径及其分布
催化剂中孔道的大小、形状和长度都是不均一的,催化剂孔道 半径可分成三类: 1)微孔,孔半径为1nm左右; 2)中孔,孔半径为1~25nm左右; 3)大孔,孔半径大于25nm的孔。 载体的作用是作为催化剂的骨架,同时提供催化剂的内表面积。
二者的区别:
化学化工学院
类别 项目
物理吸附 分子间力 差 可单层可多层 快 2-20kJ/mol
化学吸附 化学键力 好 单层 慢 80-400kJ/mol
气(液)固相反应动力学

v2
' CS CS
2
(式13-2)
D2
32
步骤3:界面化学反应
假设正、逆反应均为一级反应,则界面化学反应 的速率可表示为:
' v3 kCS kC(' D) S
' CS (k / k ) C(' D ) S v3 (式13-3) 1 k
或:
k+、k——分别为正反应和逆反应的速度常数; C(D)S——可溶性生成物(D)在反应区的浓度。
(2)推导过程思路:
对反应
aA( s ) bB( g ,l ) eE( s ) dD( g ,l ) 而言,由于内扩散控制
dm J 单位时间B的扩散量 故:单位时间A的反应量 dt dm dr1 2 4r1 dt dt
根据菲克第一定律求出在Cs = C0时
r0 r1 J 4 D2 C0 r0 r1
28
◆ 界面化学反应的基本步骤:
i) 扩散到A表面的B被A吸附 ii) 固相A转变为固相E
A + B = A· B A· B = E· D
iii) D在固体E上解吸
E· D=E+D
步骤i)、iii)称为吸附阶段;步骤ii)通称结晶化学反应阶段。 ◆ 结晶化学反应的自催化特征(图13-2)。
◇ 诱导期——反应只在固体表面上某些活性点进行,由于新相晶
33
步骤4:可溶性生成物(D)通过固膜的扩散 设可溶性生成物(D)在固膜中的浓度梯度为 常数,则D通过固膜的扩散速度为:
v( D ) 4
' C C( D ) S ' ( D)S D2 2
第二部分 多相催化反应基础-扩散过程

CA
CAg CAS CAC 距离
0
Rp
毛泽东 (1893-1976)
反应物从气流主体扩散到颗粒外表面是一个纯物理过程, 在球形颗粒外表面周围包有一层滞流边界层。反应物在气 流主体中的浓度由CAg通过边界层后递减到外表面上的浓度 CAS ,边界层中反应物的浓度梯度是常量,浓度差 CAg-CAS 就是外扩散过程的推动力 。 反应物由颗粒外表面向内部扩散时,同时就在内表面上进 行催化反应,消耗了反应物。越深入到颗粒内部,反应物 的浓度由于反应消耗而降低得越多;催化剂的活性越大, 向内部扩散的反应物的浓度降低得也越多。因此,催化剂 内部反应物的浓度梯度并非常量,在浓度-径向距离图上, 反应物的浓度分布是一曲线。产物由催化剂颗粒中心向外 表面扩散,浓度分布的趋势则与反应物相反。对于可逆反 应,催化剂颗粒中反应物可能的最小浓度是颗粒温度下的 平衡浓度CA* 。如果在距中心半径 Rd 处反应物的浓度接近 平衡浓度,此时,在半径 Rd 的颗粒内催化反应速率接近于 零,这部分区城称为“死区”。(球形颗粒自身的半径为RP)
以气-固相催化反应着手,分析多相催化反应的过程
Overall progression of heterogeneously catalysed reaction
Reaction steps 1. External film diffusion 2. Internal pore diffusion 3. Adsorption on active sites 4. Surface reaction to products 5. Desorption of products 6. Internal diffusion of products 7. External diffusion of products
气液固相反应动力学

• 气液固相反应动力学概述 • 气液相反应动力学 • 固相反应动力学 • 气液固三相反应动力学 • 气液固相反应动力学应用
01
气液固相反应动力学概述
定义与特点
定义
气液固相反应动力学是研究气液固三 相反应过程中反应速率和反应机制的 学科。
特点
气液固相反应通常涉及多相混合物, 反应过程复杂,影响因素众多,需要 深入研究和理解。
指导反应器设计
了解气液固相反应动力学有助于设计更高效的反应器,提高生产效 率和产品质量。
促进新工艺开发
通过研究气液固相反应动力学,可以发现新的反应路径和机理,促 进新工艺和技术的开发。
02
气液相反应动力学
液相传质过程
扩散
01
物质在液相中的传递主要依靠扩散作用,扩散速率取决于浓度
梯度、分子扩散系数和扩散路径长度。
太阳能利用
太阳能是一种清洁可再生的能源,气液固相反应动力学在太阳能利用领域中用于研究光催 化反应机理和光电转换效率,推动太阳能技术的进步。
核能利用
核能是一种高效能源,气液固相反应动力学在核能利用中用于研究放射性废物的处理和转 化,提高核能利用的安全性和效率。
THANKS
感谢观看
究土壤中污染物的迁移转化规律,为土壤修复技术提供理论依据。
03
废物资源化
通过气液固相反应动力学研究,实现废物的资源化利用,如废弃物的焚
烧、生物质能源转化等,降低环境污染,提高资源利用效率。
在能源领域的应用
燃料燃烧
燃烧是能源转化中的重要环节,气液固相反应动力学研究燃料在燃烧过程中的反应机理和 动力学参数,有助于提高燃烧效率,降低污染物排放。
对流
02
第五章气固相催化反应本征动力学
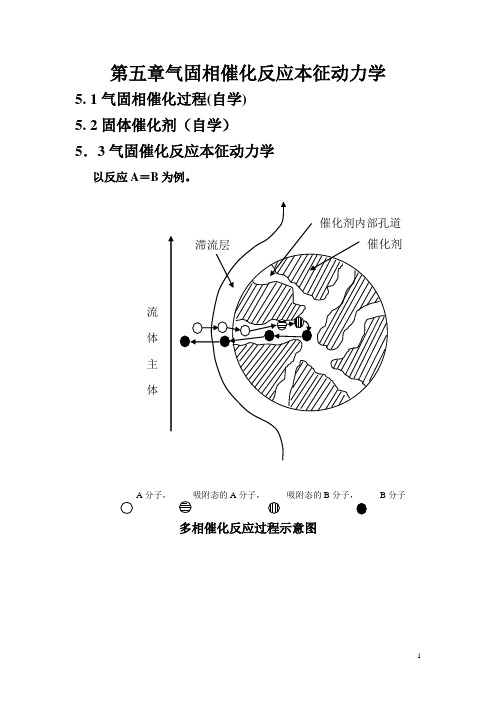
第五章气固相催化反应本征动力学5. 1气固相催化过程(自学) 5. 2固体催化剂(自学) 5.3气固催化反应本征动力学以反应A =B 为例。
A分子,A 分子, 吸附态的B 分子, B 分子多相催化反应过程示意图整个多相催化反应过程可概括为下列七个步骤组成:1、反应组分从流体主体扩散到固体催化剂的外表面(外扩散过程);2、反应物自催化剂外表面扩散到催化剂内部(内扩散过程);3、反应物在催化剂的表面上被吸附(吸附过程);4、吸附的反应物转换为吸附态的生成物(表面反应过程);5、生成物从催化剂的表面上脱附下来(脱附过程);6、脱附的产物分子由催化剂的孔道向外扩散到催化剂的外表面(内扩散过程);7、产物自催化剂的外表面扩散到流体主体(外扩散过程)。
什么是气固相催化反应本征动力学?气固相催化反应本征动力学由如下三步构成(不包括扩散的影响):1)吸附—气相分子在催化剂表面上化学吸附形成吸附络合物。
2)反应—吸附络合物之间相互反应生成产物络合物。
3)脱附—产物络合物由固体表面脱附出来。
5.3.1化学吸附与脱附目的—由吸附、脱附速率方程求出:1.θ~P的关系;2.如果其为控制步骤时就认为是本正动力学速率。
一、化学吸附速率的一般表达式A+Aσσ→θ①组分A的吸附率(活性中心覆盖率)A总的活性中心数覆盖的活性中心数被组分A A =θ 5.3—1②空位率V θ总的活性中心数心数气相分子覆盖的活性中未被 V =θ 5.3—2设i θ为i 组分的覆盖率,则有下式:1V i =θ+θ∑理论基础—表面质量作用定律:对如下的多相基元反应dD cC bB aA +=+吸吸反应速率r 与反应物的吸附量或覆盖度(吸附率)θ成正比,其覆盖度的指数等于相应的化学计量系数:bB a A k r θθ= 5.3—3表面质量作用定律是理想吸附催化反应动力学的基础,它在多相催化反应动力学中的地位相当于质量作用定律在均相反应动力学中的地位。
化学吸附为何可用表面质量作用定律?—化学吸附作用为化学键力,相当于基元化学反应过程,因此可用表面质量作用定律。
第五章气固相催化反应本征动力学

rd kd exp(h ) kd kd 0 f ( ) exp( Ed0 RT ) h RT
表观吸附速率为 r ra rd ka pA exp(g ) kd exp(h )
平衡时:ka kd
pA
exp[( g h) ]
令
K
A
ka kd
f hg
则
1 f
ln(K A pA )
焦姆金等温吸附方程
令
ka ka0 exp( Ea0 RT ) f ( )
活性 选择性 寿命
催化剂的性能
影响
物理性质: 比表面积; 孔容积; 孔容积分布。
1、比表面积:单位质量的催化剂具有的表面积Sg,m2/g; 影响催化剂的吸附量和活性。
!!!测定表面积的方法是:氮吸附法。
2、孔容积:每克催化剂内部微孔的容积Vg。cm3/g !!!测定孔容积较准确的方法是:氦-汞法。
非活化的,低活化能;活化的, 高活化能。>40kJ/mol
<8kJ/mol
>40kJ/mol
多分子层
单分子层
高度可逆
常不可逆
用于测定表面积、微孔尺寸
用于测定活化中心的面积及阐 明反应动力学规律
2、化学吸附速率的一般表达式
1)吸附方程:
A+σ→A σ
吸附率: A
被A组分覆盖的活性中心数 总的活性中心数
3)提高催化剂的机械强度。
4、催化剂活化:目的是除去吸附和沉积Байду номын сангаас外来杂质。
方法是:1)适度加热驱除易除去的外来杂质; 2)小心燃烧除去顽固杂质; 3)用氢气、硫化氢、一氧化碳或氯化烃作为活化剂
活化催化剂。
5、催化剂的开工和停工
催化作用基础第四章气固多相催化反应动力学基础(Word)

第四章气固多相催化反应动力学基础在这一章,我们将讨论气固多相催化反应动力学. 具体来说,是考察气固多相催化反应中是哪些因素影响以及如何影响反应速率的,反应的机理如何. 这里介绍的都是十分基础的理论。
研究气固多相反应动力学,从实用角度说,在于为工业催化过程确定最佳生产条件,为反应器的设计打基础;从理论上说,是为认识催化反应机理及催化剂的特性提供依据. 催化动力学参量不仅是机理证明的必要条件也是催化剂化学特性的重要量度.这些参量是现有催化剂改进以及新型催化剂设计的依据.比如,速率常数可用以比较催化剂的活性,活化能可用以判断活性中心的异同,指前因子可用以求取活性中心的数目,等等.这些都是化学动力学研究在催化理论上的价值体现.气固多相催化反应的完成包括以下步骤:反应物自气流的主体穿过催化剂颗粒外表面上的气膜扩散到催化剂颗粒外表面(外扩散);反应物自外表面向孔内表面扩散(内扩散);反应物在内表面上吸附形成表面物种(吸附);表面物种反应形成吸附态产物(表面反应);吸附态产物脱附,然后沿与上述相反的过程,直到进人气流主体.其中的吸附、脱附和表面反应为表面化学过程,而外扩散与孔内的扩散是传质过程.气固多相催化反应的动力学具有以下两个特点:反应是在催化剂表面上进行,所以反应速率与反应物的表面浓度或覆盖度有关.由于反应包括多个步骤,因而反应动力学就比较复杂,常常受吸附与脱附的影响,使得总反应动力学带有吸附或脱附动力学的特征.有时还会受到内扩散的影响.本章的前一部分讨论扩散很快,这时扩散对过程的总反应速率不产生影响,即反应速率由吸附、脱附和表面反应决定.本章的后一部分讨论传质对过程总速率有影响的情况.一、基 本 概 念(一) 反应速率1.反应速率定义.反应速率表示反应的快慢,是催化反应动力学研究中最重要的物理量,通常定义为参加反应的某种反应物或产物i 的量随反应时间的变化率,dtdn r i i Ω±=1 (4.1) 根据不同场合可以使用反应物消失速率或产物生成速率,dtdn r r r Ω-=1 或 dt dn r p p Ω=1 在r r 表示式里,负号保证速率的数值为正.速率式中Ω是反应空间,对于均相催化反应,Ω是反应体系的体积V .在使用固体催化剂的气固多相催化反应情况下,Ω可以是催化剂的体积V 、表面积S 或质量W .按上述定义表示反应速率时,必须指明与其相对应的反应物种. 因为在一个已知反应式中,各物种的反应速率也会因其化学计量系数不同而不同. 另外,还要注意,一个反应方程,如果它表示一个基元反应A B αβ→下式恒成立,B A r r βα11=但如果该反应方程仅表示一个总包反应,则上式不一定恒成立。
第五章第一节 气-固催化反应的本征动力学
i V 1
i
V Ki Pi V 1 i
则未覆盖率为:V 1 (1 Ki Pi )
i
2020年5月4日星期一
i 1
1 Ki Pi
(无解离时)
i
当被吸附的分子发生解离现象时
ka
A2 2 2A kd
吸附速率和脱附速率分别为:
a ka pA (1 A )2
d kd A
吸附平衡时: a d
2020年5月4日星期一
4)BET模型 对于物理吸附的情况:
p
1 (c 1) p
V ( p0 p) Vmc Vmcp0
式中:c为常数, p0为在该温度下吸附组分的饱和蒸汽压,
应用此式来测定参数。
2020年5月4日星期一
3、气-固催化反应动力学方程
反应:
A B R S
A的吸附:
A A
B的吸附:
K kRd K AB k Ra
2020年5月4日星期一
rA
K APA
k
PA PB PS
PR
/
K
KB PB
K AB
PA PB PS
KS PS
1
反应速率
动力学项 推动力
吸附项n
2020年5月4日星期一
2)幂数型的反应速率式
N2 3H 2 2NH3
合成氨的机理为:
N2 2 2N 控制步骤 H2 2 2H N H NH NH H NH2 NH2 H NH3 NH3 NH3
① 催化剂表面各处的吸附能力是均一的,即均匀表面 ② 被吸附分子间的作用力可略去不计(无作用力) ③ 单分子吸附 ④ 吸附的机理均相同。
2020年5月4日星期一
ka
A A kd
反应工程第二版 第四章气固相催化反应本征动力学

• 本章讨论化学动力学过程。
10
固体催化剂
• 固体催化剂由三部分组成,活性组分、 助剂和载体。
• 三者不能截然分开。 • 通常对活性组分的要求: • 具有尽可能高的催化活性,选择性和抗
毒性。 • 通常对载体的要求: • 高强度,高比表面。
化学吸附 强
可高于 沸点温度 接近反应热
19
化学吸附与脱附
• 化学吸附速率的表达
• 活性中心:固体催化剂表面能够与气相 分子发生反应的原子。以符号σ表示。
• 吸附式可以表示为如下型式:
•
A+ σ→A σ
• A-反应物, σ-活性中心, A σ-吸附
了反应物的活性中心
20
吸附率:
A
被A组分覆盖的活性中心数 总活性中心数
11
• 活性组分 • 以金属为主,根据不同的用途,有金属
氧化物及硫化物等等。 • 一个成功的催化剂往往是主催化剂和助
催化剂及载体的完美结合。 • 活性组分的选择,根据目前的知识水平
只能有一个大致的方向,尚不能预先选 择。
12
• 载体 • 以多孔物质为主,如硅藻土、三氧化二
铝等。 • 根据不同的需要,有不同的孔径和比表
26
对双组分吸附:
A组分
A
σ
kaA
Aσ
kdA
吸附速率
raA kaA pAV
脱附速率
rdA kdAA
表观速率:
B组分
B
σ
kaB
Bσ
kdB
吸附速率
raB kaB pBV
脱附速率
rdB kdBB
第四部分气固多相催化反应动力学基础教学课件

甲苯在掺碱金属K的V2O5/TiO2催化剂上氧化的补偿效应
K为电子助剂,降低反应活化能,但K吸附在V单层上,降低了活 性中心-表面V物种的浓度,从而降低了指前因子。
Compensation effect ln A Edes c
RT
A compensation effect can result from a number of sources such as • a heterogeneous surface that contains adsorption sites with a range of binding energies; • lateral interactions, in particular if they are strong enough to give rise to coverage dependent phase changes in the adsorbed layer; • Adsorbate-induced changes in the substrate structures.
A * A *
速控步骤 A * B k C *
总反应速率
C*C *
r kAPAPB 1 APA C PC
在低覆盖度时,APA C PC 1
则 r kAPAPB kapp PAPB
表观速率常数 kapp kA
d ln kapp d ln k d ln A
dT
dT dT
k是表面反应速率常数 k Aexp(E / RT)
2.2 实际吸附模型的反应速率方程
假定以反应有如下机理: A *A * A *B kC D * 速控步骤
根据表面质量作用定律 r kPB A
假定吸附热随覆盖度的变化是对数关系 q q0 ln
第四章 气固相催化反应本征动力学

气固催化反应过程
柱状(条形)二氧化硫 氧化催化剂
环状(条形)二氧化硫 氧化催化剂
Chemical Reaction Engineering of Hao
2
ECRE 第 四 章 气 固 相 催 化 反 应 本 征 动 力 学
2013-7-24
气固催化反应过程
• 在铁催化剂上合成氨的气固催 化反应
• N2 + 3H2 = 2NH3
ECRE 第 四 章 气 固 相 催 化 反 应 本 征 动 力 学
2013-7-24
非均相反应
体系 气固催化反应 液固催化反应 气液固催化反应 气固非催化反应 液固非催化反应 实例 合成氨、SO2 氧化、石油裂解、苯胺加氢、醋酸乙烯单体合成 固体酸碱催化的酯化、醚化反应、固体催化剂催化的环己烷氧化 油脂加氢反应、石油加氢脱金属、脱氮、脱硫过程、非均相湿式空气氧化 矿物焙烧、金属氧化、燃煤炉、天然气脱硫 磷矿浸取、湿法冶金、催化剂浸渍、材料刻蚀
2013-7-24
气固催化反应过程
c A f
哇!原来 是这样!
c A
联想粉笔, 活性碳
c A 0
Chemical Reaction Engineering of Hao
6
ECRE 第 四 章
气固相催化反应本征动力学
气 • 本征动力学—— 就是指在理想条件下化学反 固 应反应速率,即反应速率与反应物系组成、温 相 度、压力等因素之间的关系。但不包括物质、 催 热量传递过程反应速率的影响。 化 反 • 其研究的范畴包括:反应速率与其影响因素的 数学函数关系、催化剂的作用机理、反应机理 应 本 或反应过程。 征 动 力 学
• 示意图:一个电影院的入场过程,试问哪个门的阻力最
气液固界面上体系传质动力学的研究方法

气液固界面上体系传质动力学的研究方法气液固三相界面上存在着许多的复杂的传质动力学过程。
传质动力学是科学研究与生产技术中的重要内容之一,对于制造业、食品加工业、化工工业等不同领域的工业生产都有着非常重要的应用。
因此,研究气液固三相界面上传质动力学的研究方法和技术是十分值得深入探究的一个方向。
一、传质动力学基础1.浓度梯度传质的基本方法浓度是描述溶质在溶剂中的浓度的物理量,浓度梯度则是物质在溶质中浓度的不同差值。
由于浓度梯度,当两个相接触时,物质会向浓度较低的区域移动,这个过程称为浓度梯度传质。
2.分子扩散传质及其机理分子扩散传质是指物质在没有流体流动的情况下,由于浓度梯度粒子运动特性,不断向着低浓度的区域自发移动。
分子扩散传质的机理是基于自由分子的布朗运动,即在分子激烈、随机的跳动中,由于浓度的差异,分子会朝着低浓度方向漂移。
3.对流传质及其机理对流传质是由于运动的液体对物质的搬运作用而实现的。
其机理是离子或分子由于被带动而随流动的流体运动一同移动,同时扩散或游走。
二、气液固三相界面上传质机理气液固三相界面上传质机理复杂,其传质动力学的研究方法也因此多样化。
1.气液界面传质机理探析气液界面传质是指气体和液体在界面上的传质过程。
气液界面上有气体和液体相互作用的过程,一个物质从液体中通过界面分子扩散到气体中,液体被挥发,气体被吸附。
分子扩散面积越大,扩散速度越快,相同的面积扩散速度也决定了物质扩散的速度。
2.气体固体界面传质机理探析气体和固体之间的传质机制包括分子扩散、渗透、表面吸附等。
其中分子扩散是一种非常基本的传质方法,它通过漂移、扩散来实现质量传递。
渗透是液体和气体传质的重要机制,主要是液体分子通过固体障碍物、不规则的几何形状和大小分子孔洞隙等,弥散渗透离开。
3.液体固体界面传质机理探析在液体固体间的传质机理包括对流、分子扩散、溶解度和表面吸附等。
对流传质是指随着流体中液态液滴的漂流运动,污染物在液滴表面的分配变化,同时也会发生运动的揉捏等效应,随着扩散过程翻转,为一种先进的传质方法。
第二章 气固相催化反应宏观动力学-第四版

第二章气-固相催化反应宏观动力学气-固相催化反应步骤:1、扩散(外扩散、内扩散)2、吸附3、表面反应4、脱附5、扩散(内扩散、外扩散)第一节气-固相催化反应宏观过程2-1 气-固相催化反应过程中反应组分的浓度分布以球形催化剂为例:滞流层内扩散-物理过程滞流层内反应物浓度梯度为常量 As Ag C C --外扩散过程的推动力。
进行内扩散时,同时进行反应。
R ↑,反应量↑,反应物浓度↓ 活性↑,反应物浓度↓ 产物扩散过程与反应物相反。
2-2 内扩散有效因子与总体速率由于催化剂对反应物扩散程度不一样,反应物反应的量也不同,在催化剂内表面上的反应量一定小于按固体外表面计算的反应速度,二者之比称为内扩散有效因子或内表面利用率,或者有效因子。
内扩散有效因子定义解析式: ()()iAS s S A s S C f k dSC f k i⎰=ζ式中:s k -单位表面积计算的反应速率常数 A C -颗粒内反应物浓度 AS C -颗粒外表面上反应物浓度 i S -单位体积床层催化剂的内表面积 内扩散有效因子定义:率及内表面计算的反应速按反应组分外表面浓度梯度计算的扩散速率按反应组分外表面浓度=ζ稳定时:单位时间扩散到外表面的量=颗粒内的反应量 即:()()()ζAS i s AS Ag e g g A C f S k C C S k r =-= 上式即为外扩散在内的宏观动力学。
式中:()g A r -宏观反应速率 g k -外扩散传质系数e S -单位体积床层中的外表面积如一级反应:则()*A AS AS C C C f -=其中:*A C -平衡浓度则宏观动力学方程:()()()*A AS i s AS Ag e g g A C C S k C C S k r -=-=ζeg i s Ai s Ag e g AS S k S k C S k C S k C ++=ζζ*()()eg i s Ai s Ag e g Ag e g Ag i s e g g A S k S k C S k C S k C S k C S k S k r +--+=ζζζ*ζi s eg Ag Ag S k S k C C 11+-=稳定时,反应放热量=外表面传热量即()()()()()g S e S R AS i s R g A T T S H C f S k H r -=∆-=∆-αζ 式中:S α-气流主体与外表面间的给热系数 S T -外表面温度 g T -气流主体温度 2-3 催化反应控制阶段的判别 1、化学动力学控制 条件:(1)ζi s eg S k S k 11<<(2) 1→ζ内、外扩散的影响可忽略。
冶金原理气固反应动力学讲解

对反应 aA(s) bB(g,l) eE(s) dD(g,l) 而言,由于内扩散控制
故:单位时间A的反应量 dm 单位时间B的扩散量 J
dt
dm dt
4r12
dr1 dt
根据菲克第一定律求出在Cs = C0时
J
4 D2
r0r1 r0 r1
C0
两式相等,解方程得
(式13-12b)
2.问题分析
(1)方程式 1 (1 R)1的/3 适用k'范t 围
任何真理都有其一定的适用范围 从推导过程的“假设”知其适用范围为:
反应固相为单一、致密球体,其各方向上的化学性质一致; 反应剂浓度C0保持不变。 对非球体:
1 (1 R)1/Fp k't
三维尺寸不等时Fp 的取值介于 2和3之间
1-(1-R)1/3 1-(1-R)1/3
0
t
t
(3)应用
a. 指明提高反应率的途径
1 (1 R)1/3 kC0n t
r0
式中 kC0n t 项↑则(1- R)1/3↓ R↑
r0
故 时间t↑、C0↑、r0↓、提高温度使k↑,都有利于提高R
b. 利用不同温度下k值求反应的表观活化能
根据Arrhenius公式: lnk E B RT
形的致密颗粒,反应剂浓度不变、反应前后颗粒直径不变的情况下,
当属内扩散控制,则 直线通过原点。
1 2 R (1 R)与2/3反应时间t成直线关系, 3
表观活化能小,8~30kJ·mol-1
1-2/3R-(1-R)2/3
0
t
实例:黄铜矿的硫酸高铁浸出过程:
反应 2Fe2(SO4)3(aq) + CuFeS2(s) = CuSO4(aq) +5FeSO4(aq) + 2S(s)
第一章 气固相催化反应本征动力学..

法测分布)
平行孔模型: 平均孔半径
ra 2
vg
(1-44)
Sg
1-12
固体催化剂
三、催化剂的活化与钝化: *活化:在一定P、T下,用一定组成的气体对催化剂进行处
理,使其中以某种氧化物、氢氧化物、盐的形态存在的活
性组分得到还原或发生相变,而获得催化反应所必需的活 性组分和相组成的过程。 还原,硫化:如CO、Mo加H2脱S和耐S变换催化剂(氧化 物→硫化物)。
(1-38);
k v (均相反应);
S R ——单位反应体积的反应表面积,(或比反应表面积)
b
——单位反应体积中固体或固体催化剂 的质量(或堆密度)
1-9
反应速率常数及温度对反应速率 常数影响的异常现象
②k的单位与反应物系组成的表示方法有关: 对气相反应物系: k 、k k 、k 、cpfy
若为理想气体:
A A BB L L M M
若为均相反应:
kc kc (非基元反应) (1-32) k c
b | l m rA kcca c k A B ccLcM
rA k c c k c c
A B c A B
L M c L M
kc kc k c
(基元反应)
(1-36)
1-9
反应速率常数及温度对反应速率 常数影响的异常现象
E (1-37) k f (T ) k 0 exp( ) Rg T
Arrhenius经验方程:
讨论:
①k的单位与反应速率的表示方式有关:
k v k s S R kW b
k w(气固催化反应,气固非催化反应) ks 、
第三节
动力学方程
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三章 催化反应动力学
3.1多相催化反应过程
• 研究气固多相反应动力学,从实用的角度说, 为工业催化过程确定最佳生产条件,为反应器 的设计打基础 • 从理论上说,是为认识催化剂的特性提供依据, 因为催化剂的动力学参量是催化剂化学特性的 重要依据。这些参量是现有催化剂改进以及新 型催化剂设计的依据
•比如,速率常数可用以比较催化剂的活性,活化能 可用以判断活性中心的异同
7.动力学参数有那些
速率常数,反应级数,指前因子和活化能
第三章 催化反应动力学
本次课内容和要求
1.速率控制步骤 2.推导表面过程动力学方程时的两种方法 (平衡浓度法和稳定浓度法 3.化学反应、吸附和脱附为控制步骤的动力学方程
4.不存在控制步骤的动力学方程
5.两步机理模型
掌握速率控制步骤的内涵
要 求
第三章 催化反应动力学
3.3.1化学反应为控制步骤的动力学方程
因θA+θB +θR+θV=1 故θV=1/(1+kAPA+kBPB+kRPR)…………(5) 将(5)式代入(2),(3),(4)中有 θA=kAPA /(1+kAPA+kBPB+kRPR)………(6) θB=kBPB /(1+kAPA+kBPB+kRPR)………(7) θC=kRPR /(1+kAPA+kBPB+kRPR)………(8) 将(6),(7),(8)和(5)代入(1)式中简化有
第三章 催化反应动力学
第三章气固多相催化反应动力学基础
[教学难点]
1. 两步机理模型的两个假定,三个定理 2. 反应区间的识别
[主要内容]
1. 多相催化反应过程和表面质量作用定律 2. 化学反应,吸附和脱附为控制步骤的动力学方程 3. 两步机理模型的两个假定,三个定理 4. 外扩散和内扩散对反应动力学的影响 5. 外扩散和内扩散阻滞效应的识别
r= ks1 θAθB- ksθRθV………………(1)
其中ks1,ks—分别为表面反应的正,逆向反应速率常数 θv—未覆盖度,等于1-θA-θB-θR 其余三步达到平衡,所以有: kaAPAθV- kdA θAP A=0 或θA=kAPAθV………(2) kaBPBθV- kdB θB =0 或θB=kBPBθV………(3) kaRPRθV-kdRθR =0 或θR=kRPRθV…………(4) 式中kA=kaA/kdA,kB=kaB/kdB, kB=kaR/kdR
•有了速率控制步骤的假定,可以使速率方程的推导大大简化
第三章 催化反应动力学
3.3理想吸附层的速率方程
3.推导表面过程动力学方程时,通常有两种方法
平衡浓度法:由于存在速率控制步骤过程的总速 率取决于控制步骤过程的总速率取决于控制步骤 速率,而其它步骤处于平衡 稳定浓度法(定态法):当体系达到稳定状 态时,表面中间态物种浓度不随时间变化
催化原理II
多媒体讲义
第三章 气固多相催化反应动力学基础
第三章 催化反应动力学
第三章气固多相催化反应动力学基础
•多相催化反应过程 •表面质量作用定律 •表面过程动力学方程 •两步机理模型 •内外扩散对反应动力学的影响 •反应区间的识别
第三章 催化反应动力学
第三章气固多相催化反应动力学基础
[教学要求]
•动力学参数包括速率常数,反应级数,指前因子和 活化能等
第三章 催化反应动力学
提问
ngmuir方程, Temkin方程和 Freundlich方程分别对应的吸附能量与 覆盖度关系如何?
2.气固多相催化反应的完成一般包括几个步骤?
3.表面质量作用定律的内容 4.动力学参数有那些?
第三章 催化反应动力学
第三章 催化反应动力学
3.2表面质量作用定律
基元反应( elementary reaction):如果一个化学 反应,反应物分子在碰撞中相互直接作用直接转化 为生成物的分子 非基元反应亦称总包反应或简称总反应(overall reation),一个复杂反应要经过若干个基元反应 才能完成,这些基元反应代表了反应所经过的途 径,动力学上称为反应机理或反应历程(reation mechanism)
第三章 催化反应动力学
3.1多相催化反应过程
多相催化反应中的吸附、表面反应和脱附过程: 表面催化过程
第三章 催化反应动力学
3.1多相催化反应过程
气固多相催化反应的动力学具有以下两个特点: 1.反应是在催化剂表面上的单分子层内进行,所以 反应速率与反应物的表面浓度或覆盖度有关 2.由于反应的多阶段性,因而反应动力学就比较 复杂,尤其是受吸附与脱附的影响,常常使得总 反应动力学带有吸附或脱附动力学的特征
处理表面过程动力学的基础是表面质量作用定律 。由质量作用定律可知:表面过程的基元反应, 其反应速率 r与反应物的表面浓度(即覆盖率成正 比,其覆盖度指数等于相应的化学计量系数)
第三章 催化反应动力学
3.2表面质量作用定律
例如A与B之间的表面反应 aA +bB → 产物 其正向反应的速率表示为:(-r=kθAaθBb) 式中 k—正向反应速率常数 θ值在试验技术中还无法直接得到,为了得到θ值必 须借助于一定的模型和假设,最简单且最广泛的是 langmuir模型,利用langmuir方程把θ值表示为反应 压力,然后与实验数据关联。
第三章 催化反应动力学
3.2表面质量作用定律
经验证明基元反应的速率方程比较简单,即基元反 应速率与反应物浓度(带有相应的指数)的乘积成 正比,其中各浓度的指数就是反应式中各相应物质 的系数。基元反应的这个规律称为质量作用定律 (law of mass action) 由挪威化学家古德贝格和瓦格(Guldberg和 Weage)在前人试验的基础上提出的,“化学反应 速率与反应物的有效质量成正比”,
K为速率常数,α1、α2等为级数
第三章 催化反应动力学
3.3理想吸附层的速率方程
双曲线式方程有以下或类似的形式
此式描述的是SO2的氧化,其中A,B为常数,K为反应的平衡常数 基元过程一般服从Arrehnius定律 其中A为指前因子,E为活化能 •在总包反应情况下,总反应速率常数有时在形式上遵从 Arrehnius定律,此时所对应的E称为表观活化能,表观活 化能是否有具体的物理意义视情况而定
r=(kS1kAPAkAPB-kSkRPR)/ (1+kAPA+kBPB+kRPR)2
=K(PAPB -PR/Kp)/ (1+kAPA+kBPB+kRPR)2 ……….(9) 式中k为正反应速率常数,ห้องสมุดไป่ตู้于kS1kAkB,KP =kS1kAkB/kSkR为 该反应的平衡常数
第三章 催化反应动力学
3.3.1吸附为控制步骤的动力学方程
反应:Aσ + Bσ←→Rσ + σ 脱附:Rσ←→R +σ σ 为吸附位, Aσ , Bσ 和 Rσ 分别表示 A , B 和 R 的 吸附态。
第三章 催化反应动力学
3.3.1化学反应为控制步骤的动力学方程
当表面反应为控制步骤时,即第三步的反应速率等于整个 反应速率。将质量作用定律应用于三式所示表面反应即得:
第三章 催化反应动力学
3.3理想吸附层的速率方程
1.速率方程与动力学的参数
表示反应速率与作用物(包括反应物、产物及添加物) 分压(或浓度)关系的函数称速率方程,它可以写成
其中带有“,”的表示产物,带有“,,”表示添 加物 以上速率方程的微分形式的速率方程,微分形式的速率 方程又有幂式和双曲线式两种: 幂式速率方程形式:
第三章 催化反应动力学
3.3.2吸附为控制步骤的动力学方程
将(3)代入( 2)中可求得 θA= θRθV/ kSθB= kRPRθV/ kSkBPB….(4) 又因为θA+θB +θR+θV=1,将(3)和(4)代入得 θV=1/(1+kRPR/kSPBkB+kBPB+kRPR)……………(5) 将(4),(5)代入(1)中可得: r=kaAPAθV- kdAkRPR θV / kSPBkB =(kaAPA- kdAkRPR/ kSPBkB)/ (1+kRPR/kPPB+ kBPB+ kRPR) =kaA (PA- PR/kP PB)/ (1+kAPR/kPPB+ kBPB+ kRPR)
掌握由表面反应,吸附或脱附分别为速控步骤时的速率方程
掌握不存在控制步骤的动力学方程 掌握两步机理模型
第三章 催化反应动力学
3.3理想吸附层的速率方程
2.速率控制步骤
催化反应一般是由许多基元反应构成的连续过程,如果其总 速率由其中一步的速率决定,这一步就称为速率控制步骤
•速率控制步骤不一定是最慢的步骤,因为连续过程在 达到定态时各步的速率相等 •速率控制步骤的特性在于即使有充分的作用物质存 在,这步进行的速率也很慢,而其它步骤的反应在这 样的条件下则可以很高的速率进行 •速率控制步骤是阻力最大的一步 •从速率控制步骤的假设我们可进行进一步的推论,在定 态时速率控制步骤之外的其它各步都近似地处于平衡状态
第三章 催化反应动力学
3.3.3脱附为控制步骤的动力学方程
Rσ ←→ R +σ 反应速率为 r=kdRθR- kaRPRθV ………(4) 由于前三步达到平衡,因此将θA=kAPAθV及θB=kBPBθV 代入式θRθV/θAθB =KS中有 θR=KSkAkBPAPBθV 由于θA+θB +θR+θV=1,得 θV=1/(1+ kAPA+kBPB +kAkBPAPBθV) 将θR及θV 代入(1)得脱附为控制步骤时的反应速率方程 r=(kdRkAkBPAPBkS-kaRPR)/ (1+ kAPA+kBPB +kskAkBPAPB) =K(PAPB+PR/kP)/ (1+ kAPA+kBPB +kpkRPAPB) 式中K=kdR kAkBkS
