高中化学竞赛辅导课件 第四章 化学平衡
《化学平衡》人教版高二化学选修4PPT课件(第4课时)

一、化学平衡常数
(3)多重平衡规则:若干方程式相加(减),则总反应的平衡常数等于分步平衡 常数之乘积(商)
例 2NO (g) + O2 (g)
2NO2 (g)
K1
2NO2 (g)
N2O4 (g)
K2
2NO (g) +O2(g)
N2O4 (g)
K = K1 K2
一、化学平衡常数
3、平衡常数K的意义
0
平衡时浓度mol/L 698.6K
c(H2)
c(I2)
c(HI)
0.00183 0.003129 0.01767
2 0.01135 0.00904
0
0.00356
0.00125
0.01559
3 0.01134
4
0
0.00751 0
0 0.01069
0.00456 0.00114
0.000737 0.001141
2SO2(g)+O2
2SO3(g)
298K时K很大,但由于速度太慢,常温时,几乎不发生反应。
②平衡常数数值极小的反应,说明正反应在该条件下不可能进行,如:
N2+O2
2NO
K=10-30(298K)所以常温下用此反应固定氮气是不可能的。因此没有必要在该条件
下进行实验,以免浪费人力物力。或者改变条件使反应在新的条件下进行比较好一些。
QC > kc, 正 逆 未达平衡,逆向进行。
QC = kc, 正 逆 达平衡,平衡不移动。
QC < kc, 正 逆 未达平衡,正向进行。
一、化学平衡常数
(5)另外还有两点必须指出:
①平衡常数数值的大小,只能大致告诉我们一个可逆反应的正向反应所进行的最大
化学平衡第一课时选修四赛课课件课件

3.化学平衡的特征:
逆:可逆反应 等: V正= V逆 动: 动态平衡 V正= V逆 ≠ 0 定: 各组分含量(物质的量、 质量 、质量分数 、
体积分数、转化率等)一定
变: 当条件(温度、浓度、压强 等)改变时,
化学平衡可能改变
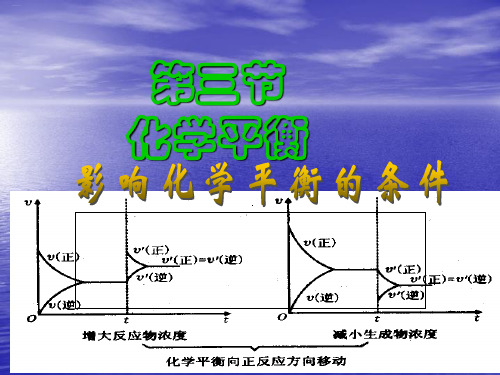
分析下面两个图像,分别在什么时间达 到了化学平衡状态?
化学平衡第一课时选修四赛课课件 课件
教学目标
1、通过对生活中的平衡及溶解平衡的理解 和迁移,使学生建立起化学平衡的概念,并 理解可逆反应。 2、通过对化学平衡概念的理解,归纳出一 个可逆反应达到平衡状态时的特征。 3、能用平衡状态的特征来判断可逆反应是 否达到平衡。
思考1:一定温度下,在100克水里加入 大量的蔗糖,蔗糖开始溶解,固体质量 会减少,等到一定程度时,固体的质量 再也不改变了,得到的溶液是什么溶液?
N2 +
消耗0.5nmol
3H2
2NH3
生成nmol
生成nmol
思考:单位时间内生成nmolN2同时生成(?) molNH3才表明达到平衡状态
二、化学平衡状态
在一定温度下,密闭容器中,发生反应
CO+H2O
CO2+H2,数据记录如下:
谢谢
某一物理量不变是否可作为 平衡已达到的标志,取决于该物 理量在平衡到达前是否发生变化。 若是(“变量”)则可;否则不行
三、化学反应平衡状态的判定
(二) “变量 ” 不变
该物理量在平衡到达 前是不断在变化的
三、化学反应平衡状态的判定
下面这些物理量到底哪些是“变量”呢?) 方法:未达平衡 (如在正向进行),这些量是否发生改变?
例2:在一定温度下容积一定的容器中,下列物
化学人教版高中选修4化学平衡优秀课件

v v正’ v正’= v逆’ v 平衡状态2
逆’
v正 v正= v逆 v逆 平衡状态1
t1
t2
t3
t4
t2:增大压强 t4:减小压强
t
mA(g) + nB(g) pC(g) + qD(g)
(1)m+n > p+q时 (2)m+n < p+q时 (3)m+n = p+q时
增大压强或减小压强时 平衡如何移动?新旧平 衡的速率大小比较。
下表中压强变化和NH3含量的关系,分析
压强对化学平衡的影响:
5 10 30
60
100
9.2 16.4 35.5 53.6 69.4
总结: mA(g) + nB(g)
pC(g) + qD(g)
若 m+n > p+q P↑ 平衡正向移动 新旧平衡比较:
CA ↑ 、 CB↑ 、 C↑C 、 ↑CD A的转化率↑ B的转化率 ↑ A% ↓ 、B%↓ 、C%↑ 、D↑%
讨论: 起始
N2 + 3H2 1 mol 3 mol
2NH3 (恒T、V) 达平衡状态1
③加入B,A的转化率减小 ④加入催化剂,气体总的物质的量不变
⑤加压使容器体积减小,A或B的浓度一定增大 ⑥若A的反应速率为vA,则B的反应速率vB=(n/m)vA A、①②④⑤ B、①②③⑤ C、①②③⑥ D、③④⑤⑥
压强
1
(MPa)
NH3 % 2.0
体积分数
N2(g)+3H2(g)
2NH3(g) ,试根据
故对化学平衡移动没有影响,只是能改变反应达平衡所需时间。
v
v正’= v逆’
《化学平衡教学》课件

在制药、石油化工、冶金等领域,化学平衡的计 03 算和分析对于工艺流程的优化和改进具有重要意
义。
环境保护中的应用
01 化学平衡在环境保护中发挥着重要作用,如大气 中温室气体的平衡、水体中污染物的平衡等。
02 通过研究污染物在环境中的化学反应和迁移转化 规律,可以预测和控制环境污染,制定有效的治 理措施。
THANKS
感谢观看
化学平衡的计算方法
平衡图解法
通过作图和观察图像,利用平衡 常数和温度的关系,求出平衡常
数和温度的关系。
代数法
通过建立化学平衡的代数方程组 ,求解未知数。
微分法
利用化学反应速率和浓度的关系 ,建立微分方程,求解未知数。
04
化学平衡的应用
工业生产中的应用
化学平衡在工业生产中有着广泛的应用,如化学 01 反应器的设计和优化、催化剂的选择和制备等。
的结构和功能研究等。
05
化学平衡的实验研究
实验目的与原理
实验目的
通过实验探究化学平衡的原理,加深对化学平衡概念的 理解。
实验原理
化学平衡是指在一定条件下,可逆反应的正逆反应速率 相等,反应物和生成物浓度不再发生变化的状态。实验 将通过具体反应来展示化学平衡的形成和特点。
实验步骤与操作
实验步骤 1. 准备实验器材和试剂,包括反应容器、温度计、搅拌器、可逆反应的试剂等。
《化学平衡教学》 ppt课件
目录
• 化学平衡的基本概念 • 化学平衡的原理 • 化学平衡的计算 • 化学平衡的应用 • 化学平衡的实验研究
01
化学平衡的基本概念
平衡的定义
人教版化学选修四化学平衡教学课件

(2)若按原反应物比例同倍数增大A和B的量,平衡右移, 达新平衡时:
①当a + b > c + d 时, A、B的转化率都增大
②当a + b < c + d 时, A、B的转化率都减小 ③当a + b = c + d 时, A、B的转化率都不变
人教版化学选修四化学平衡
人教版化学选修四化学平衡
2.特殊:反应物只有一种时,如:aA(g)
温度从T1上升到T2,由于吸增加得多,相应物质的浓度减少 得多,将使其速率减缓;而相反方向的物质浓度增加得多,将 使其速率增加,最终达到吸=放,建立新的平衡状态为止。
例. 对于达平衡的可逆反应
X+Y W+Z,增大压强则正、逆反应 速度(v)的变化如上图,分析可知X,Y, Z,W的聚集状态是
(A)Z,W为气体,X,Y中之一为气体
人教版化学选修四化学平衡
人教版化学选修四化学平衡
例3:图中表示外界条件(T、P)的变化对下列
反应的影响:L(s)+G(g) 2R(g),
△H﹥0,y 轴表示的是( B )
(A) 平衡时,混合气中R的百分含量 (B) 平衡时,混合气中G的百分含量 (C) G的转化率 (D) L的转化率
人教版化学选修四化学平衡
PCl5
①
2.T、V 2mol
减压
T、2V 2mol
PCl5
PCl5
平衡态 ③
T、V
加压
平衡态 ② T、2V
人教版化学选修四化学平衡
人教版化学选修四化学平衡
练习1:在一密闭容器中,用等物质的量的A和B发生如下反应:
A(g) +2B(g) 2C(g) ,反应达到平衡时,若混和气体中A和B
高中化学竞赛辅导课件-第四章-化学平衡

反应商判据:
J<K J=K J>K
反应正向进行; 系统处于平衡状态; 反应逆向进行。
4.2.3 计算平衡的组成
例题:已知反应CO(g)+Cl2(g) COCl2(g) 在恒温恒容条件下进行,373K时K =1.5108。
反应开始时c0(CO)=0.0350mol·L-1, c0(Cl2)=0.0270mol·L-1, c0(COCl2)=0。计算 373K反应达到平衡时各物种的分压和CO的 平衡转化率。
p(W2O6)=100.0
kPa
-
98.0 2
kPa=51.0
kPa
K
[
[ pGeWO4 / p ]2 pGeO/ p ]2[ pW2O6 /
p
]
2.0
98.0 1002
1002 51.0
100
4.
7103
平衡转化率:
def
B
n0
B neq n0 B
B
例如:
GeO 100.0 2.0kPa 100% 98%
平衡Ⅱ 0.300-
1.00×10-2 × 1.00×10-3+
cB/(mol·L-1) 1.00×10-2α2 (1- α2)
1.00×10-2 α2
3.2
1.0010-3 1.00 10-22
(0.300 1.0010-22 )[1.0010-2 (12 )]
2 43%
2 (Ag ) 1(Ag )
②对恒温恒容下已达到平衡的反应,引入 惰性气体,反应物和生成物pB不变,J= K , 平衡不移动。
③对恒温恒压下已达到平衡的反应,引 入惰性气体,总压不变,体积增大,反应物
和生成物分压减小,如果Σ n B ≠0,平衡向
《化学平衡》人教版高二化学选修4PPT课件(第1课时)

CrO42-(黄色)+2H+
取两支试管各加入5 mL 0.1 mol/L K2Cr2O7溶液,然后按下表步骤操作,观察 并记录溶液颜色的变化。
滴加5~15滴浓硫酸
滴加5~15滴6 mol/LNaOH溶液
K2Cr2O7溶液
溶液橙色加深
溶液黄色加深
回顾:影响化学反应速率的外界条件主要有哪些?
滴加浓硫酸
如果a + b = c + d ,在其它条件不变的情况下,改变压强,v正和v逆等倍增加,
对化学平衡移动无影响。
提醒:若没有特殊说明,压强的改变就默认为改变容器容积的方法来实现,如增大压强,就默认 为压缩气体体积使压强增大。
实践验证:
450℃时N2与H2反应生成NH3的实验数据
N2 (g) + 3H2 (g)
达到平衡的标志是 ( AC )
2C(g)
A. C的生成速率与C分解的速率相等
B. 单位时间内生成nmolA,同时生成3nmolB
C. A、B、C的浓度不再变化
D. A、B、C的分子数比为1:3:2
典型例题
例3 已知在一密闭容器中进行反应:2SO2(g)+O2(g) 2SO3(g),反应过程 中某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L、0.1 mol/L、0.2 mol/L, 当反应达到平衡时,可能存在的数据是( )
第1课时 化学平衡状态
人教版高中化学选修4(高二)
第二章 化学反应速率和化学平衡
第3节 化学平衡
MENTAL HEALTH COUNSELING PPT
第2课时 化学平衡的移动
学习目标
(1)理解掌握化学平衡移动的概念; (2)了解化学平衡移动的影响因素; (3)能够画出简单的化学平衡移动的图形
人教版化学选修四《化学平衡》教学课件
1L T0
等效平衡
相同条件下,同一可逆
反应体系,不管从正反应开 始,还是从逆反应开始,达 到平衡时,任何相同物质的 含量(体积分数、质量分数或 物质的量分数)都相同的化学 平衡互称等效平衡。
化学平衡状态的建立
T、V不变 2SO2+O2
SO2 2mol O2 1mol SO3 0mol
意义:增大成本较低的反应物的浓度,
提高成本较高的原料的转化率。
人教版化学选修四《化学平衡》
人教版化学选修四《化学平衡》
练习
已知在氨水中存在下列平衡:
NH3 + H2O
NH3·H2O
NH4+ + OH-
(1)、向氨水中加入MgCl2固体,平衡向正反应方向移动,
OH-浓度 减小
,NH4+浓度 增大
。
(2)、向氨水中加入浓盐酸,平衡向 正反应方向 移动, 此时溶液中浓度减小的粒子有OH-、NH3·H2O、。NH3
A.加压混和气体颜色先深后浅;
B.减压混和气体颜色先浅后深。
压强对化学平衡的影响
[讨论]
2NO2(气)
(2体积,红棕色)
N2O4(气)
(1体积,无色)
A:当加压气体体积缩小时,混和气体颜 色先变深是由于① NO2浓度增大 ,后又
逐渐变浅是由于 ②平衡向正反应方向移动;
B:当减压气体体积增大时,混和气体颜
色先变浅是由于① NO2浓度减小
,
后又逐渐变深是由于平衡向逆反应方向移动。
aA(g)+bB(g)
图象观察
cC(g)
[结论]在其它条件不变的情况下: A:增大压强,会使化学平衡向着气体
体积缩小的方向移动; B:减小压强,会使化学平衡向着气体
高一化学竞赛辅导 吉布斯自由能和化学平衡

高一化学竞赛辅导 吉布斯自由能和化学平衡1.化学反应的方向性自然界发生的一切过程都必须遵循热力学第一定律,保持能量守恒。
但在不违背热力学第一定律的前提下,过程是否发生,若能发生的话,将又会进行到什么程度,热力学第一定律却不能回答。
本章从系统能量变化的角度讨论化学反应的方向性。
1.1 自发过程在一定条件下不需要外界对系统作功就能自动进行的过程或反应称为自发过程或自发反应。
相反,它们的逆过程或逆反应是非自发的。
焓变不能作为化学反应自发性的判据。
1.2 吉布斯自由能(1) 吉布斯自由能及自发过程的判据依据反应自发性与焓、熵及温度间的关系,物理化学家吉布斯(G ibb s J W )提出了一个新的状态函数G ,它具有广度性质,称为吉布斯自由能,其定义为:G =H –TS (1-1)在等温过程中,吉布斯自由能变为:ΔG =ΔH –T ΔS (1-2)称为吉布斯–亥姆霍兹(Gibb s -HelmholTz )方程。
将此式应用于化学反应,得到:m r G ∆=m r H ∆–T m r S ∆ (1-3)若反应在标准状态下进行,则:θmr G ∆= θm r H ∆–T θm r S ∆ (1-4) m r G ∆和θmr G ∆分别称为化学反应的摩尔吉布斯自由能(变)和标准摩尔吉布斯自由能(变),两者的值均与反应式的写法有关,SI 单位为J·mol -1或kJ·mol -1。
在等温定压且系统不做非体积功条件下发生的过程,若: ΔG <0 发生的过程能自发进行; ΔG =0 系统处于平衡状态; ΔG >0 过程不能自发进行。
化学反应大部分在等温定压且系统不做非体积功的条件下进行,则: Δr G m <0 化学反应过程自发进行;Δr G m =0 化学反应系统处于平衡状态,过程宏观停止,达到化学反应的限度; Δr G m >0 化学反应过程不可能自发进行,其逆过程自发。
人教化学选修4化学平衡PPT(19页)

cm ( A) • cn (B)
【思考】平衡浓度的单位是mol·L-1,请问平衡常数K有 没有单位?
3.平衡常数的单位 ∵浓度的单位为mol·L-1 ∴K的单位为(mol·L-1)n;n=p+q-m-n
人教化学选修4化学平衡PPT(19页)
Ag+( aq)+Cl-(aq)
⑥ Cr2072-(aq)+H20 Cr042-(aq)+2H+(aq)
人教化学选修4化学平衡PPT(19页)
人教化学选修4化学平衡PPT(19页)
【思考与交流】
(1)比较①和②,分析平衡常数表达式的 书写与哪些因素有关?
(2)比较②和③,分析正、逆反应的平衡 常数之间的关系
起始时浓度mol/L
c (H2)
c(I2) c (HI)
0.0119 0.00694 0 74
平衡时浓度mol/L
c[H2]
c[I2]
c[HI]
0.00561 0.000593 0.0127
7
6
0
平衡时
c2 (HI)
c(H2) ·c(I2)
48.38
0.0122 0.00996 84
0 0.00384 0.001524 0.0168 48.61
人教化学选修4化学平衡PPT(19页)
【练习】请写出下表中各反应的平衡常数表达式并
回答问题
反应
Kc 单位
① 1/2N2(g)+3/2H2(g)
NH3(g)
② N2(g)+3H2(g)
2NH3(g)
③ 2NH3(g)
N2(g)+3H2(g)
人教版化学《化学平衡》优质课件

I. 混合气体平均相对分子质量保持不变
J. SO3的体积百分含量不随时间变化
人教版高中化学选修四2.3《化学平衡 》经典 课件
人教版高中化学选修四2.3《化学平衡 》经典 课件
思考:在一定温度下,在一恒容密闭容器中,进行下
列可逆反应: 2SO2 + O2
2SO3(g),
下列能说明反应已达平衡的事实是( DFGIJ )
一、化学平衡状态定义:
化学平衡状态,就是指在一定条件下的可逆 反应里,正反应速率和逆反应速率相等,反 应混合物中各组分的浓度保持不变的状态。
前提条件:可逆反应
强 调 实质:正反应速率=逆反应速率 三 点
一、化学平衡状态定义:
化学平衡状态,就是指在一定条件下的可逆 反应里,正反应速率和逆反应速率相等,反 应混合物中各组分的浓度保持不变的状态。
和0.01mol H2O(g),CO+H2O
CO2+H2
正反应速率逐渐减小,逆反应速率 逐渐增大,进行到一定程度,正反应
速率和逆反应速率的大小不再变化, 且正反应速率=逆反应速率。
人教版高中化学选修四2.3《化学平衡 》经典 课件
人教版高中化学选修四2.3《化学平衡 》经典 课件
速 率
人教版高中化学选修四2.3《化学平衡 》经典 课件
前提条件:可逆反应
强 调 实质:正反应速率=逆反应速率 三 点 标志:反应混合物中各组分的
浓度保持不变的状态
二、化学平衡状态的特征
二、化学平衡状态的特征 人教版高中化学选修四2.3《化学平衡》经典课件
(1)逆:研究的对象是可逆反应 (2)等:正反应速率=逆反应速率 (3)动:动态平衡(正逆反应仍在进行) (4)定:反应混合物中各组分的浓度保
化学平衡人教版高中化学选修四教学课件

化学平衡课件人教版高中化学选修四
速率-时间关系图: aA(g)+bB(g)
cC(g)
化学平衡课件人教版高中化学选修四
化学平衡课件人教版高中化学选修四
1. 在密闭容器中,反应:xA(g)+yB(g)
zC(g),在一定条
件下达到平衡状态,试回答下列问题:
(1)若x+y>z,缩小体积,增大压强,则平衡向_正__反__应___方向
4. 化学平衡常数的意义——定量地衡量化学反应进行的程度 (1) K值越大,表示反应进行的程度越大,反应物转化率也越大。 (2) 一般当K>105时,该反应进行得基本完全。
5. 平衡常数表达式与方程式的关系
(1) 化学平衡常数表达式中各物质的浓度必须是平衡时的浓度,
且不出现固体或纯液体的浓度。
(2) K表达式与化学方程式书写形式有关
化学平衡课件人教版高中化学选修四
化学平衡课件人教版高中化学选修四
2. 压强对化学平衡移动的影响
aA(g)+bB(g)
cC(g)+dD(g)
a+b≠c+d
对于反应前后气体体积发生变化的化学反应,在其他条件不变时: (1)增大压强,化学平衡向气体体积减小的方向移动。 (2)减小压强,化学平衡向气体体积增大的方向移动。
v'正 =v'逆
化学平衡课件人教版高中化学选修四
化学平衡课件人教版高中化学选修四
5. 勒夏特列原理
如果改变影响平衡的一个条件(如:浓度、压强或温度 等)平衡将向着能够减弱这种改变的方向移动。 ① 原理的适用范围:已达平衡的可逆反应。 ② 勒夏特列原理只适用于判断“改变影响平衡的一个条件”时 平衡移动的方向。若同时改变影响平衡移动的几个条件,则 不能简单地根据勒夏特列原理来判断平衡移动的方向,只有 在改变的条件对平衡移动的方向影响一致时,才能根据勒夏 特列原理进行判断。 ③ 化学平衡只能削弱外界条件的改变,而不能完全抵消这种 改变。
2021届高中化学竞赛理论辅导课件-物理化学(入门)04化学平衡

§4.1 反应的等温方程和平衡常数
4.亲和势(affinity)
1922年,比利时热力学专家德唐德(De donder)首先引进了化学 反应亲和势的概念。他定义化学亲和势A为
A
def
(
G
)T
,
p
B
BB
A是状态函数,体系的强度性质。 用A判断化学反应的方向具有“势”的性质,即:
rGm
G
T ,P
BB
2020年9月20日
§4.1 反应的等温方程和平衡常数
公式理解:
• 在一个无限量的体系内,体系的发生一个mol变化引起G的变化
• 在一个有限量的体系内,体系发生一个微小变化d ,引起体系发
生一个dG的变化。
对rGm 的理解: 1)量纲:J.mol-1 2) 强度性质,与体系的物质的量无关 3)对同一化学反应来讲,其具体值与计量方程式写法有关 4)随着反应的进行,由于浓度发生变化,则B发生变化,引起变化,
dD + eE +…. gG + hH
+……
rGm
rGm
(T )
RT
ln
( (
fG fD
/ /
p p
)g ( fH / p )d ( fE / p
)h )e
rGm (T ) RT ln Qf
逸度商
(
fG
g
)
(
fH
)h
Q = p
p
f ( fD )d ( fE )e
p
p
2020年9月20日
§4.1 反应的等温方程和平衡常数
2020年9月20日
§4.1 反应的等温方程和平衡常数
化学选修4《化学平衡》化学平衡图像PPT课件

T2P2 T1P2 T1P1
t •m+n<p+q •时间-温度 (或压强)图像
解法精要:“先拐先平,数值大” 在化学平衡图象中,先出现拐点的
反应则先达到平衡,先出现拐点的曲线表 示的温度较高或表示的压强较大。
可编辑课件
14
练习:对于反应
mA (g) + nB (g) pC (g) 有如
•对于反应mA(g)+nB(g) pC(g)+qD(g)
A
B
的
的
转
T1
转
P1
化 率
T2
化 率
P2
A% •正反应吸热
t
t
•m+n<p+q
C%
T1 T2
P1
P2
t
t
•正反应放热
•m+n=p+q
可编辑课件
12
三、某物质的转化率(或百分含量)-时间温度(或压强)图:
例:对于反应mA(g)+nB(g)
B%
pC(g)+qD(g)
可编辑课件
3
一、浓度 - 时间图:
例: c
练: c 0.4 0.3 0.2 0.1
可用于:
看起点和终
1)写出化学反应方程式: 点:分清反
C A
A+2B 3C 2)求反应物的转化率:
应物和生成 物,浓度
B
A的转化率=33.3%
B的转化率=66.7% t
(或物质的 量)减小的
B 12))写求5A出反化应学物3反的B+应转2C方化程率式::是 增 成反 大 物应 的 ,物 是 生, 生 成
v
v正
人教版高中化学选修四 化学平衡 PPT课件

化学平衡的移动
复习:化学平衡的含义
【复习】化学平衡状态的定义: 一定条件下,可逆反应里,正反应速率和逆反应速率相 等,反应混合物中各组分的浓度保持不变的状态。
❖化学平衡的特征: 逆 ——可逆反应(或可逆过程) 等 ——V正 =V逆(不同的平衡对应不同的速率) 动 ——动态平衡。达平衡后,正逆反应仍在进行(V正=V逆≠0) 定 ——平衡时,各组分浓度、含量保持不变(恒定)
温度对化学平衡的影响
• 演示实验
2NO2(g)
(红棕色)
N2O4(g);△H=-57kJ/mol
(无色)
现象: 混和气体受热颜色变深;遇冷颜色变浅。
温度对化学平衡的影响
2NO2(g)
(红棕色)
N2O4(g);△H=-57kJ/mol
(无色)
[讨论]A:混和气体受热颜色变深,说明 ①平衡向逆反应方向移动 ;② NO2浓度增大。
B:混和气体遇冷颜色变浅,说明 ① 平衡向正反应方向移动 ;②NO2浓度减小。
温度对化学平衡的影响
[思考]画出升温对平衡影响的V-t图像
V逆’
V正’= V逆’
V正
平衡状态Ⅱ
V正’
V正= V逆
平衡状态Ⅰ
V逆
0
t1
t2
t3
升温对化学平衡的影响
2、温度对化学平衡的影响
反应原理:2NO2(g) 红棕色
N2O4(g()正反应为放热反应) 无色
C. P3 > P4 , Y轴表示 混合气体密度 D. P3 > P4 , Y轴表示 混合气体平均分子量
C%
C%
T2 P2 T1 P2
p4 p3
T1 P1
0
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
p(COCl2) / p K = [ p(CO) / p ][ p(Cl2 ) / p
]
=
24.8 + x x 100 100
(83.7 − x ) / 100
= 1.5 × 10
8
因为K 很大,x很小, 假设 83.7-x ≈ 83.7, 24.8+x ≈24.8 。 83 .7 × 100 = 1 . 5 × 10 8 x = 2 . 3 × 10 − 6 24 . 8 x 平衡时:p(CO)=24.8kPa ,p(Cl2)=2.3 ×10-6 kPa p(COCl2)=83.7kPa p 0 (CO ) − p eq (CO ) α (CO ) = p 0 (CO )
第四章 化学平衡 熵和Gibbs函数
§4.1 标准平衡常数 §4.2 标准平衡常数的应用 §4.3 化学平衡的移动 §4.4 自发变化和熵 §4.5 Gibbs函数 函数
§4.1 标准平衡常数
4.1.1 4.1.2 4.1.3 化学平衡的基本特征 标准平衡常数表达式 平衡常数与 反应速率系数的关系 标准平衡常数的实验测定
[ p ( HI ) / p ] 2 K1 = [ p ( H 2 ) / p ][ p ( I 2 ) / p ]
1 H 2 1 I 2 (g) 2 (g) + 2 HI(g)
K2
[ p (HI) / p ] = (K 1 )1/2 K2= [ p (H 2 ) / p ]1/ 2 [ p (I 2 ) / p ]1/ 2
Fe3+(aq) +Ag(s)
1.00×10-3+ 1.00×10-2 α2
1.00 × 10 -3 + 1.00 × 10 -2 α 2 3 .2 = (0.300 − 1.00 × 10 - 2 α 2 )[1.00 × 10 - 2 (1 − α 2 )]
α 2 = 43% + + α 2 (Ag ) > α 1 (Ag )
98 . 0 平衡pB/kPa 100.0-98.0 100.02
p(GeO)=100.0 kPa - 98.0 kPa =2.0kPa
98 . 0 p(W2O6)=100.0 kPa kPa=51.0 kPa 2
[ p (GeWO 4 ) / p ] K = [ p (GeO ) / p ] 2 [ p (W 2 O 6 ) / p ]
对于溶液中的反应: Sn2+(aq)+2Fe3+(aq) Sn4+ (aq)+2Fe2+(aq)
[ c ( Sn K = [ c ( Sn
4+
/c 2+ /c
)][ c ( Fe /c 3+ )][ c ( Fe /c
2+
)] 2 )]
2
对于一般的化学反应:
aA(g)+ bB(aq)+ cC(s)
2
(98.0 100) 3 = = 4.7 ×10 2 (2.0 100) (51.0 100)
2
平衡转化率:
α (B) =
例如:
def
n0 (B) − neq (B) n0 (B)
(100.0 − 2.0)kPa × 100% = 98% α (GeO) =
100.0kPa
α (W2 O 6
(100.0 − 51.0)kPa × 100% = 49% )=
解:(1)计算反应商,判断反应方向 c ( Fe 3 + ) / c J = [ c ( Fe 2 + ) / c ][ c ( Ag + ) / c
1.00 × 10 −3 = 1.00 = −2 0.100 × 1.00 × 10
]
J<K , 反应正向进行。 (2) Fe2+(aq)+Ag+(aq)
化学平衡的移动:当外界条件改变时, 化学反应从一种平衡状态转变到另一种平 衡状态的过程。 对于溶液中的化学反应,平衡时,J = K 当c(反应物)增大或c(生成物)减小时, J < K 平衡向正向移动。
当c(反应物)减小或c(生成物)增大时, J > K 平衡向逆向移动。
例题:25oC时,反应 Fe2+(aq)+ Ag+(aq) Fe3+(aq) +Ag(s) 的K =3.2。 (1)当c(Ag+)=1.00 ×10-2mol·L-1, c(Fe2+)=0.100 mol·L-1, c(Fe3+)= 1.00 ×10-3mol·L-1时反应向哪 一方向进行? (2)平衡时, Ag+ ,Fe2+,Fe3+的浓度各为多少? (3) Ag+ 的转化率为多少? (4)如果保持Ag+ ,Fe3+的初始浓度不变,使c(Fe2+) 增大至0.300 mol·L-1,求Ag+ 的转化率。
K 3 = K 1 · K 2 = 0.45×0.051=0.023
4.1.3
平衡常数与 反应速率系数的关系
k (正 ) = k (逆 )
Kc
Ea(正)- Ea(逆) = exp − RT
∆r H m = exp − RT
Van’t Hoff 方程式:
K ln K
1.00×10-2 -x
Fe3+(al·L-1) 0.100 变化cB/(mol·L-1) -x
平衡cB/(mol·L-1) 0.100-x 1.00×10-2-x 1.00×10-3+x
K
=
[ c ( Fe
2+
c ( Fe ) / c ) / c ][ c ( Ag
反应商: 对于一般的化学反应: aA (g)+ bB(aq)+cC(s) 任意状态下: xX(g)+yY(aq)+zZ(l)
[ p i ( X) / p J = [ p i (A ) / p
def
] [ c i (Y ) / c ] a [ c i (B ) / c
x
] ]b
y
反应商判据: J<K J=K J>K 反应正向进行; 系统处于平衡状态; 反应逆向进行。
K
xX(g)+ yY(aq)+ zZ(l)
[ p(X ) / p ]x [c(Y ) / c ]y = [ p(A ) / p ]a [c(B) / c ]b
∗ K 是温度的函数,与浓度、分压无关。 ∗ 标准平衡常数表达式必须与化学反应计 量式相对应。
H2 (g) + I2 (g)
2HI(g)
K1
4.1.4
4.1.1
c / mol ⋅ L
−1
化学平衡的基本特征
υ 正 × 10
7.60 1.20 0.345
6
大多数化学反应都是可逆的。例如:
t/s 0
H2 (g) + I 2 (g)
0.0100
2HI(g)
0
mol ⋅ L ⋅ s
−1
υ 逆 × 10 7
−1
0.0100
0 2.04 3.43
2000 0.00397 0.00397 0.0121 4850 0.00213 0.00213 0.0157
反应开始 :c(H2),c(I2) 较大, c(HI) = 0, υ 正较大,υ逆为 0;反应进行:c(H2),c(I2)减小, υ 正减小,c(HI)增大,υ逆增大;某一时刻:υ正= υ 逆,系统组成不变,达到平衡状态。
υ正
υ逆
υ正 = υ逆
H2 (g) + I 2 (g)
0.02
2HI(g)
0.01
2 1
∆ rH = R
2 1
m
1 1 − T1 T2 1 1 − T1 T2
K 或 lg K
∆ rH m = 2 . 303 R
4.1.4
标准平衡常数的实验测定
例题:恒温恒容下,GeO(g)与W2O6 (g) 反 应生成GeWO4 (g) : 2GeO (g) +W2O6 (g) 2 GeWO4 (g)
说明平衡向右移动。
4.3.2 压力对化学平衡的影响
1.部分物种分压的变化 如果保持温度、体积不变,增大反应 物的分压或减小生成物的分压,使J减小, 导致J<K ,平衡向正向移动。反之,减小 反应物的分压或增大生成物的分压,使J增 大,导致J> K ,平衡向逆向移动。
2.体积改变引起压力的变化 对于有气体参与的化学反应 aA (g) + bB(g)
100.0kPa
§4.2 标准平衡常数的应用
4.2.1 判断反应的程度 4.2.2 预测反应的方向 4.2.3 计算平衡的组成
4.2.1 判断反应的程度
K 愈大,反应进行得愈完全; K 愈小,反应进行得愈不完全; K 不太大也不太小(如 10-3< K <103), 反应物部分地转化为生成物。
4.2.2 预测反应的方向
2HI(g) H2 (g) + I2 (g)
K3
[ p ( H 2 ) / p ][ p ( I 2 ) / p ] K3= =(K 1 )-1 2 [ p ( HI ) / p ]
多重平衡原理 例题:已知25℃时反应 ①2BrCl(g) Cl2(g)+Br2(g)的 K 1 =0.45 ②I2(g)+Br2(g) 2IBr(g)的 K 2 =0.051 计算反应 ③2BrCl (g)+ I2(g) 2IBr(g)+ Cl2(g)的 K 3 。 解:反应① + ②得: 2BrCl (g)+ I2(g) 2IBr(g)+ Cl2(g)
