医疗设备不良事件报告表
医院医疗安全不良事件报告表(最新版)

添加 标题
添加 标题
添加 标题
添加 标题
添加 标题
建立完善的安全管理制 加强医护人员的安全培 定期进行安全检查和隐 加强患者安全管理,提 建立有效的应急处理机
度和流程
训和教育
患排查
高患者安全意识 制,及时处理医疗安全
不良事件
建立风险评估与预警机制
定期进行风险评估, 识别潜在的医疗安全
风险
建立预警机制,及时 发现和处理医疗安全
良事件,减少其对患者 和医院的影响。
强化医疗设备维护与管理
建立医疗设备使用和维护 的规章制度,确保设备使 用规范
加强医疗设备操作人员的 培训,提高操作技能和维
护意识
定期检查和维护医疗设备, 确保其正常运行
建立医疗设备故障报告和 处理机制,及时处理设备
故障,减少安全隐患
05 医疗安全不良事件预防措施
医院医疗安全不良 事件报告表
汇报人:
目录
01
医疗安全不 良事件概述
02
医疗安全不 良事件报告 表设计
03
医疗安全不 良事件案例 分析
04
医疗安全不 良事件应对 策略
05
医疗安全不 良事件预防 措施
06
医疗安全不 良事件未来 展望
01 医疗安全不良事件概述
医疗安全不良事件:指在 医疗过程中发生的,对患 者造成伤害或潜在伤害的 事件。
加强医疗安全培训,提高医护人员安全意识 完善医疗安全制度,建立有效的风险防范机 制 加强医疗安全监管,确保医疗安全事件的及 时处理
推广医疗安全新技术,提高医疗安全水平 加强医疗安全文化建设,营造良好的医疗安 全氛围
感谢观看
汇报人:
加强患者安全教育
医院医疗安全不良事件报告表(最新版)

医疗质量安全(不良)事件报告表报告日期:年月日时分事件发生日期:年月日时分事件发生场所:急诊门诊住院部医技部门行政后勤部门其它不良后果:无有(请写出)信息传递错误事件:医师、护理、医技判定意见错误、医嘱错误(口头及书面)、其他传递方式错误治疗错误事件:患者、部位、器材、剂量等选择错误;不认真查对事件方法(技术)错误事件:遗忘、未治疗、延期、时间或程序错误、不必要的治疗、灭菌(消毒)错误、体位错误等药物调剂分发错误事件:医嘱、处方、给药、调剂等不良事件输血事件:医嘱、备血、传送及输血不当引起的不良事件设备器械使用事件:设备故障,一次性耗材出现问题或者设备使用不当导致的不良事件导管操作事件:静点滴漏(渗)、导管脱落(断裂、堵塞)、连接错误等医疗技术检查事件:检查人员无资质、标本丢失或弄错标本、试剂管理、医疗信息沟通错误;迟报、漏报、错报结果等知情同意事件:如知情告知不准确、未行知情告知、告知与书面记录不一致、未行签字同意等物品运送事件:如延迟、遗忘、丢失、破损、未按急需急送、品种规格错误等患者及其家属依从性事件:患者及家属不按照医嘱,医院规定,依从性差造成的事件公共设施事件:医院建筑、通道、其它工作物、有害物质外泄、放射线泄漏等相关事件医患双方冲突事件:医患双方发生的不满、言语、肢体冲突等事件治安事件:非医患双方之间的治安事件:如盗窃,患方与第三方的治安事件医护安全事件:包括锐器刺伤、接触化疗药、传染病等导致损害的不良事件非预期事件:非预期诊疗措施、重返ICU、花费大幅超出预期,住院时间延长等不作为事件:医疗护理工作中已经发现问题,但未及时处现导致的不良事件基础护理事件:如摔倒、坠床、误吸、误咽、无约束固定、烫伤事件等诊疗记录事件:包括诊疗记录丢失、未按要求记录、记录内容失实或涂改、无资质人员书写记录等其他事件:非上列之异常事件不良事件的等级:Ⅰ级事件Ⅱ级事件Ⅲ级事件Ⅳ级事件报告人:医师技师护理人员其他当事人的类别:本院进修生研究生学生不详职称:高级中级初级报告人签名:科室:联系电话:1、本表A、B、C、D项和G项最后一栏由报告人填写,其余项目由相关职能科室填写。
医疗器械不良事件报告表

型号:
产品批号: 生产日期: UDI: 二、 不良事件情况 事件发生日期:
伤害: 死亡 伤害表现:
医疗器械不良事件报告表
□严重伤害
注册证编号: 规格: 产品编号: 有效期至: 上市许可持有人名称:
发现或获知日期: 其他
(可上传附件)
姓名: 出生日期: 既往病史:
年龄:
性别: 病历号: 器械故障表现:
(可上传附件)
三、使用情况
预期治疗疾病或作用:
器械使用日期:
器械停用日期:
使用场所: □医疗机构 □家庭 □其他 场所名称:
使用过程:(套用格式:患者因何种原因何时使用何种医疗器械用于何目的,使用情况如何,何时出现何器械故障,给患者造
成何伤害。何时采取何措施,何时不良事件有何变化。)
合并用药/械情况说明:
填报人签名: 填报日期:
系统上报人签名: 系统上报日期:
单位名称: 公章
四、事件初步原因分析与品原因(报告说明书等) □操作原因
患者自身原因
无法确定
事件原因分析描述:
(可上传附件)
(可上传附件)
该患者属于 □门诊患者 住院患者
可提供 □不良事件登记本 □器械相关照片 □检验单 其他(具体请说明)
可提供 □不良事件病历记录 □诊疗、护理记录 □设备维修记录 □检验单 □器械相关照片 □其他(具体请说明)
医疗设备不良事件登记表

医疗设备不良事件登记表
一、事件基本信息
1. 事件编号:
2. 事件发生日期:
3. 事件报告日期:
4. 医疗机构名称:
5. 医疗机构所在地:
6. 医疗设备名称:
7. 医疗设备型号:
8. 医疗设备制造商:
二、不良事件描述
请详细描述该不良事件的经过和相关情况:
三、事件分类
请选择事件的分类:
1. 事故类
2. 故障类
3. 差错类
4. 无法归类
四、事件原因分析
请分析导致该不良事件发生的原因:
五、报告人信息
1. 姓名:
2. 职称/职务:
3. 联系
4. 电子邮件:
六、处理与处置情况
请描述该不良事件的处理与处置情况:
七、预防措施
请提出避免类似不良事件再次发生的预防措施:
八、其他备注
请提供其他需要补充说明的事项:
注意:
- 请确保填写完整准确的信息,以便进行后续的处理和分析。
- 不良事件的描述应包含事发的具体细节和相关背景信息。
- 在事件原因分析中,请尽量提供合理且详尽的信息,以便进一步改善和预防类似事件的发生。
- 在填写报告人信息时,请确保提供准确有效的联系方式。
- 请在处理与处置情况和预防措施部分提供具体可行且有效的解决方案。
- 在其他备注部分,您可以补充任何其他需要说明的事项。
医疗安全(不良)事件报告表(模板)

处理过程及结果分析
01
及时与患者家属沟通,告知情况 并征得同意后,进行后续治疗。
02
对故障医疗器械进行封存并上报 医院管理部门,等待进一步处理 。
处理过程及结果分析
01
结果分析
02
03
04Leabharlann 患者经过紧急处理,生命体征 平稳,未出现严重并发症。
家属对医院的处理表示满意, 未引发医疗纠纷。
医院对事件进行深入分析,找 出根本原因并采取措施防止类
完善医院管理制度
建立健全医疗安全管理制度和监 管机制,加强对重点环节和关键 领域的监控和管理。
加强患者沟通和教育
加强与患者的沟通和交流,提高
患者对治疗的理解和配合程度, 减少因患者因素导致的不良事件
。
强化医疗设备管理
加强对医疗设备的维护和保养, 确保设备处于良好状态,减少因 设备故障导致的不良事件。
分类
根据事件的性质和影响程度,医疗安全(不良)事件可分为以下几类
医疗事故
指医疗机构及其医务人员在医疗活动中,违反医疗卫生管理法律、行政法规、部门规章和 诊疗护理规范、常规,过失造成患者人身损害的事故。
定义与分类
医疗差错
指在诊疗护理过程中,医务人员确有 过失,但经及时纠正未给病人造成严 重后果或未造成任何后果的医疗纠纷 。
加强医务人员培训和教育
提高医务人员的责任心和技能水 平,加强医疗安全意识和风险防 范意识的培养。
建立应急处理机制
建立医疗安全(不良)事件应急 处理机制,及时应对和处理突发 事件,减少损失和影响。
02 报告表填写指南
填写原则与要求
真实性原则
报告人应如实填写事件发生的经 过、处理情况和相关信息,确保
医疗机构医疗器械不良事件报告举例

包装盒内无针头
包装封口密闭不严
动静脉穿刺 器
断裂、脱落、钢针偏斜
动脉采血器
漏气、异物、漏血
一次性使用 无菌胰岛素 注射器
针头外露,刺破针帽、无法推出余下液体、针 头脱落、断裂、针头堵塞
一次性使用 真空采血器 配套用针
包装破损、脱节、漏血
一次性使用 静脉输液针
断裂、疼痛、脱落、裂口、外包装破损、穿刺 针平头无尖
体温计
体温计
水银柱断裂、甩不下去、规定时间内体温计不 升高
血压计
电子血压计、 立式血压计
测试值不准、气囊漏气、血压计漏液、水银溢 出(排除操作不当因素)
听诊器(无电 能)
听诊器
脱落、折断
6821 医 用电子仪 器设备
用于心脏的治 疗、急救装置
压力导丝
压力导丝压力错误
盐水导管
无信号
除颤监护仪
除颤仪无法蓄电、无法到达设置的焦耳
6840 临 床检验分 析仪器
血液分析系统
便前血检测 试纸
一站式采便器断裂
全自动血沉 仪血沉管
采血后,血沉凝固
手持血液分 析仪
检测异常
全自动糖化 血红蛋白分 析仪
检测中仪器报Z1轴错误,未出检测结果
血气分析仪
血气值过高
血糖检测试 碟
低血糖
全自动血液 分析仪
检验结果数漂移
质控品
检测值与靶值偏低
血糖试条
一次性使用 有创压力监 测传感器
连接不紧密、漏气、不能校“0”、管路破损
无创医用传感 器
血氧传感器
监测过程中血氧值时有时无
心电诊断仪器
单导心电图 机
检测异常
动态心电记 录分析系统
医疗设备不良事件报告表

22.事件初步处理情况:
23.事件报告状态:
已通知使用单位已通知生产企业
已通知经营企业已通知药监部门
D.不良事件评价
24.省级监测技术机构评价意见(可另附附页):
25.国家监测技术机构评价意见(可另附附页):
年月日
东南大学附属中大医院
疑似医疗器械不良事件报告表
报告日期:年月日编码:
报告来源:生产企业经营企业使用单位单位名称:
联系地址:邮编:联系电话:
A.患者资料
1.姓名:
2.年龄:
3.性别男女
4.预期治疗疾病或作用:
B.不良事件情况
5.事件主要表现:
6.事件发生日期:年月日
7.发现或者知悉时间:年月日
8.医疗器械实际使用场所:
报告人:医师技师护士其他
C.医疗器械情况
11.产品名称:
12.商品名称:
13.注册证号:
14.生产企业名称:
生产企业地址:
企业联系电话:
15.型号规格:
产品编号:
产品批号:
16.操作人:专业人员非专业人员患者其它(请注明):
17.有效期至:年月日
18.生产日期:年月日
19.停用日期:年月日
20.植入日期(若植入):年月日
医疗机构家庭其它(请Байду номын сангаас明):
9.事件后果
死亡(时间);
危及生命;
机体功能结构永久性损伤;
可能导致机体功能机构永久性损伤;
需要内、外科治疗避免上述永久损伤;
其它(在事件陈述中说明)。
10.事件陈述:(至少包括器械使用时间、使用目的、使用依据、使用情况、出现的不良事件情况、对受害者影响、采取的治疗措施、器械联合使用情况)
医疗安全(不良)事件报告表(模板)
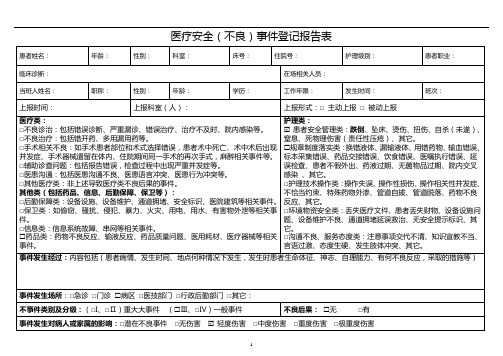
医疗安全(不良)事件登记报告表
1.医疗不良事件(medical adverse event)是指因诊疗活动而非疾病本身逍成的损害。
包括诊断治疗的失误及其相关的设施、设备引起的损害等。
不良事件包括可预防的和不可预防的两种。
2.报告范围:凡在医院内发生的或在院外转运病人时发生的不良亊件均属主动报告的范围。
3.Ⅰ级事件(警告亊件):非预期的死亡,或是非疾病自然进展过程中造成永久性功能丧失。
4.Ⅱ级事件(不良后果事件):在疾病医疗过程中是因诊疗活动而非疾病本身造成的病人机体与功能损害。
5.Ⅲ级事件(未造成后果事件):虽然发生的错误亊实,但未给病人机体与功能造成任何损害,或有轻微后果而不需任何处理可完全康复。
6.Ⅳ级事件(隐患事件):由于及时发现错误,但未形成亊实。
医疗机构医疗器械不良事件精选报告举例.docx

医疗机构医疗器械不良事件报告举例按照医疗器械分类目录对不同品种医疗器械的主要表现进行了列举,供各医疗机构参考。
医疗器分类名称产品名称不良事件表现械分类6801 基础外科手术器械6804 眼科手术器械6805 耳鼻喉科手术器械6806 口腔科手术器械医用缝合针医用缝合针断裂( 不带线 )一次性使用操作不利基础外科用刀备皮刀手术刀片 ?生锈、折断、缺损基础外科用剪手术剪 ?生锈、缺损基础外科用钳持针钳 ?断裂、缺损止血钳 ?血管钳使用后有缺损基础外科用镊无损伤镊 ?弹力不够夹一次性使用盘底不平,凹槽太浅,导致消毒液外溢基础外科其它换药盘 ?器械一次性使用断裂划破医生手指、异物、边缘不整齐有倒刺压舌板 ?其他一次性卫生导致皮肤破损垫?眼科手术用其常规眼科手睫毛镊夹不住睫毛 ?他器械术器械包 ?耳鼻喉科用其一次性使用检查时弹簧弹出、闭合欠佳造成鼻腔窥见困他器械鼻镜 ?难 ?口腔用镊、夹一次性镊子 ?折断口腔用其它器械口腔用钩、根管锉针器械分离针一次性使用异物、器械盒封闭不严、断裂、生锈口腔用其它器齿科器械盒 ?械一次性使用毛刺、断裂压舌板 ?6808 腹部外科手其他术器械矫形(骨科)外科用钳矫形(骨科)6810 矫外科用有源器形外科械(骨科)手术器械其他6812 妇妇产科用剪产科用手妇产科用其他术器械器械6815 注射穿刺器注射穿刺器械械一次性使用不能击发、打开包装后, 钉已经出仓、手柄开直线型吻合裂器?半月板篮钳 ?篮钳头部断裂脱落于膝关节腔内助力枪 ?助力枪上的螺丝脱落创伤手术工钻孔错误具脊柱内固定系统配套工工具断裂遗留在螺钉上具?会阴剪 ?螺丝脱落、刀刃有破损阴道牵开器无螺丝 ?泵用注射器 ?针头弯曲 ?一次性使用无菌避光注注射乳头断裂射器一次性使用动静脉瘘穿穿刺针有折痕刺针 ?一次性使用冠状动脉注漏液 ?射器 ?注射器乳头端断裂不能使用 ?动脉血气针 ?包装盒内无针头包装封口密闭不严 ?动静脉穿刺断裂、脱落、钢针偏斜器动脉采血器 ?漏气、异物、漏血一次性使用针头外露,刺破针帽、无法推出余下液体、针无菌胰岛素头脱落、断裂、针头堵塞注射器 ?一次性使用真空采血器包装破损、脱节、漏血配套用针 ?一次性使用断裂、疼痛、脱落、裂口、外包装破损、穿刺静脉输液针针平头无尖体温计6820 普通诊察器血压计 ?械听诊器(无电能)用于心脏的治疗、急救装置6821 医用电子仪器设备有创式电生理仪器及创新电生理仪器有创医用传感器一次性使用静脉血样采连接部位脱离、漏血、针头不锋利、异物、针头弯曲集针密闭式针尖接头不能对接、破损、断开、排液不滴、针尖自动回储型毛刺、不排除留置针因素的穿刺部位感染、漏留置针液一次性使用活塞裂开、变形、连接不良、漏液、断裂、破注射器损、无刻度、针头带钩、活塞密闭不严、异物水银柱断裂、甩不下去、规定时间内体温计不体温计升高电子血压计、测试值不准、气囊漏气、血压计漏液、水银溢立式血压计出(排除操作不当因素)听诊器脱落、折断压力导丝 ?压力导丝压力错误盐水导管 ?无信号除颤监护仪除颤仪无法蓄电、无法到达设置的焦耳电生理诊断无电信号、临时起搏电极引起并发症导管除颤起搏监无高压放电、无心电信号护仪 ?射频消融电无法放电 ?极导管埋藏式心脏囊袋感染 ?复律除颤器 ?植入式心脏导线脱出、起搏器电极脱位、电池提前耗竭、起搏器 ?程控仪与起搏器之间无法通讯、囊袋感染容量监测仪注射器变形 ?附件无抽搐电休近记忆力下降 ?克治疗仪 ?有创血压传连接后无压力显示?感器 ?心电监护仪 ?多功能心电监护波形紊乱?带 S-T 段的监血氧无结果护仪 ?无创医用传感器心电诊断仪器其他生物电诊断仪器电声诊断仪器无创监护仪器多功能心电多功能心电监护仪不显示心电波形?监护仪 ?病人监护仪血氧饱和度未测出、血压不能测出、袖带漏气压力传感器测量值出错、不显示有创血压、断裂、无压力及其附件 ?波形一次性使用有创压力监连接不紧密、漏气、不能校“ 0”、管路破损测传感器 ?血氧传感器 ?监测过程中血氧值时有时无单导心电图检测异常 ?机?动态心电记心电图信息杂乱录分析系统 ?多路心电遥心电监测错误信息报警 ?测仪 ?十二道心电接触点夹板损坏图机 ?自动分析心使用过程中出现黑屏电图机心电图机导不出图像 ?测量时结果无二导,且不出诊断分析心电分析仪不能抗电磁干扰,打印时卡纸使用监护仪监测血压不稳定且偏低?多导心电图接头断裂、接触点易脱落机心电图机异常图形、异常关机、运行异常多功能眼病电流不稳定 ?治疗仪听力筛查仪探头损坏 ?紧凑型麻醉麻醉监护仪心电图示不显示数字监护仪心电监护仪心电监护仪不出心电波形电休克治疗异常的原因不明的遗忘,定向力障碍,不能排仪除器械因素。
医疗器械不良事件报告表案例

医疗器械不良事件报告表案例医疗器械不良事件报告表是用来记录和报告医疗器械不良事件的重要工具。
它是医疗机构和相关部门进行问题溯源和风险评估的重要依据。
下面是一些医疗器械不良事件报告表的案例,以便更好地理解和应用该表格。
1. 报告表的基本信息部分包括医疗机构名称、报告人员信息、报告时间等。
2. 事件描述部分详细描述了医疗器械不良事件的经过。
包括事件发生的时间、地点、涉及的医疗器械型号和批号等。
3. 不良事件的分类部分将事件按照不同的类型进行分类,如设备故障、使用错误、设计缺陷等。
4. 事件的影响部分描述了事件对患者、医疗机构和医疗过程的影响。
例如,患者是否受伤、是否影响正常的医疗流程等。
5. 事件的原因分析部分对不良事件的原因进行分析。
可能的原因包括人为因素、设备质量问题、操作失误等。
6. 对事件的处理和措施部分描述了医疗机构对不良事件的处理措施。
包括停用或更换医疗器械、加强培训和操作指导等。
7. 风险评估部分对事件的风险进行评估,包括患者的风险和医疗机构的风险。
评估结果可能包括患者再次受伤的概率、医疗机构的声誉等。
8. 事件的报告和通知部分描述了医疗机构向相关部门报告和通知的情况。
包括向监管机构报告、向制造商报告等。
9. 预防措施部分提出了医疗机构为避免类似事件再次发生所采取的预防措施。
如加强医疗器械的维护保养、加强人员培训等。
10. 报告的审核和确认部分描述了报告的审核过程和结果。
包括报告的审核人员、审核时间和审核结果等。
医疗器械不良事件报告表是医疗机构和相关部门进行问题溯源和风险评估的重要工具。
通过详细记录和分析不良事件,可以找出问题的根源,采取相应的措施来预防类似事件的再次发生。
同时,报告表也为监管部门提供了及时而准确的信息,帮助他们对医疗器械的安全性和质量进行监督和管理。
检验科医疗器械不良事件报告表范文

检验科医疗器械不良事件报告表范文一、基本信息。
1. 事件发生单位。
单位名称:[医院具体名称]检验科。
联系地址:[详细地址]邮政编码:[具体邮编]联系电话:[电话号码]2. 报告人信息。
姓名:[你的名字]职务/职称:[如检验技师之类]联系电话:[你的电话]E mail:[如有可填写]3. 不良事件涉及医疗器械信息。
器械名称:[具体医疗器械名称,比如某品牌的血液分析仪] 器械型号:[型号代码]生产企业名称:[企业全称]生产企业地址:[详细地址]产品编号:[设备的编号]注册证号:[注册证编号]购买日期:[具体日期]使用日期:[开始投入使用的日期]二、不良事件情况。
1. 事件发生时间。
那是一个忙碌的早晨,就像往常一样,大家都在检验科里忙得晕头转向的。
大概是[具体时间]的时候,这个事儿就发生了。
2. 事件表现描述。
嘿呀,这个[医疗器械名称]突然就跟抽风了似的。
原本它测血液样本各项指标的时候,那可是稳稳当当的,就像个老黄牛一样踏实。
可那天呢,它给出来的白细胞计数结果那叫一个离谱,高得就像火箭蹿上天了。
而且啊,它还时不时地发出一些奇怪的嗡嗡声,就好像在跟我们抗议说“我不舒服,我要罢工”似的。
我们又重新检测了几次,用的都是正常的样本,结果还是乱七八糟的,不是这个指标错得离谱,就是那个数值完全不符合逻辑。
3. 事件发生的影响。
这可把我们给害惨喽!您想啊,检验科的结果那是给医生诊断的重要依据啊。
这一出错,就像给医生的眼睛蒙上了一层雾,医生都懵了,不知道该怎么准确判断病人的病情了。
我们得重新手动检测那些样本,本来就忙得脚不沾地,这又得多花好多时间,搞得后面排队等结果的病人都等得不耐烦了,就像热锅上的蚂蚁一样,一个劲儿地催。
4. 事件处理情况。
我们当时就赶紧先停止使用这个调皮的家伙了。
然后呢,我们把它的电源拔了又插,就像哄小孩似的,希望它能好起来,可没什么用。
接着,按照手册上的基本故障排查方法,检查了一些连接线啊、传感器之类的,也没发现什么明显的问题。
常见医疗器械不良事件临床表现汇总表

常见医疗器械不良事件临床表现汇总表
针对绝大局部医护人员不了解什么是医疗器械不良事件和如何判定医疗器械不良事件的现状, 通过度析历年来医疗器械可疑不良事件报告, 并查阅文献, 结合临床各个科室利用器械的情形进展分类, 整理出本?临床常见医疗器械不良事件表现汇总表?, 希望能够帮忙我院广漠医护人员对医疗器械不良事件监测工作的熟悉和了解常见的医疗器械不良事件表现, 提高我院医疗器械不良事件监测水平与报告率, 更好的保障医疗器械利用平安。
本表要紧求示范作用, 上报内容没必要局限于本表。
由于编写时刻有限而且数据处置量较大, 疏漏的地方在所不免, 希望大伙儿能够提出宝贵意见。
目录:
一、临床科室通用医疗器械
二、放射科经常使用医疗器械
三、B超、心电图室经常使用医疗器械
四、查验科、病理科经常使用医疗器械
五、内镜室经常使用医疗器
六、外科通用医疗器械
七、放疗科经常使用医疗器械
八、中医科经常使用医疗器械
一、临床科室通用医疗器械
二、放射科经常使用医疗设备
三、B超心电图室经常使用医疗器械
四、查验科、病理科经常使用医疗器械
五、内镜室经常使用医疗器
六、外科通用医疗器械
七、放疗科经常使用医疗器械
八、中医科。
《可疑医疗器械不良事件报告表》及填写要求模板

宁阳县第一人民医院医疗器械不良事件报告制度1、医疗器械临床使用管理小组负责指导本院医疗器械不良事件监测工作。
2、医务人员如发现可能与医疗器械有关的不良事件时,应及时填写医疗器械不良事迹报告单,同时,报告本科室专职监测员。
3、监测网信息员负责本科室医疗器械不良事件监测工作的宣传,医疗器械不良事件病例的收集,并报告专职监测员。
4、专职监测员发现或接到医疗器械不良事件报告,应及时到现场查看,协助调查,并填写不良事件报告表,核实后定期提交医疗器械不良事件小组评价。
5、医疗器械不良事件监测小组定期对收集的报告表进行初步的审核讨论后,有专职医疗器械不良事件监测人员汇总后,统一上报市医疗器械不良事件监测中心。
6、发现严重罕见或新的不良事件病例,应在15个工作日内报告,死亡病例需及时报告,必要时可越级上报。
7、未经国家药监管理局公布的不良事件监测资料,不得向国内外机构组织学术团体或个人泄露。
附表格及相关说明《可疑医疗器械不良事件报告表》及填写要求可疑医疗器械不良事件报告表报告日期: 年 月 日 编 码: 报告来源: 生产企业 经营企业 使用单位 单位名称:联系地址: 邮 编: 联系电话:报告人签名:国家食品药品监督管理局制填写要求《可疑医疗器械不良事件报告表》由题眉、患者资料、不良事件情况、医疗器械情况、关联性评价、不良事件评价及题末7部分组成。
1.题眉A.报告日期:是指填报人填报该次不良事件时的确切时间。
B.编码:由省(区、市)医疗器械不良事件监测技术机构填写,按以下排列方式:省(区、市)年份流水号□□□□□□□□□□□注:省(区、市)编码按中华人民共和国行政区划代码填写。
在医疗器械不良事件监测系统中,编码由系统自动生成。
C.报告来源:是指填报可疑医疗器械不良事件单位的类别,填写时请选择相应的选项,并在“□”中划“√”。
D.单位名称:是指填报可疑医疗器械不良事件单位的全称,不可用简称。
E.联系地址、电话及邮编:是指填报可疑医疗器械不良事件单位的联系地址、电话及邮编。
医疗机构医疗器械不良事件报告举例
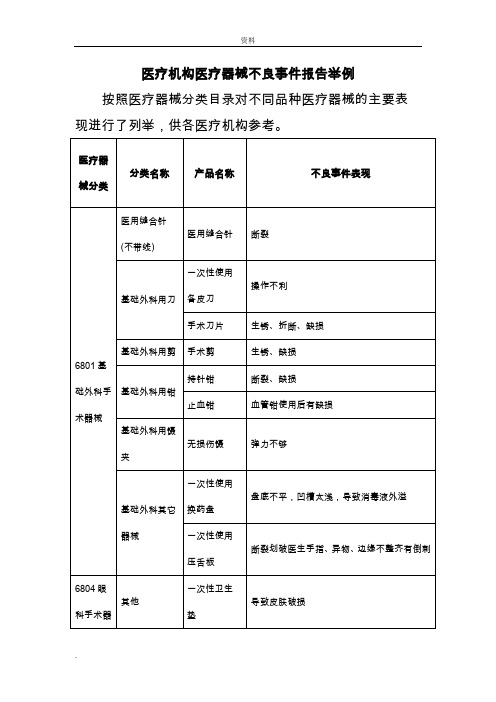
血氧饱和度未测出、血压不能测出、袖带漏气
压力传感器及其附件
测量值出错、不显示有创血压、断裂、无压力波形
一次性使用有创压力监测传感器
连接不紧密、漏气、不能校“0”、管路破损
无创医用传感器
血氧传感器
监测过程中血氧值时有时无
心电诊断仪器
单导心电图机
检测异常
动态心电记录分析系统
心电图信息杂乱
多路心电遥测仪
一次性使用无菌胰岛素注射器
针头外露,刺破针帽、无法推出余下液体、针头脱落、断裂、针头堵塞
一次性使用真空采血器配套用针
包装破损、脱节、漏血
一次性使用静脉输液针
断裂、疼痛、脱落、裂口、外包装破损、穿刺针平头无尖
一次性使用静脉血样采集针
连接部位脱离、漏血、针头不锋利、异物、针头弯曲
密闭式针尖自动回储型留置针
脚踏板无法使用
超声眼科晶状体摘除和玻璃体切除设备及附件
玻切头与管路分离
显微眼科手术系统
超声乳化头无法调节
彩色超声成像设备及超声介入/腔内诊断设备
超声骨密度仪
接连两次测查结果不一致且与既往结果有较大差异
超声经颅多普勒血流分析仪
检测异常
超声内窥镜
GF-UM240外科破损
彩色超声诊断系统
黑屏、不能正常运行、探头开裂、影像重影、面板冻结键、测量键失灵、采集图像不清晰
接头不能对接、破损、断开、排液不滴、针尖毛刺、不排除留置针因素的穿刺部位感染、漏液
一次性使用注射器
活塞裂开、变形、连接不良、漏液、断裂、破损、无刻度、针头带钩、活塞密闭不严、异物
6820普通诊察器械
体温计
体温计
水银柱断裂、甩不下去、规定时间内体温计不升高
医疗不良事件报告表
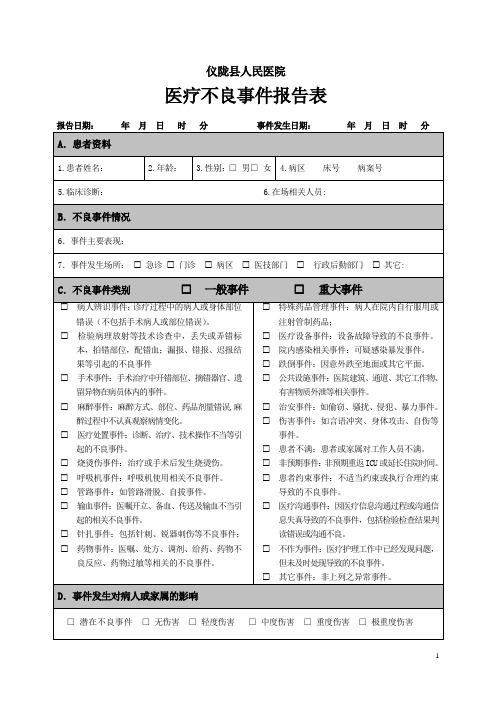
仪陇县人民医院
医疗不良事件报告表
报告人:医师 技师 护士 其他
报告人签名:联系地址: 联系电话:
1、医疗不良事件(medical adverse event)是指因诊疗活动而非疾病本身造成的损害。
包括诊断治疗的失误及其相关的设施、设备引起的损害等。
不良事件包括可预防的和不可预防的两种。
2、潜在不良事件(potential adverse event)是指由于不经意或是及时的介入行为,而使其原本可能导致的不良事件或情况并未真正发生在病人身上。
3、无伤害:事件发生在病人身上,但是没有造成任何的伤害。
4、轻度伤害:事件虽然造成伤害,但不需或仅需稍微的处理或观察;如捏伤、擦伤、皮肤小撕裂伤。
5、中度伤害:需额外的探视、评估或观察,但仅需要简单的处理;如缝合、夹板固定、冰敷、抽血检查、包扎或止血治疗。
6、重度伤害:除需要额外的探视、评估或观察外,还需住院、延长住院时间或会诊等特别处理。
7、极重度伤害:造成病人永久残障或永久功能障碍。
医疗安全不良事件报告

医疗安全不良事件报告一.事件概况事件发生时间:2024年5月1日事件发生地点:XX医院事件责任单位:XX医院二.事件描述在2024年5月1日,XX医院发生了一起医疗安全不良事件。
患者张(化名)因右肩脱臼到XX医院就诊,医生预约了手术时间为当天下午3点。
张在手术前进行了全面体检,手术前的评估指标均正常。
然而,在手术过程中出现了严重的不良事件。
当手术开始时,医生发现手术室的手术器械没有按照操作规范放置,部分器械未能妥善清洗,同时还有一些器械未经过消毒处理。
医生和护士在手术进行中,发现张右肩关节的问题更加复杂,需要进行额外的切割和修复。
然而,在准备进行开刀时,手术室的电源突然断电。
由于手术室没有备用发电机,手术被迫中断。
此外,在手术过程中,手术室的一名护士因为长时间站立而感到疲劳,手术进行到一半时,不慎将一根器械从手术台上掉落,器械的一角直接插入了张右肩,导致出血并对患者的伤口造成了二次伤害。
最终,经过紧急处理,手术顺利完成。
但是该事件使得患者张身体遭受了额外的伤害,并且对其心理造成了不小的恐惧和痛苦。
三.事件原因分析该事件的发生主要归因于以下几个原因:1.手术室管理不规范。
手术室的器械未按照操作规范进行放置和清洗,一些器械未经过消毒处理,严重影响了手术的安全性。
2.医院设备不完善。
手术室没有备用发电机,一旦电力供应中断,无法正常进行手术。
这导致了手术被迫中断,对患者的安全和手术效果产生了负面影响。
3.医护人员疲劳和差错。
由于手术室护士长时间站立的原因,导致其疲劳,不慎发生了一次失误,将器械掉落到患者身上,对患者的身体造成了额外的伤害。
四.事件教训通过对该事件的分析,提出以下教训:1.严格执行操作规范。
医院和手术室应加强对手术器械的管理,确保其按照规范进行摆放、清洗和消毒,以提高手术安全性。
2.完善设备配置。
医院应确保手术室具备备用发电机等基础设施,以应对突发情况,确保手术的顺利进行。
3.管理医护人员疲劳。
放射科医疗质量安全(不良)事件主动报告表

不良事件发生时间
不良事件发生地点
医技检查不良事件
造影剂过敏反应:放射线邪路:无应急抢救药械:未执行“危急值”报告制度等
仪器设备不良事件
设备故障:仪器损坏:导管断裂:连接错误:违规操作等
其他不良事件
上述未涵盖的医疗质量安全(不良)事件
事件
所涉
患者
信息
姓名片号Biblioteka 门诊/住院就诊科别
门诊/住院号
联系方式
事件
所涉
医护
人员
信息
姓名
科别
备注
对不良事件经过的说明
不良事件后果
初步原因分析
报告人信息
姓名
部门/科室
联系方式
上报时间
科室或部门意见
负责人(科主任或护士长)签名:
日期:年月日
医疗器械安全事件报表

备注:1、当事人身份类别:本院正式职工、本院退休返聘职工、本院见习期职工、进修生(执业许可)、研究生(执业许可)、访问学者、聘用外院人员、不明、其他。
2、职别:科主任、副主任、护士长、副护士长、执业医师、助理医师、见习期医师、进修医师、在读研究
生、住院总医师、非执业医师、注册护士、非注册护士、护理员/工/陪护、理疗、检验、医学影像、超声、核医学、药剂、康复训练、口腔技工、行政、营养、病案/信息、不明、其他。
3、本表根据卫生部医政司及中国医师协会“医疗安全(不良)事件报告网络系统”设计制作。
4、根据卫生部《三级综合医院评审标准实施细则》,医院至少每年每100张床报告10-20件。
医疗不良事件报告制度及登记表范本(三篇)

医疗不良事件报告制度及登记表范本为了加强对医疗器械的监督管理,严格医疗器械的质量跟踪检测工作,保证医疗器械的安全、有效,特制订本制度。
一、基本概念医疗器械,是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件;其效用主要通过物理等方式获得,不是通过药理学、免疫学或者代谢的方式获得,或者虽然有这些方式参与但是只起辅助作用。
医疗器械不良事件:是指获准上市的质量合格的医疗器械在正常使用情况下发生的,导致或者可能导致人体伤害的各种有害事件。
医疗器械不良事件主要包括医疗器械已知和未知作用引起的副作用、不良反应及过敏反应等。
副作用:是治疗使用的医疗器械所产生的某些与防治目的无关的作用。
医疗器械不良事件监测。
指对医疗器械不良事件的发现、报告、评价和控制的过程。
医疗器械与药品一样具有一定的风险性,特别是那些与人体长时间接触、长期使用、植入人体内的医疗器械,在其对疾病诊治的同时,不可避免地存在着相应风险。
只有通过医疗器械上市后,在使用中发生的不良事件的监测和管理,最大限度地控制医疗器械潜在的风险,保证医疗器械安全有效的使用。
二、报告原则(一)基本原则:造成患者、使用者或其他人员死亡、严重伤害的事件已经发生,并且可能与所用的医疗器械有关,需要按可疑医疗器械不良事件报告。
严重伤害包括三种情况:1.危及生命。
2.导致机体功能的永久性伤害或者机体结构的永久性损伤。
3.必须采取医疗措施才能避免上诉永久性伤害或者损伤。
(二)濒临事件原则。
有些事件当时并未造成人员伤害,但临床医务人员根据自己的临床经验认为再次发生同类事件时,会造成患者、使用者或其他人员死亡或严重伤害,则也需报告。
(三)可疑即报原则。
在不清楚是否属于医疗器械不良事件时,按可疑医疗器械不良事件报告。
报告事件可以是与使用医疗器械有关的事件,也可以是不能排除与医疗器械无关的事件。
三、报告时限及流程(一)报告时限突发、群发不良事件立即报告,并在____小时内填报《可疑医疗器械不良事件报告表》;死亡事件:发现或者知悉之日起____个工作日内报告;严重伤害或可能导致死亡或严重伤害事件:发现或者知悉之日起____个工作日内向器械科报告。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
9.事件后果
死亡(时间);
危及生命;
机体功能结构永久性损伤;
可能导致机体功能机构永久性损伤;
需要内、外科治疗避免上述永久损伤;
其它(在事件陈述中说明)。
10.事件陈述:(至少包括器械使用时间、使用目的、使用依据、使用情况、出现的不良事件情况、对受害者影响、采取的治疗措施、器械联合使用情况)
21.事件发生初步原因分析:
22.事件初步处理情况:
23.事件报告状态:
已通知使用单位已通知生产企业
已通知经营企业已通知药监部门
D.不良事件评价
24.省级监测技术机构评价意见(可另附附页):
25.国家监测技术机构评价意见(可另附附页):
年月日
报告人:医师技师护士其他
C.医疗器械情况
11.产品名称:
12.商品名称:
13.注册证号:
14.生产企业名称:
生产企业地址:
企业联系电话:
15.型号规格:
产品编号:
产品批号:
16.操作人:专业人员非专业人员患者其它(请注明):
17.有效期至:年月日
18.生产日期:年月日
19.停用日期:年月日
器械不良事件报告表
报告日期:年月日编码:
报告来源:生产企业经营企业使用单位单位名称:
联系地址:邮编:联系电话:
A.患者资料
1.姓名:
2.年龄:
3.性别男女
4.预期治疗疾病或作用:
B.不良事件情况
5.事件主要表现:
6.事件发生日期:年月日
7.发现或者知悉时间:年月日
8.医疗器械实际使用场所:
