第六章 甲醇合成
甲醇合成工艺PPT课件

淡水资源:相当世界人均的1/4,居世界第 110位
28
原油
冷凝水
LNG 海水 煤
铁矿石
25万吨
干气
催化裂化
催化裂解
燃料油1000万吨/ 聚年乙烯
乙烯 100万吨/年 其他化工产品
蒸汽
燃气发电
超临界发电
焦炉煤气
山西孝义
10
苏里格天然气公司
17
山东鲁西化工
25
山西原平
20
河北建滔
10
山东鲁南化肥厂
60
贵州贵化
20
旭阳焦化集团甲醇二期
10
河南延化化工有限责任公司 18
唐山中润公司二期
15
宁夏宝丰投资集团
20
山西兰花清洁能源公司
20
中煤能源
25
陕西榆林煤化科技新建
10
33
8.2甲醇的生产工艺原理
碳的氧化物与氢合成甲醇的反应式如下:
9
甲醇的化学性质
E 甲醇的羰基化制醋酸
甲醇与一氧化碳在250℃、50-70MPa下通过碘化钴均相 催化剂,或在180℃、3-4MPa下通过铑的碳基化合物为催 化剂(以碘为助催化剂),能合成醋酸。
CH3OH+ CO
CH3COOH
F 甲醇的脱水制二甲醚
活性氧化铝
2CH3OH
CH3OCH3+H2O
250 ℃
蒸气压 平均热 燃料种类 分子量 /MPa(60 值
℃) /kJ/kg
二甲醚 46.0 1.35 31450
液化气 56.6 1.92 45760
甲醇合成工艺

高温高压操作的安全防范措施
采用防爆电器、仪表,避免电火花引起爆炸。
防爆、防火、防泄漏措施
防爆措施
合理设置防火间距,确保设备在火灾情况下不会相互影响。
防火措施
严格控制泄漏点,采用密封性能好的设备和管道,防止物料泄漏。
防泄漏措施
甲醇合成工艺的发展趋势与展望
06
优化反应条件
通过优化反应温度、压力、气体组成等参数,提高甲醇合成过程的能效和转化率。
废气排放
废水排放
有害固废
严格控制废水排放,进行预处理及生化处理,确保达到国家排放标准。
合理处理有害固废,采用焚烧、填埋等处理方法,确保无害化处理。
03
有害物料的排放及处理
02
01
合理控制反应温度,避免超温超压,确保设备安全。
温度控制
严格监控系统压力,防止超压引发泄漏和设备损坏。
压力监控
在关键部位设置安全阀,确保设备在异常情况下能及时泄压。
甲醇是一种极性溶剂,能与水、乙醇、乙醚等有机溶剂混溶,且具有较高的蒸发热和较小的比重。
甲醇的定义及性质
甲醇合成工艺的意义
甲醇也是一种重要的燃料,可以作为汽油添加剂和燃料电池燃料。
甲醇还是一种优良的能源,具有较高的能量密度和较低的污染排放。
甲醇是重要的化工原料,可用于生产甲醛、乙酸、甲胺、甲基叔丁基醚(MTBE)、二甲醚等多种有机化工品。
20世纪初期,人们开始使用天然气作为原料生产甲醇。
20世纪70年代以后,随着对环境保护和能源多样化的重视,生物质原料生产甲醇的工艺开始得到研究和发展。
近年来,随着新技术的不断发展,甲醇合成工艺也在不断改进和完善。
随着石油工业的发展,以煤为原料生产甲醇的工艺逐渐得到广泛应用。
甲醇 合成 原料气组成

甲醇合成原料气组成一、甲醇合成原料气组成的基础知识甲醇合成原料气主要包含一氧化碳(CO)、二氧化碳(CO₂)和氢气(H₂)。
这就好比是一个小团队,每个成员都有自己独特的作用呢。
一氧化碳和二氧化碳是碳的氧化物,氢气则是非常活泼的气体。
一般来说,氢气在原料气中的比例相对较高,就像是这个小团队里的主力军。
氢气的量大概能占到60% - 70%左右哦。
一氧化碳呢,通常占20% - 30%,它可是合成甲醇过程中的关键成分。
二氧化碳的比例相对较少,大概在5% - 15%之间。
这些比例并不是固定不变的,就像生活中的很多事情都有一定的灵活性。
二、原料气组成对甲醇合成的影响(一)氢气的影响氢气如果量太多了,就像一个团队里人太多却没那么多活干一样,会造成资源浪费,而且可能会影响反应的平衡。
要是氢气量太少呢,那就像干活的人不够,甲醇合成的效率就会大打折扣。
(二)一氧化碳的影响一氧化碳可是个很重要的角色。
如果一氧化碳的量不合适,甲醇合成反应的速率就会受到影响。
如果一氧化碳量过少,反应就会慢吞吞的,就像汽车没油了跑不快一样。
要是一氧化碳量过多,可能会引发一些副反应,就像本来是做蛋糕,结果加了太多面粉,做出了奇奇怪怪的东西。
(三)二氧化碳的影响二氧化碳虽然量少,但也不能小看它。
适量的二氧化碳可以调节反应的速率和选择性。
就好比做菜时加一点特殊的调料,能让菜的味道更好。
但是如果二氧化碳太多了,就像调料放多了,味道也会变得很奇怪,反应也会受到不良影响。
三、原料气组成的来源与调整(一)来源原料气的来源有很多种呢。
比如可以通过煤气化得到,煤气化就像是把煤炭变成魔法气体一样,这个过程中会产生含有一氧化碳、氢气和二氧化碳的气体。
还有天然气重整,把天然气通过一系列反应变成我们需要的原料气。
(二)调整如果原料气的组成不太合适,我们就得调整它。
可以通过一些化学方法,比如变换反应。
如果一氧化碳太多,我们可以让一氧化碳和水反应,生成二氧化碳和氢气,这样就能调整一氧化碳和氢气的比例啦。
甲醇的生产之合成

2、甲烷部分氧化法
甲烷直接氧化生成甲醇的反应式如下:
这种制甲醇的方法工艺流程简单,节省建设投资,而且将 便宜的原料甲烷变成贵重的产品甲醇,是一种可取的生产 甲醇的方法。 但是,这种氧化过程不易控制,常因深度氧化生成碳的 氧化物和水,而使原料和产品受到很大损失,使甲醇的总 收率不高。 虽然已有运行的工业试验装置,甲烷氧化制甲醇的方法 仍未实现工业化。
任务三 应用生产原理确定工艺条件
3. 原料气组成
(1)H2/CO
生产上采用H2过量,
即H2/CO>化学计量比2。
任务三 应用生产原理确定工艺条件
②而且H2过量还可以: 抑制高级醇、高级烃和还原性物质的生成,提高 粗甲醇的浓度和纯度。 因氢的导热性能好,过量的H2有利于防止局部过 热和控制整个催化剂床层的温度。 ③但是,H2过量太多会降低设备的生产能力。 ④低压法甲醇合成,一般控制: 新鲜原料气中 H2:CO=2.2~3.0 。
低压法,即用合成气为原料在低压(5MPa)、温度为 275℃左右下进行,采用铜基催化剂合成甲醇,是近几年 开发的合成甲醇的新方法。低压法的特点是选择性高,粗 甲醇中的杂质少,精制甲醇质量好。 中压法,即以合成气为原料,操作压力为10~27MPa,温 度235~275℃,催化剂为铜基催化剂。此法的特点是处理 量大、设备庞大、占地面积大、是综合了高压、低压法的 优缺点而提出来的。此法目前发展较快,新建厂的规模也 趋大型化。 我国独创的联醇(与合成氨联合)工艺,实际上也是一种中 压法合成甲醇的方法。
任务二 生产准备
一、甲醇的性质与用途
1.甲醇的用途 产量仅次于乙烯、丙烯和苯,居第四位 有机化工原料
甲醛、醋酸、乙醇、 医药、农药、染料、 三大合成材料等
甲醇合成的工艺流程和设备

甲醇合成的工艺流程和设备1. 介绍甲醇是一种重要的化工原料,在化工工业中被广泛应用。
甲醇合成是通过一系列化学反应将一氧化碳与氢气合成甲醇。
本文将介绍甲醇合成的工艺流程和所需的设备。
2. 工艺流程甲醇合成的工艺通常分为以下几个步骤:2.1 气化反应首先,将煤、天然气或重油等碳源与氧气(或空气)在高温高压条件下进行气化反应,生成一氧化碳和氢气的混合气体。
气化反应需要使用气化炉等设备。
2.2 气体净化混合气体中存在着杂质,如硫化物、氯化物等。
这些杂质会对甲醇合成催化剂产生不利影响。
因此,需要将混合气体进行净化处理,通常包括除尘、脱硫、脱氯等步骤。
常用的净化设备包括除尘器、脱硫器和脱氯器。
2.3 合成反应在甲醇合成反应中,一氧化碳和氢气经过一系列化学反应转化为甲醇。
这一反应通常在合成反应器中进行,催化剂是促进反应的重要因素。
常用的催化剂有氧化铜-锌、铜-铝催化剂等。
2.4 分离与精制在合成反应结束后,甲醇和未反应的混合气体需要进行分离。
一种常用的分离方法是通过蒸馏将甲醇和副产物进行分离。
此外,还需要进行甲醇的精制,以提高甲醇的纯度。
常用的精制方法有吸附、结晶等。
3. 设备在甲醇合成的工艺流程中,需要使用到以下一些设备:3.1 气化炉气化炉是将煤、天然气等碳源与氧气(或空气)进行气化反应的设备。
气化炉通常由炉体、燃烧器、气化剂供给系统等组成。
3.2 除尘器除尘器用于去除混合气体中的固体颗粒物,以保证合成反应的正常进行。
除尘器可以采用重力沉淀、过滤等原理进行操作。
3.3 脱硫器脱硫器主要用于去除混合气体中的硫化物。
常用的脱硫方法有化学吸收脱硫、物理吸附脱硫等。
3.4 脱氯器脱氯器用于去除混合气体中的氯化物。
脱氯通常采用物理吸附或化学吸收的方式进行。
3.5 合成反应器合成反应器是进行甲醇合成反应的设备。
合成反应器通常由反应罐体、催化剂床层等组成。
3.6 分离设备分离设备主要用于将合成反应产物中的甲醇和副产物进行分离。
甲醇合成工艺

甲醇合成的催化剂与反应条件
甲醇合成的催化剂主要有铜基催化剂、锌基催化剂和铬基催化剂等。
在甲醇合成过程中,反应温度、压力、空速等是影响甲醇合成的重要因素。
铜基催化剂具有活性高、选择性好、稳定可靠等优点,因此应用最广泛。
在适当的温度和压力条件下,催化剂的活性可以得到充分发挥,有利于提高甲醇的产率和纯度。
河南煤业化工集团
该企业采用新型甲醇合成工艺,生产出高质量甲醇产品,并实现年产值数十亿元。
中国石化集团
该企业在燕山石化、上海石化等大型企业应用甲醇合成工艺,提高产品质量和降低能源消耗。
甲醇合成工艺在大型化工企业中的应用案例
风能甲醇合成气项目
*某公司利用风能发电,将风能转化为电能,再利用该电能生产甲醇合成气,实现新能源的综合利用。
2023
甲醇合成工艺
甲醇合成工艺简介甲醇合成工艺原理甲醇合成工艺流程甲醇合成工艺的环境影响与安全措施甲醇合成工艺的发展趋势与前景甲醇合成工艺的实际应用案例
contents
目录
01
甲醇合成工艺简介
1
甲醇的定义与性质
2
3
甲醇是一种有机化合物,其分子式为CH4O,结构简式为CH3OH。
甲醇是一种无色、透明、易燃的液体,具有刺激性气味,熔点为-97.8℃,沸点为64.5℃。
甲醇合成工艺的环保与可持续发展
资源高效利用
利用副产物和废弃物,实现循环经济。
循环经济发展
减少对环境的污染,实现绿色生产。
环境保护
05
甲醇合成工艺的发展趋势与前景
国内发展现状
我国甲醇合成工艺研究起步较晚,但发展迅速,目前已经成为全球最大的甲醇生产国和消费国,年产量超过全球总量的三分之一。
第六章 甲醇合成
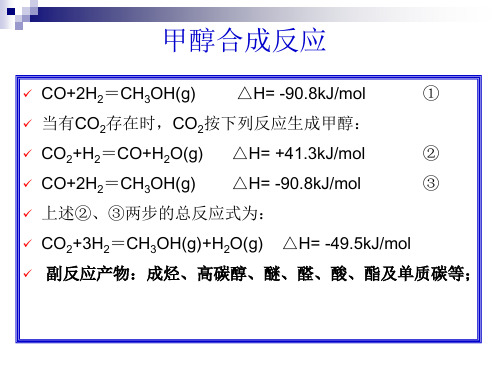
✓ CO+2H2=CH3OH(g)
△H= -90.8kJ/mol
①
✓ 当有CO2存在时,CO2按下列反应生成甲醇:
✓ CO2+H2=CO+H2O(g) △H= +41.3kJ/mol
②
✓ CO+2H2=CH3OH(g) △H= -90.8kJ/mol
③
✓ 上述②、③两步的总反应式为:
✓ CO2+3H2=CH3OH(g)+H2O(g) △H= -49.5kJ/mol ✓ 副反应产物:成烃、高碳醇、醚、醛、酸、酯及单质碳等;
⑴催化剂中毒
,硫是最
常见的毒物,也是引起催化剂活性衰退的主要因素。
原料气中的硫一般以H2S和COS形式存在,通常认为H2S
和活性组分铜起反应,使其失去活性,其反应式为: H2S+Cu=CuS+H2
在合成甲醇的反应条件下,COS会分解成H2S而使催 化剂中毒:
COS+H2=CO+H2S
⑵热老化
铜基催化剂耐热性也较差,甲醇催化剂的一般在250- 300℃温度下操作,要求维持催化剂在最佳的温度下操 作。在运行期间,铜微晶逐渐长大,催化剂比表面积和 Cu比表面积减小而引起活性下降,使用温度的提高将 加速铜晶粒长大的速度,即加快活性衰退的速度。
CO氢加合成甲醇的反应历程假设如下:其中“*”是 催化剂的活性位。
反应中步骤(a)和(b)是甲醇合成总反应速率的控制步骤
甲醇催化剂
催化剂的两大特点: (1)反应前后其物理、化学性质不变 (2) 改变了反应历程,加快反应速度
催化剂种类:
1) 锌-铬系Zn-Cr 分子式:xZnO·yZnCrO4·zH2O 典型组成:ZnO,55.0±1.5%、CrO3,34.0±1.0%
甲醇的合成PPT课件
甲醇用途
(1)甲醇是一种用途广泛的有机化工产品,在农药、 医药、染料、香料、涂料等生产中都需要甲醇 作为原料或溶剂。甲醇作为有机产品在世界范 围内其产量仅次于乙烯、丙烯及纯苯等基础原 料,是基本的有机化工原料。
(2) 甲醇在世界范围内最大的用途是作为生产甲 基丁基醚(MTBE)的原料,甲醛和醋酸也占 有一定的比例。
•6
反应特点及催化剂
反应特点:甲醇合成反应是在有催化剂存在的 一个体积缩小的、可逆的、伴有多种副反应发 生的放热反应。
催化剂:铜基催化剂 主要成分:CuO、ZnO、AL2O3,其中有活性的
是铜,必须还原后使用。 还原方程式为: CuO+H2=Cu+H2O
•7
甲醇合成技术
气相法:气相法甲醇生产过程由于温度控制、床层温升 和换热的限制,合成气的单程转化率低,出口甲醇质 量分数较小,循环量大,经济性难以令人满意。
•4
甲醇合成工艺原理
甲醇的化学式:CH3OH 甲醇合成反应是一个放热反应,化学反应方程式如下 主反应:
CO+2H2→CH3OH +102.5kJ/mol CO2+3H2→CH3OH+H2O+59.6kJ/mol CO+H2O→CO2+H2+41.19 kJ/mol
•5
甲醇合成的副反应
2 CO+4H2 →CH3OCH3+H2O 2CO+4H2→C2H5OH+H2O 2CO+3H2→CH4+H2O nCO+2nH2→(CH2)n烃类+nH2O
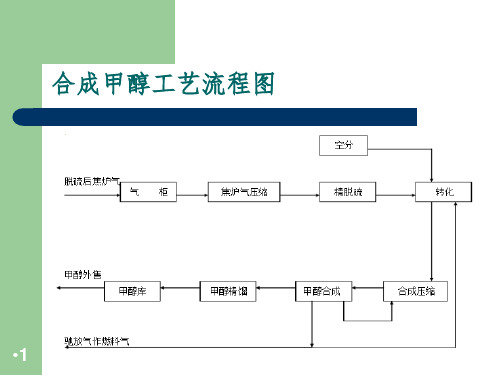
合成甲醇工艺流程图
•1
甲醇简介
主要性质
甲醇是一种无色,略带乙醇香气的挥发性可燃液 体,在常压情况下,密度0.8100g/ml,甲醇沸点为 64.7 ,自燃点473 (空气中),461 (氧气中)可与水 互溶,在汽油中有较大的溶解度。
甲醇合成的生产工艺流程及主要设备

任务1 甲醇合成的工艺条件
二、压力 压力也是甲醇合成反应过程的重要工艺条件之一。从热力学分析,甲醇
合成是体积缩小的反应,因此增加压力对平衡有利,可提高甲醇平衡产 率。在高压下,因气体体积缩小了,则分子之间互相碰撞的机会和次数 就会增多,甲醇合成反应速率也就会因此加快。因而,无论对于反应的 平衡或速率,提高压力总是对甲醇合成有利。但是,合成压力不是单纯 由一个因素来决定的,它与选用的催化剂、温度、空间速度、碳氢比等 因素都有关系。而且,甲醇平衡浓度也不是随压力的增加而成比例的增 加,当压力提高到一定程度也就不再往上增加。
上一页 下一页 返回
任务1 甲醇合成的工艺条件
另外,空速增大到一定程度后,催化床温度将不能维持。在甲醇合成生 产中,空速一般控制在10000~30000h-1之间。
综上所述,影响甲醇合成反应过程的工艺条件有温度、压力、气体组成、 空速等因素,在具体情况下,针对一定的目标,都可以找到该因素的最 佳或较佳条件,然而这些因素间又是互相有联系的。
任务1 甲醇合成的工艺条件
生产中合理的氢碳比应比化学计量比略高些,按化学计量比值,f值或 M值约为2,实际上控制得略高于2,即通常保持略高的氢含量。过量 的氢对减少羰基铁的生成与高级醇的生成,及延长催化剂寿命起着有益 的作用。
此外,原料气中含有一定量的CO2,可以减少反应热量的放出,利于 床层温度控制,同时还抑制二甲醚的生成。
三、低压法甲醇合成工艺流程 近年来,甲醇的合成,大多采用铜系低温高活性催化剂,可在5MPa
低压下将(CO+H2)合成气体或含有CO2的(CO+H2) 合成气 进行合成,并得到较高的转化率。
上一页 下一页 返回
任务2 甲醇合成的工艺流程
1.ICI低压法甲醇合成工艺流程 1966年,英国ICI公司在成功地开发了铜基低压甲醇合成催化剂
甲醇的合成

甲醇的合成甲醇的合成目录:1. 介绍甲醇2. 甲醇的合成方法3. 重要的反应路径4. 常见的合成催化剂5. 甲醇合成的条件和工艺6. 甲醇合成的应用和前景7. 结论1. 介绍甲醇甲醇,也被称为木精或甲醇酒精,是一种无色、具有特殊气味的化学物质。
它是一种普遍使用的化工原料和溶剂,并且在能源领域也有广泛的应用。
甲醇的化学式为CH3OH,是由一个碳原子、三个氢原子和一个羟基组成。
它是最简单的醇类化合物,也是一个重要的有机合成原料。
2. 甲醇的合成方法甲醇可以通过多种方法合成,其中最常用的方法是通过一氧化碳和氢气的反应,即加氢合成方法。
具体的反应方程式为:CO + 2H2 -> CH3OH甲醇合成还可以通过其他反应途径,如甲烷水合物的解离、天然气重整和生物质气化等。
3. 重要的反应路径甲醇的合成反应是一个复杂的过程,涉及多个反应路径。
在加氢合成法中,主要的反应路径包括气相和液相反应。
在气相反应中,一氧化碳首先与氢气进行反应生成甲醛,然后再通过一系列连续的加氢反应步骤转化为甲醇。
在液相反应中,催化剂通常会被溶解在金属盐中,一氧化碳和氢气在此种环境中发生反应生成甲醛和甲醇。
4. 常见的合成催化剂甲醇的合成需要使用催化剂来促进反应的进行。
常见的甲醇合成催化剂包括铜基催化剂、铁基催化剂和锌基催化剂等。
铜基催化剂是最常用的甲醇合成催化剂,它通常与锌和铝等辅助金属一起使用,以提高催化活性和选择性。
5. 甲醇合成的条件和工艺甲醇合成的条件和工艺对于实现高效、高选择性的合成过程至关重要。
一般来说,甲醇合成需要较高的压力(通常在几十到数百个大气压之间)和适当的温度(通常在180-280°C之间)。
反应过程中还需要适量的催化剂和反应物的比例,以及合适的反应时间。
6. 甲醇合成的应用和前景甲醇是一种重要的化工原料和燃料,具有广泛的应用前景。
它可以作为溶剂、反应试剂和合成化学品的原料,并可用于气体和液体燃料的制备。
甲醇合成工艺介绍ppt

甲醇具有强烈的刺激性气味,相对密度为0.791,熔点为-93.5℃,沸点为64.7℃ 。
甲醇在空气中最高允许浓度为500mg/m3,超过这个浓度会对人体健康产生危害 。
甲醇合成工艺的重要性
01
甲醇是重要的有机化工原料,可用于合成许多有机化合物,如 甲醛、乙酸、丙酮等。
化剂层。
高压气体也有利于提高 反应速度和转化率。
冷却器
冷却器用于将反应 后的高温气体降温 。
冷却后的气体返回 合成塔进行再次反 应。
一般采用管式或板 式换热器,使高温 气体与冷却水或制 冷剂进行热交换。
分离器
分离器用于分离出未反应的原料和副产品。
分离出的未反应的原料可再次进入合成塔进行反 应。
副产品则可作为其他化工产品的原料进行再利用 。
随着环保意识的提高和能源结构的调 整,甲醇合成工艺将面临更多的挑战 和机遇。
甲醇合成工艺流程
合成气制备
天然气蒸汽转化
将天然气与水蒸气反应,在高温高压下实现甲烷的 转化。
煤气化
通过煤与氧气反应生成合成气,为甲醇合成提供原 料气。
生物质气化
生物质在高温下气化生成合成气,实现生物质资源 的转化利用。
合成气净化
甲醇合成工艺的发展趋势与挑 战
新技术发展动向
新型催化剂
研发新型、高效、环保的催 化剂是未来的发展趋势,可 提高甲醇合成效率,降低能
耗和减少环境污染。
优化反应条件
通过优化反应温度、压力、 气体组成等条件,提高甲醇 合成反应的转化率和选择性
。
节能减排技术
发展新型节能减排技术,实 现甲醇合成工艺的绿色生产
甲醇合成工艺介绍

降低能耗的措施
能耗分析
对甲醇合成过程中的能耗进行详细分析,找出能耗高的环节。
节能设备与技术
采用高效换热器、回收余热等节能设备和技术,降低能耗。
能耗管理
建立能耗管理制度,加强能源利用监测与优化,提高能源利用效率。
环保与安全问题
废气、废水处理
对甲醇合成过程中产生的废气、废水进行妥善处理,防止 环境污染。
产物检测与纯化
合成得到的甲醇需要进行纯度检测和 提纯,以满足实验需求。
实验条件控制
实验室条件下,需严格控制反应温度、 压力、原料配比等参数,确保实验结 果的准确性。
生物质来源的甲醇合成工艺流程
生物质预处理
气化与合成
将生物质原料进行破碎、干燥、脱灰等预 处理,以去除杂质和提高原料的利用率。
生物质在高温条件下进行气化反应,生成合 成气(CO、H2),随后在催化剂的作用下 合成甲醇。
反应器优化设计
改进反应器设计,实现高效传热、传质和混合,降低能耗和物耗。
反应过程强化
采用微波、超声波等物理场强化技术,促进反应速率和产物分离效率。
绿色合成工艺的开发
低碳排放技术
开发低碳排放的合成工 艺,降低温室气体排放, 实现绿色可持续发展。
副产物回收利用
对合成过程中产生的副 产物进行回收利用,提 高资源利用率和经济效 益。
意识和环保措施的落实。
THANKS FOR WATCHING
感谢您的观看
精制后的甲醇可以作为产品进行储存和运输,以满足 市场需求。
03 甲醇合成工艺的优化与改 进
提高反应效率的方法
催化剂选择与优化
选用高效、稳定的催化剂,提高甲醇合成反应速率和选择性。
反应温度和压力控制
甲醇合成知识点总结

甲醇合成知识点总结甲醇,化学式为CH3OH,是一种重要的有机化合物,广泛应用于化工、医药和能源等领域。
甲醇的生产工艺涉及到催化剂、反应条件和设备工艺等多个方面,其合成过程常常使用天然气、煤化学、生物质和再生资源等原料。
本文将从甲醇合成的各个方面进行知识点总结,以便读者全面了解甲醇的合成工艺。
一、催化剂催化剂是催化合成甲醇的关键。
目前主要有铜基、铁基和锌基催化剂,铜基催化剂是目前工业上主要应用的催化剂,常用的铜基催化剂有铜锌氧化物、铜铬氧化物等。
在催化剂的研发过程中,提高催化剂的表面积、改善催化剂的稳定性和促进反应的选择性是重要的研究方向。
此外,还有氢气的压力、温度和氧化氢的浓度等对催化剂性能有重要影响,因此需要综合考虑这些因素,以提高甲醇合成的效率和产率。
二、反应条件甲醇的合成通常发生在高温高压的条件下,典型的反应条件为250-300°C的温度和50-100atm的压力。
在这些条件下,甲烷和一氧化碳在催化剂的作用下发生反应,生成甲醇和水。
此外,还有氧化氢的浓度、甲烷和一氧化碳的摩尔比等因素对甲醇的产率和选择性有重要影响。
因此,在甲醇的合成过程中,需要精确控制反应条件,以提高甲醇的产率和纯度。
三、设备工艺甲醇合成的设备工艺通常包括气相反应器、液相反应器、分离器、冷却器等设备。
其中,气相反应器是甲醇合成的关键设备,其结构和工艺参数直接影响甲醇的产率和纯度。
在甲醇合成过程中,气相反应器通常采用等温或非等温反应器,通过控制反应温度和压力,以实现甲醇的高效合成。
此外,还有催化剂的装载、物料的输送和产品的分离等与设备工艺相关的技术,需要综合考虑以提高甲醇的生产效率。
四、原料资源甲醇的合成原料主要包括天然气、煤化学、生物质和再生资源等。
天然气是甲醇合成的主要原料之一,通常通过甲烷重整制备一氧化碳和氢气,然后再进一步用作甲醇的合成原料。
煤化学是另一个重要的甲醇合成原料,煤气化产生的合成气,通过催化合成反应即可得到甲醇。
第六章6.2合成甲醇

1.概述: ⑴合成甲醇的发展 ①1923年、德国、BASF公司(巴斯夫公司)、甲醇高压合成法。 30~35MP,300~400℃. 锌铬基催化剂。 (锌铬基 锌铬基催化剂活动性较低,这种方法的缺点是动力消耗大、设备复 锌铬基 杂、产品质量差,目前已经淘汰。) ②1966年、英国、ICI公司(卜内门化学工业有限公司 )、低压合成 甲醇 5~10MP,230~280℃. 铜锌基催化剂 ③1971年、德国、Lurgi公司、低压合成甲醇法。 (铜锌基 铜锌基催化剂活性较高,低压合成与高压合成相比,设备简单、投 铜锌基 资节省、动力消耗低、原料消耗低、产品质量好,各方面均具有 显著的优越性,因而成为合成甲醇的唯一方法。)
特点: 这种形式的甲醇塔虽然结构简单,生产能力较大,催化剂装卸方便, 但是床层轴向温差大,出口浓度低,合成效率低。
⑵管壳式等温反应器
Lurgi低压管壳式甲醇合成 ★ 列管式结构,管程装填催化 剂,壳程加入沸腾水,水汽 化移走热量,反应温度由控 制反应器壳程中沸水的压力 来调节。
特点: 特点: 优点: 合成反应几乎是在等温条件下进行, 优点:①合成反应几乎是在等温条件下进行, 副反应少,粗甲醇杂质少; 副反应少,粗甲醇杂质少; 催化剂床层温度易控制, ②催化剂床层温度易控制,床层的温差 较小,操作平稳; 较小,操作平稳; 出口甲醇浓度较ICI高,总循环气量 ③出口甲醇浓度较 高 几乎少一半; 比ICI几乎少一半; 几乎少一半
⑶原料气组成 低压铜系催化剂:n(H2)/n(CO)=2.0~3.0, H2过量; (高CO:温度不宜控制,催化剂积羰基铁易失活;) 原料中一定CO2(5%):可降低峰值温度,可抑制 二甲醚的生成。
4.反应器 ⑴冷激式绝热反应器 ICI低压冷激式甲醇合成 ★移热:床层分为若干绝热段, 两段之间直接加入冷的原料 气,使反应气冷却。 ★催化剂由反应器上部装入口 加入,有下部卸出口卸出。
甲醇合成的原理及工艺

一、甲醇合成原理1、化学反应合成甲醇的主要化学反应为CO和H2在多相铜基催化剂上的反应:CO+2H2⇋CH3OH(g)-90.8kJ/mol反应气体中含有CO2时,发生以下反应:CO2+3H2⇋CH3OH(g)+H2O-49.5kJ/mol同时CO2和H2发生CO的逆变换反应:CO2+H2⇋CO+H2O(g)+41.3kJ/mol反应过程中除生成甲醇外,还伴随一些副反应的发生,生成少量的烃、醇、醛、醚、酸和酯等化合物。
这些副反应的产物还可以进一步发生脱水、缩合、酰化或酮化等反应,生成烯烃、酯类、酮类等副产物。
当催化剂中含有碱类化合物时,这些化合物的生成更快。
副产物不仅消耗原料,而且影响甲醇的质量和催化剂的寿命。
尤其是生成甲烷的反应为一个强放热反应,不利于反应温度的操作控制,且甲烷不能随着产品冷凝,在循环系统中循环,更不利于主反应的化学平衡和反应速率。
2、甲醇合成反应的特点(1)放热反应甲醇合成是一个可逆放热反应,为了使反应过程能够向着有利于生成甲醇的方向进行,适应最佳温度曲线的要求,达到较好的产量,需及时移走热量。
(2)体积缩小反应从化学反应可以看出,无论是CO还是CO2分别与H2合成CH3OH,都是体积缩小的反应,因此压力增高,有利于反应向着生成CH3OH的方向进行。
(3)可逆反应即在CO、CO2和H2合成生成CH3OH的同时,甲醇也分解为CO2、CO和H2,合成反应的转化率与压力、温度和氢碳比ƒ=(H2-CO2)/(CO+CO2)有关。
(4)催化反应在有催化剂时,合成反应才能较快进行。
二、甲醇合成催化剂随着英国ICI公司铜‐锌‐铝催化剂的研制成功,甲醇生产进入了低温(220~280℃)、中低压(5~10MPa)时代。
近年来,低压铜基催化剂的使用逐渐普遍,各种新型甲醇催化剂层出不穷,无论活性、选择性、寿命等各方面均大大超过前代产品,从而推动甲醇生产实现了长周期、低能耗、低成本运行。
1、铜基催化剂(1)CuO‐ZnO‐Al2O3催化剂英国ICI公司开发的CuO‐ZnO‐Al2O3催化剂是比较有代表性的铜基催化剂。
甲醇生产技术第六章甲醇合成

三、甲醇合成反应动力学
气-固相催化反应按控制阶段可划分如下。 (1)动力学控制 (2)外扩散控制 (3)内扩散控制
c Ag C AS C AC , C AC C A
c Ag C AS C AC , C AC C A
二、甲醇合成催化剂 的活性组分及促进剂
2.双组分氧化物混合催化剂 (1)氧化锌—氧化铬
(2)氧化铜-氧化锌
3.三组分氧化物混合催化剂
三、工业用甲醇合成催化剂
1.锌铬催化剂 (1)锌铬催化剂的制备
(2)锌铬催化剂的还原
2ZnCrO4·H2O+3H2=ZnO+ZnCr2O4+5H2O 2ZnCrO4·H2O+3CO=ZnO+ZnCr2O4+3CO2+2H2O 可将还原反应简写为 2CrO3·H2O+3H2=Cr2O3+5H2O
催化剂粒度为0.4mm,宏观动力学研究时使用的工业颗粒
催化剂。本征动力学的研究结果表明Natta方程式(6-11) 仍适用,但zn-Cr催化剂的活性是当时Natta 所用的催化 剂的四倍。在上述条件下,工业颗粒催化剂的宏观反应 速率可以下式表示
三、甲醇合成反应动力学
2.铜基催化剂上甲醇合成反应动力学 代表反应CO+2H2=CH3OH和CO2+H2=CO+H2O的反应速率(614)和(6-15)。
(3)锌铬催化剂的中毒和寿命
三、工业用甲醇合成催化剂
2.铜基催化剂 (1)铜基催化剂的制备 (2)铜基催化剂的还原 (3)铜基催化剂的中毒和寿命
(4)国外甲醇合成铜基催化剂一览表
原料气的脱碳及甲醇合成

第六章原料气的脱碳学习目的与要求:1.了解脱碳在甲醇生产中的意义。
2.掌握典型脱碳方法的基本原理。
能够对工艺条件的选择进行分析。
3.掌握典型脱碳方法的工艺条件的选择、工艺流程的组织原则及主要设备的结构与作用。
4.掌握典型脱碳方法中吸收剂的组成与再生原理。
5.明确技能训练的课题、目标和要求。
通过同步练习,使学生掌握脱碳生产的主要设备的结构、操作控制要点,生产工序的开停车操作、正常生产中异常现象的判断及故障的排除方法。
各种原料制取的粗原料气,经脱硫、变换后,仍然有相当量的二氧化碳。
CO2/CO之比高,气体组成不符合H2-CO2/(C O+ C O2)=2.1-2.2甲醇和成的要求。
因此,必须脱除大部分二氧化碳。
工业生产中脱除二氧化碳的方法很多,一般采用溶液吸收法。
根据吸收剂性能不同可分为物理吸收法、化学吸收法和物理化学吸收法三大类。
化学吸收法常用的方法有氨水法、改良热钾碱法(如:本菲尔法)等;物理吸收法一般用水和有机溶剂为吸收剂,常用的方法有加压水洗法、碳酸丙烯酯法、低温甲醇法、聚乙二醇二甲醚法(NHD法)等;物理化学吸收法兼有物理吸收和化学吸收的特点,方法有环丁砜法,甲基二乙醇胺法(MDEA法)等。
这些方法都可用于甲醇生产中。
第一节低温甲醇洗脱除二氧化碳一、基本原理1.甲醇的性质甲醇是一种无色、易挥发、易燃液体。
结构式为CH3OH,相对分子质量为32,凝固点-97.8℃、沸点64.7℃(0.1MPa),它能与水以任何比例混溶。
甲醇有毒,人服10ml能使双目失明,服30ml可致死亡。
在空气中的允许浓度为50mg/m3。
甲醇是一种具有极性的有机溶剂,化学性质稳定,不变质,不腐蚀设备。
2.吸收原理甲醇吸收二氧化碳是一个物理吸收过程,它对二氧化碳、硫化氢等酸性气体有较大的溶解能力,而粗原料气中的一氧化碳在其中的溶解度很小。
因此用甲醇吸收原料气中的CO2、H2S等酸性气体,而CO的损失很少。
二氧化碳在甲醇中溶解度的大小与温度和压力有关。
甲醇合成工艺

日本三菱瓦斯化学公 司开发的甲醇生产技 术,操作压力15 MPa 左右。图6-8为该公 司新泻工场的甲醇生 产流程。以天然气为 原料经镍催化剂蒸汽 转化后的合成气加压 到14.5 MPa,与循环 气混合,在循环段增 压至15.5MPa送入合 成部分。
第二节 甲醇合成工艺流程
• 操作温度为250~280℃,反应后的出塔气经换热、冷凝后至甲 醇分离器,分离出的粗甲醇送往精馏部分。 • 分离器出口气体大部分循环,少部分排出系统供转化炉燃料 用,流程中还设有开工加热器。 • 出合成塔的气体经热交换器换热后进废热锅炉副产 0.3MPa低 压蒸汽。催化剂使用寿命3~5年,但该厂一般两年更换一次, 因催化剂使用后期乙醇含量急剧上升,就需要更换了。
下面以英国某公司以天然气为原料的低压甲醇合成工艺为例说明。
第二节 甲醇合成工艺流程
第二节 甲醇合成工艺流程
• (2)Lurgi低压甲醇合成流程
• 以减压渣油为原料,在6MPa压力下用部分氧化法造气采用石脑
油萃取法回收炭黑,在常温下采用Amisol法脱硫、脱CO2。吸收液 为甲醇溶液中加二乙醇胺,气体净化度高,净化气一部分宜接进入 合成系统,另一部分经过CO高温变换,变换气经常温Purisol法脱 碳,以N-甲基吡咯烷酮脱除部分CO2,然后在5MPa压力下等压合
第二节 甲醇合成工艺流程
表6-4 I.C.I法和Lurgi法比较
项目 1.合成压力,MPa 2.合成反应温度,℃ 3.催化剂成分 I .C.I法 5(中压法10) 230~270 Cu-Zn-Al Lurgi法 5(中压法8) 225~250 Cu-Zn-Al-V
4.空时产率,t/m3•h
5.进塔气中CO含量,%
0.33(中压法0.5)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CO+2H2=CH3OH(g) CO2+H2=CO+H2O(g) CO+2H2=CH3OH(g)
△H= -90.8kJ/mol
①
当有CO2存在时,CO2按下列反应生成甲醇: △H= +41.3kJ/mol △H= -90.8kJ/mol ② ③
上述②、③两步的总反应式为: CO2+3H2=CH3OH(g)+H2O(g) △H= -49.5kJ/mol
2、甲醇催化剂的工艺影响
⑴停车 在开停车次数较多时,如处理不当将使催化剂活性受到损 害。
停车时气氛对催化剂活性的影响
试验号 停车后反应器 中气氛 I CO+H2 停车时间 h 12 停车前催 化剂活性 16.5 停车后催 化剂活性 12.17
II
含2%H2的N2
16
16.99
16.75
3、催化剂寿命
甲醇的合成; 甲醇的冷凝分离; 气体的循环以及新鲜气的补充与惰性气的排放。
甲醇合成工序的基本流程示意图
ICI低压甲醇合成工艺流程
工艺流程特点:低温低压操
作,节省能耗,同时抑制甲烷 化反应及其他副反应;采用多 段冷激式合成塔,结构简单, 催化剂装卸方便,使用寿命长。
Lurgi低压甲醇合成工艺流程
甲醇典型合成催化剂性能对比
国家或 公司 英国 ICI 德国 BASF 德国 Lurgi 丹麦 Topsφ e 美国 UCI 苏联 中国 型号 51-1 51-2 51-3 S3-85 组成(%) CuO 48.75 45.41 35.4 ZnO 24.0 24.94 44.25 Al2O3 8.42 8.72 2.68 Cr2O3 V 2O 5 规格(mm) Ф 5.4×3.6 Ф 5.4×3.6 Ф 5×5 操作条件 压力(MPa) 温度(℃) 5.0 5.0~10.0 5.0 210~270 210~270 220~280
③提高脱硫效率,使入塔气中总硫含量控制在0.1ppm以下;
④适当提高新鲜气中CO2的含量。
⑶开停车频繁
①不管如何精心操作,在停车过程中不可避免地总会损害催 化剂的活性,如处理不当,未及时置换合成塔内的原料气, 将使催化剂的活性受到严重损害。为此,在使用过程中应 力求避免不必要的开停车。 ②在装置停车期间,用于保护催化剂的N2中含有少量O2,
甲醇合成反应须在催化剂存在下,进行反应。
即使这样的条件下, 甲醇合成反应的收率 也只有5-10%。
合成气的循环使用, 且在循环前须将甲醇 分离下来。
在操作上,要求催化剂床层的温度易控制,调节灵
活,合成反应的转化率高,催化剂的生产强度大,能以 较高能位回收反应热,床层中气体分布均匀,压降低;
在结构上,要求简单紧凑,高压空间利用率高,触媒
装卸方便;
在材料上,要求具有抗羰基化物及抗氢脆的能力; 在制造、维修、运输、安装上要求方便。
ICI多段冷激型甲醇合成反应器
MHI/MGC 管壳-冷管复合型反应器
主要甲醇合成塔特征比较
合成塔 类型 Lurgi合 成塔 ICI激冷合 成塔 Casale合成 塔 高空隙率 冷激合成 塔 Topsφe合成 塔 MRF合成 塔 常规 流化床 合成塔 循环 流化床 合成塔
气体流 动方式
轴向
轴向
轴径
轴向
径向
径向
轴向
轴向
控温 方式
副反应产物:成烃、高碳醇、醚、醛、酸、酯及单质碳等;
甲醇合成反应机理
铜基催化剂中的活性成份—溶解于氧化锌中的Cu2+;
Cu2+/ Cu 的比例取决于反应气体中CO2和CO 比例,即一
定比例内有促进作用;存在于催化剂所有物相中,以 铜-氧化锌固熔体上的活性组分最好;
甲醇合成首先是H2、CO和CO2 在铜基催化剂上的竞争性吸 附,然后合成甲醇。
52~54 38.0 >50 -
26~28 18.7 >25 -
5~6 3.8 ~4 -
22.8 -
~3 -
5.0~15.0 5.0 25~32 5.0~10.0 5.0
210~290 210~280 250~280 210~280 210~280
甲醇催化剂的使用
⑴催化剂的装填
除按常规方法装填催化剂外,还应注意以下几点: ①催化剂强化较差,运输途中避免摔滚和碰撞; ②装填前,催化剂应轻轻过筛,除去粉末与碎片; ③采用撒布法装填,尽可能降低催化剂自由下落高度; ④不要在阴雨天装填,以免催化剂吸潮而降低活性。催化剂 装填后应立即上盖密封,进行升温还原,否则应很好的将合 成塔封闭起来。 ⑤装填时防止催化剂颗粒入塔周环隙、温度计套管与中心管 等。
⑴催化剂中毒
,硫是最 常见的毒物,也是引起催化剂活性衰退的主要因素。 原料气中的硫一般以H2S和COS形式存在,通常认为H2S 和活性组分铜起反应,使其失去活性,其反应式为: H2S+Cu=CuS+H2 在合成甲醇的反应条件下,COS会分解成H2S而使催 化剂中毒: COS+H2=CO+H2S
优点:床层阻力小、传热系数高、单程转化率 高(出口甲醇浓度可达到8.5%)、催化剂寿 命长等。
Linde等温型甲醇合成反应器
结构特点:Linde等温型甲醇合成反 应器结构与高效螺旋盘管换热器类 似 ,盘管内为沸水,盘管外放置催 化剂,反应热通过盘管内沸水移走 。
该反应器的主要优点:基本上在等 温下操作,可防止催化剂过热,催 化剂易还原,操作简单,反应器触 媒体积装填系数大,冷却盘管与气
为防止还原过分剧烈,床层温度猛涨,使催化剂烧结而失
去活性,一般采用低氢还原,以惰性气体(如N2)作为稀
释气体,氢浓度为1-2%。低氢还原法注重在温和条件下 进行还原,操作稳妥可靠,床层温度便于控制,有利于提
高催化剂的活性,保护催化剂的强度;不利之处为还原时
间较长,一般约80-100h,高纯氮不易获得。
S3-86 CL104
LMK-2
70.0 57.19
36.0
28.63
37.0
1.73
-
20.0
5.04
-
Ф 5×5
Ф 4.5×4.5 Ф 6.4×3.2 Ф 5×5 Ф 5×5.9×9 Ф 5×5 Ф 5×5
4.0~10.0 5.0
5.0~15.0
200~300 210~270
210~290
C79-2 CHM-1 CHM-2 CNJ202 C301
每个催化剂都有一个活性温度,在这个温度范 围内,催化剂才能与反应物结合,发挥作用。
锌-铬系Zn-Cr: 385-420℃
Cu-Zn-Al : 240-400℃
需要对反应物加热, 到催化剂的活性温度
铜基催化剂的特点
根据催化剂厂家提供的有关催化剂活性的数据,随着催化剂使 用时间的延长,其活性会逐渐下降。比如,使用四年后〔48个 月)后,即使在低温操作的情况下,其活性仅能达到新催化剂的 45%—50%。在这种情况下,粗甲醇产量必然下降。
H2、CO在催化剂表面存在竞争吸附
初始表面配合物为:HCO*
CO氢加合成甲醇的反应历程假设如下:其中“*”是 催化剂的活性位。
反应中步骤(a)和(b)是甲醇合成总反应速率的控制步骤
甲醇催化剂
催化剂的两大特点: (1)反应前后其物理、化学性质不变 (2) 改变了反应历程,加快反应速度
催化剂种类:
回收 热量
冷激
气气 换热
冷激
外部 换热
回收 热量
回收 热量
回收 热量
生产能力(t/d) 碳效率(%) 催化剂相对体积
1500 -
2300 98.3 1
5000 99.3 0.8
7600 94.3 2.4
5000 0.8
>10000 0.8
3200 98.0 -
9000 99.0 -
甲醇合成工序的基本流程 基本流程主要包括:
也会造成部分催化剂钝化,从而引起催化剂活性缓慢下降。
(4)孔径分布的改变。催化剂孔径分布是其活性和选择性的重要
影响因素。如,特定大孔对特定反应起作用。催化剂比表面积和Cu比
表面积减小造成催化剂失活。
活性降低的表现:热点温度开始下移甲醇、产量降低、杂质 增多。
§甲醇合成反应器
甲醇合成反应器的基本要求
⑵热老化
铜基催化剂耐热性也较差,甲醇催化剂的一般在250-
300℃温度下操作,要求维持催化剂在最佳的温度下操 作。在运行期间,铜微晶逐渐长大,催化剂比表面积和 Cu比表面积减小而引起活性下降,使用温度的提高将 加速铜晶粒长大的速度,即加快活性衰退的速度。
防止热老化的一些措施:
①在还原、开停车过程中按预定的指标小心操作,防止超 温; ②在保证产量及稳定操作的前提下,尽可能降低操作温度, 每次提升热点温度应慎重,提升幅度不宜过大,一般以 5℃为好;
②高氢还原
针对低氢还原的缺点,有的厂采用高氢还原,以精制气作为 还原气体(含H260-70%)。 采用严格控制床层温度的方法,以出水量为指标,控制还原 过程的进行。 优点是:还原时间较短,一般为40h,气源容易获得,对催
化剂使用寿命短、更换频繁的生产厂比较合适;
不足:操作必须十分细心严格,稍有不慎将引起催化剂床层 剧烈超温而导致催化剂失活报废,另外,催化剂强度易受到 损害,造成催化剂部分粉化而引起床层压力降增加。
ICI多段冷激塔 结构特点: 反应床层由若干绝热段组成,两段之间通 入冷的原料气,使反应气体冷却,以使 各段的温度维持在一定值; 塔体是空筒,塔内无催化剂筐,催化剂 不分层,由惰性材料支撑,冷激气体喷 管直接插入床层,并有特殊设计的菱形 冷却气体分布器; 优点:单塔操作能力大,控温方便,冷激 采用菱形分布器专利技术,催化剂层上下 贯通,装卸方便; 缺点:催化剂床层温差较大(轴向:~ 70℃,径向:~23℃)、有部分气体与未 反应气体之间的返混、催化剂时空产率不 高,用量较大、单程转化率较低。
