转基因大豆定性检测方法介绍详解
实验三 PCR-荧光探针法鉴定转基因大豆

实时荧光定量PCR Quantitative Real-Time PCR
(一)Real-time qPCR原理
实时定量PCR原理
• 实时定量PCR技术(real-time quantitative PCR) 是指在PCR反应体系中加入荧光染料,实时监测 荧光染料 整个PCR过程中荧光信号的累积强度,并利用特定 数学原理对未知模板进行定量分析的方法。
基因组DNA分离纯化中的注意事项
保证基因组DNA的完整性和纯度 提高DNA的洗脱效率 DNA的储存
(二)转基因大豆鉴定 — CaMV35S基因核酸检测试剂盒杂交试剂盒
• 采用实时荧光PCR技术,针对CaMV35S基因核 酸序列设计特异性引物和荧光探针,通过实 时荧光PCR(Taqman探针法)对转基因成分 CaMV35S基因进行检测。
特异性高 多重PCR检出
要求反应的特异性 不能进行多重PCR
Probe设计要求高 Probe合成费用高
常用于mRNA表达量分析等
常用于SNP解析,病毒、病原菌检测
(三)Real-Time qPCR主要概念
非探针 扩增曲线
化学原理
实时定量PCR
两个重要图形
探针
熔解曲线
Real-Time qPCR曲线的意义
106 105 104 103 102 10
荧光强度---循环数曲线
初始模板量对数---C(T)循环数标准曲线
三、实验内容
• 大豆DNA提取 • PCR-荧光探针法检测CaMV35S基因
四、实验材料和用品
大豆 大豆DNA提取试剂盒 CaMV35S基因核酸检测试剂盒 仪器:荧光定量PCR仪 台式离心机等
DePure Plant DNA Kit 基于硅胶 柱纯化方式。样品经液氮或研磨仪匀 浆后,在裂解液中裂解,DNA 释放到 裂解液中。经高盐溶液沉淀去除多糖 等杂质后,加入乙醇,转移至柱子中 过滤,DNA 被吸附到柱子的膜上,而 蛋白质则不被吸附而去除。柱子经 Buffer GW2 洗涤去除盐分,最后 DNA 经 Buffer AE洗脱。
食品中转基因成分检测(大豆)

食品中转基因成分检测第12章ELISA方法定量检测抗农达® (RoundupReady®) 转基因大豆F.Eyquem食品中转基因成分检测 第12章2ELISA 方法定量检测抗农达® (Roundup Ready®) 转基因大豆 目 录第12章ELISA 方法定量检测抗农达® (Roundup Ready®) 转基因大豆引言 3酶联免疫吸附分析 (ELISA) 技术 7 实验部分 10参考文献 20食品中转基因成分检测 第12章3ELISA 方法定量检测抗农达® (Roundup Ready®) 转基因大豆 引言本章介绍一种用免疫学技术检测转基因植物的方法,这种方法是基于对转化事件中转入基因产生的新蛋白的检测。
但是,值得注意的是,基因修饰并不总是直接特异地对应于产生新蛋白,蛋白表达量水平也并不总是足够用于检测的目的。
另外,某些蛋白可能仅在植物的特定部位表达 (如:组织特异性启动子),或者在不同部位或不同生理时期其表达量水平也不一样。
有报道称植物中转基因产物表达量水平占总可溶性蛋白的0~2%,甚至在一些强启动子植物中也是如此 (Longstaff ,1995)。
然而,在许多情况下,文献资料报道的转入基因蛋白表达量水平 (如:批准的GM 作物) 一般低于2%的表达上限 (henner ,1997)。
免疫学分析是一种用抗体作为检测试剂的分析测定系统。
抗体是一种从动物血清中分离得到的特异性蛋白,它可特异性地结合于诱导它们产物的底物,即抗原。
抗体的制备是通过将待检测的底物 (如:CP4 EPSPS ,是一种产生农达除草剂抗性的蛋白) 注射到动物如兔子或者老鼠体内,然后动物体内的细胞会将此底物识别为外来物质并产生抗体与之对抗。
抗体经过纯化,并用可检测的标记与之连接,然后可作为检测目标底物的试剂。
免疫学检测方法发展和应用的先决条件是:得到可直接和待检测新蛋白作用的高特异性抗体。
基因芯片法对转基因大豆及其产品物种结构特异性基因的定性检测

基因芯片法对转基因大豆及其产品物种结构特异性基因的定性检测(一)适用范围转基因大豆(GTS-40-3-2)及其加工产品由单一作物种类组成的物种结构特异性基因的定性检测。
(二)试验原理通过多重PCR扩增和基因芯片技术,可以检测转基因大豆(GTS-40-3-2)及其加工产品中由单一作物种类组成的物种结构特异性基因。
(三)术语基片:基因芯片中用于固定探针的基质,通常采纳标准的“载玻片或其他固体载体”,经过化学修饰制备而成。
基因芯片探针:基因芯片中固定于基质表面、能与样本DNA互补、用于探测样本DNA信息的核酸分子,本部分采纳寡核苷酸片段作探针。
定位探针:是一段与待测基因无关的,通过和标志的定位探针互补链杂交显示信号,用于点样矩阵的位置确实定。
阳性质控探针:用于样品抽提、PCR、杂交的反应体系的监控,普通用生物的管家基因来设计阳性质控探针。
阴性质控探针:是一段与待测基因无关的寡核苷酸,用于基因芯片非特异性杂交背景的监控。
基因芯片空白质控点:由不含核酸的点样液点制而成,用于基因芯片杂交背景的监控。
目标基因探针:用于检测目标基因序列的探针。
信噪比:是杂交信号值与杂交背景值的比值,由图像分析软件自动判读。
(四)主要试剂用法的试剂应为不含DNA和DNase的分析纯或生化试剂。
(1)点样液0.2mol/L。
(2)基因芯片洗脱液0.2% SDS。
(3)基因芯片杂交液1 % SDS, 10×SSPE。
(4)阴性目标DNA对比不含外源目标核酸序列片段的模板。
可用法阴性标准物质,并与测试样品等同处理举行核酸提取及PCR扩增。
(5)CTAB提取缓冲液(pH 8.0)称取4.00g CTAB, 16.38g,2.42g Tris,1.50g EDTA二钠,4.00g PVP-40,用适量水溶解后,调整pH,定容至200mL,高压灭菌。
临用前按用法量加入,使终浓度为2%。
(6)引物和探针转基因大豆的引物序列和探针序列如表5-19所示,对比的引物和探针序列如表5-20所示。
转基因大豆

转基因大豆摘要:本文主要研究转基因大豆,主要包含转基因大豆的抗药性原理,转基因大豆存在的隐患及危害,转基因大豆的检测,转基因大豆的生产现状与趋势关键词:转基因大豆转基因技术是将人工分离和修饰过的基因导入到生物体基因组中,由于导入基因的表达,引起生物体的性状的可遗传的修饰,这一技术称之为转基因技术(Transgene technology)。
1996年春,美国伊利诺伊西部许多农场主种植了一种大豆新品种——转基因大豆,这种大豆是移植了矮牵牛的一种基因,这个新大豆品种可以抵抗杀草剂——草甘膦(毒滴混剂)而草甘膦会把普通大豆植株与杂草一起杀死。
原理:转基因大豆的研制是为了配合草甘膦除草剂的使用。
除草剂有选择性的和非选择性的,草甘膦是一种非选择性的除草剂,可以杀灭多种植物,包括作物,这样,虽然这种除草剂的效果很好,但是却难以投入使用。
草甘膦杀死植物的原理在于破坏植物叶绿体或者质体中的EPSPS合成酶。
通过转基因的方法,让植物产生更多的EPSPS 酶,就能抵抗甘草膦,从而让作物不被草甘膦除草剂杀死。
转基因大豆油对人体危害:1、转基因大豆及产品会引起跨物种感染,使人类感染动物的疾病,带来严重灾难。
转基因食品中引入特定的基因或病毒,为跨物种感染埋下了通道。
转基因食品引起跨物种感染的破坏性非常严重,不得不加倍慎重对待。
2、转基因大豆及其产品会损害人体的内部系统。
转基因大豆的组成物质与非转基因大豆相比有较大的变化,如植物凝血素提高了约1倍,蛋白酶抑制剂高26.7%,而蛋白质和苯丙氨酸明显下降,维生素B2复合体胆碱的含量低29%等,这些组成物质的变化可能会使人体生长缓慢,使人身材矮小;转基因大豆还含有一种类似雌性激素钓化学物质,它会破坏人体荷尔蒙,导致人体生殖器官异常,并损害免疫系统。
此外,有证据表明,转基因大豆食品与非霍奇淋巴瘤发病率的提高具有一定相关性。
3、转基因大豆及其产品可能对人体产生过敏反应。
全世界有近2%的成年人和4%—6%的儿童发生过食品过敏,而90%的过敏是由蛋、鱼、贝壳、奶、花生、大豆、坚果和小麦8种食物引起的。
实验三 大豆中转基因成分定性PCR检测

大豆中转基因成分定性PCR 检测一、 实验目的 (1)DNA 的原理和操作技术。
(2)DNA 的纯度、含量与分子大小。
(3)学习PCR 的基本原理和操作方法。
(4)掌握高速冷冻离心机、微量移液枪、水平电泳仪、PCR 仪等仪器设备的使用。
二、 实验原理由于现有的商品化转基因产品中绝大多数含35S 启动子和NOS 终止子。
故转基因食品的检测一般基于聚合酶链式反应(PCR)35S 启动子和NOS 终止子进行筛选。
聚合酶链反应(PCR)是近年来常用的一种快速、灵敏的检测转基因产品的方法,但要求待分析的基因组DNA 样品尽可能纯化。
PCR 技术的基本原理类似于DNA物。
PCR 由变性、退火、延伸三个基本反应步骤构成。
三、 PCR 引物设计表1 引物序列及扩增产物长度四、 转基因大豆抗草甘膦转基因大豆品种京引D-1 、京引D-2 、京引D-3 、京引D-4获市面上购买的转基因大豆,万能粉碎机粉碎。
五、 DNA 的提取 1、称取约0.1g 2ml 离心管中;2、加入600μl CTAB(十六烷基三甲基溴化铵)缓冲液震荡均匀,65℃水浴保温30min;3、加入500μl 酚:三氯甲烷:异戊醇(25:24:1),振荡均匀,12000r/min离心15min;4、吸取上清液,放入另一新管中加入500ul的异丙醇,12000r/min离心10min。
5、弃去上清液,加入70%乙醇溶液洗涤,12000r/min离心1min。
6、弃去上清液,干燥,用50μl TE缓冲溶液溶解沉淀。
7、加入5μl RNA酶溶液,37℃水浴保温30min。
8、加入400μl的CTAB缓冲溶液,振荡均匀。
9、加入250μl的三氯甲烷:异戊醇(1:1),振荡均匀,12000r/min离心15min。
10、吸取上清液,放入另一个新管中,加入200μl的异丙醇,12000r/min离心10min。
11、弃去上清液,干燥,用50μl TE缓冲液溶解沉淀。
如何检测转基因大豆

PCR检测转基因大豆:[目的]定性检测转基因大豆。
[方法]以非转基因大豆和CP4-EPSPS转基因大豆为材料,以大豆内源基因Lectin和外源基因5-莽草酸-3-磷酸合成酶基因(CP4-EPSPS)为检测的目的片段,建立PCR反应体系。
采用改进CTAB法提取大豆基因组DNA,并对所提DNA进行PCR扩增和电泳检测,确定转基因大豆的PCR检测限。
实时荧光定量PCR技术检测转基因大豆方法的建立:采用实时荧光定量PCR技术,通过使用特异的引物和探针,对大豆中的内源基因Lectin和转基因大豆中的外源基因EPSPS进行了定量检测,建立了Monsanto公司生产的商业化转基因大豆Roundup Ready○R的定量PCR检测方法。
该方法的检测灵敏度<001%,是国际上设定的转基因最低限量的100倍用巢式和半巢式PCR检测转基因大豆Roundup Ready及其深加工食品:用从转基因大豆(Glycinemax )颗粒中提取的DNA作为模板,经过稀释,形成不同浓度梯度的DNA溶液,然后用巢式和半巢式PCR进行扩增反应。
结果表明,巢式和半巢式PCR均可以扩增DNA浓度为10-14g/μL的溶液。
用巢式和半巢式PCR对市场的食品原料和深加工食品进行检测,可以从大豆油、酱油、面酱、大豆磷脂、豆腐、豆浆等食品原料和深加工食品的17个品牌的食品中检测出大豆内标基因(housekeepinggene)。
ELISA方法定量检测转基因大豆及其产品的研究:以美国、阿根廷、巴西转基因大豆等为材料,建立了ELISA法定量检测抗草甘膦转基因大豆CP4 EP- SPS蛋白的方法,成功检测出美国转基因大豆含量为3.768%、阿根廷转基因大豆含量为2.820%、巴西转基因大含量为1.920%,转基因豆粉、转基因豆粕和中国大豆未检测到CP4 EPSPS蛋白。
此方法具有简便、快速、稳定等优点,其检测灵敏度可达到0.0075%,并且稳定性良好,为抗草甘膦转基因大豆中CP4EPSPS蛋白的定量检测提供了有效的手段。
豆粉中大豆转基因成分检测能力验证项目检验方法分析
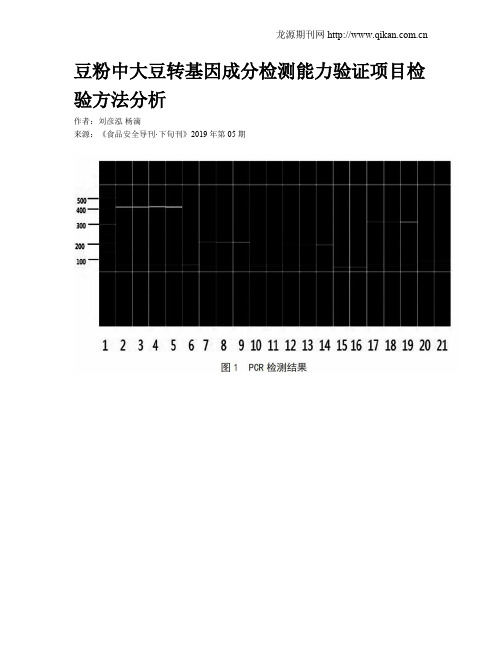
豆粉中大豆转基因成分检测能力验证项目检验方法分析作者:刘彦泓杨滴来源:《食品安全导刊·下旬刊》2019年第05期摘; 要:为进行能力验证,以阳性样品转基因大豆GTS40-3-2为例,采用普通PCR和实时荧光PCR两种检测方法进行检测,得出准确的定性检验结果,。
针对PCR实验中容易出现假阳性的情况,给出避免污染的建议,采取正确的应对措施。
同时建议选择两种以上检验方法,比较后得出检验结论。
关键词:转基因大豆;定性检测;能力验证能力验证已经成为实验室质量控制的常用方法之一,其在确定实验室检测或校准能力方面具有不可替代的作用。
中国合格评定国家认可委员会(CNAS)要求已认可的实验室和申请认可的实验室必须参加能力验证活动。
转基因抗草甘膦除草剂(Roundup Ready® )大豆(即转基因大豆GTS-40-3-2)是目前种植面积和产量都很高的转基因作物,实验室开展此项目的检测能力验证,既可以提高实验室的检测技术能力与水平,也有利于提高实验室对转基因大豆进行监管的能力。
1 材料与试剂1.1 试验样品转基因大豆GTS40-3-2样品:中检院NIFDC-PT-136豆粉中大豆转基因成分测定能力验证阳性样品。
1.2 主要试剂DNA提取试剂盒(Magnetic DNA Purif ication System For Food),购自Promega公司;PCR 反应试剂盒TaKaRa Ex Taq®; DNA Polymerase、Premix Ex Taq™ (Probe qPCR),购自Takara Bio公司。
1.3 引物及探针序列引物及探针购自Takara Bio公司,引物及探针序列见SN/T1195-2003[1]和GB/T19495.5-2018[2]。
2 方法2.1 模板DNA的提取采用Promega公司Magnetic DNA Purif ication System For Food试剂盒说明书进行提取。
转基因大豆食用安全性探究及检测

摘要由于基因工程技术的迅速发展,于是食品工业中产生了转基因食品,但是转基因食品的食用安全性一直受到人们的质疑。
本文对转基因大豆进行了概述,并介绍了转基因大豆在食用中可能产生的安全性问题以及一些与转基因大豆安全性相关的实验探究,然后总结了转基因大豆的一些检测技术。
最后对转基因大豆食用安全性的评价方法作了展望。
关键词:转基因大豆安全性基因AbstractAs the rapidly development of genetic engineering technology technology,it is applied to the food industry to produce a genetically modified food but the genetically modified food safety has been questioned.This paper describes the safety problems in the consumption of transgenic soybean and some security exploration experiments about transgenic soybeans,and summarizes the safety evaluation of these issues and testing methods.Keywords:transgenic soybean; security; gene目录1 转基因大豆概述 (1)2 转基因大豆的安全性 (1)2.1 外源基因毒性 (1)2.2 抗药性 (1)2.3 过敏性 (2)2.4 产生有毒物质 (2)2.5 转基因大豆营养组成及生物利用率的变化 (2)2.6 抗营养因子的变化 (2)3 转基因大豆食用安全性的实验探究 (2)3.1 转基因与非转基因大豆营养及次生物质的比较 (2)3.2 转基因大豆对雄性鼠生殖系统的安全性评估 (2)3.3 转基因大豆膳食纤维食用安全性研究 (3)3.4 摄食转基因大豆罗非鱼各组织中转基因成份的检测研究 (3)4 转基因大豆检测技术 (3)4.1 蛋白质检测 (4)4.2 核酸检测 (4)5 展望 (5)参考文献 (6)转基因大豆食用安全性探究及检测技术转基因技术是指将外源基因通过生物、物理或化学手段导人其他生物基因组,以获得外源基因稳定遗传和表达的遗传改良体的技术。
如何检测转基因大豆

PCR检测转基因大豆:[目的]定性检测转基因大豆。
[方法]以非转基因大豆和CP4-EPSPS 转基因大豆为材料,以大豆内源基因Lectin和外源基因5-莽草酸-3-磷酸合成酶基因(CP4-EPSPS)为检测的目的片段,建立PCR反应体系。
采用改进CTAB法提取大豆基因组DNA, 并对所提DNA进行PCR扩增和电泳检测,确定转基因大豆的PCR检测限。
实时荧光定量PCR技术检测转基因大豆方法的建立:采用实时荧光定量PCR技术 ,通过使用特异的引物和探针 ,对大豆中的内源基因Lectin和转基因大豆中的外源基因EPSPS进行了定量检测 ,建立了Monsanto公司生产的商业化转基因大豆Roundup Ready○R 的定量PCR检测方法。
该方法的检测灵敏度 <0 0 1% ,是国际上设定的转基因最低限量的 10 0倍用巢式和半巢式PCR检测转基因大豆Roundup Ready及其深加工食品:用从转基因大豆(Glycinemax )颗粒中提取的DNA作为模板,经过稀释,形成不同浓度梯度的DNA溶液,然后用巢式和半巢式PCR进行扩增反应。
结果表明,巢式和半巢式PCR均可以扩增DNA浓度为10-14g/μL的溶液。
用巢式和半巢式PCR对市场的食品原料和深加工食品进行检测,可以从大豆油、酱油、面酱、大豆磷脂、豆腐、豆浆等食品原料和深加工食品的17个品牌的食品中检测出大豆内标基因(housekeepinggene)。
ELISA方法定量检测转基因大豆及其产品的研究:以美国、阿根廷、巴西转基因大豆等为材料,建立了ELISA法定量检测抗草甘膦转基因大豆CP4 EP- SPS蛋白的方法,成功检测出美国转基因大豆含量为3.768%、阿根廷转基因大豆含量为2.820%、巴西转基因大含量为1.920%,转基因豆粉、转基因豆粕和中国大豆未检测到CP4 EPSPS蛋白。
此方法具有简便、快速、稳定等优点,其检测灵敏度可达到0.0075%,并且稳定性良好,为抗草甘膦转基因大豆中CP4 EPSPS蛋白的定量检测提供了有效的手段。
转基因大豆A5547—127品系成分LAMP快速检测方法的建立

2 . G u a n g d o n g I n s p e c t i o n a n d Q u a r a n t i n e T e c h n o l o y g C e n t e r , G u a n g z h o u 5 1 0 6 2 3 , G u a n g d o n g , C h i n a ;
摘 要: 根 据 转基 因大 豆 A 5 5 4 7 — 1 2 7品 系外 源 插 入 片段 与植 物基 因组 序 列 设 计 品 系特 异 性 引 物 , 筛选 最 佳 引物 并 对
反 应 体 系和 反 应 条 件 进 行 优 化 , 最 终 建 立 了转 基 因大 豆 A 5 5 4 7 — 1 2 7品 系成 分特 异 性 L A MP的 快速 检 g , C h i n a )
Abs t r a c t :Ac c o r d i n g t o e x o g e n o u s i n s e r t s e q u e n c e s c o n n e c t i o n wi t h t h e p l a n t g e n o me s e q u e n c e s o f t r a n s g e n i c
o f Tr a n s g e n i c S o y b e a n A5 5 4 7 -1 2 7 Co mp o ne n t
转基因大豆定性检测方法介绍

Upper signal: GMO
Lower signal: Control
Lane M:100bp DNA Ladder Marker Lane 2: Non GMO Soybean Control Lane 4: GMO Soybean Control 1% Lane 6: GMO Soybean Control 100% Lane 8: Sample 1 Lane 10: Sample 1
转基因大豆定性检测方法介绍
1பைடு நூலகம்检测样品:
豆粕,编号:sample 1、sample 2、sample 3、 sample 4
2、核酸提取: 各取5g样品,分别用研钵研磨至粉末状,再各取 0.5g作为实验材料,使用试剂盒提取基因组DNA(结果 见图1)。
3、检测方法: 转基因大豆定性PCR检测方法
图1 样品提取基因组DNA电泳图 Lane1: Sample 1 Lane3: Sample 3 M: λ-HindIII digest Lane2: Lane4: Sample 2 Sample 4
1.2 仪器及试剂
仪器: TaKaRa PCR Thermal Cycler DICE (TaKaRa Code:TP600) (TaKaRa 试剂: PCR Screening Kit for GM Soybean Ver.2.0 Code:DRR201A) 1.3 扩增基因及片断长度 重组基因 : CP4 EPSPS
dH2O
24 μI
50μI
反应条件:
94℃ 94℃ 5min 30sec
60℃
72℃
72℃ 1、5 检测结果
30sec
1min
10min
40Cycles
ncu创新学分转基因大豆的检测

组员:温正新、张星、姜文峰、葛磊、高顺利、曾伟 主要完成人: 转基因大豆的检测试验结题报告转基因大豆的检测试验结题报告摘要:由于转基因大豆在社会上的普遍性和重要性,以及民众对转基因食品的担忧,本次研究针对样品大豆的基因中是否含有抗草甘膦基因而成为转基因大豆进行了检测。
对于转基因大豆的检测的主要方法是PCR扩增大豆DNA,通过琼脂糖电泳后在紫光灯下观察是否有相应的DNA色带来判断大豆是否为转基因大豆。
关键词:转基因、DNA、PCR一、研究意义随着转基因工程技术的迅速发展与在生物改良及遗传育种中的大规模应用,转基因生物(Genetically Modified Organism)及其产品的种类越来越多,含有的外源基因类型也越来越多。
抗草甘膦(glyphosate)大豆(商品名,roundup ready soybean)是在传统大豆株Variety A5403中转入外源基因CAMV-35S启动子、抗草甘膦基因CP4-EPSPS和NOS终止子而得到。
大豆是植物蛋白、油脂、食品、饲料及工业原料的重要来源作物。
仅排在水稻、小麦和玉米之后,是世界四大粮食作物之一。
自从1996 年第1 个转基因抗草甘膦大豆品种商业化种植以来,转基因大豆在世界范围内迅速推广。
转基因大豆的种植在带来巨大经济效益的同时,食品和环境安全性的潜在风险受到广泛关注。
目前,全球种植面积最大的转基因作物为抗除草剂大豆,占全球大豆种植面积的67%。
它是目前使用最广的转基因作物之一,每年至少有800万吨转基因大豆进入我国市场。
因此,研究抗草甘膦大豆的快速检测方法具有重要意义。
当前,转基因大豆商业化种植的主要品种美国抗除草剂草甘膦转基因大豆是通过农杆菌介导方法,将矮牵牛Ti 质粒(CaMy)中35S 启动子控制EPSPS 基因导入到大豆植株,进而培育成的新品种。
基于核酸的检测技术主要有PCR 方法和基于PCR 原理的其他检测方法如多重PCR、巢式PCR 等等。
转基因作物检测识别方法

种 子2010.426转基因作物,是指利用分子生物学技术将某些生物的基因转移到其他物种中,使遗传物质得到改造的生物,兼具高产优质、多抗等诸多优点。
由于目前尚缺乏科学依据证明转基因作物及产品的安全性,对人类健康和环境潜在的风险已引起广泛关注和忧虑。
如何准确检测和识别转基因作物及其产品,也成为人们关注的热点。
1.生物表型检测法 将待检测识别的种子样品在特定的培养基上培养成幼苗,观察幼苗是否具有转基因的特定性状,以此区分转基因和非转基因幼苗。
如耐除草剂的转基因幼苗在除草剂处理的培养基上可以正常生长,而非转基因幼苗则受伤害或死亡,从而区分出耐除草剂的转基因幼苗。
该方法的优点是可利用实验室现有的设备和条件,成本低廉,不仅可以测定识别转基因产物,而且可判断其活性。
但其缺点是只能测定活的发芽种子,不同的转基因性状需单独测定,且需要的时间较长。
2. PCR 检测法定性PCR 测定法:迄今,最好的定性转基因种子分析方法是利用P C R 测定导入作物植株基因的特定D N A 序列是否存在。
PCR 可对插入两个已知DNA序列之间的特定DNA 序列进行特别和灵敏的扩增(多重)。
通常,导入的基因结构(基因卡盒)由3部分构成:启动子、结构基因、终止子。
在测定前,至少应该知道这3种中的任何1种,PCR就能用于测定其中任何一种基因,或者来自启动子和终止子D NA 标记。
PCR 基本测定主要包括3个步骤:①D N A 提取和纯化。
②插入DNA 的PCR 扩增。
③PCR 扩增产物存在的电泳确认。
每个步骤均会影响测定结果的可靠性和灵敏度,因此全部3个程序都应在最佳状态下操作。
定量PCR 测定法:定量PCR 测定有几种方法。
主要有:①竞争PCR ,根据目的序列合成一种突变的DNA 序列作为竞争模板,竞争模板与目的序列十分相似,可共用一套引物,根据扩增后这两种DNA 的含量和已知的竞争模板起始DNA 浓度,确定目的模板的起始DNA 浓度。
转基因食品有两种检测方法:一种是蛋白质水平上的检测

转基因食品有两种检测方法:一种是蛋白质水平上的检测;另一种是核酸水平上的检测。
1蛋白质水平的检测1.1酶联免疫法(ELISA)ELISA检测是将抗原和抗体反应的特异性与酶对底物的高效催化作用结合起来,根据酶作用于底物后的显色反应,当抗原与抗体结合时,借助于比色或荧光反应鉴定GMF。
酶与底物反应的颜色与样品中抗原的含量成正比。
ELISA检测对样品进行定性检测的同时又能进行定量分析。
Rogan等人用ELISA法检测出传统大豆加工产品中混有2%Roundup Ready 大豆中的CP4 EPSPS蛋白质。
此方法具有选择性和灵敏性,具有商业可利用性;但是复杂基质对它的准确性和准确度有干扰,并且外源基因表达的蛋白质在较低水平或热处理变性时,免疫方法的检测能力就会下降。
1.2试纸法主要将特异的抗体交联到试纸条上和有颜色的物质上,当纸上抗体和特异抗原结合后,再和带有颜色的特异抗体进行反应,就形成了带有颜色的三明治机构,并且固定在试纸条上,如果没有抗原,则没有颜色。
此法不需要特殊的仪器设备,适用于现场检验或初筛。
上面两种方法有三方面不足:第一,抗原抗体反应的专一性;第二,加工过的转基因食品中的蛋白质抗原性很容易破坏,从而影响检测结果的准确性;第三,有些转基因食品不表达蛋白质或表达量很低或很大时,则无法进行检测。
1.3蛋白质印迹法(Western Blot)蛋白质印迹法将电泳较高的分离能力、抗体的特异性和显色酶反应的灵敏性结合起来,是检测复杂混合物中特异蛋白质最有力的工具之一,普遍用于分离、检测特异的目的蛋白质,灵敏度为1~5ng。
它可确定一个样品中是否含有低于或超过预定限值水平的目的蛋白质,特别是用于不可溶蛋白质的分析。
V an Duijn等人用蛋白质印迹法检测Roundup Ready大豆中的CP4合成酶,检测限在0.5%~l%。
经验证,这种方法可以应用于转基因Roundup Ready 大豆原材料和大豆蛋白质产品的检测。
转基因大豆及其制品的安全性和检测研究现状

转基因大豆及其制品的安全性和检测研究现状转基因大豆及其制品日益增多,己经直接或间接地影响到人们的生活。
也正因如此,转基因大豆及其制品对人体健康及生态环境的影响引起人们的广泛关注。
为满足消费者选择权和知情权以及出于国际贸易的需要,转基因食品的检测手段也越来越引起各国政府和有关食品监督机构的重视。
随着各国有关转基因各种法规的建立和不断完善,这就要求各国不仅能使定性检测技术日趋简捷和准确,更要求能探索出更加适合检测需要的定量手段。
1转基因大豆及其制品的安全性问题从理论上说,转基因技术和常规杂交育种都是通过优良基因重组获得新品种的,但常规育种的安全性并未受到人们的质疑。
其主要理由是常规育种是模拟自然现象进行的,基因重组和交流的范围很有限,仅限于种内或近缘种间。
并且,在长期的育种实践中并未发现什么灾难性的结果。
而转基因技术则不同,它可以把任何生物甚至人工合成的基因转入植物,因为这种事件在自然界是不可能发生的,所以人们无法预测将基因转入一个新的遗传背景中会产生什么样的作用,故而对其后果存在着疑虑口。
目前被国际上广为接受的转基因食品安全性评价原则是“实质等同性”原则。
按照实质等同性原则,孟山都公司对培育抗草甘膦转基因大豆品种进行食品安全评价,结果表明,转基因大豆品种所有氨基酸含量与普通大豆品种没有明显差异;内源蛋白过敏原及其含量与普通大豆品种没有差异。
研究结果还表明CP4一EPSPS和已知的毒蛋白结构没有相似性,急性老鼠管饲法实验也表明CP4一EPSPS 无毒。
但是,由于转基因技术仍处于发展过程中,国际上生物安全方面评估技术尚不成熟,现有知识仍不足以评估转基因生物的利益与风险。
目前对转基因大豆安全性仍在争论中,尚无定论。
从目前研究成果看,转基因大豆可能造成的安全隐患不容忽视。
2转基因大豆及其制品的检测技术由于越来越多的国家要求对转基因产品进行标识,我国农业部颁布的《农业转基因生物标识管理办法》也规定,从2002年3月20日开始要求对五大类中17种产品进行标识。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Lane 1:Negative Control Lane 3: GMO Soybean Control 0.1% Lane 5: GMO Soybean Control 5% Lane 7: Positive Control Lane 9: Sample 2 Lane 11: Sample 2
1.6 结果分析 对以上的电泳结果分析可知,Negative Control、 Positive Control以及各种GMO混入率的对照样品均可得到 正常结果,送检的4个样品中Sample1、Sample2、 Sample3检测出重组基因, Sample4为检测出重组基因, 说明Sample1、Sample2、Sample3为转基因大豆, Sample4为非转基因大豆或GMO混入率低于0.1%的检出界 限。
1.2 仪器及试剂
仪器: TaKaRa PCR Thermal Cycler DICE (TaKaRa Code:TP600) (TaKaRa 试剂: PCR Screening Kit for GM Soybean Ver.2.0 Code:DRR201A) 1.3 扩增基因及片断长度 重组基因 : CP4 EPSPS
1、转基因大豆定性PCR检测方法 1、1 原理 采用PCR法,在同一个反应体系中同时加入扩增 Roundup Ready(CP4 EPSPS)大豆重组基因和内 源基因(Actin 蛋白基因)的引物,通过重组基因的是 否被扩增来判断样品是否为转基因大豆,通过内源基因 是否被扩增来监控PCR反应是否正常进行,从而防止 假阴性的结果。 此检测方法操作简单、成本低,可以对转基因大豆 进行定性分析,经大量实验结果证明,此方法的 GMO(genetically modified organism,转基因生物)混入率的检出界限 为0.1%。
Upper signal: GMO
Lower signal: Control
Lane M:100bp DNA Ladder Marker Lane 2: Non GMO Soybean Control Lane 4: GMO Soybean Control 1% Lane 6: GMO Soybean Control 100% Lane 8: Sample 1 Lane 10: Sample 1
d件:
94℃ 94℃ 5min 30sec
60℃
72℃
72℃ 1、5 检测结果
30sec
1min
10min
40Cycles
Lane 1为未添加Template 的Negative Control;Lane2-6使用了各种 GMO混入率的商品化的对照样品;Lane7使用了试剂盒配备的TEST template for GM-soybean ,目的为检测试剂性能,扩增的两个目的 片段分别为1000bp(由重组基因引物扩增得到)及700bp(由内源基 因引物扩增得到);Lane8-11为4个送检样品。
转基因大豆定性检测方法介绍
1、检测样品:
豆粕,编号:sample 1、sample 2、sample 3、 sample 4
2、核酸提取: 各取5g样品,分别用研钵研磨至粉末状,再各取 0.5g作为实验材料,使用试剂盒提取基因组DNA(结果 见图1)。
3、检测方法: 转基因大豆定性PCR检测方法
图1 样品提取基因组DNA电泳图 Lane1: Sample 1 Lane3: Sample 3 M: λ-HindIII digest Lane2: Lane4: Sample 2 Sample 4
内源基因: Actin蛋白基因 1.4 反应体系及反应条件: 反应体系:GM-Soybean PCR Mixture 1: GM-Soybean PCR Mixture 2: 样品DNA(约50ng) or TEST template for GM-Soybean or dH2O 1 μI 20μI 5 μI 570bp 225bp
