催化剂课件
合集下载
催化剂课件

thank you !
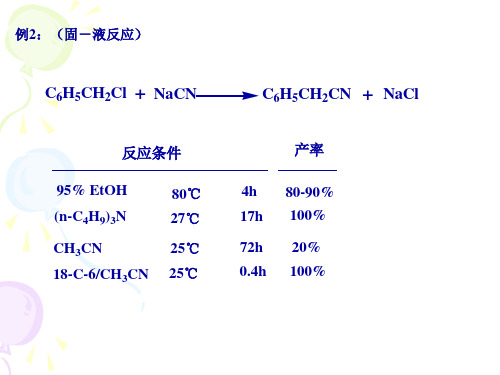
• ② 反应物是液体,催化剂是固体的反应称为液-固多相催 化反应。 例如,在 Ziegler-Natta催化剂作用下的烯烃聚合反应 (Ti,Cr→高密度聚乙烯;Ti→聚丙烯;Ti,Co,Ni→聚丁二 烯橡胶) ,油脂的加氢反应等。
(3) 酶催化反应 (enzyme catalysis reaction): 酶催化反应兼有均相与多相的特点。酶本身呈胶 体均匀分散在水溶液中(均相) ,但反应却从反 应物在其表面上积聚开始(多相) ,因此同时具 有均相和多相的性质。
(2)共催化剂(cocatalyst):又叫协同催化剂。有 的催化剂,其活性组份不止一个,而且能和主催化 剂同时起催化作用,这种催化剂叫做共催化剂。 (3)助催化剂(promoter):这是催化剂中具有提高 主催化剂的活性、选择性,改善催化剂的耐热性、 抗毒性、机械强度和寿命等性能的组分。
• 助催化剂通常可区分为: (a)结构助催化剂:能使催化活性物质粒度变小、表面积增 大,防止催化活性降低等。 (b)电子助催化剂:由于合金化使空 d轨道发生变化,通过 改变主催化剂的电子结构提高活性和选择性。 (c)晶格缺陷助催化剂:使活性物质晶面的原子排列无序化, 通过增大晶格缺陷浓度提高活性。
0 1985 1990 1995 1996 2000 2003 2009
不同时期全球催化剂 销售额
催化反应
• 一.催化反应的分类 • 1.根据体系中催化剂和反应物的相分类
(1)均相催化反应:当催化剂和反应物形成均一的相时, 反应成为均相催化反应(homogeneous catalysis reaction)。 例如: • 气相均相催化反应中由 I2(gas) ,NO(gas)等气体分子催 化的一些热分解反应。 • 液相均相催化反应 中由酸、碱催化的加水分解反应 。
《酸碱催化剂》课件

酸碱催化剂的经济性评价
总结词
经济性是衡量酸碱催化剂在生产成本和使用成本方面的重要指标,涉及到催化剂的制备、回收再利用 等方面。
详细描述
酸碱催化剂的经济性评价主要关注其在生产成本、使用成本以及回收再利用等方面的经济性。经济性 好的酸碱催化剂应该具备较低的生产成本、使用成本,同时在使用后能够方便地回收再利用,降低生 产成本。
详细描述
酸碱催化剂的选择性评价主要关注其在特定反应中能否专一催化某一反应,即产 物与原料的摩尔比值。该值越高,说明催化剂的选择性越好,能够更专一地催化 某一反应。
酸碱催化剂的稳定性评价
总结词
稳定性是衡量酸碱催化剂在多次使用或长时间使用后性能保持不变的能力的重要指标。
详细描述
酸碱催化剂的稳定性评价主要关注其在多次使用或长时间使用后性能的变化情况。通过测定催化剂在不同时间段 的活性数据,可以评估其稳定性。稳定性好的酸碱催化剂能够在多次使用或长时间使用后保持稳定的催化效果。
碱催化的反应条件通常是碱性环境, 有时需要使用碱性溶剂或碱性载体。
酸碱催化的比较
酸催化通常适用于亲电和亲核 反应,而碱催化则更适用于亲
核和亲电子反应。
酸催化通常需要酸性环境,而 碱催化则需要碱性环境。
酸催化通常通过质子化来激活 底物,而碱催化则通过去质子 化来激活底物。
酸催化和碱催化在化学反应中 具有不同的选择性,因此在选 择催化剂时应根据具体反应类 型和目标产物进行选择。
酸碱催化剂的分类
酸催化剂
能够提供质子,包括无机酸、有 机酸和阳离子交换树脂等。
碱催化剂
能够提供电子对,包括无机碱、 有机碱和金属氧化物等。
酸碱催化剂的作用
降低反应活化能
酸碱催化剂可以提供反应所需的 酸性或碱性活性中心,降低反应 的活化能,从而加速反应的进行
催化剂培训材料培训课件PPT工业催化剂制备与使用

– 若晶核长大速率大大超过晶核生成速率,溶液中最 初形成的晶核不是很多,较多的离子以晶核为中心, 依次排列长大而生成颗粒较大的晶型沉淀。
• 对沉淀剂选择有以下要求:
① 尽可能使用易分解并含易挥发成分的沉淀剂
– 常用的沉淀剂有:
• 碱类(NH4OH、NaOH、KOH) • 碳酸盐[(NH4)2CO4、Na2CO4、CO2] • 有机酸(乙酸、草酸)等 • 最常用的是NH4OH和(NH4)2CO4,因为铵盐在洗涤和热处
涤、干燥、粉碎和机 械成型,最后经500℃ 焙烧活化得到 γ-Al2O3。
– 该法生产设备简单、 原料易得且产品质量 稳定。
② 碱中和法
• 将铝盐溶液[Al(NO3)3、AlCl3、 Al2(SO4)3等]用氨水或其它碱 液( NaOH、KOH、NH4OH ) 中和,得到水合氧化铝:
Al3+ + OH- ==== Al2O3·nH2O↓
易洗涤。
④ 形成沉淀物的溶解度应小些
– 沉淀反应愈完全、原料消耗愈小;
• 对于贵金属尤为重要。
⑤ 无毒
– 不应使催化剂中毒或造成环境污染。
• 对金属盐类选择有以下要求:
– 一般选用硝酸盐的形式提供金属盐,硝酸根易于洗 脱或加热时分解而无残留。
– 而氯化物或硫化物残留在催化剂中,在使用时会呈 现H2S或HCl形式释放出来,致使催化剂中毒。
1、载体选择
• 浸渍法首先要选择合适载体,根据用途可选择 – 粉末状载体 – 成型载体
• 根据反应类型特点选择不同性质的载体
– 外扩散控制
不需比表面较大的载体;
– 内扩散控制
载体孔径不宜过小;
• 阻挡反应物分子进入孔道内部;
• 生成物返回气相受阻。
• 对沉淀剂选择有以下要求:
① 尽可能使用易分解并含易挥发成分的沉淀剂
– 常用的沉淀剂有:
• 碱类(NH4OH、NaOH、KOH) • 碳酸盐[(NH4)2CO4、Na2CO4、CO2] • 有机酸(乙酸、草酸)等 • 最常用的是NH4OH和(NH4)2CO4,因为铵盐在洗涤和热处
涤、干燥、粉碎和机 械成型,最后经500℃ 焙烧活化得到 γ-Al2O3。
– 该法生产设备简单、 原料易得且产品质量 稳定。
② 碱中和法
• 将铝盐溶液[Al(NO3)3、AlCl3、 Al2(SO4)3等]用氨水或其它碱 液( NaOH、KOH、NH4OH ) 中和,得到水合氧化铝:
Al3+ + OH- ==== Al2O3·nH2O↓
易洗涤。
④ 形成沉淀物的溶解度应小些
– 沉淀反应愈完全、原料消耗愈小;
• 对于贵金属尤为重要。
⑤ 无毒
– 不应使催化剂中毒或造成环境污染。
• 对金属盐类选择有以下要求:
– 一般选用硝酸盐的形式提供金属盐,硝酸根易于洗 脱或加热时分解而无残留。
– 而氯化物或硫化物残留在催化剂中,在使用时会呈 现H2S或HCl形式释放出来,致使催化剂中毒。
1、载体选择
• 浸渍法首先要选择合适载体,根据用途可选择 – 粉末状载体 – 成型载体
• 根据反应类型特点选择不同性质的载体
– 外扩散控制
不需比表面较大的载体;
– 内扩散控制
载体孔径不宜过小;
• 阻挡反应物分子进入孔道内部;
• 生成物返回气相受阻。
催化剂导论PPT课件

3.×,起加速反应作用而又不改变该反应的标
4.
准Gibbs自由焓变化的物质是催化剂。
4. √
5. ×,催化剂参与化学反应过程
6. √
7. √
8. ×,由盐溶液共沉淀法制备氢氧化物时,部
分氢氧化物沉淀的PH可值编辑都课件 大于7
19
二、在下列各题叙述中选择你认为正确的答案
1.下列分子筛中择形性突出的为: D
可编辑课件
7
第五节 离子交换法
1. 分子筛的合成
2. 分子筛的分类
3.
A、X、Y、ZSM-5等
3. Si/Al比与分子筛的稳定性关系
4.
第六节 催化剂成型
5. 压片、挤条、油可编辑中课件 、转动成型
8
第三章 催化剂性能的评价、 测试和表征
1.催化反应动力学研究的意义和作用
催化动力学研究的一个重要目标是为所研 究的催化反应提供数学模型,帮助弄清催 化反应机理。
知道NaY的结晶度)? (5)你估计图示该工艺中制备NaY的导向剂是何物质? (6)如何将制得的NaY原粉做成球型催化剂?
可编辑课件
26
答: (1)将水玻璃,硫酸铝,偏铝酸钠按合适比例与一定 量导向剂混合,搅拌使成胶,在一定温度下晶化一定时 间后,过滤洗涤除去硫酸根等,干燥即制得NaY原粉 (2)影响晶化的因素主要是:晶化温度、晶化时间、 原料配比及其碱度。通过单因素实验,正交与均匀设 计实验等,即可确定这些因素的较佳值。 (3)导晶沉淀法 (4)通过X射线粉末衍射即可测定NaY的晶化程度 (5)NaY晶种(P52:化学组成、结构类型与分子 筛相类似的、具有一定粒度的半晶化分子筛)。 (6)成球机成型;胶溶后,油柱成型。
催化剂工程导论
催化剂制备方法PPT课件

过 滤
干燥
洗 涤
Na型 丝光
沸石
18
浸渍法
将载体放进含有活性物质的液体中浸渍
载体(如Al2O3)的沉淀 洗涤干燥 载体的成型 用活性组份浸渍 干燥
焙烧分解
活化还原
2021
负载型金属催化剂
19
浸渍法的原理
活性组份在载体表面上的吸附 毛细管压力使液体渗透到载体空隙内部 提高浸渍量(可抽真空或提高浸渍液温度) 活性组份在载体上的不均匀分布
粉末细,成型后机械强度高,但成球困难 加入粘合剂(水),量少成球时间长,量
大时造成多胞,难成球 加大转盘转数和倾斜度,粒度下降;转盘
深,粒度大
2021
47
固体催化剂制备方法进展
超细粒度催化剂
– 超细粒子在纳米尺度时的表面效应
– 反应中的扩散行为
– 催化剂活性增强
溶胶凝胶法
– 多组分在胶体中分布均匀
加热到90-100 0C尿素, 同时释放出OH-
2021
11
导晶沉淀法
借助晶化导向剂引导非晶型沉淀转化为 晶型沉淀
X,Y分子筛 合成
分子筛合 成原料
加晶种 晶化
2021
无定型物 转
X,Y晶体 化
高结晶度
12
沉淀时金属盐类的选择
一般选用硝酸盐(大都溶于水) 贵金属为氯化物的浓盐酸溶液 铼选用高铼酸(H2Re2O7)
金属盐溶液
NaOH(Na2CO3)
沉淀
活
洗涤 干燥 焙烧 研磨 成型
化
催化剂
2021
8
单组分沉淀法
制备非贵金属的单组分催化剂或载体
Al3+ + OH-
载体Al2O3
催化剂及其催化作用概述ppt课件
➢ (2)负载型杂多酸固体酸催化剂。
此外,交联型固体酸催化剂(硅锆交联蒙 脱土)
精细化工
合成增塑剂
1邻苯二甲酸二酯(DOP)(由苯酐和 2-乙基己醇合成催化剂为SO2-4/TiO2Al2O3
酯化率可达99%
2己二酸二辛酯(DOA)(PVC优良耐 寒助剂(SO2-4/ZrO2-La2O3)
3蔗糖八乙酯(SO2-4/TiO2)
O
O Al O O C2H5
乙氧基
O Al O OH
高温
O
O
CH2 CH2+H2O+ HO Al O Al O
O-
O
O
HO AlH O Al
O
O
低温
O
C2H5OC2H5
C2H5 C2H5
异丙苯裂解
在B酸中心下进行
CH3 CH CH3 H + H+
HC CH3 + CH3
+ CH3CH CH3
酸性强弱与催化反应关系
➢金属氧化物表面的金属离子是L酸,氧负离 子是L碱。金属离子的电负性越大,则金属离 子的酸性越强。
➢金属氧化物的碱性也可以同电负性相关联, 但由于金属氧化物表面往往含有羟基这时的 酸碱性由M-OH中M-O的键本质决定.若M-O键强, 则解离出H+,显酸性,反之,若M-O键弱,则解离 出OH-,显碱性。
丙烯酸丁酯用于表面涂料,粘合剂,密 封剂,皮革处理剂( SO4 2- /TiO2)
甲基丙烯酸异丁酯是耐酸耐碱性涂料的 基料SO4 2- /ZrO2-TiO2
L-H模型与E-R模型
L-H(Langmuir-Hinshelwood)
A+B+ S-S
此外,交联型固体酸催化剂(硅锆交联蒙 脱土)
精细化工
合成增塑剂
1邻苯二甲酸二酯(DOP)(由苯酐和 2-乙基己醇合成催化剂为SO2-4/TiO2Al2O3
酯化率可达99%
2己二酸二辛酯(DOA)(PVC优良耐 寒助剂(SO2-4/ZrO2-La2O3)
3蔗糖八乙酯(SO2-4/TiO2)
O
O Al O O C2H5
乙氧基
O Al O OH
高温
O
O
CH2 CH2+H2O+ HO Al O Al O
O-
O
O
HO AlH O Al
O
O
低温
O
C2H5OC2H5
C2H5 C2H5
异丙苯裂解
在B酸中心下进行
CH3 CH CH3 H + H+
HC CH3 + CH3
+ CH3CH CH3
酸性强弱与催化反应关系
➢金属氧化物表面的金属离子是L酸,氧负离 子是L碱。金属离子的电负性越大,则金属离 子的酸性越强。
➢金属氧化物的碱性也可以同电负性相关联, 但由于金属氧化物表面往往含有羟基这时的 酸碱性由M-OH中M-O的键本质决定.若M-O键强, 则解离出H+,显酸性,反之,若M-O键弱,则解离 出OH-,显碱性。
丙烯酸丁酯用于表面涂料,粘合剂,密 封剂,皮革处理剂( SO4 2- /TiO2)
甲基丙烯酸异丁酯是耐酸耐碱性涂料的 基料SO4 2- /ZrO2-TiO2
L-H模型与E-R模型
L-H(Langmuir-Hinshelwood)
A+B+ S-S
催化剂课件ppt

高比表面积载体
因 具 有 酸 性 或 碱 性 , 会 影 响 催 化 剂 的 性 能 。 如 SiO2 、 Al2O3、活性炭、分子筛等。
15
常用的载体
低比表面积载体
高比表面积载体
载体 比表面积 (m2/g)
载体
比表面积 (m2/g)
刚玉
0~1
氧化铝
100~200
碳化硅 硅藻土 石棉 耐火砖
<1 2~30 1~16 <1
共催化剂
和主催化剂同时起催化作用的组分
6
固体催化剂的组成
助催化剂
本身没有活性或者活性很小可以忽略,但却能 显著改善催化剂的性能(活性、选择性和稳定 性)。
7
助催化剂的分类及其作用
➢结构型助催化剂 ➢电子(调变)型助催化剂 ➢扩散型助催化剂(致孔剂) ➢毒化型助催化剂
8
结构型助催化剂
提高活性组分的分散度,从而提高其催化活性。 (如合成甲醇Cu-ZnO-Al2O3催化剂中的Al2O3,提高了Cu的 比表面积,从而提高其反应活性。)
25
空速
空速(Space velocity):单位时间内,单位质量或体积催化剂 所能处理的反应物量。
空速越大,表明催化剂的处理能力越强。 空速的倒数为接触时间 重时空速(weight hourly space velocity, WHSV) 液时空速(liquid hourly space velocity, LHSV) 气时空速(gas hourly space velocity, GHSV)
48
3.1 酸碱催化剂的应用及类型
固体酸碱催化剂的应用
已在石油化工、石油炼制生产过程中得到广泛应用。正 逐步取代目前工业常用的硫酸、盐酸、氢氟酸等液体酸催 化剂。实例 固体碱催化剂在工业中的应用较少,有待进一步加强。
因 具 有 酸 性 或 碱 性 , 会 影 响 催 化 剂 的 性 能 。 如 SiO2 、 Al2O3、活性炭、分子筛等。
15
常用的载体
低比表面积载体
高比表面积载体
载体 比表面积 (m2/g)
载体
比表面积 (m2/g)
刚玉
0~1
氧化铝
100~200
碳化硅 硅藻土 石棉 耐火砖
<1 2~30 1~16 <1
共催化剂
和主催化剂同时起催化作用的组分
6
固体催化剂的组成
助催化剂
本身没有活性或者活性很小可以忽略,但却能 显著改善催化剂的性能(活性、选择性和稳定 性)。
7
助催化剂的分类及其作用
➢结构型助催化剂 ➢电子(调变)型助催化剂 ➢扩散型助催化剂(致孔剂) ➢毒化型助催化剂
8
结构型助催化剂
提高活性组分的分散度,从而提高其催化活性。 (如合成甲醇Cu-ZnO-Al2O3催化剂中的Al2O3,提高了Cu的 比表面积,从而提高其反应活性。)
25
空速
空速(Space velocity):单位时间内,单位质量或体积催化剂 所能处理的反应物量。
空速越大,表明催化剂的处理能力越强。 空速的倒数为接触时间 重时空速(weight hourly space velocity, WHSV) 液时空速(liquid hourly space velocity, LHSV) 气时空速(gas hourly space velocity, GHSV)
48
3.1 酸碱催化剂的应用及类型
固体酸碱催化剂的应用
已在石油化工、石油炼制生产过程中得到广泛应用。正 逐步取代目前工业常用的硫酸、盐酸、氢氟酸等液体酸催 化剂。实例 固体碱催化剂在工业中的应用较少,有待进一步加强。
催化剂PPT授课课件

(2)测量小车从A点出发到达B点所花费的时间,如果 过了B点才停止计时,所测AB段 的平均速度vAB会偏__小__。
基础巩固练
【点拨】由题图可知,小球从 D 点运动到 F 点的路程 s= 12.50 cm-4.50 cm=8.00 cm=0.08 m,时间 t=2×0.2 s= 0.4 s,速度 v=st=00.0.48 sm=0.2 m/s。
使带火星木条复 化氢的分解速率
燃的气体
Ⅱ.向B试管中
红砖粉末的___质__量___
重新加入5%的 ①又产生大量能 和_化__学__性__质___ 在反应
过氧化氢溶液,使带火星木条复 前后均没有发生变化,
反应停止后过 燃的气体
能作过氧化氢分解的
滤、洗涤、干 ②滤渣质量为a g 催化剂
燥、称量滤渣
HK版 八年级上
【答案】8.00;0.2
能力提升练
10.[中考·江苏泰州]如图是“研究气泡的运动规律”实验 装置。
(1)实验时所用的测量工具是刻度尺和___秒__表___。 (2)要正确判断气泡是否做匀速直线运动,需要对气泡
运动时的相关物理量进行测量,为便于测量,就使 气泡在管内运动得较___慢_____(填“快”或“慢”),气泡 的运动如果是匀速直线运动,收集到的数据特点是运动的 路程和时间成____正____比。
2. 太空舱利用NiFe2O4将航天员呼出的CO2转化为O2,
而NiFe2O4的质量和化学性质在反应前后都不变。则
NiFe2O4在该过程中是( D )
A. 反应物
B. 生成物
C. 消毒剂
D. 催化剂
3. 【2020•东莞】实验室用过氧化氢制氧气的实验中, 应加入少量二氧化锰。下列说法中正确的是( D ) A. 只有二氧化锰能作过氧化氢分解的催化剂 B. 二氧化锰只能作过氧化氢分解的催化剂 C. 加入二氧化锰可以增加过氧化氢分解产生氧气 的质量 D. 二氧化锰能加快过氧化氢分解
基础巩固练
【点拨】由题图可知,小球从 D 点运动到 F 点的路程 s= 12.50 cm-4.50 cm=8.00 cm=0.08 m,时间 t=2×0.2 s= 0.4 s,速度 v=st=00.0.48 sm=0.2 m/s。
使带火星木条复 化氢的分解速率
燃的气体
Ⅱ.向B试管中
红砖粉末的___质__量___
重新加入5%的 ①又产生大量能 和_化__学__性__质___ 在反应
过氧化氢溶液,使带火星木条复 前后均没有发生变化,
反应停止后过 燃的气体
能作过氧化氢分解的
滤、洗涤、干 ②滤渣质量为a g 催化剂
燥、称量滤渣
HK版 八年级上
【答案】8.00;0.2
能力提升练
10.[中考·江苏泰州]如图是“研究气泡的运动规律”实验 装置。
(1)实验时所用的测量工具是刻度尺和___秒__表___。 (2)要正确判断气泡是否做匀速直线运动,需要对气泡
运动时的相关物理量进行测量,为便于测量,就使 气泡在管内运动得较___慢_____(填“快”或“慢”),气泡 的运动如果是匀速直线运动,收集到的数据特点是运动的 路程和时间成____正____比。
2. 太空舱利用NiFe2O4将航天员呼出的CO2转化为O2,
而NiFe2O4的质量和化学性质在反应前后都不变。则
NiFe2O4在该过程中是( D )
A. 反应物
B. 生成物
C. 消毒剂
D. 催化剂
3. 【2020•东莞】实验室用过氧化氢制氧气的实验中, 应加入少量二氧化锰。下列说法中正确的是( D ) A. 只有二氧化锰能作过氧化氢分解的催化剂 B. 二氧化锰只能作过氧化氢分解的催化剂 C. 加入二氧化锰可以增加过氧化氢分解产生氧气 的质量 D. 二氧化锰能加快过氧化氢分解
催化作用与催化剂PPT课件
• 载体有天然的和人工合成的,可划分为低比表 面和高比表面两大类。
• 载体关系到催化剂的活性、选择性、热稳定性、 机械强度,也关系到催化过程的传质特性。
载体的功能
1、提供有效的表面和合适的孔结构; 2、增强催化剂的机械强度; 3、改善催化剂的热稳定性; 4、减少活性组分的含量; 5、提供附加的活性中心; 6、与活性组分之间的溢流现象和强相互作
反应物
催化剂对反应具有选择性
-实例
催化剂及反应条件
产物
CO+H2
Rh/Pt/SiO2,573K,7×105Pa Cu-Zn-O,Zn-Cr-O,573K, 1.0133×107~ 2.0266×107Pa
Rh络合物,473~573K, 5.0665×107~ 3.0399×108Pa
Cu,Zn,493K, 3×106Pa
合成氨的反应中,铁系催化剂可以单独作为主催化 剂,已成功工业化数十年,近年的研究证明,使用 Mo-Fe合金更好,合金中Mo含量在80%时其活性比 单独的Fe或Mo都高,这里Mo就是主催化剂,而Fe反 倒成了共催化剂
助催化剂(promoter)
• 助催化剂是加到催化剂中的少量物质 (<5~10%) ,是催化剂的辅助成分,本身没有 催化活性或活性很小。
本章主要内容
1
催化作用的定义
2
催化作用的特征
3
催化剂的组成
催化剂分类 4
催化剂的反应性性能及对工业催
5
化剂的要求
1
催化作用的定义
Catalysis: 1835~1836年,瑞典学者J.J.Berzelius提出,“cata” 意思是“down”,而“lysis”为动词,意思是分裂或者破坏,当时认 为:“一种催化剂是破坏阻碍化学反应进行的正常力。
• 载体关系到催化剂的活性、选择性、热稳定性、 机械强度,也关系到催化过程的传质特性。
载体的功能
1、提供有效的表面和合适的孔结构; 2、增强催化剂的机械强度; 3、改善催化剂的热稳定性; 4、减少活性组分的含量; 5、提供附加的活性中心; 6、与活性组分之间的溢流现象和强相互作
反应物
催化剂对反应具有选择性
-实例
催化剂及反应条件
产物
CO+H2
Rh/Pt/SiO2,573K,7×105Pa Cu-Zn-O,Zn-Cr-O,573K, 1.0133×107~ 2.0266×107Pa
Rh络合物,473~573K, 5.0665×107~ 3.0399×108Pa
Cu,Zn,493K, 3×106Pa
合成氨的反应中,铁系催化剂可以单独作为主催化 剂,已成功工业化数十年,近年的研究证明,使用 Mo-Fe合金更好,合金中Mo含量在80%时其活性比 单独的Fe或Mo都高,这里Mo就是主催化剂,而Fe反 倒成了共催化剂
助催化剂(promoter)
• 助催化剂是加到催化剂中的少量物质 (<5~10%) ,是催化剂的辅助成分,本身没有 催化活性或活性很小。
本章主要内容
1
催化作用的定义
2
催化作用的特征
3
催化剂的组成
催化剂分类 4
催化剂的反应性性能及对工业催
5
化剂的要求
1
催化作用的定义
Catalysis: 1835~1836年,瑞典学者J.J.Berzelius提出,“cata” 意思是“down”,而“lysis”为动词,意思是分裂或者破坏,当时认 为:“一种催化剂是破坏阻碍化学反应进行的正常力。
有机合成相转移催化剂课件ppt
n-C12H25Cl 91%
但是,若底物的反应活性低时,应避免使用CH2Cl2,否则CH2Cl2可能和 底物竞争参加反应;如例4;若Nu-具有强碱性时,应避免使用CHCl3,否则 会生成活泼的二氯卡宾(二氯碳烯)(参见本节四2);
例4:
OH
CH2Cl2 +
NaOH/H2O R4N+Cl-
H2 OC O
四、应用: 1. 中性条件下的PTC反应: (1)亲核取代反应:
这类反应特别适合于用PTC反应进行,是PTC反应研究最多的一种; 如例1-3。
(2)氧化反应:
例5: KMnO4/C6H6/H2O
CH3(CH2)7CH=CH2 (n-C8H17)3N+CH3 . Cl- CH3(CH2)7COOH + HCO2H
91%
例6:
KMnO4/C6H6
O
二环己烷-18-C-6 H3C C
有机相相溶,使得无机盐和有机物的反应可在均相中进行;
另外,使用偶极极性非质子溶剂,还可避免阴离子在质子性溶剂中的溶
剂化而引起的亲核性降低;如:
O
O
H C N(CH3)2
H C N(CH3)2
Oδ- δ+ H C N(CH3)2
位阻大
δ+
H(R)
NU H O
位阻小
(2)使用相转移催化剂(Q+ X-):以RX和NaCN反应生成RCN为例说明相 转移催化原理;
88% OCH3
4. 酸性条件下PTC反应:
δ+ δ-
R4N+ . X - + H-Y
(亲水)
R4N+ . X - H-Y (亲油)
例21:
催化剂PPT课件

1.主催化剂 主催化剂又称为活性组分,它是多元催化剂的主体, 是必备的组分,没有它就缺乏所需的催化作用。
V2O5是SCR商用催化剂中最主要的活性组分。钒的 负载量可能不尽相同,在SCR系统中负载量不能太 大,这主要是因为V2O5也能将SO2氧化成SO3,这 对SCR反应是不利的。
2.助催化剂 助催化剂是加入催化剂中的少量物质,这种物质本 身没有活性或活性很小,但却能显著地改善催化剂 的效能,包括催化剂活性、选择性和稳定性等。
采用的一种再生方法。通过将催化剂孔隙中的 含碳沉积物氧化为CO和CO2除去,即可恢复催 化活性。影响烧炭反应的主要因素是氧分压。 当催化剂上积炭量一定时,烧炭的最高温升取 决于输入氧的浓度。烧炭的初始阶段宜采用低 浓度氧气,其后才能逐渐将其浓度提高到一定 的范围。
(2)补充组分法 对于那些因组分流失而失活的催化剂,最适宜
2.加装备用层催化剂。大部分的燃煤电厂脱硝SCR 系统都设计成多层催化剂,多层催化剂在催化剂的 寿命管理和系统性能表现方便更具有灵活性。即便 单层催化剂便能够达到初始的性能要求,反应器的 设计也应考虑至少具备一层附加层。
3.在机组停运检修时,须防止雨水或锅炉冲洗水等 湿气进入催化剂,一般保持脱硝反应器内湿度低于 70%,当湿度较大时,建议在反应器内通入干燥的 压缩空气或放入干燥剂,也可以在反应器下部安装 除湿机,保持反应器内的干燥环境,避免催化剂活 性降低。
(3)机械稳定性:固体催化剂抵抗气流产生的冲击力、摩 擦力、承受上层催化剂的质量负荷的作用、温度变化作用 及变应力作用的能。
(4)化学稳定性:指催化剂能保持稳定的化学组成和化合 状态的性能。
工业催化剂的使用寿命:是指在给定的设计操作条件下, 催化剂能满足工艺设计指标活性的持续时间(总寿命)。
催化剂种类介绍ppt课件

6
生物催化
• 酶是生物催化剂,是植物、动物和微生物 产生的具有催化能力的有机物(绝大多数 的蛋白质。但少量RNA也具有生物催化功 能),旧称酵素。酶的催化作用同样具有 选择性。例如,淀粉。酶催化淀粉水解为 糊精和麦芽糖,蛋白酶பைடு நூலகம்化蛋白质水解成 肽等。活的生物体利用它们来加速体内的 化学反应。
7
2
均相催化 (Homogeneous catalysis)
• 催化剂和反应物同处于一相,没有相界存 在而进行的反应,称为均相催化作用,能 起均相催化作用的催化剂为均相催化剂。 均相催化剂包括液体酸、碱催化剂和色可 赛思固体酸和碱性催化剂。溶性过渡金属 化合物(盐类和络合物)等。均相催化剂以 分子或离子独立起作用,活性中心均一, 具有高活性和高选择性。
催化剂种类介绍
1
主要分类
• 按状态可分为液体催化剂和固体催化剂; • 按反应体系的相态分为均相催化剂和多相催化剂。
均相催化剂有酸、碱、可溶性过渡金属化合物和 过氧化物催化剂 ;多相催化剂有固体酸催化剂、 有机碱催化剂、金属催化剂、金属氧化物催化剂、 络合物催化剂、稀土催化剂、分子筛催化剂、生 物催化剂、纳米催化剂等。 • 按照反应类型又分为聚合、缩聚、酯化、缩醛化、 加氢、脱氢、氧化、还原、烷基化、异构化等催 化剂 。 • 按照作用大小还分为主催化剂和助催化剂。
3
碱催化反应机理 以丙酮溴化反应为例: 丙酮先与碱作用,生成烯醇负离子及碱 的共轭酸;碳负离子与溴生成产物:
4
• 酸催化反应机理 以丙酮在酸性水溶液中卤 化为例,其反应机理为:
即先形成碳鎓离子,而后立刻转化成 烯醇,并迅速与卤素发生反应。
5
多相催化 (Heterogeneous catalysis)
生物催化
• 酶是生物催化剂,是植物、动物和微生物 产生的具有催化能力的有机物(绝大多数 的蛋白质。但少量RNA也具有生物催化功 能),旧称酵素。酶的催化作用同样具有 选择性。例如,淀粉。酶催化淀粉水解为 糊精和麦芽糖,蛋白酶பைடு நூலகம்化蛋白质水解成 肽等。活的生物体利用它们来加速体内的 化学反应。
7
2
均相催化 (Homogeneous catalysis)
• 催化剂和反应物同处于一相,没有相界存 在而进行的反应,称为均相催化作用,能 起均相催化作用的催化剂为均相催化剂。 均相催化剂包括液体酸、碱催化剂和色可 赛思固体酸和碱性催化剂。溶性过渡金属 化合物(盐类和络合物)等。均相催化剂以 分子或离子独立起作用,活性中心均一, 具有高活性和高选择性。
催化剂种类介绍
1
主要分类
• 按状态可分为液体催化剂和固体催化剂; • 按反应体系的相态分为均相催化剂和多相催化剂。
均相催化剂有酸、碱、可溶性过渡金属化合物和 过氧化物催化剂 ;多相催化剂有固体酸催化剂、 有机碱催化剂、金属催化剂、金属氧化物催化剂、 络合物催化剂、稀土催化剂、分子筛催化剂、生 物催化剂、纳米催化剂等。 • 按照反应类型又分为聚合、缩聚、酯化、缩醛化、 加氢、脱氢、氧化、还原、烷基化、异构化等催 化剂 。 • 按照作用大小还分为主催化剂和助催化剂。
3
碱催化反应机理 以丙酮溴化反应为例: 丙酮先与碱作用,生成烯醇负离子及碱 的共轭酸;碳负离子与溴生成产物:
4
• 酸催化反应机理 以丙酮在酸性水溶液中卤 化为例,其反应机理为:
即先形成碳鎓离子,而后立刻转化成 烯醇,并迅速与卤素发生反应。
5
多相催化 (Heterogeneous catalysis)
第7次课工业催化剂设计与开发课件

第一节 工业催化剂的基本要求与特征
1.1 工业催化剂在经济上的重要性
工业催化剂市场有三大领域: ➢炼油催化剂市场; ➢化学品生产催化剂市场; ➢环保(汽车排气)催化剂市场。
1
1.2 工业催化剂的基本要求
所谓工业催化剂,是强调具有工业生产实 际意义的催化剂,它们可以用于大规模的 生产过程。 工业催化剂的基本要求: ➢ 活性 ➢ 选择性 ➢ 稳定性
这些载体表面的金属原子的壳层电子能级与体相 相比发生位移,电荷由载体向金属发生转移,其作用远 大于润湿作用,金属粒子的表面形貌发生了很大变化, 呈二维或筏状排列,从而大大改变了活性和选择性。
2.2.5 金属-载体相互作用
➢ 实例:废气排放净化催化剂: Pt, Pd, Rh/q-Al2O3, 助催化剂La2O3, CeO2 q-Al2O3高表面积、热稳定; La2O3 防止q-Al2O3向低表面a- Al2O3转变; CeO2 强化CO氧化和水煤气变换活性,这在
在金属氧化物上,如Cr2O3、Co3O4、NiO、ZnO等,在 400C下经真空干燥除去表面氧化物的羟基,使金属离子暴露,
常温下可使H2非解离吸附。
H-H -
Zn O 22
2、O2的活化:非解离吸附(O2-形式参与表面过程);解离
吸附(以O-和O2-形式参与表面过程)。 乙烯在Ag催化剂上的环氧化反应
催化剂组分至少有两种,承担活性和选择性的需要。
➢ 异构化、水合等催化反应
固体酸,如氢型的分子筛沸石、γ-Al2O3、H3PO4/硅藻土等。
21
(二) 根据反应分子活化方式进行评选
1、H2的活化
在金属催化剂上,在-50C--100C下,可按照LH机理进行解 离吸附。解离后的原子H可在金属表面移动,可以对不饱和化 合物加氢。
1.1 工业催化剂在经济上的重要性
工业催化剂市场有三大领域: ➢炼油催化剂市场; ➢化学品生产催化剂市场; ➢环保(汽车排气)催化剂市场。
1
1.2 工业催化剂的基本要求
所谓工业催化剂,是强调具有工业生产实 际意义的催化剂,它们可以用于大规模的 生产过程。 工业催化剂的基本要求: ➢ 活性 ➢ 选择性 ➢ 稳定性
这些载体表面的金属原子的壳层电子能级与体相 相比发生位移,电荷由载体向金属发生转移,其作用远 大于润湿作用,金属粒子的表面形貌发生了很大变化, 呈二维或筏状排列,从而大大改变了活性和选择性。
2.2.5 金属-载体相互作用
➢ 实例:废气排放净化催化剂: Pt, Pd, Rh/q-Al2O3, 助催化剂La2O3, CeO2 q-Al2O3高表面积、热稳定; La2O3 防止q-Al2O3向低表面a- Al2O3转变; CeO2 强化CO氧化和水煤气变换活性,这在
在金属氧化物上,如Cr2O3、Co3O4、NiO、ZnO等,在 400C下经真空干燥除去表面氧化物的羟基,使金属离子暴露,
常温下可使H2非解离吸附。
H-H -
Zn O 22
2、O2的活化:非解离吸附(O2-形式参与表面过程);解离
吸附(以O-和O2-形式参与表面过程)。 乙烯在Ag催化剂上的环氧化反应
催化剂组分至少有两种,承担活性和选择性的需要。
➢ 异构化、水合等催化反应
固体酸,如氢型的分子筛沸石、γ-Al2O3、H3PO4/硅藻土等。
21
(二) 根据反应分子活化方式进行评选
1、H2的活化
在金属催化剂上,在-50C--100C下,可按照LH机理进行解 离吸附。解离后的原子H可在金属表面移动,可以对不饱和化 合物加氢。
《催化剂工程》课件

选择性高:能够选择性地催化特定反应,提高产品纯度
耐高温、高压:能够在高温、高压环境下稳定工作
活性高:能够快速反应,提高生产效率
稳定性好:在反应过程中不易分解或失效
确定目标反应:明确需要催化的反应类型和反应条件
筛选催化剂:选择合适的催化剂材料和结构
优化催化剂性能:通过实验和计算优化催化剂的活性、选择性和稳定性
能源领域:用于燃料电池、太阳能电池等过程
环境保护:用于废气、废水处理等过程
化学工业:用于合成氨、合成树脂等过程
均相催化剂:如Fenton催化剂,用于废水处理
复合催化剂:如Fenton-光催化剂,用于废水和空气净化
性质:具有较高的活性和选择性,稳定性好,易于回收和再生。
非均相催化剂:如光催化剂,用于空气净化
均相催化:催化剂与反应物质处于相同的浓度
非均相催化:催化剂与反应物质处于不同的浓度
光催化剂:在光照条件下,催化剂与反应物质发生反应
复合催化剂:由两种或两种以上催化剂组成的复合催化剂
生物催化剂:利用生物酶等生物物质作为催化剂
液体催化剂的性质:流动性好,易于运输和储存,反应速度快,效率高。
酶:生物催化剂的一种,具有高效性和特异性
单击添加标题
单击添加标题
单击添加标题
设计原则:高效、稳定、环保
设计方法:理论计算、实验验证、优化调整
设计步骤:确定反应条件、选择催化剂、优化反应参数
开发流程:实验室研究、中试放大、工业化生产
应用领域:石油化工、精细化工、环保等领域
经济性:成本低,易于生产、运输和使用
环保性:无毒、无污染,符合环保要求
工业应用:将优化后的催化剂应用于实际生产中,并进行性能评估和优化
添加标题
耐高温、高压:能够在高温、高压环境下稳定工作
活性高:能够快速反应,提高生产效率
稳定性好:在反应过程中不易分解或失效
确定目标反应:明确需要催化的反应类型和反应条件
筛选催化剂:选择合适的催化剂材料和结构
优化催化剂性能:通过实验和计算优化催化剂的活性、选择性和稳定性
能源领域:用于燃料电池、太阳能电池等过程
环境保护:用于废气、废水处理等过程
化学工业:用于合成氨、合成树脂等过程
均相催化剂:如Fenton催化剂,用于废水处理
复合催化剂:如Fenton-光催化剂,用于废水和空气净化
性质:具有较高的活性和选择性,稳定性好,易于回收和再生。
非均相催化剂:如光催化剂,用于空气净化
均相催化:催化剂与反应物质处于相同的浓度
非均相催化:催化剂与反应物质处于不同的浓度
光催化剂:在光照条件下,催化剂与反应物质发生反应
复合催化剂:由两种或两种以上催化剂组成的复合催化剂
生物催化剂:利用生物酶等生物物质作为催化剂
液体催化剂的性质:流动性好,易于运输和储存,反应速度快,效率高。
酶:生物催化剂的一种,具有高效性和特异性
单击添加标题
单击添加标题
单击添加标题
设计原则:高效、稳定、环保
设计方法:理论计算、实验验证、优化调整
设计步骤:确定反应条件、选择催化剂、优化反应参数
开发流程:实验室研究、中试放大、工业化生产
应用领域:石油化工、精细化工、环保等领域
经济性:成本低,易于生产、运输和使用
环保性:无毒、无污染,符合环保要求
工业应用:将优化后的催化剂应用于实际生产中,并进行性能评估和优化
添加标题
《催化剂工程》课件

总结词
催化剂工程在现代化学工业中具有重要意义,它能够降低能耗、减少废弃物排放、提高产品质量和经济效益。
详细描述
催化剂工程在现代化学工业中扮演着至关重要的角色。通过研究和开发高效的催化剂,可以降低化学反应的能耗 ,减少废弃物排放,提高产品质量和经济效益。在石油化工、制药、环保等领域,催化剂工程的应用已经取得了 显著的成果。
微乳液法
总结词
一种基于微小液滴的催化剂制备方法
详细描述
微乳液法是将两种互不相溶的溶剂在表面活 性剂的作用下形成微小液滴,并在微小液滴 中制备出催化剂的方法。该方法能够制备出 具有高比表面积、高活性的催化剂,适用于
制备纳米尺度的催化剂。
03 催化剂的表征技术
物理表征技术
扫描电子显微镜(SEM)
观察催化剂的表面形貌和微观结构。
催化剂是一种能够改变反应速率但不改变反应总吉布斯自由能的物质。它可以加速化学 反应的速率,提高产物的选择性。根据性质和用途的不同,催化剂可以分为均相催化剂 和多相催化剂。均相催化剂通常为液态或气态,与反应物处于同一相态;而多相催化剂
则由固态载体和活性组分组成,与反应物处于不同的相态。
催化剂工程的重要性
05 催化剂的未来发展
高性能催化剂的研发
总结词
随着工业生产对催化剂性能要求的不断提高,高性能 催化剂的研发成为未来的重要方向。
详细描述
高性能催化剂的研发主要集中在提高催化剂的活性、 选择性、稳定性和降低成本等方面。通过改进催化剂 的制备工艺、优化活性组分的结构、探索新型载体材 料等方法,可以进一步提高催化剂的性能。
绿色催化剂的研发
要点一
总结词
随着环保意识的日益增强,绿色催化剂的研发成为未来的 重要趋势。
催化剂工程在现代化学工业中具有重要意义,它能够降低能耗、减少废弃物排放、提高产品质量和经济效益。
详细描述
催化剂工程在现代化学工业中扮演着至关重要的角色。通过研究和开发高效的催化剂,可以降低化学反应的能耗 ,减少废弃物排放,提高产品质量和经济效益。在石油化工、制药、环保等领域,催化剂工程的应用已经取得了 显著的成果。
微乳液法
总结词
一种基于微小液滴的催化剂制备方法
详细描述
微乳液法是将两种互不相溶的溶剂在表面活 性剂的作用下形成微小液滴,并在微小液滴 中制备出催化剂的方法。该方法能够制备出 具有高比表面积、高活性的催化剂,适用于
制备纳米尺度的催化剂。
03 催化剂的表征技术
物理表征技术
扫描电子显微镜(SEM)
观察催化剂的表面形貌和微观结构。
催化剂是一种能够改变反应速率但不改变反应总吉布斯自由能的物质。它可以加速化学 反应的速率,提高产物的选择性。根据性质和用途的不同,催化剂可以分为均相催化剂 和多相催化剂。均相催化剂通常为液态或气态,与反应物处于同一相态;而多相催化剂
则由固态载体和活性组分组成,与反应物处于不同的相态。
催化剂工程的重要性
05 催化剂的未来发展
高性能催化剂的研发
总结词
随着工业生产对催化剂性能要求的不断提高,高性能 催化剂的研发成为未来的重要方向。
详细描述
高性能催化剂的研发主要集中在提高催化剂的活性、 选择性、稳定性和降低成本等方面。通过改进催化剂 的制备工艺、优化活性组分的结构、探索新型载体材 料等方法,可以进一步提高催化剂的性能。
绿色催化剂的研发
要点一
总结词
随着环保意识的日益增强,绿色催化剂的研发成为未来的 重要趋势。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Mo O
V
O
Mo OH
OH
(B)
(E)
Mo O O
IV
H 2O
(F)
Chapter 1. Introduction
催化基本概念(Basic Concepts on Catalysis):
• 对催化作用的诠释 (续) :
(6) 催化剂用量少且不消耗。 催化剂用量少且不消耗。 (7)不影响化学计量方程式。 不影响化学计量方程式。 (8) 反应速度(mol/s, 而不是mol/s/g_cat)与催化剂 反应速度(mol/s, 而不是mol/s/g_cat)与催化剂 量成正比。 量成正比。 (9) 反应后催化剂有微小变化。 反应后催化剂有微小变化。
Chapter 1. Introduction
催化基本概念(Basic Concepts on Catalysis):
• 催化剂活性评价的几个重要参数 (续):
转化率 = (反应物已转化的量) / (反应物起始量) × 100% 反应物已转化的量) 反应物起始量) 100%
(2)选择性(Selectivity) 选择性(Selectivity)
选择性 = (转化为目的产物所消耗的某反应物量) / (某反应物转化的总量) × 100% 转化为目的产物所消耗的某反应物量) 某反应物转化的总量) 100%
工 业 催化
Catalysis in Industry (Practical Catalysis) Catalysis)
有关催化的参考书 (Reference Books on Catalysis)
• 催化作用基础,黄开辉,万惠霖著,科学出 催化作用基础,黄开辉,万惠霖著,
版社,1980年 版社,1980年。 • 催化作用基础 , 李荣生著 , 科学出版社 , 催化作用基础, 李荣生著, 科学出版社, 1990年 1990年。 • 催化研究中的实验方法,第三卷:表面和吸附 催化研究中的实验方法,第三卷: 物种的表征, 科学出版社, 物种的表征,J. R. Anderson, 科学出版社, 1986年 1986年。 • 催化化学(上、下),吴越著,科学出版社, 催化化学( 吴越著,科学出版社, 1990, 1995年 1990, 1995年。
催化基本概念(Basic Concepts on Catalysis):
• 对催化作用的诠释 (续) :
(10) 加速反应但不参与反应者不是催化剂。 10) 加速反应但不参与反应者不是催化剂。 (12) 引发剂不是催化剂。 12) 引发剂不是催化剂。 (13) 催化剂是物体形式的物质。 13) 催化剂是物体形式的物质。
Mo O
VI
H H C
H H C
Mo C2H6 OH
VI
O
H C2H4
(C)
C2 H 6 O
C2 H 4 Mo OH
H
IV
O
(D)
(A)
C2H6 + O2 → C2H4 +H2O
C2H5OH O2
IV
Molybdenum ions undergo cycles of reduction and oxidation (Redox): Mo6+ → Mo4+ → Mo6+
反应速率 (Reaction Rate) (催化作用 Catalysis) 催化作用
Chapter 1. Introduction
研究催化化学必须应用多学科知识: 研究催化化学必须应用多学科知识
• 催化剂制备 (Catalyst Preparation): Preparation):
固态化学 (Solid State Chemistry) 表面与胶体化学 (Surface and Colloidal Chemistry) 材料科学 (Materials Science) 无机化学 (Inorganic Chemistry) 金属有机化学 (Organometallic Chemistry) 高分子化学 (Polymer Chemistry)
Chapter 1. Introduction
研究化学反应必须考虑两个问题: 研究化学反应必须考虑两个问题
• 化学热力学 (Chemical Thermodynamics): Thermodynamics):
化学平衡 (Chemical Equilibrium)
• 化学动力学 (Chemical Kinetics): Kinetics):
−E’
催化剂 — Au Pt — Au Pt — I2 蒸汽
2N2O 2N2 + O2
245
(C2H5)2O 热解
224
Chapter 1. Introduction
催化基本概念(Basic Concepts on Catalysis):
• 对催化作用的诠释 (续) :
(5) 存在催化循环 (Catalytic cycle)
Chapter 1. Introduction
a TEM Fresh CH4/O2, 280oC, 24h
4.1 wt% Pd/ZrO2 → PdO/ZrO2 → Pd/ZrO2
Air, 850oC, 1h He, RT
粒径变大 表面变粗糙
H2, 100oC, 1h
Chapter 1. Introduction
Chapter 1. Introduction
催化基本概念(Basic Concepts on Catalysis):
• 对催化作用的诠释(续) : 对催化作用的诠释(
位 能 E A…B…K A…K E1 A+B+K AK+B E2 E3 A……B
催化剂K催化反应: 催化剂 催化反应:A + B 催化反应
Chapter 1. Introduction
催化基本概念(Basic Concepts on Catalysis):
• 对催化现象的认识过程 : 模糊
(1)气体催化剂 2SO2 + O2 (2) 液体催化剂 2CH3CH2OH (3) 固体催化剂 2SO2 + O2 特殊物质 接触 催化力 促进
Chapter 1. Introduction
催化基本概念(Basic Concepts on Catalysis):
• 对催化作用的诠释 (续) :
非催化反应和催化反应的活化能(kJ/mol) 非催化反应和催化反应的活化能(kJ/mol)
反应 2HI → H2 + I2 E (非催化) (非催化) 184 E ’ (催化) 催化) — 105 59 — 121 134 — 144 ∆E = E — 79 125 — 124 131 — 80
NO
清楚
2SO3 (C2H5)2O + H2O 2SO3 催化剂 (触媒) 触媒)
H2SO4
Pt
Chapter 1. Introduction
催化基本概念(Basic Concepts on Catalysis):
• 对催化作用的定义 :
国际纯粹化学和应用化学联合会 (IUPAC, International Union of Pure and Applied Chemistry, 1976) 1976) (1) 催化是靠用量较少且本身不消耗的一种叫催化剂的外加物 质来增大化学反应速度的现象。 质来增大化学反应速度的现象。 ( 2 ) 催化剂提供了把反应物和产物连接起来的一系列基元步 骤。 (3) 没有催化剂时,是不发生这些过程的。 没有催化剂时,是不发生这些过程的。 (4) 催化剂的存在使反应按新的途径进行从而增大反应速度。 催化剂的存在使反应按新的途径进行从而增大反应速度。 (5) 催化剂参与反应,经过一个化学循环后再生出来。 催化剂参与反应,经过一个化学循环后再生出来。
Chapter 1. Introduction
研究催化化学必须应用 催化反应机理 (Catalytic Reaction Mechanism): Mechanism):
活性位) 催化活性中心 (活性位 (Catalytically active centers or sites) 活性位 反应物活化方式 (Activation pathways for reactants) 吸附物种 (Adsorption species) 基元反应步骤 (Elementary reaction steps) 活化能 (Activation energy) 催化反应动力学方程 (Catalytic reaction kinetic equation)
化学性质 (Chemical Properties)
催化活性 (Catalytic Activity): 转化率 (Conversion) 选择性 (Selectivity) 得率(产率 得率 产率) (Yield) 产率 反应速率 (Reaction rate) 转换频率 (Turnover frequency)
Chapter 1. Introduction
研究催化化学必须应用多学科知识: 研究催化化学必须应用多学科知识
• 催化剂表征 (Catalyst Characterization): Characterization):
物理性质 (Physical Properties)
晶体结构 (Crystal structure) 表面形貌 (Surface morphology) 表面和体相化学组成 (Chemical compositions on the surface and in the bulk) 元素氧化态分布 (Oxidation state distribution of elements) 粒径孔径分布 (Particle size and pore size distribution) 比表面积 (Specific surface areas)
