原料药、药用辅料和药包材登记表
申请人之窗原辅包平台使用手册

申请人之窗原辅包平台使用手册目录1简介 (1)2原辅包登记 (1)2.1登记 (1)2.1.1登录系统 (1)2.1.2资料登记 (2)2.1.3修改 (4)2.2操作日志 (5)2.3更新 (6)2.3.1重大变更 (7)2.3.2中等变更 (9)2.3.3微小变更 (10)2.3.4基础信息变更 (11)2.4待补正 (12)2.5待补充资料 (13)2.6技术转让 (13)2.7注销 (14)3原辅包审评意见 (14)4原辅包发补通知 (15)5年度报告 (16)6注意事项 (17)1简介原辅包登记:化学原料药、药用辅料及药包材(以下简称原辅包),企业的原辅包产品通过申请人之窗系统登记提交。
原辅包审评意见:原辅包产品的审评意见通过申请人之窗公示给申请人。
原辅包发补通知:原辅包产品的书面发补通知通过申请人之窗告知申请人,申请人需及时根据书面发补的要求进行回复。
年度报告:已公示的原辅包产品需上传年度报告,自登记号在药品审评中心原辅包公示公示之日起每12个月上传一份年度报告。
2原辅包登记2.1登记2.1.1登录系统访问申请人之窗登录页面:正确输入用户名、密码及验证码后成功登录进入申请人之窗系统。
进入申请人之窗系统后,展开左侧目录“原辅包”,点击“原辅包登记”按钮,进入原辅包产品登记列表。
2.1.2资料登记点击“登记”按钮,创建登记表。
根据要求填写登记表信息,其中*号标记字段为必填内容。
申请人在登记原辅包品种时,进行分页填写。
第一页包含:申报事项, 品种情况, 相关情况;第二页包含:产品所有权人;第三页包含:生产企业;第四页包含:境内全权代理机构和委托研究机构。
原料药、药用辅料和药包材申报登记表:申请人可点击“下一步”进入下一页填写信息,或点击“上一步”返回上一页填写信息。
提交登记表后,点击打印,系统自动产生Word文件。
将打印的登记表盖上公章,邮寄至药品审评中心。
2.1.3修改申请人可在登记表底部点击“编辑”按钮,对登记表进行修改。
申请人之窗原辅包平台使用手册

申请人之窗原辅包平台使用手册目录1简介 (1)2原辅包登记 (1)2.1登记 (1)2.1.1登录系统 (1)2.1.2资料登记 (2)2.1.3修改 (4)2.2操作日志 (5)2.3更新 (6)2.3.1重大变更 (7)2.3.2中等变更 (9)2.3.3微小变更 (10)2.3.4基础信息变更 (11)2.4待补正 (12)2.5待补充资料 (13)2.6技术转让 (13)2.7注销 (14)3原辅包审评意见 (14)4原辅包发补通知 (15)5年度报告 (16)6注意事项 (17)1简介原辅包登记:化学原料药、药用辅料及药包材(以下简称原辅包),企业的原辅包产品通过申请人之窗系统登记提交。
原辅包审评意见:原辅包产品的审评意见通过申请人之窗公示给申请人。
原辅包发补通知:原辅包产品的书面发补通知通过申请人之窗告知申请人,申请人需及时根据书面发补的要求进行回复。
年度报告:已公示的原辅包产品需上传年度报告,自登记号在药品审评中心原辅包公示公示之日起每12个月上传一份年度报告。
2原辅包登记2.1登记2.1.1登录系统访问申请人之窗登录页面:正确输入用户名、密码及验证码后成功登录进入申请人之窗系统。
进入申请人之窗系统后,展开左侧目录“原辅包”,点击“原辅包登记”按钮,进入原辅包产品登记列表。
2.1.2资料登记点击“登记”按钮,创建登记表。
根据要求填写登记表信息,其中*号标记字段为必填内容。
申请人在登记原辅包品种时,进行分页填写。
第一页包含:申报事项, 品种情况, 相关情况;第二页包含:产品所有权人;第三页包含:生产企业;第四页包含:境内全权代理机构和委托研究机构。
原料药、药用辅料和药包材申报登记表:申请人可点击“下一步”进入下一页填写信息,或点击“上一步”返回上一页填写信息。
提交登记表后,点击打印,系统自动产生Word文件。
将打印的登记表盖上公章,邮寄至药品审评中心。
2.1.3修改申请人可在登记表底部点击“编辑”按钮,对登记表进行修改。
实验室药品登记

实验室药品登记编号123456789101112131415161718192021222324252627咖啡酸、绿原栀子苷、N,N D-果糖、抗坏苯骈戊三酮(上规格(ml)容量瓶10、25、250、500容量瓶100、200、500、1000瓶塞量筒10、50、100、250、500 DGGE配件注射器、微孔滤膜、铝盒、游标卡尺、酒精计玻璃漏斗塑料吸管三角瓶100、150采血管小试剂瓶称量装置烧杯25、100刻度试管10、15、20、25玻璃棒、PH计配件滤纸脱脂棉、橡皮筋、铝箔灭菌用品石棉网、坩锅、坩锅铗工作服、空调配件培养皿玻璃砂芯过滤装置取样袋移液管(架)胶管、索氏提取器海绵、冰盒三酮(茚三酮)实验室SK226 冰箱药品登记表实验室SK226 玻璃器皿登记表、绿原酸、D-奎尼酸、莽草酸、D-半乳糖醛酸、L-苹果酸、D-甘露糖、D-苹果酸、40、N,N-二甲基对苯二胺盐酸盐、过硫酸铵、鼠李糖、香柏油、变色酸、福林酚、2,6、抗坏血酸、L-阿拉伯糖、L-甲硫氨酸、维生素B2核黄素、焦性没食子酸、间苯三酚表下规格容量瓶50、100、500容量瓶100、500、1000容量瓶100、250量筒500、1000量筒25、50、100、250三角瓶500三角瓶250大试剂瓶大试剂瓶烧杯250、500、1000胶烧杯无刻度试管分液漏斗手套粉碎机、筛子、洗瓶报纸瓷盘、锁培养皿培养皿酸、40%丙烯酰胺、琼脂粉、TEMED、邻菲啰啉、2,6-二叔丁基对甲酚、酚红、去离子甲酰胺苯三酚、没食子酸水合物、D-木糖、水合印酸酮上下容量瓶容量瓶容量瓶容量瓶瓶塞容量瓶量筒量筒DGGE配件量筒注射器,微孔滤膜玻璃漏斗塑料吸管三角瓶三角瓶采血管三角瓶小试剂瓶大试剂瓶。
原辅料贮存、保管及领用记录表格表
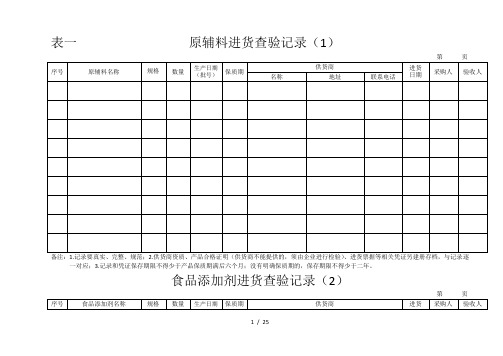
表一原辅料进货查验记录(1)
第页
一对应;3.记录和凭证保存期限不得少于产品保质期满后六个月;没有明确保质期的,保存期限不得少于二年。
食品添加剂进货查验记录(2)
第页
1 / 25
备注:1.记录要真实、完整、规范;2.供货商资质、产品合格证明(供货商不能提供的,须由企业进行检验)、进货票据等相关凭证另建册存档,与记录逐一对应;3.记录和凭证保存期限不得少于产品保质期满后六个月;没有明确保质期的,保存期限不得少于二年。
食品相关产品进货查验记录(3)
第页
2 / 25
备注:1.记录要真实、完整、规范;2.供货商资质、产品合格证明(供货商不能提供的,须由企业进行检验)、进货票据等相关凭证另建册存档,与记录逐一对应;3.记录和凭证保存期限不得少于产品保质期满后六个月;没有明确保质期的,保存期限不得少于二年
表二原辅料贮存、保管及领用记录(1)
第页
3 / 25
备注:1.原辅料库房应专人管理,标示明显,卫生清洁,贮存条件符合相关要求;2.定期检查原辅料贮存状况,及时清理变质或过保质期的原辅料;3.领用出库顺序应遵循先进先出原则,领用数量与生产投料数量相符。
食品添加剂贮存、保管及领用记录(2)
第页
4 / 25
备注:1.食品添加剂应专门贮存、专人管理,标示明显,卫生清洁,贮存条件符合相关要求;2.定期检查食品添加剂贮存状况,及时清理变质或过保质期的食品添加剂;3.领用出库顺序应遵循先进先出原则,领用数量与生产投料数量相符。
食品相关产品贮存、保管及领用记录(3)
第页
5 / 25。
原料药、药用辅料及包材申报资料的内容及格式要求(DMF)

原料药、药用辅料及包材申报资料的 内容及格式要求(DMF)1989年9月 美国FDA发布草案2009年6月 药审中心组织翻译辉瑞制药有限公司翻译北核协会审核药审中心最终核准目录I. 前言 (1)II. 定义 (1)III. DMF的类型 (2)IV. DMF的申报 (2)A. 传送信函 (3)1. 首次申报 (3)2. 修订 (3)B. 管理信息 (3)1. 首次申报 (3)2. 修订 (4)C. DMF内容 (4)1. DMF的类型 (4)a.第一类:生产地点、厂房设施、操作步骤和人员 (4)b.第二类:原料药、原料中间体、及生产过程中使用的物料,或制剂 (4)c.第三类:包装材料 (5)d.第四类:辅料、着色剂、香料、香精,或生产过程中使用的物料 (5)e.第五类:FDA认可的参考信息 (6)2.一般信息和建议 (6)a.环境评价 (6)b.稳定性 (6)D. 格式、装订和移交 (6)V. 查阅DMF的授权 (7)A. 给FDA的授权信函 (7)B. 给申请人、发起人和其他持有人的副本 (8)VI. DMF受理和审阅政策 (8)A.与DMF处理相关的政策 (8)B. DMF审阅 (9)VII. 持有人义务 (9)A. DMF变更时按需通知 (9)B. 建立授权查阅DMF的人员名单 (9)C. 文件的年度更新 (10)D. 代理的委任 (10)E. 所有权转移 (10)IX. DMF的终止 (11)原料药、药用辅料及包材申报资料的内容及格式要求(DMF)I.前言DMF是提交给美国食品药品监督管理局的文件,它可以用来提供有关一种或多种人用药品的制造、加工、包装和贮藏中使用的设施、工艺和物料的详细机密信息。
DMF的提交并无法律和FDA的规章的必需要求,提交与否完全由持有人自行决定。
DMF中的信息可以用来支持新药临床研究申请(IND)、新药上市申请(NDA)、仿制药申请(ANDA)、其它的DMF、出口申请或以上文件中任何一种文件/申请的修订和补充。
原料药、药用辅料及包材申报资料的内容及格式要求(DMF)

原料药、药用辅料及包材申报资料的 内容及格式要求(DMF)1989年9月 美国FDA发布草案2009年6月 药审中心组织翻译辉瑞制药有限公司翻译北核协会审核药审中心最终核准目录I. 前言 (1)II. 定义 (1)III. DMF的类型 (2)IV. DMF的申报 (2)A. 传送信函 (3)1. 首次申报 (3)2. 修订 (3)B. 管理信息 (3)1. 首次申报 (3)2. 修订 (4)C. DMF内容 (4)1. DMF的类型 (4)a.第一类:生产地点、厂房设施、操作步骤和人员 (4)b.第二类:原料药、原料中间体、及生产过程中使用的物料,或制剂 (4)c.第三类:包装材料 (5)d.第四类:辅料、着色剂、香料、香精,或生产过程中使用的物料 (5)e.第五类:FDA认可的参考信息 (6)2.一般信息和建议 (6)a.环境评价 (6)b.稳定性 (6)D. 格式、装订和移交 (6)V. 查阅DMF的授权 (7)A. 给FDA的授权信函 (7)B. 给申请人、发起人和其他持有人的副本 (8)VI. DMF受理和审阅政策 (8)A.与DMF处理相关的政策 (8)B. DMF审阅 (9)VII. 持有人义务 (9)A. DMF变更时按需通知 (9)B. 建立授权查阅DMF的人员名单 (9)C. 文件的年度更新 (10)D. 代理的委任 (10)E. 所有权转移 (10)IX. DMF的终止 (11)原料药、药用辅料及包材申报资料的内容及格式要求(DMF)I.前言DMF是提交给美国食品药品监督管理局的文件,它可以用来提供有关一种或多种人用药品的制造、加工、包装和贮藏中使用的设施、工艺和物料的详细机密信息。
DMF的提交并无法律和FDA的规章的必需要求,提交与否完全由持有人自行决定。
DMF中的信息可以用来支持新药临床研究申请(IND)、新药上市申请(NDA)、仿制药申请(ANDA)、其它的DMF、出口申请或以上文件中任何一种文件/申请的修订和补充。
药用辅料登记资料(样本)

药⽤辅料登记资料(样本)附件1药⽤辅料登记资料品种名称:XXX登记⼈:XXXXXXX辅料分类:国内外批准制剂中未有使⽤历史的,且○1.1 新的分⼦结构的辅料以及不属于第1.2、1.3的辅料;○1.2 由已有使⽤历史的辅料经简单化学结构改变(如盐基,⽔合物等);○1.3 两者及两者以上已有使⽤历史的辅料经共处理得到的辅料;○1.4 已有使⽤历史但改变给药途径的辅料。
国内外批准制剂中已有使⽤历史的,且○2.1 中国药典/USP/EP/BP/JP均未收载的辅料;○2.2 USP/EP/BP/JP已收载,但未在国内上市制剂中使⽤的辅料;○2.3 USP/EP/BP/JP已收载,中国药典未收载;●2.4 中国药典已収载的辅料。
在⾷品或化妆品中有使⽤历史的辅料,且○3.1 具有⾷品安全国家标准的⽤于⼝服制剂的辅料;○3.2具有化妆品国家或⾏业标准的⽤于外⽤制剂的辅料。
○其他拟⽤制剂给药途径:●注射○吸⼊○眼⽤○局部及⾆下○透⽪○⼝服○其他来源:○动物或⼈○矿物●植物○化学合成○其他登记⼈名称:XXXXXXXXX有限公司盖章法定代表⼈:XXX 签名⼀、申报资料项⽬1 登记⼈基本信息1.1 登记⼈名称、地址、⽣产地址1.2 证明性⽂件1.3 研究资料保存地址2 辅料基本信息2.1 名称2.2 结构与组成2.3 理化性质及基本特性2.4 境内外批准上市及使⽤信息2.5 境内外药典收载情况3 ⽣产信息3.1 ⽣产⼯艺和过程控制3.2 物料控制3.3 关键步骤和中间体的控制3.4 ⼯艺验证和评价3.5 ⽣产⼯艺的开发4 特性鉴定4.1 结构和理化性质研究4.2 杂质研究4.3 功能特性5 质量控制5.1 质量标准5.2 分析⽅法的验证5.3 质量标准制定依据6 批检验报告7 稳定性研究7.1 稳定性总结7.2 稳定性数据7.3 辅料的包装8 药理毒理研究⼆、申报资料1 登记⼈基本信息1.1 登记⼈名称、注册地址、⽣产地址⽣产商名称:XXXX有限公司地址:XXXXXXXXX 102号电话:******传真:******⽣产商场所地址:XXXXXXXXXX号电话:*******传真:********邮编:****1.2 证明性⽂件营业执照见附件12 辅料基本信息2.1 名称中⽂名称:XXXX化学名:XXXX英⽂名称:XXX英⽂别名:XXXXCAS号:XXX中国药典名称:XXXX欧洲药典名称:XXXX美国药典名称:XXX印度药典名称:XXXX英国药典名称:XXXX2.2 结构与组成分⼦式:X分⼦量:XXXXX2.3 理化性质及基本特性2.3.1理化性质性状:X密度:X熔点:X沸点:X2.3.2基本特性(1)XXX具有XXXXXXXX。
原料药、药用辅料和药包材登记表

附件1原料药、药用辅料和药包材登记表原料药登记—填表说明申请人保证:本项内容是各登记机构对于本项登记符合法律、法规和规章的郑重保证,各登记机构应当一致同意。
其他特别申明事项:需要另行申明的事项。
登记号:需填写由“原辅包登记平台”生成的登记号。
1.本登记属于:系指如果属于登记国产原料药填写“国产原料药登记”,如果属于登记进口原料药填写“进口原料药登记”,如果属于登记港澳台原料药填写“港澳台原料药登记”。
本项为必填写项目。
2.品种通用名称:应当使用正式颁布的国家药品标准或者国家药典委员会《中国药品通用名称》或其增补本收载的药品通用名称。
本项为必填项目。
3.英文名称:英文名填写INN英文名。
本项为必填项目。
4.包装:系指直接接触原料药的包装材料或容器,如有多个包装材质要分别填写,中间用句号分开,例如“玻璃瓶。
塑料瓶”。
包装规格是指基本包装单元的规格,原料药的基本包装单元,是原料药生产企业生产供上市的原料药最小包装,如:每瓶×毫升,对于按含量或浓度标示其规格的液体、半固体或颗粒,其装量按包装规格填写。
配用注射器、输液器或者专用溶媒的,也应在此处填写。
每一份登记表可填写多个包装规格,不同包装规格中间用句号分开,书写方式为“药品规格:包装材质:包装规格”,例如:“0.25g:玻璃瓶:每瓶30片”,多个规格的按上述顺序依次填写。
本项为必填项目。
5.质量标准:指本项原料药登记所提交药品标准的来源或执行依据。
来源于中华人民共和国药典的,需写明药典版次;属局颁或部颁标准的,需写明何种及第几册,散页标准应写明药品标准编号;来源于进口药品注册标准的,写明该进口注册标准的编号或注册证号;来源于国外药典的,需注明药典名称及版次;其他是指非以上来源的,应该写明具体来源,如自行研究,国产药品注册标准等情况。
本项为必填项目。
6.专利情况:所登记原料药的专利情况应当经过检索后确定,发现本品已在中国获得保护的有关专利或国外专利信息均应填写。
4《化学原料药、药用辅料及药包材与药品制剂关联审评审批管理规定(征求意见稿)》

附件1化学原料药、药用辅料及药包材与药品制剂关联审评审批管理规定(征求意见稿)第一章总则第一条(目的依据)为提高药品注册质量和效率,保证药品的安全性、有效性和质量可控性,根据《中华人民共和国药品管理法》、《药品注册管理办法》制定本管理规定。
第二条(总体要求)化学原料药、药用辅料、直接接触药品的包装材料和容器(以下简称药包材)应当符合药用要求,其质量、安全及功能应该满足药品制剂的需要。
第三条(关联审评审批制度) 国家药品监督管理局(以下简称国家局)在审评审批药品制剂时,对化学原料药一并审评审批,对相关药用辅料、药包材一并审评。
仿制境内已上市药品所用的化学原料药(以下简称“仿制化学原料药”)可申请单独审评审批。
第四条(原辅包登记) 化学原料药、辅料及药包材(以下简称原辅包)实施登记管理,原则上原辅包登记人应为原辅包生产企业,境外原辅包企业应当指定中国境内的企业法人办理相关登记事项,按要求在化学原料药、辅料及直接接触药品的包装材料和容器登记平台(以下简称原辅包登记平台)登记相关产品信息并提交登记资料,外文资料应当按照要求提供中文译本。
第五条(关联审评结果公开)国家局药品审评中心(以下简称药品审评中心)建立原辅包登记平台,并设立信息公开栏目向社会公开原辅包的登记号、产品名称、企业名称、给药途径等基本信息,供相关申请人或者持有人选择。
化学原料药关联审评审批或单独审评审批通过的,药用辅料、药包材关联审评通过的,药品审评中心在原辅包登记平台更新登记状态标识。
第六条(登记号管理原则)同一企业在同一生产场地生产的同一原辅包产品,生产工艺和质量标准相同的,应按照同一登记号登记。
采用不同原理的生产工艺(如发酵、合成、半合成等)生产的同种原料药可按照不同登记号登记,采用相同原理的生产工艺生产的同种原料药应选择最优工艺进行登记。
第二章责任与义务第七条(药品上市许可持有人责任)药品上市许可持有人承担制剂质量的主体责任,建立以制剂为核心,原辅包为基础的质量管理体系。
原辅料贮存、保管及领用记录表格表

表一原辅料进货查验记录(1)第页一对应;3.记录和凭证保存期限不得少于产品保质期满后六个月;没有明确保质期的,保存期限不得少于二年。
食品添加剂进货查验记录(2)第页1 / 25备注:1.记录要真实、完整、规范;2.供货商资质、产品合格证明(供货商不能提供的,须由企业进行检验)、进货票据等相关凭证另建册存档,与记录逐一对应;3.记录和凭证保存期限不得少于产品保质期满后六个月;没有明确保质期的,保存期限不得少于二年。
食品相关产品进货查验记录(3)第页2 / 25备注:1.记录要真实、完整、规范;2.供货商资质、产品合格证明(供货商不能提供的,须由企业进行检验)、进货票据等相关凭证另建册存档,与记录逐一对应;3.记录和凭证保存期限不得少于产品保质期满后六个月;没有明确保质期的,保存期限不得少于二年表二原辅料贮存、保管及领用记录(1)第页3 / 25备注:1.原辅料库房应专人管理,标示明显,卫生清洁,贮存条件符合相关要求;2.定期检查原辅料贮存状况,及时清理变质或过保质期的原辅料;3.领用出库顺序应遵循先进先出原则,领用数量与生产投料数量相符。
食品添加剂贮存、保管及领用记录(2)第页4 / 25备注:1.食品添加剂应专门贮存、专人管理,标示明显,卫生清洁,贮存条件符合相关要求;2.定期检查食品添加剂贮存状况,及时清理变质或过保质期的食品添加剂;3.领用出库顺序应遵循先进先出原则,领用数量与生产投料数量相符。
食品相关产品贮存、保管及领用记录(3)第页5 / 25备注:1.食品相关产品应专人管理,卫生清洁,贮存条件符合相关要求;2.定期检查食品相关产品贮存状况,及时清理变质或过保质期的食品相关产品;3.领用出库顺序应遵循先进先出原则,领用数量与生产投料数量相符。
表三产品投料及生产记录6 / 25备注:1.记录应当真实、准确;2.严格按照生产工艺、参数和产品配方进行投料;3.食品添加剂使用应符合GB2760相关要求,严禁超范围、超限量使用食品添加剂。
原料药、药用辅料和药包材申报登记表_口服液瓶铝塑组合盖_15.3╳7.0mm

产品质量负责人:肖峰
职位:质量部经理
联系人:肖峰
职位:质量部经理
电话:0791-85294982
传真:0791-85293120
电子信箱:936653120@
手机:13732925849
药品生产许可证编号:
是否具有相应 GMP证书: ○ 是 ● 否 编号:
法定代表人(签名):
6.质量标准: ○ 采用国家标准(是否有修订 ○ 是 ○ 否)
来源:○ 中国药典:版 ○ 生物制品规程:版
○ 局颁标准:册标准号:
○ 其:
○ 国外药典标准及版次:
● 企业标准
相关情况
7.专利情况:
□ 有中国专利 □ 化合物专利 □ 工艺专利 □ 处方专利 □ 其他专利
专利号
专利权人
专利授权
□ 有外国专利
其他特别申明事项:
申报事项
1.本申报属于:
产品来源:● 国产 ○进口○港、澳、台
○ 原料药
○ 药用辅料
● 药包材
● 首次登记 ○ 已登记产品重大变更 已有登记号:
本药包材属于:○ 高风险药包材 ● 低风险药包材
新颖性:□ 新材料□新结构□新用途 ☑ 其它
本药包材类型:
○ 包装系统:
● 包装组件:瓶盖(口服液瓶铝塑组合盖);垫片(口服液用易刺型氯化丁基橡胶塞)
邮编:330001
通讯地址:江西省南昌市青云谱区南莲路434号
邮编:330001
产品质量负责人:肖峰
职位:质量部经理
联系人:肖峰
职位:质量部经理
电话:0791-85294982
传真:0791-85293120
电子信箱:936653120@
完整word版,原料药、药用辅料和药包材企业授权使用书

附件2
原料药、药用辅料和药包材企业授权使用书
国家食品药品监督管理总局药品审评中心:
本原料药、药用辅料和药包材企业(或被授权人)__________,同意提供产品给药品上市许可持有人(申请人)_______用于______制剂的研究、开发以及上市生产。
该产品登记名称为_____,给药途径为_____,产品登记号为_____。
原料药、药用辅料和药包材企业(或被授权人)
签字盖章__________
日期:
注:1.本样稿仅供参考,如产品较多,可以采用列表的方式提供。
2.如为供应商需有原料药、药用辅料和药包材企业授权,并
附授权信。
—1—。
总局关于调整原料药、药用辅料和药包材审评审批事项的公告

总局关于调整原料药、药用辅料和药包材审评审批事项的公告(20XX年第146号)为贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔20XX〕42号)与《国务院关于取消一批行政许可事项的决定》(国发〔20XX〕46号),取消药用辅料与直接接触药品的包装材料和容器(以下简称药包材)审批,原料药、药用辅料和药包材在审批药品制剂注册申请时一并审评审批。
现就有关事项公告如下:一、药品注册申请人在中华人民共和国境内提出的注册分类 2.2、2.3、2.4、3、4、5类药品制剂申请所使用的原料药,以及各类药品注册申请所使用的药用辅料、药包材适用于本公告要求。
二、自本公告发布之日起,各级食品药品监督管理部门不再单独受理原料药、药用辅料和药包材注册申请,国家食品药品监督管理总局药品审评中心(以下简称药审中心)建立原料药、药用辅料和药包材登记平台(以下简称为登记平台)与数据库,有关企业或者单位可通过登记平台按本公告要求提交原料药、药用辅料和药包材登记资料,获得原料药、药用辅料和药包材登记号,待关联药品制剂提出注册申请后一并审评。
三、原料药登记资料主要内容:基本信息、生产信息、特性鉴定、原料药的质量控制、对照品、药包材、稳定性等。
具体内容应当符合《关于发布化学药品新注册分类申报资料要求(试行)的通告》(国家食品药品监督管理总局通告20XX年第80号)中原料药药学申报资料要求。
四、药用辅料登记资料主要内容:企业基本信息、辅料基本信息、生产信息、特性鉴定、质量控制、批检验报告、稳定性研究、药理毒理研究等。
具体内容应当符合《关于发布药包材药用辅料申报资料要求(试行)的通告》(国家食品药品监督管理总局通告20XX年第155号)中药用辅料申报资料要求。
五、药包材登记资料主要内容:企业基本信息、药包材基本信息、生产信息、质量控制、批检验报告、稳定性研究、安全性和相容性研究等。
具体内容应当符合20XX年第155号通告中药包材申报资料要求。
(仅供参考)原料药、药用辅料及包材申报资料的内容及格式要求(DMF)

原料药、药用辅料及包材申报资料的 内容及格式要求(DMF)1989年9月 美国FDA发布草案2009年6月 药审中心组织翻译辉瑞制药有限公司翻译北核协会审核药审中心最终核准目录I. 前言 (1)II. 定义 (1)III. DMF的类型 (2)IV. DMF的申报 (2)A. 传送信函 (3)1. 首次申报 (3)2. 修订 (3)B. 管理信息 (3)1. 首次申报 (3)2. 修订 (4)C. DMF内容 (4)1. DMF的类型 (4)a.第一类:生产地点、厂房设施、操作步骤和人员 (4)b.第二类:原料药、原料中间体、及生产过程中使用的物料,或制剂 (4)c.第三类:包装材料 (5)d.第四类:辅料、着色剂、香料、香精,或生产过程中使用的物料 (5)e.第五类:FDA认可的参考信息 (6)2.一般信息和建议 (6)a.环境评价 (6)b.稳定性 (6)D. 格式、装订和移交 (6)V. 查阅DMF的授权 (7)A. 给FDA的授权信函 (7)B. 给申请人、发起人和其他持有人的副本 (8)VI. DMF受理和审阅政策 (8)A.与DMF处理相关的政策 (8)B. DMF审阅 (9)VII. 持有人义务 (9)A. DMF变更时按需通知 (9)B. 建立授权查阅DMF的人员名单 (9)C. 文件的年度更新 (10)D. 代理的委任 (10)E. 所有权转移 (10)IX. DMF的终止 (11)原料药、药用辅料及包材申报资料的内容及格式要求(DMF)I.前言DMF是提交给美国食品药品监督管理局的文件,它可以用来提供有关一种或多种人用药品的制造、加工、包装和贮藏中使用的设施、工艺和物料的详细机密信息。
DMF的提交并无法律和FDA的规章的必需要求,提交与否完全由持有人自行决定。
DMF中的信息可以用来支持新药临床研究申请(IND)、新药上市申请(NDA)、仿制药申请(ANDA)、其它的DMF、出口申请或以上文件中任何一种文件/申请的修订和补充。
原辅包登记填报说明

原料药登记—填表说明申请人保证:本项内容是各登记机构对于本项登记符合法律、法规和规章的郑重保证,各登记机构应当一致同意。
其他特别申明事项:需要另行申明的事项。
登记号:需填写由“原辅包登记平台”生成的登记号。
版本号:需填写由“原辅包登记平台”生成的版本号。
1.本登记属于:系指如果属于登记国产原料药填写“国产原料药登记”,如果属于登记进口原料药填写“进口原料药登记”,如果属于登记港澳台原料药填写“港澳台原料药登记”。
本项为必填写项目。
2.品种通用名称:应当使用正式颁布的国家药品标准或者国家药典委员会《中国药品通用名称》或其增补本收载的药品通用名称。
本项为必填项目。
3.英文名称:英文名填写INN英文名。
本项为必填项目。
4.包装:系指直接接触原料药的包装材料或容器,如有多个包装材质要分别填写,中间用句号分开,例如“玻璃瓶。
塑料瓶”。
包装规格是指基本包装单元的规格,原料药的基本包装单元,是原料药生产企业生产供上市的原料药最小包装,如:每瓶×毫升,对于按含量或浓度标示其规格的液体、半固体或颗粒,其装量按包装规格填写。
配用注射器、输液器或者专用溶媒的,也应在此处填写。
每一份登记表可填写多个包装规格,不同包装规格中间用句号分开,书写方式为“药品规格:包装材质:包装规格”,例—1—如:“0.25g:玻璃瓶:每瓶30片”,多个规格的按上述顺序依次填写。
本项为必填项目。
5.质量标准:指本项原料药登记所提交药品标准的来源或执行依据。
来源于中华人民共和国药典的,需写明药典版次;属局颁或部颁标准的,需写明何种及第几册,散页标准应写明药品标准编号;来源于进口药品注册标准的,写明该进口注册标准的编号或注册证号;来源于国外药典的,需注明药典名称及版次;其他是指非以上来源的,应该写明具体来源,如自行研究,国产药品注册标准等情况。
本项为必填项目。
6.专利情况:所登记原料药的专利情况应当经过检索后确定,发现本品已在中国获得保护的有关专利或国外专利信息均应填写。
总局2017年第146号公告附件1(1.原料药、药用辅料和药包材登记表)

附件1原料药、药用辅料和药包材登记表—1——2——3——4——5——6——7——8——9——10—原料药登记—填表说明申请人保证:本项内容是各登记机构对于本项登记符合法律、法规和规章的郑重保证,各登记机构应当一致同意。
其他特别申明事项:需要另行申明的事项。
登记号:需填写由“原辅包登记平台”生成的登记号。
1.本登记属于:系指如果属于登记国产原料药填写“国产原料药登记”,如果属于登记进口原料药填写“进口原料药登记”,如果属于登记港澳台原料药填写“港澳台原料药登记”。
本项为必填写项目。
2.品种通用名称:应当使用正式颁布的国家药品标准或者国家药典委员会《中国药品通用名称》或其增补本收载的药品通用名称。
本项为必填项目。
3.英文名称:英文名填写INN英文名。
本项为必填项目。
4.包装:系指直接接触原料药的包装材料或容器,如有多个包装材质要分别填写,中间用句号分开,例如“玻璃瓶。
塑料瓶”。
包装规格是指基本包装单元的规格,原料药的基本包装单元,是原料药生产企业生产供上市的原料药最小包装,如:每瓶×毫升,对于按含量或浓度标示其规格的液体、半固体或颗粒,其装量按包装规格填写。
配用注射器、输液器或者专用溶媒的,也应在此处填写。
每一份登记表可填写多个包装规格,不同包装规格中间用句号分开,书写方式为“药品规格:包装材质:包装规格”,例如:“0.25g:玻璃瓶:每瓶30片”,多个规格的按上述顺序依次—11—填写。
本项为必填项目。
5.质量标准:指本项原料药登记所提交药品标准的来源或执行依据。
来源于中华人民共和国药典的,需写明药典版次;属局颁或部颁标准的,需写明何种及第几册,散页标准应写明药品标准编号;来源于进口药品注册标准的,写明该进口注册标准的编号或注册证号;来源于国外药典的,需注明药典名称及版次;其他是指非以上来源的,应该写明具体来源,如自行研究,国产药品注册标准等情况。
本项为必填项目。
6.专利情况:所登记原料药的专利情况应当经过检索后确定,发现本品已在中国获得保护的有关专利或国外专利信息均应填写。
原料药、药用辅料和药包材登记表

药品注册代理机构名称、公章、法定代表人签名、签名日期: 药 品注册代理机构在此由法定代表人签名、加盖机构公章。
8.委托研究机构: 系指药品申报资料中凡属于非申报机构自行研 究取得而是通过委托其他研究机构所取得的试验资料或数据 (包括药 学、药理毒理等)的研究机构。
是否具有相应GMP证书:○是
编号:
○否原因:
法定代表人(签名):
加盖公章处) 年 月 日
9.新药证书申请人:
中文名称:
英文名称:
社会信用代码/组织机构代码/身份证号:
法定代表人:职位:
注册地址:邮编:
通讯地址:邮编:
登记负责人:职位:
联系人:职位:
电话:传真:
电子信箱:手机:
法定代表人(签名):
(加盖公章处) 年 月 日
1.本登记 属于:
2.拟用制剂给药途径: □吸入 □注射 □眼用 □透皮 □口服 □外用 □其他 新颖性: □新材料 □新结构 □新用途 □其他 登记的药包材类型: □包装系统 □包装组件 □其他
○高风险药包材 ○低风险药包材登记品种情况
3.产品名称:
4.英文名称:
5.规格:
6.包装组件名称:
7.配方:
8.本品用于包装的剂型:
9.本品为
□包装系统:
□包装组件:
○其他:
10.质量标准
产品质量标准:○国家标准:
○企业标准:
○国外药典或标准及版次:
配件质量标准:○国家标准:
○企业标准: ○国外药典或标准及版次:申请人(国产药包材)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
其他特别申明事项:
登记号: 登记事项
1.本登记属于:
2.应用情况:○高风险药用辅料 ○低风险药用辅料
3.来源: □动物或人 □矿物 □植物 □化学合成 □其他
4.拟用制剂给药途径: □注射 □吸入 □眼用 □局部及舌下
年
月
日
14.进口药用辅料注册代理机构
中文名称:
英文名称:
社会信用代码/组织机构代码:
法定代表人:
职位:
注册地址:
邮编:
生产地址:
邮编:
通讯地址:
邮编:
登记负责人:
职位:
联系人:
职位:
电话:
传真:
电子信箱:
手机:
法定代表人(签名):
(加盖公章处)
年
月
日
15.委托研究机构
序号
研究项目
研究机构名称
研究负责人
联系人:
职位:
电话:
传真:
电子信箱:
手机:
法定代表人(签名):
(加盖公章处) 年 月 日
8.国内原料药生产企业:
所在省份:
中文名称:
英文名称:
社会信用代码/组织机构代码:
法定代表人:
职位:
注册地址:
邮编:
生产地址:
邮编:
通讯地址:
邮编:
登记负责人:
职位:
联系人:
职位:
电话:
传真:
电子信箱:
手机:
药品生产许可证编号:
8.本品用于包装的剂型:
9.本品为
□包装系统:
□包装组件:
○其他:
10.质量标准
登记号:
登记事项
1.本登记属于: 登记品种情况
2.品种通用名称:
3.英文名称:
4.包装:包装规格:
5.质量标准:
○采用国家标准(是否有修订
○是
○否) ○自拟
来源:○中华人民共和国药典:
版
○生物制品规程:
版
○局颁标准:第
册
标准号:
○其他:
相关情况
6.专利情况: □有中国专利 □化合物专利 □工艺专利 □处方专利 □其他专利 专利号:专利权人:
登记负责人: 联系人: 电话: 电子信箱: 法定代表人(签名):
传真:
职位:
职位:
传真:
加盖公章处)
加盖公章处) 年
职位: 邮编: 邮编: 邮编: 职位: 职位: 传真: 手机:
年月
月日
序号
研究项目
研究机构名称
研究负责人
联系电话
日
11.委托研究机构
加盖公章处) 年 月
二、药用辅料登记表
声明
申请人保证:①本登记表内容及所提交资料均真实、来源合法,未侵犯他人权益,其中试验研究的方法和数据均为本产品所采用的方法和由本产品得到的试 验数据。
附件
原料药、药用辅料和药包材登记表
一、原料药登记表
声明
申请人保证:①本登记表内容及所提交资料均真实、来源合法,未侵犯他人权益,其中试验研究的方法和数据均为本产品所采用的方法和由本产品得到的试 验数据。
②一并提交的电子文件与打印文件内容完全一致。 如查有不实之处, 我们承担 由此导致的一切法律后果。
其他特别申明事项:
□有外国专利 专利号:专利权人: 专利授权/公开日期: 专利权属声明:我们声明:本登记对他人专利不构成侵权。
序号
研究项目
研究机构名称
研究负责人
联系电话
申请人及委托研究机构(进口药用辅料)11.境外制药厂商:
中文名称: 英文名称: 法定代表人: 注册地址: 国家或地区: 登记负责人: 电话: 电子信箱: 法定代表人(签名):12.进口药用辅料生产厂
10.委托研究机构
序号
研究项目
研究机构名称
研究负责人
联系电话
申请人及委托研究机构(进口原料药)
7.境外制药厂商: 中文名称: 英文名称: 法定代表人: 注册地址: 国家或地区: 登记负责人: 电话: 电子信箱: 法定代表人(签名):8.进口原料药生产厂
中文名称: 英文名称: 法定代表人: 生产地址: 国家或地区: 登记负责人:
是否具有相应GMP证书:○是
编号:
○否原因:
法定代表人(签名):
加盖公章处) 年 月 日
9.新药证书申请人:
中文名称:
英文名称:
社会信用代码/组织机构代码/身份证号:
法定代表人:职位:
注册地址:邮编:
通讯地址:邮编:
登记负责人:职位:
联系人:职位:
电话:传真:
电子信箱:手机:
法定代表人(签名):
(加盖公章处) 年 月 日
1.本登记 属于:
2.拟用制剂给药途径: □吸入 □注射 □眼用 □透皮 □口服 □外用 □其他 新颖性: □新材料 □新结构 □新用途 □其他 登记的药包材类型: □包装系统 □包装组件 □其他
○高风险药包材 ○低风险药包材登记品种情况
3.产品名称:
4.英文名称:
5.规格:
6.包装组件名称:
7.配方:
中文名称:
英文名称:
法定代表人: 职位: 生产地址:
国家或地区:
登记负责人:职位:
电话:传真:
电子信箱:
法定代表人(签名):
(加盖公章处)
年
月
日
13.进口药用辅料国外包装厂
中文名称:
英文名称:
法定代表人:
职位:
生产地址:
国家或地区:
登记负责人:
职位:
电话:
传真:
电子信箱:
法定代表人(签名):
(加盖公章处)
□透皮 □口服 □其他 登记品种情况
5.品种名称:
6.英文名称:
7.规格:
8.包装:包装规格:
9.质量标准:○采用国家标准(是否有修订 ○是○否)○自拟
来源:○中华人民共和国药典:版○生物制品规程:版
○局颁标准:第 册 标准号:
○其他
相关情况
10.专利情况: □有中国专利 专利号:专利权人: 专利授权/公开日期:
联系电话
三、药包材登记表
声明
申请人保证:①本登记表内容及所提交资料均真实、来源合法,未侵犯他人权益,其中试验研究的方法和数据均为本产品所采用的方法和由本产品得到的试 验数据。
②一并提交的电子文件与打印文件内容完全一致。 如查有不实之处, 我们承担 由此导致的一切法律后果。
其他特别申明事项:
登记号: 登记事项
职位:
职位:
传真:
(加盖公章处) 年 月 日
职位:
职位:
电话:
电子信箱: 法定代表人(签名) : 日9.进口原料药国外包装厂
中文名称:
英文名称: 法定代表人: 生产地址: 国家或地区: 登记负责人: 电话: 电子信箱: 法定代表人(签名):10.进口原料药注册代理机构
中文名称:
英文名称:
社会信用代码/组织机构代码: 法定代表人: 注册地址: 生产地址: 通讯地址:
专利授权/公开日期:
□有外国专利 专利号:专利权人: 专利授权/公开日期: 专利权属声明:我们声明:本登记对他人专利不构成侵权
申请人及委托研究机构(国产原料药) :
7.申请人:
中文名称:
英文名称:
社会信用代码/组织机构代码/身份证号:
法定代表人:
职位:
注册地址:
邮编:
通讯地址:
邮编:
登记负责人:
职位:
