利奈唑胺片生物等效性试验招标书要求
医学检验项目招标文件

招标编号:[招标编号]招标项目名称:[项目名称]医学检验项目招标一、招标公告1.1 招标人:[招标人名称]1.2 招标代理机构:[招标代理机构名称]1.3 招标项目名称:[项目名称]医学检验项目1.4 招标项目地点:[项目地点]1.5 招标项目内容:[项目内容概述]1.6 招标文件获取时间:[具体时间]1.7 招标文件获取地点:[具体地点]1.8 招标文件售价:[售价]1.9 投标截止时间:[具体时间]1.10 投标地点:[具体地点]1.11 开标时间:[具体时间]1.12 开标地点:[具体地点]二、项目概况2.1 项目名称:[项目名称]医学检验项目2.2 项目地点:[项目地点]2.3 项目规模:[项目规模描述]2.4 项目内容:[项目内容详细描述,包括但不限于检验项目、检验设备、检验方法、检验质量标准等]2.5 项目总投资:[总投资金额]2.6 项目资金来源:[资金来源说明]2.7 项目工期:[项目工期要求]三、投标人资格要求3.1 投标人须具备独立法人资格,注册资金不少于[注册资金要求]万元。
3.2 投标人须具备有效的《医疗机构执业许可证》。
3.3 投标人须具备《医疗器械生产许可证》或《医疗器械经营许可证》。
3.4 投标人须具备相应的检验项目检验能力,具备完善的检验质量管理体系。
3.5 投标人须具备良好的商业信誉和健全的财务会计制度。
3.6 投标人须在近三年内(自投标截止之日起向前推算)没有重大违法违规行为。
3.7 投标人须同意并遵守本招标文件的所有规定。
四、投标文件要求4.1 投标文件应包含以下内容:(1)投标函;(2)法定代表人身份证明或授权委托书;(3)企业法人营业执照副本;(4)医疗机构执业许可证副本;(5)医疗器械生产许可证或医疗器械经营许可证副本;(6)检验项目检验能力证明材料;(7)检验质量管理体系文件;(8)近三年内业绩证明材料;(9)其他证明投标人符合资格要求的材料。
4.2 投标文件应按照招标文件规定的格式进行编制,并加盖公章。
仿制药生物等效性试验指导原则(日本)

药食审发第1124004号文2006年11月24日尊敬的各省市县医药卫生主管部门领导厚生劳动省医药品食品卫生管理局管理科科长签发有关仿制药生物等效性试验等指导原则的一系列制订与修订事宜在药品申报时、对于所应交付的仿制药生物等效性试验资料要求,曾在1997年12月22日医药审发第487号文“仿制药生物等效性试验指导原则”、2000年2月14日医药审发第64号文“含量规格不同的口服固体制剂生物等效性试验指导原则”、2000年2月14日医药审发第67号文“口服固体制剂更改处方后生物等效性试验指导原则”、2001年5月31日医药审发第786号文“仿制药生物等效性试验等一系列指导原则的修订事宜(即增补版)”及2003年7月7日药食审发第0707001号文“局部皮肤用药的仿制药生物等效性试验指导原则”等一系列文件中公布出来。
此次对以上各指导原则再次进行了修订,详见附件-1、2、3和4。
其中所附事项,请各相关单位敬请留意并遵照执行。
序1.此次变更的指导原则(1) 仿制药生物等效性试验指导原则(2) 含量规格不同的口服固体制剂生物等效性试验指导原则(3) 口服固体制剂更改处方后生物等效性试验指导原则(4) 局部皮肤用药的仿制药生物等效性试验指导原则2.以上各指导原则的执行时间自2006年11月24日起执行。
但原指导原则仍可并行使用至2007年11月24日。
附件-1 《仿制药生物等效性试验指导原则》目录第1章序言第2章专业用语第3章试验部分A.口服普通制剂与肠溶制剂I. 参比制剂与仿制制剂II. 生物等效性试验1.试验方法1)试验计划2)试验例数3)受试者4)给药条件a. 给药量b. 给药方法①单次给药②多次给药5)测定a. 体液采集b. 采集次数与时间c. 检测组分d.分析方法6)停止给药时间2.评价方法1)等效性评价指标2)生物学同等性判定范围3)统计学分析4)同等性判定III. 药力学试验IV. 临床试验V. 溶出度试验1.试验次数2.试验时间3.试验条件1)酸性药物制剂2)中性或碱性药物制剂、包衣制剂3)难溶性药物制剂4)肠溶制剂4.溶出曲线相似性判定VI. 生物等效性试验结果记录事项1.试样2.试验结果1)目的与宗旨2)溶出度试验结果3)生物等效性试验结果4)药力学试验结果5)临床试验结果B.口服缓(控)释制剂I. 参比制剂与仿制制剂II. 生物等效性试验1.试验方法2. 评价方法1)生物等效性评价参数、生物等效性判定范围以及统计学分析2)等效性判定III. 药力学试验及临床试验IV. 溶出度试验1.试验次数2.试验时间3.试验条件4.溶出曲线相似性及同等性的判定V. 生物等效性试验结果记录事项C.非口服制剂I. 参比制剂与仿制制剂II. 生物等效性试验III. 药力学试验及临床试验IV. 溶出度替代试验及物理化学常数测定V. 生物学同等性试验结果记录事项D.可豁免生物等效性试验的制剂附录表简写参数一览表图1 生物等效性试验实施逻辑树图2 溶出曲线相似性判定逻辑树图3 口服缓(控)释制剂溶出曲线同等性判定逻辑树【说明】日文排版与我国不同、首行缩进1个字体,故本译文沿用了此格式。
药物招标文件

招标编号:XXXX-XXXX一、招标项目概况1.1 项目名称:XX地区药物集中采购项目1.2 项目内容:本次招标旨在通过公开招标方式,采购符合国家药品标准和相关规定的药品,以满足XX地区医疗机构临床用药需求。
1.3 招标范围:本次招标范围为各类药品,包括但不限于注射剂、口服制剂、外用制剂、生物制品等。
1.4 招标地点:XX地区1.5 招标时间:XXXX年XX月XX日至XXXX年XX月XX日二、投标人资格要求2.1 具有独立法人资格,持有有效的营业执照。
2.2 具有有效的药品生产许可证、药品经营许可证。
2.3 具有良好的商业信誉和健全的财务会计制度。
2.4 具有履行合同所必需的设备和专业技术能力。
2.5 具有良好的售后服务体系。
2.6 近三年内无重大违法违规记录。
三、投标文件要求3.1 投标人须按照招标文件的要求编制投标文件,投标文件应包括以下内容:3.1.1 投标函3.1.2 法人代表身份证明或授权委托书3.1.3 营业执照副本复印件3.1.4 药品生产许可证、药品经营许可证副本复印件3.1.5 质量保证体系文件3.1.6 近三年内药品质量抽检报告3.1.7 近三年内重大合同履行情况3.1.8 投标报价及付款方式3.1.9 售后服务承诺3.1.10 其他相关证明材料3.2 投标文件应按照招标文件要求装订成册,并加盖投标人公章。
3.3 投标文件递交截止时间:XXXX年XX月XX日四、评标办法4.1 评标委员会由招标人代表、采购专家和有关人员组成。
4.2 评标委员会根据投标文件的内容、报价、质量、服务等方面进行综合评审,按照得分高低确定中标候选人。
4.3 评标过程中,如有以下情况之一,评标委员会可取消其投标资格:4.3.1 投标文件不符合招标文件要求。
4.3.2 投标人未按照规定提交投标保证金。
4.3.3 投标人存在虚假陈述、提供虚假证明材料等欺诈行为。
4.4 评标结果将在评标结束后3个工作日内公示。
医疗机构生物等效性药品管理办法

医疗机构生物等效性药品管理办法
1. 采购管理:医疗机构应根据需要、合理选择生物等效性药品,并按照采购法律法规的规定进行采购程序。
采购过程要公开透明、公正合理,确保药品质量和价格的合理性。
2. 配备与储存:医疗机构应对生物等效性药品进行配备计划,
确保药品库存充足。
同时,要严格按照药品储存要求,保持药品的适宜环境,防止药品受潮、破损或过期。
3. 使用管理:医疗机构应建立适当的使用管理制度,明确生物
等效性药品的适应症和使用范围。
医务人员在使用生物等效性药品时,要遵循科学、规范的用药原则,确保给予患者恰当的治疗。
4. 药品质量和安全监控:医疗机构应建立生物等效性药品质量
和安全监控机制,监测药品的有效性和不良反应情况。
对发现的药品质量问题和安全事件要及时上报相关部门,并采取必要的措施保障患者安全。
5. 内部培训与教育:医疗机构应定期开展有关生物等效性药品
的培训与教育活动,加强医务人员的专业知识和技能。
提高医务人员对生物等效性药品的了解,提高药品使用的质量和安全性。
6. 监督与评估:相关部门应对医疗机构的生物等效性药品管理
进行监督和评估,确保医疗机构按照规定进行管理,并及时纠正存在的问题。
对于不符合规定的行为,要采取相应的法律和纪律措施。
利奈唑胺药品说明书

利奈唑胺注射液【适应症】1、万古霉素耐药的屎肠球菌引起的感染,包括伴发的菌血症。
2、院内获得性肺炎,复杂性皮肤和皮肤软组织感染,非复杂性皮肤和皮肤软组织感染,社区获得性肺炎,由肺炎链球菌(包括对多药耐药的菌株[MDRSP]*)引起的社区获得性肺炎,包括伴发的菌血症,或由金黄色葡萄球菌(仅为甲氧西林敏感的菌株)引起的社区获得性肺炎。
【用法用量】本品治疗感染的推荐剂量见表1。
表1.利奈唑胺推荐剂量【不良反应】上市后的经验利奈唑胺上市后的临床应用中,有骨髓抑制报道(包括贫血、白细胞减少、全血细胞减少和血小板减少)(参见警告)。
曾有周围神经病和视神经病变有时进展至失明的报道。
应用利奈唑胺过程中,有乳酸性酸中毒的报道.虽然上述报道主要出现在应用利奈唑胺超过推荐的最长应用时间(28天)的患者中,但在用药时间较短的患者中也有报道。
利奈唑胺合用5-羟色胺类药物,包括抗抑郁药物如:选择性5-羟色胺再摄取抑制剂(SSRIs)的患者中,有5-羟色胺综合征的报告(见注意事项)。
在利奈唑胺应用的过程中有惊厥的报道(见注意事项)。
过敏性反应、血管性水肿、描述为Stevens Johnson综合征的皮肤水疱也有报道。
这些不良事件可能由于其严重性、报告的频度、与利奈唑胺可能的相关性,或同时伴有以上多种因素而被列出。
由于上述事件为自发性报告,无法知晓其来源于多人样本的患者人群,故不能对其发生率进行估计,也不能准确地判定其与用药的因果关系.【禁忌】本品禁用于已知对利奈唑胺或本品其他成分过敏的患者。
单胺氧化酶抑制剂正在使用任何能抑制单胺氧化酶A或B的药物(如:苯乙肼、异卡波肼)的患者,或两周内曾经使用过这类药物的患者不应使用利奈唑胺。
引起血压升高的潜在相互作用与5—羟色胺类药物潜在的相互作用【注意事项】警告在应用利奈唑胺的患者中有出现骨髓抑制的报道(包括贫血、白细胞减少、全血细胞减少和血小板减少症)。
对发生骨髓抑制或骨髓抑制发生恶化的患者应考虑停用利奈唑胺治疗。
利奈唑胺片生物等效性试验招标书要求

利奈唑胺片生物等效性试验招标书要求利奈唑胺片生物等效性招标文件要求投标须知本临床试验采用邀请招标方式,邀请国内具有临床经验丰富,试验监控能力强的CRO公司参与招标。
投标人须仔细阅读招标文件的全部条款,并作出明确响应。
投标方式必须满足以下所有条款:投标单位具有生物等效性试验经营范围的CRO公司,投标单位此前做过的生物等效性试验等临床试验经验,并提供所做品种的清单,CRO公司选定的临床医院必须具有利奈唑胺片治疗领域的临床试验资质,检验必须符合现行国家临床试验最新的要求。
招标程序及费用:1、发放标书时间:2016 年04 月12 日2、发放标书地点:湖北广济药业招标办公室3、答疑时间:如对招标文件的疑问,请投票单位在2016 年04月14 日12:00时前用书面形式提出,招标方2016年04月15日17:00时前用书面形式答复。
4、送标截止时间:2016年04月18 日9:00.逾期送达或未加盖单位公章视为废标。
5、送达投标文件地点:湖北广济药业招标办公室6、开标时间:2016年04月19日9:30。
要求参加投标单位代表带技术人员现场开标。
7、开标地点:湖北广济药业楼会议室。
8、投标费用:(1)购买招标文件费用100 元,售后不退。
(2)开标前须交纳万元投票保证金,开标后,中标单位转为履约保证金,第一笔款项拍卖会时无息退还,未中标单位在宣布结果当天无息退还。
(3)不补偿落标单位费用。
二、招标内容利奈唑胺片为湖北广济药业股份有限公司申报的化学药品6类,药物临床试验批件号为:2015L06008,按照中华人民共和国国家食品药品监督管理局(CFDA)颁布的《药品注册管理办法》(局令第28号)和《药物临床试验质量管理规范》(局令第3号,简称GCP)的最新相关要求进行生物等效性试验研究。
生物等效性试验内容包括:预试验、正试生物等效性试验(含餐前、餐后),检验方法验证、临床采血、检验、统计、资料的整理、相关记录的保管等。
利奈唑胺的临床应用治疗药物监测实施细则

利奈唑胺的临床应用治疗药物监测实施细则利奈唑胺是一种合成的噁唑烷酮类抗菌药物,用于治疗革兰氏阳性球菌及结核分枝杆菌等引起的感染。
1、NMPA批准的适应证利奈唑胺用于严重的革兰阳性球菌感染,包括社区获得性肺炎(肺炎链球菌、MSSA)、医院获得性肺炎(MSSA、MRSA、肺炎链球菌)、非复杂的皮肤及软组织感染(MSSA、化脓性链球菌)、复杂的皮肤及软组织感染(MSSA、MRSA、化脓性链球菌、无乳链球菌)、万古霉素耐药的屎肠球菌感染(VRE)。
2、超说明书用药WHO在2016年的《耐药结核病治疗指南》中将其归为MDR-TB的核心治疗药物。
2019年的《WHO耐多药或利福平耐药结核病治疗指南》中,将利奈唑胺调整到治疗耐药结核病A组的核心药物。
3、利奈唑胺作用机制利奈唑胺作用于50S亚基上核糖体23S结合位点(P位点),抑制70S 起始复合物的形成,作用于细菌蛋白质合成的起始阶段,最终产生抑菌作用。
临床用药评价公众号:有研究表明,利奈唑胺在内毒素或病原体的刺激下能够抑制免疫细胞的吞噬能力、细胞因子的合成和分泌以及免疫相关基因在mRNA水平的表达。
4、利奈唑胺药动学特点(1)吸收:口服生物利用度100%,不受食物、抗酸药物影响。
口服1-2h 可达Cmax,口服峰Cmax约12~21mg/L。
临床用药评价公众号:静脉给药Cmax 约13~15 mg/L。
(2)分布:利奈唑胺为亲水性抗菌药物,血浆蛋白结合率31%,表观分布容积40~50L。
在肺上皮细胞衬液、肺泡巨噬细胞渗透性良好,在皮肤及软组织药物浓度高,同时其脑脊液穿透性较好。
(3)代谢:主要经肝脏代谢(50%~70%),但不通过人体细胞色素P450酶代谢,也不抑制人体细胞色素同工酶活性。
在体内代谢为两个无活性产物(氨基乙氧基乙酸、羟乙基氨基乙酸)。
(4)排泄:利奈唑胺约35%以原型经肾排泄,非肾脏清除率为65%;t1/2为3.5~6h。
5、利奈唑胺血药浓度监测(1)监测原因:利奈唑胺的药品说明书推荐成人标准剂量为600 mg q12h,说明书建议轻、中度肾功能不全患者无须调整剂量。
药物研发招标文件范本

招标编号:[招标编号]招标项目名称:[药物研发项目名称]招标单位:[招标单位名称]发布日期:[发布日期]一、项目概述1.1 项目背景[招标单位名称]为满足市场需求,提高我国药物研发水平,拟开展一项[药物研发项目名称]的研发工作。
本项目旨在开发一种具有创新性、疗效显著、安全性高的新药,以解决[具体疾病或问题]。
1.2 项目目标本项目旨在研发出一种具有以下特点的新药:(1)针对[具体疾病或问题],具有明确的治疗作用;(2)具有创新性,区别于现有药物;(3)具有良好的安全性,无明显毒副作用;(4)生产工艺合理,质量可控。
1.3 项目内容本项目主要包括以下内容:(1)新药的研发与筛选;(2)新药的安全性、有效性及药代动力学研究;(3)新药的生产工艺研究;(4)新药的质量标准制定;(5)新药的临床试验。
二、投标人资格要求2.1 具有独立法人资格,注册资金不低于人民币1000万元;2.2 具有良好的商业信誉和健全的财务会计制度;2.3 具有药物研发相关资质,具备新药研发经验;2.4 具有完善的研发团队,具备新药研发能力;2.5 近三年内无重大违法、违规行为;2.6 满足招标文件中规定的其他要求。
三、投标文件要求3.1 投标文件应包括以下内容:(1)投标函;(2)法定代表人身份证明或授权委托书;(3)企业法人营业执照副本;(4)组织机构代码证副本;(5)税务登记证副本;(6)近三年财务审计报告;(7)研发团队介绍;(8)新药研发相关资质证明;(9)项目研发计划及实施方案;(10)其他相关证明材料。
3.2 投标文件应按照招标文件要求进行装订,封面应标明招标编号、项目名称、投标人名称等信息。
四、投标报价4.1 投标报价应包括研发费用、项目管理费用、质控费用、临床试验费用等,具体费用明细由投标人自行确定。
4.2 投标报价应采用人民币报价,且不得高于招标文件规定的最高限价。
4.3 投标人应保证投标报价的真实性、合理性,如发现虚假报价,将取消其投标资格。
利奈唑胺

作为MRSA肺炎治疗的一线药物。
Cao B,et al. Clin Respir J.2014 Apr 14.
良好的药物组织分布浓度是治疗 MRSA肺炎的重要保证
组织
骨 脑脊液 上皮细胞衬液 炎性渗出液 肌肉 腹透液 汗液
斯沃®
60%12 70%13 450%13 104%14 94%12 6J Antimicrob Agents.2013;41(5):426-33.
及时换用斯沃®片剂可降低患者静脉给药天数
静脉给药时间(天)
*
*
*
*
*
ITT:意向治疗人群;MITT:调整意向治疗人群;CE:临床可评估人群;ME:微生物可评估人群 *:P < 0.0001 一项随机、开放性、多中心临床研究,入组1200例成年疑似MRSA感染住院SSTI患者,按照1:1随机化,分别给 予斯沃® 600mg iv. 或po q12h,或万古霉素1g iv. q12h,比较两组患者住院天数等结果。
Fu J,et al.PLoS One. 2013;8(3)e58240.
斯沃®较其他抗菌药物更有效 抑制细菌生物被膜形成
庆大霉素 斯沃® 利福平
菌株累积数
菌株累积数
X 替加环素
万古霉素
MBICs:最低生物膜抑菌浓度
浮游细菌
附着细菌
MBECs:最低生物膜根除浓度
细菌生物被膜耐药机制是多因素的,且不同病原菌具有不同耐药机制。该研究旨在探索利奈唑胺与其他抗菌药物抑制MRSE生物被膜的有效性。结果 发现,利奈唑胺显示出更好的体外抗菌活性(MBIC:利奈唑胺vs庆大霉素 P<0.001,vs利福平 P=0.019,vs万古霉素 P=0.008;MBEC:利 奈唑胺vs庆大霉素 P<0.001,vs利福平 P=0.002,vs万古霉素 P<0.001)。
医院检验试剂招标文件

一、招标公告根据《中华人民共和国招标投标法》及有关规定,我院现就检验试剂进行公开招标,欢迎具有相应资质的企业参加投标。
二、招标项目概况1. 项目名称:医院检验试剂采购项目2. 项目内容:本次招标内容包括但不限于临床生化试剂、免疫试剂、分子诊断试剂等。
3. 项目预算:人民币XX万元整(具体金额以招标文件最终确认为准)。
4. 项目地点:我国XX省XX市XX医院5. 项目实施期限:合同签订后XX个月内完成所有检验试剂的供应。
三、投标人资格要求1. 具有独立法人资格,具备有效的营业执照、税务登记证、组织机构代码证。
2. 具有良好的商业信誉和健全的财务会计制度,无不良记录。
3. 具有相关检验试剂的生产或销售资质,且所供产品符合国家相关标准和规定。
4. 具有完善的售后服务体系,能够及时解决使用过程中出现的问题。
5. 具有良好的履约能力,能按时、按质、按量完成供货。
四、招标文件获取1. 招标文件获取时间:自本公告发布之日起至2023年X月X日止。
2. 招标文件获取方式:投标人须在规定时间内,将以下资料发送至指定邮箱(邮箱地址:***************):- 营业执照副本复印件- 税务登记证复印件- 组织机构代码证复印件- 相关检验试剂生产或销售资质证书复印件- 财务状况报告- 其他相关证明材料3. 招标文件费用:人民币XX元整,售后不退。
五、投标文件递交1. 投标文件递交截止时间:2023年X月X日X时X分。
2. 投标文件递交地点:XX省XX市XX医院招标办公室。
六、开标时间及地点1. 开标时间:2023年X月X日X时X分。
2. 开标地点:XX省XX市XX医院会议室。
七、评标办法1. 本项目采用综合评分法进行评标。
2. 评标委员会根据投标文件内容、产品性能、价格、售后服务等因素进行综合评分。
3. 评标委员会将按照得分高低确定中标候选人。
八、中标及合同签订1. 中标候选人公示:评标结束后,将在医院官方网站上公示中标候选人名单。
肿瘤ngs招标 技术参数

肿瘤ngs招标技术参数
肿瘤NGS招标的部分技术参数包括以下几个方面:
1. 检测范围:肿瘤NGS检测应覆盖癌症早筛、辅助诊断、用药指导、预后监测及遗传风险提示方面的应用。
2. 样本类型:NGS检测服务应能够处理各种样本类型,包括但不限于组织
样本、血液样本和细胞样本。
3. 检测深度:应提供足够的检测深度,以保证检测的灵敏度和特异性。
4. 数据分析:应提供高质量的数据分析服务,包括变异检测、基因融合检测、拷贝数变异检测等。
5. 质量控制:应提供严格的质量控制体系,确保检测结果的准确性和可靠性。
6. 实验室条件:投标方应具备符合相关规定的实验室条件,包括但不限于洁净度、温度控制、湿度控制等。
7. 技术人员资格:投标方应具备相应的技术人员资格,包括但不限于基因检测技术人员和生物信息分析人员。
8. 仪器设备:投标方应具备高性能的仪器设备,包括但不限于高通量测序仪、液相色谱仪、荧光定量PCR仪等。
9. 试剂与耗材:投标方应提供高品质的试剂与耗材,确保检测结果的稳定性和可靠性。
10. 服务期限:肿瘤NGS检测服务应具有合理的服务期限,以满足客户需求。
以上是肿瘤NGS招标的技术参数的简要介绍,具体的参数要求可能会根据招标文件和客户需求有所不同。
利奈唑胺片说明书

利奈唑胺片说明书
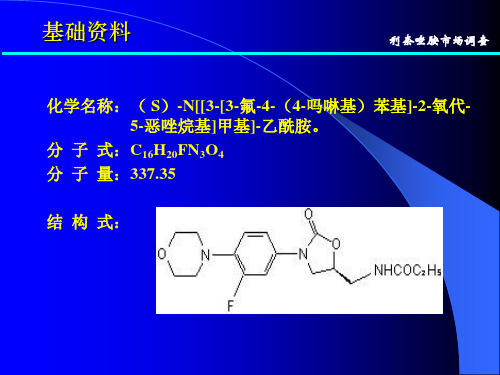
请仔细阅读说明书并在医师指导下使用。 【药品名称】 通用名称:利奈唑胺片 商品名称:斯沃® / Zyvox® 英文名称:Linezolid Tablets 汉语拼音:Linaizuoan Pian 【成份】 本品主要成份为利奈唑胺。 化学名称:(S)-N[[3-[3-氟-4-(4-吗啉基)苯基]-2-氧代-5-噁唑烷基]甲基]-乙酰胺。 化学结构式:
第 1 页,共 29 页 Version No: 20150213
或预防确诊或高度怀疑敏感菌所致感染。 如可获得细菌培养和药物敏感性结果, 应当考虑据 此选择或调整抗菌治疗。 如缺乏这些数据, 当地的流行病学资料和药物敏感性状况可能有助 于经验性治疗的选择。 在对照临床研究中, 对于应用利奈唑胺制剂超过 28 天的安全性和有效性尚未进行评价。 利奈唑胺不适用于治疗革兰阴性菌感染。如确诊或疑诊合并革兰阴性菌感染,立即开 始针对性的抗革兰阴性菌治疗十分重要(见警告)。 【规格】 600mg 【用法用量】 本品治疗感染的推荐剂量见表 1。 表 1 利奈唑胺推荐剂量
第 3 页,共 29 页 Version No: 20150213
非复杂性皮肤和皮肤软组织感染 利奈唑胺 不良反应 400 mg 口服 每 12 小时一次 (n=548) 头痛 腹泻 恶心 呕吐 头晕 皮疹 贫血 味觉改变 阴道念珠菌病 口腔念珠菌病 肝功能检查异常 真菌感染 舌褪色 局限性腹痛 弥漫性腹痛
剂量和给药途径 感染
利奈唑胺市场分析(全)
产品特点
利奈唑胺市场调查
1、作用机制独特,不易产生耐药性;
2、对耐万古霉素肠球菌、耐甲氧西林葡萄球菌、耐青霉 素肺炎链球菌等有较强抗菌活性,为治疗耐万古霉素肠 球菌感染的惟一药物;
治疗方法专利
4.
200680005849
制备利奈唑胺中间体的方法
中间体工艺专利
2007.7.7公开 2008.2.20公开
一种利奈唑胺的制备方法及其中
5.
200910045209 间体(联华科技股份: 王萍; 潘强
彪; 李杨州; 廖承志)
工艺专利
2010.7.14公开
6.
200680050215
作为促淀粉样变蛋白成像剂的同 位素标记的苯并噻唑化合物
只有当微生物实验检查显示敏感性革兰氏阳性菌感染时才应该使用利奈唑胺 治疗复杂性皮肤或皮肤软组织感染。如果已证实或怀疑同时存在革兰氏阴性致 病菌感染,在没有其他有效治疗措施时才使用利奈唑胺,还必须联合应用抗革 兰氏阴性菌的药物;
非复杂性皮肤或皮肤软组织感染,由金黄色葡萄球菌(仅为甲氧西林敏感的菌 珠)所致;
国内专利情况
利奈唑胺市场调查
序号 1.
申请号
名称
专利涉及面
到期时间
200680026281
包括利奈唑胺晶型IV的稳定的药 物组合物
晶型及药物组合专利
2008.9.10公开
2.
200780012580 制备利奈唑胺的方法(辉瑞) 工艺、中间体专利
2009.4.22公开
3.
201010002638
利奈唑胺超说明书使用专家共识

利奈唑胺超说明书使用专家共识01 利奈唑胺利奈唑胺是人工合成的噁唑烷酮类抗生素,2000年获得美国FDA批准,用于治疗革兰阳性(G+)球菌引起的感染,包括由耐甲氧西林金黄色葡萄球菌(MRSA)引起的疑似或确诊院内获得性肺炎(HAP)、社区获得性肺炎(CAP)、复杂性皮肤或皮肤软组织感染(SSTI)以及耐万古霉素肠球菌(VRE)感染。
利奈唑胺为细菌蛋白质合成抑制剂,作用于细菌50S核糖体亚单位。
与其它药物不同,利奈唑胺不影响肽基转移酶活性,只是作用于翻译系统的起始阶段,抑制mRNA与核糖体连接,阻止70S起始复合物的形成,从而抑制了细菌蛋白质的合成。
02 利奈唑胺说明书摘要1. 适应症:本品用于治疗由特定微生物敏感株引起的下列感染:由金黄色葡萄球菌(甲氧西林敏感和耐药的菌株)或肺炎链球菌引起的HAP;由肺炎链球菌引起的CAP,包括伴发的菌血症,或由金黄色葡萄球菌(仅为甲氧西林敏感的菌株)引起的社区获得性肺炎;包括未并发骨髓炎的糖尿病足部感染,由金黄色葡萄球菌(甲氧西林敏感和耐药的菌株)、化脓性链球菌或无乳链球菌引起的复杂性皮肤和皮肤软组织感染;由金黄色葡萄球菌(仅为甲氧西林敏感的菌株)或化脓性链球菌引起的非复杂性皮肤和皮肤软组织感染;万古霉素耐药的屎肠球菌感染,包括伴发的菌血症;仅用于治疗已确诊或高度怀疑敏感菌所致感染。
2. 用法:成人和青少年(12岁及12岁以上)每12小时静注或口服(片剂或口服混悬剂)600mg。
03 利奈唑胺超说明书使用超适应症腹腔感染:Birmingham等进行的一项前瞻性、开放标签、非比较性、非随机同情用药的研究项目,纳入796例患者,包括120例腹腔内感染(15.1%)病人,致病病原体包括VRE(66.3%)和MRSA(22.1%)。
结果表明,临床治愈率和微生物学成功率分别为91.5%和85.8%,利奈唑胺提供了高临床治愈率和微生物学成功率,具有非常好的总体耐受性。
2017年世界急诊外科学会的腹腔内感染管理指南建议,对于肾功能正常的院内获得性腹腔感染重症患者,如果存在VRE感染风险(包括既往肠球菌感染或定植、免疫功能低下、ICU 住院时间长或近期暴露于万古霉素),其经验性抗菌治疗方案建议为利奈唑胺给药或达托霉素治疗。
斯沃(利奈唑胺片)

斯沃(利奈唑胺片)【药品名称】商品名称:斯沃通用名称:利奈唑胺片英文名称:Linezolid Tablets【成份】利奈唑胺。
【适应症】适应症:1.本品用于治疗由特定微生物敏感株引起的下列感染:耐万古霉素的屎肠球菌引起的感染,包括并发的菌血症。
院内获得性肺炎,致病菌为金黄色葡萄球菌(甲氧西林敏感或耐甲氧西林的菌株)或肺炎链球菌(包括多药耐药的菌株[MDRSP])。
如果已证实或怀疑存在革兰阴性致病菌感染,临床上可能需要联合用药。
2.复杂性皮肤和皮肤软组织感染,包括未并发骨髓炎的糖尿病足部感染,由金黄色葡萄球菌(甲氧西林敏感或耐甲氧西林的菌株)、化脓链球菌或无乳链球菌引起。
尚无斯沃用于治疗褥疮的研究。
如果已证实或怀疑存在革兰阴性致病菌感染,临床上应考虑进行联合用药。
非复杂性皮肤和皮肤软组织感染,由金黄色葡萄球菌(仅为甲氧西林敏感的菌株)或化脓链球菌引起。
3.社区获得性肺炎及伴发的菌血症,由肺炎链球菌(包括对多药耐药的菌株[MDRSP],多药耐药的肺炎链球菌[MDRSP]是指对于如下2种或更多种抗生素耐药的菌株。
抗生素包括:青霉素、二代头孢菌素、大环内酯类药物、四环素和SMZ/TMP),或由金黄色葡萄球菌(仅为甲氧西林敏感的菌株)所致。
为减少细菌对药物耐药的发生和保持斯沃及其他抗菌药物的疗效,斯沃应仅用于确诊或高度怀疑敏感菌所致感染的治疗或预防。
当获悉培养和药物敏感性结果,应当考虑选择或调整抗菌治疗。
如缺乏这些资料,当地的流行病学和药物敏感性状况可能有利于经验性治疗的选择。
【用法用量】1.复杂性皮肤和皮肤软组织感染、社区获得性肺炎及伴发的菌血症、院内感染的肺炎(指特定的病原体,见适应症):成人和青少年(12岁及以上):每12小时600mg,静脉注射或口服;儿童患者(刚出生至11岁):每8小时按10mg/kg静脉注射或口服。
建议疗程:连续治疗10-14天。
2.万古霉素耐药的屎肠球菌感染及伴发的菌血症:成人和青少年(12岁及以上)每12小时600mg,静脉注射或口服;儿童患者(刚出生至11岁):每8小时按10mg/kg静脉注射或口服。
医院试验招标文件

一、招标公告根据我国相关法律法规,现就XX医院试验项目进行公开招标,欢迎符合条件的供应商参加投标。
一、项目名称:XX医院试验项目二、项目编号:XXXX-XXXX三、项目概况:1. 项目内容:本次招标项目为XX医院试验项目,包括但不限于临床试验、临床试验相关服务、试验药品及器械等。
2. 项目地点:XX医院3. 项目周期:自合同签订之日起至项目验收合格之日止。
4. 项目预算:人民币XXX万元四、投标人资格要求:1. 具有独立法人资格,注册资金不低于人民币XXX万元;2. 具有良好的商业信誉和健全的财务会计制度;3. 具有履行合同所必需的设备和专业技术能力;4. 具有近三年内承担过同类项目的成功案例;5. 具有有效的《药品经营许可证》或《医疗器械经营许可证》;6. 具有有效的《医疗器械注册证》或《药品注册证》。
五、投标文件要求:1. 投标人须按照招标文件的要求编制投标文件,投标文件应包括以下内容:(1)投标函;(2)法定代表人身份证明或授权委托书;(3)营业执照副本;(4)法定代表人或授权代表身份证复印件;(5)相关资质证书复印件;(6)近年承担类似项目的业绩证明材料;(7)项目实施方案及报价;(8)其他证明投标人具备履行合同能力的材料。
2. 投标文件须按照招标文件的要求进行装订、密封,并在封口处加盖公章。
六、投标截止时间及地点:1. 投标截止时间:2022年X月X日X时X分2. 投标地点:XX医院招标办公室七、开标时间及地点:1. 开标时间:2022年X月X日X时X分2. 开标地点:XX医院招标办公室八、评标办法:1. 采用综合评分法,总分100分。
2. 投标文件符合招标文件要求且投标报价在预算范围内的,按照以下标准进行评分:(1)投标人资质(30分):包括企业资质、业绩、信誉等方面;(2)项目实施方案(40分):包括项目进度、人员配备、质量保证等方面;(3)投标报价(30分):以投标报价与预算价的比值进行评分。
生物等效性临床试验方案

试验药物名称: 阿莫西林胶囊 资料项目名称: 阿莫西林胶囊中国健康受试者生物等效性试验
本研究方案版本信息及修订记录
方案编号
方案版本号 制定日期.........................................................................................................................1 方案摘要..........................................................................................................................3 1 研究背景......................................................................................................................8 1.1 立题依据 ....................................................................................................................8 1.2 试验药物临床应用情况 ..............................................................................................9 1.2.1 作用机理 ...........................................................................................
评估国产利奈唑胺对葡萄球菌和肠球菌体外抗菌活性

评估国产利奈唑胺对葡萄球菌和肠球菌体外抗菌活性于淑颖1,2,肖 盟1,杨文航1,程敬伟1,2,周梦兰1,2,陈新飞1,2,张 戈1,刘亚丽1,杨启文1,孙宏莉1,黄 勋3,伍众文4,黄文祥5,杨 青6,俞云松7,徐英春1摘要: 目的 以进口利奈唑胺(原研药)为对照,评估国产利奈唑胺(仿制药)的体外抗菌活性及与进口利奈唑胺的一致性。
方法 收集6所医院分离的甲氧西林耐药和敏感金黄色葡萄球菌(MRSA 、MSSA ),甲氧西林耐药和敏感凝固酶阴性葡萄球菌(MRCNS 、MSCNS ),万古霉素耐药肠球菌(VRE )临床分离菌株,采用CLSI 推荐的微量肉汤稀释法进行抗菌药物敏感性试验。
结果 国产利奈唑胺对金黄色葡萄球菌、凝固酶阴性葡萄球菌及VRE 的MIC 50和MIC 90分别为2 mg/L 和4 mg/L 、1 mg/L 和2 mg/ L 及2 mg/L 和2 mg/L ,全部研究菌株对国产利奈唑胺呈现敏感。
国产和进口利奈唑胺仅在对MSSA 的MIC 50上相差一个稀释梯度,两者对其他葡萄球菌和VRE 的MIC 范围、MIC 50和MIC 90完全一致。
国产和进口利奈唑胺对全部研究菌株抗菌药物敏感性结果的分类一致率(CA )和基本一致率(EA )均高达100%,两者对全部研究菌株的MIC 值完全一致或相差不超过±1个稀释梯度。
除了MRCNS 对替考拉宁的敏感率为88.0%,葡萄球菌对替加环素、达托霉素、万古霉素和替考拉宁的敏感率均高达100%。
VRE 菌株对替加环素和达托霉素呈现100%敏感率,而对替考拉宁的敏感率仅为50.0%。
相比之下,全部菌株对左氧氟沙星的敏感率明显低于其他抗菌药物。
结论 国产利奈唑胺对多重耐药葡萄球菌及肠球菌具有极好的体外抗菌活性,且与进口利奈唑胺的体外抗菌活性高度一致。
关键词: 利奈唑胺; 药物敏感性试验; 耐甲氧西林葡萄球菌; 耐万古霉素肠球菌中图分类号:R978;R378 文献标识码:A 文章编号:1009-7708 ( 2019 ) 04-0400-05DOI: 10.16718/j.1009-7708.2019.04.012Evaluation of the in vitro antimicrobial activity of domestic linezolid against clinical Staphylococcus and Enterococcus isolatesYU Shuying, XIAO Meng, YANG Wenhang, CHENG Jingwei, ZHOU Menglan, CHEN Xinfei, ZHANG Ge, LIU Yali, YANG Qiwen, SUN Hongli, HUANG Xun, WU Zhongwen, HUANG Wenxiang, YANG Qing, YU Yunsong, XU Yingchun. (Department of Laboratory Medicine, Peking Union Medical College Hospital, Beijing Key Laboratory for Mechanisms Research and Precision Diagnosis of Invasive Fungal Diseases, Chinese Academy ofMedical Sciences, Beijing 100730, China )Abstract: Objective To evaluate the in vitro antimicrobial activity of domestic linezolid (generic drug) and its consistency with imported linezolid (original drug). Methods MRSA, MSSA, MRCNS, MSCNS, and VRE strains were collected from six hospitals. The antimicrobial susceptibility testing was carried out using the microdilution method recommended by CLSI. Results The MIC 50 and MIC 90 values of domestic linezolid against Staphylococcus aureus , coagulase-negative Staphylococcus and VRE were 2 mg/L and 4 mg/L, 1 mg/L and 2 mg/L, and 2 mg/L and 2 mg/L, respectively. All the isolates were susceptible to the domestic linezolid. Only one dilution difference was found between domestic and imported linezolid in the MIC 50 value against MSSA. Other·论著·基金项目: 中国医学科学院医学与健康科技创新工程(2016-I2M-1-014);北京协和医学院创新工程基金(2018-1002-01-02)。
医院生化试剂招标文件

招标编号:[招标编号]一、招标项目名称[医院名称]生化试剂采购项目二、招标项目内容1. 项目名称:[医院名称]生化试剂采购项目2. 项目内容:本次招标旨在采购医院所需各类生化试剂,包括但不限于肝功能、肾功能、血糖、血脂、电解质、免疫学、内分泌、肿瘤标志物等检测项目所需的试剂。
3. 供货周期:中标供应商需在合同签订后30天内完成所有试剂的供货。
4. 供货地点:[医院名称]指定仓库。
5. 付款方式:验收合格后30个工作日内支付货款。
三、投标人资格要求1. 具有独立法人资格,持有有效的营业执照;2. 具有良好的商业信誉和健全的财务会计制度;3. 具有稳定的供货渠道和充足的库存;4. 具有有效的生产许可证、产品质量认证、产品注册证等相关证书;5. 具有良好的售后服务体系,能够及时解决医院在使用过程中遇到的问题;6. 近三年内无不良商业行为记录;7. 具有同类产品销售经验,且业绩良好。
四、投标文件要求1. 投标函(加盖公章);2. 法人营业执照副本复印件(加盖公章);3. 生产许可证、产品质量认证、产品注册证等相关证书复印件(加盖公章);4. 近三年财务报表(加盖公章);5. 近三年同类产品销售业绩证明材料(加盖公章);6. 具体的产品报价单(加盖公章);7. 售后服务承诺书(加盖公章);8. 其他相关证明材料。
五、招标程序1. 投标人应于招标文件规定的时间内递交投标文件,逾期不予受理;2. 招标人将对投标文件进行审查,审查合格者进入开标环节;3. 开标时,招标人将邀请所有合格投标人参加,公开开标;4. 招标人将组织评标委员会对投标文件进行评审,评审合格者进入中标候选人名单;5. 招标人将根据评审结果确定中标供应商,并签订合同。
六、招标时间及地点1. 招标时间:[招标时间]2. 投标截止时间:[投标截止时间]3. 投标地点:[医院名称]招标办公室七、联系方式1. 联系人:[联系人姓名]2. 联系电话:[联系电话]3. 电子邮箱:[电子邮箱]八、其他事项1. 本招标文件解释权归招标人所有;2. 投标人应严格按照招标文件的要求进行投标,如有违反,招标人有权取消其投标资格;3. 招标人有权对投标文件进行必要的澄清或修改;4. 本招标文件未尽事宜,由招标人另行通知。
利奈唑胺片说明书

6 小时口服一次;苯唑西林 2g 每 6 小时静注一次;万古霉素 1g 每 12 小时静注一次。
在治疗 uSSSI 的患者中,3.5%的使用利奈唑胺的患者和 2.4%的使用对照药物的患者因 与药物相关的不良事件而停止治疗。对于所有其它适应症,2.1%的使用利奈唑胺的患者和 1.7%的使用对照药物的患者因与药物相关的不良事件而停止治疗。最常见的、与药物相关 并因此而停止治疗的不良事件为恶心、头痛、腹泻和呕吐。 下表列出了临床研究中发生的频率≥0.1%或被认为严重的药物不良反应。这些研究共招 募 2000 名成年患者,给予推荐剂量的利奈唑胺长达 28 天。 大约 22%的患者出现了不良反应; 最常见的有头痛 (2.1%) 、 腹泻 (4.2%) 、 恶心 (3.3%) 和念珠菌病(尤其是口腔念珠菌病[0.8%]和阴道念珠菌病[1.1%],见下表) 。导致治疗停止的 最常见药物相关不良事件有头痛、腹泻、恶心和呕吐。约 3%的患者因出现药物相关不良事 件而停止治疗。 上市后报告的其他不良反应在下表中的频率类别为“未知”, 因为无法根据现有数据估计 实际的频率。
‡
每 8 小时,10 mg/kg 静注或口服
‡
每 12 小时,600 mg 静注或口服‡
10 至 14
每 12 小时,600 mg 静注或口服‡ 成人:每 12 小时口服
‡
14 至 28
400 mg
5-11 岁:每 12 小时,10 mg/kg 口服‡
*
青少年:每 12 小时口 服‡600 mg
10 至 14
指由特定病原体引起的感染(参见【适应症】 ) 大婴儿低, 且 AUC 值更大。这些新生儿的初始剂量应为 10 mg/kg 每 12 小时给药,当临床效果不佳 时, 应考虑按剂量 10 mg/kg 每 8 小时给药。 所有出生 7 天或以上的新生儿应按 10 mg/kg 每 8 小时的剂 量给药(参见【药代动力学】 、特殊人群、 【儿童用药】 ) 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
利奈唑胺片生物等效性招标文件要求
投标须知
本临床试验采用邀请招标方式,邀请国内具有临床经验丰富,试验监控能力强的CRO公司参与招标。
投标人须仔细阅读招标文件的全部条款,并作出明确响应。
投标方式必须满足以下所有条款:投标单位具有生物等效性试验经营范围的CRO公司,投标单位此前做过的生物等效性试验等临床试验经验,并提供所做品种的清单,CRO公司选定的临床医院必须具有利奈唑胺片治疗领域的临床试验资质,检验必须符合现行国家临床试验最新的要求。
招标程序及费用:
1、发放标书时间:2016 年04 月12 日
2、发放标书地点:湖北广济药业招标办公室
3、答疑时间:如对招标文件的疑问,请投票单位在2016 年04月14 日12:00时前用书面形式提出,招标方2016年04月15日17:00时前用书面形式答复。
4、送标截止时间:2016年04月18 日9:00.逾期送达或未加盖单位公章视为废标。
5、送达投标文件地点:湖北广济药业招标办公室
6、开标时间:2016年04月19日9:30。
要求参加投标单位代表带技术人员现场开标。
7、开标地点:湖北广济药业楼会议室。
8、投标费用:
(1)购买招标文件费用100 元,售后不退。
(2)开标前须交纳万元投票保证金,开标后,中标单位转为履约保证金,第一笔款项拍卖会时无息退还,未中标单位在宣布结果当天无息退还。
(3)不补偿落标单位费用。
二、招标内容
利奈唑胺片为湖北广济药业股份有限公司申报的化学药品6类,药物临床试验批件号为:2015L06008,按照中华人民共和国国家食品药品监督管理局(CFDA)颁布的《药品注册管理办法》(局令第28号)和《药物临床试验质量管理规范》(局令第3号,简称GCP)的最新相关要求进行生物等效性试验研究。
生物等效性试验内容包括:预试验、正试生物等效性试验(含餐前、餐后),检验方法验证、临床采血、检验、统计、资料的整理、相关记录的保管等。
三、资质要求
(1)临床试验CRO公司资质及技术要求
1、临床试验CRO公司营业执照、组织机构代码证复印件并盖公章;
2、临床试验CRO公司的质量保证文件目录,能够保证临床试验的顺利实施;
3、临床试验CRO公司有足够的有临床经验的人员保证临床试验的正确进行,(提供主要人员名单,提供以前做过的品种,临床试验核查过程中是否真实性问题,针对临床试验自查、核查有那些重要的整改措施);
4、临床试验监督员的工作经验证明;
5、充分熟悉临床试验自查后最新的技术要求,并提供必要的证明;
6、临床试验CRO公司有足够地与国家局相关机构、临床试验单位、临床试验样品检验单位沟通能力;
7、投标人必须有投标单位法人授权书。
(2)临床试验资质及技术要求
1、计划的临床试验单位,临床试验资质、有效期、试验范围包含利奈唑胺片;
2、临床试验机构质量保证文件目录,针对临床试验自查、核查有那些重要的整改措施;
3、临床试验机构应为省级以上重点临床试验单位;
4、充分熟悉临床试验自查后临床试验过程中最新的技术要求,并提供必要的证明。
(3)试验样品检验的资质及技术要求
1、检验机构的资质认证;
2、检验机构的相关质量保证文件目录;
3、检验机构出具的数据及检验过程中的必须符合国家最新要求;
4、主要检验仪器清单,能够保证试验的正常进行;
2、投标报价和付款要求
1、对临床试验分项报价。
2、分阶段付款。
1、合同签订后付10%;2、预试验完成后付5%;
3、利奈唑胺片人体生物等效性试验伦理委员会批准件后付10%;
4、实验启动前付40%;
5、临床试验单位总结报告电子版后通过国家局现场检查后付25%;
6、临床试验部分资料在CDE审核过程中无临床试验过程操作问题付10%。
3、CRO公司收到合同款后即时出具正试发票,注明税率。
3、合同主要条款
1、注明合同双方的权利和义务;
2、合同款项包含受试者的补偿及相关保险费用;
3、合同方对临床试验质量负全责。
4、进度要求
1、试验药品及对照药品提供给CRO公司后,2个月内完成预试验。
2、正试试验6个月内完成临床试验总结报告。
5、执行要求
1、合同签订后,必须提供试验进度安排表;
2、试验过程中除安排临床监督员外,合同双方均要安排人员对过程进行确认。
6、投标文件格式用内容
投标书需按标准文件提供投标书提纲逐条应答,按招标内容、资质要求、投标报价和付款要求、合同主要条款、进度要求、执行要求五大部分编制投标文件,一式五份(正本一份,副本四份)每份装订成册,并加盖单位公章,投标单位自留底稿,标书交后不退。
投标文件要求简明扼要。
(一) 招标内容
包含预试验、正试试验整个过程及数据的统计及报告的整理等详细内容。
(二)资质要求
提供资质项的复印件。
(三)投标报价和付款要求
提供分项报价及付款方案。
(四)合同主要条款
详细列出双方的权利和义务。
(五)进度要求
详细列出进度安排表。
(六)执行要求
列出实施试验过程中,工作安排计划表,试验前准备的工作计划清单,阶段过程确认事项。
7、评标办法。
