初三上学期化学方程式
(完整版)初三化学方程式大全
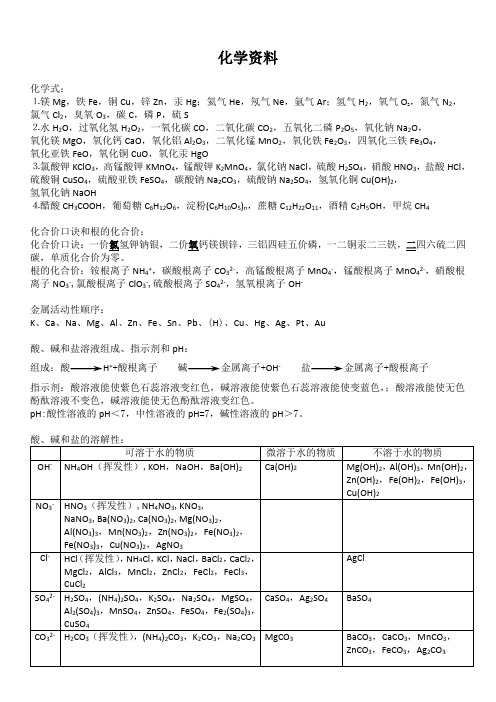
化学资料化学式:⒈镁Mg,铁Fe,铜Cu,锌Zn,汞Hg;氦气He,氖气Ne,氩气Ar;氢气H2,氧气O2,氮气N2,氯气Cl2,臭氧O3,碳C,磷P,硫S⒉水H2O,过氧化氢H2O2,一氧化碳CO,二氧化碳CO2,五氧化二磷P2O5,氧化钠Na2O,氧化镁MgO,氧化钙CaO,氧化铝Al2O3,二氧化锰MnO2,氧化铁Fe2O3,四氧化三铁Fe3O4,氧化亚铁FeO,氧化铜CuO,氧化汞HgO⒊氯酸钾KClO3,高锰酸钾KMnO4,锰酸钾K2MnO4,氯化钠NaCl,硫酸H2SO4,硝酸HNO3,盐酸HCl,硫酸铜CuSO4,硫酸亚铁FeSO4,碳酸钠Na2CO3,硫酸钠Na2SO4,氢氧化铜Cu(OH)2,氢氧化钠NaOH⒋醋酸CH3COOH,葡萄糖C6H12O6,淀粉(C6H10O5)n,蔗糖C12H22O11,酒精C2H5OH,甲烷CH4化合价口诀和根的化合价:化合价口诀:一价氯氢钾钠银,二价氧钙镁钡锌,三铝四硅五价磷,一二铜汞二三铁,二四六硫二四碳,单质化合价为零。
根的化合价:铵根离子NH4+,碳酸根离子CO32-,高锰酸根离子MnO4-,锰酸根离子MnO42-,硝酸根离子NO3-,氯酸根离子ClO3-,硫酸根离子SO42-,氢氧根离子OH-金属活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au酸、碱和盐溶液组成、指示剂和pH:组成:酸H++酸根离子碱金属离子+OH-盐金属离子+酸根离子指示剂:酸溶液能使紫色石蕊溶液变红色,碱溶液能使紫色石蕊溶液能使变蓝色,;酸溶液能使无色酚酞溶液不变色,碱溶液能使无色酚酞溶液变红色。
pH:酸性溶液的pH<7,中性溶液的pH=7,碱性溶液的pH>7。
在水中不能共存的离子:H+和OH-,H+和CO32-,H+和HCO3-,NH4+和OH-,Ca2+和CO32-,Ba2+和SO42-、CO32-,Ag+和Cl-,Fe3+、Cu2+、Mg2+和OH-检验氨气的方法:氨气能使湿润的红色石蕊试纸变蓝色。
初三上册化学方程式大全

初三上册化学方程式大全一、氧气的性质1、镁在空气中燃烧:2Mg + O₂点燃 2MgO2、铁在氧气中燃烧:3Fe + 2O₂点燃 Fe₃O₄3、铜在空气中受热:2Cu + O₂加热 2CuO4、铝在空气中燃烧:4Al + 3O₂点燃 2Al₂O₃5、氢气中空气中燃烧:2H₂+ O₂点燃 2H₂O6、红磷在空气中燃烧:4P + 5O₂点燃 2P₂O₅7、硫粉在空气中燃烧: S + O₂点燃 SO₂8、碳在氧气中充分燃烧:C + O₂点燃 CO₂9、碳在氧气中不充分燃烧:2C + O₂点燃 2CO二、实验室制氧气1、加热氯酸钾(有少量的二氧化锰):2KClO₃加热 2KCl +3O₂ ↑2、加热高锰酸钾:2KMnO₄加热 K₂MnO₄+ MnO₂+ O₂↑3、过氧化氢在二氧化锰作催化剂条件下分解反应:2H₂O₂二氧化锰 2H₂O + O₂ ↑三、水的性质1、水在直流电的作用下分解:2H₂O 通电 2H₂↑+ O₂ ↑2、生石灰溶于水:CaO + H₂O == Ca(OH)₂四、二氧化碳的性质1、碳在氧气中充分燃烧:C + O₂点燃 CO₂2、二氧化碳通过灼热碳层: C + CO₂高温 2CO3、一氧化碳在氧气中燃烧:2CO + O₂点燃 2CO₂4、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO₂+H₂O === H₂CO₃5、碳酸不稳定而分解:H₂CO₃=== H₂O + CO₂↑6、二氧化碳通入澄清石灰水:Ca(OH)₂+ CO₂==== CaCO₃↓+ H₂O7、大理石与稀盐酸反应(实验室制二氧化碳):CaCO₃+ 2HCl == CaCl₂+ H₂O + CO₂↑五、燃料及其利用1、甲烷在空气中燃烧:CH₄+ 2O₂点燃 CO₂+ 2H₂O2、酒精在空气中燃烧:C₂H₅OH + 3O₂点燃 2CO₂+ 3H₂O这些化学方程式是初三上册化学中的重要知识点,需要同学们熟练掌握和理解。
初三化学公式大全

初三化学公式大全整理了初中化学方程式大全,包括化合反应、分解反应、置换反应、以及其他初中常用化学方程式:一:化合反应1、镁在空气中燃烧:2Mg + O2 点燃2MgO2、铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O43、铝在空气中燃烧:4Al + 3O2 点燃2Al2O34、氢气在空气中燃烧:2H2 + O2 点燃2H2O5、红磷在空气中燃烧:4P + 5O2 点燃2P2O56、硫粉在空气中燃烧:S + O2 点燃SO27、碳在氧气中充分燃烧:C + O2 点燃CO28、碳在氧气中不充分燃烧:2C + O2 点燃2CO9、二氧化碳通过灼热碳层:C + CO2 高温2CO10、一氧化碳在氧气中燃烧:2CO + O2 点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO312、生石灰溶于水:CaO + H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4•5H2O14、钠在氯气中燃烧:2Na + Cl2点燃2NaCl二:分解反应15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O+ O2↑16、加热高锰酸钾:2KMnO4 加热K2MnO4 +MnO2 + O2↑17、水在直流电的作用下分解:2H2O 通电2H2↑+ O2↑18、碳酸不稳定而分解:H2CO3 === H2O + CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3 高温CaO + CO2↑三:置换反应20、铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu21、锌和稀硫酸反应(实验室制氢气):Zn + H2SO4 == ZnSO4 + H2↑22、镁和稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑23、氢气还原氧化铜:H2 + CuO 加热Cu + H2O24、木炭还原氧化铜:C+ 2CuO 高温2Cu +CO2↑25、甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 +2H2O26、水蒸气通过灼热碳层:H2O + C 高温H2 + CO27、焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe +3CO2↑四:其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH + CuSO4 == Cu(OH)2↓+ Na2SO429、甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 +2H2O30、酒精在空气中燃烧:C2H5OH + 3O2 点燃2CO2 + 3H2O31、一氧化碳还原氧化铜:CO+ CuO 加热Cu +CO232、一氧化碳还原氧化铁:3CO+ Fe2O3 高温2Fe+ 3CO233、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH + CO2 ==== Na2CO3 + H2O35、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 + 2HCl === CaCl2 +H2O + CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3 + 2HCl === 2NaCl + H2O +CO2↑。
九年级化学上册方程式总结

九年级上册化学方程式(一)化合反应1、木炭在氧气中燃烧:C+O2=点燃=CO22、硫在氧气中燃烧:S+O2=点燃=SO23、镁在空气中燃烧:2Mg+O2=点燃=2MgO4、铁在氧气中燃烧:3Fe+2O2=点燃=Fe3O45、磷在氧气中燃烧:4P+5O2=点燃=2P2O56、铜在空气中加热:2Cu+O2=△=2CuO7、氢气在氧气中燃烧:2H2+O2=点燃=2H2O8、一氧化碳在空气中燃烧:2CO+O2=点燃=2CO29、碳不充分燃烧:2C+O2(不充分)=点燃=2CO10、二氧化碳通过灼热的碳层:CO2+C=高温=2CO11、二氧化碳与水反应:CO2+H2O=H2CO311'、氧化钠溶于水:Na2O+H2O=2NaOH11''、生石灰和水化合:CaO+H2O=Ca(OH)211'''、三氧化硫溶于水:SO3+H2O=H2SO4(二)分解反应:12、氯酸钾与二氧化锰共热(实验室制O2):2KClO3=(MnO2=△=2KCl+3O2↑13、加热高锰酸钾:2KMnO4=△=K2MnO4+MnO2+O2↑14、加热碱式碳酸铜:Cu2(OH)2CO3=△=2CuO+H2O+CO2↑15、电解水:2H2O=通电=2H2↑+O2↑16、碳酸不稳定分解:H2CO3=H2O+CO2↑17、高温煅烧石灰石:CaCO3=高温=CaO+CO2↑18、硫酸铜晶体受热失去结晶水:CuSO4·5H2O=△=CuSO4+5H2O18'、氢氧化铜受热分解:Cu(OH)2=△=CuO+H2O(三)置换反应19、锌和稀硫酸反应(实验室制H2):Zn+H2SO4=ZnSO4+H2↑20、锌和盐酸的反应:Zn+2HCl=ZnCl2+H2↑21、铁和盐酸:Fe+2HCl=FeCl2+H2↑22、铁和稀硫酸:Fe+H2SO4=FeSO4+H2↑23、氢气还原氧化铜:H2+CuO=△=Cu+H2O24、木炭还原氧化铜:C+2CuO=高温=2Cu+CO2↑25、碳还原氧化铁:3C+2Fe2O3=高温=4Fe+3CO2↑26、铁和硫酸铜溶液:Fe+CuSO4=Cu+FeSO427、铜和硝酸汞溶液:Cu+Hg(NO3)2=Hg+Cu(NO3)228、氢气还原氧化铁:3H2+Fe2O3=△=2Fe+2H2O29、铝和稀硫酸:2Al+3H2SO4=Al2(SO4)3+3H2↑30、钠和水反应:2Na+2H2O=2NaOH+H2↑(四)复分解反应31、大理石和稀盐酸(实验室制CO2):CaCO3+2HCl=CaCl2+H2O+CO2↑32、氢氧化钠和硫酸铜:2NaOH+CuSO4=Cu(OH)2↓+Na2SO433、碳酸钠和盐酸(灭火器原理):Na2CO3+2HCl=2NaCl+H2O+CO2↑34、碳酸钾(草木灰)和盐酸:K2CO3+2HCl=2KCl+H2O+CO2↑35、盐酸和氢氧化钠(中和反应):HCl+NaOH=NaCl+H2O36、硫酸和氢氧化钠溶液:H2SO4+2NaOH=Na2SO4+2H2O37、硫酸与氯化钡溶液:H2SO4+BaCl2=BaSO4↓+2HCl38、盐酸与硝酸银溶液:HCl+AgNO3=AgCl↓(白)+HNO339、氢氧化钠和氯化铁溶液:3NaOH+FeCl3=Fe(OH)3↓(红褐色)+3NaCl40、碳酸钡和稀硝酸:BaCO3+2HNO3=Ba(NO3)2+CO2↑+H2O41、硫酸钠和氯化钡:Na2SO4+BaCl2=BaSO4↓+2NaCl42、氯化钠和硝酸银:NaCl+AgNO3=AgCl↓+NaNO343、碳酸钠和石灰水:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH44、氢氧化铝和盐酸:Al(OH)3+3HCl=AlCl3+3H2O45、硝酸铵和氢氧化钠:NH4NO3+NaOH=△=NaNO3+H2O+NH3↑46、氢氧化铁和硫酸:2Fe(OH)3+3H2SO4=Fe2(SO4)347、盐酸除铁锈:Fe2O3+6HCl=2FeCl3+3H2O48、氧化铜和硫酸:CuO+H2SO4=CuSO4+H2O(五)其他:49、二氧化碳使澄清石灰水变浑浊:CO2+Ca(OH)2=CaCO3↓+H2O50、二氧化碳通入氢氧化钠溶液:CO2+2NaOH=Na2CO3+H2O51、用氢氧化钠溶液吸收二氧化硫:SO2+2NaOH=Na2SO3+H2O52、一氧化碳还原氧化铜:CO+CuO=△=Cu+CO253、一氧化碳还原氧化铁(炼铁):3CO+Fe2O3=高温=2Fe+3CO254、甲烷在空气中燃烧:CH4+2O2=点燃=CO2+2H2O55、乙醇在空气中燃烧:C2H5OH+3O2=点燃=2CO2+3H2O56、甲醇在空气中燃烧:2CH3OH+3O2=点燃=2CO2+4H2O。
初三化学方程式总结(初三上册)

初三化学方程式总结(初三上册)初三化学方程式总结(初三上册)初三化学方程式总结(1--7单元)化合反应1、镁在空气中燃烧:2Mg+O2点燃2MgO2、铁在氧气中燃烧:3Fe+2O2点燃Fe3O43、铝在空气中燃烧:4Al+3O2点燃2Al2O34、氢气在空气中燃烧:2H2+O2点燃2H2O5、红磷在空气中燃烧:4P+5O2点燃2P2O56、硫粉在空气中燃烧:S+O2点燃SO27、碳在氧气中会充分燃烧:C+O2点燃CO28、碳在氧气中不充分燃烧:2C+O2点燃2CO9、二氧化碳通过冰凉碳层:C+CO2高温2CO10、一氧化碳在氧气中燃烧:2CO+O2点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O===H2CO312、生石灰溶于水:CaO+H2O===Ca(OH)213、无水硫酸铜作干燥剂:CuSO4+5H2O====CuSO45H2O14、钠在氯气中燃烧:2Na+Cl2点燃2NaCl分解反应15、实验室用双氧水制氧气:2H2O2MnO22H2O+O2↑16、加热高锰酸钾:2KMnO4加热K2MnO4+MnO2+O2↑17、水在直流电的积极作用下分解:2H2O通电2H2↑+O2↑18、碳酸不稳定而纯化:H2CO3===H2O+CO2↑19、高温煅烧石灰石(二氧化碳农业机械制法):CaCO3高温CaO+CO2↑置换反应20、铁和硫酸铜氢氧化钠反应:Fe+CuSO4==FeSO4+Cu21、锌和稀硫酸反应(实验室制氢气):Zn+H2SO4==ZnSO4+H2↑22、镁和稀盐酸反应:Mg+2HCl===MgCl2+H2↑23、氢气还原氧化铜:H2+CuO加热Cu+H2O24、木炭还原氧化铜:C+2CuO高温2Cu+CO2↑25、甲烷在空气中会燃烧:CH4+2O2点燃CO2+2H2O26、水蒸气通过灼热碳层:H2O+C高温H2+CO27、焦炭还原氧化铁:3C+2Fe2O3高温4Fe+3CO2↑其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+CuSO4==Cu(OH)2↓+Na2SO429、甲烷在空气中燃烧:CH4+2O2点燃CO2+2H2O30、酒精在空气当中燃烧:C2H5OH+3O2点燃2CO2+3H2O31、乙炔还原氧化铜:CO+CuO加热Cu+CO232、硫化氢还原氧化铁:3CO+Fe2O3高温2Fe+3CO233、氢气通过澄清石灰水(检验二氧化碳):Ca(OH)2+CO2====CaCO3↓+H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+CO2====Na2CO3+H2O35、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3+2HCl===CaCl2+H2O+CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的电磁场):Na2CO3+2HCl===2NaCl+H2O+CO2↑一.生物体与氧气的反应:(1)单质与氧气的反应:1.镁在空气中燃烧:2Mg+O2点燃2MgO2.铁在氧气中燃烧:3Fe+2O2点燃Fe3O43.铜在空气中受热:2Cu+O2加热2CuO4.铝在空气中燃烧:4Al+3O2点燃2Al2O35.氢气中二氧化碳中燃烧:2H2+O2点燃2H2O6.红磷在空气中挥发:4P+5O2点燃2P2O57.硫粉在空气中燃烧:S+O2点燃SO28.碳在氧气中充分熔化:C+O2点燃CO29.碳在氧气中不充分燃烧:2C+O2点燃2CO(2)化合物与氧气的反应:10.一氧化碳在氧气中燃烧:2CO+O2点燃2CO211.甲烷在空气之中燃烧:CH4+2O2点燃CO2+2H2O12.酒精在空气中燃点:C2H5OH+3O2点燃2CO2+3H2O二.几个分解反应:13.水在直流电的示范作用下分解:2H2O通电2H2↑+O2↑14.加热碱式碳酸铜:Cu2(OH)2CO3加热2CuO+H2O+CO2↑15.加热氯酸钾(有少量的二氧化锰):2KClO3====2KCl+3O2↑16.加热高锰酸钾:2KMnO4加热K2MnO4+MnO2+O2↑17.碳酸不稳定而分解:H2CO3===H2O+CO2↑18.高温煅烧石灰石:CaCO3高温CaO+CO2↑三.几个氧化还原成反应:19.氢气还原氧化铜:H2+CuO加热Cu+H2O20.木炭还原氧化铜:C+2CuO高温2Cu+CO2↑成才热线:8698887,8697778初三化学复习资料石灰石(或大理石)与稀盐酸反应(实验室制CO2):CaCO3+2HCl===CaCl2+H2O+CO2↑二氧化碳通过澄清石灰水(检验CO2):Ca(OH)2+CO2=CaCO3↓+H2OMnO2氯酸钾与氯二氧化锰的混合物共热:2KClO32KCl+3O2↑加热高锰酸钾:2KMnO4K2MnO4+MnO2+O2↑点燃一、燃烧反应1、木炭在氧气中会燃烧:C+O2CO2(在氧气中:产生使石灰水变浑浊的无色气体)点燃2、木炭在空气中所不充分燃烧:2C+O23、硫化氢在氧气中燃烧:2CO+O24、硫粉在氧气中所燃烧:S+O25、磷在氧气中燃烧:4P+5O26、铁在氧气中燃烧:3Fe+2O2点燃2CO2CO2(产生蓝色火焰)点燃SO2(在空气中:呈淡蓝色火焰;在氧气中:呈明亮的蓝紫色闪电,产生有刺激性气味的气体)点燃2P2O5(产生浓厚的白烟)Fe3O4(剧烈燃烧,火星四射,生成黑色固体)瓶底留少量2MgO(发出耀眼的白光,生成白色固体)2CuO(红色固体变为黑色固体)水或细沙点燃7、镁在空气中燃烧:2Mg+O28、铜在空气中加热;2Cu+O2点燃9、氢气在二氧化碳中燃烧:2H2+O2点燃2H2O(产生淡蓝色火焰,干冷烧杯壁有小水株。
初三九上化学方程式知识点汇总

11. 二氧化碳通过灼热的碳层:C + CO2 === 2CO
高温
12. 木炭还原氧化铜:C + 2CuO === CO2↑+ 2Cu(黑色粉末变红,澄清石灰水变浑浊)
高温
13. 木炭还原氧化铁:3C + 2 Fe2O3 === 3CO2↑+ 4Fe( Fe2O3 为红色,铁粉为黑色,)
14. 实验室用石灰石和稀盐酸制二氧化碳:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
24. 实验室用锌与稀硫酸制氢气:Zn + H2SO4 === ZnSO4 + H2↑ 25. 加热氧化汞:2HgO =△=== 2Hg + O2 ↑(HgO 为红色)
26. 碳酸钠和稀盐酸反应:Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑
27. 生石灰与水反应:CaO + H2O === Ca(OH)2(放出大量的热) 28. 甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O(淡蓝色火焰) 29. 乙醇(酒精)燃烧:C2H5OH +3O2 点燃 2CO2 + 3H2O( 蓝色火焰)
下册第八单元化学方程式:
(1) 金属单质 + 酸 -------- 盐 + 氢气 (置换反应) 29. 锌和稀硫酸 Zn + H2SO4 = ZnSO4 + H2↑ (实验室制取氢气) 30. 铁和稀硫酸 Fe + H2SO4= FeSO4 + H2↑ 31. 镁和稀硫酸 Mg + H2SO4 = MgSO4 + H2↑ 32. 铝和稀硫酸 2Al +3 H2SO4 = Al2(SO4)3 +3 H2↑ 33. 锌和稀盐酸 Zn + 2HCl === ZnCl2 + H2↑ 34. 铁和稀盐酸 Fe + 2HCl === FeCl2 + H2↑ 35. 镁和稀盐酸 Mg+ 2HCl === MgCl2 + H2↑ 36. 铝和稀盐酸 2Al + 6HCl == 2AlCl3 + 3 H2↑ (2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐 37. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu 38. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu 39. 铜和硝酸银溶液反应:Cu + 2 AgNO3=== Cu(NO3)2 + 2 Ag 40. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg FeSO4 、FeCl2(含 Fe2+)溶液颜色为浅绿色;Cu(NO3)2 、CuSO4(含 Cu2+)溶液为蓝色
初三上册化学反应式及其字母表达式

初三上册化学反应式及其字母表达式化学就像一个魔法世界,那些化学反应式就像是魔法咒语一样。
下面咱们就来看看初三上册都有哪些有趣的化学反应式吧。
1. 镁在空气中燃烧化学反应式:镁+氧气→氧化镁。
字母表达式:2Mg + O₂→2MgO。
这就像是镁这个小战士和氧气这个小伙伴一结合,就变成了氧化镁。
镁在燃烧的时候会发出耀眼的白光,超级酷炫的,就像夜空中最亮的星一样,这个反应在照明弹里就有应用呢。
2. 铁在氧气中燃烧化学反应式:铁+氧气→四氧化三铁。
字母表达式:3Fe+2O₂→Fe₃O₄。
铁这个硬汉在氧气里燃烧的时候,火星四射,可带劲了。
而且生成的四氧化三铁是一种黑色的固体,就像黑色的小宝石一样。
3. 氢气在空气中燃烧化学反应式:氢气+氧气→水。
字母表达式:2H₂+O₂→2H₂O。
氢气和氧气就像两个小天使,手拉手就变成了我们生命中离不开的水。
这个反应要是在纯氧里进行,燃烧会更剧烈呢。
4. 红磷在空气中燃烧化学反应式:红磷+氧气→五氧化二磷。
字母表达式:4P + 5O₂→2P₂O₅。
红磷燃烧的时候会产生大量的白烟,那白烟就是五氧化二磷的小颗粒啦。
这个反应在测定空气中氧气含量的实验里可是主角呢。
5. 硫在空气中燃烧化学反应式:硫+氧气→二氧化硫。
字母表达式:S+O₂→SO₂。
硫燃烧的时候会发出淡蓝色的火焰,如果在氧气里燃烧,火焰会变成蓝紫色的,是不是很神奇呢?不过二氧化硫可是一种有刺激性气味的气体,还会污染空气呢。
6. 碳在氧气中充分燃烧化学反应式:碳+氧气→二氧化碳。
字母表达式:C+O₂→CO₂。
碳在氧气里充分燃烧的时候,就安安静静地变成了二氧化碳。
这二氧化碳可是个很重要的气体,植物光合作用就需要它呢。
7. 碳在氧气中不充分燃烧化学反应式:碳+氧气→一氧化碳。
字母表达式:2C+O₂→2CO。
这个反应和碳充分燃烧不一样,生成的一氧化碳可是个很危险的气体,它无色无味,但是有毒呢。
8. 水通电分解化学反应式:水→氢气+氧气。
初三上册化学考试必背方程式

初三上册化学考试必背方程式化学方程式,也称为化学反应方程式,是用化学式表示化学反应的式子。
化学方程式反映的是客观事实。
用化学式(有机化学中有机物一般用结构简式)来表示物质化学反应的式子,叫做化学方程式。
搜集的《初三上册化学考试必背方程式》,期望对同学们有帮。
初三上册化学考试必背方程式篇一一、燃烧反应1、碳充分燃烧:C+O2=点燃CO22、碳不充分燃烧:2C+O2=点燃2CO3、硫燃烧:S+O2=点燃SO24、磷燃烧:4P+5O2=点燃P2O55、铁燃烧:3Fe+2O2=点燃Fe3O46、镁燃烧:2Mg+O2=点燃2MgO7、氢气燃烧:2H2+O2=点燃2H2O8、一氧化碳燃烧:2CO+O2=点燃2CO29、甲烷燃烧:CH4+2O2=点燃CO2+2H2O10、乙醇燃烧:C2H5OH+3O2=点燃2CO2+3H2O二、容易见到气体制备方程式制取氧气1、过氧化氢与二氧化锰混合制氧气:2H2O2=MnO22H2O+O2↑2、加热氯酸钾和二氧化锰制备氧气:2KClO3=MnO22KCl+O2#3、加热高锰酸钾:2KMnO4=加热K2MnO4+MnO2+O2↑4、加热氧化汞:2HgO=加热2Hg+O2↑5、电解水:2H2O=通电H2↑+O2↑制取二氧化碳1、石灰石跟稀盐酸反应制二氧化碳:CaCO3+2HCl=CaCl2+H2O+CO2↑2、碳酸不稳定:H2CO3=H2O+CO2↑3、高温煅烧石灰石:CaCO3=高温CaO+CO2↑制取氢气1、锌跟稀硫酸反应:Zn+H2SO4=ZnSO4+H2↑2、锌跟稀盐酸:Zn+2HCl=ZnCl2+H2↑3、镁跟稀盐酸反应:Mg+2HCl=MgCl2+H2↑三、其他方程式1、二氧化碳使澄清石灰水变浑浊:Ca2+CO2=CaCO3↓+H2O2、二氧化碳溶于水:CO2+H2O=H2CO33、木炭粉跟氧化铜高温共热:C+2CuO=高温2Cu+CO2↑4、木炭粉还原氧化铁:3C+2Fe2O3=高温4Fe+3CO2↑5、一氧化碳还原氧化铜:CO+CuO=加热Cu+CO26、H2还原氧化铜:H2+CuO=加热Cu+H2O7、一氧化碳还原氧化铁:3CO+Fe2O3=高温2Fe+3CO28、一氧化碳还原四氧化三铁:4CO+Fe3O4=高温3Fe+4CO2四、金属与盐溶液反应1.铁与硫酸铜溶液:Fe+CuSO4=Cu+FeSO42.铝与硫酸铜溶液:2Al+3CuSO4=Al23+3Cu3.锌与硫酸铜溶液:Zn+CuSO4=Cu+ZnSO44.铁与硝酸银溶液:Fe+2AgNO3=Fe2+2Ag5.铜与硝酸银溶液:Cu+2AgNO3=Cu2+2Ag6.锌与硝酸银溶液:Zn+2AgNO3=Zn2+2Ag初三上册化学考试必背方程式篇二C+O2点燃====CO2现象:生成能使纯净的石灰水变浑浊的气体Ca2+CO2===CaCO3↓+H2O现象:生成白色的沉淀,用于检验二氧化碳CaCO3+CO2+H2O===Ca2现象:白色固体渐渐溶解Ca△====CaCO3↓+CO2↑+H2O现象:生成白色的沉淀,同时有能使纯净的石灰水变浑浊的气体生成Cu22CO3△====2CuO+H2O+CO2↑现象:固体由绿色渐渐变成黑色,同时有能使纯净石灰水变浑浊的气体生成2NaOH+CO2===Na2CO3+H2O现象:不明显CaCO3高温====CaO+CO2↑现象:有能使纯净石灰水变浑浊的气体生成跟一氧化碳有关的,但同时也跟二氧化碳有关:Fe3O4+4CO====3Fe+4CO2现象:固体由黑色变成银白色,同时有能使纯净石灰水变浑浊的气体生成高温FeO+CO===Fe+CO2现象:固体由黑色渐渐变成银白色,同时有能使纯净石灰水变浑浊的气体生成高温Fe2O3+3CO====2Fe+3CO2现象:固体由红色渐渐变成银白色,同时有能使纯净石灰水变浑浊的气体生成高温CuO+CO====Cu+CO2现象:固体由黑色变成红色,同时有能使纯净石灰水变浑浊的气体生成初三上册化学考试必背方程式篇三1.氢氧化钠与酸性氧化物反应与二氧化碳反应,化学方程式:2NaOH+CO2=Na2CO3+H2O;实验现象:没有明显现象。
九年级上册化学化学方程式汇总

CO2+CaOH2=CaCO3↓+ H2O
19
镁在二氧化碳中燃烧
2Mg+CO2点燃2MgO +C
20
碳和二氧化碳反应
C+CO2高温2CO
21
实验室制二氧化碳
CaCO3+ 2HCl==CaCl2+ CO2↑+ H2O
22
工业制取二氧化碳
CaCO3高温CaO + CO2↑
23
一氧化碳在空气中燃烧
HCl + NaOH == NaCl + H2O 2HCl + CaOH2== CaCl2+ 2H2O
H2SO4+ 2NaOH == Na2SO4+ 2H2O H2SO4+ BaCl2== BaSO4↓+ 2HCl
2HCl + Na2CO3== 2NaCl + CO2↑+ H2O
2HCl + CaCO3== CO2↑+ CaCl2+ H2O实验室制备CO2
2HCl +Zn == ZnCl2+ H2↑ H2SO4+ Fe == FeSO4+ H2↑
2HCl + Fe == FeCl2+ H2↑
Fe2O3+3H2SO4== Fe2SO43+ 3H2O Fe2O3+6HCl == 2FeCl3+ 3H2O
CuO + 2HCl == CuCl2+ 2H2O CuO +H2SO4== CuSO4+ H2O
CaOH2+ CO2== CaCO3↓+ H2O澄清石灰水变浑浊的原因
初三上册化学所有的化学方程式

初三上册化学所有的化学方程式1. 过氧化氢反应的方程式:2H2O2 → 2H2O + O22. 硝酸反应的方程式:HNO3 + NaOH → NaNO3 + H2O3. 氯酸反应的方程式:HCl + NaOH → NaCl + H2O4. 酸性固形物溶解反应的方程式:H2CO3 + H2O → H3O+ + HCO3–5. 碳酸反应的方程式:H2CO3 → H2O + CO26. 烧碱反应的方程式:Na2CO3 + H2SO4 → Na2SO4 + H2O + CO27. 氧化性水溶液反应的方程式:MnO4–+ H2SO4 + H2O → Mn2+ + SO42– + H3O+8. 氢氧化钠反应的方程式:2Na + 2H2O → 2NaOH + H29. 氯化钠溶液的方程式:NaCl + H2O → Na+ + Cl– + H2O10.氧化铜溶液的方程式:Cu + O2 + H2O → Cu2+ + OH–11.碳酸氢钠溶液的方程式:Na2CO3 + H2O → HCO3– + Na+ + OH–12.醋酸反应的方程式:CH3COOH + H2O → CH3CO O– + H3O+13.氯化钾反应的方程式:KCl + H2O → K+ + Cl– + H2O14.硫酸反应的方程式:H2SO4 + NaOH → Na2SO4 + H2O15.铁(II)硫酸根的反应的方程式:FeS2 + HCl → FeCl2 + H2S16.还原酸反应的方程式:Fe3+ + H2C2O4 → Fe2+ + H2O + CO217.硝酸乙酯反应的方程式:C2H5ONO2 + H2O → C2H5OH + HNO318.甲醛的反应的方程式:CH2O + H2O → HCHO + H3O+19.硫酸钡的反应的方程式:BaSO4 + H2SO4 → Ba2+ + SO42– + H2O20.氧化锌的反应的方程式:Zn + O2 + H2O → Zn2+ + OH–。
初三上册化学方程式3篇

初三上册化学方程式3篇初三上册化学方程式1初中化学上册化学方程式及现象石灰石(或大理石)与稀盐酸反应(实验室制co2):caco3 + 2hcl === cacl2 + h2o+ co2↑初中化学上册化学方程式及现象二氧化碳通过澄清石灰水(检验co2):ca(oh)2 + co2 =caco3↓+ h2o初中化学上册化学方程式及现象初中化学上册化学方程式及现象氯酸钾与二氧化锰的混合物共热:2kclo3初中化学上册化学方程式及现象 2kcl + 3o2↑初中化学上册化学方程式及现象加热高锰酸钾:2kmno4初中化学上册化学方程式及现象k2mno4 + mno2 + o2↑一、燃烧反应1、木炭在氧气中燃烧:c + o2初中化学上册化学方程式及现象co2 (在氧气中:产生使石灰水变浑浊的无色气体)2、木炭在空气中不充分燃烧:2c + o2 初中化学上册化学方程式及现象2co3、一氧化碳在氧气中燃烧:2co + o2 初中化学上册化学方程式及现象2co2 (产生蓝色火焰)4、硫粉在氧气中燃烧: s + o2 初中化学上册化学方程式及现象 so2 (在空气中:呈淡蓝色火焰;在氧气中:呈明亮的蓝紫色火焰,产生有刺激性气味的气体)5、磷在氧气中燃烧:4p + 5o2初中化学上册化学方程式及现象2p2o5 (产生浓厚的白烟)初中化学上册化学方程式及现象6、铁在氧气中燃烧:3fe + 2o2初中化学上册化学方程式及现象fe3o4 (剧烈燃烧,火星四射,生成黑色固体)7、镁在空气中燃烧:2mg + o2 初中化学上册化学方程式及现象2mgo (发出耀眼的白光,生成白色固体)8、铜在空气中加热;2cu + o2 初中化学上册化学方程式及现象2cuo (红色固体变为黑色固体)9、氢气在空气中燃烧:2h2 + o2初中化学上册化学方程式及现象2h2o (产生淡蓝色火焰,干冷烧杯壁有小水株。
或产生爆鸣声)10、甲烷在空气中燃烧:ch4 + 2o2初中化学上册化学方程式及现象co2 + 2h2o11、酒精在空气中燃烧:c2h5oh + 3o2初中化学上册化学方程式及现象2co2 + 3h2o二、制取气体1、实验室用过氧化氢与二氧化锰的混合物制氧气:2h2o2 初中化学上册化学方程式及现象2h2o+ o2↑2、石灰石(或大理石)与稀盐酸反应(实验室制co2):caco3 + 2hcl === cacl2 + h2o+ co2↑初中化学上册化学方程式及现象3、锌和稀硫酸反应(实验室制h2):zn + h2so4 = znso4 + h2↑4、锌和稀盐酸反应:zn + 2hcl = zncl2 + h2↑5、镁和稀盐酸反应:mg + 2hcl = mgcl2 + h2↑6、高温煅烧石灰石:caco3初中化学上册化学方程式及现象cao + co2↑(工业上制二氧化碳的方法)三、还原反应1、木炭还原氧化铜:c+2cuo初中化学上册化学方程式及现象2cu + co2↑(黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体)2、焦炭还原氧化铁:3c+ 2fe2o3 初中化学上册化学方程式及现象4fe + 3co2↑3、一氧化碳还原氧化铜:co+cuo初中化学上册化学方程式及现象cu + co2(黑色固体变红色,产生使澄清石灰水变浑浊的气体)4、一氧化碳还原氧化铁:3co+ fe2o3初中化学上册化学方程式及现象2fe + 3co25、氢气还原氧化铜:h2 + cuo初中化学上册化学方程式及现象cu + h2o初三上册化学方程式3篇扩展阅读初三上册化学方程式3篇(扩展1)——初三上册化学方程式知识3篇初三上册化学方程式知识11、与氧气有关的化学方程式:现象:燃烧、放出大量的热、同时放出耀眼的白光,生成白色固体现象:一种黄色固体在空气中燃烧是淡蓝色的火焰;纯氧中是蓝紫色的火焰;同时生成有刺激性气味的气体。
初三化学方程式大全

初三化学方程式大全初三化学方程式大全一、物质与氧气的反应:1.单质与氧气的反应:镁在空气中燃烧:2Mg + O2 → 2MgO铁在氧气中燃烧:3Fe + 2O2 → Fe3O4铜在空气中受热:2Cu + O2加热→ 2CuO铝在空气中燃烧:4Al + 3O2 → 2Al2O3氢气中空气中燃烧:2H2 + O2 → 2H2O红磷在空气中燃烧:4P + 5O2 → 2P2O5硫粉在空气中燃烧:S + O2 → SO2碳在氧气中充分燃烧:C + O2 → CO2碳在氧气中不充分燃烧:2C + O2 → 2CO2.化合物与氧气的反应:一氧化碳在氧气中燃烧:2CO + O2 → 2CO2甲烷在空气中燃烧:CH4 + 2O2 → CO2 + 2H2O酒精在空气中燃烧:C2H5OH + 3O2 → 2CO2 + 3H2O二、几个分解反应:水在直流电的作用下分解:2H2O通电→ 2H2↑+ O2 ↑加热碱式碳酸铜:Cu2(OH)2CO3加热→ 2CuO + H2O + CO2↑加热氯酸钾(有少量的二氧化锰):2KClO3 → 2KCl + 3O2 ↑加热高锰酸钾:2KMnO4加热→ K2MnO4 + MnO2 + O2↑碳酸不稳定而分解:H2CO3 → H2O + CO2↑高温煅烧石灰石:CaCO3高温→ CaO + CO2↑三、几个氧化还原反应:氢气还原氧化铜:H2 + CuO加热→ Cu + H2O木炭还原氧化铜:C+ 2CuO高温→ 2Cu + CO2↑焦炭还原氧化铁:3C+ 2Fe2O3高温→ 4Fe + 3CO2↑焦炭还原四氧化三铁:2C+ Fe3O4高温→ 3Fe + 2CO2↑一氧化碳还原氧化铜:CO+ CuO加热→ Cu + CO2一氧化碳还原氧化铁:3CO+ Fe2O3高温→ 2Fe + 3CO2一氧化碳还原四氧化三铁:4CO+ Fe3O4高温→ 3Fe +4CO2四、单质、氧化物、酸、碱、盐的相互关系:金属单质+酸→盐+氢气(置换反应)锌和稀硫酸反应:Zn + H2SO4 → ZnSO4 + H2↑铁和稀硫酸反应:Fe + H2SO4 → FeSO4 + H2↑28.镁和稀硫酸反应生成硫酸镁和氢气。
初三常用化学方程式 100个

初三常用化学方程式1.氢气与氧气发生化合反应:2H2 + O2 → 2H2O2.镁与氧气发生化合反应:2Mg + O2 → 2MgO3.铁与氧气发生化合反应:3Fe + 2O2 → Fe3O44.碳与氧气发生化合反应:C + O2 → CO25.一氧化碳与氧气发生化合反应:2CO + O2 → 2CO26.甲烷在空气中燃烧:CH4 + 2O2 → CO2 + 2H2O7.乙醇在空气中燃烧:C2H5OH + 3O2 → 2CO2 + 3H2O8.氢氧化钠与稀硫酸发生中和反应:NaOH + H2SO4 → Na2SO4 +H2O9.氢氧化钙与稀盐酸发生中和反应:Ca(OH)2 + 2HCl → CaCl2 +2H2O10.二氧化碳与氢氧化钠反应:CO2 + 2NaOH → Na2CO3 + H2O11.氢氧化钠与二氧化碳反应:2NaOH + CO2 → Na2CO3 + H2O12.氢氧化钙与碳酸钠反应:Ca(OH)2 + Na2CO3 → CaCO3↓ +2NaOH13.碳酸钙高温分解:CaCO3 → CaO + CO2↑14.氧化钙与水反应:CaO + H2O → Ca(OH)215.硫酸铜与氢氧化钠反应:CuSO4 + 2NaOH → Cu(OH)2↓ +Na2SO416.氯化铁与氢氧化钠反应:FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl17.氯化钡与硫酸钠反应:BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl18.盐酸与硝酸银反应:HCl + AgNO3 → AgCl↓ + HNO319.硫酸与氯化钡反应:H2SO4 + BaCl2 → BaSO4↓ + 2HCl20.硫酸与氢氧化钠反应:H2SO4 + 2NaOH → Na2SO4 + 2H2O21.氧化铁与盐酸反应:Fe2O3 + 6HCl → 2FeCl3 + 3H2O22.氧化铜与硫酸反应:CuO + H2SO4 → CuSO4 + H2O23.氢氧化钠与稀硫酸反应:2NaOH + H2SO4 → Na2SO4 + 2H2O24.氢氧化钙与稀盐酸反应:Ca(OH)2 + 2HCl → CaCl2 + 2H2O25.氢氧化钠与二氧化碳反应:2NaOH + CO2 → Na2CO3 + H2O26.氢氧化钙与碳酸钠反应:Ca(OH)2 + Na2CO3 → CaCO3↓ +2NaOH27.氢氧化钠与氯化铁反应:3NaOH + FeCl3 → Fe(OH)3↓ + 3NaCl28.硫酸与氢氧化铁反应:3H2SO4 + 2Fe(OH)3 → Fe2(SO4)3 + 6H2O29.硝酸银与稀盐酸反应:AgNO3 + HCl → AgCl↓ + HNO330.硝酸银与稀氯化钠反应:AgNO3 + NaCl → AgCl↓ + NaNO331.锌与稀硫酸反应:Zn + H2SO4 → ZnSO4 + H2↑32.镁与稀盐酸反应:Mg + 2HCl → MgCl2 + H2↑33.铝与稀硫酸反应:2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑34.铁与稀盐酸反应:Fe + 2HCl → FeCl2 + H2↑35.铜与硝酸银反应:Cu + 2AgNO3 → Cu(NO3)2 + 2Ag36.铁与硫酸铜反应:Fe + CuSO4 → FeSO4 + Cu37.氧化钙与水反应:CaO + H2O → Ca(OH)238.二氧化碳与氢氧化钠反应:CO2 + 2NaOH → Na2CO3 + H2O39.二氧化碳与氢氧化钙反应:CO2 + Ca(OH)2 → CaCO3↓ + H2O40.二氧化碳与水反应:CO2 + H2O → H2CO341.氢气还原氧化铜:H2 + CuO → Cu + H2O42.碳还原氧化铜:C + 2CuO → 2Cu + CO2↑43.一氧化碳还原氧化铜:CO + CuO → Cu + CO244.碳还原氧化铁:3C + 2Fe2O3 → 4Fe + 3CO2↑45.一氧化碳还原氧化铁:3CO + Fe2O3 → 2Fe + 3CO246.碳酸钙与稀盐酸反应:CaCO3 + 2HCl → CaCl2 + H2O + CO2↑47.碳酸钠与稀盐酸反应:Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑48.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl → NaCl + H2O + CO2↑49.硫酸与碳酸钠反应:H2SO4 + Na2CO3 → Na2SO4 + H2O + CO2↑50.硫酸与碳酸氢钠反应:H2SO4 + NaHCO3 → Na2SO4 + H2O + CO2↑51.氨气与氯化氢反应:NH3 + HCl → NH4Cl52.氢氧化钠与稀硫酸反应:2NaOH + H2SO4 → Na2SO4 + 2H2O53.氢氧化钠与氯化铵反应:NaOH + NH4Cl → NaCl + NH3↑ + H2O54.碳酸氢钠受热分解:2NaHCO3 → Na2CO3 + CO2↑ + H2O55.碳酸氢铵受热分解:NH4HCO3 → NH3↑ + CO2↑ + H2O56.盐酸与硝酸银反应:HCl + AgNO3 → AgCl↓ + HNO357.硫酸与碳酸钠反应:H2SO4 + Na2CO3 → Na2SO4 + CO2↑ + H2O58.硫酸与碳酸氢钠反应:H2SO4 + NaHCO3 → Na2SO4 + CO2↑ +H2O59.硫酸与氢氧化铁反应:3H2SO4 + 2Fe(OH)3 → Fe2(SO4)3 + 6H2O60.硝酸与氢氧化铁反应:3HNO3 + Fe(OH)3 → Fe(NO3)3 + 3H2O61.氧化铁与氢气反应:Fe2O3 + 3H2 → 2Fe + 3H2O62.氧化铁与一氧化碳反应:Fe2O3 + 3CO → 2Fe + 3CO263.氧化铜与氢气反应:CuO + H2 → Cu + H2O64.氧化铜与一氧化碳反应:CuO + CO → Cu + CO265.氧化钙与水反应:CaO + H2O → Ca(OH)266.二氧化碳与氢氧化钙反应:CO2 + Ca(OH)2 → CaCO3↓ + H2O67.二氧化硫与水反应:SO2 + H2O → H2SO368.二氧化硫与氢氧化钠反应:SO2 + 2NaOH → Na2SO3 + H2O69.一氧化碳还原氧化铁:3CO + Fe2O3 → 2Fe + 3CO270.一氧化碳还原四氧化三铁:4CO + Fe3O4 → 3Fe + 4CO271.一氧化碳还原氧化铜:CO + CuO → Cu + CO272.甲烷在空气中燃烧:CH4 + 2O2 → CO2 + 2H2O73.水在直流电的作用下电解:2H2O → 2H2↑ + O2↑74.石灰石与稀盐酸反应:CaCO3 + 2HCl → CaCl2 + H2O + CO2↑75.小苏打受热分解:2NaHCO3 → Na2CO3 + CO2↑ + H2O76.碳酸钠与稀盐酸反应:Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑77.双氧水在二氧化锰催化下分解:H2O2 → H2O + O2↑78.氯酸钾在二氧化锰催化下分解:KClO3 → KCl + O2↑79.硫酸铜与氢氧化钠反应:CuSO4 + 2NaOH → Cu(OH)2↓ +Na2SO480.氯化铁与氢氧化钠反应:FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl81.硝酸铵受热分解:NH4NO3 → N2O↑ + 2H2O82.硝酸钾受热分解:KNO3 → KNO2↑ + O2↑83.碳酸氢铵受热分解:NH4HCO3 → NH3↑ + CO2↑ + H2O84.氢氧化钠与稀硫酸反应:NaOH + H2SO4 → Na2SO4 + 2H2O85.硫酸与氢氧化铜反应:H2SO4 + Cu(OH)2 → CuSO4 + 2H2O86.硫酸与氢氧化铁反应:Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 3H2O87.盐酸与硝酸银反应:HCl + AgNO3 → AgCl↓ + HNO388.盐酸与碳酸钠反应:Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑89.氯化钡与稀硫酸反应:BaCl2 + H2SO4 → BaSO4↓ + 2HCl90.硝酸与氢氧化钠反应:HNO3 + NaOH → NaNO3 + H2O91.氯化铵受热分解:NH4Cl → NH3↑ + HCl↑92.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl → NaCl + H2O + CO2↑93.硫酸铜与氢氧化钠反应:CuSO4 + 2NaOH → Cu(OH)2↓ +Na2SO494.硝酸银与氯化钠反应:AgNO3 + NaCl → AgCl↓ + NaNO395.一氧化碳还原氧化亚铁:FeO + CO → Fe + CO296.一氧化碳还原氧化银:Ag2O + CO → 2Ag + CO297.二氧化碳与氢氧化钡反应:CO2 + Ba(OH)2 → BaCO3↓ + H2O98.二氧化硫与氢氧化钾反应:SO2 + 2KOH → K2SO3 + H2O99.一氧化氮与氧气反应:NO + O2 → NO2100.二氧化氮与水反应:NO2 + H2O → HNO3。
初三上册化学方程式大全(10篇)

初三上册化学方程式大全(10篇)1.初三上册化学方程式大全篇一跟氢有关的化学方程式:2H2+O2点燃====2H2O现象:淡蓝色的火焰Zn+H2SO4==ZnSO4+H2↑现象:有可燃烧的气体生成Mg+H2SO4==MgSO4+H2↑现象:同上Fe+H2SO4==FeSO4+H2↑现象:变成浅绿色的溶液,同时放出气体2Al+3H2SO4==Al2(SO4)3+3H2↑现象:有气体生成Zn+2HCl==ZnCl2+H2↑现象:同上Mg+2HCl==MgCl2+H2↑现象:同上Fe+2HCl==FeCl2+H2↑现象:溶液变成浅绿色,同时放出气体2Al+6HCl==2AlCl3+3H2↑现象:有气体生成H2+CuO====Cu+H2O现象:由黑色的固体变成红色的,同时有水珠生成高温2Fe2O3+3H2=====2Fe+3H2O现象:有水珠生成,固体颜色由红色变成银白色跟碳有关的化学方程式:C+O2点燃====CO2(氧气充足的情况下)现象:生成能让纯净的石灰水变浑浊的气体2C+O2点燃====2CO(氧气不充足的情况下)现象:不明显高温C+2CuO=====2Cu+CO2↑现象:固体由黑色变成红色并减少,同时有能使纯净石灰水变浑浊的气体生成高温3C+2Fe2O3=====4Fe+3CO2↑现象:固体由红色逐渐变成银白色,同时黑色的固体减少,有能使纯净的石灰水变浑浊的'气体生成CO2+C高温====2CO现象:黑色固体逐渐减少3C+2H2O=CH4+2CO现象:生成的混和气体叫水煤气,都是可以燃烧的气体2.初三上册化学方程式大全篇二跟一氧化碳有关的,但同时也跟二氧化碳有关:Fe3O4+4CO====3Fe+4CO2现象:固体由黑色变成银白色,同时有能使纯净石灰水变浑浊的气体生成高温FeO+CO===Fe+CO2现象:固体由黑色逐渐变成银白色,同时有能使纯净石灰水变浑浊的气体生成高温Fe2O3+3CO====2Fe+3CO2现象:固体由红色逐渐变成银白色,同时有能使纯净石灰水变浑浊的气体生成高温CuO+CO====Cu+CO2现象:固体由黑色变成红色,同时有能使纯净石灰水变浑浊的气体生成3.初三上册化学方程式大全篇三跟硫酸有关的化学方程式:2NaOH(或KOH)+H2SO4==Na2SO4+2H2O现象:不明显Fe2O3+3H2SO4==Fe2(SO4)3+3H2O现象:红色固体溶解,生成黄色溶液CuO+H2SO4==CuSO4+H2O现象:黑色固体溶解,生成蓝色溶液Cu(OH)2+H2SO4==CuSO4+2H2O现象:蓝色沉淀溶解,生成蓝色溶液H2SO4+BaCl2==BaSO4↓+2HCl现象:生成不溶于强酸的白色沉淀,用于检验硫酸根离子CaCO3+H2SO4==CaSO4+H2O+CO2↑Na2CO3+H2SO4==Na2SO4+H2O+CO2↑2NaHCO3+H2SO4==Na2SO4+2H2O+2CO2↑现象:这三个反应现象同与盐酸反应现象一致4.初三上册化学方程式大全篇四跟碱有关的化学方程式:NaOH+HCl(或HNO3、H2SO4)==NaCl+H2O现象:酸碱中和反应,现象不明显CaO+H2O==Ca(OH)2现象:放出大量的热NaOH(KOH)+FeCl3(Fe(NO3)3、Fe2(SO4)3)==Fe(OH)3↓+NaCl现象:生成红棕色絮状沉淀,括号里面的反应过程相似,产物相对应就行了2NaOH(KOH)+FeCl2(Fe(NO3)2、FeSO4)==Fe(OH)2↓+2NaCl现象:生成白色絮状沉淀,括号里面的反映过程相似,产物相对应就行了2NaOH(KOH)+CuCl2(Cu(NO3)2、CuSO4)==Cu(OH)2↓+2NaCl现象:生成蓝色絮状沉淀,括号里面的反应过程相似,产物相对应就行了NH4Cl(NH4NO3、(NH4)2SO4)+NaOH(KOH)==NH3↑+H2O+NaCl现象:有可以使石蕊试纸变蓝的气体生成MgCl2(Mg(NO3)2、MgSO4)+NaOH(KOH)==Mg(OH)2↓+NaCl现象:生成白色沉淀,括号里面的反应过程相似,产物相对应就行了NaHCO3+NaOH==Na2CO3+H2O现象:不明显此反应的Na换成K是一样的Ca(HCO3)2+2NaOH==CaCO3↓+Na2CO3+2H2O现象:生成白色沉淀,此反应把Na换成K是一样的2NaOH+CO2==Na2CO3+H2O现象:无明显现象此反应的Na换成K是一样的Ca(OH)2+CO2==CaCO3↓+H2O现象:产生白色沉淀,此反应用于检验二氧化碳NaHSO4+NaOH==Na2SO4+H2O现象:无明显现象2NaOH+SO2==Na2SO3+H2O现象:无明显现象5.初三上册化学方程式大全篇五跟钡盐有关的化学方程式:BaCl2+Na2SO4==BaSO4↓+2NaCl现象:有白色的不溶于强酸的沉淀生成跟钙盐有关的化学方程式:CaCl2+Na2CO3==CaCO3↓+2NaCl现象:生成白色沉淀CaCO3+CO2+H2O==Ca(HCO3)2现象:固体逐渐溶解Ca(HCO3)2+Ca(OH)2==2CaCO3↓+2H2O现象:生成白色沉淀跟几种金属及其盐有关的化学方程式:铜:CuSO45H2O△====CuSO4+5H2O↑现象:固体由蓝色变为白色高温CuO+CO====Cu+CO2现象:固体由黑色逐渐变成红色,同时有能使纯净的石灰水变浑浊的气体生成H2+CuO====Cu+H2O现象:固体由黑色逐渐变成红色,同时有水珠生成Cu+2AgNO3==Cu(NO3)2+2Ag现象:铜表面慢慢生成了银白色金属CuCl2+2NaOH==Cu(OH)2↓+2NaCl现象:生成了蓝色絮状沉淀CuO+H2SO4==CuSO4+H2O现象:黑色固体溶解,生成蓝色溶液6.初三上册化学方程式大全篇六跟盐酸有关的化学方程式:NaOH(也可为KOH)+HCl==NaCl+H22O现象:不明显HCl+AgNO3==AgCl↓+HNO3现象:有白色沉淀生成,这个反应用于检验氯离子CaCO3+2HCl==CaCl2+H2O+CO2↑现象:百色固体溶解,生成能使纯净石灰水变浑浊的气体Na2CO3+2HCl==2NaCl+H2O+CO2↑现象:生成能使纯净石灰水变浑浊的气体NaHCO3+HCl==NaCl+H2O+CO2↑现象:生成能使纯净石灰水变浑浊的气体Fe2O3+6HCl==2FeCl3+3H2O现象:红色固体逐渐溶解,形成黄色的溶液Fe(OH)3+3HCl==FeCl3+3H2O现象:红棕色絮状沉淀溶解,形成了黄色的溶液Cu(OH)2+2HCl==CuCl2+2H2O现象:蓝色沉淀溶解,形成黄绿色的溶液CuO+2HCl==CuCl2+H2O现象:黑色固体溶解,生成黄绿色的溶液Zn+2HCl==ZnCl2+H2↑现象:同上Mg+2HCl==MgCl2+H2↑现象:同上Fe+2HCl==FeCl2+H2↑现象:溶液变成浅绿色,同时放出气体2Al+6HCl==2AlCl3+3H2↑现象:有气体生成7.初三上册化学方程式大全篇七跟二氧化碳有关的化学方程式:C+O2点燃====CO2现象:生成能使纯净的石灰水变浑浊的气体Ca(OH)2+CO2===CaCO3↓+H2O现象:生成白色的沉淀,用于检验二氧化碳CaCO3+CO2+H2O===Ca(HCO3)2现象:白色固体逐渐溶解Ca(HCO3)△====CaCO3↓+CO2↑+H2O现象:生成白色的沉淀,同时有能使纯净的石灰水变浑浊的气体生成Cu2(OH)2CO3△====2CuO+H2O+CO2↑现象:固体由绿色逐渐变成黑色,同时有能使纯净石灰水变浑浊的气体生成2NaOH+CO2===Na2CO3+H2O(也可为KOH)现象:不明显CaCO3高温====CaO+CO2↑现象:有能使纯净石灰水变浑浊的气体生成8.初三上册化学方程式大全篇八1、2Mg+O2点燃2MgO剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2、2Hg+O2点燃2HgO银白液体、生成红色固体拉瓦锡实验3、2Cu+O2Δ2CuO红色金属变为黑色固体4、4Al+3O2点燃2Al2O3银白金属变为白色固体5、3Fe+2O2点燃Fe3O4剧烈燃烧、火星四射、生成黑色固体、放热4Fe+3O2高温2Fe2O36、C+O2点燃CO2剧烈燃烧、白光、放热、使石灰水变浑浊7、S+O2点燃SO2剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰8、2H2+O2点燃2H2O淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料9、4P+5O2点燃2P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量10、CH4+2O2点燃2H2O+CO2蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧11、2C2H2+5O2点燃2H2O+4CO2蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属12、2KClO3MnO22KCl+3O2↑生成使带火星的木条复燃的气体实验室制备氧气O213、2KMnO4ΔK2MnO4+MnO2+O2↑紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气14、2HgOΔ2Hg+O2↑红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验15、2H2O通电2H2↑+O2↑水通电分解为氢气和氧气电解水16、Cu2(OH)2CO3Δ2CuO+H2O+CO2↑绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热17、NH4HCO3ΔNH3↑+H2O+CO2↑白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失18、Zn+H2SO4=ZnSO4+H2↑有大量气泡产生、锌粒逐渐溶解实验室制备氢气19、Fe+H2SO4=FeSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解20、Mg+H2SO4=MgSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解9.初三上册化学方程式大全篇九1、氧化性:2FeCl3+Fe===3FeCl22FeCl3+Cu===2FeCl2+CuCl2(用于雕刻铜线路版)2FeCl3+Zn===2FeCl2+ZnCl2FeCl3+Ag===FeCl2+AgCFe2(SO4)3+2Ag===FeSO4+Ag2SO4(较难反应)Fe(NO3)3+Ag不反应2FeCl3+H2S===2FeCl2+2HCl+S2FeCl3+2KI===2FeCl2+2KCl+I2FeCl2+Mg===Fe+MgCl22、还原性:2FeCl2+Cl2===2FeCl33Na2S+8HNO3(稀)===6NaNO3+2NO+3S+4H2O3Na2SO3+2HNO3(稀)===3Na2SO4+2NO+H2O2Na2SO3+O2===2Na2SO43、与碱性物质的作用:MgCl2+2NH3.H2O===Mg(OH)2+NH4ClAlCl3+3NH3.H2O===Al(OH)3+3NH4ClFeCl3+3NH3.H2O===Fe(OH)3+3NH4Cl10.初三上册化学方程式大全篇十1.需水浴加热的反应列表有:(1)银镜反应;(2)乙酸乙酯的水解;(3)苯的硝化;(4)糖的水解;(5)酚醛树脂的制取;(6)固体溶解度的测定;凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
初三化学方程式全部上册

初三化学方程式全部上册一、燃烧反应(描述现象要点:光或火焰,放热,生成物的颜色、状、态气味)1、碳充分燃烧:C+O2 =点燃CO2 (基本反应类型:化合反应)(空气中:红热)(氧气中:发出白光,放出热量,产生使石灰水变浑浊的无色气体)2、碳不充分燃烧:2C+O2 =点燃2CO (基本反应类型:化合反应)3、硫燃烧:S+O2 =点燃SO2(基本反应类型:化合反应)(空气中:淡蓝色火焰,放出热量,产生具有刺激气味的气体)(氧气中:蓝紫色火焰,放出热量,产生具有刺激气味的气体)4、磷燃烧:4P+5O2=点燃2P2O5(基本反应类型:化合反应)(产生大量白烟,P2O5污染空气)5、铁燃烧:3Fe+2O2=点燃Fe3O4(基本反应类型:化合反应)(氧气中:剧烈燃烧,火星四射,放出大量热,生成黑色固体)(瓶底留少量水或细沙,防止溅落的高温熔化物炸裂瓶底。
)6、镁燃烧:2Mg+O2=点燃2MgO (基本反应类型:化合反应)(发出耀眼的白光,生成白色固体)7、氢气燃烧:2H2+O2=点燃2H2O (基本反应类型:化合反应)(产生淡蓝色火焰,干冷烧杯壁有小水株)8、一氧化碳燃烧:2CO+O2=点燃2CO2(基本反应类型:化合反应)(产生蓝色火焰,产生使石灰水变浑浊的无色气体)9、甲烷燃烧:CH4+2O2=点燃 CO2+2H2O(产生明亮的蓝色火焰)10、乙醇燃烧:C2H5OH+3O2=点燃2CO2+3H2O二、常见气体制备方程式(一)制取氧气1、过氧化氢与二氧化锰混合制氧气:2H2O2 =MnO22H2O + O2↑(基本反应类型:分解反应)2、加热氯酸钾和二氧化锰制备氧气:2KClO3=MnO2△=2KCl+3O2↑(基本反应类型:分解反应)3、加热高锰酸钾:2KMnO4 =加热K2MnO4 + MnO2 + O2↑(基本反应类型:分解反应)(棉花:防止高锰酸钾粉末堵塞导管)(先撤导管后灭酒精灯:防止水倒流回试管底部而炸裂试管)4、加热氧化汞:2HgO=加热2Hg+O2↑(基本反应类型:分解反应)5、电解水:2H2O =通电H2↑+O2↑(基本反应类型:分解反应)(电极:正氧负氢;体积比:氢二氧一;质量比:氧八氢一;加入硫酸或氢氧化钠的目的:增强水的导电性)(二)制取二氧化碳1、石灰石跟稀盐酸反应制二氧化碳:CaCO3 + 2HCl = CaCl2 + H2O+ CO2↑(基本反应类型:复分解反应)2、碳酸不稳定:H2CO3 = H2O+CO2↑(基本反应类型:分解反应)3、高温煅烧石灰石:CaCO3=高温 CaO+CO2↑(CO2工业制法,基本反应类型:分解反应)(三)制取氢气1、锌跟稀硫酸反应:Zn + H2SO4=ZnSO4 + H2↑(实验室制氢气,基本反应类型:置换反应)2、锌跟稀盐酸:Zn + 2HCl=ZnCl2 + H2↑(实验室制氢气,基本反应类型:置换反应)3、镁跟稀盐酸反应:Mg + 2HCl=MgCl2 + H2↑(基本反应类型:置换反应)三、其他方程式1、二氧化碳使澄清石灰水变浑浊(CO2的检验):Ca(OH)2 + CO2 =CaCO3↓+ H2O2、二氧化碳溶于水:CO2+H2O = H2CO3 (基本反应类型:化合反应)(CO2通入紫色石蕊试液,试液由紫色变为红色)3、木炭粉跟氧化铜高温共热:C+2CuO=高温2Cu+CO2↑(基本反应类型:置换反应)(黑色粉末逐渐变红,生成能使澄清石灰水变浑浊的气体)4、木炭粉还原氧化铁:3C+2Fe2O3=高温4Fe+3CO2↑(基本反应类型:置换反应)5、一氧化碳还原氧化铜:CO+CuO=加热Cu+CO2(要有尾气处理装置)6、H2还原氧化铜:H2+CuO=加热Cu+H2O(基本反应类型:置换反应)(反应前先通一段时间气体:排尽装置中的空气或氧气;反应结束后继续通一段时间气体,直至试卷冷却至常温下:防止生成的Cu重新被氧化成氧化铜)7、一氧化碳还原氧化铁(赤铁矿炼铁):3CO+Fe2O3 =高温2Fe+3CO28、一氧化碳还原四氧化三铁(磁铁矿炼铁):4CO+Fe3O4=高温3Fe+4CO2四、金属与盐溶液反应(基本反应类型:置换反应)1.铁与硫酸铜溶液:Fe + CuSO4 = Cu + FeSO4(湿法冶铜,不能用铁桶盛放硫酸铜溶液原理。
初三上册化学方程式汇总完整版

初三上册化学方程式汇总Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-初三化学上册化学方程式汇总一.物质与氧气的反应:(1)单质与氧气的反应:现象1.镁在空气中燃烧:2Mg+O2点燃2MgO(发出耀眼白光、放热、生成白色粉末)2.铁在氧气中燃烧:3Fe+2O2点燃Fe3O4(剧烈燃烧火星四射,放热、生成黑色固体)3.铜在空气中受热:2Cu+O2△2CuO(红色固体变为黑色)4.铝在空气中氧化:4Al+3O22Al2O35.氢气中空气中燃烧:2H2+O2点燃2H2O6.红磷在空气中燃烧:4P+5O2点燃2P2O5(放热、生成大量白烟)7.硫粉在空气中燃烧:S+O2点燃SO2(硫在空气里燃烧发出微弱的淡蓝色火焰,在氧气中燃烧得更旺发出蓝紫色火焰,放热、生成有刺激性气味的气体)8.碳在氧气中充分燃烧:C+O2点燃CO2(发出白光、放热、生成一种能使石灰水变浑浊的无色气体)9.碳在氧气中不充分燃烧:2C+O点燃2CO (2)化合物与氧气的反应:10.一氧化碳在氧气中燃烧:2CO+O2点燃2CO211.甲烷在空气中燃烧:CH4+2O2点燃CO2+2H2O12.酒精/乙醇在空气中燃烧:C2H5OH+3O2点燃2CO2+3H2O二.实验室制取氧气、二氧化碳、氢气原理★★★★13.加热高锰酸钾:2KMnO4△K2MnO4+MnO2+O2↑★14.加热氯酸钾(二氧化锰做催化剂):2KClO3MnO22KCl+3O2↑★15.双氧水制取氧气:2H2O2MnO22H2O+O2↑★16.△实验室制取二氧化碳:CaCO3+2HClCaCl2+CO2↑+H2O17.实验室制取氢气:Zn+H2SO4(稀)ZnSO4+H2↑三.利用氢气、碳、一氧化碳还原性的反应:18.一氧化碳还原四氧化三铁:Fe3O4+4CO高温3Fe+4CO219.氢气还原氧化铜:CuO+H2高温H2O+Cu★20.木炭还原氧化铜:2CuO+C高温CO2↑+2Cu(有红色固体生成,有能使澄清石灰水变浑的气体生成)21.焦炭还原氧化铁:2Fe2O3+3C高温4Fe+3CO2↑22.焦炭还原四氧化三铁:Fe3O4+2C高温3Fe+2CO2↑★23.一氧化碳还原氧化铜:CuO+CO高温Cu+CO2(黑色粉末变红色,有能使澄清石灰水变浑的气体生成)★24.一氧化碳还原氧化铁:Fe2O3+3CO高温2Fe+3CO2(炼铁原理)(红色粉末变黑色,有能使澄清石灰水变浑的气体生成)25..二氧化碳与碳高温下反应:C+CO高温2CO 四.其它反应:26.碳酸不稳定而分解:H2CO3CO2↑+H2O(红色石蕊试液变紫)★27.水在直流电的作用下分解:2H2O通电2H2↑+O2↑(生成无色气体,正氧负氢,氢二氧一)28.二氧化碳溶解于水:CO2+H2O==H2CO3(紫色石蕊试液变红)29.高温煅烧石灰石:CaCO3高温CaO+CO2↑(工业制二氧化碳)★30.检验二氧化碳的方法;石灰水露置在空气中产生一层白膜;刚粉刷的墙壁出汗;石灰水变浑浊;石灰水瓶壁有一层白膜CO2+Ca(OH)2CaCO3↓+H2O31.铁与硫酸铜反应:Fe+CuSO4FeSO4+Cu(生成红色固体,蓝色溶液变为浅绿色)32.碳酸钠与盐酸反应(泡沫灭火器原理):Na2CO3+2HCl2NaCl+CO2↑+H2O33.氢氧化钠与硫酸铜反应:CuSO4+2NaOHCu(OH)2↓+Na2SO4(有蓝色沉淀生成)。
初三化学必背知识点方程式

初三化学必背知识点方程式一、必背化学方程式。
1. 氧气的制取。
- 过氧化氢分解制取氧气。
- 化学方程式:2H_2O_2{MnO_2}{===}2H_2O + O_2↑- 反应原理:过氧化氢在二氧化锰作催化剂的条件下分解生成水和氧气。
- 氯酸钾分解制取氧气。
- 化学方程式:2KClO_3{MnO_2,}{===}2KCl+3O_2↑- 反应原理:氯酸钾在二氧化锰作催化剂并加热的条件下分解生成氯化钾和氧气。
- 高锰酸钾分解制取氧气。
- 化学方程式:2KMnO_4{}{===}K_2MnO_4+MnO_2+O_2↑- 反应原理:高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气。
2. 氢气的制取。
- 锌和稀硫酸反应制取氢气。
- 化学方程式:Zn + H_2SO_4===ZnSO_4+H_2↑- 反应原理:锌的活动性比氢强,能置换出稀硫酸中的氢元素生成氢气。
3. 二氧化碳的制取。
- 大理石(或石灰石)与稀盐酸反应制取二氧化碳。
- 化学方程式:CaCO_3+2HCl===CaCl_2+H_2O + CO_2↑- 反应原理:碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳。
大理石或石灰石的主要成分是碳酸钙。
4. 水的电解。
- 化学方程式:2H_2O{通电}{===}2H_2↑+O_2↑- 反应现象:电极上有气泡产生,正极产生的气体能使带火星的木条复燃(氧气),负极产生的气体能燃烧,产生淡蓝色火焰(氢气),氢气和氧气的体积比约为2:1。
5. 碳的化学性质相关方程式。
- 碳在氧气中充分燃烧。
- 化学方程式:C + O_2{点燃}{===}CO_2- 反应现象:发出白光,放出热量,生成能使澄清石灰水变浑浊的气体。
- 碳在氧气中不充分燃烧。
- 化学方程式:2C+O_2{点燃}{===}2CO- 碳还原氧化铜。
- 化学方程式:C + 2CuO{高温}{===}2Cu+CO_2↑- 反应现象:黑色固体逐渐变成红色,生成能使澄清石灰水变浑浊的气体。
初三上化学方程式汇总

初三上化学方程式汇总今天咱们一起来看看初三上学期那些有意思的化学方程式哟。
就好像我们在探索一个神奇的化学世界,每个方程式都是打开这个世界一扇扇门的钥匙呢!一、化合反应。
咱们先说说化合反应哈。
啥叫化合反应呢?简单说呀,就是几种物质变成一种物质的反应,就好像几个小伙伴手拉手变成了一个超级小伙伴一样。
比如说,碳在氧气中燃烧的反应:C + O_2{点燃}{===}CO_2。
想象一下,黑乎乎的碳就像一个个小煤炭精灵,氧气呢,就像一群调皮的小风儿,当它们碰到一起,被点燃后呀,就会发生奇妙的变化,变成了无色无味的二氧化碳气体啦,就好像小煤炭精灵和小风儿一起玩了个神奇的魔法,变成了新的东西呢。
还有硫在氧气中燃烧:S + O_2{点燃}{===}SO_2。
硫就像一颗黄色的小珠子,当它在氧气里燃烧的时候呀,会发出明亮的蓝紫色火焰,可漂亮啦!然后就变成了有刺激性气味的二氧化硫气体,就好像这个小珠子施了魔法,变成了一种会让我们鼻子有点不舒服的新东西哟。
二、分解反应。
接下来看看分解反应哦。
分解反应呀,就像是一个大团队解散,分成了几个小团队。
比如说过氧化氢分解:2H_2O_2{MnO_2}{===}2H_2O + O_2↑。
过氧化氢就像一个装满了魔法药水的瓶子,当我们加入二氧化锰这个神奇的“催化剂”后呀,它就开始变魔术啦!会分解成水和氧气,就好像瓶子里的魔法药水分成了两部分,一部分变成了我们天天都能见到的水,另一部分变成了能让小蜡烛燃烧得更旺的氧气哟。
还有高锰酸钾受热分解:2KMnO_4{}{===}K_2MnO_4 + MnO_2 + O_2↑。
高锰酸钾就像一个神秘的紫色小盒子,当我们给它加热的时候呀,它就像打开了宝藏一样,会分解出锰酸钾、二氧化锰和氧气。
想象一下,这个紫色小盒子里藏着好多小秘密,一加热,这些秘密就都跑出来啦,变成了不同的东西哟。
三、置换反应。
置换反应就像是两个小伙伴交换了自己的玩具一样。
比如说铁和硫酸铜溶液反应:Fe + CuSO_4 = FeSO_4 + Cu。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初三上册化学方程式
一、物质与氧气的反应:
1. 镁在空气中燃烧:2Mg + O2点燃 2MgO
2. 铁在氧气中燃烧:3Fe + 2O2点燃 Fe3O4
3. 铜在空气中受热:2Cu + O2加热 2CuO
4. 铝在空气中燃烧:4Al + 3O2点燃 2Al2O3
5. 氢气中空气中燃烧:2H2 + O2点燃 2H2O
6. 红磷在空气中燃烧:4P + 5O2点燃 2P2O5
7. 硫粉在空气中燃烧: S + O2点燃 SO2
8. 碳在氧气中充分燃烧:C + O2点燃 CO2
9. 碳在氧气中不充分燃烧:2C + O2点燃 2CO
10. 一氧化碳在氧气中燃烧:2CO + O2点燃 2CO2
11. 甲烷在空气中燃烧:CH4 + 2O2点燃 CO2 + 2H2O
12. 酒精在空气中燃烧:C2H5OH + 3O2点燃 2CO2 + 3H2O
二.分解反应:
13. 水在直流电的作用下分解:2H2O 通电 2H2↑+ O2 ↑
14. 加热氯酸钾(有少量的二氧化锰):2KClO3 === 2KCl + 3O2 ↑
15. 加热高锰酸钾:2KMnO4加热K2MnO4 + MnO2 + O2↑
16. 碳酸不稳定而分解:H2CO3 === H2O + CO2↑
17. 高温煅烧石灰石:CaCO3高温CaO + CO2↑
三.氧化还原反应:
19. 氢气还原氧化铜:H2 + CuO 加热 Cu + H2O
20. 木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑
21. 焦炭还原氧化铁:3C+ 2Fe2O3高温4Fe + 3CO2↑
22. 焦炭还原四氧化三铁:2C+ Fe3O4高温3Fe + 2CO2↑
23. 一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO2
24. 一氧化碳还原氧化铁:3CO+ Fe2O3高温2Fe + 3CO2
25. 一氧化碳还原四氧化三铁:4CO+ Fe3O4高温3Fe + 4CO2
四、其他反应
26 实验室制CO2大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
27. CO2与水反应:H2O + CO2 ==== H2CO3
28 检验二氧化碳的方法:Ca(OH)2 + CO2 ==== CaCO3↓+ H2O
29. 锌和稀硫酸Zn + H2SO4==== ZnSO4 + H2↑。
