第三章 电极-溶液界面的结构与性质
电化学基本原理与应用-第3章

净电荷
α
偶极层
3.2.1 “孤立相”的几种电位
(1)外电位(Ψα)
将试验电荷自无穷远处移至距球面约 10-4~10-5厘米处。在这一过程中可以认为 球体与试验电荷之间的短程力尚未开始作 用。根据电位的定义,此时所做的功为:
W1 = Zie0ψ α
ψ α = W1
Z ie0
球体α的外部电位
试验电荷电量
当试验电荷从相内逸出到相外时,这一过 程所涉及的能量变化(-Wiα)相当于试验电荷从 该相逸出而必须摆脱与该相物质之间的短程 相互作用及越过表面时对表面电势所做的功。 这部分功称为试验电荷在α相的“逸出功”, 显然应满足下列关系式:
−Wiα = μiα + Zi Fχ α
3.2.1 “孤立相”的几种电位
(b)内电位差,又称“伽伐尼(Galvani) 电位差”,定义为φα-φβ。直接接触的两相 间的内电位差,用 αΔβφ 表示。由于表面电 位无法测量,所以该值不能测量。也无法理 论计算。
3.2.2 相间电位差
φα −φ β = (χ α +ψ α ) − (χ β +ψ β ) = (ψ α − ψ β ) + ( χ α − χ β )
(1)相间电位差的种类 两相之间出现“相间电位差”的原因只可
能是界面层中带电粒子或偶极子的非均匀分 布,并形成了界面荷电层。
根据以上关于孤立相电位的讨论不难推 想,所谓α、β两相之间的电位差也因此可 能有各种不同的定义,其中较常用的有下面 三种:
3.2.2 相间电位差
(a) 外电位差,又称“伏打(Volta)电位 差”,定义为ψα-ψβ。直接接触的两相间的 外电位差,用 αΔβψ 表示。两相均为金属 时,为金属接触电位差,可直接测量。
电化学原理-吴金平-2012第三章304-1-wu

OHP
水化程度高, 冲出水化膜、 钻进水偶极 层难! 水偶极层 水化阳离子层
外紧密层结构示意图
b.内紧密层结构(q>0)
特性吸附:内紧密层的离 子吸附称为特性吸附 紧密层厚度:仅为一个 阴离子半径,d=r-
IHP
0 r
x1
1 1 1 = C紧 C水 C 0 r
x2
x1 x2 1 = C紧 0 H2O 0
H2O
x1 1 C紧 0 H 2O
实验结果证明:在荷负电的电极上, 紧密层的
电容与组成双电层的水化阳离子的种类基本无关.
x1 1 C紧 0 H2O
紧密层是带有剩余电荷的两相之间的界面层,厚度不 超过几个埃;而分散层是液相中具有剩余离子电荷及 电位梯度的表面层,稀溶液中及表面电荷密度很小时 分散层厚度可达几百埃。 浓溶液中及表面电荷密度不太小时几乎可以忽视分散 层的存在,即可近似认为分散层中的剩余电荷均集中 在界面层的外表面上。
§3.5 零电荷电位
例:已知某电极的 求此时对应的零标电位
思考:零标电位能否用于热力学计算中的电位标度?
p162
课堂练习:
某电极的微分电容曲线如图2所示,试画出图中1和 2 电位下的双电层结构示意图及电位分布图。
四、
的作用
判断电极表面剩余电荷q的符号和数量
1、可以通过
规律:
例:已知汞在稀的KCl溶液中
2 . 通过零电荷电位可研究电极/溶液界面的许 多重要性质:
双电层电位分布、界面电容、界面张力、 离子的 界面吸附行为、气体在金属表面的附着、溶液对金属 电极的润湿性、电动现象和光电现象等 . 零电荷电位下的极值现象: 界面张力
电极溶液界面的结构与性质

电极溶液界面的结构与性质各类电极反应都发生在电极/溶液的界面上,因而界面的结构和性质对电极反应有很大影响。
这一影响主要表现在以下两个方面。
1.界面电场对电极反应速度的影响界面电场是由电极/溶液相间存在的双电层所引起的。
而双电层中符号相反的两个电荷层之间的距离非常小,因而能给出巨大的场强。
特别有意义的是,电极电位可以被人为地、连续地加以改变,因而可以通过控制电极电位来有效地、连续地改变电极反应速度。
这正是电极反应区别于其他化学反应的一大特点。
2.电解液性质和电极材料及其表面状态的影响电解质溶液的的组成和浓度,电极材料的物理、化学性质及其表面状态均能影响电极/溶液界面的结构和性质,从而对电极反应的性质和速度有明显的作用。
所以,要深入了解电极过程的动力学规律,就必须了解电极/溶液界面的结构和性质。
对界面有了深入的研究,才能达到有效地控制电极反应性质和反应速度的目的。
一、电极/溶液界面的基本结构在电极/溶液界面存在着两种相间相互作用:一种是电极与溶液两相中的剩余电荷所引起的静电作用;另一种是电极和溶液中各种粒子之间的短程作用。
这些相互作用决定着界面的结构和性质。
我们在物理化学中已学过,某种物质的分子、原子或离子在界面富集或贫乏的现象称为吸附。
按照吸附作用力的性质,可分为物理吸附和化学吸附。
当电极表面带有剩余电荷时,会在静电作用下使荷相反符号电荷的离子聚集到界面区,这种现象可称为静电吸附。
除此之外,溶液中的各种粒子还可能因非静电作用力而发生吸附,则称为特性吸附。
本节只讨论特性吸附现象。
凡是能在电极/溶液界面发生吸附而使界面张力降低的物质,就叫做表面活性物质。
表面活性物质在界面的特性吸附行为取决于电极与表面活性粒子之间、电极与溶剂分子之间、表面活性粒子与溶剂分子之间的相互作用。
因此,不同的物质发生特性吸附的能力不同,同一物质在不同的电极体系中的吸附行为也不相同。
如前所述,绝大多数阳离子地表面活性都很小,可作为非表面活性物质处理。
第三章2电极溶液界面
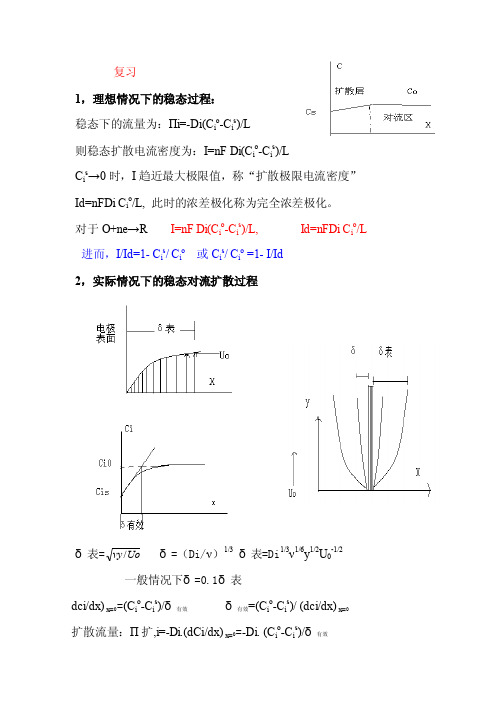
复习1,理想情况下的稳态过程:稳态下的流量为:Πi=-Di(C i o-C i s)/L则稳态扩散电流密度为:I=nF Di(C i o-C i s)/LC i s→0时,I趋近最大极限值,称“扩散极限电流密度”Id=nFDi C i o/L, 此时的浓差极化称为完全浓差极化。
对于O+ne→R I=nF Di(C i o-C i s)/L, Id=nFDi C i o/L 进而,I/Id=1- C i s/ C i o或C i s/ C i o =1- I/Id2,实际情况下的稳态对流扩散过程δ表=Uovy/δ=(Di/ν)1/3δ表=Di1/3ν1/6y1/2U0-1/2一般情况下δ=0.1δ表dci/dx) x=0=(C i o-C i s)/δ有效δ有效=(C i o-C i s)/ (dci/dx) x=0扩散流量:Π扩,i=-Di.(dCi/dx) x=0=-Di. (C i o-C i s)/δ有效I=-nF Π扩,i=nF Di. (C i o -C i s )/δ有效将δ=(Di/ν)1/3 δ表=Di 1/3ν1/6y 1/2U 0-1/2代入上两式得电极表面上各处的电流密度和极限电流密度:I=nF Di 2/3ν-1/6-y -1/2U 01/2 (C i o -C i s ) Id= nF Di 2/3ν-1/6-y -1/2U 01/2 C i o 同样:I/Id=1- C i s / C i o 或C i s / C i o =1- I/Id 旋转圆盘电极上的扩散过程δ=(C i o -C i s )/ (dci/dy) y=0=1.62 Di 1/3ν1/6y 1/2U 0-1/2=1.62 Di 1/3ν1/6ω-1/2 所以稳态对流扩散的电流密度为: I= nF Di. (C i o -C i s )/δ有效=0.62nF Di 2/3ν-1/6ω1/2(C i o -C i s )Id=0.62nF Di 2/3ν-1/6ω1/2C i o同样:I/Id=1- C i s / C i o 或C i s / C i o =1- I/Id§3.6 当电极反应速度由液相传质步骤控制时极化曲线的形成及其应用因为具体实验中,通常最容易得到的是I-Φ曲线,所以我们有必要对液相传质步骤的极化曲线的形状有所了解。
电化学原理-第3章:电极溶液界面的结构性质-4

为了研究界面的结构 和性质,就希望界面 上不发生电极反应, 使外电源输入的全部 电流都用于建立或改 变界面结构和电极电 位,即可等效为图3.1 (b)中的电路。
( ) ' ln a
根据(3.21)或(3.22) 求得该浓度下的离子表 面剩余量 v
(v v ) RT ln a ( ) '
v ( ) ' (v v ) RT ln a
当电极表面带负电时,(曲 线右半部分),正离子表面
1.界面电场对电极反应速度的影响
界面电场是由电极/溶液相间存在的双电层所引起的。
而双电层中符号相反的两个电荷层之间的距离非常小, 因而能给出巨大的场强。 例如 双电层电位差(即电极电位)为1V,而界面两 个电荷层的间距为 108 cm 时,其场强可
达 10 V cm 。
8
已知电极反应是得失电子的反应,也就是有电荷在相 间转移的反应。 巨大的界面电场下,电极反应速度必将发生极大的变 化,甚至某些在其他场合难以发生的化学反应也得以 进行。
特别有意义的是,电极电位可以被人为的,连续的加
以改变,因而可以通过控制电极电位来有效地,连续 地改变电极反应速度。这正是电极反应区别于其他化
学反应的一大优点。
2.电解液性质和电极材料及其表面状态的影响
电解质溶液的组成和浓度,电极材料的物理,化学性质及其 表面状态均能影响电极/溶液界面的结构和性质,从而对电 极反应性质和速度有明显的作用。 例如在同一电极电位下,同一种溶液中,析氢反应
这样,可以把电极电位 改变到所需要的数值, 并可定量分析建立这种 双电层结构所需要的电 量。 这种不发生任何电极反 应的电极体系称为理想 极化电极。
电极溶液界面课件

contents
目录
• 电极溶液界面基础 • 电极溶液界面的电化学性质 • 电极溶液界面的物理化学性质 • 电极溶液界面的应用 • 电极溶液界面的研究方法与技术
01
电极溶液界面基础
电极溶液界面的定义
总结词
电极溶液界面是指电极和与之接触的溶液之间的界面,是电化学反应的重要场 所。
燃料电池
燃料电池利用电极溶液界面将化学能转化为电能。电极溶液界面的性质决定了燃料电池的效率和耐久 性。优化电极溶液界面的结构和组成可以提高燃料电池的性能。
传感器与生物电分析
电化学传感器
电极溶液界面在电化学传感器中发挥着关键作用。通过监测电极溶液界面上的电化学反应,可以实现对气体、离 子、有机物等的快速、灵敏检测。例如,电化学气体传感器利用电极溶液界面检测环境中的有害气体。
形貌
电极表面形貌对溶液在电极表面的润湿和电化学反应过程产 生影响,不同形貌的电极具有不同的电化学性能。
04
电极溶液界面的应用
电化学能源存储与转换
电池技术
电极溶液界面在电池中起着至关重要的作用。它可以影响电池的能量密度、充放电速度和循环寿命。 例如,锂离子电池利用电极溶液界面进行电荷转移和离子传输,从而实现高效的能量存储和释放。
电极反应的步骤和涉及的中间产物。
电极反应动力学方程
描述电极反应速率与反应物浓度、温度等因素关系的方程。
离子传输与迁移
01
02
下的迁移 速率。
离子淌度
离子迁移速率与电场强度 的比值。
离子扩散系数
描述离子在溶液中扩散速 率的参数。
双电层结构与电动现象
双电层结构
电极表面与溶液之间的电荷分布, 包括紧密层和扩散层。
电化学原理第三章

第三章
二、电毛细现象 三、双电层的微分电容
电极/溶液界面 四、双电层的结构
的结构和性质 五、零电荷电位 六、电极/溶液界面的吸附现
象
09:37:26
§3.1 概述
一、 研究电极/溶液界面性质的意义
由于各电极反应都发生在电极/溶液的界面上,故界面结和性质对电极反 应影响很大。
1. 界面电场对电极反应速度的影响 由于双电层极薄,故场强可很大,而电极反应是电荷在相间转移的反
09:37:26
三、离子表面剩余量 构成双电层溶液一侧发生了离子的吸附。金属侧电子过剩
或不足,溶液侧剩余正负离子浓度不同,发生了吸附现象 ,见下图。
09:37:26
离子表面剩余量:界面层存在时离子的摩尔数与无离子双 电层存在时离子的摩尔数之差定义为离子的表面剩余量。
T
(v
v v )RT
ln a
(1) 假设离子与电极间除静电引力外无其它相互作用, 双电层厚度比电极曲线半径小很多,将电极视为平板电极, 粒子在界面电场中服从波尔兹曼分布。
(2) 忽略粒子的体积,假定溶液中离子电荷是连续分布 的(实际上离子具有粒子性,故离子电荷是不连续分布的) 。故可用泊松(Poisson)方程。把剩余电荷的分布与双电层 溶液一侧的电位分布联系起来。电极表面剩余电荷密度q为正 值时,φ>0,随距离x增加,φ值逐渐减小 即: 0
李普曼方程
§3.2 电毛细现象 一、电毛细曲线及其测定
两相间均存在界面张力,电极体系界面张力不仅与界面 层的物质有关,而且与电极电位有关,此界面张力随电极电 位变化的现象叫做电毛细现象。而界面张力与电极电位的关 系曲线叫做电毛细曲线。常用毛细管静电计测取液态金属的 电毛细曲线。
电化学原理简答题

电化学原理简答题第三章电极/溶液界面的结构与性质1.为什么电毛细曲线是具有极大值的抛物线形状?溶液界面存在双电层,剩余电荷无论带正电还是负电,同性电荷间相互排斥,使界面扩大,而界面张力力图使界面缩小,两者作用效果相反,因此带电界面的张力比不带电时小,且电荷密度越大,界面张力越小,因此电毛细曲线是具有极大值的抛物线形状。
2.标准氢电极的表面剩余电荷是否为零?不一定,标准氢电极电位为0指的是氢标电位,是人为规定的,电极表面剩余电荷密度为0时的电位指的是零电荷电位,其数值并不一定为0;因为形成相间电位差的原因除了离子双电层外,还有吸附双电层\偶极子双电层\金属表面电位。
3.影响双电层结构的主要因素是什么?为什么?静电作用和热运动。
静电作用使符号相反的剩余电荷相互靠近,贴于电极表面排列,热运动使荷电粒子外散,在这两种作用下界面层由紧密层和分散层组成。
4.什么叫Ψ1电位?能否说Ψ1电位的大小只取决于电解质总浓度而与电解质本性无关? Ψ1电位的符号是否总是与双电层总电位的符号一致?为什么?距离电极表面d处的电位叫Ψ1电位。
不能,因为不同的紧密层d的大小不同,而紧密层的厚度显然与电解质本性有关,所以不能说Ψ1电位的大小只取决于电解质总浓度而与电解质本性无关。
当发生超载吸附时Ψ1电位的符号与双电层总电位的符号不一致。
5.简要概括电极/溶液界面发展的四个阶段、优缺点及其主要内容。
①亥姆赫兹紧密双电层模型:主要内容:将双电层比作是平行板电容器优点:a能够解释界面张力随电极电位变化b能够解释微分电容曲线上所出现的平台区域缺点:a解释不了界面电容随电极电位和溶液总浓度的变化规律b解释不了在稀溶液中,零电荷电位下微分电容最小等实验事实②Gouy和Chapman分散层模型:主要内容:溶液中的离子在静电作用和热运动作用下,按位能场中粒子的波尔兹曼分配律分布,完全忽略紧密层,只考虑分散层。
优点:a能较好解释微分电容最小值的出现b能较好解释电容随电极电位的变化规律缺点:a理论计算微分电容值与实验事实相差太大b解释不了微分电容曲线上的“平台区”的出现③Stern模型(双电层静电模型):主要内容:双电层由紧密层和分散层两部分组成。
第三章-电极溶液界面
• 影响:改变电极上双电层的分布,从而影 响反应粒子在电极表面的浓度和活化能, 使反应速率发生变化
一、无机离子的吸附
• 1.大多数无机阴离子是表面活性物质,而无 机阳离子的表面活性很小,只有少数离子 才表面活性。
表面张力变化原因
• 无论双电层是带正电还是带负电,由于同 性电荷的相互排除使界面有扩大的趋势, 与表面张力使界面缩小的趋势相反。因此, 带电界面比不带电界面表面张力下。而剩 余电荷密度与电势有关,故表面张力与电 势有关。
二、电毛细曲线的微分方程
• 根据吉布斯等温吸附方程
d id i
i
电子的表面吸附量 e q / F
• 常用的方法: • 充电曲线法
• 电位扫描法
氢原子的吸附
• 氢的吸附过程伴随有氢分子的分解,分解 生成的氢原子与金属表面相互作用而形成 吸附键。吸附氢原子与吸附自由氢原子是 不同的,吸附过程放出大量吸附热,吸附 氢原子的能量低得多。
氧原子的吸附
• 在常温下,主要是氧原子和含氧粒子的吸 附。这些含氧粒子是在逐步还原或OH-逐步 氧化过程形成并吸附的。
若保持电位恒定,并保持i组分外的化学势不变
i
(
i
) ,ki
负离子可逆,正离子表面剩余电荷量
(
Ina
)
1
正离子离子可逆,负离子表面剩余电荷量
( Ina
)
1
求解表面剩余电荷量的步骤
• 1.测量不同电解质浓度的电毛细曲线 • 2.从各条电毛细曲线下取同一相对电位下的
• 值,做出 ~ Ina 关系曲线。
双电层电位由紧密层电位差和分散层电位差
电极与溶液界面的性质

(3)“紧密层”中的电势分布呈线性,“分散层”中的电势分布为非线 性
27
可解释以下实验现象: (1)、在稀溶液中,Cd有极小值; (2)、电极表面荷正电时,Cd值较大; (3)、电极表面荷较大负电时, Cd值约20; (4)、随电极表面荷电量的加大, Cd急剧上升。
C=ε0 ε/d dH2O=2.8 X10-8cm ε0= 8.85 X10-8μF/cm; εH2O= 6; C= 8.85 X10-8X6/2.8 X10-8 ≈20 μF/cm2
0.2V/20Å
106 V/cm
速率V2= exp(-βFΔV/RT)×速率V1
研究“电极 /溶液”界面的目的:弄清界面性质与电极反应速度的关联
性; 加深对界面电势和电极电势等物化概念的理解
6
“电极溶液”界面对电极反应速度的影响因素: ( 1 )材料因素:电极材料及其表面状态、电解质溶液性质 对电极反应速度有影响
上一章基本概念回顾
电极反应 阳极,阳极反应 阴极,阴极反应 电极过程,阳极过程,阴极过程 电极过程的主要特征
控制步骤
电极电势:绝对电极电势,相对电极电势,氢标电势 极化
超电势
1
本章内容引导
现象:
1、在不同电极上,同一电极反应的进行速度可以相 差10个数量级;
H+ + e
H2( Pt上比Hg上快10个数量级)
(电解质溶液的组成和浓度、电极材料的物理、化学性质及 表面状况)
(2)电场因素:界面电场影响反应的活化能,从而影响电极
反应速度;
7
3、电极/溶液界面附近荷电层的形成、结构 形成机制(金属电极/电解质界面): (1)、离子双电层
由电极表面的剩余电荷与溶液中与之相反的离子组成
3、电极-溶液界面的结构与性质

电毛细曲线微分方程 ( Lippmann方程 )
3、2 电毛细现象
对电毛细曲线微分方程的实验解释 当电极表面存在正的剩余电荷时:
q 0: 0
对应电毛细曲线左半部分(上升分支); 当电极表面存在负的剩余电荷时, q 0: 0 对应电毛细曲线右半部分(下降分支) 。
RT
Page 20
ln
,
3、2 电毛细现象
离子表面剩余量的具体求法 测出不同浓度的
~ 曲线;
从 ~ 曲线上取同一
下的 值,做
,
由 ~ ln 曲线求出某一浓度下的斜率 ~ ln, 即 ,从而得 。
3、2 电毛细现象
电极的极化(polarization) 当电极上无电流通过时,电极处于平衡状态,这时 的电极电势分别称为阳极平衡电势和阴极平衡电 势——理想极化电极。
在有电流通过时,随着电极上电流密度的增加,电
极实际分解电势值对平衡值的偏离也愈来愈大,
这种对平衡电势的偏离称为电极的极化。
Page 9
零电荷 0
左半部 0 电极表面剩余电荷密度 为正值。 右半部 0 电极表面剩余电荷密度 为负值。
Page 28
3、3 双电层的微分电容
溶液越稀微分电容曲线的极小值
点越明显。
微分电容曲线有“平台”出现,
即
不随 Cd
变化。
但正、负离子出现“平台”的数
值不同,表明双电层结构不同。
Rf
通常情况下,通过外电路 流向“电极/溶液”界面的 电荷可能参加两种不同的 过程:
C
电极体系的等效电路
在界面上参加电化学(电极)反应而被消耗,相当 于部分电量通过一个电阻
2009-01-15--第三章+电极-溶液界面结构与性质(3.4-双电层的结构和零电荷电位2学时)
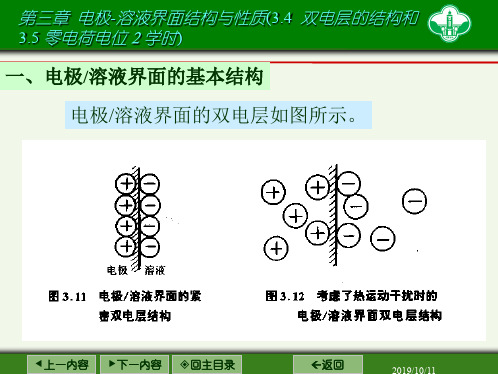
一、电极/溶液界面的基本结构
电极/溶液界面的双电层如图所示。
上一内容 下一内容 回主目录
返回
第三章 电极-溶液界面结构与性质(3.4 双电层的结构和 3.5 零电荷电位2学时)
电极/溶液界面剩余电荷分布和电位分布如图3.14所示。
常数
2RT F
ln a
RT F
ln
c
Ψl<0时
1
常数
2RT F
ln( a)
RT F
ln
c
式中,“常数”为:
2RT ln 1 F C紧
2 RT 0 r
上一内容 下一内容 回主目录
返回
第三章 电极-溶液界面结构与性质(3.4 双电层的结构和 3.5 零电荷电位2学时)
RT
)
返回
第三章 电极-溶液界面结构与性质(3.4 双电层的结构和 3.5 零电荷电位2学时)
当
1和x=时,
x
=0和
x
=0
利用数学关系式
2
x2
1 ( )2
2 x x
从x=d到x=∞积分
(
x
)2 x=d
2cRT
0 r
exp(
1F
上一内容 下一内容 回主目录
返回
第三章 电极-溶液界面结构与性质(3.4 双电层的结构和 3.5 零电荷电位2学时)
双电层电位差由紧密层电位差与分散层电位差两部分 组成,可以利用下列式计算双电层电容:
1 da d (a 1) d1 1 1
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
理论上,测出μi 和σ的关系曲线后,就可以计算 Г i 。实际上,由于下述原因做不到 恒定: 两电极体系中,改变组分i的浓度,参比电极电 位将发生变化;因此不宜采用氢标电位,而应 采用相对于同一溶液中参比电极的相对电位。
在电解质溶液中不可能单独只改变一种离子的 浓度,往往改变的是电解质MA的浓度。
基本线路
直流极 化回路
交流讯 号源
交流电桥
电极电位测量 回路
交流电桥法测定微分电 容的基本线路
3.3.3 微分电容曲线
Cd可以通过实验来测量,将测 1-0.1mM 出不同下电极电势下的Cd值 2-1mM 3-10mM 相对于绘图, 得到的曲线称 4-100mM 为微分电容曲线。 同一电位下,随着溶液浓度的 增加,微分电容值增大。表明 随着浓度的变化,双电层的结 构也会发生变化。 在稀溶液中,微分电容曲线将 零电荷电势 出现极小值。 出现微分电容最小值的电位就 是同一电极体系的电毛细曲线 最高点所对应的电位,即零电 滴汞电极在不同浓度KCl溶 液中的微分电容曲线 荷电位。
溶液
在恒温、恒压下:
Ad ni di 0
ni d di 0 A ni i — i的表面吸附量(mol/cm2) A
d i di 0
— Gibbs吸附等温式
一般情况下,不带电的固相中没有可以自由移动而在 界面吸附的粒子,因而对固/液界面,化学势一项只 需要考虑液相中的吸附粒子。但对电极电位可变的电
极体系来说,可以把电子看成是一种能自由移动并在
界面发生吸附的粒子。若电极表面剩余电荷密度为q
(C/cm2),则电子的表面吸附量为:
q e F
其化学位变化为: de Fd
因此: e de qd
d i di 0
Gibbs吸附等温式
把电子这一组分单独列出来,则有:
若参比电极对负离子可逆,则:
维持相对电位' 不变:
代入化学势加和性公式:
代入电中性和等电量公式:
相对
同理,若参比电极对正离子可逆:
相对
正负离子表面剩余量计算公式:
RT
ln
,
具体求解离子表面剩余量的步骤: (1)测量不同浓度电解质溶液的电毛细曲线,如左下图 (2)从各条电毛细曲线上取同一相对电势下的值,作出 -lna关系曲线 (3)根据-lna关系曲线,求出某一浓度下的斜率 ln a
3.1.2 电极/溶液界面性质的研究方法
电极/溶液界面: 两相之间的一个界面层,即与任何一相基体 性质不同的相间过渡区域。 界面结构—在这一过渡区域中剩余电荷和电势的分 布以及它们与电极电位的关系。
界面性质—界面层的物理化学特性,特别是电性质。
研究方法:
由于界面结构与界面性质之间有着密切的内在联系, 因而研究界面结构的基本方法是测定某些重要的、
在非常窄的电势范围内近似的满足理想
极化条件。
2. 液态汞电极表面易于更新,可以保持表面洁净, 金属电极表面易吸附电解质溶液中杂质而被污染,
导致界面层性质的改变;
3. 液态贡电极完全平滑,易于重现,金属电极表 面在原子水平上是不平整的。
3.2 电毛细现象
3.2.1 电毛细曲线及其测定
对电极体系,界面张力()不仅与界面层的物质 组成有关,而且与电极电势()有关。这种界面 张力随电极电势变化的现象叫做电毛细现象。 界面张力与电极电势的关系曲线叫做电毛细曲 线。 通常用毛细管静电计测取液态金属电极的电毛 细曲线
3.2.2 电毛细曲线的微分方程
一般体系,Gibbs-Duham方程:
SdT Vdp ni di 0
其中:ni — 组分 i 的物质的量, i — 组分 i 的化学势。 存在相界面的体系,Gibbs-Duham方程:
SdT Vdp Ad ni di 0
Hg
其中:A — 界面面积, — 表面张力,
根据Lippman公式,可以判断表面剩余电荷密度的符号
(1)当电极表面存在正的剩余电荷时,
q 0, 0
随电极电势变正,界面张力不断减小—带正电。 (2)当电极表面存在负的剩余电荷时,
q 0, 0
Rf
Rl
R ,f
a
Cd
, Cd
b
辅助电极上(如Pt)几乎无反应,所以可 以去掉,又由于其面积很大,Cd很大,相 当于辅助电极短路,可以将电路进一步简 化为:
Rf
Rl
a
Cd
b
对理想极化电极还可以进一步简化为:
Cd
Rl
a
b
常用的理想极化电极——滴汞电极 Dropping mercury electrode (DME)
* 研究电极/溶液界面对研究电极的要求
通过外电路流向“电极 /溶液”界面的电荷可 能参加两种不同的过 程: 在界面上参加电化学 反应而被消耗 ;
Rf
C
用来改变界面结构。
电极等效电路
* 电解池的设计及其等效电路分析
C ab
Ra
Rb
a
Rf
Rl
R ,f
b
Cd
, Cd
由于电极本身是金属材料,导电性能好,可 不考虑Ra和Rb;同时由于两电极间距离大, 所以Cab<<Cd, 此时,电路简化为:
没有一个真正的电极是IPE,但有些如 汞、金等,在一定的电势范围内表现 为IPE。
Hg在KCl溶液中
-2.1+0.25V
在-2.1+0.25V范围内为IPE 研究电极界面双电层结构和吸附现象
理想非极化电极(ideal nonpolarizable electrode,
INPE):电势不随通过的电流而变化,有固定电势
表面电荷密度q=0时的
电极电势,也就是与界
/ 电极电势称为零电荷电
势,常用符号0表示。
q 0: 0
零电荷电势0
根据Lippman公式,可以直接通过电毛细曲线的斜率 求出 某一电极电位下的电极表面剩余电荷密度q,做 图就得到 q-曲线(II)。
反映界面性质的参数 (例如界面张力、微分电容、
电极表面剩余电荷密度等)及其与电极电位的函数 关系。把这些实验测定结果与根据理论模型推算出 来的数值相比较,如果理论值与实验结果比较一致, 那么该结构模型就有一定的正确性。
3.1.3 理想极化电极和理想非极化电极 理想极化电极(ideal polarizable electrode,IPE) :无 论施加多大电势,在金属-溶液界面间都不发生电荷 转移(电子得失的电极反应)。或当有一无限小的电 流通过时,电势发生显著改变。
(电中性) (等电量) (化学势加和性)
当溶液成分发生变化时,由于参比电极电势变化而 引起的电极电势变化为: 其中相对为相对于浸在组成经历了同样变化的溶液 中的参比电极测得的研究电极电势的变化。 若所用参比电极对于溶液中的正 离子是可逆的(如氢电圾),则: 若参比电极对于溶液中的负离 子是可逆的(如甘汞电极),则:
(+) (-)
2 Hg Hg
2 2
2e 0.1V
K e K Hg 1.6V
在+0.1~-1.6V之间可以认为 该电极是理想极化电极。
1. 液态汞电极是理想极化电极,在很大的 电势窗口内是不发生氧化和还原等有电 子在电极/溶液在界面间迁移的过程。 而金属电极通常在表面上很容易发生氧 化或还原反应(电活性物质吸附),所 以难以完全满足理想极化条件,一般只
d d d d qd
i i e e i i
理想极化电极的界面上没有化学反应发生,溶液中物
质组成不变,即对于溶液中每一组分来说:di =0。
d qd
q 电毛细曲线的微分方程—Lippman公式 i
+ +
+ +
+ +
电毛细曲线
呈抛物线状, why?
汞/溶液界面存在着双电层,即界面的同一侧带有相同符号的
剩余电荷。无论是带正电荷还是带负电荷,由于同性电荷之间
的排斥作用,都力图使界面扩大,而界面张力力图使界面缩小, 二者作用恰好相反。因此,带电界面的界面张力比不带电时要 小,并且表面电荷密度越大,界面张力就越小。最高点处是电 极表面剩余电荷密度为零时,其它点处表面带过剩电荷。
第三章 电极/溶液界面的结构与性质
电极溶液 + + + + e+ + + +
3.1 概述
3.1.1 研究电极/溶液界面性质的意义
各类电极反应都发生在电极/溶液的界面上,界 面的结构和性质对电极反应有很大影响。
1.界面电场对电极反应速度的影响
双电层电位差(即电极电位)为1 V,界面两个电 荷层的间距为10-8cm时,其场强可达l08 V/cm 2. 电解液性质和电极材料及其表面状态的影响 析氢反应2H+ + 2e- —H2在Pt电极上进行的 速度比在Hg电极上进行的速度大107倍以上
积分电容:从 0到某一电位之间的平均电 容称为积分电容 。
q Ci
C i 与 C d 的关系: ∵
q dq Cd d
0 q
0
q q 1 ∴ Ci o 0
C
0
d
d
3.3.2 微分电容的测量
交流电桥法:在处于平衡电位 平 或直流极化 的电极上迭加一个小振幅的正弦波(扰动 <10mV),用交流电桥测量与电解池阻抗相 平衡的串联等效电路的电容值与电阻值,从 而求得 C d 。
