stratagenemx3005荧光定量实验方法操作手册
荧光定量PCR原理及实验步骤精选全文
可编辑修改精选全文完整版
荧光定量PCR原理及实验步骤
一、实时荧光定量PCR原理
常规PCR技术对PCR扩增反应的终点产物进行定量和定性分析无法对起始模板准确定量,无法对扩增反应实时检测。
实时定量PCR技术,在PCR反应体系中加入荧光基团,利用荧光信号的变化实时检测PCR扩增反应中每一个循环扩增产物量的变化,通过Ct值和标准曲线的分析对起始模板进行定量分析。
几个概念:
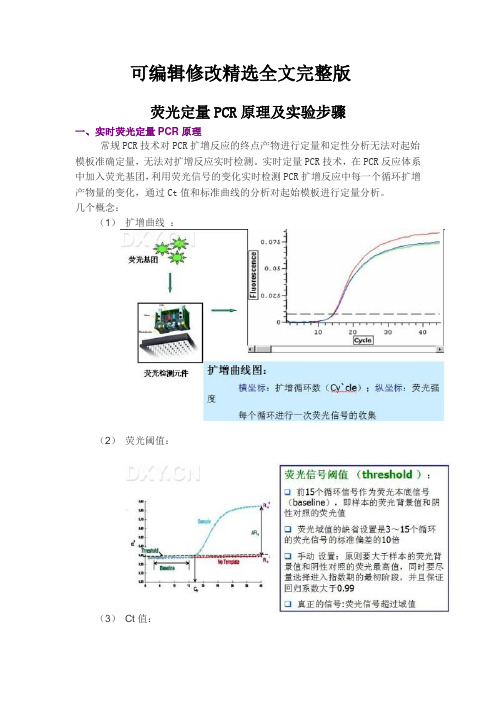
(1)扩增曲线:
(2)荧光阈值:
(3)Ct值:
(4)标准曲线
SYBR Green工作原理:
1、SYBR Green 能结合到双链DNA的小沟部位
2、SYBR Green 只有和双链DNA结合后才发荧光
3、变性时,DNA双链分开,无荧光
4、复性和延伸时,形成双链DNA,SYBR Green 发荧光,在此阶段采集荧光
信号。
二、实验步骤
1. 实验前先在大型仪器共享平台上预约多元荧光定量PCR仪。
1、将所需引物和SYBgreen(避光)拿出,解冻。
计算好所有引物和SYBgreen
的用量。
2、反应体系(25μL)如下:
H2O 11μL
SYBgreen 12.5Μl
上游引物0.25μL
下游引物0.25μL
cDNA 1μL
可先将H2O 和SYBgreen按照所需量配好后,分装,再根据需要加引物和模板。
4、加完所有试剂后,盖上盖子,混匀,离心。
上机。
荧光定量PCR仪操作流程资料

荧光定量PCR仪操作流程1、开启电脑,并打开Smart Cycler开关,启动Smart软件,系统用户名为Smart,密码为Cycler。
若Create Run 图标非灰色,表明机器已与电脑连接,否则应重新连接,直至Create Run 图标变亮。
2、定义一个程序⑴. 点击Define Protocols 图标。
⑵. 点击New Protocols 图标。
⑶. 输入一个独特的程序名。
⑷. 输入热循环参数。
⑸.点击Save Protocol按钮。
3、创建运行⑴. 点击Create Run 图标。
⑵. 输入一个Run Name。
⑶. 选择Dye Set。
⑷. 点击Add/Remove Site按钮⑷a. 突出一个程序名。
⑷b. 突出位点。
⑷c.点击右箭头。
⑷d.重复⑷a-⑷c步骤直到所有程序和点都被选定。
⑸.点击OK。
⑹.点击Start Run按钮。
4、实时监控反应过程(这一步可省)5、实验完毕,分析实验结果运行开始后,程序会自动切换到View Results栏。
在运行过程中,用户能实时监控温度和光学数据,选择图表,分析设置和样品类型信息。
在运行完成前后及运行期间,分析设置、图表和样品类型信息可以改变。
运行过程中,可以查看存在电脑中的以前的运行。
6、保存并输出实验数据⑴点击View Results显示栏的Export按钮。
⑵检查输出数据类型。
⑶点击Export Data根目录里的Export按钮。
⑷从Look In下拉菜单里选择一个文件夹。
程序默认为Smart Cycler文件夹里的Export文件夹。
⑸.输入一个文件名或接受一个默认的文件名,点击Save。
生物技术中心仪器管理人:李红兵2006年10月15日。
荧光定量仪操作指南

荧光定量仪操作指南1.准备工作在使用荧光定量仪之前,需要进行一些准备工作:-打开仪器电源,并接通仪器的电源线。
-启动仪器,并等待其自检完成。
-检查仪器所需的配件是否齐全,如荧光管、滤光片等。
2.校准仪器在进行荧光定量测量之前,需要对仪器进行校准,以确保测量结果的准确性。
校准通常包括两个步骤:-波长校准:使用标准荧光溶液,根据其发射波长设置仪器的激发和发射波长。
-亮度校准:使用标准荧光溶液,根据其知名的荧光强度设置仪器的亮度。
3.准备样品在测量样品之前,需要进行一些准备工作:-根据测定要求,选择合适的荧光染料,并将其溶解在适当的溶剂中。
-在样品舱中选择合适的载体,如荧光底板或石英反射板,并将样品涂覆在载体上。
4.进行测量在开始测量之前,需要进行一些操作:-打开样品舱盖,并将载体放置在样品舱中。
-选择适当的激发波长和发射波长,并将它们设置到仪器上。
-调节仪器上的曝光时间,以确保荧光强度在仪器的线性范围内。
5.数据分析测量完成后,需要对数据进行分析:-使用仪器上的软件导出数据,并存储到计算机中。
-对数据进行统计分析,如计算平均值、标准差等。
-通过比较样品间的荧光强度,得出相应的结论。
6.清洁和维护在使用荧光定量仪完成实验后,需要进行仪器的清洁和维护工作:-关闭仪器电源,并拔下电源线。
-将使用过的载体和滤光片取下,并进行清洗。
-清洁仪器的外壳和光学系统,可以使用干净的纸巾或专门的清洁剂。
注意事项:-避免直接接触荧光管,以免对其造成损坏。
-在测量荧光强度之前,应先调节仪器的对比度和亮度,以获得清晰的图像。
-在测量过程中,尽量避免光线干扰,可在实验室内提供充足的遮光条件。
总结:以上是荧光定量仪的操作指南。
正确操作荧光定量仪是确保实验结果准确的重要步骤,希望本文对您在实验中使用荧光定量仪时有所帮助。
stratagenemx3005荧光定量实验方法操作手册

在定量实验中标准品是要和未知样品一起进行定量实验的,这样在实验结束,无论是标准品还是未知样品都将跑出曲线,获得了Ct值。那么先可以把未知样品放到一边,对于标准品来说,既获得了Ct值,还知道他们的拷贝数(虽然对于相对定量来说这个拷贝数是我们自己赋予的)。这样可以通过标准品的Ct值和拷贝数做一条标准曲线(以拷贝数为横坐标,而Ct值为纵坐标)。一旦作出了标准曲线,而未知样品的Ct值知道(通过实验求得的),这时候就在标准曲线上进行定位,就可以得到未知样品的拷贝数了。
选择稀释倍数
每次选择不同的孔,在里面赋的值会自动按照倍数增加
5、设置温度
在这里提供一个对于SYBR染料常用的温度的控制模板,可以参考。注意最后的溶解曲线制作过程在升温的过程中选择标有all的放大镜,代表从55℃到95℃逐渐升温的过程中不停的检测荧光信号。
6、设好了之后可以运行程序了,最后的标准曲线和扩增曲线系统会自动给出,也会算出未知样品的拷贝数。
首先打开分析软件,选择基因表达分析一项
基本信息设置:软件首先出现的界面就是板信息设置界面。先选中要放置反应管的位置A-D四行,接下来就是在程序界面的右边的设置命令面板上给选中的孔上填入信息。信息的输入顺序一般是从上到下的。
首先要选择孔的类型(Well type)。在孔类型中可以选择Unknow(未知样品),Standard(标准品),NTC(阴性对照)等。为了方便起见,我先将所有的孔都设置成Unknow。
上图中的ABCD表示标号相同是来自同一份组织,这样就把同一份组织中的看家基因和目的基因对应了起来。
选择对照样本:在基因表达实验中总要选择一个cDNA样本作为基因表达的基准,比如实验中会有一个正常样本,最后的表达结果作为1,所有其他的样本的基因表达量都和它相比较,这个作为基准的样品称为Calibrator。在板上选中这个cDNA样品对应的目的基因和看家基因,在well type中选择calibrator。
宝生物荧光定量PCR使用说明

① 按下列组份配制 PCR 反应液(反应液配制请在冰上进行)。
试剂 SYBR® Premix Ex TaqTM(2×) PCR Forward Primer(10 µM) PCR Reverse Primer(10 µM) DNA 模板 dH2O(灭菌蒸馏水) Total
司独自开发的Buffer系统相结合,具有高扩增效率,高扩增灵敏度,高扩增特异性之特点。
●操作注意 以下为使用本试剂盒时的注意事项,使用前一定认真阅读。
1. 本制品请于 4℃避光保存,避免冻结制品。实验证明,4℃保存一年半制品性能稳定,反复冻融制品性 能可能下降。
2. 使用时请上下颠倒轻轻均匀混合,避免起泡,并经轻微离心后使用。 3. 本制品中含有荧光染料SYBR® Green I,保存制品或配制PCR反应液时应避免强光照射。 4. 反应液的配制、分装请一定使用新的(无污染的)枪头、Microtube 等,尽量避免污染。
1.热变性
Primer
荧光物质
2.引物退火
Polymerase
3.延伸反应
●试剂盒特长
1. 适用于 Real Time PCR 反应,可以快速、准确地对目的基因进行检测、定量。 2. 在 2×浓度的Premix中,预先混有SYBR® Green I,PCR反应液配制时,只需加入模板、引物、灭菌
蒸馏水便可进行Real Time PCR反应,操作简单方便。 3. DNA聚合酶使用了改良后的TaKaRa Ex TaqTM HS,可以进行Hot Start法PCR反应,再与TaKaRa公
*3 建议反应液体积为 25 ~ 50 µl。
荧光定量PCR实验操作流程

荧光定量PCR实验操作流程1、实验器材多样品研磨珠均质仪台式高速冷冻型微量离心机荧光定量PCR仪超净工作台分光光度计离心管TIP头2、主要实验试剂及耗材RNA提取液三氯甲烷异丙醇无水乙醇引物75%乙醇:HyPure TMMolecular Biology Grade Water配制离心管、TIP头均购湿热灭菌40min,干燥。
二、荧光定量PCR实验步骤1、总RNA抽提(枪头和离心管均经过湿热灭菌,无RNA酶)1)取匀浆器,加入1ml的Trizol Reagent,置冰上预冷。
2)取100mg组织,加入到匀浆器中。
3)充分研磨直至无可见组织块。
4)12000rpm离心10min取上清。
5)加入250 μl三氯甲烷,颠倒离心管15s,充分混匀,静置3min。
6)4℃下12000rpm离心10min。
7)将上清转移到一新的离心管中,加入0.8倍体积的异丙醇,颠倒混匀。
8)-20℃放置15min。
9)4℃下12000rpm离心10min,管底的白色沉淀即为RNA。
10)吸除液体,加入75%乙醇1.5ml洗涤沉淀。
11)4℃下12000rpm离心5min。
12)将液体吸除干净,将离心管置于超净台上吹3min。
13)加入15μl无RNA酶的水溶解RNA。
14)55℃孵育5min。
15)使用UV1800检测RNA浓度及纯度:仪器空白调零后取2.5μl 待测RNA溶液于检测基座上,放下样品臂,使用电脑上的软件开始吸光值检测。
16)将浓度过高的RNA进行适当比例的稀释,使其终浓度为200ng/μl.左右。
2、反转录(枪头和PCR均经过湿热灭菌,无RNA酶)1)取一PCR管,加入含2μg RNA的溶液。
2)加入1μl 逆转录引物。
3)用无核糖核酸酶的去离子水补足至12μl。
4)于PCR仪上65℃保温5min,迅速置冰上冷却。
5)依次加入4μl 5×buffer,2μl 10mM dNTPs,1μl RNA inhibitor和1μl 反转录酶,用枪抽吸混匀。
实时荧光定量PCR仪介绍

实时荧光定量PCR仪介绍 | QPCR的国际标准---MIQE | 联系我们仪器名称实时荧光定量PCR仪英文名称Real-Time QPCR System国产/进口进口产地/品牌美国品牌,德国制造型号Mx3000P/Mx3005P实时荧光定量PCR仪【性能参数】美国安捷伦Stratagene公司实时荧光定量PCR仪Mx3000P/Mx3005PMx3000P系统性能指标:激发光源:石英卤钨灯检测器:扫描光电倍增管(PMT)多重检测:四个光学通道,并提供用户选择的滤光系统加热系统:Peltier的热循环加热模块内置芯片在断电或连接中断时自动保存数据样品量:96孔高通量平台,反应体系10-100ul外形尺寸:33cm(宽) x 46cm(长) x 43cm(高),重量:20kgMx3000P系统参数配置:动力学范围:10个数量级激发光范围:350—750nm发射光范围:350—700nm温度均一性:+/- 0.25℃温度精确性:+/- 0.25℃升降温速率:2.5℃/秒兼容所有常规荧光染料:FAM、SYBR Green I 、Texas Red、ROX、TET 、Cy3、Cy5、HEX、JOE、VIC 、TAMRA、ALEXA Fluor 350等标准配置的滤光片组为:Cy5,HEX,FAM,ROX具有快速QPCR功能(反应时间在50分钟内)Mx3000P软件功能:•分析功能强大:通过一台计算机可连接和控制6台QPCR仪;可同时分析12个独立的96孔板;也可以在同一块板上进行和分析不同的实验•设置和运行简单:根据实验目的和方法不同,可选择多种实验设置:(多重)绝对定量PCR、相对定量PCR、Sybr Green定量及熔解曲线分析、SNP分析、Molecular Beacon熔解曲线分析等使用简便:实验条件设置、反应过程监控、数据显示分析三大功能模块从同一界面链接,直观简便•实时观测和数据分析:反应过程中可实时监测和收集荧光信号,在实验还未结束的情况下便可对现有数据进行分析提供多种数据显示模式:用户可根据自己需要选择:扩增曲线模式、熔解曲线模式、标准曲线模式、原始荧光信号模式、最终定量结果模式等•多种数据传输格式:所有结果可以原始数据的形式显示,也可输出到Excel 中作进一步分析,曲线和表格等结果可直接用于PowerPoint、Text等文档中。
荧光定量PCR原理及操作步骤课件

荧光信号检测
使用荧光检测仪器,实时监测PCR扩 增过程中的荧光信号变化。
数据分析
对荧光信号数据进行处理和分析,计 算目标基因的相对表达量或拷贝数, 并评估实验结果的可靠性和准确性。
03
荧光定量PCR的应用
基因表达分析
基因表达分析
荧光定量PCR可用于检测特定基因在不同组织或不同生长条件下的表达水平,帮助研究者了解基因的功能和调控 机制。
缺点
成本高
荧光定量PCR需要特殊的仪器和试剂 ,尤其是荧光探针,这使得它的成本 相对较高。
操作复杂
相对于常规PCR,荧光定量PCR的操 作步骤更为复杂,需要更多的实验技 能和经验。
可能出现假阳性
由于荧光定量PCR的灵敏度极高,有 时可能会出现非特异性扩增或污染导 致的假阳性结果。
无法检测基因突变类型
引物、DNA模板和酶
根据实验需求,加入适量的引物、DNA模板和酶,确保PCR 反应的正常进行。
PCR扩增
循环参数
设置适当的PCR循环参数,如变性、退火、延伸等温度和时间,确保PCR扩增的 效率和特异性。
扩增产物检测
在PCR扩增过程中,实时监测荧光信号的变化,以确定扩增产物的量。
荧光信号的检测与数据分析
表达的基因等方面非常有用。
实时监测
通过在PCR反应过程中连续监测 荧光信号,可以实时跟踪DNA的 扩增情况,从而精确控制PCR的
进程。
01
03
02 04
特异性
由于使用的是TaqMan或类似的 探针技术,荧光定量PCR具有很 高的特异性,可以有效地避免非 特异性扩增。
通量高
通过多通道检测,可以在一次实 验中检测多个基因或样本,大大 提高了实验的通量。
荧光定量简易操作流程

Applied Biosystems QuantStudio 3 & 5实时荧光定量PCR 仪V1.X 相对定量简易操作流程1、双击桌面图标开启QuantStudio Design & Analysis Software,或从开始菜单 > All Programs > Applied Biosystems > Quant Studio Design & Analysis Software> Quant Studio Design & Analysis Software开启软件。
2、进入主界面后,点击“Create New Experiment”。
3、在“Properties”界面设置实验属性:a.输入实验的名称;b.选择仪器型号;c.选择仪器的block(加热模块)类型;d.选择实验类型:“Comparative C T(∆∆C T)”;e.选择实验试剂类型:Taqman 探针法选择“Taqman reagents”,SYBR 染料法选择“SYBR Green Reagents”,其他选择“Other”;f.选择运行模式(run mode):普通试剂选择“Standard”;快速试剂选择“Fast”。
4、点击“Next ”进入“Method”界面,设置实验的运行程序:4.1、(可选)设置多梯度反应温度:○1单击(Advanced Settings);○2勾选veriflex,○3然后更改block上相应的反应温度,相邻区域温度差异不能超过5℃。
注:QuantStudio 3 可设置3个梯度反应温度;上图为QuantStudio 5示例图,可设置6个梯度反应温度。
4.2、(可选)设置暂停程序:点击○1图标,○2勾选Pause,○3设置暂停前的反应循环数(Pause after cycles),以及暂停后的温度(Pausing Temperature,范围:4~30℃)。
人类KRAS7种突变检测试剂盒(荧光PCR法)说明书-P4.2-12T-2015.10.09

人类KRAS基因7种突变检测试剂盒(荧光PCR法)说明书【产品名称】通用名称:人类KRAS基因7种突变检测试剂盒(荧光PCR法)英文名称:Human KRAS Gene 7 Mutations Fluorescence Polymerase Chain Reaction (PCR) Diagnostic Kit【包装规格】12测试/盒【预期用途】KRAS基因是人体肿瘤中常见的致癌基因。
该基因的突变常见于多种恶性肿瘤,在肺癌患者中的突变率为15~30%,在结直肠癌患者中的突变率为20~50%。
导致KRAS处于激活状态的突变主要位于第12和13密码子上。
KRAS 基因突变一般会使肺癌患者对EGFR酪氨酸激酶抑制剂产生耐药,使结直肠癌患者对抗EGFR抗体类药物产生耐药。
但是,2010年10月的最新研究发现第13密码子上的Gly13Asp(G13D)突变亦对抗EGFR抗体类药物有治疗反应性(参见:De Roock. W. JAMA. 2010;304(16):1812-1820)。
因此,KRAS基因突变检测能提高肿瘤临床治疗的针对性,降低治疗费用,节省宝贵的治疗时间。
大部分肿瘤的突变都是体细胞突变,突变细胞往往与野生型细胞混杂在一起,因此所提取的DNA常带有大量野生型DNA,所以对体细胞突变检测需要较高的特异性,而目前广泛使用的直接测序法检测能力有限,不能完全满足临床需要。
本试剂盒用于检测人类KRAS基因的12和13密码子上7种热点体细胞突变(见表1),试剂盒以DNA为检测样本,提供突变状态的定性评估。
辅助临床医生筛选出可受益于肿瘤靶向药物的大肠癌等癌症患者。
该产品用于组织中提取DNA的KRAS基因7种突变的检测,为临床医生对大肠癌或肺癌患者选择肿瘤靶向药物治疗提供参考。
表1 人类KRAS基因的12和13密码子上7种热点体细胞突变突变名称氨基酸变化碱基变化Cosmic ID 公司命名Gly12Asp 甘氨酸到天门冬氨酸GGT>GAT 521 12-2-A Gly12Ala 甘氨酸到丙氨酸GGT>GCT 522 12-2-C Gly12Val 甘氨酸到缬氨酸GGT>GTT 520 12-2-T Gly12Ser 甘氨酸到丝氨酸GGT>AGT 517 12-1-A Gly12Arg 甘氨酸到精氨酸GGT>CGT 518 12-1-C Gly12Cys 甘氨酸到胱氨酸GGT>TGT 516 12-1-T Gly13Asp 甘氨酸到天门冬氨酸GGC>GAC 532 13-2-A 【检测原理】本试剂盒基于实时PCR平台结合了特异引物和双环探针两种技术,检测DNA样品中含有的突变基因。
结核杆菌RNA-SAT测定在肺结核治疗过程中的疗效判定与评估

结核杆菌RNA-SAT测定在肺结核治疗过程中的疗效判定与评估【摘要】目的:分析结核杆菌RNA实时荧光恒温扩增技术(SAT)测定在肺结核治疗过程中的疗效判定与评估作用。
方法:此次实验对象为行标准化抗结核治疗至6个月末的涂阳初治肺结核患者,入选时间均在2020.06月至2022.06月,入选患者共100例,利用随机数字表法进行分组,分为对照组(痰浓缩集菌检测+痰结核菌培养检查,n=50)与观察组(结核杆菌RNA-SAT检测+痰浓缩集菌检测+痰结核菌培养检查,n=50)。
观察并对比两组的检测结果。
结果:在准确率、敏感度及特异度上,观察组均高于对照组(P<0.05)。
结论:结核杆菌RNA-SAT用于肺结核患者治疗期间疗效判定及评估的效果显著,具有较高的敏感度与特异度,有利于提高疗效判定与评估的准确性,为后续治疗方案的调整提供依据,临床可进一步推广应用。
【关键词】结核杆菌;RNA实时荧光恒温扩增技术;肺结核;疗效监测涂阳初治肺结核是临床常见的慢性传染疾病,主要是由于结核杆菌感染所致,给患者的日常生活造成极大的不良影响[1]。
标准化抗结核治疗是肺结核的主要治疗手段,有利于改善临床症状,控制病情恶化,促使患者早日康复。
目前,我国肺结核的疗效判定依据于痰浓缩集菌检测及痰结核菌培养进行肺结核的疗效监测,但监测结果不理想。
临床研究发现,RNA实时荧光恒温扩增技术(SAT)用于肺结核疗效监测的效果良好,具有较高的敏感度与特异度[2]。
鉴于此,本文就结核杆菌RNA-SAT在肺结核治疗过程中的疗效判定与评估效果进行分析,详细报告如下:1对象和方法1.1对象此次研究开展时间在2020.06~2022.06,实验对象为行标准化抗结核治疗至6个月末的涂阳初治肺结核患者,利用随机数字表法分为2组,每组例数为50例。
观察组中男30例、女20例;年龄区间范围在18岁至65岁,平均(41.53±8.24)岁;病程时间3个月~18个月,平均(12.50±1.20)个月;体质量指数17.85kg/m2~28.63kg/m2,平均(22.59±1.47)kg/m2。
实时荧光定量PCR具体实验步骤

实时荧光定量PCR具体实验步骤1.提取样本RNA/DNA:首先,从研究对象中提取出所需的RNA或DNA样本。
可以使用商业化的提取试剂盒来完成这一步骤。
2. 反转录酶链反应(RT):如果提取的样本为RNA,则需要先进行反转录酶链反应,将RNA转录成cDNA(即DNA拷贝),反转录酶具有多样性(M-MLV逆转录酶)和过程性(RTase)。
3.准备PCR反应体系:根据实验所需的扩增模板和引物,将PCR反应体系按照厂家提供的信息制备,通常需要包括PCR反应缓冲液、dNTPs、引物、酶、模板DNA/cDNA和稀释水。
4. 调整荧光探针的浓度:如果实验中使用到了荧光探针(如TaqMan探针、MGB探针等),需要根据实验要求对荧光探针的浓度进行调整。
5.放置PCR板:将所需的PCR试管或板放置在适当的位置,以便加载反应体系。
6.反应体系加载:按照实验所需的样品数量和模板浓度,依次向PCR反应管或板中加入反应体系。
注意,需要设置相应的阳性对照和阴性对照。
7.封闭PCR反应管/板:闭合PCR反应管或板,以防止反应体系的挥发和样品的交叉污染。
8.准备PCR仪:根据PCR仪的要求,调整PCR仪的温度和时间参数。
9.PCR扩增:将已封闭的PCR反应管或板放置在预热的PCR仪中,开始PCR扩增。
根据实验需要,设置不同的PCR程序(如热启动PCR、两步PCR和三步PCR等)。
10. 实时监测PCR过程:在PCR反应过程中,实时监测PCR反应管或板中产生的荧光信号,并记录下每个周期(cycle)的荧光值。
11. 数据分析:根据荧光信号的变化,结合标准曲线法或相对表达量法,对PCR反应中目标序列的数量进行定量分析。
常见的分析软件包括Stratagene MxPro QPCR软件和Applied Biosystems SDS软件等。
12.结果分析和解释:根据数据分析的结果,对实验结果进行解释和讨论,并在图表中呈现。
13. 结果验证:可以使用其他方法验证RT-qPCR的结果,如Western blotting、细胞免疫化学分析等。
荧光定量仪操作指南

目录:1 安全预防法2 安装交货包装仪器的安装功能性单元Mastercycler ep realplex启动realplex模块与热模块之间的连接Mastercycler ep realplex 与计算机之间的连接与其它部件的连接realplex软件的安装安装主程序数据恢复开始realplex软件的运行3. 操作管理者登陆登陆用户变更系统配置对使用者的管理新用户建立编辑用户删除用户用户层循环仪realplex 模块系统层特性登陆出错信息用户登陆软件更新检测项目管理建立检测项目打开检测项目保存检测项目保存模板文件模板文件的使用复制检测项目检测项目的输出检测项目的输入建立文件夹删除检测项目和文件夹探针管理染料管理校准背景校准颜色校准使用商业的校准工具包进行的颜色校准客户特有的染料的校准数据库管理当前数据库的自动保存当前数据库的保存输入数据库数据库的归档4 编程(检测项目的建立)建立一个新的检测项目建立板布局染料的确定参考染料的选择样本容积输入探针类型的确定背景的确定样品类型的定义标准阳性对照阴性对照未知样品复制和标准系列的自动建立定量的样品类型相对定量的样品类型多plex分析例子单plex分析的例子熔点分析中的样品类型终点测定中的样品类型+/-检测项目中的样品类型基因辨识中的样品类型样品的复制与剪切删除样品几个样品的归组子检测项目的测定板布局的删除完整检测项目的板布局编辑pcr程序的建立用模板程序建立一个pcr程序不用模板程序建立pcr程序程序步的插入和编辑温度循环(1-5步循环)保温暂停声音熔解曲线终点程序的复制程序的删除测量点的确定热盖设置5 操作(监测)样品的加载模块温度控制样品体积启动检测项目单个样品的选择单个样品类型的选择循环仪状态当前运行检测项目的中断继续运行检测项目终止检测项目mastercycler ep realplex 作为pcr的使用 mastercycler ep realplex 作为荧光计的使用关闭6 分析概要打开检测项目打开在运行的检测项目打开子检测项目单一检测项目的选择使样品处于不活动状态样品类型的选择分析模式的选择图标缩放存储默认设置图表的保存和复制样品数据的保存和复制编辑报告模板报告的应用分析的保存调用分析定量阈值确定基准线测定标准曲线分析multiplex 分析相对定量阈值的测定多plex 分析的估算单plex分析的估算熔解曲线分析阈值的测定分析终点测量标准曲线分析+/-检测项目将终点测定作为数据源的+/-检测项目分析模式阈值的测定pcr数据作为数据源的+/-assay阈值测定分析多plex分析基因测定阈值测定分析7 维护清洁仪器的一般方法热模块的清洁热模块的验证与校准8 故障查找一般故障在sybr绿色分析中发生的错误qrt-pcr过程中发生的错误登陆新用户的建立创建一个检测项目检测项目的保存执行检测项目概述板布局pcr程序开始检测项目当前运行检测项目的中断继续运行检测项目退出检测项目分析10 技术数据功能性单元Mastercycler ep realplex图1:关闭的realplex模块前面观1 realplex模块2 状态显示3 密封压板(锁住状态)4 控制面板的挂钩(Mastercycler ep realplex不需要)5 热模块图2:打开的realplex模块前面观1 密封压板(开启状态)2 realplex模块3 热模块放入试验样本后,向前拉动realplex模块,覆盖住插入的试管。
美链 eva qpcr supermix kit 使用说明书

User’s Manual and InstructionsEva QPCR SuperMix KitCatalog Number: K5052200, K5052400IntroductionReal–time or quantitative PCR (QPCR) allows quantification of DNA, cDNA, or RNA templates. QPCR is based on the detection of a fluorescent reporter molecule that increases as PCR products accumulate with each cycle of amplification. In BioChain’s Eva QPCR SuperMix, a superior green fluorescence DNA-binding dye is used for real-time detection and quantitation of DNA. The Eva QPCR SuperMix is a ready-to-use, 2x-concentrated master mix that contains all the reagents (except primers and templates) needed for running quantitative, real-time DNA detection assays, in the double-stranded DNA dye detection format. The passive reference dye ROX is included in a separate tube to make the Eva Supermix adaptable for many real-time QPCR platforms. A pair of human beta-actin primers is also included in the kit as a control. BioChain’s QPCR SuperMix contains BioChain’s Taq polymerase with hot start capability. BioChain’s hot-start Taq polymerase improves PCR amplification reactions by decreasing non-specific amplification and preventing primer-dimer formation. This enzyme is activated after an initial seven to ten minutes heating at 95°C. And the real-time PCR buffer is specially formulated to provide superior specificity and increase amplification efficiency. This SuperMix can amplify and detect a broad range of DNA or cDNA targets, including those are GC- or AT-rich.Eva DyeEva Dye binds double–stranded DNA. Detection is monitored by measuring the increase in fluorescence intensity throughout the cycle. Eva Dye has higher affinity to double-stranded DNA than SYBR Green dye and shows stronger fluorescence intensity than SYBR Green upon binding to DNA. Eva Dye is more stable than SYBR Green and the absorption and emission spectra of Eva Dye are similar to SYBR Green Dye or FAM, so the same optical setting for SYBR Green Dye or FAM can also be used for Eva Dye.Y=-3.289Log(x)+37.56, R 2=0.999, Efficiency=101.4%Figure 1. BioChain Eva QPCR SuperMix amplifies over a broad dynamic range. 2 x 101 to 2 x 108 copies of plasmid containing cDNA of human beta-actin gene were amplified in 25 µl reactions. Highly reproducible triplicates demonstrated good linearity of 0.999 and excellent PCR efficiency of 101.4% over an 8-order of dynamic range. BioChain’s Eva SuperMix has high sensitivity, detecting as few as 20 copies of target DNA within the linear range.Figure 2. Dissociation Curve of PCR products amplifies over a broad dynamic range. 2 x 101 to 2 x 108copies of plasmid containing cDNA of human -actin gene were amplified in 25-µl reactions.1x102 1x103 1x104 1x105 1x106 1x107 1x108Initial Quantity, Copy NumberFeatures∙Convenient - All reaction components are supplied for quick and easy set up∙Save time - Ready-to-use SuperMix reduces setup time and liquid handling steps∙Wide dynamic range: good linearity and excellent PCR efficiency over an 8 orders of dynamic range∙High Sensitivity - detect as low as 20 copies of DNA.∙Amplify and detect a broad range of DNA or cDNA targets- including those that are GC- or AT-rich∙Flexible – Compatible with most of the real-time PCR instruments.Applications∙ Real-Time PCR∙Gene expression profiling∙Gene knockdown verification∙ Array validationDescriptionComponents in this kit are prepared with pure chemicals according to our proprietary technology. BioChain’s QPCR SuperMix is a 2x concentration of premix reagent including Hotstart DNA polymerase and Eva Dye and specially formulated real time buffer designed for real-time PCR with intercalator format.Quality Control1 kit of this lot has been tested for amplifying plasmid containing human β-actin cDNA (amplified fragment: 202 bp) over an 8 orders of dynamic range using Stratagene’s Mx3005P as a real time PCR instrument. Good linearity and great PCR efficiency is observed and consistent with the previous lot.ComponentsEva QPCR SuperMix Kit:Catalog Number: K5052200: Reagents are sufficient for 200 assaysItem Amount Part No.1. Eva QPCR SuperMix 1.25 ml x 2 K5052200-12. ROX reference Dye 50 μl x 2 K5052200-23. human β-actin control F/R primer pair (25x) 50 μl K5052200-3 Catalog Number: K5052400: Reagents are sufficient for 400 assaysItem Amount Part No.1. Eva QPCR SuperMix 1.25 ml x 4 K5052400-12. ROX reference Dye 50 μl x 4 K5052400-23. human β-actin control F/R primer pair (25x) 50 μl K5052400-3Reagents and Equipments Required but not Supplied in this Kit:1. Nuclease-free PCR-grade water2. Spectrofluorometric thermal cyclerStorage and StabilityUpon receipt, store all components at -20 ºC in a constant temperature freezer. Avoid repeated freeze/thaw cycles. When stored under these conditions the supermix is stable for 6 months after ship date. You may aliquot the supermix and store a portion at 4°C for ready use. The thawed Eva QPCR SuperMix is stable at least for 3 months at 4ºC. The Eva Dye and the ROX reference dye are light sensitive and should be kept away from light whenever possible.Protocol(Using Stratagene’s Mx3000P TM/Mx4000®, and ABI PRISM®/GENEAmp® 5700Real-time PCR Instrument)Use of the ROX Reference DyeROX reference dye is included in this kit and may be added to compensate for non-PCR relatedvariations in fluorescence. Addition of the reference dye is optional. Optimizing the ROX dyeconcentration within the qPCR reaction is an important aspect of setup. Too much ROX in theqPCR reaction will reduce background but also makes a low target signal difficult to distinguishfrom background. Conversely, too little ROX can increase background, meaning that low orweak target signals can be lost. For instruments that allow excitation at ~584 nm (such asStratagene’s Mx instrument and ABI 7500), firstly 1:10 dilute the ROX reference dye provided inthe kit, then begin optimization using 0.5 μl diluted ROX reference dye in 25 μl qRT-PCRreaction. For instruments that do not allow excitation near 584 nm (such as ABIPRISM®/GENEAmp® 5700 instrument), begin optimization using 0.5 μl undiluted ROXreference dye in 25 μl qRT-PCR reaction.Reagent Preparation and StorageThaw the tube containing Eva QPCR SuperMix on ice and store it on ice while setting up thereactions. After initial thawing, aliquot the supermix and store a portion at 4ºC for ready use.Avoid direct light in preparation of the PCR reaction mixture because Eva Dye is light sensitive.1. If the ROX reference dye will be included in the reaction, keep all solutions containingthe ROX protected from light.2. (Optional) Set up a no-template control to screen for contamination of reagents or falseamplification.3. Due to the sensitivity of quantitative PCR, results can be easily affected by pipettingerrors. Always prepare a master mix of Eva SuperMix containing the primers and thereference dye (if reference dye is used). Individual pipetting of replicate samples is notrecommended.Real-time PCR Cycling Programs4. Prepare the following PCR reaction mixture. (First make the master mix without thetemplate. After making the master mix, gently mix the reaction without creating thebubbles, aliquot and then add 2 μl of template to each experimental reaction)per reaction: 25 μlConcentration Regents VolumeFinal Eva QPCR SuperMix (2x) 12.5 μl 1xPCR forward primer X μl 100-200 nMPCR reverse primer X μl 100-200 nMReference Dye ROX a 0.5 μlTemplate b 2 μlNuclease-free PCR grade water Add up to 25 μlaSee page 5: Use of the ROX Reference Dye bFinal template concentration varies depending on the copy number of target present in the template solution. Optimal amount should be determined by preparing the dilution series. It is recommended to use DNA template in less than 100 ng.5. Gently mix the reactions without creating bubbles since bubbles interfere withfluorescence detection. Then centrifuge the reactions briefly.6. Place the reactions in the instrument and run the appropriate PCR program. Try thefollowing protocol firstly, and optimize the reaction condition if needed.PCR program for amplification:Cycles Temperature Time Detection Remark1 95°C 7-10 min. OFF This step will activate the Taqpolymerase.4095°C 30 sec OFF Set the instrument to detectand report fluorescence eitherat the annealing step or the extension step of each cycle.55-65°C a1 min ON 72°C 30 sec to 1.5 min bOFF172°C 3 min OFF This step can be omitted if theamplicon size is <300 bp.a. Set an appropriate annealing temperature for the primer set used.b. Set the extension time to 1-1.5 min if the amplicon size is > 400 bp.2. Dissociation Program for all PCR productsFollow manufacturer’s guidelines for setting up dissociation depending on the instrument’s software version.PCR Setup and Cycling Program for human β-actin control primer set (amplicon size = 202 bp)1. Prepare the following PCR reaction mixture. (First make the master mix without thetemplate. After making the master mix, gently mix the reaction without creating the bubbles, aliquot and then add 2 μl of template to each experimental reaction).per reaction: 25 μlRegents Volume Eva QPCR SuperMix (2x) 12.5 μl Human β-actin primer set (25x) 1 μlReference Dye ROX a0.5 μlTemplate b2 μl Nuclease-free PCR grade water Add up to 25 μlaSee page 5: Use of the ROX Reference Dye bFinal template concentration varies depending on the copy number of target present in the template solution. Optimal amount should be determined by preparing the dilution series2. PCR program for amplification of human β-actin amplicon.Cycles Temperature Time Detection1 95°C 10 min. OFFsec OFF40 95°C 3055-65°C 1 min ON72°C 30sec OFF3. Dissociation Program: Follow manufacturer’s guidelines for setting up dissociationdepending on the instrument’s software version.Related ProductsPro QPCR SuperMix (Cat# K5053200, K5053400), dNTP set for PCR (Cat# K6011100), PCR mix (Cat# 5051100), PCR Optimization Kit (K5051100), Taq Polymerase (Cat#7051200), RNA, PCR ready cDNA, and PCR ready genomic DNA.References1. Biotium, Inc. at /product/product_info/allcolor.pdf2. Brown, Katharine, et al. "SIRT3 reverses aging-associated degeneration." Cellreports 3.2 (2013): 319-327.3. Gray, Nora E., et al. "Angiopoietin-like 4 (Angptl4) protein is a physiological mediator ofintracellular lipolysis in murine adipocytes." Journal of Biological Chemistry 287.11(2012): 8444-8456.。
荧光定量PCR仪操作规程

荧光定量PCR仪操作规程1.开机程序(1)打开电脑,进入桌面。
(2)打开PCR仪器的电源开关(注:该仪器有两个电源开关,一个控制PCR 仪,一个控制光源系统)。
(3)双击桌面上的软件图标,点击“yes”,进入软件的主菜单。
(4)或打开开关,视窗上显示“SELF TEST”,显示10秒中后,显示RUN-ENTER 菜单:“RUN ENTER PROGRAM”准备执行程序。
2.关机程序(1) 保存数据,退出软件的主菜单。
(2) 关掉电脑,关闭PCR仪器的电源开关。
3.程序文件的设置及打开(1)实验程序已预先设定点击软件左方主目录中的“Library”,进入该界面后。
选择“ViewProtocol(查看协议)”页面,根据路径,找到预存的程序文件。
放入样本管,关紧盖子。
运行已经编好的程序,则直接按《Proceed》,用箭头键选择已储存的程序,按《Proceed》,则屏幕显示:“-ENABLE DISABLE HEATED LID” 按《Proceed》选择ENABLE,则开始执行程序。
(2)创建新的程序文件点击软件左方主目录中的“Workshop”,进入该界面。
选择“Edit Prot ocol”页面,输入相应的温度、时间、重复的循环数(Repeats),增加或删除步骤(Cycle和Step),在“Select data collection step(s)”中选择需要进行荧光收集的步骤。
完成后,在“Protocol Filename”中输入程序的文件名,点击“Save this protocol”。
如果要输入新的程序,则在RUN-ENTER菜单上用箭头键选择ENTER PROGRAM,按《Proceed》,屏幕显示“ -NEW LIST EDIT DELET”,按《Proceed》,1)选择NEW,命名新的程序,最多8个字母,输入后按《Proceed》确认。
输入程序步骤:名字输入后,显示“ STEP1TEMP GOTO OPITON END”,按《Proceed》则可以输入温度(0~100℃),按《Proceed》确认后,则可以输入孵育时间,用《Select》键移动光标,输入数字,完成后按《Proceed》确认,跳到下一步,输入方式同上。
荧光定量pcr操作流程

荧光定量pcr操作流程
荧光定量PCR技术是一种常用的实时PCR技术,可以检测DNA和RNA的含量。
它被广泛应用于病毒检测和转基因研究等。
本文将介绍荧光定量PCR技术的操作流程。
首先,在实验室中准备所需要的实验材料,包括样本,PCR引物,模板DNA,dNTP,DNA聚合酶和实时PCR荧光探针,缓冲液,水等。
其次,将样本进行DNase处理,解析得到模板DNA,将模板DNA 用合适的容量放入每个实验管中,以此来建立实验。
然后,将PCR反应液配制好,将与模板DNA一起放入PCR反应管中,包括PCR引物,dNTP,DNA聚合酶,实时PCR荧光探针,缓冲液,水等。
接下来,将放入PCR反应管中的反应液放入PCR设备里进行反应,PCR反应完毕分为一系列步骤,包括反应温度的上升,溶解和延迟,合成,放大等。
其中最重要的步骤是DNA聚合酶与模板DNA的结合,可加速DNA的复制。
最后,PCR反应完毕后,将反应管中的反应液进行荧光定量,将荧光的强度和弱度绘制成曲线,而反应体系中的DNA含量可以用曲线来测定,从而得出DNA的数量。
以上就是荧光定量PCR技术的操作流程。
它可以检测DNA和RNA 的含量,是实验室中常用的实时PCR技术。
它具有灵敏度高,操作简便,时间节约,可重复性好,可用于病毒检测和转基因研究等。
荧光定量PCR实验使用方法

第一部分一、基本步骤:1、目的基因(DNA和mRNA)的查找和比对;2、引物、探针的设计;3、引物探针的合成;4、反应体系的配制;5、反应条件的设定;6、反应体系和条件的优化;7、荧光曲线和数据分析;8、标准品的制备;二、技术关键:1、目的基因(DNA和mRNA)的查找和比对;从/网点的genbank中下载所需要的序列。
下载的方式有两种:一为打开某个序列后,直接点击“save”,保存格式为“.txt”文件。
保存的名称中要包括序列的物种、序列的亚型、序列的注册号。
然后,再打开DNAstar软件中的Editseq软件,点击“file”菜单中的“import”,打开后点击“save”,保存为“.seq”文件。
另一种直接用DNAstar 软件中的Editseq软件,点击“file”菜单中的“open entrez sequence”,导入后保存为“.seq”文件,保存的名称中要包括序列的物种、序列的亚型、序列的注册号。
然后要对所有的序列进行排序。
用DNAstar软件中的Seqman软件,点击“sequence”菜单中的“add”,选择要比较的“.seq”的所有文件,点击“add”或“add all”,然后点击“Done”导入要比较的序列,再点击“assemble”进行比较。
横线的上列为一致性序列,所有红色的碱基是不同的序列,一致的序列用黑色碱基表示。
有时要设定比较序列的开始与结尾。
有时因为参数设置的原因,可能分为几组(contig),若想全部放在一组中进行比较,就调整“project”菜单下的“parameter”,在“assembling”内的“minimum math percentage”默认设置为80,可调低即可。
再选择几个组,点击“contig”菜单下的“reassemble contig”即可。
选择高低的原则是在保证所分析的序列在一个“contig”内的前提下,尽量提高“minimum math percentage”的值。
QRT-PCR Master Mix Stratagene Mx3000P Mx3005P QPCR

Stratagene Products 1Brilliant III Ultra-Fast SYBR ® GreenQRT-PCR Master MixQuick Reference Guide for the StratageneMx3000P/Mx3005P QPCR SystemsAgilent Technologies This quick reference guide provides an optim ized protocol for usingthe Stratagene Brilliant III Ultra-Fast SYBR® Green QRT-PCRMaster Mix with the Stratagene Mx3000P and Mx3005P QPCRSystem s from Agilent. For detailed instructions, refer to the fullproduct m anual.Prepare theReactions 1Dilute the reference dye 1:500 using nuclease-free PCR-g rade water.2Prepare the experimental reactions by combining the components of thereag ent mixture in the order listed in the table below. Prepare a sing lereag ent mixture for replicate reactions (plus at least one reaction volumeexcess) using multiples of each component. Keep the reagent m ixture onice.3Gently mix the reag ent mixture without creating bubbles, then distribute the mixture to the experimental reaction tubes. Keep the reactions onice.4Add x P l of experimental RNA to each reaction to bring the finalreaction volume to 20 P l . The table below lists a suggested quantity rangefor different RNA templates.5Mix the reactions without creating bubbles, then centrifug e briefly.Reagent Mixture Nuclease-free PCR-grade water to bring final volume to 20 P l (including RNA)10 P l of 2× SYBR Green QRT-PCR Master Mix x P l of upstream primer at optimized concentration (150–500 nM)x P l of downstream primer at optimized concentration (150–500 nM)0.3 P l of diluted reference dye0.2 P l of 100 mM DTT1 P l of RT/RNase BlockRNAQuantity per reaction Total RNA0.1 pg – 100 ng mRNA 0.1 pg – 1 ngR B Y S t s a F -a r t l U I I I t n a i l l i r B 2® Green QRT-PCR Master Mix Set Up theQPCR Plate andThermal Profile 1Complete the Plate Setup screen for a new experiment as needed, including assig ning well types and assay information.2On the Thermal Profile Setup screen, set the Thermal Profile Designselection to Standard .V Under Pre-Melt/RT Segment , click 2 Plateaus .V Under Amplification Segment , click Fast 2 Step .V Under Dissociation/Melt Segment , click Dissociation/Melt .3Adjust the thermal profile according to the imag e below. The profileincludes a 5-second denaturation step. Note that some assays mayrequire a denaturation of up to 20 seconds. The exact denaturation timeneeds to be optimized for each targ et.Run the PCRProgram1Place the reactions in the Mx3000P/Mx3005P instrument.2On the Run screen, click Start Run .Analyze Data1Analyze the results of the run as needed for your experiment.Notices to Purchaser Purchase of this product includes an immunity from suit under patents specified in the product insert to use only the amount purchased for the purchaser’s own internal research. No other patent rights are conveyed expressly, by implication, or by estoppel. Further information on purchasing licenses may be obtained by contacting the Director of Licensing, Applied Biosystems, 850 Lincoln Centre Drive, Foster City, California 94404, USA.SYBR ® is licensed for research and development only under patents and patent applications owned by Invitrogen Corporation.SYBR ® is a registered trademark of Molecular Probes, Inc.An o i s i v e R ,7027-0995 r e b m u N t r a P l a u n aM Product InformationCatalog #600886, 400 reactionsCatalog #600887, 4000 reactionsOrdering Information By phone (US only*): 800-424-5444, x3On the web: Technical Services By phone (US only*): 800-894-1304, x2Byemail:*************************For other countries, please contact your local sales representative at /chem/contactus©Agilent Technologies, Inc. 2010Printed June 1, 20105990-5997EN For Research Use Only. Not for use in diagnostic procedures.。
诺如病毒标本处理和室检测技术方案

附件4诺如病毒标本处理和实验室检测技术方案诺如病毒完整的检测及分型流程包括标本前处理、RNA提取、Real-time RT-PCR检测、传统RT-PCR检测、测序和基因分型6个步骤。
Real-time RT-PCR方法灵敏度和准确度高,是检测诺如病毒的金标准。
用传统RT-PCR可对Real-time RT-PCR阳性标本的PCR 产物进行测序,通过序列分析确定诺如病毒的基因群和基因型。
在发生聚集或暴发时,ELISA 方法可作为辅助的手段快速检测诺如病毒抗原。
食品、水、环境涂抹样检测方法的灵敏度不稳定,仅作为参考方法。
一、标本前处理1.粪便、呕吐物1.1设备和材料微量移液器、无菌过滤器、漩涡振荡器、微量离心机、1.5 ml无菌离心管、10 mM pH 值为 7.0 — 7.4 的 PBS。
1.2操作方法(1)离心管每管分装0.5 mlPBS。
用一次性移液管(或无菌棒)添加豌豆大小的粪便(约0.1 g),稀释成约10%至20% (重量/体积)的粪便悬浮液。
当粪便样品是液态时,不必在PBS中稀释,直接使用500间的样品。
(2)漩涡振荡每个样品1 min。
在2 400 g下离心5 min,使得固体沉淀。
澄清上清液可以直接用于病毒核酸提取或贮存于—70℃。
(3)取澄清的上清液200同进行RNA提取。
2.水通过阴离子滤膜过滤水样品。
用牛肉膏(1.5%w/v)含0.05 M甘氨酸(pH9.0)缓冲液洗脱附在膜上的病毒。
使用Microsep 100TM或CentriconTM columns离心管进一步浓缩洗脱液。
2.1设备和材料DEPC水、新配置次氯酸盐(至少1%)或等效消毒剂、Millipore HA filter (孔径0.45um、)、换膜过滤器、真空泵、计时器、PH值酸度计、磁力搅拌器及转子、低温冰箱(-20 ℃、-70 ℃ )、Microsep 100 K columns (PALL 公司)、Centriprep YM-50 (Millipore 公司)、洗脱液(BE-0.05Gly pH7.0)、PBS 8口7.2)、离心机、氯仿、丁醇。
HBVDNA实时荧光定量检测程序的测量不确定度评估及分析

论著 临床研究H B VGD N A实时荧光定量检测程序的测量不确定度评估及分析∗刘伟平,杨新春,殷明刚ә(自贡市第一人民医院检验科,四川自贡643000)㊀㊀摘㊀要:目的㊀根据国际标准化组织(I S O)15189实验室认可要求,评估乙型肝炎病毒(H B V)D N A定量检测程序的测量不确定度.方法㊀采用室内质控获得的中间精密度计算H B VGD N A测量重复性引入的测量不确定度,采用卫生部室间质量评价结果计算H B VGD N A偏倚引入的测量不确定度,将二者合成计算出合成标准不确定度和扩展不确定度.结果㊀H B VGD N A在室内质控水平为4.03(对数的倒数)时实验室内测量重复性引入的相对测量不确定度为3.45%,H B VGD N A偏倚引入的相对测量不确定度为5.27%.相对合成标准不确定度为6.30%;相对扩展不确定度为12.60%;而H B VGD N A在该水平的相对测量不确定度可表示为(4.03ʃ12.60)%.结论㊀H B VGD N A实时荧光定量检测程序的测量不确定度可作为检验结果质量持续改进的依据,并用于解释临床结果.关键词:肝炎病毒,乙型;㊀D N A,病毒;㊀聚合酶链反应;㊀荧光D O I:10.3969/j.i s s n.1673G4130.2019.01.016中图法分类号:R446;R373.2文章编号:1673G4130(2019)01G0059G03文献标识码:AE v a l u a t i o na n da n a l y s i s o fm e a s u r e m e n t u n c e r t a i n t y o n r e a lGt i m e f l u o r e s c e n c eq u a n t i t a t i v e d e t e c t i o no f h e p a t i t i sBv i r u sD N A∗L I U W e i p i n g,Y A N G X i n c h u n,Y I N M i n g g a n gә(D e p a r t m e n t o f C l i n i c a lL a b o r a t o r y,Z i g o n g F i r s tP e o p l eᶄsH o s p i t a l,Z i g o n g,S i c h u a n643000,C h i n a)A b s t r a c t:O b j e c t i v e㊀T oe v a l u a t e t h eu n c e r t a i n t y o fm e a s u r e m e n to fHB VGD N A q u a n t i t a t i v e t e s t p r o c eGd u r e a c c o r d i n g t o l a b o r a t o r y a c c r e d i t a t i o n r e q u i r e m e n t s o f I S O15189.M e t h o d s㊀T h e u n c e r t a i n t y o fm e a s u r i n g r e p e a t a b i l i t y o fH B VGD N A w a s o b t a i n e d f r o m i n t e r m e d i a t e p r e c i s i o nb y t e s t i n g t h e i n d o o r q u a l i t y c o n t r o l.T h e b i a s u n c e r t a i n t y o fH B VGD N A w a so b t a i n e df r o mt e s t i n g r e s u l t so f e x t e r n a l q u a l i t y a s s e s s m e n to fN a t i o n a lC e n t e r f o rC l i n i c a l l a b o r a t o r i e s.A n d t h e n t h e s y n t h e s i s c a l c u l a t e d t h e c o m b i n e ds t a n d a r du n c e r t a i n t y a n de xGp a n d e du n c e r t a i n t y w e r e c a l c u l a t e d.R e s u l t s㊀T h e q u a l i t y c o n t r o l l e v e l o fH B VGD N A w a s4.03(L o g),a n d t h e r e l a t i v eu n c e r t a i n t y o fm e a s u r e m e n t r e p e a t a b i l i t y i n t r o d u c e d i n t h e l a b o r a t o r y w a s3.45%.T h e r e l a t i v e u n c e rGt a i n t y o fm e a s u r e m e n t i n t r o d u c e db y b i a so fH B VGD N A w a s5.27%.T h er e l a t i v es t a n d a r du n c e r t a i n t y w a s 6.3%,a n d r e l a t i v ee x p a n d e du n c e r t a i n t y w a s12.6%.S ot h e r e l a t i v eu n c e r t a i n t y o fH B VGD N Aa t t h i s l e v e l c o u l db e e x p r e s s e d a s12.6%.C o n c l u s i o n㊀T h em e a s u r e m e n t u n c e r t a i n t y e v a l u a t i o no f h e p a t i t i sBv i r u sD N A c a nb eu s e d a s t h eb a s i s f o r t h e c o n t i n u o u s i m p r o v e m e n t o f t h e q u a l i t y a n d t o e x p l a i n t h e c l i n i c a l r e s u l t s.K e y w o r d s:h e p a t i t i sBv i r u s;㊀D N A,v i r a l;㊀p o l y m e r a s e c h a i n r e a c t i o n;㊀f l u o r e s c e n c e㊀㊀测量不确定度是一个与测量结果相联系的参数,其表征合理地赋予被测量之值的分散性[1G2].国际标准化组织(I S O)15189:2012«医学实验室质量和能力的专用要求»明确指出,实验室应为检验过程中用于报告患者样品被测量值的每个测量程序确定测量不确定度.实验室应规定每个测量程序的测量不确定度性能要求,并定期评审测量不确定度的评估结果[3].因此,进行测量不确定度评估对实验室具有重要意义.检验项目的不确定评定可通过实验室的室内质量控制和室间质量评价数据计算出来[4G7].本研究采用实验室室内质量控制的中间精密度和卫生部室间质量评价结果,计算了乙型肝炎病毒(H B V) D N A定量项目的测量不确定度.1㊀材料与方法1.1㊀仪器与试剂㊀S t r a t a G e n e M x3005P实时荧光定量P C R仪购自美国A g i l e n t公司,H B VGD N A荧光95国际检验医学杂志2019年1月第40卷第1期㊀I n t J L a bM e d,J a n u a r y2019,V o l.40,N o.1∗基金项目:四川省卫生和计划生育委员会科研课题(17P J526);自贡市重点科技计划项目(2017S F09).㊀㊀作者简介:刘伟平,男,副主任技师,主要从事临床免疫和分子生物学检验的研究.㊀ә㊀通信作者,EGm a i l:y m g1973@163.c o m.㊀㊀本文引用格式:刘伟平,杨新春,殷明刚.H B VGD N A实时荧光定量检测程序的测量不确定度评估及分析[J].国际检验医学杂志,2019,40(1):59G61.定量检测试剂盒购自湖南圣湘生物科技有限公司,室内质控品为自制质控品.1.2㊀方法1.2.1㊀检测程序㊀每年定期对S t r a t a G e n eM x 3005P 实时荧光定量P C R 检测系统进行校准,同时,每年对H B V GD N A 荧光定量检测试剂盒进行性能评价,每批次试剂均进行留样再测比对,确定检测试剂盒的性能达到要求.自制H B V GD N A 室内质控品,保存于-70ħ超低温冰箱,使用前进行全面性能评价,稳定性好.1.2.2㊀中间精密度测定㊀收集2016年10-12月获得的相同批号室内质控结果,计算批间变异系数(C V %),其数值等于实验室内测量重复性引入的相对测量不确定度[u r e l (R w )].1.2.3㊀偏倚(b i a s )㊀根据2014-2016年本实验室参加卫生部室间质量评价的结果计算偏倚引入的相对不确定度,按以下步骤进行:(1)单次P T 的偏倚值(b i )和相对偏倚值(b i ,r e l ).b i =单次P T 测得的E Q A 结果-该次P T 相对应的E Q A 靶值;b i ,r e l =(单次P T 测得的E Q A 结果-该次P T 相对应的E Q A 靶值)/该次P T 相对应的E Q A 靶值ˑ100.(2)H B V GD N A 检测方法和实验室的偏倚(R M S b i a s )及相对偏倚[R M S r e l (b i a s )]计算公式:R M S b i a s =Σnib i 2n ;R M S r e l (b i a s )=Σnib i ,r e l n .(3)H B V GD N A 单次P T 公认值的测量重复性引入的不确定度计算公式:u r e l (c o n s ,i )=R S D R ,im;R S D R ,i 表示单次PT 各实验室间的相对重复性,m 表示参加单次P T 的实验室数量.(4)H B V GD N A 多次P T 公认值的测量重复性引入的不确定度计算公式:u r e l (C r e f )=Σni =1u r e l (c o n s ,i )n;n 表示P T 次数.(5)H B V GD N A 偏倚引入的相对测量不确定度计算公式:u c r e l (b i a s )=R M S 2r e l(b i a s )+u 2r e l(C r e f ).(6)相对合成标准不确定度(u c r e f )的计算由中间精密度引入的相对不确定度和偏倚引入的不确定度合成.计算公式:u c r e f =u 2r e l(R w )+u c r e f2(b i a s ).(7)相对扩展不确定度评定.相对扩展不确定度等于相对合成标准不确定度ˑ包含因子(K ),计算公式:U =K ˑu c r e f .若取95%置信限,则K =2.2㊀结㊀㊀果2.1㊀偏倚引入的测量不确定度评估结果㊀通过2014-2016年卫生部室间质量评价结果计算所得H B V GD N A 偏倚引入的相对测量不确定度为5.27%.见表1.2.2㊀实验室内测量重复性引入的测量不确定度评估结果㊀质控数据均值为4.03,实验室内测量重复性引入的相对测量不确定度(u r e l )为3.45%.见表2.表1㊀㊀偏倚引入的测量不确定度评估结果E Q A 批号结果靶值b ib i ,r e l R S D R ,i u r e l (c o n s ,i )2014143.924.10-0.18-4.39%3.25%0.230%2014253.823.85-0.03-0.78%3.46%0.245%2015234.374.67-0.30-6.42%2.86%0.202%2015114.804.540.265.73%2.94%0.208%2016144.664.99-0.33-6.61%2.86%0.202%2016244.514.280.235.37%3.12%0.221%表2㊀㊀H B V GD N A 的中间精密度测定结果(n =40)批次质控值(L o g )批次质控值(L o g )批次质控值(L o g )批次质控值(L o g )14.16113.8214.32313.9423.68123.88224.19324.0533.98134.13233.73334.1543.95143.96244.09344.1653.96154.09254.23353.9363.99164.12264.18364.1173.89173.96274.00373.9684.22183.98284.25383.9394.11193.95294.14393.95104.03203.94304.12404.022.3㊀H B V GD N A 的相对扩展不确定度㊀由表1㊁表2计算得到相对合成标准不确定度(u c r e f )为6.3%;相对扩展不确定度为12.6%(K =2).3㊀讨㊀㊀论㊀㊀医学实验室认可已成为我国三级甲等医院检验科提升检验质量和能力的重要途径.I S O 15189实验室认可明确要求实验室要评估定量项目的测量不确定度.测量不确定度与检验总误差概念和意义有一定区别[7].评定测量不确定度评定的意义主要体现在以下2个方面:(1)确认患者结果是否符合实验室设定的质量目标,确定将患者结果与之前相同类型的结果或临床决定值进行比对时其变化或波动值在多大范围内有意义.(2)实验室在解释测量结果量值时应考虑测量不确定度.通过对不确定度的评价,可提高实验室的检测水平,有助于临床医生更好地理解㊁使用检验结果[8].H B V GD N A 定量已广泛用于乙型肝炎患者临床疗效判断和预后评估,测量不确定度结果可作为检验结果质量的参考依据[9G10].测量不确定度可在中间精密度条件下通过测量质控物获得的量值进行计算,这些条件包括测量程序标准操作中尽可能多而合理的常规变化.评定偏倚的测量不确定度主要通过测量有证参考物质㊁利用室间质评等获得[11G12].本研究采用弱阳性水平H B V GD N A 质控品获得的中间精密度和室间质量评价结果评定了H B V G06 国际检验医学杂志2019年1月第40卷第1期㊀I n t J L a bM e d ,J a n u a r y 2019,V o l .40,N o .1D N A在该水平上的不确定度.实际测量过程相关联的不确定度分量应从接收样品启动测量程序开始,至输出测量结果终止.按本方法计算所得测量不确定度不确定来源上主要包含了分析测量阶段中各种影响组分(如操作人员㊁仪器㊁试剂㊁校准品㊁质控品㊁环境条件等)的变异.但未包括与分析前和分析后阶段相关的测量不确定度分量,也未包括由于人群生物学变异而产生的测量不确定度.每个实验室应建立自己的目标不确定度,以评价各检验指标是否满足临床要求[13G14].目前,尚未有检验程序的测量不确定度的国家标准或性能规范,据文献报道,扩展不确定度若大于10%,需改善检测系统性能及稳定性,提高检测的准确度和精密度[15].本实验室根据实验室自身的条件,制定H B VGD N A的目标不确定度为10%.而本研究评定得到的相对不确定度(12.6%)略高于实验室设定的目标不确定度,提示应从检测人员㊁检测仪器㊁检测试剂和方法㊁所使用的校准品和质控品㊁环境温湿度条件等方面入手,采取加强人员培训㊁提高试剂质量㊁变更方法㊁加强仪器检定和校准㊁严格控制环境温湿度,逐步改进检验质量,以缩小测量不确定度,为临床疾病的诊治提供更有价值的参考依据.4㊀结㊀㊀论㊀㊀H B VGD N A实时荧光定量检测程序的测量不确定度评定具有重要意义,可作为临床实验室检验结果质量持续改进的依据,并用于解释临床检验结果.参考文献[1]肖倩,张轩,李有强,等.化学发光分析仪检测激素类项目的测量不确定度评估[J].实用医学杂志,2015,31(9):1532G1535.[2]田恩冰,李颖,李伟强,等. 自上而下 法评定检验项目的测量不确定度[J].标记免疫分析与临床,2017,24(1):113G117.[3]S C HN E I D E R F,MA U R E R C,F R I E D B E R G R C.I n t e rGn a t i o n a l o r g a n i z a t i o n f o r s t a n d a r d i z a t i o n(I S O)15189[J].A n nL a b M e d,2017,37(5):365G370.[4]MA G N U S S O N B,O S S OW I C K I H,R I E N I T Z O,e ta l.R o u t i n e i n t e r n a lGa n d e x t e r n a lGq u a l i t y c o n t r o l d a t a i n c l i nGi c a l l a b o r a t o r i e s f o r e s t i m a t i n g m e a s u r e m e n t a n dd i a g n o sGt i cu n c e r t a i n t y u s i n g G UM p r i n c i p l e s[J].S c a n dJC l i n L a b I n v e s t,2012,72(3):212G220.[5]徐润灏,张洁.8项生化指标测量不确定度评估及允许范围的初步研究[J].上海交通大学学报:医学版,2016,36(12):1777G1783.[6]童清,周睿,梁玉芳,等.使用室内质控与能力验证数据评估测量不确定度[J].检验医学与临床,2016,13(20):2866G2868.[7]张诗诗,王薇,赵海建,等.临床检验总误差与测量不确定度[J].现代检验医学杂志,2016,31(5):153G156.[8]卢妙莲,胡珺,高云龙,等.血液常规检验项目测量不确定度评定[J].实用医学杂志,2014,30(11):1817G1819.[9]蒋玲丽,王雪亮,肖艳群,等.荧光定量P C R测定H B VGD N A测量不确定度评定的探讨[J].检验医学,2014,29(3):241G244.[10]庄健海,罗娜,黄星华,等.2项分子生物学诊断指标测量不确定度评定[J].国际医药卫生导报,2013,19(6):756G762.[11]吕京.常规临床检验结果不确定度的若干问题[J].临床检验杂志,2011,29(5):322G323.[12]包安裕,李艳,陈晨.22项生化检测项目测量不确定度的评价[J].现代检验医学杂志,2014,29(6):156G158.[13]熊大迁,张灵玲,许安春.目标不确定度的确定方式与不确定度的定期评审在质量改进中的价值[J].国际检验医学杂志,2014,35(17):2369G2371.[14]汪旭强,方洁芸.N o r d e r t e s t准则评价13项生化检测项目的测量不确定度[J].国际检验医学杂志,2017,38(1):109G110.[15]尹晶平,董菁,徐杰,等.测量不确定度评估临床干生化检验的初步应用[J].检验医学与临床,2015,12(20):3033G3034.(收稿日期:2018G08G16㊀修回日期:2018G10G22)(上接第58页)㊀㊀M i c e l l i z a t i o n o fm i x t u r e s o f a m p h i p h i l i c d r u g s a n d c a t i o nGi c s u r f a c t a n t s:ad e t a i l e d s t u d y[J].C o l l o i d sS u r f BB i o i n tGe r f a c e s,2012,92(1):16G24.[4]钱盈盈,严玉澄,沈玥,等.K l o t h o在急性缺血再灌注性肾损伤中的变化及其与凋亡的关系[J].上海交通大学学报(医学版),2014,34(6):788G793.[5]HU M C,K U R OGO M,MO E O W.K l o t h oa n dk i d n e y d i s e a s e[J].JN e p h r o l,2010,23S u p p l16:S136G144.[6]HU M C,S H IM,Z HA N GJ,e t a l.K l o t h o d e f i c i e n c y i s a n e a r l y b i o m a r k e ro fr e n a l i s c h e m i aGr e p e r f u s i o ni n j u r y a n d i t sr e p l a c e m e n ti s p r o t e c t i v e[J].K i d n e y I n t,2010,78(12):1240G1251.[7]P A N N U N,K L A R E N B A C H S,W I E B E N,e ta l.R e n a l r e p l a c e m e n t t h e r a p y i n p a t i e n t sw i t ha c u t e r e n a l f a i l u r e:a s y s t e m a t i c r e v i e w[J].J AMA,2008,299(7):793G805.[8]L I U YJ,S U N H D,C H E NJ,e t a l.K l o t h o:an o v e l a n d e a r l y b i o m a r k e r o f a c u t ek i d n e y i n j u r y a f t e r c a r d i a cv a l v e r e p l a c e m e n t s u r g e r y i na d u l t s[J].I n tJC l i n E x p M e d,2015,8(5):7351G7358.[9]S E O M Y,Y A N GJ,L E EJ U NGY O N G,e t a l.R e n a l k l o t h o e x p r e s s i o n i n p a t i e n t sw i t h a c u t e k i d n e y i n j u r y i s a s s o c i a tGe d w i t ht h es e v e r i t y o ft h ei n j u r y[J].K o r e a nJI n t e r nM e d,2015,30(4):489G495.(收稿日期:2018G08G02㊀修回日期:2018G10G08)16国际检验医学杂志2019年1月第40卷第1期㊀I n t J L a bM e d,J a n u a r y2019,V o l.40,N o.1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
这样板设置就完成了。
熔解曲线设置方法
熔解曲线的原理
定量PCR的荧光标记方法通常有两种,一种是探针法,一种是染料法。染料法通常指的是用SYBR GreenI染料作为荧光标记。
SYBR GreenI这种染料之所以可以用来定量,是因为它的特殊性质决定的。第一,它可以非特异性地结合到双链DNA的小沟处,和单链DNA以及蛋白都不结合。第二,SYBR GreenI这种染料游离存在的情况下它没有荧光,一旦它和双链DNA结合了,再用一定波长的光激发它时就可以发出很强的荧光(大概是游离状态的1000倍)。我们再想PCR的过程,PCR的最终产物正是双链DNA,随着每次的循环双链DNA产物的数量成指数增长。如果把SYBR GreenI这种染料加入到反应体系中,就可以随着每次循环结合到双链DNA产物上。产物的量越多,结合的染料就越多,染料发出的荧光就和产物的量成正比,因此通过检测SYBR GreenI的荧光就可以时实监控PCR反应的产物变化。
样品组织分类:看家基因和目的基因未知样品应该对应起来,即同一个cDNA样品应该既作了目的基因也作了看家基因。再接下来把来自同一个cDNA的样品的目的基因和看家基因扩增标出来。可以在Identify associations中的下拉菜单中选择一个字母来标记用同一个cDNA模板分别扩增目的基因和看家基因的孔。
用红色代表IL1
这时候软件只知道在这个实验中检测了两个基因,而哪个基因是看家基因并不知道,下一步是要告诉系统哪一个是看家基因,在Normalizing assay中选择GAPDH就可以了
这时候原来图上的GAPDH就变成了NORM
重复设置:接下来设置重复,每一个样品设置了三个重复。如果一个样品重复三次,这些相同重复的样品可以标上同样的一个数字,这时系统就知道标有同样数字的孔是重复样品,将来在分析数据的时候可以对这些样品进行取平均等操作。
选择稀释倍数
每次选择不同的孔,在里面赋的值会自动按照倍数增加
5、设置温度
在这里提供一个对于SYBR染料常用的温度的控制模板,可以参考。注意最后的溶解曲线制作过程在升温的过程中选择标有all的放大镜,代表从55℃到95℃逐渐升温的过程中不停的检测荧光信号。
6、设好了之后可以运行程序了,最后的标准曲线和扩增曲线系统会自动给出,也会算出未知样品的拷贝数。
如何做标准曲线
在定量实验中标准品是要和未知样品一起进行定量实验的,这样在实验结束,无论是标准品还是未知样品都将跑出曲线,获得了Ct值。那么先可以把未知样品放到一边,对于标准品来说,既获得了Ct值,还知道他们的拷贝数(虽然对于相对定量来说这个拷贝数是我们自己赋予的)。这样可以通过标准品的Ct值和拷贝数做一条标准曲线(以拷贝数为横坐标,而Ct值为纵坐标)。一旦作出了标准曲线,而未知样品的Ct值知道(通过实验求得的),这时候就在标准曲线上进行定位,就可以得到未知样品的拷贝数了。
数据文本显示,实验得到的数据可以以文本的形式显示出来,用户可以很直观的看到用于计算的具体数据,自己也可以利用这些数据进行统计计算。
、数据导出
实验产生的结果都可以方便地导出,图片可以导成图片格式、Excel图片或Powerpoint等,数据也可以导入Excel或文本文件中。
多种数据的导出形式。
基因表达分析板设置方法
Stratagene定量PCR仪标准曲线制作方法
定量PCR定量的基本原理就是用已知拷贝数梯度稀释的样品作出标准曲线,未知样品和标准曲线相比较从而得到未知样品的量。无论是在基因表达分析实验还是在病原微生物检测应用中都有可能要做标准曲线,分别用于绝对定量和相对定量。
标准样品的准备
1、绝对定量。绝对定量就是要确定未知样品的拷贝数。对于这类实验标准品是通过某种方法制备得到的已知拷贝数的含有目标片段的核苷酸序列。最常见的是插入有目标序列的质粒,因为质粒是环状DNA有较强的稳定性,而且分子量比较大定量的时候比较准确。也有用线状的PCR产物作为标准品的,通常要比扩增的目标片段要大一些,这也是为了获得分子量比较大的片段,提高拷贝数的准确性。标准品的拷贝数是通过紫外定量的方法来确定,先得到标准品的浓度C(ng/uL),因为无论是质粒还是PCR产物它们的序列都是已知的,这样通过核苷酸的相对分子量和标准品序列信息估算出标准品的分子量B,则标准品的拷贝数A(copy/uL)为:
标准曲线,看家基因和待测基因的标准曲线都能被作出来,并显示出分别的扩增效率。
如果不做标准曲线,用户也可以根据经验写入扩增效率的值,这样最后的计算结果也可以根据用户写入的扩增效率进行计算。
扩增效率的引入方法是点软件操作界面上方的Term settings键 ,打开Analysis term settings对话框,点里面的Efficiency Settings,在efficiency框中输入不同基因的扩增效率。
如果有些孔有重复就用用样的数字标明,这样仪器就知道哪些是重复,最终结果处理的话也可以取平均等操作。
有相同标号的系统就认为是同样的样品的重复。
4、标准品赋值
接下来要给标准品赋上值,系统要知道按照什么去计算
标准品赋值要先选上要赋值的标准品,然后在工具面板中输入相应的值。
为了方便设置系统有一个自动增加稀释倍数的设置,点开后就可以选择你的稀释倍数,然后用鼠标去选择孔的时候会自动增加
上图中的ABCD表示标号相同是来自同一份组织,这样就把同一份组织中的看家基因和目的基因对应了起来。
选择对照样本:在基因表达实验中总要选择一个cDNA样本作为基因表达的基准,比如实验中会有一个正常样本,最后的表达结果作为1,所有其他的样本的基因表达量都和它相比较,这个作为基准的样品称为Calibrator。在板上选中这个cDNA样品对应的目的基因和看家基因,在well type中选择calibrator。
标准品设置:先将标准品和未知样品分开,在本实验中A行为看家基因的标准品,C行为目的基因的标准品。分别选择A行和C行,在Well type下拉菜单中选择Standard将其设置成标准品类型。
在设置命令面板Standard quantity中写入标准品的量。可以利用Auto-Increment来自动设置稀释的倍数。
Stratagene荧光定量PCR仪的应用软件MxPro提供了比较强大的基因表达差异分析功能,要很好的运用这些功能的前提是要告诉仪器一些必要板设置信息。下面举例子来说明如何来进行板设置。
在这里举一个例子,用SYBRGreenI染料法,用GAPDH作内参,检测不同样品中LI1的基因表达差异,在这里要设置各自的标准品样品和阴性对照等信息。
首先打开分析软件,选择基因表达分析一项
基本信息设置:软件首先出现的界面就是板信息设置界面。先选中要放置反应管的位置A-D四行,接下来就是在程序界面的右边的设置命令面板上给选中的孔上填入信息。信息的输入顺序一般是从上到下的。
首先要选择孔的类型(Well type)。在孔类型中可以选择Unknow(未知样品),Standard(标准品),NTC(阴性对照)等。为了方便起见,我先将所有的孔都设置成Unknow。
熔解曲线,其中红色表示目的基因,绿色表示看家基因,峰位置代表产物的Tm值的温度,图中可以看到看家基因和待测基因的产物基本具有相似的Tm值。
基因表达差异柱壮图显示,程序可以自动计算出基因表达的差异,并用柱壮图显示出来,每一个柱表示一个样本,基因表达的趋势清晰可见,对照样本被算为1。
柱壮图还可以表示成Log的形式,这样可以清楚分开上调和下调的样本。
然后再选择使用的荧光染料,这里由于只用到了SYBR GreenI一种荧光染料,所以就选上SYBR。如果实验当中用了几种荧光染料,就可以将这几种荧光染料都选中。
当选中了荧光染料之后,板设置的基本信息已经输入电脑了,实验可以运行了。以下信息可以在实验进行之前设置,也可以在实验结束之后再设置。
不同基因设置:由于做基因表达分析实验通常要做目的基因和看家基因,所以接下来要告诉软件目的基因和看家基因的名字,软件才能加以区分。点Assign assay name打开如下对话框
当采用SYBR GreenI染料法做定量PCR实验时为了确定实验产物中有没有引物二聚体或非特异性的引发,一般要在反应结束之后做一个熔解曲线。熔解曲线的原理是根据SYBR GreenI染料只和双链DNA结合的特性,设计一个从55℃到95℃逐渐升温的过程,随着温度的升高,双链DNA在不断的解链,SYBR GreenI染料的结合数量也在减少,发出的荧光也越来越少,当到达产物Tm值的时候,荧光信号突然下降,然后趋于平缓,这时双链完全解开,不发荧光。
事实上,操作起来没有那么复杂,只需要告诉软件哪个孔是标准品,哪个是未知样品,以及标准品的拷贝数等必要信息,软件会自动帮把标准曲线和未知样品的拷贝数计算出来了。
举例来说如何进行设置
1、先进入软件,在板设置中选择所放样品的位置,并标上unknow或standard等信息。
2、选择要使用的荧光染料。
3、设置复孔。
A=C/B×+14
2、相对定量。主要是针对基因表达分析实验而来的,因为要知道都是相对的数值(对照样品和实验样品中基因表达的比值),这样就不需要知道精确的拷贝数,所以标准品也就无须知道精确的拷贝数,只需知道稀释的倍数就可以了。
实验中的标准品可以是来源比较丰富的细胞或组织的RNA转录得到的cDNA。将这种cDNA进行梯度的稀释,可以是稀释10倍,100,1000,10000等倍(具体实验要根据具体的情况来调整稀释倍数。最好能作一个预实验来看看什么样的稀释倍数比较适合这种基因的扩增)。而对于各个稀释倍数要对它的拷贝数进行赋值,这个值当然不是标准品中真实含有的基因数量,当然在基因表达分析中也不需要,而是要求根据稀释倍数给每一个稀释度人为赋予的拷贝数,这只是为了方便实验最终结果的计算而已。比如可以把前面稀释十倍的样品赋值为10000个拷贝,100倍的赋值为1000个拷贝依次类推把10000倍的赋为10等。要注意,赋值的数目的倍数差异和稀释的倍数应该是一样的,比如前面是10稀释,后面赋值也是10倍变化。
