上海交通大学无机与分析化学第十一章教学PPT资料
无机及分析化学第十一章氧化还原滴定课后练习与答案

第十一章氧化还原平衡与氧化还原滴定法一、选择题1.在一个氧化还原反应中,如果两个电对的电极电势值相差越大,则下列描述该氧化还原反应中正确的是()A.反应速度越大 B.反应速度越小 C.反应能自发进行 D.反应不能自发进行2.在电极反应S2O32-+2e SO42-中,下列叙述正确的是()A.S2O32-是正极,SO42-是负极 B.S2O32-被氧化,SO42-被还原C.S2O32-是氧化剂,SO42-是还原剂 D.S2O32-是氧化型,SO42-是还原型3.将反应:Fe2++ Ag+ = Fe3+ + Ag组成原电池,下列表示符号正确的是()A.Pt|Fe2+,Fe3+||Ag+|Ag B.Cu|Fe2+,Fe3+||Ag+|FeC.Ag|Fe2+,Fe3+||Ag+|Ag D.Pt|Fe2+,Fe3+||Ag+|Cu4.有一原电池:Pt|Fe2+,Fe3+||Ce4+,Ce3+|Pt,则该电池的反应是()A.Ce3++ Fe3+ Fe2++Ce4+ B.Ce4+ + e Ce3+C.Fe2+ +Ce4+ Ce3++ Fe3+ D.Ce3++ Fe2+ Fe +Ce4+5.在2KMnO4 + 16HCl 5Cl2 + 2MnCl2 + 2KCl +8H2O的反应中,还原产物是下面的哪一种()。
A.Cl2 B.H2O C.KCl D.MnCl26.Na2S2O3与I2的反应,应在下列哪一种溶液中进行()A.强酸性 B.强碱性 C.中性或弱酸性 D.12mol·L-1 HCl中7.在S4O62-离子中S的氧化数是( )A.2 B.2.5 C.+2.5 D.+48.间接碘量法中,应选择的指示剂和加入时间是()A.I2液(滴定开始前) B.I2液(近终点时)C.淀粉溶液(滴定开始前) D.淀粉溶液(近终点时)9.用Na2C2O4标定KMnO4溶液浓度时,指示剂是()A.Na2C2O4溶液 B.KMnO4溶液 C. I2液 D.淀粉溶液10.用K2Cr2O7标定Na2S2O3溶液的浓度,滴定方式采用()A.直接滴定法 B.间接滴定法 C.返滴定法 D.永停滴定法二、判断题1.氧化还原反应中氧化剂得电子,氧化数降低;还原剂失电子,氧化数升高。
无机及分析化学第十一章 电势分析法

二、参比电极
Ag/AgCl电极: A g (l) A g C l(s) C l (a Cl )
A g C l(s) e A g (s) C l
0 .0 5 9 2 lg a C l 0 .1 9 4 V (2 9 8 K ))
第十一章第一节
导线 电极帽 加液口 饱和KCl溶液 Ag/AgCl
第二类电极——金属金属难溶盐电极:M MXn
M 这X n 类 电n e 极主M 要有 n AX g /AgX 电极M n 、/M 甘 汞0 .0 电n 5 9 极2 l 等g K 。s p ( a (M X ) X nn )
三、指示电极
第十一章第一节
第三类电极——氧化还原电极
差。
膜电势=膜外相间电势-膜内相间电势
电极管
内参比电极 内参比溶液 敏感膜
三、指示电极
第十一章第一节
M
外内k1
0.0n592lgaaM M外 外液 膜k2
0.0n592lgaaM M内 内液 膜
(k1 k2)0.0n592lgaaM M内 外液 液
k
0.0592 n lgaM外
阳离子取“+” 阴离子取“–”
若化学电池为: () 参比电极 待测溶液(ai) 指示电极 (+) 则 EKSlgai
一、电势分析法的基本原理
第十一章第一节
2. 电势滴定法的测量原理
电势滴定法就是以指示电极的电势突变(或电池电 动势的突变)来指示滴定终点的滴定分析法。
(2)导电性(尽管很小):通常以荷电离子的在膜内 的迁移形式传导;
(3)高选择性:膜或膜内的物质能选择性地和待测离 子“结合”。通常的“结合”方式有:离子交换、结晶 、络合。
化学第十一单元课件

有氨味
无氨味
(NH4)2SO4 NH4Cl NH4NO3
Co(NH2)2
灼烧
(NH4)2SO4 + BaCl2
燃烧发光
熔化、冒烟
NH4NO3
(NH4)2SO4 NH4Cl
有白色沉淀
= BaSO4 +↓2NH4Cl
(NH4)2SO4
溶于水加入BaCl2溶液
氨水(NH3﹒H2O)
铵盐类 (NH4NO3)
(NH4HCO3)(NH4)2SO4
硝酸盐 (NaNO3) Ca(NO3)2…
注: 氮肥中含氮量最高的氮肥是 【Co(NH2)2】
(NH4Cl)
(1)氮肥在植物生长中的作用: 促进作物的茎叶生长茂盛,叶色浓绿
(2)植物生长中缺乏氮肥的表现:
生长迟缓或停滞,叶色发黄,作物的品质降低
eg: Na2CO3 + Ba(NO3) = BaCO3 ↓+ 2NaNO3 AgNO3 + NaCl = AgCl ↓+ NaNO3 BaCl2 + H2SO4 = BaSO4 ↓+ 2HCl
五、物质的分类
纯净物 物 质
混合物
单质
化合物
金属氧化物 ——碱性氧化物
氧化物
二、几种常见的盐
1、氯化钠 (NaCl) 俗名: 食盐 存在: 海水、盐湖、盐井和盐矿
主要物理性质: 白色晶体、易溶于水
主要化学性质: 与AgNO3溶液反应生成白色沉淀AgCl,AgCl不溶于所有的酸。
NaCl+ AgNO3 = AgCl↓+ NaNO3
医疗上:用于配制生理盐水
无机与分析化学 PPT课件
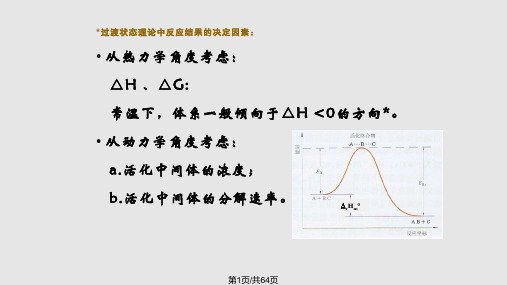
•从动力学的角度来看,决定反应速率 的一步是氮分子在催化剂表面的吸附分 解反应,这一步所需要的活化能相当高, 反应速率慢。 •而催化剂表面的氨的脱附所需要的活化能 很低,因而反应速率快。
第42页/共64页
化学吸附 表面反应
脱附
N2 2(Fe) 2N(Fe) H2 2(Fe) 2H(Fe) N(Fe) H(Fe) NH(Fe) (Fe) NH(Fe) H(Fe) NH2(Fe) (Fe) NH2(Fe) H(Fe) NH3(Fe) (Fe) NH3(Fe) NH3 (Fe)
• 焓减、熵减、体积减少的反应;
*从热力学角度考虑:应高压、低温为佳。
• 但该反应的活化能Ea=326.4kJ.mol-1,反应速率在常温下非常慢,无可操作 性;
• 高压对成本的要求较高,能耗大;
第37页/共64页
有关的热力学数据:
组分
fHm0(kJ.mol-1) 温度S与m氨o(产J率.K之-间1.的m关o系l:-1)
二氧化硫的反应等; • 多相催化:反应物与催化剂不同相,一般催化剂为固相。 *多相催化的过程较复杂,含吸附、反应、解吸等过程;与复杂的吸附机理、
传质速率、反应活性等诸多因素有关。
第30页/共64页
第31页/共64页
催化反应举例:
• 2SO2+O2
2SO3 无催化剂参加的反应,活化能较大;
• 若用NO为催化剂,则上述反应可认为分成下列两个活化能较小、反应速率 较快的反应:
15.3
81.5
86.5
89.9
95.4
98.3
2.2
52
64.2 71
84.2
92.6
0.4
25.1
上交大基础化学电子课件第11章章物质结构基础

11.5 化 学 键
11.5.3.3 价键理论的要点
(1)电子配对原理 两个原子接近时,只有自旋方向相反的两个单电子可以相
互配对,从而使核间的电子云密度增大,系统的能量降低, 形成稳定的共价键,即电子配对原理。
(2)最大重叠原理 它是指形成共价键时,尽可能使成键电子的原子轨道按对
称性匹配原则进行最大程度的重叠,这样所形成的共价键较 牢固。
变化规律
11.4 元素周期表和元素基本性质的周期性
思考题
11-3 共价半径长短的主要决定因素是什么?有 什么规律?
11.4 元素周期表和元素基本性质的周期性
2. 元素的电离能和电子亲和能
(1)电离能。
(2)电子亲和能
11.4 元素周期表和元素基本性质的周期性
3. 电负性
电离能和电子亲和能都是从一 个侧面反映元素原子失去或得到电 子能力的大小。
11.3 原子核外电子的排布
(2) 能量最低原理
(1) 泡利不相容原理
Ad(d Y3o)ur Text 洪特规则
11.4 元素周期表和元素基本性质的周期性
11.4.1 多电子原子轨道的能级
1. 元素的周期
长式周期表共有7个横行,每个横行为1个周期,共有7个周期,即电子 层数相同且按照原子序数递增的顺序排列的一系列元素称为1个周期。
11.1 微观粒子的运动特征
思考题
11-1 经典物理学在研究微观物体的运动时遇到 过哪些困难?举例说明。如何正确对待量子论?
11.2 核外电子的运动状态
11.2.1 波函数与原子轨道
(1)波函数Ψ是描述核外电子 运动状态的数学函数式。
(2)每个波函数Ψ都具有对应 的能量E。
无机化学课件第十一章

3. 存在、分离、性质
氟广泛存在于自然界 萤石(CaF2) 冰晶石(Na3AlF6) 氟磷灰石(Ca3(PO4)2CaCFCl)2
氯: 主要以海水和内地盐湖中的NaCl形式存在
溴,碘:以Na,K,Mg的无机盐形 式存在于海水中
分离:从卤化物中分离卤素单质
2 P(s) + 3 Br2(g) 2 P(s) + 5 I2(g)
2 PBr3(l) 2 PCl3(s)
(无色发烟) (红色)
与 H2 的反应 在低温下,暗处,F2 可与 H2 发生剧烈反应,放出大
量热,导致爆炸。
F2(g) + H2(g)
2 HF(g)
Cl2 在常温下与H2 缓慢反应, 但在紫外光照射下,可
1.强氧化性 F ,Cl ,Br ,I 能力依次减弱
2
2 22
2.与单质作用
F2 在任何温度下都可与金属直接化合,生成高价氟 化物。F2 与 Cu、Ni、Mg 作用时由于金属表面生成一层 致密氟化物保护膜而中止反应。所以 F2 可储存在 Cu、 Ni、Mg 或合金制成的容器中。
Cl2 可与各种金属作用,但干燥的 Cl2 不与 Fe 反应, 因此,Cl2 可储存在铁罐中。
烈。
2 S(s) + Cl2(g)
S2Cl2(l)
(红黄色液体)
S(s) + Cl2(g)(过量)
SCl2(l) (深红色发烟液体)
2 P(s) + 3 Cl2(g)
2 PCl3(l) (无色发烟液体)
2 P(s) + 5 Cl2(g)(过量)
2 PCl5(s) (淡黄色固体)
上海交大无机与分析化学第十一章试题

上海交大无机与分析化学第十一章试题无机与分析化学第十一章一、选择题1EDTA滴定三价铝离子时候,pH值一般控制在4到7范围内。
则下列说法哪些是正确的()A,pH小于四的时候,铝离子水解影响反应进度B,pH大于七的时候,EDTA酸效应降低反应进行程度C,pH小于四的时候,EDTA酸效应降低反应进行程度D,pH大于七的时候,铝离子的氨配位效应降低了反应进行程度2在EDTA配位滴定中,下列有关EDTA酸效应的叙述,哪些是正确的()A,酸效应系数越大,配合物稳定性越高B,酸效应系数越小,配合物越稳定C,反应的PH值越大,EDTA酸效应系数越大D,选择配位滴定的指示剂与酸效应无关度3用0.0100摩尔每升EDTA溶液滴定某金属离子的常量分析中,应当控制EDTA溶液的滴定体积为()(单位:毫升)A,大于等于10 B,大于等于50 C,大于等于40D,在20和30之间E,在10和20之间4在直接EDTA配位滴定法中,其终点所呈现的颜色是()A,金属指示剂与被测金属离子形成的配合物的颜色B,游离金属指示剂的颜色C,EDTA与被测金属离子所形成配合物的颜色D,A,B 的混合色5在EDTA配位滴定中,铬黑T指示剂常常用于()A,测定钙镁总量B,测定铁铝总量C,测定镍总量D,氢氧化钠滴定氯化氢6在EDTA配位滴定中,下列有关PAN指示剂的陈述哪些是错误的()A,用于配制PAN得溶剂是乙醇B,PAN适用的范围很宽,大约为2-12C,PAN指示剂最适用于EDTA滴定钙镁总量D,PAN指示剂最适用于用铜离子溶液或锌离子溶液滴定EDTA 7测定平板玻璃中微量铁的时候,最适宜的指示剂是()A,磺基水杨酸B,PAN C,钙指示剂D,铬黑T E,K-B指示剂8用苦杏仁酸置换铜盐溶液返滴定法测定水泥生料中二氧化钛,最适宜的指示剂是()A,磺基水杨酸B,PAN C,钙指示剂D,铬黑T E,K-B指示剂9用钙标准溶液标定EDTA溶液浓度,最适宜的指示剂是()A,磺基水杨酸B,PAN C,钙指示剂D,铬黑T10测定钡离子的时候,加入过量EDTA溶液的时候,用镁标准溶液反滴定,最适宜的指示剂是()A,磺基水杨酸B,PAN C,钙指示剂D,铬黑T11测定三价铝离子的时候,加入过量EDTA溶液后,用二价铜离子标准溶液返滴定,最适宜的指示剂是()A,磺基水杨酸B,PAN C,钙指示剂D,铬黑T E,K-B指示剂12测定水的总硬度时,最适宜的指示剂是()A,磺基水杨酸B,PAN C,钙指示剂D,铬黑T13 某溶液中主要含有钙,镁离子,但也含有少量铁,铝离子。
无机及分析化学教案 第11章 配位化合物

第十一章配位化合物配位化合物简称配合物,也称络合物,是一类复杂的化合物,它的存在和应用都很广泛,生物体内的金属元素多以配合物的形式存在。
例如植物中的叶绿素是镁的配合物,植物的光合作用靠它来完成。
又如动物血液中的血红蛋白是铁的配合物,在血液中起着输送氧气的作用;动物体内的各种酶几乎都是以金属配合物形式存在的。
当今配合物广泛地渗透到分析化学、生物化学等领域。
发展成为一门独立的学科──配位化学。
本章将对配合物的基本概念、组成、性质等作一初步介绍。
§11-1 配合物的基本概念一、配合物及其组成配位化合物是一类复杂的化合物,含有复杂的配位单元。
配位单元是由中心离子(或原子)与一定数目的分子或离子以配合键结合而成的。
例如在硫酸铜溶液中加入氨水,开始时有蓝色Cu2(OH)2SO4沉淀生成,当继续加氨水过量时,蓝色沉淀溶解变成深蓝色溶液。
总反应为:CuSO4 + 4NH3ƒ[Cu(NH3)4]SO4 (深蓝色)此时在溶液中,除SO42-和[Cu(NH3)4]2+外,几乎检查不出Cu2+的存在。
再如,在HgCl2溶液中加入KI,开始形成桔黄色HgI2沉淀,继续加KI过量时,沉淀消失,变成无色的溶液。
HgCl2 + 2KI ƒHgI2↓+ 2KCl HgI2 + 2KI ƒK2[HgI4]象[Cu(NH3)4]SO4和K2[HgI4]这类较复杂的化合物就是配合物。
配合物的定义可归纳为:由一个中心离子(或原子)和几个配体(阴离子或分子)以配位键相结合形成复杂离子(或分子),通常称这种复杂离子为配离子。
由配离子组成的化合物叫配合物。
在实际工作中一般把配离子也称配合物。
经研究表明,在[Cu(NH3)4]SO4中,Cu2+占据中心位置,称中心离子(或形成体);中心离子Cu2+的周围,以配位键结合着4个NH3分子,称为配体;中心离子与配体构成配合物的内界(配离子),通常把内界写在方括号内;SO 42-被称为外界,内界与外界之间是离子键,在水中全部离解。
无机化学课件(下11-17)---华东

sp3 :NH3 :NH3 :NH3 :NH3
为四面体
。.
• (3) [Ni(CN)4]2-的形成 • 实验证明, Ni(CN)4) 2-为平面正方形,且为反 磁性的配合物(没有单电子), Ni 2+在轨道杂 化前电子发生重排,空出一个3d轨道,以dsp2 杂化轨道成键。
[Ni(CN)4]2-的形成
Ni
Cu2+ Ca2+ Fe3+
:CO
en EDTA
C
N N,O O 6
4
4
[Ca(EDTA)]2- EDTA合钙离子 [Fe(C 2O4)3]3三草酸根合铁(III)
(:OOC)2 2-
6
• 简单配合物:只有一个中心离子,每个配位体 只有一个配位原子与中心离子成键 • 如 Ag(NH3)2+ 、 [Co(NH3)3Cl3 ] • 螯合物: • 如: Cu(en)22+ 、[Ca(edta)]2-
• 配位数的确定: • 简单(单基)配位体:配位体只含一个 • 配位原子 • 则 配位数=配位体个数 • 如: Ag(NH3)2+ • 复杂(多基)配位体:配位体含两个或 • 两个以上配位原子 • 如乙二胺 en :每个en分子有两个N可做 • 配位原子 • Cu(en)22+ 配位体数2,配位数是4
• (2) [Ni(NH3)4]2+的形成 • Ni2+的价电子构型为 3d84s0
4p 4s
3d ↑↓ ↑↓ ↑↓ ↑
↑
↑
sp 3杂化
3d ↑↓ ↑↓ ↑↓ ↑
重叠
4 NH 3
3d ↑↓ ↑↓ ↑↓ ↑↓ 3杂化轨道成键, 2-空间构型 ↑↓ sp ↑↓ ↑↓ ↑ ↑ • Ni 2+采用 Ni(Cl ) 3 4 sp
大学无机化学课件第十一章配位化学物2.ppt

交界酸
交界碱
Fe2+,Co2+,Ni2+,Cu2+,Zn2+
Br-,NO2-
配位体的影响
• 配位体的电负性: 配位原子的电负性越大,其越易与硬酸形成电价 键形式的配位化合物;
• 配位体的碱性: 配位体的碱性大,根据路易斯酸碱理论,越容易 给出电子对,形成共价键形式的配位化合物;
• 配位体的空间效应: 成环(5、6员环),1:1,配位体分子较小不互 相排斥则稳定。
• 稳定化能(CFSE)的特点:
一份额外的能量降低效应; 一个相对的数值,CFSE=10Dq (Δo);
• 在八面体场中,稳定化能的计算方法:
△o=Eeg-Et2g=10Dq 4Eeg+6Et2g=0 Eeg=6Dq Et2g=- 4Dq
不同晶体场的能量关系
• △t=4/9 △o; • △s=1.72 △o; • △的大小: △s> △o> △t; • 不同晶体场的轨道次序(eg,t2g); • 不同晶体场的d轨道能量——均与分裂能的相对
-d--x2y-2--d z2eg
△o
-d-x-y ---d yz --- d xz
八面体场中的d轨道 t2g
四面体场d轨道的分裂
四面体场d轨道的分裂
d轨道的不同分裂
Ni(H2O)6在八面体场中电子排布
d8电子
填完第三个电子 以后,第四个电 子填在哪里?
高自旋、低自旋的排布--3d4
3d5
软酸
软碱
与CN–成配合物稳定
常见的软硬酸碱
硬酸
Al 3+,Ca 2+,Mg 2+ , Fe3+,Cr3+,Co3+,Ti4+等
分析化学第十一章吸光光度法

10
第十一章 吸光光度法
A
0.300
0.200 0.100 400 500
吸收曲线的特点: 不同的物质因其分子结 构不同而具有不同形状的吸 收曲线; 同一物质,浓度不同,其 吸收曲线的形状和λmax的位 置不变,但在同一波长下吸 光度随浓度的增大而增大。
λ
6波长的依据。
可
见
光 3
可见光:λ=400-750nm
第十一章 吸光光度法
光波具有波粒二象性。 其波长λ 、频率ν与速度c之间的关系为: E=ħν = ħc/λ ħ为普朗克常数,其值为6.63×10-34J· s。 普朗克方程表示了光的波动性和粒子性之 间的关系。 显然,不同波长的光具有不同的能量, 波长愈短,能量愈高;波长愈长,能量愈 低。
16
第十一章 吸光光度法
•
S与κ及吸光物质摩尔质量M的关
系为:
S
M
可见,某物质的摩尔吸光系数k越大,其桑
德尔灵敏度S越小,即该测定方法的灵敏度 越高。
17
第十一章 吸光光度法
朗伯—比尔定律的物理意义和适用范围
当一束平行单色光垂直通过某一均匀非 散射的吸光物质时,其吸光度A与吸光物质的 浓度c及吸收层厚度b成正比。这正是吸光光度 法进行定量分析的理论依据。 朗伯 — 比尔定律是光吸收的基本定律, 适用于所有的电磁辐射与所有的吸光物质 ( 可 以是气体、固体、液体、原子、分子和离子 ) 间的作用。但由推导过程中所确定的假设可 知,朗伯—比尔定律的成立是有前提的,即(1) 入射光为平行单色光且垂直照射; (2) 吸光物 质为均匀非散射体系; (3) 吸光质点之间无相 互作用; (4) 辐射与物质之间的作用仅限于光 吸收过程,无荧光和光化学现象发生。 18
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1913 1955 1967 1971 1973 1981 1983 1987 1992
创立配位化学 金属烯烃催化剂 研究快速反应 硼烷化学 发展金属有机化学 等瓣理论 配合物和固氮反应机理 超分子化学 电子传递过程
配位化合物的创立和发展
我国配位化学的奠基人-戴安邦先生
1963年创建南京大学络合物化学研究室, 于1978年扩建为南京大学配位化学研究 所,1988年创建了南京大学配位化学国 家重点开放实验室。为我国配位化学培 养了大批人才。
Basic Concepts of Coordination Compound
·· K·+ :Cl·
→
K + [:C··l:]-
··
··
H
H
F
B
+
F
F
CH3 N CH3
CH3
F
F
B
F
CH3 N CH3
CH3
配位化合物的基本概念
Basic Concepts of Coordination Compound
要为[Fe(CN)6]3-;而KCl ·MgCl2 ·6H2O溶于水后主 要以简单离子形式存在。
配位化合物的创立和发展
配位化学的创始人- Alfred Werner
瑞士化学家,他于1893年(27岁)在 《 无机化学领域中的新见解》一 书中提出 络合物 的配位理论, 大 胆地提出了副价、配位数等概念, 创立了配位化学理论。因此而获得 1913年诺贝尔化学奖。
配位化合物的创立和发展
配位化学已成为当今无机化学中及其重要研究领域, 每年全世界要合成上百万种新的化合物,其中绝大部 分是配位化合物。诺贝尔化学奖授予与配位化学有关 领域的学者:
Werner: Ziegler/Natta Eigen: Libscom: Wilkinson/Fisher: Hoffmann: Taube: Cram/Pederson/Lehn: Marcus:
第十一章 配位平衡及配位滴定
本章学习要求
✓ 了解配位化合物的含义、组成、命名和结构特征 ✓ 掌握配合物中价键理论的要点及应用,掌握晶体
场理论的要点和应用
✓ 掌握配位平衡的特点和与酸碱平衡,沉淀平衡、 氧化还原平衡之间的关系
✓ 掌握配位滴定的基本原理及酸效应、配位效应等 副反应系数在滴定时的影响
配位化合物的基本概念
常见的配合物
Oxygen carrier in blood Porphyrin-Fe:
Haemoglobin(血红蛋白) transition metal complex Fe(II) ion
HO2C
N NOFe2 N
N NR
is octahedrally coordinated
HO2C
HO2CN N Fe
Composition of Coordination Compounds
配位化合物的组成
Composition of Coordination Compounds
配位化合物的组成
Composition of Coordination Compounds
一、外界 外界显示各离子或分子的单独性质, 例如: [Cu(NH3)4](OH)2 (OH)- + [Cu(NH3)4]2+ 加入Al3+ 有 Al(OH)3 沉淀生成; 二、内界 内界为一稳定的基团,在水溶液中不显示其阳离子 或阴离子单独的性质;
N
N
NR
HO2C
常见的配合物
Cis-[PtCl2(NH3)2]
square planar Pt(II) complex cis-isomer(顺式)
Anranofin-Au(I) complex
the first of a series of platinum coordination complex-based anticancer drugs. (Platinol-AQ)
Alfred Werner Nobel Prize winner 1913
配位化合物的创立和发展
Werner's Experiment:
CoCl3•6NH3 yellow xs Ag+ 3 moles AgCl
CoCl3 •5NH3 purple xs Ag+ 2 moles AgCl
CoCl3•4NH3 green xs Ag+ 1 moles AgCl
一、配位化合物的定义
1. 定义:溶液或晶体中存在配位键的化合物称为配位 化合物,简称配合物。
2. 配位单元:中心离子(原子)提供空轨道,配位体上 的配位原子提供孤对电子,形成配位键。包括:
a. 离子—配位离子(配阴离子和配阳离子) 如:[Fe(CN)6]4- , [Ag(NH3)2]+
b. 分子—配位分子, 如:Ni(CO)4 3.与复盐区别: K3[Fe(CN)6] 溶液中,Fe3+存在形式主
CoCl3•3NH3
xs Ag+0 moles AgCl
[Co(NH3)6]Cl3
[Co(NH3)5Cl]Cl2
[Co(NH3)4Cl2]Cl
[Co(NH3)3Cl3]
3+
2+
+
Werner's conclusions 1. The metal is in a particular oxidation state (primary valancy) 2. The complex has a fixed coordination number (secondary valancy) 3. The ligands are bound to the metal via a bond which resembles a covalent bond
常见的配合物
Asp-81
O
His-118
O His-78
His-61 N
N
Zn
N
N
Cu
H2O N
His-46
N
N
His-63
His-44
N
His95
N
N பைடு நூலகம் Zn N
S His93 OH-(H2O)
O
OO N Mo
SS S
Fe
Fe Fe
X
S
Fe
Fe Fe
SS S
Fe S
N His117
配位化合物的组成
1987年在南京召开第25届国际配位化学 会议,有44个国家和地区约1000人参加, 戴安邦被推举为大会主席,这也是中国 首次主办国际大型学术会议。
我国配位化学研究在国际上已占有一定 的地位。
戴安邦 院士 (1901—1999)
常见的配合物
在医药、生物、分离分析、催化、材料、环境科学等领域, 配合物都有重要的应用。
