第十一章核磁共振波谱分析
核磁共振波谱分析ppt课件

DE=hν ——②
则:处于低能级态的1H就会吸收电磁波的能量,跃迁到 高能级态,发生核磁共振。
11
核磁共振波谱分析
1.2.4 核磁共振的条件
发生核磁共振时,必须满足下式:
n=
g 2p
Ho
3
③式称为核磁共振基本关系式。
❖ 可见,固定H0,改变ν射或固定ν射,改变H0都可满足③ 式,发生核磁共振。
但为了便于操作,通常采用后一种方法。
• 乙酸乙酯的核磁共振氢谱
1H NMR ( 300 MHz, CDCl3 ),δ( ppm) 1.867 ( t, J= 7.2 Hz, 3H ), 2.626 ( s, 3H ), 4.716 ( q, J= 7.2 Hz, 2H )
• s—单峰;d—双峰(二重峰);t—三峰 (三重峰);q—四峰(四重峰);m—多 峰(多重峰)
C6H5CH2CH3 C6H5
CH3
CH2
17
17
核磁共振波谱分析
核磁共振氢谱信号 结构信息
信号的位置 (化学位移)
信号的数目
信号的强度 (积分面积)
信号的裂分 (自旋偶合)
质子的化学环境 化学等价质子的组数 引起该信号的氢原子数目
邻近质子的数目,J(偶
合常数)单位:Hz
18
核磁共振波谱分析
(2)核磁共振数据
19
核磁共振波谱分析
§3 化学位移 (Chemical shift)
化学环境不同 的1H 核在不 同位置(ν) 产生共振吸 收
化学环境不同的1H 核在外磁场中 以不同的Larmor频率进动;1H 核在分子中所处的化学环境不同 导致Larmor频率位移
20
核磁共振波谱分析
核磁共振波谱分析

核磁共振波谱分析引言1945年,美国哈佛大学和斯坦福大学的几位学者,各自独立观察到一般状态下物质的核磁共振现象,1952年由此获得诺贝尔物理奖。
1953年世界上第一台商品化NMR谱仪研制成功(30MHz),1964年第一台超导磁体的NMR谱仪研制成(200MHz),1976年Ernst等人确立了二维谱的理论基础,1991年Ernst教授因其在脉冲付立叶变换NMR和二维NMR方面的杰出贡献而获当年诺贝尔化学奖。
2000年在900MHz谱仪上获得NMR谱图。
30MHz= 0.7T (泰斯勒tesla) = 7000高斯(Gauss)200MHz= 4.7T = 47000高斯400MHz= 9.4T = 94000高斯10000高斯 = 1T2929核磁共振谱仪的主要组成部分 1. 提供外磁场B 0的磁铁 2. 产生射频场B 1的谱仪部分 3. 用于控制及数据处理的计算机 三者构成一个整体——核磁共振谱仪(1) 超导磁体—— 铌-钛合金绕成的螺管线圈,置于盛有液氦的超低温杜瓦瓶中,通过一定电流产生强磁场,在接近绝对零度的温度时,螺管线圈内阻几乎为零,成为超导体,消耗的功率也接近零,断绝电源后,超导电流仍保持循环流动,形成永久磁场。
(2) 波谱仪 N S FID D/A FT探头是NMR 谱仪的心脏,样品管放置其中,探头绕有线圈,射频源作用于样品线圈,把共振时样品线圈发生的变化转交给接收机。
(3) 数据处理系统FID -free inductione decay 自由感应衰减 FT -Tourier transferm 付立叶变换一、核磁共振基本原理核磁共振研究对象为具有磁矩的原子核。
只有存在自旋运动的原子核才具有磁矩。
原子核的自旋运动与自旋量子数Ⅰ相关。
Ⅰ= 0的原子核没有自旋运动,Ⅰ≠ 0的原子核才有自旋运动。
在此主要讨论Ⅰ= 1/2的1H,13C,19F,31P……当原子核自旋量子数Ⅰ非零时,它具有自旋角动量P。
核磁共振波谱分析

的电磁波辐射样品,当辐射
E
能量等于磁核能级差时磁核
将吸收能量实现跃迁。
E E
h
E
(h
2
)H0
(7)
H0 (8)
2
12
7.2.5 弛豫过程
根据玻尔兹曼定律,受激态磁核与低能级磁核保持一定比例 的平衡。受激态高能级磁核,失去能量回到低能级磁核的非 辐射过程,称为弛豫。
2
07
7.2.1 原子核的自旋
08
7.2.2 原子核的磁矩和自旋角动量
自旋量子数不为零的原子 核由于自旋而具有磁矩。
P (1)
P h I(I 1) (2)
2
为核磁矩,J.T-1;
P 为自旋角动量;
为磁旋比,核特征常数;
I 为自旋量子数;
h 为普朗克常数。
09
7.2.3 原子核在静磁场中的进动及能量
图10 SmartProbe核磁共振谱仪
38
7.3.3 仪器实例介绍
图11 Decaborane 11B NMR from SmartProbe
39
7.3.3 仪器实例介绍
图12 Decaborane 11B NMR with and without 1H decoupling:
recorded with NS=1 40
高能级
1
低能级
1
高能级 横向弛豫:
受激态高能级磁核
将能量传递给同种
低能级磁核,自身
2
低能级 回到低能级磁核的
过程。1/T1
13
7.2.5 弛豫过程
根据玻尔兹曼定律,受激态磁核与低能级磁核保持一定比例 的平衡。受激态高能级磁核,失去能量回到低能级磁核的非 辐射过程,称为弛豫。
核磁共振波谱分析方法 ppt课件
-CH:
-CH2: CH2 =0.981.54ppm
CH= CH3 +(0.5 0.6)ppm
O CH3 N CH3 C C CH3 O C CH3 CH3
36
H=3.2~4.0ppm H=2.2~3.2ppm H=1.8ppm H=2.1ppm H=2~3ppm
CH3
Si
CH3
CH3
(3)容易回收(b.p低),与样品不反应、不缔合。
16
试样的共振频率
标准物质TMS的共振频率
试样 TMS 6 10 0
化学位移
仪器频率
感生磁场 H'非常小,只有 外加磁场的百万分之几, 6 10 为方便起见,故×
17
(3).影响化学位移(电子云密度)的因素: a.电负性:
数)
E = hν
H0
低能态
h E H0 2
9
3.核磁共振的产生 : 外界提供的能量等于不同取向原子核的能级差.即:
h h E H0 2
H0 2
I≠0
核——原子核自旋 磁——外加磁场H0 共振—— H 0 2
10
诱导产生自旋能级分裂
能级跃迁
二、核磁共振仪器:
ii) 某组环境相同的氢核,分别与n个和m个环境 不同的氢核(或I=1/2的核)偶合, 则裂分为 (n+1)(m+1)个峰
28
Hb
Hb Ha Hc C C C Br Hb Ha Hc
4
c
a
b
3
2
1
0
Jba Jca
Jca Jba Ha裂分峰:(3+1)(2+1) = 12 实际裂分峰: 6
波谱分析核磁共振PPT讲稿

• 在分子体系中,同种核所处的化学环境不同,核外电子云
密度不同,产生的屏蔽作用就不同,处于不同化学环境的 同种核的共振频率不同。
• 由于核周围分子环境不同而使其共振频率发生位移的现象
叫做化学位移。
H0 (1 ) 2
σ为原子核的屏蔽常数(数值为10-5数量级)
例:乙醇的分子式中有三种不同化学环境的氢核,甲基(-
3.影响化学位移的因素
•核外电子云密度的影响-电负性的作用
与质子相连元素的电负性越强,吸电子作用越强,价电 子偏离质子,屏蔽作用减弱,化学位移较大,信号峰在 低场出现。
磁的各向异性效应
质子在分子中所处的空间位置不同,屏蔽 作用的不同的现象称为磁各向异性效应。 在外磁场作用下,环电子流所产生的感应 磁力线是闭合的,与外磁场反向的磁力线 部位起屏蔽作用,而同向的磁力线部位起 去屏蔽作用。
三、化学位移
在有机化合物中,各种氢核 周围的电子云 密度不同(结构中不同位置)共振频率有 差异,即引起共振吸收峰的位移,这种现 象称为化学位移。
但V0与H0有关,不同的仪器测得的数据难 以比较,故需引入化学位移的概念。
1.屏蔽效应产生化学位移
核外电子云在外磁场的作用下,倾向于在垂直磁场的 平面里作环流运动,从而产生一个与外磁场反向的感 应磁场,因而核实际所受到的磁场强度减弱。
波谱分析核磁共振课件
概述
• 核磁共振谱(NMR)与红外、紫外一样,都属于吸收光谱。
• 红外光谱是由分子的振动和转动能级的跃
迁产生的吸收光谱
• 紫外-可见吸收光谱来源于分子的电子能级
间的跃迁
• 核磁共振是分子中原子核自旋能级的跃迁
产生的吸收光谱。
• 在NMR中电磁辐射的频率为兆赫数量级,
有机化学第11章 波谱(核磁)

一般有机物中质子的δ值在0 ~ 10之间(见P462表11-8)。
4、影响化学位移的因素 1)δ伯H < δ仲H < δ叔H; 2) δ值随邻近原子电负性的增加而增加,随电负性大的 原子数目的增多而增加;
E
h
2
H0
E h
2
H0
实现核磁共 振的条件
CH3CH2OH
二、化学位移 1、定义
CH3CH2OH
由于化学环境的不同而引起的NMR吸收峰位置的不同,
称为化学位移。
2、化学位移的产生原因——屏蔽效应
屏蔽效应是有机化合物分子中的氢核与独立质子相比较, 由于分子中的电子对氢核有屏蔽作用,其核磁共振信号 出现在高磁场。
1HNMR谱图s(3H)为CH3
q(2H)为CH2
O CH3 CH2 C CH3
由于屏蔽效应,外加磁场的强度要略为增加,才能产生 核磁共振信号。显然,核周围的电子云密度越大,屏蔽 效应亦愈大,共振信号将移向高磁场区。
3、化学位移的表示方法——δ值 由于屏蔽效应所造成的磁场强度的改变数量很小,通常
难以准确地测出其绝对值,因此需要一个参考标准来对比。 常用的标准物质是四甲基硅烷,(CH3)4Si,简写为TMS, 它只有一个峰,而且一般质子的吸收峰都出现在它的左边
第十一章 有机波谱分析(2)
11.4 核磁共振谱(Nuclear Magnetic Resonance 简称 NMR)
一、基本原理
核磁共振是由原子核的自旋运动引起的。目前应用广
泛的是氢原子核(质子)的核磁共振谱,称为1HNMR。
仪器分析第十一章习题解答

1.根据no=gH0/2p,可以说明一些什么问题? 解:这是发生核磁共振的条件.由该式可以说明:(1)对于不同的原子核,由于磁 旋比g不同,发生共振的条件不同;即发生共振时n0 和H0的相对值不同.(2)对于 同一种核,当外加磁场一定时,共振频率也一定;当磁场强度改变时,共振频率也随 着改变. 2.振荡器的射频为56.4MHz时,欲使19F及1H产生共振信号,外加磁场强度各需多少?
--
9.简要讨论13C-NMR在有机化合物结构分析中的作用. 解:碳原子构成有机化合物的骨架,而13C谱提供的是分子骨架最直接的信息, 因而对有机化合物结构鉴定很有价值. 与氢谱一样,可根据13C的化学位移C确定官能团的存在.而且,C比H大很多, 出现在较宽的范围内,它对核所处化学环境更为敏感,结构上的微小变化可在 碳谱上表现出来.同时碳谱图中峰的重叠比氢谱小得多,几乎每个碳原子都能 给出一条谱线,故对判断化合物的结构非常有利. 同时由于不同种类碳原子的弛豫时间相差较大,因而可以借以了解更多结 构信息及分子运动情况.
由于化学位移是由核外电子云密度决定的,因此影响电子云密度的各种因素都会 影响化学位移,如与质子相邻近的元素或基团的电负性,各项异性效应,溶剂效 应,氢键等.
--
5. 下列化合物OH的氢核,何者处于较低场?为什么?
H C
O
OH (I)
CH3
OH (II)
解: (I)中-OH质子处于较低场,因为-HC=O具有诱导效应.而(II)中甲基则具有 推电子效应.
--
6. 解释在下列化合物中,Ha, Hb的值为何不同?
H
O
C
Ha
Hb
H a:=7.72 H b:=7.40
解:Ha同时受到苯环,羰基的去屏蔽效应,而Hb则只受到苯环的去屏蔽效应, 因而Ha位于较低场.
第十一章核磁共振与电子自旋共振波谱

• 从70年代后期起,随着计算机和NMR在理论和技术上的完善,NMR无论 在广度、深度上都获得了长足的发展,它已成为物理、化学、生物、 医学和地学研究中必不可少的实验手段。
人们在发现核磁共振现象之后很快就产生了实际用途,化学家利用分 子结构对氢原子周围磁场产生的影响,发展出了核磁共振谱。
(a)自旋的氢核 (b)右手定则 (c)与自旋氢核相似的小磁棒 氢核自旋产生的磁场
2、核磁在外磁场中的行为
(1)核磁与外磁场之间的作用力
自旋量子数 I=1/2的原子核(氢
核),可当作电荷均匀分布的球体, 绕自旋轴转动时,产生磁场,类似一 个小磁铁,由无序变为有序排列。
当置于外加磁场H0中时, 相对于外磁场,可以有(2I+1)
一、 化学位移的表示方法
1.位移的标准 没有完全裸露的氢
核,没有绝对的标准。
相对标准:四甲基硅烷 Si(CH3)4 (TMS)(内标)
位移常数 TMS=0
2.为什么用TMS作为基准? (1) 12个氢处于完全相同的化学环境,只产生一个尖峰;
(2)屏蔽强烈,位移最大。与有机化合物中的质子峰不重迭; (3)化学惰性;易溶于有机溶剂;沸点低,易回收。
4. 化学位移
分子内或分子间的同类核,因化学环境相异而引起的共振频率不同的现象 称为化学位移。
5. 核自旋---自旋偶合作用
每条谱线进一步分裂为更多谱线,它们间的距离表现为一定的规律性。
核磁共振与化学位移
理想化的、裸露的氢核;满足共振条件:
0 = H0 / (2 )
产生单一的吸收峰; 实际上,氢核受周围不断运动着的电子影响。在外磁场作用下,运动 着的电子产生相对于外磁场方向的感应磁场,起到屏蔽作用,使氢核实际 受到的外磁场作用减小:
谱图解析与结构确定

位置;
(4)峰的裂分数:相邻碳原子上 H 质子数;
(5)偶合常数(J): 确定化合物构型。
二、简化谱图的方法
1. 采用高场强仪器 60MHz ABC系统 •100MHz •ABX系统 HC
HB HC C C HA CN
HB
HA
•220MHz •AMX系统
N M R
o ore
est
应用范围
化学、物理、生物、药学、医学、农业、 环境、矿业 脑科学、量子计算机、纳米材料、C60、软 物质、超导材料 分子结构研究、物质的分子组成及相 互作用、分子水平上的其它研究
应用范围
图谱解析、谱峰指认
核磁共振的信息
化学位移 偶合裂分 谱峰强度
化合物的分子结构
1H、13C一维谱
原子与原子的连接 原子之间的空间取向 化学结构的动态平衡
同核二维谱 异核二维 三维谱
弛豫时间
NOE作用
NMR谱图
化合物 CБайду номын сангаас0H12O2 2 2 5 3
8 0
7
6
5
4
3
2
1
一、谱图中化合物的结构信息
(1)峰的组数:标志分子中磁不等性质子的种类,多少种 H;
(2)峰的强度(面积):每类质子的数目(相对),多少个 H;
谱图解析与结构(1)确定
化合物 C10H12O2 2 2 5 3
8
7
6
5
4
3
2
1
0
8
7
6
5
4
3
2
1
0
=1+10+1/2(-12)=5
第十一章核磁共振波谱分析

改用100 MHz的NMR仪进行测量,质子吸收峰与 TMS 峰相隔的距离,即为相对于TMS的化学位移 值Δν Δν = 2.23 100 = 223Hz
06:29:04
三、影响化学位移的因素
factors influenced chemical shift
甲醇
-O-H, 大 低场
- CH3 , 小 高场
06:29:04
电负性对化学位移的影响
F CH3 Cl CH3 Br CH3 I CH3
4.26
3.05
2.68 2.60
H3C Br H3CH2C Br CH3(CH2)2 Br CH3(CH2)3 Br
2.68
1.65
1.04
0.90
H3C Cl 3.05
Cl H2C Cl
5.33
Cl HC Cl
Cl 7..24
06:29:04
2.磁各向异性效应
(1)双键 价电子产生诱导
磁场,质子位于其 磁力线上,与外磁 场方向一致, 去屏蔽。
06:29:04
(2)叁键
价电子以圆柱形环绕叁键运行,产生诱导磁 场,分子轴向磁场与外磁场方向相反,产生屏 蔽效应。
06:29:04
• 取代基的电负性 • 磁各向异性 • 氢键 • 环烷基的环电流效应 • 溶剂特性
06:29:04
1.诱导效应 --去屏蔽效应
与质子相连元素的电负性 越强,吸电子作用越强,价电 子偏离质子,屏蔽作用减弱, 信号峰在低场出现。
例如:碘乙烷
CH3 , =1.6~2.0,高场; CH2I, =3.0 ~ 3.5, 低场
11-核磁共振波谱法剖析

二、 核磁共振现象
1H可当作电荷均匀分布的球体, 绕自旋轴转动时,产生磁场,类似 一个小磁铁。
当置于 外 加磁场 H0 中时, 有 (2I+1)种取向:
(1)与外磁场平行,磁量子数m=
+1/2;
(2)与外磁场相反,m=-1/2;
两种取向不完全与外磁场平行,相互作用,产生进动,进动频率
0; 角速度0; 0 = 20 = H0, 磁旋比; H0外磁场强度;
化学位移的表示方法
1.位移的标准
没有完全裸露的氢核,没有绝对的标准。
相对标准:四甲基硅烷 Si(CH3)4 (TMS)(内标)
位移常数 TMS=0
2.为什么用TMS作为基准?
(1) 12个氢处于完全相同的化学环境,只产生一个尖峰; (2) 屏蔽强烈,位移最大。与有机化合物中的质子峰不重迭; (3) 化学惰性;易溶于有机溶剂;沸点低,易回收。
进动取向不同的氢核之间的能级差:E= μ H0 (μ--磁矩)
三、核磁共振条件
(1) 核有自旋(磁性核); (2) 外磁场, 能级裂分;
(3) 照射频率与外磁场的比值0 /H0 = /(2)
讨论:
质子的共振频率与结构(化学环境)有关。高分辨率下, 吸收峰产生化学位移和裂分。由有机化合物的核磁共振图, 可获得质子所处化学环境的信息,进一步确定化合物结构。
理想化的、裸露的氢核;满足共振条件:
0 = H0 / (2 )
产生单一的吸收峰;实际上,氢核受周围不断运动着的电 子影响。在外磁场作用下,运动着的电子产生相对于外磁场 方向的感应磁场,起到屏蔽作用。
由于屏蔽作用的存在,氢核产生共振需要更大的外磁场强 度(相对于裸露的氢核),来抵消屏蔽影响。
有机化合物中,各种氢核周 围的电子云密度不同,共振频率 有差异,引起共振吸收峰的位移, 称为化学位移。
仪器分析课后答案教材
第七章 原子吸收光谱法基本要求:掌握以下基本概念:共振线、特征谱线、锐线光源、吸收线轮廓、通带、积分吸收、峰值吸收、灵敏度和检出限, 掌握原子吸收的测量、AAS 的定量关系及定量方法, 了解AAS 中的干扰及火焰法的条件选择, 通过和火焰法比较,了解石墨炉法的特点。
重点:有关方法和仪器的基本术语。
难点:AAS 的定量原理,火焰法的条件选择。
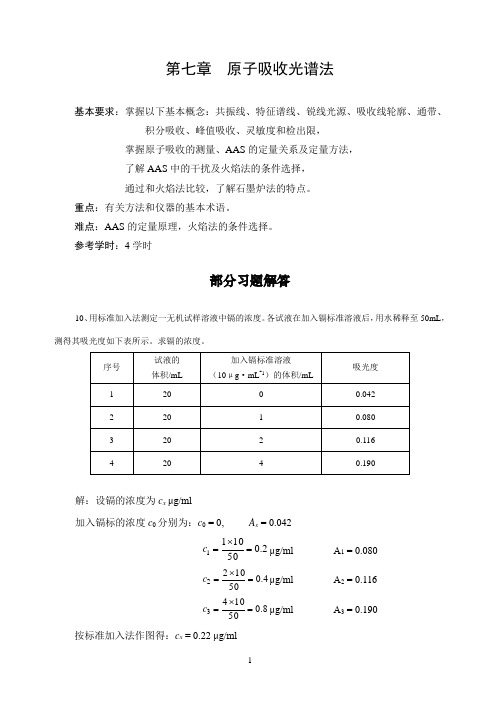
参考学时:4学时部分习题解答10、用标准加入法测定一无机试样溶液中镉的浓度。
各试液在加入镉标准溶液后,用水稀释至50mL ,测得其吸光度如下表所示。
求镉的浓度。
解:设镉的浓度为c x μg/ml加入镉标的浓度c 0分别为:c 0 = 0, A x = 0.0422.0501011=⨯=c μg/ml A 1 = 0.080 4.0501022=⨯=c μg/ml A 2 = 0.116 8.0501043=⨯=c μg/ml A 3 = 0.190 按标准加入法作图得:c x = 0.22 μg/ml11、用原子吸收光谱法测定自来水中镁的含量(用mg ·L -1表示)。
取一系列镁标准溶液(1μg ·mL -1)及自来水水样于50mL 容量瓶中,分别加入5%锶盐溶液2mL 后,用蒸馏水稀释至刻度。
然后与蒸馏水交替喷雾测定其吸光度,其数据如下表所示。
计算自来水中镁的含量。
解:吸光度(A )—标准溶液含镁量(μg )的标准曲线线性回归得x yˆ0484.00427.0ˆ+= γ=0.9999将A=0.135代入得自来水样中含镁量为1.91μg 。
∴ 自来水中镁的含量为095.02091.1=μg ·mL -1 即 0.095mg ·mL -1 12、某原子吸收分光光度计倒线色散率为1nm/mm ,狭缝宽度分别为0.1nm, 0.2mm, 1.0mm ,问对应的通带分别是多少?解:W = D ·S已知:D = 1nm/mm, S 1 = 0.1mm, S 2 = 0.2mm, S 3 = 1.0mm通带:W 1 = D ·S 1 = 1×0.1 = 0.1nmW 2 = D ·S 2 = 1×0.2 = 0.2nm W 3 = D ·S 3 = 1×1.0 = 1.0nm第八章紫外-可见分光光度法基本要求:掌握紫外一可见吸收光谱的特征及其产生的原因,了解有机化合物的电子跃迁类型及饱和烃、不饱和烃、羰基化合物、苯和单取代苯的特征吸收,了解影响紫外一可见吸收光谱的因素,共轭烯烃、α、β一不饱和羰基化合物的λmax的估算以及UV-Vis在定性和结构分析中的应用,掌握Lambert-Beer定律及其物理意义,偏离Lambert-Beer定律的原因,了解显色反应及显色条件的选择,掌握光度测量条件的选择原则,了解多组分分析、光度滴定、酸碱离解常数的测定、双波长光度法以及配合物的组成和K稳测定等方面的应用及其特点。
基础医学课件-核磁共振波谱分析PPT课件

2020年10月2日
11
5.2.3 核的回旋
当原子核的核磁矩处于外加磁场B0 中,由于核自
身的旋转,而外加磁场又力求它取向于磁场方向,在 这两种力的作用下,核会在自旋的同时绕外磁场的方 向进行回旋,这种运动称为Larmor进动。
2020年10月2日
2020年10月2日
22
样品处理
对液体样品,可以直接进行测定。对难以溶解的 物质,如高分子化合物、矿物等,可用固体核磁共振 仪测定。但在大多数情况下,固体样品和粘稠样品都 是配成溶液(通常用内径4mm的样品管,内装0.4mL 质量分数约为10%的样品溶液)进行测定。
溶剂应该不含质子,对样品的溶解性好,不与样 品发生缔合作用。常用的溶剂有四氯化碳、二硫化碳 和氘代试剂等。四氯化碳是较好的溶剂,但对许多化 合物溶解度都不好。氘代试剂有氘代氯仿、氘代甲醇、 氘代丙酮、重水等,可根据样品的极性选择使用。氘 代氯仿是氘代试剂中最廉价的,应用也最广泛。
在上图中,当自旋取向与外加磁场一致时(m =+1/2), 氢核处于一种低能级状态(E=-μB0);相反时(m=- 1/2),氢核处于一种高能级状态(E=+μB0)两种取向间 的能级差,可用ΔE来表示:
ΔE = E2-E1 =+μB0-(-μB0) = 2μB0 式中:μ为氢核磁矩;B0为外加磁场强度
然而,核磁共振信号的强弱是与被测磁性核的天然丰 度和旋磁比的立方成正比的,如1H的天然丰度为99.985%, 19F和31P的丰度均为100%,因此,它们的共振信号较强, 容易测定,而13C的天然丰度只有1.1%,很有用的15N和17O 核的丰度也在1%以下,它们的共振信号都很弱,必须在傅 里叶变换核磁共振波谱仪上经过多次扫描才能得到有用的 信息。
核磁共振 波谱分析

现采用相对数值。通常以四甲基硅(TMS)为标准物质,
规定:它的化学位移为零,然后,根据其它吸收峰与零点 的相对距离来确定它们的化学位移值。 低场 9 高场
8 7 6 6 5 4 3 2 1 零 点 -1 -2 -3
TMS
化学位移用表示,以前也用表示, 与的关系为:
= 10 -
25
16
自旋-自旋弛豫 (spin-spin Relaxation):
高能态核把能量传给同类低能态的自旋核,本身回到低 能态,维持Boltzmann分布。结果是高低能态自旋核总 数不变。 自旋-自旋弛豫过程的半衰期用T2表示。 液体T2~1s, 固体或粘度大的液体,T2很小,104~10-5s
晶格泛指环境,即高能态自旋核把能量传给周围环境 (同类分子、溶剂小分子、固体晶格等)转变为热运动 而本身回到低能态维持Boltzmann分布。 自旋-晶格弛豫过程的半衰期用T1表示 (T1与样品状 态及核的种类、温度有关),液体T1~1s,固体或粘度 大的液体T1 很大。 自旋-晶格弛豫又称纵向弛豫。
·
式中: h为普朗克常数 自旋不为0的原子核,都有磁矩,用μ 表示, 磁矩随角动量增加成正比增加.
μ = r· P
式中r 为磁旋比, 不同的核具有不同的磁旋比。
9
NMR技术是观察原子序数或其质量数为奇数的原子核自旋 的手段。质子是最简单的原子核,它的原子序数是奇数且 最小为1,可以自旋。自旋的质子相当于带正电荷的小球 在旋转运动中产生磁场。
第三章
核磁共振氢谱
核磁共振基本原理 核磁共振仪与实验方法 1H的化学位移 各类质子的化学位移 自旋偶合和自旋分裂 自选系统及图谱分类 核磁共振氢谱的解析
1
仪器分析核磁共振波谱分析课件

2024/4/7
仪器分析核磁共振波谱分析课件
图12.9
·共轭效应:影响电子云密度,如,甲氧基苯环上的H,邻位的化学位移为 6.84,对位的化学位移为6.99,间位的化学位移为7.81。杂化影响:若无其它 效应的影响,杂化轨道随S成分增加而电子云密度降低,屏蔽作用减小,化
学位移增大
2024/4/7
仪器分析核磁共振波谱分析课件
2024/4/7
仪器分析核磁共振波谱分析课件
因此,处于高能级的核必须回到低能态,才能维持处
于低能态的核的微弱的数量优势,使得核磁共振信号得以 检测。这一过程以非辐射的形式实现,称为驰豫过程,可 分为: 1、自旋--晶格驰豫,又称纵向驰豫:
自旋核与周围分子交换能量的过程,如固体的晶格, 液体则为周围的同类分子或溶剂分子。用弛豫时间T1 示。 2、自旋--自旋驰豫,又称横向驰豫:
2024/4/7
(a)在CDCl3中 (b)~(d)中为逐步加入苯 4 二甲基甲酰胺的溶剂效应
仪器分析核磁共振波谱分析课件
2024/4/7
图12.15 苯环对二甲基甲酰胺甲基的屏蔽
仪器分析核磁共振波谱分析课件
交换反应: 1.位置交换: 活泼氢,如-OH, -SH,-COOH, -NH2 2.构象交换: 环己烷平伏键与直立键
2024/4/7
图12.13 单键的各向异性
仪器分析核磁共振波谱分析课件
(二) 氢键的影响:分子形成氢键后,使质子周围电子云密度降低,产生去屏
蔽作用而使化学位移向低场移动,如醇类、胺类和酸类等。
1. 分子间氢键:受溶液浓度、温度和溶剂的影响较显著; 2. 分子内氢键:几乎不受溶液浓度、温度和溶剂的影响。 溶剂效应:如二甲基甲酰胺,随各向异性溶剂苯的加入,两个甲基化学位移 发生变化
核磁共振波谱分析原理

核磁共振波谱分析原理
核磁共振波谱分析(NMR)是一种基于核磁共振现象的分析
技术,用于确定分子结构和化学环境。
原理很简单:原子核具有自旋,当这些原子核处于外加磁场中时,会存在基态和激发态之间的能级差。
当外加磁场的强度等于能级差时,原子核会发生能级间的跃迁,而产生共振吸收信号。
核磁共振波谱分析基于这个原理,首先将样品置于强磁场中,使各个原子核的自旋方向与强磁场方向发生共线。
然后通过施加射频脉冲,使部分自旋发生共振吸收,从而产生强度较大的共振信号。
这些信号会被NMR仪器接收并处理,最终转换成
核磁共振波谱。
在核磁共振波谱图上,横轴表示共振频率,纵轴表示吸收强度。
通过对波谱图的分析,可以确定不同核的化学位移,从而推断其所处的化学环境和分子结构。
同时,核磁共振波谱还可以提供有关化学键长、化学键角和空间构型等信息。
核磁共振波谱分析在有机化学、生物化学、材料科学等领域有着广泛的应用。
它是一种无损分析方法,可以用来鉴定化合物、研究反应动力学、分析混合物等。
同时,核磁共振波谱分析还可以用来定量分析样品中不同核的含量,并通过不同核之间的耦合情况推断化学结构。
总之,核磁共振波谱分析是一种非常有用的分析技术,可以提供丰富的化学信息,对于科学研究和实际应用具有重要意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(3)化学位移
= [( 样 - TMS) / 工作频率 ] 106 (ppm) = [( BTMS - B样 ) / B工作频率 ] 106 (ppm)
小: 屏蔽强,共振需要的磁场强度大,在高场出现,图右侧;
大: 屏蔽弱,共振需要的磁场强度小,在低场出现,图左侧;
23:13:35
化学位移与核磁共振图 谱
nuclear magnetic resonance and chemical shift
23:13:35
NMR的直接信息
化学位移() 耦合常数(J) 信号强度(I) NOE效应() 驰豫时间(T1/T2)
23:13:35
一、化学位移chemical shift
屏蔽作用的大小与核外电子云密度有关。
23:13:35
2. 化学位移:chemical shift
在有机化合物中,各种氢核 周围的电子云密度不同 (结构中不同位置)共振频率有差异,即引起共振吸收峰的 位移,这种现象称为化学位移。
由于化学位移的大 小与氢核所处的化学 环境密切相关,因此 就有可能根据 的大 小来判断H 的化学环 境,从而推断有机化 合物的分子结构。
形成氢键后1H核屏蔽作用减少,氢键产生去屏 蔽效应。
H
H3CH2C O H O CH2CH3 5.72ppm CCl4 3.7ppm
OH OH
H OO
CH3
7.45ppmCCl4 4.37ppm
23:13:35
5.质子交换对化学位移的影响
(1)可交换氢(活泼氢) 与N、O、S 等相连的 H,交换速度:OH > NH > SH
甲醇
-O-H, 大 低场
- CH3 , 小 高场
23:13:35
电负性对化学位移的影响
F CH3 Cl CH3 Br CH3 I CH3
4.26
3.05
2.68 2.60
H3C Br H3CH2C Br CH3(CH2)2 Br CH3(CH2)3 Br
2.68
1.65
1.04
0.90
H3C Cl 3.05
解: δ = 134Hz / 60MHz 106 = 2.23 (ppm)
改用100 MHz的NMR仪进行测量,质子吸收峰 与TMS 峰相隔的距离,即为相对于TMS的化学 位移值Δν Δν = 2.23 100 = 223Hz
23:13:35
三、影响化学位移的因素
factors influenced chemical shift
4.27 4.27 4.26
3.23 2.74 2.73 2.72 2.54 2.52 2.52 2.51 2.34 2.33 2.32 1.80 1.79 1.79 1.78 1.78 1.77
5.0
9
4.5
4.0
NMR的直接信息
3
3.5
1
3.0
5 48
2.5
2.0
7
1.5 ppm
例题, 某质子的吸收峰与TMS峰相隔134Hz。若 用60 MHz的核磁共振仪测量,计算该质子的化学 位移值是多少?
23:13:35
二. 化学位移的表示方法
(1)位移的标准 没有完全裸露的氢核,没
有绝对的标准。
相对标准:四甲基硅烷(TMS) Si(CH3)4 (内标)
规定:它的化学 位移 TMS = 0
(2) 为什么用TMS作为基准? a. 12个氢处于完全相同的化学环境,只产生一个尖峰; b. 屏蔽强烈,位移最大。与有机化合物中的质子峰不重迭; c. 化学惰性;易溶于有机溶剂; d. 沸点低,易回收。
• 取代基的电负性 • 磁各向异性 • 氢键 • 环烷基的环电流效应 • 溶剂特性
23:13:35
1.诱导效应 --去屏蔽效应
与质子相连元素的电负性 越强,吸电子作用越强,价电 子偏离质子,屏蔽作用减弱, 信号峰在低场出现。
例如:碘乙烷
CH3 , =1.6~2.0,高场; CH2I, =3.0 ~ 3.5, 低场
Cl H2C Cl
5.33
Cl HC Cl
Cl 7..24
23:13:35
2.磁各向异性效应
(1)双键 价电子产生诱导
磁场,质子位于其 磁力线上,与外磁 场方向一致, 去屏蔽。
23:13:35
(2)叁键
价电子以圆柱形环绕叁键运行,产生诱导磁 场,分子轴向磁场与外磁场方向相反,产生屏 蔽效应。
23:13:35
1.屏蔽作用(shielding effect)
理想化的、裸露 的氢核;满足共振 条件:
0 = H0 / (2 )
产生单一的吸收峰;
23:13:35
B =(1- )B0 :屏蔽常数。 越大,屏蔽效应越大。
0 = [ / (2 ) ](1- )B0
由于屏蔽的存在,共振需更强的外磁场(相 对于裸露的氢核)。
23:13:35
12
13
11
15
10
14 54
10.5 10.02Fra bibliotek18
9
7 6
3 2
NH
9.5
23:13:35
9.0
8.5
8.0
7.5
7.0
6.5
6.0
5.5
9.85
7.29 7.28 7.27 7.26 7.25 7.25 7.15 7.15 7.13 7.13 7.12 7.12 7.08 7.08 7.07 7.07 7.06 7.05
(3)苯环
苯环上的6个 电子产生较强的诱 导磁场,质子位于 其磁力线上,与外 磁场方向一致,去 屏蔽。
23:13:35
23:13:35
3.共轭效应
=3.99
H2C=CH2
=5.28
H OCH3
C=C
H
H
=3.85 =6.38
=6.28 O
H
C
C=C
CH3
= 2.20
H
H
=6.18 =5.82
第十一章 核磁共振波谱
分析
一、核磁共振与化学位移
nuclear magnetic resonance and chemical shift
二、影响化学位移的因素
nuclear magnetic resonance spectroscopy
第三节
factors influenced chemical shift
活泼氢可与同类分子或与溶剂分子的氢进行交换: ROH (a) + R’OH (b) = ROH (b) + R’OH (a) ROH (a) + HOH (b) = ROH (b) + HOH (a)
23:13:35
3.70
OCH3 6.81 7.19
6.80
给电子效应
OO N
8.20 7.57
7.57
吸电子效应
23:13:35
O
H3C
CH
CC
Hx'
Ha
Hb
6.87
6.03
CHO
Ha'
Ha
Ha 7.75
CH3 Hx 7.31
Ha 7.82 SO3H
Hb Cl
23:13:35
Hb 7.50
4.氢键效应
