2011年第二季度SFDA批准的一类新药
胃粘膜肠化生的治疗
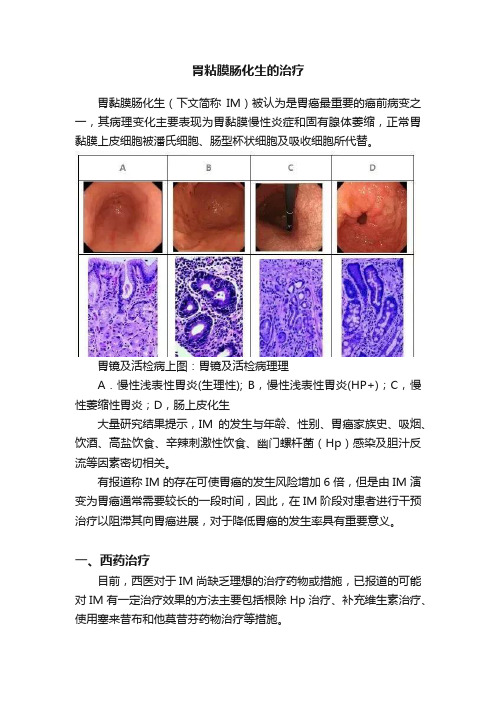
胃粘膜肠化生的治疗胃黏膜肠化生(下文简称IM)被认为是胃癌最重要的癌前病变之一,其病理变化主要表现为胃黏膜慢性炎症和固有腺体萎缩,正常胃黏膜上皮细胞被潘氏细胞、肠型杯状细胞及吸收细胞所代替。
胃镜及活检病上图:胃镜及活检病理理A.慢性浅表性胃炎(生理性); B,慢性浅表性胃炎(HP+);C,慢性萎缩性胃炎;D,肠上皮化生大量研究结果提示,IM的发生与年龄、性别、胃癌家族史、吸烟、饮酒、高盐饮食、辛辣刺激性饮食、幽门螺杆菌(Hp)感染及胆汁反流等因素密切相关。
有报道称IM的存在可使胃癌的发生风险增加6倍,但是由IM演变为胃癌通常需要较长的一段时间,因此,在IM阶段对患者进行干预治疗以阻滞其向胃癌进展,对于降低胃癌的发生率具有重要意义。
一、西药治疗目前,西医对于IM尚缺乏理想的治疗药物或措施,已报道的可能对IM有一定治疗效果的方法主要包括根除Hp治疗、补充维生素治疗、使用塞来昔布和他莫昔芬药物治疗等措施。
1、根除Hp治疗据报道,全球Hp感染率超过50%,认为Hp感染是胃炎、IM及胃癌的重要危险因素之一;Hp感染可通过导致胃黏膜炎症进而使IM 的发生风险增加4.5~9.0倍,尤其是Cag-A+的菌株。
因此,从理论上讲,根除Hp治疗有利于IM的恢复,故有人尝试通过根除Hp治疗进而诱导IM的逆转。
然而,一项荟萃分析结果显示,根除Hp治疗后,无论是胃窦部还是胃体部的IM并未像黏膜萎缩一样出现逆转。
来自日本等多个国家的研究结果也显示,根除Hp治疗并不能有效逆转IM,但一致认为,在胃黏膜出现IM病变之前进行根除Hp治疗有利于对胃炎的控制,而在出现IM之后进行Hp根除治疗虽然不能使IM发生逆转,但是有助于延缓IM的进展。
2、补充维生素目前已有充分证据证明摄入新鲜蔬菜和水果可有效预防胃癌,可能是由于其中含有抗氧化剂、维生素等;维生素C是存在于胃液中强有力的抗氧化剂,可使氧自由基失活,还有助于亚硝酸盐的清除。
因此有学者观察了补充维生素对IM的影响,结果显示,根除Hp治疗后给予补充β-胡萝卜素(在体内可转化为维生素A)和维生素C治疗,可使IM的逆转率从6%分别提高到20%和19%。
自考《药事管理学及法规》章节试题:药品注册管理

自考《药事管理学及法规》章节试题:药品注册管理自考《药事管理学及法规》章节试题:药品注册管理在备考自考《药事管理学及法规》知识点后,考生们要及时做题进行巩固,以下是店铺搜索整理的一份自考《药事管理学及法规》章节试题:药品注册管理,供参考练习,希望对大家有所帮助!想了解更多相关信息请持续关注我们店铺!第五章药品注册管理一、A型题1.新药的技术转让要求,接受新药技术转让的生产企业必须取得( )A.《药品生产许可证》B.《营业执照》C.《新药证书》和《药品生产许可证》D.《药品GMP证书》和《药品生产许可证》2.负责对药物临床研究、药品生产审批的是( )A.SFDAB.FDAC.省级药品监督管理部门D.卫生部3.GLP规定该规范适用于( )A.为申请药品临床试验而进行的非临床研究B.为申请药品注册而进行的非临床研究C.为申请新药证书而进行的非临床研究D.为申请药品上市而进行的非临床研究4.药品注册境内申请人应当是中国境内的( )A.合法登记的法人机构B.持有新药证书的新药研究课题负责人C.持有生产批准文号的机构D.办理药品注册申请事务的人员5.对获得生产或销售含有新型化学药品许可的生产者、销售者提交的自行取得的未披露数据,SFDA给予( )A.从申请之日起,5年保护B.从申请之日起,6年保护C.从批准之日起,5年保护D.从批准之日起,6年保护6.临床研究用药物,应当( )A.在符合GLP要求的实验室制备B.在符合GMP条件的车间制备C.在符合GCP规定的环境中制备D.在符合GDP条件的操作室制备7.创新药(NCEs)批准生产后其药品标准试行期为( )A.1年B.2年C.3年D.4年8.专利法规定可以授予专利权的是( )A.科学发现B.智力活动的规则和方法C.动物和植物品种的生产方法D.疾病的论断和治疗方法9.药品不良反应主要是指合格药品( )A.使用后出现的与用药目的无关的或意外的`有害反应B.在正常用法下出现的与用药目的无关的或意外的有害反应C.在正常用法用量下出现的有害反应D.正常用法用量下出现的与用药目的无关的或意外的有害反应10.药品不良反应监测专业机构的人员组成包括( )A.医学、流行病学及有关专业的技术人员B.医学、药学及有关专业的技术人员C.药学、药物流行病学及有关专业的技术人员D.药学、法医学及有关专业的技术人员二、B型题[11-14]A.Ⅰ期临床试验B.Ⅱ期临床试验C.Ⅲ期临床试验D.Ⅳ期临床试验E.药品临床试验机构11.新药上市后监测是( )12.随机盲法对照临床试验是( )13.申请新药证书是在完成哪期临床试验之后( )14.治疗作用初步评价阶段是( )[15-18]A.1年B.2年C.5年D.10年E.20年15.临床研究被批准后应当在几年内实施( )16.《进口药品注册证》的有效期为( )17.新药批准文号的有效期为( )18.进口药品分包装期限一般不超过( )[19-22]A.化学药品一类新药B.化学药品二类新药C.化学药品三类新药D.化学药品四类新药E.化学药品五类新药19.已在国外上市尚未在国内上市的原料药( )20.已在国外上市尚未在国内上市的复方制剂( )21.国内外均未上市的新复方制剂( )22.国内外均未上市的已知药物中光学异构体及制剂( ) [23-25]A.GLPB.GCPC.GMPD. GSPE.GAP23.药物临床前研究中的安全性评价研究必须执行( )24.药物临床研究必须执行( )25.《药物非临床研究质量管理规范》缩写是( )三、X型题26.新化学药品名称包括( )A.通用名B.商品名C.英文名D.化学名E.汉语拼音27.SFDA对下列新药可以实行加快审批的( )A.罕见病的新药B.NCES新药C.糖尿病新药D.新的中药材及其制剂E.新工艺可产生巨额利润的已知药物28.药品不良反应监测的范围是( )A.可疑药品不良反应B.可疑严重药品不良反应C.说明书中已载明的不良反应D.新的药品不良反应E.超剂量服用药品产生的不良反应29.授予发明专利权的药品应当具备( )A.经济性B.高新技术C.实用性D.创造性E.新颖性30.药品注册申请包括( )A.新药申请B.进口药品申请C.补充申请D.已有国家标准药品的申请E.处方药申请参考答案:(一)A型题1、D2、A3、B4、A5、D6、B7、B8、C9、D 10、C(二)B型题[11-14]DBCB [15-18]BCCC [19-22]CCAA [23-25]ABA(三)X型题26、ACDE 27、ABCD 28、ABD 29、CDE 30、ABCD 【自考《药事管理学及法规》章节试题:药品注册管理】。
艾得辛(艾拉莫德):先声新星

艾得辛(艾拉莫德):先声新星《医药经理人》杂志记者崔昕能看到创新带来的巨大的价值,不一定能理解创新所要付出的沉重代价。
在药物创新这条路上,付出和收获,并不完全成正比。
好在这一次,先声可以开庆功宴了。
19个科学技术专业领域的研发团队,150位基础和临床研究专家,12年,1.5亿元人民币,先声药业用这些数字,最终打造出了全球首个小分子治疗类风湿性关节炎药物—“艾得辛”(艾拉莫德)。
2012年1月8日,先声药业集团董事局主席任晋生在北京宣布:“艾得辛”正式上市用于临床。
艾得辛是具有我国完全自主知识产权的小分子类抗类风湿性关节炎的药物,这也是17年来,类风湿性关节炎治疗领域里的首个小分子类药物。
研发龟兔赛跑2011年8月,新闻联播播出先声药业研发的艾得辛正式获得SFDA国家一类新药证书及**注册批文的新闻。
这条只有几秒钟的消息,却引得几百万人通过央视打电话到先声询问这个药何时能在市场上买得到。
市场上的需求如此迫切,在中华医学会中华风湿病学分会主任委员、北京大学人民医院风湿免疫科主任栗占国看来,这确实是临床上真实的反应。
2006年,贾占国在国内做调查时就发现,造成肢体致残的疾病中,致残率最高的一个是脑血管病,另外一个就是关节病。
但这类患者中只有44%得到了规范治疗,将近56%的患者没有很好的治疗,或者压根就没有经过抗风湿病的治疗,最终造成残废。
而造成这个局面的主要原因是,一直以来,很多人包括医生在内,都认为类风湿性关节炎无药可治。
临床上治疗类风湿性关节炎的一线用药甲氨喋呤,其实有些“名不正,言不顺”,因为它实际上是抗***物。
艾拉莫德最初进入先声药业的视野是在2004年,当时已经先期进行了5年探索的先声药业合成工艺室丁磊在搜索国家食品**监督管理局审评中心关于另一个首仿药的注册情况时,顺便输入了艾拉莫德的英文名称iguratimod,查询中国申报情况,忽然发现天津药物研究院已经按照1.1类新药申报审评。
一周后,先声药业研发副总裁殷晓进就出现在天津药物研究院院长办公室里,很快,一项技术转让协议签订了,先声药业开始与天津药物研究院联合开发艾拉莫德。
抗生素临床使用规范管理

50
20 40
6000 4000 2000 0 2006年 2007年 2008年 2009年 2010年
血培养
2002-2010年分离的革兰氏阴性杆菌菌株数
3000 2522 2500 2471
菌 株 2000 数 株
1500 1000 592 500 0 588 885 1197 1056
1865 1451
《关于进一步加强抗菌药物临床应用管理的暂行
规定》
《关于多重耐药菌医院感染预防控制管理制度》 《关于“超级细菌”感染的预防控制预案》
我院合理用药指导及示范培训工作
• 2011年5月20日——我院举办“2011年大连市中心 医院医疗质量大会” • 2011年7月11日—— 我院承办了“大连市抗菌药 物临床应用专项整治活动现场经验交流会” • 2011年8月——我院医务部及药学部多次组织院内 抗菌药物应用重点科室进行专项讨论学习 • 2011年9月7日——我院举办“药物基因组学及其 在合理用药中的应用”市级继续医学教育学习班
抗生素临床使用规范管理
1
行政干预临床不合理用药的起因
—患者投诉
患者要求 院长职责 医院长远发展需要
当时我院不合理使用抗生素的表现
无指征用药; 重复用药; 频繁换药; 使用时间长; 无病原学依据; 使用剂量大。
不合理用药的后果
严重影响医疗质量和医疗安全
可造成某些药源性疾病的新流行病学趋势
分 类
非限制使用
限制使用 特殊使用
复方磺胺甲噁 磺胺类和甲氧苄啶 唑 红霉素2 大环内酯类 阿奇霉素 (口服)2 克拉霉素2 林可酰胺类 氨基糖苷类 克林霉素 庆大霉素 环丙沙星2 氟喹诺酮类 左氧氟沙星3 依替米星 莫西沙星2 阿奇霉素 (注射)2
(完整版)利福霉素

利福霉素前言:全球现有结核病人2000万,每年新发现800-1000万,每年约有300万人死于结核病。
世界卫生组织预测近乎10年全球肺结核患者将有2000万人增加到3000万人以上。
中国结核病人数居世界第二位,仅次于印度,有肺结核病人600万,其中有传染性的病人200万,每年死于结核病的人数约为25万。
综述:利福霉素(rifamycins )是由地中海拟无枝酸菌(Amycolatopsis mediterranei )产生的一类安莎(ansamycins )大环内酯抗生素。
这类抗生素的毒性低、疗效高且抗菌谱较广,可特异性地与依赖DNA 的RNA 聚合酶作用,抑制细菌DNA 的转录过程;而且对肿瘤RNA 病毒的依赖RNA 的DNA 逆转录酶有抑制作用。
广泛应用于治疗G +(革兰氏阳性菌)、结核病、麻风病和与艾滋病有关的分枝杆菌感染。
利福霉素简介:利福霉素是1957年由意大利Lepetit 研究室Sensi 等发现的,他们从从地中海拟无枝酸菌的培养液中可以得到利福霉素A 、B 、C 、D 、E 五种组分,其中主要组分为B 组分,后来人们又在不同产生菌菌种的发酵液中发现了利福霉素O 、S 、SV 组分。
利福霉素成员虽多,但抗菌活性不一,有实用价值者甚少,只有利福霉素SV 应用于临床。
利福霉素B 活性虽较小,但却很容易转化为其他活性较高的衍生物,如利福霉素O 、S 、SV,转化关系如下:利福霉素的化学结构:利福霉素各结构组分上的差异只在于芳香核上侧链的不同。
生产菌种:利福霉素产生菌是1957年米兰研究室从法国拉斐尔植物国土样中分离筛选获得,当时将其分类为地中海链霉菌,属于放线菌。
后来根据生物化学分类法划入诺卡式菌属(因其细胞壁化学组成有消旋二氨基康二酸、阿拉伯糖、半乳糖),并更正为地中海诺卡式菌。
后来将这一类菌单列一属,改名为地中海拟无枝酸菌。
除地中海拟无枝酸菌外,相继从链霉菌、诺卡式菌属和小单孢菌属分离出利福霉素产生菌。
2014年第一季度FDA批准的9个新药

2014年第一季度FDA批准的9个新药一、达格列净片(Dapagliflozin)2014年1月8日FDA批准阿斯科利及BMS的达格列净用于治疗成人2型糖尿病,达格列净是一种选择性钠-葡萄糖协同转运蛋白-2 (sodium-glucose cotransporter-2,SGLT2)抑制剂,主要作用机制为降低肾小管对原尿中葡萄糖的重吸收,该作用不依赖于胰岛素。
结构式:剂量:5mg/10mg,一天一次。
达格列净不适用于治疗:1型糖尿病、血或尿液(糖尿病酮酸中毒)中酮升高、或者中度或重度肾损害,终末期肾病,或者透析人群。
由于安全性方面的担心,达格列净片批准为有条件上市,FDA要求上市后进行包括评价心血管及膀胱癌风险在内的6项临床试验。
达格列净由百时美施贵宝和阿斯利康联合开发,2012年11月12日获欧盟委员会批准用于治疗2型糖尿病,也是SGLT2类药物中全球首个获批的药物。
阿斯利康去年年底以超过40亿美元的价格买断与百时美施贵宝的糖尿病药合资企业的股份,收购价格中包括前期金和销售相关的里程碑付款。
达格列净为FDA批准的第二个SGLT2抑制剂(为第一个向FDA递交上市申请),因膀胱癌风险FDA要求补充临床数据,强生的卡格列净反而首先上市。
单用达格列净的降糖效果弱于单用卡格列净,100-300mg卡格列净降低HbA1c0.91-1.16%,5-10mg达格列净降低HbA1c 0.5-0.7%。
二、他司美琼胶囊2014年1月31日FDA批准Vanda制药的Hetlioz(商品名),褪黑激素(melatonin)MT1和MT2受体激动剂,用于治疗完全失明患者中治疗非-24-小时睡眠觉醒障碍(“非-24”)。
非-24是盲人中一种慢性的昼夜节律(人体生物钟)疾病引起睡眠时间的困扰,光线不进入他们的眼睛而不能使其人体生物钟与24-小时明暗周期同步,即该病患者可能难以入睡或保持睡眠,而且可能昏昏沉沉醒来或感觉好像他们需要更多的休息,患者睡眠模式逆转- 在白天需睡觉而晚上清醒。
柯菲平医药-自主+开放的创新之路 来自《北大商业评论》2011年1月期

107柯菲平医药:“自主+开放”的创新之路芮华一 北京大学战略研究所助理研究员刘 学 北京大学光华管理学院教授,副院长,北京大学战略研究所所长【企业】自主创新并不单是战略选择问题,还需要足够的胆识和对自主创新的信仰。
至于能否将这条道路走通,则需要结合企业内外部条件,设计合理的路径,并坚定执行专题Special战略性新兴产业生物医药是生物产业至关重要的组成部分。
发展我国生物医药行业的关键之一,是培育企业的自主创新能力。
然而,新药创制是创造性很强的发明活动,是一个高风险、高投入和长周期的系统过程,而且技术成果在产业化过程中还面临着高度不确定的市场。
特别是在这个靠仿制还能赚钱的时代,大多数企业都缺乏创新动力。
即便有一些企业认识到自主创新的重要性,也因为苦于没有掌握正确的方法,未能有效地开展新药创制。
不过,在整体环境不利于新药自主创新的情况下,依然有少部分企业长期坚定不移地开展新药创制。
在这些企业中,既有已经成功上市并获得很高知名度的先声药业,也有与其同处一个城市的柯菲平医药有限公司。
相比国内许多老牌的医药企业,柯菲平医药无疑是我国生物医药行业中的晚辈。
但这家以药品代理销售起家的公司,坚持每年投入数以千万计的资金用于新产品研发,在新药创制领域已经取得了不俗的成绩。
在成立至今的八年里,它取得了销售收入增长28倍、利税增长35倍的成绩。
2010年柯菲平医药的销售收入超过6个亿;有20项发明获得授权专利,其中最有价值的化合物专利超过10项;在已报国家食品药品监督管理局审批的新药中,有8个正在申请临床,5个已进入申报生产阶段。
创新一定要“自主”柯菲平医药最初是一家药品代理销售公司,在公司成立之前,创始人秦引林在心血管药物领域具有十年的销售经验。
然而,从创立柯菲平医药开始,秦引林没有想着只给别人卖药,不然,仅仅凭一款公司代理销售的诺新康,柯菲平就可以安居小康。
深谙中国医药市场竞争本质的秦引林,坚持认为:只有依靠自主创新,销售自己独有的产品,才能够摆脱与其他企业在低水平层次上的白热化竞争,而以仿制药参与市场竞争难以给企业带来真正大的发展。
热熔挤出技术制备艾拉莫德固体分散体及体外溶出度的影响因素研究

T614 ) 是治疗类风湿的 艾拉莫德 ( iguratimod, 2 生成, 小分子药物, 可选择性抑制 COX抑制免疫
004 ) 基金项目: 国家重大新药创制科技重大专项( 2009ZX09310作者简介: 陈玉红, 女, 硕士 开发 研究方向: 药物新剂型与新技术 Email: zhangcan@ cpu. edu. cn
[3 ]
电离源( ESI 源 ) ; Agilent 1290 液相色谱系统, 包括 G4220B 型 二 元 输 液 泵, G4226A 型 自 动 进 样 器, G1330B 型柱温箱。 1. 2 药品与试剂 T614 原料药、 艾拉莫德片 ( 江苏先声药业有限 , mA17100701 、 42100803 ) ; PVP / VA 64 公司 批 号 ( Kollidon VA64 ) 、 Kollidon CLSF、 Soluplus ( 德国巴斯夫公司 ) ; HPMC ASLF、 HPMC E6 、 HPCSL ( 信越化学工业株式会社 ) ; Eudragit L10055 ( 赢创 德 固 赛 ) ; 部 分 预 胶 化 淀 粉 PC10 、 MCC302 、 MCC802 ( 旭化成) ; CMSNa、 微粉硅胶 ( 湖州展望 ) ; 硬脂酸镁( 安徽山河 ) ; DMF、 乙腈为色谱纯, 其他均 为分析纯。 1. 3 动物 SpragueDawley 大鼠, ( 260 ± 10) g, 雄性( 上海斯 克莱实验动物有限公司, 合格证号: 2007000537261) 。 2 2. 1 方 法 载体预筛选
。疏水性药物以分子、 无定形或者微
晶状态分散在水溶性载体中, 可以减小药物粒径或 [45 ] 。 改变药物物理状态, 增加润湿性和溶出度 melt extrusion, HME ) 技术在高分 热熔挤出( hot子材料的玻璃化转变温度之上对其加热 、 捏合, 使活 并根据给药目 性成分均匀包被在热塑性聚合物中, 。 HME 的将挤出物塑造成形 具有其他制备 SD 的方 法如溶剂挥发法、 喷雾干燥法、 熔融法等所不具备的 特别是可连续操作, 过程一步完成, 大生产可 优势, 行, 且不使用有机溶剂, 避免了环境污染、 爆炸以及 [6 ] 溶剂残留等隐患 。 应用 HME 技术制备 SD 的报 道日益增多, 成功提高溶解度和生物利用度的有伊 [7 ] [8 ] [9 ] 17 β 曲康唑 、 硝苯地平 、 雌二醇 等。 614 的体 外 溶 出 度 并 改 善 其 流 动 为了提高 THPMC 性, 本 实 验 拟 以 经 典 SD 载 体 PVP / VA 64 、 ASLF、 HPCSL 和新型辅料 Soluplus ( PEG6000 / 乙烯基己内酰胺 / 醋酸乙烯酯共聚物 ) 为载体, 采用 HME 技术, 614 速释固体分散体。 同时用 X 制备 T614 在固体分散体中的物理状 射线粉末衍射分析 T考察影响溶出度和 SD 稳定性的因素以及大鼠 态, 体内的生物利用度。 1 1. 1 材料与仪器
利福霉素

利福霉素前言:全球现有结核病人2000万,每年新发现800-1000万,每年约有300万人死于结核病。
世界卫生组织预测近乎10年全球肺结核患者将有2000万人增加到3000万人以上。
中国结核病人数居世界第二位,仅次于印度,有肺结核病人600万,其中有传染性的病人200万,每年死于结核病的人数约为25万。
综述:利福霉素(rifamycins )是由地中海拟无枝酸菌(Amycolatopsis mediterranei )产生的一类安莎(ansamycins )大环内酯抗生素。
这类抗生素的毒性低、疗效高且抗菌谱较广,可特异性地与依赖DNA 的RNA 聚合酶作用,抑制细菌DNA 的转录过程;而且对肿瘤RNA 病毒的依赖RNA 的DNA 逆转录酶有抑制作用。
广泛应用于治疗G +(革兰氏阳性菌)、结核病、麻风病和与艾滋病有关的分枝杆菌感染。
利福霉素简介:利福霉素是1957年由意大利Lepetit 研究室Sensi 等发现的,他们从从地中海拟无枝酸菌的培养液中可以得到利福霉素A 、B 、C 、D 、E 五种组分,其中主要组分为B 组分,后来人们又在不同产生菌菌种的发酵液中发现了利福霉素O 、S 、SV 组分。
利福霉素成员虽多,但抗菌活性不一,有实用价值者甚少,只有利福霉素SV 应用于临床。
利福霉素B 活性虽较小,但却很容易转化为其他活性较高的衍生物,如利福霉素O 、S 、SV,转化关系如下:利福霉素的化学结构:利福霉素各结构组分上的差异只在于芳香核上侧链的不同。
生产菌种:利福霉素产生菌是1957年米兰研究室从法国拉斐尔植物国土样中分离筛选获得,当时将其分类为地中海链霉菌,属于放线菌。
后来根据生物化学分类法划入诺卡式菌属(因其细胞壁化学组成有消旋二氨基康二酸、阿拉伯糖、半乳糖),并更正为地中海诺卡式菌。
后来将这一类菌单列一属,改名为地中海拟无枝酸菌。
除地中海拟无枝酸菌外,相继从链霉菌、诺卡式菌属和小单孢菌属分离出利福霉素产生菌。
美国FDA批准新药:仅比2008年多1个

产 品 ,2 0年 ,诺 华 与拜 耳达 成 了 一 07
项 合作 议 ,诺 华可 以推 i具有 自身 品 j I 牌 的 同类J 。所 以,本 文 作者 并 未把 品
■ 图l1 9 ~ 0 9 D 批准的新分子实体药物和生物制品的数目 9 6 2 0年F A
2 0 年批 准 C n y e 第 二 用 于遗 传 08 irz后 个 性 血 管 水肿 的产 品 。C n y e 一 种通 irz为
然 来 自专 业 的 制 药 公 司 ,卡 比 之 下 制 雕
B o h r p u iS 司 开 发 的重 组 人 抗 i t ea e t C 公
( a a l p i ) ,他 预 测 本 品将 会 同 S x g i tn F A 准 的 第 一 P 一 抑 制 剂 J n va D批 个D P 4 a u i ( i a l P i ) 样 达 到 数 十 亿 美 S t g i tn 元 的销 售 业 绩 。此 外 , 他 还看 好 由
肽 基 肽 酶 一 ( P ~ )抑 制 剂 O g z 4 D P4 nl a y
在 2 0 年 批 准 了2 个 新 药 , 译 者 将 其 09 6 进 行 了 对 比 , 发 现 国 内 作 者 将 诺 华
公 司 用 F多 发 性 硬 化 症 的 B 干 扰 素
批 准 , 而 是 F A 物 制 品 评 价 和 研 究 D生 中心 ( B R 批 准 市 的 , 是 由G C CE ) T
D a C r o a in y x o p r t o 公司 开 发 的用 于遗 传 性 管 水 肿 的血 浆 激 肽 释 放 酶 抑 制
剂K l i o ( c l a t d ),这 是继 a b t r e a ln ie
银杏叶类注射剂的市场对比

名称 所含成分 申报类别
银杏内酯注射剂 银杏萜内酯 中药 5 类 活血化於,通经活络。 用于中风病中经络(轻 度脑梗塞)恢复期淤血 阻络症等。
银杏叶类注射剂的市场对比
核 心 提 示 : 银杏叶提取物注射剂(包括舒血宁注射液)是我国最多厂家生产的银杏叶类注射 剂。2011 年,银杏内酯注射液也获得 SFDA 批准生产。银杏内酯 B 注射剂,在 SFDA 临床审 批中。
米内网专稿(研究员 刘姹)2011 年第四季度,中药注射剂银杏内酯注射液获得 SFDA 批 准上市,引发药企及市场的极大关注。银杏叶是最古老的中生代孑遗植物银杏的干燥叶。由于 发现其所含的主要成分黄酮苷能有效地清除体内有毒过氧自由基的作用;银杏内酯具有高度的 专属性抗血小板活化因子(PFA)的作用而成为国际植物药研究的热点课题。最新研究发现银杏 内酯中银杏内酯 B 的活性生理活性最强,是迄今发现的最强的血小板活化因子拮抗剂。 德国威玛舒培博士药厂于 2001 年将银杏叶提取物注射剂引入中国,开始了我国银杏叶类 注射液的仿制和创新。目前我国银杏叶类注射剂的临床及市场情况: 表 1:银杏叶类注射剂的生产及研发情况
银杏内酯 B 注射剂 银杏内酯 B 化药 1 类/中药 1 类 拮抗血小板活化因子。 用于治疗血栓、急性胰 腺炎和心血管疾病等。/ 用于治疗缺血性脑中风 的痰瘀阻络证。
功效
根据米内网- 中成药临床叶注射剂的市场份额最大,占 16.77%,市场份额大幅领先其他中药注射剂品种。 图 1:2010 年心血管疾病用药中成药竞争格局
2008年8-10月FDA批准的新药

2008年8-10月FDA批准的新药2008年8月21日-10月20日FDA批准的新药2008年8月底至10月底,美国FDA批准的新药数量为12个,其中包括Helsinn Healthcare公司的第2代5-HT3受体拮抗剂Aloxi(palonosetron HCl,盐酸帕洛诺司琼胶囊);安进公司研发的首个并且是唯一的血小板生成药物Nplate(romiplostim),用于治疗脾切除及非脾切除的成人免疫性血小板减少症;诺和诺德公司50%胰岛素鱼精蛋白混悬液+50%重组DNA胰岛素速效注射剂的预混合组合包装产品(NovoLog Mix 50/50);印度矩阵实验室(Matrix Labs)抗乙肝药拉米夫定(Lamivudine);苏格兰Strakan公司开发的全球第1种经皮吸收的5-HT3受体阻断剂Sancuso(Granisetron,格拉司琼),用于治疗化疗引起恶性呕吐;UCB公司的抗癫痫药Keppra XR (levetiracetam,左乙拉西坦缓释片);印度Aurobindo制药公司的抗HIV药硫酸阿巴卡韦(Abacavir sulfate);通用电气医疗集团诊断造影剂AdreView(Iobenguane sulfate I 123,碘[123I]苄胍),用来检测神经内分泌瘤;美国Akorn公司研制生产的Akten (Lidocaine hydrochloride,盐酸利多卡因)眼用凝胶剂3.5%,用于眼部局麻;Watson 实验室研制的用于前列腺增生的α1肾上腺素受体拮抗剂Rapaflo(Silodosin,西罗多辛);Medpointe Pharma HLC开发的Astepro(Azelastine hydrochloride,盐酸氮卓斯汀),治疗季节性过敏性鼻炎;以及Teva Parenteral制药公司的抗溃疡药泮托拉唑钠(Pantoprazole sodium)。
药品名称活性成分NDA化学类别审批类型适应证研发公司批准日期Aloxi Palonosetronhydrochloride3 镇吐药HelsinnHealthcare2008-08-22Nplate Romiplostim 促血小板生成药安进2008-08-22Novolog Mix50/50 Insulin aspartprotaminerecombinant;3 S 降血糖药诺和诺德2008-08-26Insulin aspart recombinantLamivudine; Tenofovir disoproxil fumarate Lamivudine;Tenofovirdisoproxilfumarate抗病毒药MatrixLabs2008-09-12Sancuso Granisetron 2 S 止吐药Strakan 2008-09-12Keppra XR Levetiracetam3 S 抗癫痫药UCBInc.2008-09-12Abacavir sulfate Abacavirsulfate抗病毒药AurobindoPharma2008-09-12Adreview Iobenguanesulfate I 1231 P,O 诊断用药通用电气医疗集团2008-09-19AktenLidocainehydrochloride局麻药Akorn2008-10-07Rapaflo Silodosin 1 S 用于前列腺增生WatsonLabs2008-10-08AsteproAzelastinehydrochloride5 S 抗组胺药MedpointePharmaHLC2008-10-15Pantoprazole sodium Pantoprazolesodium抗溃疡药TevaParenteral2008-10-20注: 1:新分子实体;2:新酯、新盐或其他非共价衍生物;3:新制剂;5:新生产商;S标准审批药;P优先审批药;O罕见病用药。
2011年新药展望

2011年新药展望:热点领域创新频繁来源:中国医药营销联盟核心提示:呼吸系统治疗药物市场的规模预计将从285亿美元增加到2015年的356亿美元。
今后1年中,药剂师们可以预计到组合药物将继续成为哮喘治疗领域里的重要支柱。
Kolling指出,磷酸二酯酶-4(PDE-4)抑制剂也许会复苏,不过,针对吸入剂仿制产品的审批路径目前还不清楚。
一、呼吸系统疾病:组合药物将成主流呼吸系统治疗药物市场的规模预计将从285亿美元增加到2015年的356亿美元。
今后1年中,药剂师们可以预计到组合药物将继续成为哮喘治疗领域里的重要支柱。
Kolling指出,磷酸二酯酶-4(PDE-4)抑制剂也许会复苏,不过,针对吸入剂仿制产品的审批路径目前还不清楚。
预计以下新药的动向值得关注:1.Aclidinium(由Almirall/Forest公司开发)。
作为一种长效、每日使用2次的干粉吸入剂(DPI),Aclidinium是毒蕈碱拮抗剂(抗胆碱)支气管扩张剂,用来治疗慢性阻塞性肺病(COPD)。
单药治疗(Ⅲ期)和复合药物(Ⅱ期)正在开发之中。
预计今年将会提交单药的NDA(新药申请)。
2.Fluticasone furoate/vilant-erol trifenatate(Relovair,由葛兰素史克开发)。
这是一种长效β-2激动剂+糖皮质激素激动剂,用来治疗COPD和哮喘。
在治疗COPD的Ⅱb期试验中,它达到了疗效目的,但在对哮喘的治疗中没有达到目的。
3.Indacaterol(前身为QAB-149,由诺华开发)。
这是每日使用一次的长效β-激动剂DPI,具有24小时支气管扩张作用,用来治疗COPD。
4.Indacaterol + glycopyrronium bromide(由诺华开发)。
这是每日使用一次的固定剂量复合药,由长效β-激动剂DPI+长效毒蕈碱拮抗剂(格隆溴铵)组成,用来治疗COPD。
5.Roflumilast(Daxas,由Forest Labs/Nycomed公司开发)。
盐酸戊已奎醚替代阿托品治疗

盐酸戊已奎醚替代阿托品治疗发表时间:2009-02-17T11:01:53.340Z 来源:<<中国医药卫生>>杂志供稿作者:王金亮俞小娥[导读]王金亮俞小娥广丰县人民医院(江西广丰334600)【摘要】目的比较盐酸戊已奎醚和阿托品对有机磷农药中毒的疗效和副作用。
方法 102例患者使用盐酸戊已奎醚救治,86例患者使用阿托品救治,比较其疗效和副作用。
结果〓盐酸戊已奎醚的疗效明显优于阿托品,而其副作用的发生率明显轻于阿托品组。
结论盐酸戊已奎醚治疗有机磷农药安全有效,副作用少,住院时间短,治愈率高,死亡率低,可取代阿托品治疗有机磷农药中毒。
【关键词】盐酸戊已奎醚阿托品有机磷农药中毒[中图分类号]R595 [文献标识码]A [文章编号]1810-5734(2008)11-0037-02随着人们生活水平的提高,自服有机磷农药而中毒的病例已大为减少,但有机磷农药的误服中毒和皮肤吸收中毒病例时有发生。
我院自2006年7月至今,收治了102例有机磷农药中毒的病例,使用盐酸戊已奎醚(长托宁)或盐酸戊已奎醚伍用氯解磷定治疗。
我们整理了2006年7月份以前的86例有机磷农药中毒病例的临床资料,作为临床对照组,将2006年7月份以后收治的102例有机磷农药中毒的病例,作为临床观察组,比较两组的疗效和副作用。
现报告如下: 1 资料与方法1. 1 一般资料:临床对照组(A组):病例86例,男39例,女47例,年龄最大者72岁,最小者2岁,平均年龄(45±12)。
其中甲胺磷68例,占79.07%,乐果13例,占15.12%,敌敌畏5例,占5.81%。
甲胺磷中毒病例中:自服者36例,甲胺磷皮肤吸收者25例,误食洒有甲胺磷农药的蔬菜者7例。
按《内科学》第六版急性有机磷中毒的分级标准:重度中毒6例,中度36例,轻度26例。
临床观察组(B组):病例102例,男68例,女44例,年龄最大者83岁,最小者1.5岁,平均年龄(48.2±9.3)。
近年药物研发最热门靶点汇总

近年药物研发最热门靶点汇总1.癌症2000年后肿瘤信号⽹络被逐渐阐释、完善,⼤量的分⼦靶向药物进⼊临床研究、⾛上市场,近年针对受体酪氨酸激酶靶点如Bcr-Abl(见1.1)、VEGF/VEGFRs(见1.2)、PDGF/PDGFRs(见1.3)、EGFR/HER2(见1.5)、ALk(见1.7)已有多个药物上市,me-too品种的研发逐渐放缓,但扩展适应症、克服耐药性、优化治疗⽅案的研究还没有结束。
⽬前肿瘤信号⽹络中,FGFR(见1.4)、c-Met(见1.6)、HER3(见1.5)、Hedgehog(见1.13)等靶点吸引了不少的研究,但最热的当是PI3K/Akt/mTOR (见1.15)、Raf/MEK/ERK(见1.16)两条细胞内信号通路。
2013年FDA批准了BTK抑制剂ibrutinib,对CLL 的疗效很好,吸引了⼀些药企开发me-too/me-better药物。
涉及细胞周期调控的靶点如Aurora激酶(见1.8)、CDK(见1.9)、ChK(见1.10)也有不少新药在研,最耀眼的⽆疑是CDK4/6抑制剂,已经有三个分⼦推进到后期开发,⽽Aurora激酶和ChK抑制剂则⼤多在早期临床失败。
针对DNA 损伤修复的PARP(见1.11)的药物研发也回暖,⽽针对蛋⽩-蛋⽩相互左右的新靶点如Bcl-2(见1.12)、MDM2(见1.14)、IAP也有多个分⼦进⼊临床研究。
特别值得⼀提的是表观遗传调控剂,早年发现的阿扎胞苷、地西他滨等被证明为DNA甲基转移酶抑制剂,⽬前研究得最多的是HDAC抑制剂(见1.17),表观遗传的其他靶点如组蛋⽩赖氨酸甲基转移酶EZH2、组蛋⽩H3甲基转移酶DOT1L、溴结构域蛋⽩BET等也开展了⼤量基础研究。
近来抗癌领域最耀眼的⽆疑是免疫疗法,调节CTLA4、PD1/PDL1、4-1BB、OX40、CD27等免疫检查点(见1.18)可以激活T 细胞免疫应答,⽽基因⼯程修饰的CAR、TCR T细胞的应⽤更是标志着个性化免疫治疗时代的到来。
2012年美国食品药品管理局(FDA)批准新药回顾

2012年美国食品药品管理局(FDA)批准新药回顾2012年,美国食品药品管理局(FDA)共批准了39种新药,这一数字成为该机构自1996年以来批准新药数量的第二高——1996年FDA共批准53种新药,为历史之最,包括阿托伐他汀(立普妥)这样的“重磅炸弹”级药物。
对于制药行业和患者来说,这足以令人感到意外和惊喜,因为在2011年和2010年,FDA分别只批准了30和21种新药,2002~2011年年平均批准数为23种。
对于2012年有39种新药获批,有人认为系原研药企业正蓄势待发,以应对近年来由于专利到期、仿制药竞争带来的销售损失。
分析师预计,2012年批准的药物中有一些将获得数十亿美元的销售额,不过,FDA发言人、药学博士Li sa Kubaska表示:“FDA在2012年批准的新分子实体不断增加令人鼓舞,但现在就说FDA批准新药增加进入到一个长期的趋势还为时过早。
”1 1月17日,BTG制药公司的Voraxaze(Glucarpidase,羧肽酶)注射剂获得批准,用于治疗因肾功能衰竭而导致的甲氨蝶呤中毒(血液中甲氨蝶呤水平过高)。
Voraxaze是一种酶,可将甲氨蝶呤分解成可排出体外的成分,从而迅速降低其血液水平。
2 1月23日,LEO Pharma AS公司的外用凝胶PICATO(Ingenol mebutate,巨大戟醇甲基丁烯酸酯)获得批准,用于治疗光化性角化病。
光化性角化病是一种由累积日光暴露导致的癌前病变,可能进展为鳞状细胞癌。
该药是从澳大利亚植物Euphorbia peplus的汁液中提取的活性成分,母核为巨大戟醇,可诱导细胞凋亡,但其治疗的具体作用机制尚不明确。
3 1月27日,辉瑞公司的Inlyta(Axitinib,阿西替尼)获得批准,用于治疗其他药物治疗无效的晚期肾癌(肾细胞癌)。
Inlyta是一种小分子酪氨酸激酶抑制剂,对多个靶点有效,包括VEGF受体1、2和3。
4 1月30日,基因泰克公司的Erivedge(Vismodegib,维莫德吉)获得批准,用于治疗成人最常见的皮肤癌——基底细胞癌。
洛铂联合依托泊苷治疗小细胞肺癌的临床疗效

洛铂联合依托泊苷治疗小细胞肺癌的临床疗效叶静;陆友金;赵卉【摘要】目的评价洛铂联合依托泊苷治疗初治小细胞肺癌的疗效和毒副反应,并与同期应用的顺铂联合依托泊苷治疗初治小细胞肺癌的方案相比较.方法分析呼吸内科住院治疗的45例初治小细胞肺癌患者,其中洛铂治疗组25例:洛铂50mg/m2,iv,d1,依托泊苷:100 mg/m2,iv,d 1~3;顺铂治疗组20例:顺铂80mg/m2,iv,d1,依托泊苷:100 mg/m2,iv,d1~3;并对两组患者近期疗效及毒副反应进行比较.结果洛铂组CR 8例,PR 9例,SD 4例,PD 4例;顺铂组CR 9例,PR 7例,SD 3例,PD 2例;两组总有效率为68%和80%,差异无统计学意义(P=0.805).全组主要毒性反应为骨髓抑制.顺铂组Ⅲ-Ⅳ度胃肠道反应及脱发明显高于洛铂组,差异有统计学意义(P<0.05).结论洛铂联合依托泊苷治疗初治小细胞肺癌疗效确切,毒副反应小,与顺铂联合依托泊苷方案相比,疗效相似.【期刊名称】《临床肺科杂志》【年(卷),期】2013(018)009【总页数】3页(P1641-1643)【关键词】小细胞肺癌;洛铂;顺铂;依托泊苷【作者】叶静;陆友金;赵卉【作者单位】230601,安徽,合肥,安徽医科大学第二附属医院呼吸内科;230601,安徽,合肥,安徽医科大学第二附属医院呼吸内科;230601,安徽,合肥,安徽医科大学第二附属医院呼吸内科【正文语种】中文肺癌是我国最常见的恶性肿瘤之一,近年来其发生率及病死率上升幅度呈各类恶性肿瘤之首。
其中小细胞肺癌(SCLC)在肺癌中所占的比例约为10%~20%。
SCLC 肿瘤细胞倍增时间短,进展快,早期即发生远处广泛转移,治疗以全身化疗为主,且近期疗效好,但毒副反应巨大,而且复发率高,治愈率低,90%以上的患者治疗后复发,5年生存率仅1%~3%,预后极差[1,2]。
洛铂(LBP)即1,2-二氨基-环丁烷-乳酸合铂,是第三代铂类抗癌药物,其具有稳定性好,抗瘤谱广,抗瘤活性强,作用与第一代的顺铂和第二代的卡铂相当,特别是与顺铂没有交叉耐药性,而毒性与卡铂类似[3]。
西达本胺——新型亚型选择性口服组蛋白去乙酰化酶抑制剂

血管免疫母细胞性 间变性大细胞 (AILT), 271, (ALCL)ALK+, 172, 11.52%
7.31%
在中国,NK/T细胞淋巴瘤发病率也明显很高
Yang QP. et al., Subtype Distribution of Lymphomas in Southwest China: Analysis of 6,382 Cases Using WHO Classification in a Single Institution. Diagnostic Pathology 2011; 6:77
北美及欧洲,PTCL-NOS最常见 东亚地区,NK/T细胞淋巴瘤和ATLL的发病率最高
中国85家医院上传淋巴瘤病例
2009年8月-2010年04月NHL-T亚型分类数量比例图
肝脾T细胞淋巴瘤, 皮下脂膜炎样T细胞 其他类型T细胞淋巴 原发皮肤外周T细胞
11, 0.47%
淋巴瘤, 28, 1.19% 瘤, 177, 7.52% 淋巴瘤 罕见型, 14,
Vose J, Armitage J, Weisenburger D; International T-Cell Lymphoma Project. International peripheral T-cell and natural killer/T-cell lymphoma study: pathology findings and clinical outcomes. J Clin Oncol. 2008; 26(25):4124-30.
重新表达与肿瘤细胞分化、生长抑制相关的基因(抑癌基因) 诱导淋巴及血液肿瘤细胞分化和凋亡(单药治疗) 调控Treg、NK、T及B细胞的细胞因子和免疫活性,选择性抑制剂 能够抑制 Treg从而刺激免疫系统介导的抗肿瘤作用(单药及联合 治疗) 诱导肿瘤干细胞分化、逆转上皮细胞向间充质细胞的表型转化 (EMT),从而抑制肿瘤细胞产生耐药性、复发、侵袭和转移 (联合治疗) 除淋巴及血液细胞外,对多数正常组织细胞影响弱(靶向特征)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2011年第二季度,有多个一类新药获得生产批文,
其中包括贝达药业的埃克替尼、恒瑞医药的艾瑞昔布、天士力药业的注射用重组人尿激酶原。
新获批进口产品有百时美施贵宝的沙格列汀、施维雅的阿戈美拉汀、葛兰素史克的度他雄胺。
2011年第二季度,有多个一类新药获得生产批文,其中包括贝达药业的埃克替尼、恒瑞医药的艾瑞昔布、天士力药业的注射用重组人尿激酶原。
盐酸埃克替尼片(商品名:凯美纳),由浙江贝达药业有限公司研制,是小分子靶向抗肿瘤药,适应症是晚期非小细胞肺癌。
目前,盐酸埃克替尼已拥有中国、美国和国际专利。
艾瑞昔布片(商品名:恒扬),由江苏恒瑞医药股份有限公司研制。
艾瑞昔布是昔布类药物,属于选择性的COX-2抑制剂,该类药物能提供与传统的非选择性NSAIDs一样的镇痛和抗炎作用,而摒弃了与抑制COX-1相关的胃肠道和肾脏并发症。
注射用重组人尿激酶原(商品名:普佑克),由天津天士力制药的控股子公司上海天士力药业有限公司研制,主要用于急性ST 段抬高性心肌梗死的溶栓治疗。
进口产品方面,糖尿病新药沙格列汀片(商品名:安立泽,英文名:Onglyza)获批进口,进口企业为百时美施贵宝。
该产品属于二肽基肽酶4(DPP-4)抑制剂,由百时美施贵宝和阿斯利康联合研制,并且共同推广,2009年获得FDA批准上市。
2010年该产品全球销售额2.27亿美元。
阿戈美拉汀片(商品名:维度新,英文名:Valdoxan),施维雅公司进口,是首个褪黑素受体激动剂,具有良好的抗抑郁效果。
度他雄胺软胶囊(商品名:安路达,英文名:Avodart),葛兰素史克产品,为5α-还原酶抑制
剂,2003年1月首次在美国上市,主要用于抗前列腺增生。
2010年全球销售额6.29亿英镑,同比增长18.68%。
米内网
国家药监局紧急通知要求停用药品“力百汀”
广东展开全面清查
国家食品药品监督管理
相关公司股票走势
白云山A局昨日在其网站上公布通知,要求立即停止销售和使用葛兰素史克公司生产的阿莫西林克拉维酸钾干混悬剂(商品名为力百汀),已上市的要求召回。
经中国食品药品鉴定研究院检验,力百汀中检出邻苯二甲酸二异癸酯(DIDP),即所谓的“塑化剂”。
昨日,国家药监局官网紧急发出关于停止销售和使用葛兰素史克公司生产的阿莫西林克拉维酸钾干混悬剂的通知,指经中国食品药品鉴定研究院检验,在上述药品中检出DIDP(即“塑化剂”),这也是继食品、保健品后内地首次检出药品“含塑”。
国家药监局通知表示,经中国食品药品鉴定研究院检验,在葛兰素史克公司生产的阿莫西林克拉维酸钾干混悬剂中检出邻苯二甲酸二异癸酯(DIDP)。
国家食品药品监督管理局决定立即停止葛兰素史克公司生产的阿莫西林克拉维酸钾干混悬剂产品的销售和使用,已进口上市的由企业召回。
国家药监局这份通报并未同时提供需召回的药品的产地、批次、流向、检出塑化剂含量等更多详情。
据记者了解,葛兰素史克公司生产的阿莫西林克拉维酸钾干混悬剂是处方药,在内地的产品名为“力百汀”(Augmentin)。
“力百汀”适用于治疗上呼吸道及下呼吸道感染、生殖泌尿道感染、皮肤及软组织感染、骨和关节感染,以及其他敏感菌引起的感染。
省药监局相关负责人昨日告诉记者,该局已在6月17日下午接到国家药监局通知,并于当天将该通知转发各地市局,在全省范围内部署展开葛兰素史克公司生产的阿莫西林克拉维酸钾干混悬剂的检查、封存、登记、监督回收等工作。
昨日,记者走访广州市内多家药房,并未找到“力百汀”的踪影。
在昌岗路口附近的大参林,销售员查询了电脑后称,只有儿童服用的阿莫西林克拉维酸钾胶囊,是南京一家药厂生产的;在江南大道的百健医药、岁岁康大药房,记者只看到白云山制药和浙江一家药厂制造的阿莫西林克拉维酸钾药片、胶囊。
广东金康大药房、健民等药房均表示,已多年未经营“力百汀”。
广东老百姓大药房则表示,该药在香港被曝光“含塑”后,为安全起见已将其下架。
葛兰素史克回应
初查“塑”源是瓶盖
葛兰素史克内地联系人告诉记者,公司是从国家药监局的官网上了解到召回决定的,目前正在制定具体回收细节,他强调上述药品的生产过程中没有故意使用DIDP或者任何其他的邻苯二甲酸酯。
目前可判断DIDP的唯一来源是瓶盖中的塑料内层,进一步的调查还在进行中。
事实上,香港卫生署早已检出上述药品“含塑”。
香港6月9日指令葛兰素史克召回法国产的“安灭菌”(香港译名,与“力百汀”是同一种药),规格为156毫克/5毫升,原因是样本中发现含有DIDP,含量是18/106,是欧洲规定的迁移量上限的两倍。
6月10日,香港方面再指葛兰素史克在英国生产、规格为457毫克/5毫升的“安灭菌”需要召回,样本含有DIDP、DINP 两种塑化剂,分别为88/106和1.4/106。
