兽药GMP检查验收情况的报告
兽药生产企业GMP验收复验工作问题讨论

检查验收评定标准修订情况
修定评定标准的依据: 在《兽药管理条例》、农业部令第11号发布的《兽药生产 质量管理规范》等框架下修订标准。 修定评定标准掌握的几个原则: (一)标准的科学性,标准制定应立足于生产企业的实际情 况,标准应能准确的反应出生产企业的实际水平,体现质 量控制的核心精神。 (二)条款的易操作性,条款的表述要准确、不产生歧义, 一项条款表述一项事情,以便于现场判定。 (三)条款的表述上尽量原则一点,具有法定约束力,以避 免规定过细,反而对企业有时是一种约束。
结果评定
关键项目缺陷 一般项目缺陷 结 果
0 0 1~3 0 1~3 ﹥3
≤15% >15%—≤25% ≤15% ﹥25% ﹥15%
通过兽药GMP检查验收,作出“推荐”结论 缺陷数及缺陷率在规定范围内,作出“推迟 推荐”结论
未通过兽药GMP检查验收,作出“不推荐”结 论
*一般项目缺陷率=一般项目缺陷数/涉及一般项目条款数 ×100%
8.对委托实验的(包括动物实验以及原料药 红外检测等),应检查委托执行情况,特 别要检查其被委托单位出具的报告。 9.标准品、对照品采购是否满足实际生产、 检验需要,应检查其使用记录。 10. 按照以前的评定标准验收合格的企业,在 申请复验时,如存在硬件缺陷且不能通过 软件进行弥补的,应要求其必须进行硬件 改造。
(二)生物制品评定标准: 上版标准中,检查验收项目共197项(其中 关键项目58项,一般项目139项);修订后 的新版标准中,检查验收项目共224项(其 中关键项目25项,一般项目199项)。
检查项目分布状况(关键项/检查项)如 下: 机构与人员3/14 厂房与设施7/62 设备1/22 物料5/25 卫生0/16 验证1/14 文件1/14 生产管理2/20 质量管理3/21 产品销售与收回1/6 3/21 1/6 投诉与不良反应报告0/4 自检1/6 合计25/224
兽用生物制品gmp检查验收评定标准指南

兽用生物制品gmp检查验收评定标准指南下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!兽用生物制品GMP检查验收评定标准指南1. 介绍兽用生物制品GMP(Good Manufacturing Practice)检查验收评定标准指南对于兽药生产企业是非常重要的指导文件。
兽药GMP检查验收评定标准

兽药GMP检查验收评定标准一、兽药GMP检查验收评定规则1、根据《兽药生产质量管理规范》(以下简称兽药GMP)及其附录,制定兽药GMP检查验收评定标准。
2、兽药GMP检查验收项目共220项,其中关键项目(条款号前加“*”)47项,一般项目173项。
检查项目分布状况(关键项/检查项):机构与人员3/15;厂房与设施10/55;设备5/22;物料8/23;卫生0/19;验证3/10;文件1/11;生产管理12/35;质量管理5/17;产品销售与收回0/5;投诉与不良反应报告0/3;自检0/3。
3、在组织兽药GMP验收检查时,须以申请检查范围,按照兽药GMP检查验收项目,确定相应的检查范围和内容,其中条款前加“#”的为静态检查时不进行评定的条款。
4、现场检查时,应对所列项目及其涵盖内容进行全面检查,并逐项作出评定。
评定结果分为“N”、“Yˉ”和“Y”三档,凡属完整、齐全的项目,应判定为“Y”;凡属项目内容基本完整、齐全,但尚不够完善的项目,应判定为“Yˉ”;判定某项基本符合要求(如打分应在75分以上)的,打“Y”;判定某项存在一定缺陷(如打分应在75-50分之间)的,打“Yˉ”;判定某项缺陷严重(如打分应在50分以下)的,打“N”。
汇总时按照3个“Yˉ”相当于1个“N”和2个“Y”的原则核定。
通过百分率计算来评定是否符合GMP。
关键项目不合格的则称为严重缺陷;一般项目不合格的则称为一般缺陷。
一般缺陷项目或检查中发现的其它问题严重影响兽药质量则视同为严重缺陷,检察员对此应调查取证,详细记录。
5、非洁净区生产环境要求及卫生等参照洁净区管理标准。
6、静态检查验收应在完成主要生产设备、灭菌设备、工艺用水设施等性能确认试验验证及产品工艺验证等工作的基础上进行。
7、结果评定二、兽药GMP检查验收项目综合评定结果:涉及总条款条,其中涉及一般条款条,结果属于“Y”条,属于“Yˉ” 条,属于“N” 条,符合率为 %。
涉及关键条款条,结果属于“Y”条,属于“Yˉ” 条,属于“N” 条;符合率为 %。
兽药企业GMP检查验收结果公示表(第五至十二批)

改扩 建
改扩 茬
推 稃 为 G 台 格军 阿 2 0 肝 0 6年 1月 l 组 长 李钧 文 2 日至 1 l 月 3日 组 员 詹 述宣 、才绍 河 、 程 江
摊 稃 为 G 台 格 军 同 肝 2 0 年 1 8 日 组 长 I 李 钧 文 16 1 月
业有 限 公 司
蓖扩 建
组 员 :王 苏 华 、范 小平 、 丁在 亮
1 . 文 登 市 雨 泽 银 丰 动 物 粉 什 刑 、量 辫 灭 小 窨 量 注 射 刑 ,片 卉 / j 改 扩 建 3 玎辑 f 可
台 格 车 同 216 年 1 月 1 组 长 z 刘 同 民 1 0 1
新 戆 稚 稃为 叫
至 1月 9 日
推 稃 为 G 台 梧 军 阿 216军 1月 9 日 1 0
组 员 王 苏 华、 范 小平 、 丁在 亮
组 长 l刘 同民
1. 乳 山市 峨 母 化 工 有 限 渭 毒刑 ( 体 、援 体 ) 2 固
至 1月 l O日 教 扩 建
堆 秤 为 G 台 惜 军 同 2 0 年 1 月 l 组 长 l 事 饲 文 肝 16 1 1
限 公司 4 .
5 .
华 北制 药 集 团爱 谱 有 原 科 两 ( 罐l 阿 U奢 、伊罐 膂 鬃 ) 限公 司
河北 新 乐 车 方 动 钾 两 戢 刑 、扮 刑 / 掘剂 预
6 . 幂 萤 兀 愿 镁 鲥 粉 剂/ 刑/ 混荆 、消毒 剂 ( 体 ) 敢 预 液 业有 限 公 司 改扩 建
至 1月 9日
组 员 t 詹述 宣 、 才 绍河 、 穗 江
第
攥 稃 为 G 台格 车 同 2 0 o 6年 1月 l 组 长 一 事 钧文 0 日至 1月 1 组 员 詹述 宜 、 才 绍河 、程 江 1日
兽药GMP检查验收中的常见问题分析

中国兽药杂志2012,46(1):44 46/吴礼龙,等兽药GMP 检查验收中的常见问题分析吴礼龙,邓云波(湖南省兽药饲料监察所,长沙410006)[收稿日期]2011-08-29[文献标识码]A [文章编号]1002-1280(2012)01-0044-03[中图分类号]S851.66[摘要]兽药GMP 认证工作主要是对相关人员、硬件与软件三大要素和验证、规程与记录三项重点工作进行考核与检查。
其中,硬件是根本,软件是重点,人员是关键。
记录是实施GMP 认证的基础性工作,必须真实、详细;规程是兽药生产的规范性文件和行动指南,必须规范、合理,可操作性强;而验证则是GMP 检查验收工作的精髓和重中之重,各项规程及标准等都必须通过验证。
[关键词]兽药;GMP 认证;质量管理作者简介:吴礼龙,硕士研究生,研究员级高级工程师,现主要从事兽药、饲料及畜产品的检测与研究工作。
The Common Problems in GMP Inspection of Veterinary DrugsWU Li -long ,DENG Yun -bo(Hunan Province Institute of Veterinary Drug and Feed Control ,Changsha ,410006,China )Abstract :GMP inspection of Veterinary drugs mainly covers three principle points including personnel ,hardware and software ,and also three key work including validation ,protocols and records.hardware is fundamental ,software is important and personnel are critical among them.Various records are the fundamental work in GMP inspection.It must be true and detailed.Various protocols are standard documents and behavior guidance in manufacturing of veterinary drugs.The validation is the critical point of key works in GMP inspection.All protocols and standards must pass the validation.Key words :veterinary drugs ;GMP inspection ;quality control 兽药GMP 的核心就是兽药生产的质量管理,而兽药GMP 的检查验收工作即是围绕这一核心,对相关的人员、硬件与软件三个要素及各种验证、规程与记录三项重点工作进行重点考核、查检和验收。
兽药GMP检查验收指南

兽药GMP检查验收评定标准指南第一章机构与人员001 企业应建立生产和质量管理机构,各类机构设置应合理,岗位职责应明确。
1检查企业的组织机构图。
1.1组织机构图中应包括生产、质量、物料仓储、设备、销售及人员管理等相应部门,体现各部门的设置、相互关系,其中生产管理部门和质量管理部门应分别独立设置。
1.2组织机构图中应体现质量管理部门受企业负责人的直接领导。
1.3组织机构图中应明确各部门名称。
2检查部门职责,应责任明确,无交叉,无空白。
2.1制定了组织机构中涉及的各部门职责。
2.2各部门职责应明确,质量管理部门应有独立的权限,能对生产等部门执行GMP 进行监督和制约。
3检查岗位职责,应责任明确,无交叉,无空白。
3.1制定了企业负责人、主管生产管理的负责人、主管质量管理的负责人的岗位职责。
3.2制定了各部门负责人的职责。
3.3制定了其他各类人员的岗位职责。
002 管理人员和技术人员的专业知识和生产经验及其数量应与生产相适应。
1查看企业人员一览表。
基本内容应包括:姓名、职务、职称、学历、毕业院校、所学专业、专业年限、所在岗位、本岗位年限等。
2企业生产及质量管理相关中层干部的任命书。
3检查管理人员和技术人员的档案,包括学历、职称、各类培训证书和职业资格证书等相关材料,应符合相关规定。
4管理人员和技术人员均应为全职人员,查看相关人员的聘用合同,不得在其他企业兼职和挂名,其数量应与生产规模相适应。
003 企业主管生产和质量管理的负责人应具有兽医、药学等相关专业大专以上学历,并具有兽药生产、质量管理经验。
1检查企业主管生产和质量管理的负责人的毕业证书,相关专业包括药学、药理、兽医、制药、化学、化工、生物、中药、生化、水产等,含大专学历。
2企业负责人应具备4年以上兽医(药品)生产、质量管理的实践经验。
004 兽药生产管理部门的负责人和质量管理部门的负责人应具有兽医、药学等相关专业大专以上学历,有生产、质量管理经验。
兽药GMP检查验收评定标准

兽药GMP检查验收评定标准(生物制品)
一、兽药GMP检查验收评定标准说明
(一)本标准根据《兽药生产质量管理规范》(以下简称兽药GMP)及其附录制定。
(二)兽药GMP检查验收项目共224项,其中关键项目(条款号前加“*”)25项,一般项目199项。
检查项目分布状况(关键项/检查项):机构与人员3/14;厂房与设施7/62;设备1/22;物料5/25;卫生0/16;验证1/14;文件1/14;生产管理2/20;质量管理3/21;产品销售与收回1/6;投诉与不良反应报告0/4;自检1/6。
(三)在组织兽药GMP检查验收时,须根据申请验收的范围,按照兽药GMP检查验收项目确定相应的检查项目,并进行全面检查和评定。
(四)现场检查中发现不符合要求的项目统称为“缺陷项目”。
其中,关键项目不符合要求者称为“严重缺陷”,一般项目不符合要求者称为“一般缺陷”。
(五)在检查过程中,企业隐瞒有关情况或提供虚假材料的,按严重缺陷处理。
检查验收组应调查取证并详细记录。
(六)结果评定1.未发现严重缺陷,且一般缺陷≤20%的,现场做出“推荐”结论。
2.发现严重缺陷或一般缺陷>20%的,现场做出“不推荐”结论。
2015年新版兽药GMP生产质量管理规范检查验收规定

第一章总则第一条为规范兽药生产质量管理规范(以下简称“兽药GMP”)检查验收活动,根据《兽药管理条例》和《兽药生产质量管理规范》的规定,制定本办法。
兽药聚乙烯水剂瓶第二条农业部负责制定兽药GMP及其检查验收评定标准,负责全国兽药GMP检查验收工作的指导和监督,具体工作由农业部兽药GMP工作委员会办公室承担。
省级人民政府兽医主管部门负责本辖区兽药GMP检查验收申报资料的受理和审查、组织现场检查验收、省级兽药GMP检查员培训和管理及企业兽药GMP日常监管工作。
第二章申报与审查第三条新建、复验、原址改扩建、异地扩建和迁址重建企业应当提出兽药GMP检查验收申请。
复验企业应当在《兽药生产许可证》有效期届满6个月前提交申请。
第四条申请验收企业应当填报《兽药GMP检查验收申请表》(表1),并按以下要求报送申报资料(电子文档,但《兽药GMP检查验收申请表》及第4、5、8、14目资料还需提供书面材料)。
新建企业须提供第1至第13目资料;原址改扩建、复验、异地扩建和迁址重建企业须提供第1目至第17目资料,迁址重建企业还须提供迁址后试生产产品的第12、13目资料;中药提取企业须提供第18目资料。
1.企业概况;2.企业组织机构图(须注明各部门名称、负责人、职能及相互关系);3.企业负责人、部门负责人简历;专业技术人员及生产、检验、仓储等工作人员登记表(包括文化程度、学历、职称等),并标明所在部门及岗位;高、中、初级技术人员占全体员工的比例情况表;4.企业周边环境图、总平面布置图、仓储平面布置图、质量检验场所(含检验动物房)平面布置图及仪器设备布置图;5.生产车间(含生产动物房)概况及工艺布局平面图(包括更衣室、盥洗间、人流和物流通道、气闸等,人流、物流流向及空气洁净级别);空气净化系统的送风、回风、排风平面布置图;工艺设备平面布置图;6.生产的关键工序、主要设备、制水系统、空气净化系统及产品工艺验证情况;7.检验用计量器具(包括仪器仪表、量具、衡器等)校验情况;兽药塑料疫苗瓶B66-250ml8.申请验收前6个月内由空气净化检测资质单位出具的洁净室(区)检测报告;9.生产设备设施、检验仪器设备目录(需注明规格、型号、主要技术参数);10.所有兽药GMP文件目录、具体内容及与文件相对应的空白记录、凭证样张;11.兽药GMP运行情况报告;12.(拟)生产兽药类别、剂型及产品目录(每条生产线应当至少选择具有剂型代表性的2个品种作为试生产产品;少于2个品种或者属于特殊产品及原料药品的,可选择1个品种试生产,每个品种至少试生产3批);13.试生产兽药国家标准产品的工艺流程图、主要过程控制点和控制项目;14.《兽药生产许可证》和法定代表人授权书;15.企业自查情况和GMP实施情况;16.企业近3年产品质量情况,包括被抽检产品的品种与批次,不合格产品的品种与批次,被列为重点监控企业的情况或接受行政处罚的情况,以及整改实施情况与整改结果;17.已获批准生产的产品目录和产品生产、质量管理文件目录(包括产品批准文号批件、质量标准目录等);所生产品种的工艺流程图、主要过程控制点和控制项目;18.中药提取工艺方法和与提取工艺相应的厂房设施清单及各类文件、标准和操作规程。
34家兽药企业通过农业部GMP检查验收(5月4~6月9日)

新 建 夏 验
推荐为 G P ∞l M O年 {胄 音格 隼 阔 2 日蔓 2 日 4 5 捕霄为 G ∞l荤 4 O 月 禽格 草 闻 日至 2 日 7
组 长t紫 桂 跨 蛆虽 t王恩 青 何 苒撞 率亚 琳 蓐 缎 长 叶样 方 4 f 蛆 禺t 昧 尊毕 张 华 眦
I l 匕
盘
l 2
太 胃 懂 键源 劫 僳科 拉 升 发 糟 押 预 潲 , l l l 荆 瓣中 嚣 ( 扎 {{ 非 氯 漓辱 棚 ( 做 } 薄 l壹 骧体 )
有最公司
礤 宴荆 《 瓣俸)
畲括车阐
日至 日 组矗,邵德 骂搜
河 南 t 利来 生 勃率 披 有 I 耪 荆 馓 舯 顾 濯 捍 卅 荆 剂 、最终 荑 茁小 譬 置注射 耕 } 曩 I 颗较 口服溶 公 可 液 荆 、非 氯清 毒 抨 ( l 液体 ) 、非 茏西 厩料 嚣 ( 胺 厕 甲氧 疃睫 磺 I腋阐审氯嚼嚷钠,尼卡e嘛 盐髓环玛沙雇 乳酸环两沙震 . 豌扩建 I
861 97 61 52 08 0 8 20 0
强
3 4家兽药企业通过农业部 1 3 MP检查验收
( 5月 4 6 月 9 日)  ̄
嫡 企 业 名稚
哥
申请验 欹范 凰
验 收粪 翌 辕 收情 况 复 验 接榫为 G
验 收 日期 ∞l O年 {胃
验收专 霉 名 蕈 坦长娥 , I翥
推荐坶 G ∞l MP O年 4月 组 长 ;来秀 毒 宣格 车 闻 3 日至 2 日 4 5 组 最: 葶运 莲 碍 华兵 l }
8
四J 佳纛动物菇业有限蛰 l I 糟针莽 、耪荆激 捧 q k 曛漏荆、抟剂 t 耆孛萄疆职 )耨牧荆 ( 禽 谢 中菊提取 } 量缝灭西牛霉置注射荆 ( 含审嚣疆取 最鲣灭盛丈 歌扩建 霉量非狰赫洼射耕 c 台中药提取' 口服溶液劓 耆中药 毫 , 职)
兽药GMP检查验收评定标准

兽药GMP检查验收评定标准兽药GMP检查验收评定标准一、兽药GMP检查验收评定规则1、根据《兽药生产质量管理规范》(以下简称兽药GMP)及其附录,制定兽药GMP检查验收评定标准。
2、兽药GMP检查验收项目共220项,其中关键项目(条款号前加“*”)47项,一般项目173项。
检查项目分布状况(关键项/检查项):机构与人员3/15;厂房与设施10/55;设备5/22;物料8/23;卫生0/19;验证3/10;文件1/11;生产管理12/35;质量管理5/17;产品销售与收回0/5;投诉与不良反应报告0/3;自检0/3。
3、在组织兽药GMP验收检查时,须以申请检查范围,按照兽药GMP检查验收项目,确定相应的检查范围和内容,其中条款前加“#”的为静态检查时不进行评定的条款。
4、现场检查时,应对所列项目及其涵盖内容进行全面检查,并逐项作出评定。
评定结果分为“N”、“Yˉ”和“Y”三档,凡属完整、齐全的项目,应判定为“Y”;凡属项目内容基本完整、齐全,但尚不够完善的项目,应判定为“Yˉ”;判定某项基本符合要求(如打分应在75分以上)的,打“Y”;判定某项存在一定缺陷(如打分应在75-50分之间)的,打“Yˉ”;判定某项缺陷严重(如打分应在50分以下)的,打“N”。
汇总时按照3个“Yˉ”相当于1个“N”和2个“Y”的原则核定。
通过百分率计算来评定是否符合GMP。
关键项目不合格的则称为严重缺陷;一般项目不合格的则称为一般缺陷。
一般缺陷项目或检查中发现的其它问题严重影响兽药质量则视同为严重缺陷,检察员对此应调查取证,详细记录。
5、非洁净区生产环境要求及卫生等参照洁净区管理标准。
6、静态检查验收应在完成主要生产设备、灭菌设备、工艺用水设施等性能确认试验验证及产品工艺验证等工作的基础上进行。
37、结果评定4二、兽药GMP检查验收项目5678910111213141516171819202122232425262728293031323334353637384041424344454647484950。
兽药GMP检查验收材料(空白)

兽药GMP检查验收材料XXXX公司XXX年XX月XX日目录1.企业概况;2.企业组织机构图;3.企业负责人、部门负责人简历;专业技术人员及生产、检验、仓储等工作人员登记表(包括文化程度、学历、职称等),并标明所在部门及岗位;高、中、初级技术人员占全体员工的比例情况表;4.企业周边环境图、总平面布置图、仓储平面布置图、质量检验场所平面布置图及仪器设备布置图;5.生产车间概况及工艺布局平面图;空气净化系统的送风、回风、排风平面布置图;工艺设备平面布置图;6.生产的关键工序、主要设备、空调控温系统、检验仪器设备及产品工艺验证报告;7.检验用计量器具校验情况;8. 前6个月内洁净室(区)检测报告;9.生产设备设施、检验仪器设备目录;10.所有兽药GMP文件目录、具体内容及与文件相对应的空白记录、凭证样张;11.兽药GMP运行情况报告;12.生产兽药类别、剂型及产品目录;13.生产兽药国家标准产品的工艺流程图、主要过程控制点和控制项目;14.《兽药生产许可证》复印件和法定代表人授权书;15.企业自查情况和GMP实施情况;16.企业近3年产品质量情况,包括被抽检产品的品种与批次,不合格产品的品种与批次,被列为重点监控企业的情况或接受行政处罚的情况,以及整改实施情况与整改结果;17.已获批准生产的产品目录和产品生产、质量管理文件目录;所生产品种的工艺流程图、主要过程控制点和控制项目;18.中药提取工艺方法和与提取工艺相应的厂房设施清单及各类文件1.企业概况;2.企业组织机构图(须注明各部门名称、负责人、职能及相互关系);3.企业负责人、部门负责人简历;专业技术人员及生产、检验、仓储等工作人员登记表(包括文化程度、学历、职称等),并标明所在部门及岗位;高、中、初级技术人员占全体员工的比例情况表;4.企业周边环境图、总平面布置图、仓储平面布置图、质量检验场所平面布置图及仪器设备布置图;(书面材料)5.生产车间概况及工艺布局平面图(包括更衣室、盥洗间、人流和物流通道、气闸等,人流、物流流向及空气洁净级别);空气净化系统的送风、回风、排风平面布置图;工艺设备平面布置图;(书面材料)6.生产的关键工序、主要设备、空调控温系统、检验仪器设备及产品工艺验证报告;7.检验用计量器具(包括仪器仪表、量具、衡器等)校验情况;8. 前6个月内洁净室(区)检测报告;(书面材料)9.生产设备设施、检验仪器设备目录(需注明规格、型号、主要技术参数);10.所有兽药GMP文件目录、具体内容及与文件相对应的空白记录、凭证样张;11.兽药GMP运行情况报告;12.生产兽药类别、剂型及产品目录;(书面材料)13.生产兽药国家标准产品的工艺流程图、主要过程控制点和控制项目;14.《兽药生产许可证》复印件和法定代表人授权书;(书面材料)15.企业自查情况和GMP实施情况;16.企业近3年产品质量情况,包括被抽检产品的品种与批次,不合格产品的品种与批次,被列为重点监控企业的情况或接受行政处罚的情况,以及整改实施情况与整改结果;17.已获批准生产的产品目录和产品生产、质量管理文件目录(包括产品批准文号批件、质量标准目录等);所生产品种的工艺流程图、主要过程控制点和控制项目;18.中药提取工艺方法和与提取工艺相应的厂房设施清单及各类文件。
兽药GSP验收工作总结9篇

兽药GSP验收工作总结9篇第1篇示例:兽药GSP验收工作总结近年来,兽药行业的发展迅速,对兽药品质的要求也越来越高。
兽药GSP(Good Storage Practice)验收工作是确保兽药品质的重要环节之一。
本次总结旨在对兽药GSP验收工作进行回顾和分析,总结经验教训,提出改进建议,以期进一步提升兽药品质管理水平。
1. GSP验收内容全面。
在验收过程中,我们严格按照GSP验收标准,对兽药的生产日期、有效期、质量状态、环境条件等进行全面检查,确保兽药的存储符合标准要求。
2. 验收记录规范完善。
我们建立了健全的兽药GSP验收记录表格,对每批验收的兽药进行详细记录,包括兽药名称、规格、数量、生产日期、验收日期等信息,确保了验收记录的全面性和准确性。
3. 验收人员技能素质过硬。
我们注重对验收人员的培训和考核,提高其对GSP验收标准的理解和执行能力,确保验收工作的专业性和准确性。
1. 部分兽药存储条件不符合要求。
在实际验收中发现,部分兽药的存储条件未能符合GSP验收标准要求,存在温度、湿度不稳定等问题,影响了兽药的品质保障。
2. 验收记录不完善。
部分验收记录存在信息缺失或填写不规范的情况,影响了验收工作记录的准确性和可追溯性。
三、改进建议1. 加强兽药存储条件管理。
对兽药存储环境进行定期检查和评估,确保其符合GSP验收标准要求,加强温湿度监测,确保存储条件的稳定性。
2. 规范验收记录填写。
加强对验收人员的培训,提高其对验收记录填写规范性的认识和要求,建立完善的验收记录管理制度,确保验收记录的完整和准确。
四、结语第2篇示例:兽药GSP验收工作总结兽药GSP(Good Supply Practice)验收是兽药生产企业的重要环节之一,对于保障兽药质量、确保兽药安全和有效性具有重要意义。
本文将对兽药GSP验收工作进行总结和分析,以期提高兽药企业的管理水平和生产质量。
1.货物验收:包括兽药原料、包装材料等货物的验收工作,对货物的外观、数量、质量等方面进行检验,确保货物符合相关规定和标准。
兽药GMP检查验收项

生产管理
应制定工艺查证制度并组织实施。 应有防止物料及制品所产生的气体、蒸汽、 喷雾物或生物体等引起交叉污染的措施。 直接接触制品的包装材料、设备和其他物品 应按规定清洗、干燥、灭菌,对灭菌物品应 规定使用时限。 每一生产操作间或生产用设备、容器应有所 生产的制品或物料的名称、批号、数量等状 态标志。
验证
关键设备的验证应全面、合理。 应根据验证方案进行验证。 影响制品质量的主要因素发生变化或生产一 定周期后应进行再验证。 验证工作完成后应写出验证报告,由验证工 作负责人审核、批准。 验证文件归档应符合要求。
文件
应有完整的生产管理、质量管理文件和各类 管理制度、记录。 生产管理文件应包括生产工艺规程、岗位操 作法或标准操作规程、批生产记录等。 生产工艺规程内容应符合要求。 岗位操作法内容应符合要求。 标准操作规程内容应符合要求。 设计的批生产记录内容应符合要求。
生产管理
生产前应确认无上次生产遗留物。 不同品种的抗原(半成品)制备如用同一生 产线,其生产操作不得同时进行,应在一种 制品制备后,进行有效的清洁、消毒,并进 行验证。 有数条包装线同时包装时,应采取隔离或其 他有效防止混淆的设施。 生产过程中应按照工艺、质量控制要点进行 质量检测,并填写记录。
质量管理
质量管理部门应建立制品批检验记录制度, 批检验记录应符合要求。 质量管理部门应负责建立制品质量档案,质 量档案内容应符合要求。 质量管理部门应履行制订企业质量责任制和 质量管理及检验人员职责的职责。 质量管理部门应履行组织自检工作的职责。
质量管理
质量管理部门应履行审核验证方案的职责。 质量管理部门应履行制修订物料、半成品和 成品的内控标准和检验操作规程的职责。 质量管理部门应负责制定取样和留样观察制 度,内容应符合要求。 质量管理部门应负责制订检验用设施、设备、 仪器、试剂、试液、标准品(或对照品)、 滴定液、培养基、实验动物、消毒剂的使用 及管理办法。
兽药GSP验收工作总结8篇

兽药GSP验收工作总结8篇第1篇示例:近日,我单位完成了对兽药GSP验收工作的总结。
在过去的一段时间里,我们对兽药GSP进行了全面的检查和验收,以确保合格的产品能够正常投放到市场上。
通过此次验收工作,我们总结了一些经验和教训,希望可以对今后的工作提供借鉴。
在兽药GSP验收工作中,我们要高度重视对资料的准确性和完整性的核实。
在验收过程中,我们发现一些企业提供的资料存在不完整或者不准确的情况,这会给我们的工作带来一定的困难。
我们在接下来的工作中要更加严格地对企业提供的资料进行审核,确保其真实性和准确性。
我们要加强对企业生产环境和生产设备的考察。
在此次验收过程中,我们发现有些企业的生产环境不达标,生产设备存在一些安全隐患,这会影响到产品的质量和安全性。
我们要对企业的生产环境和设备进行更加细致的检查,确保其符合相关的标准和要求。
我们要积极引导企业加强自律和规范管理。
在兽药GSP验收工作中,我们要给予企业更多的指导和支持,帮助他们建立健全的管理体系,加强质量控制和安全管理,确保其产品的质量和安全性。
只有这样,我们才能更好地维护动物的健康和消费者的安全。
通过此次兽药GSP验收工作,我们取得了一定的成绩,但同时也发现了一些问题和不足。
我们要不断总结经验,吸取教训,不断提高自身的工作水平和素质,为兽药GSP的验收工作做出更大的贡献。
希望我们的工作能够取得更好的成绩,为动物的健康和安全保驾护航。
【字数已达要求,是否需要继续添加内容?】第2篇示例:兽药GSP验收工作是农业生产中非常重要的一环,它关乎着动物的健康和生产质量,对于保障农业生产的安全性和效率起着至关重要的作用。
在过去的一段时间里,我们一直致力于做好兽药GSP验收工作,通过这次总结,我们可以更好地反思过去的工作经验,总结经验教训,为今后的工作提供指导。
在兽药GSP验收工作中,我们严格按照相关的标准和规定进行操作,确保验收过程的规范和严谨。
我们对进货的兽药进行仔细检查,核对产品品名、生产日期、有效期、规格等信息,确保产品的质量达标。
兽药GSP检查验收申报材料完整版
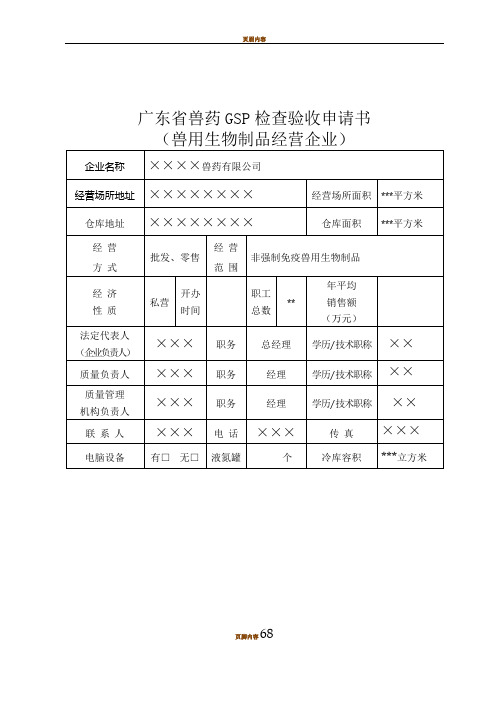
广东省兽药GSP检查验收申请书6868注:1. 经营方式系指连锁经营、批发经营、零售经营、批零兼营。
2. 经营范围系指兽用化学药品、中药制剂、外用杀虫剂、消毒剂、原料药、生化药品、中药材(中药饮片)、特殊药品(兽用麻醉药品、精神药品、易制毒化学药品、毒性药品、放射性药品),以及兽用生物制品等。
3. 经济性质系指国有企业、外资企业、私营企业、个人独资企业。
4. 企业所属非法人分支机构的,应另表说明。
68企业人员情况一览表填报单位:填报日期:注:1.填报本表时,请将学历证书及专业技术职称证书的复印件附后。
2.质量负责人、质量管理人员、验收人员、养护人员等应在职务/岗位一栏中注明。
3. 质量管理人员参加县级以上兽医行政管理部门的培训、考核情况应在备注栏中注明。
68企业经营设施、设备情况表填报单位:填报日期:说明:1.根据企业设施、设备的实际填写。
如无栏目所设项目,应注明“无”。
2. 表中所有面积均为建筑面积,单位为平方米,冷库单位为立方米。
3.“营业场所及辅助、办公用房”栏目中“辅助用房”指库区中服务性或劳保用房。
68企业所属非法人分支机构情况表填报单位:填报日期:68兽药GSP现场验收报告68兽药GSP认证自查报告一、企业概况二、管理职责三、人员与培训四、设施和设备五、进货与验收六、陈列与储存七、销售与服务八、存在问题及改进措施:××市××兽药有限公司组织机构图68××市××兽药有限公司质量管理机构图为确保企业所经营生物制品质量,保证消费者使用安全,根据《广东省兽药经营质量管理规范》、《兽药管理条例》要求,决定设立专职质量管理员,具体负责本企业的质量管理工作,在企业内部对生物制品质量进行裁决,对企业经营的生物制品质量具有一票否决权。
主要职责是:一、贯彻执行有关的生物制品质量管理的法律、法规和行政规章。
68二、起草企业生物制品质量管理制度,并指导、督促制度的执行。
【优质】兽药检验报告-范文word版 (15页)

本文部分内容来自网络整理,本司不为其真实性负责,如有异议或侵权请及时联系,本司将立即删除!== 本文为word格式,下载后可方便编辑和修改! ==兽药检验报告篇一:兽药GMP整改报告表8 兽药gmp整改情况核查表篇二:13.兽药gmp运行情况报告1兽药gmp运行情况报告129 ☆申报资料13gmp运行情况一、机构与人员我公司严格按照《兽药生产质量管理规范》的要求,组织机构健全,设立了gmp办公室、综合部、生产部、质保部、供应部、销售部、财务部。
规范了生产和质量管理机构,各部门聘用了一批优秀的人才作为管理人员和技术人员。
管理人员和技术人员均为大中专以上学历,具备了一定的专业知识、组织和管理能力。
公司现有在职职工44人,其中大中专以上学历的管理、技术人员共有18人,占职工总人数的41%。
质保部工作人员共7人,全部为相关专业大专以上学历,4人持有河南省兽药监察所核准颁发的兽药行业质检人员上岗证。
分设了质量检验和质量监督人员,能够保证生产现场的质量监督和兽药质量检验。
生产和质量的部门负责人互不兼任。
公司全体员工均受到严格的gmp系统知识培训和相关的知识和技能考核,生产的直接岗位人员均为高中或中专学历,其他部门工作人员全部为大中专以上学历,人员素质和培训情况能够达到gmp要求。
二、厂房与设施公司生产厂区位于郑州市与荥阳市的交界处——中原区须水镇,地处郊区环境优美,空气清新。
生产厂房严格按照gmp要求规范设计,布局合理。
生产区、仓储区、行政区、辅助区分开,互不干扰,厂区内道路通畅,地面平整,绿地面积达到65%,按照gmp的要求进行绿化。
工厂周围无杂草、垃圾、积水和蚊蝇滋生地,有独立的供水供电等公用系统,有防止昆虫和动物进入厂房的设施。
公司gmp生产车间为粉剂、散剂、预混剂、颗粒剂车间,建筑面积为461 m2,为单层钢架混凝土框架结构,车间彩钢板吊顶高2.7m,采用了彩钢板隔断和围护。
仓储2区使用面积1074 m(分别为成品库279m2, 原辅料包材库576m2,中药材仓库177m2,,阴凉库20㎡,危险品库22㎡)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
药政处
截止今年9月的统计
共有72家企业或其部分车间 共有72家企业或其部分车间 通过兽药GMP验收。 通过兽药GMP验收。 其中71家企业的 其中71家企业的 76个GMP证书 76个GMP证书 在有效期内。
2000年之前通过验收的企业
序号
1 2 3 4 5 6 7 8 9
加快增长的原因
政策推动 示范作用 观念转变
兽药GMP企业地区分布
14 12 12 11
10 8 8 6 6 5 6 5
4
3
3 2 2 1 1 1 1 2
2
1
1
0 北京 天津 上海 重庆 山东 四川 广东 浙江 江苏 河南 河北 黑龙江 福建 内蒙古 甘肃 陕西 广西 山西
目前18个省有GMP企业
批准时间
1997年 1997年 2月 1997年10月 1997年10月 1998年 1998年 3月 1998年 1998年 3月 1998年 1998年 2000年11月 2000年11月 2000年11月 2000年11月 2000年11月 2000年11月 2000年11月 2000年11月 2000年11月 2000年11月
验收范围
企 业 片剂车间 企 业 生物制品企业 企 业 企 业 片剂车间 企 业 企 业 企 业
批准时间
2001年 2001年 1月 2001年 2001年 3月 2001年10月 2001年10月 2001年 2001年 7月 2001年 2001年 9月 2001年 2001年 9月 2001年 2001年 9月 2001年10月 2001年10月 2001年10月 2001年10月 2001年10月 2001年10月
2003年通过验收的企业
序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 *中牧股份南京药械厂 *内蒙生药厂 北京立时达药业有限公司粉针、注射液车间 江苏大丰华曙药业有限公司 上海龙园赛鸽制药有限公司 北京康牧兽医药械中心制药厂 *中牧股份兰州生药厂 瑞普(天津)动物药业有限公司 浙江国邦兽药有限公司原料药车间 哈尔滨亨通开发实业总公司兽药厂粉针车间 四川维尔康动物药业有限公司 四川广汉正大饲料科技有限公司粉剂、消毒剂车间 哈尔滨市和平兽药厂粉针车间 重庆兽药厂粉针车间 山东圣地宝摇业有限公司粉针、注射液、粉剂车间 四川自贡倍乐瑞克动物药业有限公司 *北京中海动物保健有限公司冻干疫苗车间 *国家动物疫病诊断液制备中心生物制品车间 河北奥菲动物药业有限公司 山东信得药业有限公司注射液、粉剂车间 河北远征药业有限公司(复验)粉针剂车间 山东维坊华辰生物科技有限公司注射液、粉剂车间 企 业 名 称 序号 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 企 业 名 称 四川隆昌华蜀动物药业有限公司注射液、口服液车间 河南濮阳泓天威药业有限公司(复验) 广州和生堂动物药业有限公司 广州拓普思动物药业有限公司 信宜市丽珠动物药业有限公司 南海市东方澳龙制药有限公司 普强苏州动物保健品有限公司(复验) 浙江康裕制药有限公司原料药车间 浙江升华拜克生物股份有限公司注射液车间 宁波市激素制品有限公司无菌冻干粉车间 西安亨通光华制药有限公司原料药车间 江苏润康药业有限公司粉针、注射液车间 广东溢多利生物科技股份有限公司中药粉剂、颗粒剂车间 北京日泰兽药有限公司粉剂车间 江苏牧王药业有限公司消毒剂车间 *肇庆大华农生物制品有限公司 驻马店天河动物药业有限公司注射液、粉针剂车间 郑州广牧动物药品有限公司 广西中和兽药厂 太原市恒丰强生物技术发展有限公司 长治市强大动物药业有限公司 北京万宁畜药研制开发有限公司注射液车间
2001年通过验收的企业
序号
1 2 3 4 5 6 7 8 9
企业名称
四川精华动物药业有限公司 成都乾坤动物药业有限公司 *梅里亚(南京)动物保健有限公司 福建蒲城正大生化有限公司 江苏牧王药业有限公司 山东齐鲁动物保健品厂 拜耳(四川)动物保健有限公司 成都维尔京药业有限公司(元亨) 四川鼎尖动物药业有限公司
全国兽药企业GMP达标率为2.7%
3% 97%
企业总数 通过验收数
全国生物制品企业GMP达标率
(有10家生物制品企业通过验收)
20%
80%
企业名称
上海诺华畜禽保健品公司 普强苏州动物保健品有限公司 河南濮阳泓天威药业有限公司 *黑龙江化血研生物技术有限公司 河北远征药业有限公司 山东鲁西兽药股份有限公司 山东齐鲁动物保健品厂 山东鲁抗舍里乐药业股份公司 华北制药集团爱诺有限公司
验收范围
企 业 企 业 企 业 生物制品企业 粉针剂车间 注射液车间 预混剂车间 注射液车间 原料药车间 企 业
兽药GMP企业年度递增表
80 70 60 50 当年数 累计数 40 30 20 10 0 9 9 9 2001年 2001 年 2002年 2002 年 2003年 2003 年 17 16 32 44 72
2000年之前 2000 年之前
通过验收的企业数以每年翻番 的速度增长
2001年验收数相当于2000年以前的总和 2001年验收数相当于2000年以前的总和 2002年比2001年验收数增长了78% 2002年比2001年验收数增长了78% 2003年 月止比2002年增长了175% 2003年9月止比2002年增长了175%
2002年通过验收的企业
序号
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
企业名称
上海申亚动物保健有限公司 山东济南古塔兽药有限公司 *四川华西动物药业有限公司 上海诺华动物保健有限பைடு நூலகம்司 北京锦绣大地风华兽药有限公司 四川齐全动物药业有限公司 浙江海翔医药化工有限公司 *四川世红生物技术有限公司 广东省海康兽药有限公司 广东燕塘兽药有限公司 山东济宁医化(集团)有限公司济宁兽药厂 山东齐鲁制药厂平阴分厂 山东圣旺药业股份有限公司 内蒙华蒙金河实业有限公司 河南商丘市森澳达动物药业有限公司 河南驻马店华中正大有限公司
2000年之前上海、江苏、河南、黑龙江、 2000年之前上海、江苏、河南、黑龙江、 河北、山东6省区有GMP企业 河北、山东6省区有GMP企业 2001年增加了四川、福建两省 2001年增加了四川、福建两省 2002年增加了北京、浙江、广东、内蒙 2002年增加了北京、浙江、广东、内蒙 古4省区 2003年甘肃、天津、重庆、陕西、山西、 2003年甘肃、天津、重庆、陕西、山西、 广西等6 广西等6省区实现了零的突破。
验收范围
企 业 大输液、注射液车间 生物制品企业 企业企业-复验 企 业 企 业 企 业 生物制品企业 注射液车间 注射液、粉针、粉剂 企 业 原料药车间 粉针剂车间 企 业 企 业 企 业
批准时间
2002年 2002年 1月 2002年 2002年 1月 2002年 2002年 1月 2002年 2002年 3月 2002年 2002年 7月 2002年 2002年 7月 2002年 2002年 7月 2002年11月 2002年11月 2002年11月 2002年11月 2002年11月 2002年11月 2002年11月 2002年11月 2002年11月 2002年11月 2002年11月 2002年11月 2002年11月 2002年11月 2002年11月 2002年11月 2002年11月 2002年11月
