原料药生产管理的GMP检查
GMP自检报告范文

GMP自检报告范文GMP(Good Manufacturing Practices)是指良好的生产规范,是一种确保药品制造过程安全、有效和质量可控的国际标准。
作为药品生产企业,自我检查对GMP制度的实施非常重要。
下面是一份GMP自检报告,内容详细,适合有一定基础知识的读者阅读。
一、制度和组织1.公司是否建立了符合GMP要求的质量管理体系,包括制定文件、程序和文件管理等,并进行了有效的实施?2.各个部门是否明确了质量管理的职责,并建立了相应的岗位责任制?二、原辅料管理1.是否有完善的原辅料采购程序,包括原辅料供应商的选择、评估和批准?2.原辅料的接收、检验和贮存是否符合要求,并建立了相应的记录?三、生产管理1.生产设备和设施是否符合GMP要求,并定期进行维护、保养和校准?2.是否建立了生产工艺流程,并确保生产过程的控制和记录?四、质量控制1.是否建立了标准化的质量控制实验室,并配备了合格的检验设备和仪器?2.是否建立了有效的样品管理制度,确保样品的准确性和可追溯性?五、药品质量记录1.是否建立了完善的药品质量记录,包括原辅料检验记录、生产记录和质量控制记录?2.药品质量记录是否符合GMP要求,并进行了适当的保存和管理?六、不良事件和产品召回1.是否建立了报告和处理不良事件的程序,包括不良事件的记录、调查和纠正措施?2.是否建立了产品召回制度,并进行了有效的实施?七、员工培训和资质管理1.是否建立了员工培训制度,包括培训计划、培训记录和培训评估?2.是否建立了员工的资质管理制度,包括职业资格的评估和持证上岗要求?八、环境管理和清洁消毒1.是否建立了清洁消毒制度,并建立了相应的清洁消毒记录?2.是否建立了废弃物管理制度,保证废弃物的安全处理?九、持续改善1.公司是否进行了定期的内部审核,发现问题并采取纠正和改进措施?2.是否建立了持续改进的机制,包括质量事故的分析和改进?十、外部审核1.公司是否接受了外部的GMP审核,有无被发现重大问题?2.是否按时完成了上一次外部审核的整改和改进要求?此次自检报告覆盖了GMP制度的各个方面和环节,对公司的质量管理体系进行了全面的检查和自我评估。
原料药生产的GMP问题

分 )。2)生产 的 原 理 和制 剂 不 同 ,大 多数 都 通 过 化 学 反应 、生 物 反应 多 的 成 分 ,制 剂 出现 质 量 问 题 后 往 往 很 难 检 查 到原 料 药 的 质 量 情
和 提 取 过 程 ,这 给生 产带 来难 度 ,不 同原 料 、不 同 人 员 经 常 出 现 不 况 。原 料 药 的 生 产 工 艺 极 为 复 杂 ,工 艺 对 产 品质 量影 响极 大 ,因而
纯化 和 精 制 包 装
注 :“
”表 示GMP适 用的 起 始 步 骤 。
…
作 为指 南 .这 很 不 具 体 ,很 难 把 握 ,包 括 FDA的 有 关 指 南 也 没 有 明确 定 义 但 FDA在处 理 具 体 问 题 时一 般 分 两 种情 况 :1)起 始 原 料 为原 料 药 .一 定 把 该 原料 药 作 为 起 始原 料 。如 克林 霉 素 磷 酸 酯虽 然 由林 可 霉 素 经 过 七 八 步 反 应 生 成 ,但 由于 林 可 霉 素 是 原 料 药 , 所 以 一 定 把 林 可 霉 素 作 为 起 始 原 料 .也 就 是 林 可 霉 素 一 定 符 合 GMP要 求 。2)起 始 原 料 为 非原 料 药 ,如 结 构 和 最终 产 品结 构 差 异 大 (对 最 终 产 品质 量 影 响 不 大 ),又 是 市场 化 商 品 (至 少 两 家 以 上 ),可 以作 为起 始 原 料 。对 于结 构 相 似 或 者 只有 一 步 反 应 (哪 怕 是 结 晶 ), 也 可 购买 作 为 起 始 原 料 .但 必 须 按 照 DMF文 件 工 艺 ,并 要 将供 应 商 的详 细 质 量 和 生 产 信 息 作 为DMF的 附 件 报 FDA,FDA也 需 要 检 查 . 但 到 目前 FDA只查 过 一 家 。 3.2 批 和 混批 问题
原料药生产用设备验证gmp指南

原料药生产用设备验证gmp指南下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!原料药生产用设备验证GMP指南在原料药生产过程中,设备的验证是非常重要的一环。
原料药FDA现场GMP符合性要求与检查实践-精品文档

• • • • • FDA的国外检查 FDA对原料药检查的依据 FDA检查方式 FDA的系统检查法 FDA检查重点及检查实践
1
FDA的国外检查
1955年开始进行第一次国外检查(抗生素)。 1961年国外检查达13 次,以后继续增加。 1971年成倍增加, 达到80 次。 此后,在整个70 年代里不断增加。到了80年代 及至90年代初,达到了每年检查160次之多。 1993年FDA计划要进行340次检查 2000年进行了48次检查,批准了28项。在不批准 的项目中有14个是问题很大的。发出了11封警告 信(2019年发出了9封)。 从1981年起, FDA先后派了一些检查官来我国检查一 些申报原料药的药厂。 截至2019年10月,我国原料药获得美国FDA的DMF II文件登记号为213项,涉及产品150余种,文件持 有者达100余家.
OOS调查 4% 设备确认 4% 工艺验证 4% 质量系统 5% 原料控制 5% 生产工艺 稳定性研究 7% 6% 实验室记录 7% 其它 19% 实验室控制 14% 各种SOPs不 足 9% 生产批记录 9% 设备清洗 7%
14
2019年API生产商CGMP检查存在的缺陷
工艺验证 4% 分析方法 4% 水系统 4% 环境控制 4% 设备确认 6% 其它 20% 实验室控制 13% OOS调查 10% 实验室记录 8% 各种SOPs不 足 生产工艺控制 8% 设备清洗 生产记录 7% 6% 6%
2
FDA对国外API检查
天然原料药 NEC 7% 发酵非无菌 化学合成 6% 无菌 2% 生物技术 原料药 1% 化学合成非无 菌 81% 天然原料药NEC 生物技术原料药 发酵非无菌 其它 其它 3%
化学合成 无菌 化学合成非无菌
药品GMP检查指南原料药(新版)

药品GMP认证(原料药)检查评定标准一、药品GMP认证(原料药)检查项目共172项,其中关键项目(条款号前加“*”)47项,一般项目125项。
二、药品GMP认证(原料药)检查时,应根据申请认证的范围确定相应的检查项目,并进行全面检查和评定。
三、检查中发现不符合要求的项目统称为“缺陷项目”。
其中,关键项目不符合要求者称为“严重缺陷”,一般项目不符合要求者称为“一般缺陷”。
四、缺陷项目如果在申-请认证的各剂型或产品中均存在,应按剂型或产品分别计算。
五、在检查过程中,企业隐瞒有关情况或提供虚假材料的,按严重缺陷处理。
检查组应调查取证并详细记录。
六、结果评定(一)未发现严重缺陷,且一般缺陷≤20%,能够立即改正的,企业必须立即改正;不能立即改正的,企业必须提供缺陷整改报告及整改计划,方可通过药品GMP认证。
严重缺陷或一般缺陷>20%的,不予通过药品GMP认证。
一、机构与人员*0301 企业应建立药品生产和质量管理机构,明确各级机构和人员的职责。
看企业组织机构图,查生产质量管理组织机构及功能设置(图示),是否涵盖生产、质量、物料仓储、设备、销售及人员管理等内容,并有负责培训的职能部门/人员。
1.有企业的组织机构图。
1.1组织机构图中体现企业各部门的设置、隶属关系及各部门之间的关系,其中生产和质量管理部门分别独立设置。
1.2组织机构图中体现质量管理部门受企业负责人直接领导。
1.3组织机构图中明确各部门名称及部门负责人。
2.岗位职责。
2.1制定了各级领导的岗位职责。
2.2制定了各部门及负责人的职责,特别是质量管理部门有独立的权限,并能对生产等部门执行《药品生产质量管理规范》进行临督和制约。
2.3制定了各岗位的岗位职责。
2.4岗位职责的制定能体现GMP的所有规定,权力、责任明确,且无交叉,无空白。
0302 企业应配备一定数量的与药品生产相适应的具有相应的专业知识、生产经验及工作能力,应能正确履行其职责的管理人员和技术人员。
关于原料药供应商审计的GMP要求

关于原料药供应商审计的GMP要求1.1 提供质量保证体系图1.2 质量管理部门是否独立于其他的部门?1.3 质量管理部门是否配备足够的人员负责相应的工作?1.4关键人员的情况以及负责产品放行人员姓名,如有变更是否及时告知?1.5 技术人员和质量管理人员比例1.6 接触产品人员是否具有健康档案?1.7 是否制订企业年度培训计划,是否落实培训计划?2.1 生产环境2.1.1 厂房所处的环境是否易造成对物料或产品的污染?2.1.2 厂区是否整洁?2.1.3 厂房布局是否合理?是否能防止交叉污染?2.1.4 厂房的洁净级别是否符合制剂生产要求?2.2 是否采取必要的防虫鼠措施?2.3 提供关键生产设备及检验仪器一览表。
2.4 是否为专用车间,如不是,列出其它产品名录?2.5 企业的生产能力是否满足供货需求?2.6 是否对厂房设施、设备按规定进行维护保养?2.7 是否进行了空调净化系统、工艺用水系统及关键设备的相关验证?4. 生产管理4.1 提供生产工艺流程图4.2 批的划分原则,批号的管理是否有可追溯性?4.3 批的划分是否符合规定?批量为___________4.4混批的控制是否符合要求?4.5生产量和供货量是否匹配4.6是否建立书面的清场、清洁及消毒SOP,执行是否有记录?4.7是否有相应的SOP控制不合格品?抽查落实情况4.8溶剂或母液的回收是否建立了相应的质量标准?5.1 查看质量标准和检验方法,提供成品质量标准作为审计报告附件。
5.2 成品是否按质量标准实施全项检验?5.3 检验能力考评,抽查检验报告及原始记录5.4 是否保存用户反馈、投诉记录及处理情况?5.5 是否建立OOS控制的SOP?抽查落实情况。
5.6 是否有委托检验,如有,是否得到有效控制?5.7 是否对杂质(有机杂质、无机杂质和残留溶剂等)进行了有效控制?5.8 是否建立退货产品处理的SOP,并严格执行?5.9 是否建立不合格产品处理的SOP,并严格执行?5.10 成品放行是否得到有效控制?5.11 是否定期自检?自检的频率为_______5.12 留样及稳定性实验是否符合规定?5.13 外包材生产企业的审计是否有印刷模版的控制及清场的管理?5.14 内包材企业的检验能力是否与其质量标准相匹配?。
原料药生产管理的GMP检查PPT

03
GMP检查内容
人员和组织
人员资质
确保所有参与原料药生产的人员 具备相应的资质和培训,符合岗 位任职要求。
组织架构
检查企业是否建立了完善的组织 架构,各部门职责明确,协作顺 畅。
厂房和设施
厂房布局
合理规划厂房布局,确保生产、存储、辅助区域等功能划分 明确。
设施配备
根据生产需求,配备相应的设施,如空调、通风、照明等。
产品质量得到显著提升,客户反馈良好,企业声誉得到提升。同时,企业生产效率和成本控制也得到 了优化。
THANK YOU
感谢聆听
04
GMP检查方法
现场检查
现场检查是GMP检查的重要环节,主要对原料药的制造、加 工、包装、标签、储存等环节进行实地查看,确保生产环境 、设备、操作人员等符合GMP要求。
检查内容包括生产车间的布局、设备设施的维护保养、生产 过程的控制、清洁卫生等,以及操作人员的培训和行为规范 等方面。
文件检查
原料药生产管理的GMP检查
目
CONTENCT
录
• GMP简介 • 原料药生产流程 • GMP检查内容 • GMP检查方法 • GMP检查的注意事项 • GMP检查案例分析
01
GMP简介
GMP的定义
总结词
GMP是药品生产质量管理的基本准则,它是一套适用于制药、食 品和其他健康相关产品的生产和质量管理的体系。
确保有足够的人员配合检查工作,包括生产 人员、质量管理人员等。
检查过程中的注意事项
真实反映情况
在检查过程中,要真实、客观地反映原 料药生产的实际情况,不要隐瞒或虚假
陈述。
尊重检查人员
尊重检查人员的权威和专业性,不要 对检查人员的工作进行干扰或质疑。
新版gmp自检报告

新版gmp自检报告自检单位:XXX公司检测时间:2022年5月15日一、概述GMP(Good Manufacturing Practice)是一种质量管理体系,旨在确保药品、食品、化妆品等相关行业的制造过程符合相关法规和标准,以保证产品的质量、安全和有效性。
为了加强质量管理,我公司进行了自检,并制定了该报告。
二、检测内容1. 原材料采购:检查原材料的合规性、供应商的资质及审核程序。
2. 生产设备:检查生产设备的完好性、操作规范、维护保养情况。
3. 生产过程控制:检查产品生产过程中的关键控制点、记录、检测等。
4. 清洁和卫生措施:检查生产区域的清洁状况、卫生管理和消毒程序。
5. 质量控制体系:检查质量控制体系的完善性、合规性及实施情况。
6. 文档管理:检查GMP相关文档的编制、更新及管理情况。
三、自检过程及结果1. 原材料采购自检过程:核对供应商的资质文件,比对采购记录和实际收货情况。
自检结果:供应商资质符合要求,采购记录与实际收货一致。
2. 生产设备自检过程:检查设备运行情况,确认操作手册是否有效执行。
自检结果:生产设备完好,操作手册有效执行。
3. 生产过程控制自检过程:监测关键控制点温度、湿度、压力等参数,记录检测结果。
自检结果:关键控制点参数在合理范围内,检测结果记录完整。
4. 清洁和卫生措施自检过程:检查生产区域的清洁状况,核对卫生管理和消毒计划。
自检结果:生产区域清洁有序,卫生管理和消毒计划执行到位。
5. 质量控制体系自检过程:审核质量控制体系文件,核对实施情况与记录。
自检结果:质量控制体系文件齐全,实施情况和记录符合要求。
6. 文档管理自检过程:检查GMP相关文档的编制、更新和文件存储情况。
自检结果:GMP相关文档编制规范,更新及存储管理有序。
四、改进措施基于自检的结果和评估,我司将采取以下改进措施:1. 加强供应商管理,确保采购原材料的合规性和稳定性。
2. 定期维护保养生产设备,确保其性能和操作的正常。
原料药GMP检查细则

药品GMP检查指南原料药国家食品药品监督管理局药品安全监管司国家食品药品监督管理局药品认证管理中心各药品生产企业:随着GMP认证工作的进一步推进,为了保证药品GMP认证工作的公正、公开、公平,规范和指导实施GMP认证工作。
国家食品药品监督管理局药品安全监管司和国家食品药品监督管理局药品认证管理中心组织编写了《药品GMP检查指南》,该指南分为法律法规、通则、中药饮片、中药制剂、原料药、医用氧、生物制品等部分共4本书。
该指南中的GMP认证检查评定标准已作了修订,由原来的225项增加到235项,其中关键项目从56项增加到58项(1801、6802),一般项目从169项增加到177项。
该指南将作为今后药品监督管理部门及GMP认证检查员监督检查的依据。
国家食品药品监督管理局药品认证管理中心要求由省局统一征订。
海南省食品药品监督管理局委托我中心具体承办该指南征订工作。
请各药品生产企业于2004年3月25日前务必将购书回执传真到培训中心。
该指南每套220元(含邮寄费)。
地址:海口白龙南路48号(省科技活动中心)B座503、504室。
一、机构与人员*0301 企业是否建立药品生产和质量管理机构,明确各级机构和人员的职责。
看企业组织机构图,查生产质量管理组织机构及功能设置(图示),是否涵盖生产、质量、物料仓储、设备、销售及人员管理等内容,并有负责培训的职能部门/人员。
1. 查企业分管生产及质量的负责人、生产及质量管理中层干部基本情况,内容包括:姓名、职务、职称、学历、毕业院校、所学专业、从事制药行业年限、所在岗位等。
2. 独立的质量管理部门的主要职责不得委派给他人。
以文件形式规定的质量管理部门的职责通常包括(但不一定局限于)以下各项:2.1 所有原料药的放行和否决,外销的中间体的放行和否决;2.2 建立原材料、中间体、包装材料和标签的放行或拒收系统;2.3 在决定原料药放行前,审核已完成关键步骤的批生产记录和实验室控制记录;2.4 确保各种重大偏差已进行调查并已解决;2.5 批准所有的质量标准和工艺规程;2.6 批准所有与原料药或中间体质量相关的各种规程;2.7 确保进行内部审计(自检);2.8 批准中间体和原料药的委托生产单位;2.9 批准对中间体或原料药质量可能造成影响的各种变更;2.10 审核并批准验证方案和报告;2.11 确保对质量相关的投诉进行调查并给予适当处理;2.12 确保确立有效的体系,用于关键设备的维护、保养和校准;2.13 确保物料都经过适当的检测并有测试报告;2.14 确保有稳定性数据支持中间体或原料药的复验期或有效期及储存条件;2.15 对产品质量情况进行回顾及审核(ICH标准)。
gmp检查报告

gmp检查报告一、概述根据要求,我们对公司的生产工艺、设备、操作规范以及质量管理体系进行了GMP(Good Manufacturing Practice,良好生产规范)检查。
本报告旨在详细总结我们的检查过程、发现的问题以及建议的改进措施。
二、生产工艺1.检查目的我们对公司的生产工艺进行了全面检查,以确保其符合GMP的要求,并确保产品的质量和安全性。
2.检查结果经过仔细的观察和分析,我们发现以下问题:(1)生产场所的清洁程度不达标,存在一些杂乱和污秽的区域;(2)某些工艺步骤的操作规范不够明确,导致作业人员产生误操作的风险;(3)某些生产设备的状态不佳,存在一些损坏或未及时维护的情况。
3.改进建议针对以上问题,我们建议采取以下改进措施:(1)加强生产场所的清洁管理,定期进行彻底清洁,并设立相应的日常清洁和消毒制度;(2)对操作规范进行修订和完善,明确每个工艺步骤的具体要求,并进行培训,确保作业人员的操作准确性;(3)加强设备维护管理,建立定期保养和维修制度,及时修复或更换损坏的设备。
三、质量控制1.检查目的我们对公司的质量控制流程和记录进行了检查,以确保合格产品的生产,并保证质量符合GMP的要求。
2.检查结果经过仔细核查,我们发现以下问题:(1)质量控制过程文件不完善,一些关键环节缺乏明确的操作指南;(2)检验记录不准确或缺失,无法及时追溯产品质量问题;(3)培训记录不完备,作业人员在质量控制上存在一定的知识盲区。
3.改进建议为了解决上述问题,我们建议采取以下改进措施:(1)更新和修订质量控制过程文件,确保每个关键环节都有相应的操作指南;(2)加强检验记录的管理,建立规范的记录流程,确保记录的准确性和完整性;(3)加强培训计划,针对不同岗位的作业人员,开展相关的质量控制培训,提高其工作技能和知识水平。
四、总结通过本次GMP检查,我们发现了一些问题,并提出了相应的改进建议。
我们希望公司能够重视这些问题,并根据建议采取积极有效的改进措施,以提高生产工艺和质量控制的水平,确保生产的产品符合GMP要求,并满足市场和客户的需求。
某省原料药GMP检查要点(
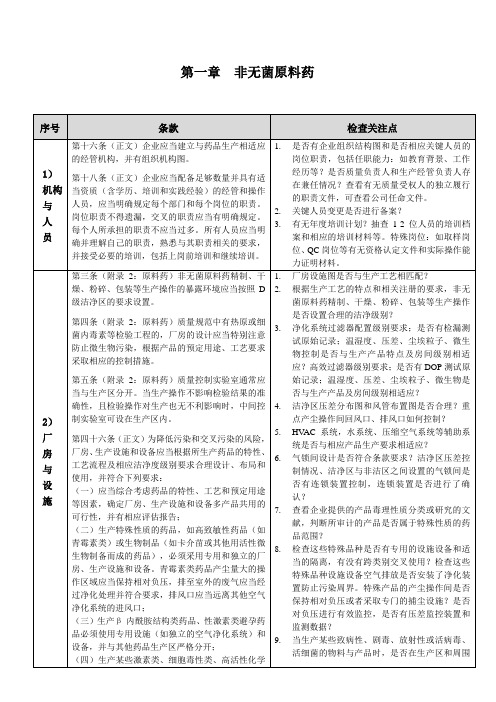
2.
3.关键人员变更是否进行备案?
4.
5.有无年度培训计划?抽查1-2位人员的培训档案和相应的培训材料等。特殊岗位:如取样岗位、QC岗位等有无资格认定文件和实际操作能力证明材料。
物料和产品的处理应当按照操作规程或工艺规程执行,并有记录。
第一百零四条(正文)物料供应商的确定及变更应当进行质量评估,并经质量经管部门批准后方可采购。
第一百零八条(正文)物料和产品应当根据其性质有序分批贮存和周转,发放及发运应当符合先进先出和近效期先出的原则。
第十二条(附录2:原料药)进厂物料应当有正确标识,经取样(或检验合格)后,可与现有的库存(如储槽中的溶剂或物料)混合,经放行后混合物料方可使用。应当有防止将物料错放到现有库存中的操作规程。
2)
厂
房
与
设
施
第三条(附录2:原料药)非无菌原料药精制、干燥、粉碎、包装等生产操作的暴露环境应当按照D级洁净区的要求设置。
第四条(附录2:原料药)质量规范中有热原或细菌内毒素等检验工程的,厂房的设计应当特别注意防止微生物污染,根据产品的预定用途、工艺要求采取相应的控制措施。
第五条(附录2:原料药)质量控制实验室通常应当与生产区分开。当生产操作不影响检验结果的准确性,且检验操作对生产也无不利影响时,中间控制实验室可设在生产区内。
16.
17.仓库及中间站的温湿度规定需与物料储存条件相匹配;车间现场物料定值经管情况,是否每个包装袋都有合格标识?储罐和物料经管是否都有标识?
18.
原料药_GMP检查_杨国栋

2009-04
6
药品认证管理中心
Process Characteristics
API vs. Drug Product
API
Drug
Product
Basic
Chemicals
API
2009-04
2009-04
21
药品认证管理中心
厂房与设施
对一些特殊品种如青霉素类、强致敏性药 物、某些甾体、生物碱、高活性、有毒、 有害的药物应分别在独立厂房或独立空气 处理系统的密闭区域中,使用专用设备进 行生产。
2009-04
22
药品认证管理中心
厂房与设施
易燃、易爆、有毒、有害物质的生产和储 存的厂房设施应符合国家的有关规定。使 用有机溶剂或在生产中产生大量有害气体 的原料药精制、干燥工序,在确保净化的 同时要考虑防爆、防毒的有效措施,这种 情况下,这些区域应保持相对负压,回风 不易循环使用。原料药精、干、包区域的 废气、废液的排放要有防止倒灌的措施。
在确保净化的同时是否考虑防爆、防毒的有效措施,这种 情况下,这些区域是否保持相对负压,回风不循环使用; 原料药精、干、包区域的废气、废液的排放是否有防止倒 灌的措施。
2009-04
25
药品认证管理中心
厂房与设施
对于无菌原料药还应检查: 1、无菌区域和非无菌区域是否严格分开; 2、无菌区域和非无菌区域空调系统是否独立;无菌区域
原料药的管理有其自身的特点与要求,检查 员在检查时一定要结合这些特点,针对影响 原料药质量的关键环节进行重点检查。
2009-04
15
原料药GMP检查细则

药品GMP检查指南原料药国家食品药品监督管理局药品安全监管司国家食品药品监督管理局药品认证管理中心各药品生产企业:随着GMP认证工作的进一步推进,为了保证药品GMP认证工作的公正、公开、公平,规范和指导实施GMP认证工作。
国家食品药品监督管理局药品安全监管司和国家食品药品监督管理局药品认证管理中心组织编写了《药品GMP检查指南》,该指南分为法律法规、通则、中药饮片、中药制剂、原料药、医用氧、生物制品等部分共4本书。
该指南中的GMP认证检查评定标准已作了修订,由原来的225项增加到235项,其中关键项目从56项增加到58项(1801、6802),一般项目从169项增加到177项。
该指南将作为今后药品监督管理部门及GMP认证检查员监督检查的依据。
国家食品药品监督管理局药品认证管理中心要求由省局统一征订。
海南省食品药品监督管理局委托我中心具体承办该指南征订工作。
请各药品生产企业于2004年3月25日前务必将购书回执传真到培训中心。
该指南每套220元(含邮寄费)。
地址:海口白龙南路48号(省科技活动中心)B座503、504室。
一、机构与人员*0301 企业是否建立药品生产和质量管理机构,明确各级机构和人员的职责。
看企业组织机构图,查生产质量管理组织机构及功能设置(图示),是否涵盖生产、质量、物料仓储、设备、销售及人员管理等内容,并有负责培训的职能部门/人员。
1. 查企业分管生产及质量的负责人、生产及质量管理中层干部基本情况,内容包括:姓名、职务、职称、学历、毕业院校、所学专业、从事制药行业年限、所在岗位等。
2. 独立的质量管理部门的主要职责不得委派给他人。
以文件形式规定的质量管理部门的职责通常包括(但不一定局限于)以下各项:2.1 所有原料药的放行和否决,外销的中间体的放行和否决;2.2 建立原材料、中间体、包装材料和标签的放行或拒收系统;2.3 在决定原料药放行前,审核已完成关键步骤的批生产记录和实验室控制记录;2.4 确保各种重大偏差已进行调查并已解决;2.5 批准所有的质量标准和工艺规程;2.6 批准所有与原料药或中间体质量相关的各种规程;2.7 确保进行内部审计(自检);2.8 批准中间体和原料药的委托生产单位;2.9 批准对中间体或原料药质量可能造成影响的各种变更;2.10 审核并批准验证方案和报告;2.11 确保对质量相关的投诉进行调查并给予适当处理;2.12 确保确立有效的体系,用于关键设备的维护、保养和校准;2.13 确保物料都经过适当的检测并有测试报告;2.14 确保有稳定性数据支持中间体或原料药的复验期或有效期及储存条件;2.15 对产品质量情况进行回顾及审核(ICH标准)。
原料药GMP检查细则

原料药GMP检查细则随着全球医药行业的不断发展,原料药在药品生产中的重要性日益凸显。
原料药作为药品生产的基础,必须符合国家和国际相关法规和标准。
原料药的质量直接影响着药品的质量、安全和疗效。
因此,原料药的生产和质量管理至关重要。
为了保证原料药质量的稳定和可靠,国际上采用原料药GMP检查细则来规范原料药生产和质量管理。
本文将详细介绍原料药GMP检查细则的相关内容。
一、原料药GMP检查细则的概述GMP(Good Manufacturing Practice,良好生产规范)是一种全面的质量体系,适用于所有药品生产环节。
GMP要求原料药生产过程和质量控制必须符合国际药典和相关法规、规范的要求。
GMP检查贯穿原料药生产过程的所有阶段,从原材料采购到产品放行的全流程质量管理。
原料药GMP检查细则是保证原料药生产质量的重要工具,是全球药品监管机构对制药企业管理质量的核心标准之一。
在国际贸易中,符合GMP标准的原料药才能通过各国监管机构的审核,被批准在国内出售。
二、原料药GMP检查细则的实施原则原料药GMP检查细则包括原材料控制、生产过程控制、生产设备及施工规范、生产计划、检验和质量控制、产品标准、稳定性等多个方面。
在实施过程中,应遵循以下几个原则:1、全面性。
GMP检查细则应覆盖原料药生产的所有环节,包括物流管理、原材料采购、生产加工等级面和售后服务等所有领域。
2、实施性。
GMP检查细则要具有可操作性,需要在实践中施行,而非只存在于纸面文件中。
3、主动性。
制药企业应自行承担生产过程的全面质量控制责任,主动开展生产检查活动,并对检查结果负责。
三、原料药GMP检查细则的实践操作1、原材料控制。
原材料应符合GMP规范,具备合格供应商,且必须进行批次检查。
原材料检查应包括外观、标识、含量、杂质等多方面;由于药品对原材料要求较高,生产企业应制定检查标准,严格执行原材料的检查、分析和储存。
2、生产过程控制。
制药企业应先针对生产工艺进行分析和控制,根据实际生产过程进行管控。
原料药企业药品GMP认证检查缺陷分析

原料药企业药品GMP认证检查缺陷分析GMP(Good Manufacturing Practice)是指在药品生产过程中,按照一定的质量管理标准和规范,确保药品的质量和安全性。
药品GMP认证检查是对药品生产企业的整个生产过程进行全面、系统、严密的检查和评估,以确保企业符合GMP标准要求,提高药品质量和安全性。
1. 生产工艺不规范:生产工艺是药品生产中最关键的环节之一。
如生产设备不符合GMP要求,操作人员操作不规范等。
这些因素可能导致药品的质量不稳定,影响其有效性和安全性。
2. 质量控制体系不健全:质量控制体系是确保药品质量的关键要素。
如果企业的质量控制体系不健全,缺乏有效的质量控制措施和监测方法,可能导致药品的质量无法得到有效的控制和保证。
3. 原辅料不合格:原辅料的质量直接影响到药品的质量和安全性。
如果原辅料不合格,可能会导致药品质量不稳定或存在安全隐患。
4. 产品批记录不完整:产品批记录是对药品生产全过程的记录和审核,可以追溯产品的生产过程和质量情况。
如果产品批记录不完整、不准确,将会影响对药品质量的评估和控制。
5. 不合理的质量风险控制措施:在药品生产中,企业应采取合理的质量风险控制措施,确保生产过程的可控性和稳定性。
如果企业没有制定和实施有效的质量风险控制措施,可能会导致生产过程的变异和不可控,从而影响药品的质量和安全性。
针对这些常见的缺陷,原料药企业可以采取以下措施进行改进和提升:1. 加强质量意识,培养员工的GMP意识和遵守GMP规范的能力。
通过培训和教育,提高员工对GMP要求的理解和重视程度,确保生产过程中的操作规范和质量控制措施的有效实施。
2. 健全质量管理体系,建立完备的质量控制体系。
通过制定和实施相应的质量管理手册和操作规范,确保药品生产过程中的各个环节都能按照GMP要求进行管理和控制。
3. 严格把关原辅料的供应和采购,建立健全的供应商管理体系。
定期对原辅料供应商进行审核和评估,确保原辅料的质量符合要求。
FDA原料药的生产质量管理规范(GMP)指南

FDA行业指南:原料药的生产质量管理规范(GMP)指南美国健康与人类事物务部食品与药品管理局药品评估与研究中心(CDER)生物制品评估与研究中心(CBER)2001 年8 月ICH目录1 引言 5 1.1 目的 5 1.2 规范的适用性 61.3 管制范围 62 质量管理部门职责8 2.1 总原则8 2.2 质量管理部门职责8 2.3 生产部门职责9 2.4 内部质量审计(自检)102.5 产品质量审核103 人员管理11 3.1 人员资质要求11 3.2 人员卫生113.3 顾问114. 厂房和设施12 4.1 设计和施工12 4.2 公用设施13 4.3 生产用水13 4.4 专属生产区14 4.5 照明14 4.6 排污与垃圾14 4.7 清洁和保养15 5生产设备155.1设备设计、选用及安装15 5.2设备维护及清洁15 5.3校验16 5.4计算机管理系统17 6文件与记录管理186.1文件系统和规格标准18 6.2设备清洁及使用记录19 6.3原材料、中间体、原料药、标签、包装材料的记录19 6.4工艺规程(主生产和控制记录)19 6.5批生产记录(批生产和控制记录)20 6.6实验室控制记录21 6.7批生产记录审核22 7物料管理227.1控制通则22 7.2接收和待验23 7.3购进生产物料的抽样及检验237.4仓储24 7.5重新评估24 8生产操作和在线工艺控制25 8.1生产操作25 8.2时间限制25 8.3工序间取样和工艺控制26 8.4中间体或原料药的混批26 8.5污染的控制27 9原料药和中间体的包装和标签管理28 9.1总则28 9.2包装材料28 9.3标签的发放和控制28 9.4包装与标签操作29 10储存和销售管理29 10.1仓库储存程序29 10.2销售程序30 11实验室控制30 11.1控制通则30 11.2中间体和原料药的测试31 11.3 分析方法验证(见12章12.8节)32 11.4分析报告单32 11.5原料药的稳定性研究32 11.6有效期和复检期33 11.7留样33 12验证34 12.1验证方针34 12.2验证文件34 12.3确认35 12.4工艺验证方法35 12.5工艺验证程序36 12.6已验证系统的定期审核36 12.7清洁验证37 12.8分析方法验证38 13变更控制38 14物料的拒收与再用39 14.1拒收39 14.2返工39 14.3重新加工40 14.4物料与溶剂的回收40 14.5退货40 15投诉与产品召回41 16合同制造商(含实验室)4217代理商、经纪人、贸易商、批发商、重新包装商与重新贴签商42 17.1适用性42 17.2已销售的原料药与中间体的可追溯性42 17.3质量管理43 17.4原料药和中间体重新包装、重新贴签与储存43 17.5稳定性43 17.6信息传递43 17.7投诉与召回的处理44 17.8退货的处理44 18用细胞培养/发酵法生产的原料药的特别指南44 18.1总则44 18.2细胞库的维护与记录保存46 18.3细胞培养/发酵46 18.4收取、分离与提纯47 18.5病毒去除和灭活过程48 19用于临床试验阶段的原料药管理原则48 19.1总则48 19.2质量管理48 19.3设备和设施49 19.4原材料控制49 19.5生产49 19.6验证49 19.7变更50 19.8实验室控制50 19.9文件备案50 20GLOSSARY术语表51原料药的生产质量管理规范(GMP)指南1.引言1.1目的Q7A指南目的在于给原料药生产商家在适当系统中生产原料药进行质量管理时执行cGMP提供指导原则。
WHO原料药GMP现场检查(中英文)

Part Three, 18.1–18.59
Module 14
Slide 2 of 23
WHO - EDM
Active Pharmaceutical Ingredients
原料药
Areas to be Covered 涉及范围
Module 14
Slide 15 of 23
WHO - EDM
Active Pharmaceutical Ingredients
原料药
Production (continued)生产(接上)
Packaging包装
packaging material selection包材选择 procedures to prevent error预防差错的程序 labelling, including:标贴,包括:
– – – – – – – Product name产品名称 Quality质量 Batch number批号 Expiry or retest date有效期或复检期 Warnings, if required警示,必要时 Storage conditions贮存条件 Part Three, 18.43–18.45 Names of manufacturers and suppliers生产商和供应商名称
Active pharmaceutical ingredients原料药
meet specifications符合质量标准 limits for residue and reactants残留和反应物的限量 sterile APIs无菌原料药
Part Three, 18.41–18.42
原料药GMP认证检查精品PPT课件

二、原料药生产中的特殊要求:
1、一般原料药生产厂家同时生产多个品种,为防 止污染和交叉污染,对一些特殊品种青霉素类、 强致敏性药物、某些甾体化学物、生物碱、高 活性、有毒、有害的药物应符合《规范》 (1998年修订)中的相关规定,分别在独立厂 房或独立空气处理系统的密闭区域中,使用专 用设备进行生产。
12
四、原料药生产管理要点:
⑷ 原料药精制脱色后必须过滤,将滤液压入或 抽入洁净区的结晶罐内。严格检查过滤器及 滤材是否符合工艺要求,并制订清洗规程, 做好记录;
⑸ 随时检查滤液是否澄清。开始收集的滤液须 重新过滤,确认无漏炭现象后,方可连续过 滤。
⑹ 未进行验证或对成品质量有影响的回收品或 母液不得套用,并应单独列批,制订专门的 处理方法;
6
二、原料药生产中的特殊要求:
9、原料药的生产记录应有可追溯性,批生产记录 至少从粗品的精制工序开始。连续生产的批生 产记录以该批产品各工序生产操作及质量监控 的记录为依据。
7
三、原料药生产环境的划分:
1、非无菌原料药的生产中,除粗品或浓缩液、 活性炭、溶剂、外包装及其清理 等置于一般区 域外,其余工序均应设在30万 级区域内(即:过滤、结晶、分离、干燥、 过 筛、混粉、内包装等)
2、进入原料药无菌操作的人员和物料,必须按规 定净化,物料还需进行消毒或灭菌 。
3
二、原料药生产中的特殊要求:
3、原料药生产中使用或产生大量的易燃、易爆、 有害的物质,生产及贮存的厂房设施,要符合 国家有关规定,生产过程中产生的“三废”也要 符合国家排放标准。
4、原料药生产宜使用密闭设备,密闭的设备及管 道可放在室外。如使用敞口设备或打开设备操 作时,应具有避免污染的措施,对于难清洗的 特定类型设备可专用于特定的中间产品、原料 药的生产或贮存。
药品gmp认证检查评定标准

3901 物料是否符合药品标准、包装材料 标准、生物制品规程或其他有关标 准,不得对药品的质量产生不良影 响。
PPT文档演模板
药品gmp认证检查评定标准
二、药品 GMP 认证检查项目
1、重点项目:
二、药品 GMP 认证检查项目
1、重点项目:
2211 生物制品生产的厂房与设施是否对 原材料、中间体和成品存在潜在污 染。
2212 聚合酶链反应试剂(PCR)的生产和 检定是否在各自独立的建筑物中进 行,防止扩增时形成的气溶胶造成 交叉污染。
PPT文档演模板
药品gmp认证检查评定标准
二、药品 GMP 认证检查项目
PPT文档演模板
药品gmp认证检查评定标准
二、药品 GMP 认证检查项目
1、重点项目:
4602 标签、使用说明书是否经质量管理部 门校对无误后印刷、发放、使用。
5701 企业是否进行药品生产验证,是否根 据验证对象建立验证小组,提出验证 项目、制定验证方案,并组织实施。
PPT文档演模板
药品gmp认证检查评定标准
1、重点项目:
7004 有数条包装线同时包装时,是否采取 隔离或其他有效防止污染和混淆的设 施.
7005 无菌药品生产直接接触药品的包装材 料是否回收使用.
PPT文档演模板
药品gmp认证检查评定标准
二、药品 GMP 认证检查项目
1、重点项目:
7101 是否根据产品工艺规程选用工艺用 水,工艺用水是否符合质量标准,是 否根据验证结果,规定检验周期,是 否定期检验,是否有检验记录.
药品gmp认证检查评定标准
GMP质量管理体系的原料药管理

GMP质量管理体系的原料药管理在药品生产领域,GMP质量管理体系是至关重要的,它确保了药品的质量、安全性和有效性。
原料药是制药过程中不可或缺的关键组成部分,对原料药的管理至关重要。
下面我们将探讨GMP质量管理体系下的原料药管理。
原料药采购GMP要求企业在采购原料药时必须确保原材料的质量符合要求。
企业应建立完善的原料药采购管理文件,规定采购程序、审核供应商资质、审核原料药质量等要求。
只有符合GMP标准的供应商才能进入采购名单,确保原料药的质量。
原料药接收与检验原料药接收环节也是十分重要的。
按照GMP要求,企业应该制定详细的原料药接收操作规程,负责接收的人员要经过专门培训。
在接收环节,要对原料药进行标识、检查、验收和登记等程序,确保接收的原料药符合质量要求。
原料药储存良好的原料药储存条件对确保药品质量至关重要。
企业应该建立原料药储存区域,严格按照GMP的要求进行管理。
储存区域应具备良好的通风、遮光和温度控制等条件,确保原料药不受外界因素影响。
原料药使用原料药使用环节是整个制药过程中最核心的环节之一。
按照GMP要求,企业必须确保使用的原料药质量可追溯、可控制。
在使用过程中,要建立详细的记录,包括原料药批号、使用量等信息,确保药品跟踪和回溯能力。
原料药处理处理原料药的过程也必须符合GMP的要求。
企业应制定原料药处理操作规程,确保处理过程符合GMP要求。
处理过程中必须保持原料药的纯度和活性,避免受到任何污染或损害。
原料药质量控制质量控制是GMP质量管理体系的核心。
企业必须建立原料药质量控制体系,确保原料药的质量符合药品生产的要求。
要定期对原料药进行检测和验证,确保原料药的纯度、稳定性、活性等指标符合要求。
通过以上几个环节的管理,企业可以有效地管理原料药,确保生产出质量可靠的药品。
遵循GMP质量管理体系的原料药管理要求,有助于企业提高生产质量,降低风险,确保患者用药安全和有效。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
❖ 往往包含复杂的化学变化和/或生物变化过程 ❖ 具有较为复杂的中间控制过程 ❖ 生产过程中往往会产生副产物,通常需要有纯化过程 ❖ 不同品种的生产设备与操作工艺大为不同 ❖ 同一反应设备有时会于不同的反应 ❖ 自动化程度越来越高,自动化生产设施设备、过程分析技
术的应用越来越多
❖ 有些化学反应和生物反应的机理尚未彻底明了 ❖ 污染更多可能来自设备中物料的降解物,可能会随着工艺
❖将符合同一质量标准的原料药或中间产品合并, 以得到均一产品的工艺过程。
❖将来自同一批次的各部分产品(如同一结晶批号 的中间产品分数次离心)在生产中进行合并,或 将几个批次的中间产品合并在一起作进一步加工 ,可作为生产工艺的组成部分,不视为混合。
2010-04
13
药品认证管理中心
四、混合
(一)原料药或中间产品的混合(要求)
-一般说来,那些无法在工艺中被有效去除的杂质产生的工序被定 义为关键工艺步骤。
❖ 关键控制点的确定,考虑以下两个方面
-单元操作中的风险是否存在控制措施;
-为了预防、抑制或减少对产品的危害以及对患者的风险,单元操 作的控制措施是否必须的
2010-04
6
药品认证管理中心
二、原料药的工艺流程和生产特点
(一)原料药生产的特点
母液 去回收塔
D级洁净区
药品认证管理中心
三、中间控制和取样
(一)必要的中间控制
❖中间控制数据有助于对工艺过程进行监控
❖ pH控制、反应终点、结晶,水分、残留溶媒等干 燥检查
❖应当综合考虑所生产原料药的特性、反应类型、 工艺步骤对产品质量影响的大小等因素来确定控 制标准、检验类型和范围。前期生产的中间控制 严格程度可较低,越接近最终工序(如分离和纯 化)中间控制越严格。
2010-04
9
药品认证管理中心
三、中间控制和取样
(一)必要的中间控制
❖有资质的生产部门人员可进行中间控制,并可在 质量管理部门事先批准的范围内对生产操作进行 必要的调整。在调整过程中发生的中间控制检验 结果超标通常不需要进行调查。
2010-04
10
药品认证管理中心
三、中间控制和取样
(二)取样
❖ 有应当制定操作规程,详细规定中间产品和原料药的取样 方法。
总量 内毒素 控制微生物
晶形测试
关键 非关键 关键 非关键
关键 非关键
*如果工艺不进行控制或不影响属性,可以用GMP控制。
2010-04
4
工艺控制 工艺控制和/或GMP控制,(如水的质量,环 境监控) 工艺控制
药品认证管理中心
一、从风险原则出发,确定检查关键点
(一)检查关键区域的确定
❖并非所有的关键质量属性都受工艺影响, 很多属性是由GMP来控制的。
2010-04
药物制剂 关键参数
原料药的关键 质量属性
潜在的关键参 数
关键步骤
检查的关键区 域
必须考虑原料药所制最终制剂的用途
3
药品认证管理中心
原料药的关键质量属性与GMP的关联
属性 鉴别 物理化学特性
性状描述
含量 纯度
测试 所有鉴别 PH,熔点、折射率
物理状态(固体、液体等)
关键或非关键
关键的
可以是关键的也可以是非关键的, 依赖于API的物理特性及其使用的目 的
❖ 经中间控制检测表明某一工艺步骤尚未完成,仍可按正常工艺继续操 作,不属于返工。
2010-04
17
药品认证管理中心
五、不合格中间产品或原料药的处理
(二)物料和溶剂的回收
❖ 回收反应物、中间产品或原料药(如从母液或滤液中回收),应当有 经批准的回收操作规程,且回收的物料或产品符合与预定用途相适应 的质量标准。
-鉴别:准确使用批记录、原料、和标签。温度、摩尔比等 工艺参数很难影响。
❖需要关注操作的难易程度和关键工艺参数 的范围
❖关注污染和交叉污染
-污染的主要来源:异物和杂质
2010-04
5
药品认证管理中心
一、从风险原则出发,确定检查关键点
(二)HACCP方法确定检查关键区域中的关键 控制点
❖ 识别工艺中所有的关键工艺步骤。需要按照工艺流程图, 对每个单元操作进行分析,有潜在污染的那些单元操作被 认为关键工艺步骤。
2010-04
18
药品认证管理中心
五、不合格中间产品或原料药的处理
(二)溶剂回收
❖回收溶剂的检验项目:
-多于初始进厂溶剂? -等于初始进厂溶剂? -少于初始进厂溶剂?
❖回收溶剂的质量标准:
-高于初始进厂溶剂? -等于初始进厂溶剂? -低于初始进厂溶剂?
2010-04
19
药品认证管理中心
五、不合格中间产品或原料药的处理
❖ 溶剂可以回收。回收的溶剂在同品种相同或不同的工艺步骤中重新使 用的,应当对回收过程进行控制和监测,确保回收的溶剂符合适当的 质量标准。回收的溶剂用于其它品种的,应当证明不会对产品质量有 不利影响。
❖ 未使用过和回收的溶剂混合时,应当有足够的数据表明其对生产工艺 的适用性。
❖ 回收的母液和溶剂以及其它回收物料的回收与使用,应当有完整、可 追溯的记录,并定期检测杂质。
2010-04
11
药品认证管理中学合理,考虑的风险因素如下:
–物料的关键程度(与关键质量属性相关) –包装控制 –历史数据 –均匀性
❖ 不同性质物料的取样
-固体 -浆体 -均匀的液体 -托盘干燥产品
2010-04
12
药品认证管理中心
四、混合
(一)原料药或中间产品的混合(定义)
❖ 应当按照操作规程进行取样,取样后样品密封完好,防止 所取的中间产品和原料药样品被污染。
❖ 取样工具应当具有一套清洗规程来进行控制,且在不使用 时,应当被恰当地储存以避免污染。
❖ 在取样过程中,应当将外部污染风险降到最低。
- 当对API中间产品取样时,应当考虑使用原位取样探头,或者采用保护性遮盖物来对 有生产设备打开的区域进行保护。至少在取样点的周围区域应当进行很好的维护,以 证明不存在剥落的油漆、铁锈、灰尘或其他可能的污染源。
CCD
原料药生产管理的GMP检查
翟铁伟
药品认证管理中心
提纲
❖从风险原则出发,确定检查关键点:关键 质量属性、关键工艺参数和关键工艺步骤
❖工艺流程和生产操作特点 ❖中间控制和取样 ❖混合 ❖不合格中间产品或原料药的处理
2010-04
2
药品认证管理中心
一、从风险原则出发,确定检查关键点
(一)检查关键区域的确定
❖拟混合的每批产品均应当按照规定的工艺生产、 单独检验,并符合相应质量标准。
❖不得将不合格批次与其它合格批次混合。
2010-04
14
药品认证管理中心
四、混合
(一)原料药或中间产品的混合(要求)
❖ 物理性质至关重要的原料药(如用于口服固体制剂或混悬 剂的原料药),其混合工艺应当进行验证,验证包括证明 混合批次的质量均一性及对关键特性(如粒径分布、松密 度和堆密度)的检测。
2010-04
21
药品认证管理中心
谢谢大家!
2010-04
22
药品认证管理中心
关键的
含量测试
关键的
有机杂质(HPLC杂质)
关键的
无机杂质(硫酸盐残渣灰分)
残留溶媒
重金属*
手性杂质(手性含量和对映体)
工艺控制或GMP控制 GMP控制 工艺控制和/或GMP控制,依赖于药物
GMP控制或工艺控制(物理状态能被工艺条件 影响) 工艺控制 工艺控制
颗粒度 微生物纯度
多晶性
颗粒大小 堆密度
❖ 混合可能对产品的稳定性产生不利影响的,应当对最终混 合的批次进行稳定性考察。
❖ 混合批次的有效期应当根据参与混合的最早批次产品的生 产日期确定。
2010-04
15
药品认证管理中心
四、混合
(二)原料药或中间产品混合的情形
❖ 将数个小批次混合以增加批量; ❖ 将同一原料药的多批零头产品混合成为一个批次。
2010-04
16
药品认证管理中心
五、不合格中间产品或原料药的处理
(一)返工和重新加工
❖ 不符合质量标准的中间产品或原料药可重复既定生产工艺中的步骤, 进行重结晶等其它物理、化学处理,如蒸馏、过滤、层析、粉碎方法 。
❖ 多数批次都要进行的返工,应当作为一个工艺步骤列入常规的生产工 艺中。
❖ 除已列入常规生产工艺的返工外,应当对将未反应的物料返回至某一 工艺步骤并重复进行化学反应的返工进行评估,确保中间产品或原料 药的质量未受到生成副产物和过度反应物的不利影响。
带到别的设备中
2010-04
7
药品认证管理中心
化 学 原 料 药 的 典 型 工 艺 流 程
冷盐水
碱液 盐酸
精制用溶剂 冷纯化水
起始原料或中间体
合成反应 过滤
萃取、分层 脱色 过滤
水解、分层 脱色
过滤 结晶 离心 干燥
过筛 包装
一般生产区
2010-04
8
溶剂、试剂或催化剂
有机层 去回收塔
有机层 去回收塔
(三)经检验不合格的中间产品有无可能被直
接使用?
2010-04
20
药品认证管理中心
总结
❖ 原料药的生产特殊性决定了其GMP检查更需要注重 风险原则。
❖应根据企业的产品特性确定检查关键区域和检查关键 点。
❖检查过程中应注重质量管理的科学性。
❖第三百一十一条 企业可以采用经过验证的替代方法 ,达到本规范的要求。
