初中常见化学式和化学方程式练习
初二化学式的练习题

初二化学式的练习题化学式是化学物质的一种表示方式,通过化学式可以简明地表示出化学物质的组成元素和原子数目。
初二学生在学习化学时,练习化学式的题目可以帮助他们加深对化学式的理解和掌握。
下面是一些初二化学式的练习题,供学生进行练习:1. 根据元素符号填写化学式的正确名称:a) NaCl:_______b) H2O:________c) CO2:________d) Fe2O3:________e) NH3:________2. 根据化学名字写出相应的化学式:a) 氯化钠:_______b) 二氧化碳:_______c) 水:________d) 亚硝酸:_______e) 硫酸:_______3. 化学式求摩尔质量:a) H2O的摩尔质量是多少?b) CO2的摩尔质量是多少?c) NaCl的摩尔质量是多少?d) Ca(OH)2的摩尔质量是多少?e) Al2(SO4)3的摩尔质量是多少?4. 化学式求元素的摩尔数:a) 在H2O中,氢元素的摩尔数是多少?b) 在CO2中,碳元素的摩尔数是多少?c) 在CaCl2中,钙元素的摩尔数是多少?d) 在H2SO4中,氢元素的摩尔数是多少?e) 在Al2O3中,铝元素的摩尔数是多少?5. 化学式求物质的摩尔比:a) C2H5OH中碳、氢、氧的摩尔比分别是多少?b) NH4NO3中氮、氢、氧的摩尔比分别是多少?c) Al(OH)3中铝、氢、氧的摩尔比分别是多少?d) K2Cr2O7中钾、铬、氧的摩尔比分别是多少?e) MgSO4·7H2O中镁、硫、氧、氢的摩尔比分别是多少?通过练习化学式的题目,初二学生可以加深对化学式的理解,从而提高化学知识的掌握程度。
希望以上练习题能对学生们有所帮助。
初中化学常见物质的化学式、化学方程式

初中化学常见物质的化学式一、常见的单质:(一)金属单质:钾:K 钙:Ca 钠:Na 镁:Mg 铝:Al 锌:Zn 铁:Fe 锡:Sn铅:Pb 铜:Cu 汞:Hg 银:Ag 铂:Pt 金:Au 钡:Ba 钨:W(二)非金属单质:碳:C 硫:S 磷:P 硅:Si 碘:I2溴:Br2氧气:O2氮气:N2氢气:H2氯气:Cl2(三)稀有气体单质:氦气:He 氖气:Ne 氩气:Ar 氪气:Kr 氙气:Xe二、常见的化合物:(一)氧化物:氧化钾:K2O 氧化钠:Na2O 氧化银:Ag2O 水:H2O氧化钙:CaO 氧化钡:BaO 氧化镁:MgO 氧化锌:ZnO 氧化铜;CuO氧化铝:Al2O3二氧化锰:MnO2二氧化硅:SiO2五氧化二磷:P2O5一氧化碳:CO 二氧化碳:CO2一氧化氮:NO 二氧化氮:NO2二氧化硫:SO2三氧化硫:SO3氧化亚铁:FeO 氧化铁:Fe2O3四氧化三铁:Fe3O4 (二)氯化物:氯化钾:KCl 氯化钠:NaCl 氯化银:AgCl 氯化氢;HCl氯化钙:CaCl2氯化钡:BaCl2氯化镁:MgCl2氯化锌:ZnCl2氯化铜:CuCl2氯化铝:AlCl3氯化亚铁:FeCl2氯化铁:FeCl3(三)含原子团的化合物:硝酸:HNO3硫酸:H2SO4碳酸:H2CO3磷酸:H3PO4氢氧化钾:KOH 氢氧化钠:NaOH 氢氧化钙:Ca(OH)2氢氧化钡:Ba(OH)2氢氧化镁:Mg(OH)2氢氧化铜:Cu(OH)2氢氧化铝:Al(OH)3氢氧化亚铁:Fe(OH)2氢氧化铁:Fe(OH)3硝酸钾:KNO3硝酸钠:NaNO3硝酸钙:Ca(NO3)2硝酸钡:Ba(NO3)2硝酸镁:Mg(NO3)2硝酸铜:Cu(NO3)2硝酸铝:Al(NO3)3硝酸亚铁:Fe(NO3)2硝酸铁:Fe(NO3)3硫酸钾:K2SO4硫酸钠:Na2SO4硫酸钙:Ca SO4 硫酸钡:BaSO4硫酸镁:MgSO4硫酸铜:CuSO4 硫酸铝:Al2(SO4)3硫酸亚铁:FeSO4硫酸铁:Fe2 (SO4)3碳酸钾:K2CO3碳酸钠:Na2CO3碳酸钙:CaCO3碳酸钡:BaCO3碳酸镁:MgCO3碳酸铜:CuCO3氯化铵:NH4Cl 硝酸铵:NH4NO3硫酸铵:(NH4)2SO4碳酸铵:(NH4)2CO3碳酸氢铵:NH4HCO3(四)其他化合物:氯酸钾:KClO3 高锰酸钾:KMnO4锰酸钾:K2MnO4过氧化氢:H2O2氨气:NH3初中常用的化学方程式一、物质与氧气的反应:点燃1、硫燃烧:S+O2====SO2点燃2、碳燃烧:C+O2====CO2点燃3、磷燃烧:4P+5O2====2P2O5点燃4、镁燃烧:2Mg+O2====2MgO点燃5、铁丝燃烧:3Fe+2O2====Fe3O4点燃6、铝箔燃烧:4Al+3O2====2Al2O3点燃7、氢气燃烧:2H2+O2====2H2O点燃8、汞加热:2Hg+O2====2HgO二、生成氧气的反应:MnO21、过氧化氢制氧气:2H2O2 ===== 2H2O+O2↑△2、高锰酸钾制氧气 : 2KMnO4====K2MnO4+MnO2+O2↑MnO23、氯酸钾制氧气: 2KClO3===== 2KCl+3O2↑△通电4、电解水:2H2O===== 2H2↑+O2↑△5、氧化汞受热分解:2HgO====2Hg+O2↑三、氢气的性质与制法:1、锌粒与稀硫酸反应:Zn+H2SO4====ZnSO4+H2↑△2、氢气还原氧化铜:H2+CuO====Cu+H2O。
初中常见化学式及化学方程式大全

初中常见化学式及化学方程式➢常见的化学式一、常见单质二、化合物初中化学方程式全(已配平).一、化合反应1、镁在空气中燃烧:2Mg+ O2点燃 2MgO2、铁在氧气中燃烧:3Fe +2O2点燃 Fe3O43、铝在空气中燃烧:4Al+ 3O2点燃 2Al2O34、氢气在空气中燃烧:2H2 +O2点燃 2H2O5、红磷在空气中燃烧:4P +5O2点燃 2P2O56、硫粉在空气中燃烧: S+ O2点燃 SO27、碳在氧气中充分燃烧:C +O2 点燃 CO28、碳在氧气中不充分燃烧:2C +O2点燃 2CO9、二氧化碳通过灼热碳层: C +CO2高温 2CO10、一氧化碳在氧气中燃烧:2CO +O2 点燃 2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O === H2CO312、生石灰溶于水:CaO+ H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 +5H2O ==== CuSO4·5H2O14、钠在氯气中燃烧:2Na+ Cl点燃 2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O +O2↑16、加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 +O2↑17、水在直流电的作用下分解:2H2O 通电 2H2↑+O2↑18、碳酸化学物理学报不稳定而分解:H2CO3 === H2O +CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温 CaO+ CO2↑三、置换反应20、铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4 +Cu21、锌和稀硫酸反应(实验室制氢气):Zn+ H2SO4 == ZnSO4+H2↑22、镁和稀盐酸反应:Mg +2HCl === MgCl2 +H2↑23、氢气还原氧化铜:H2 +CuO 加热 Cu +H2O24、木炭还原氧化铜:C+ 2CuO 高温 2Cu +CO2↑25、甲烷在空气中燃烧:CH4 +2O2 点燃 CO2+2H2O26、水蒸气通过灼热碳层:H2O +C 高温 H2 +CO27、焦炭还原氧化铁:3C +2Fe2O3高温 4Fe +3CO2↑其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+ CuSO4== Cu(OH)2↓+ Na2SO429、甲烷在空气中燃烧:CH4 +2O2点燃 CO2 +2H2O30、酒精在空气中燃烧:C2H5OH+ 3O2点燃 2CO2 +3H2O31、一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO232、一氧化碳还原氧化铁:3CO+ Fe2O3高温 2Fe+ 3CO233、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+ CO2==== CaCO3 ↓+ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+ CO2 ==== Na2CO3 +H2O35、石灰石(或小学音乐教案大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 +2HCl === CaCl2 +H2O +CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3+ 2HCl === 2NaCl +H2O +CO2↑一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg+ O2点燃 2MgO2. 铁在氧气中燃烧:3Fe+ 2O2点燃 Fe3O43. 铜在空气中受热:2Cu+ O2加热 2CuO4. 铝在空气中燃烧:4Al +3O2 点燃 2Al2O35. 氢气中空气中燃烧:2H2 +O2点燃 2H2O6. 红磷在空气中燃烧:4P+ 5O2点燃 2P2O57. 硫粉在空气中燃烧: S +O2 点燃 SO28. 碳在氧气中充分燃烧:C+ O2点燃 CO29. 碳在氧气中不充分燃烧:2C+ O2点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+ O2点燃 2CO211. 甲烷在空气中燃烧:CH4 +2O2点燃 CO2 2H2O12. 酒精在空气中燃烧:C2H5OH +3O2点燃 2CO2+3H2O二.几个分解反应:13. 水在直流电的作用下分新概念英语第一册解:2H2O 通电 2H2↑+ O2↑14. 加热碱式碳酸铜:Cu2(OH)2CO3加热 2CuO +H2O +CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl+ 3O2↑16. 加热高锰酸钾:2KMnO4 加热 K2MnO4 +MnO2 +O2↑17. 碳酸不稳定而分解:H2CO3 === H2O +CO2↑18. 高温煅烧石灰石:CaCO3 高温 CaO +CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2+ CuO 加热 Cu+ H2O20. 木炭还原氧化铜:C+ 2CuO 高温 2Cu +CO2↑2 初三化学方程式大合集21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe+ 3CO2↑22. 焦炭还原四氧化三铁:2C +Fe3O4高温 3Fe+ 2CO2↑23. 一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO224. 一氧化碳还原氧化铁:3CO+ Fe2O3高温 2Fe +3CO225. 一氧化碳还原四氧化三铁:4CO +Fe3O4高温 3Fe+ 4CO2四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+酸 -------- 盐+氢气(置换反应)26. 锌和稀硫酸Zn+ H2SO4 = ZnSO4+ H2↑27. 铁和稀硫酸Fe +H2SO4 = FeSO4+ H2↑28. 镁和稀硫酸Mg +H2SO4 = MgSO4 +H2↑29. 铝和稀硫酸2Al+ 3H2SO4 = Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn +2HCl === ZnCl2+ H2↑31. 铁和稀盐酸Fe+ 2HCl === FeCl2+ H2↑32. 镁和语文教案格式稀盐酸Mg 2HCl === MgCl2+ H2↑33. 铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑(2)金属单质+盐(溶液) ------- 另一种金属+另一种盐34. 铁和硫酸铜溶液反应:Fe+ CuSO4 === FeSO4+ Cu35. 锌和硫酸铜溶液反应:Zn+ CuSO4 === ZnSO4+ Cu36. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2 === Cu(NO3)2 +Hg (3)碱性氧化物+酸 -------- 盐+水37. 氧化铁和稀盐酸反应:Fe2O3+ 6HCl === 2FeCl3+ 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 +3H2SO4 === Fe2(SO4)3+ 3H2O39. 氧化铜和稀盐酸反应:CuO +2HCl ==== CuCl2 +H2O40. 氧化铜和稀硫酸反应:CuO +H2SO4 ==== CuSO4+ H2O41. 氧化镁和稀硫酸反应:MgO+ H2SO4 ==== MgSO4+ H2O42. 氧化钙和稀盐酸反应:CaO +2HCl ==== CaCl2 +H2O(4)酸性氧化物+碱 -------- 盐+水43.苛性钠暴露在空气中变质:2NaOH +CO2 ==== Na2CO3+H2O 44.苛性钠吸收二氧化硫气体:2NaOH +SO2 ==== Na2SO3 +H2O 45.苛性钠吸收三氧化硫气体:2NaOH+ SO3 ==== Na2SO4+ H2O 46.消石灰放在空气中变质:Ca(OH)2+ CO2 ==== CaCO3 ↓+ H2O47. 消石灰吸收二氧化硫:Ca(OH)2 +SO2 ==== CaSO3↓+H2O(5)酸+碱 -------- 盐+水48.盐酸和烧碱起反应:HCl+ NaOH ==== NaCl+ H2O49. 盐酸和氢氧化钾反应:HCl+ KOH ==== KCl+H2O50.盐酸和氢氧化初中家长会课件铜反应:2HCl+ Cu(OH)2 ==== CuCl2 +2H2O51. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 ==== CaCl2 +2H2O52. 盐酸和氢氧化铁反应:3HCl+ Fe(OH)3 ==== FeCl3 +3H2O53.氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 ==== AlCl3 +3H2O54.硫酸和烧碱反应:H2SO4 +2NaOH ==== Na2SO4 +2H2O55.硫酸和氢氧化钾反应:H2SO4 +2KOH ==== K2SO4 +2H2O56.硫酸和氢氧化铜反应:H2SO4 +Cu(OH)2 ==== CuSO4 +2H2O57. 硫酸和氢氧化铁反应:3H2SO4 +2Fe(OH)3==== Fe2(SO4)3+ 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸+盐 -------- 另一种酸+另一种盐59.大理石与稀盐酸反应:CaCO3 +2HCl === CaCl2 H2O +CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 +2HCl === 2NaCl +H2O+ CO2↑ 61.碳酸镁与稀盐酸反应: MgCO3 +2HCl === MgCl2 +H2O+CO2↑62.盐酸和硝酸银溶液反应:HCl+ AgNO3=== AgCl↓+ HNO363.硫酸和碳酸钠反应:Na2CO3 +H2SO4 === Na2SO4 +H2O +CO2↑64.硫酸和氯化钡溶液反应:H2S O4 +BaCl2 ==== BaSO4↓+ 2HCl(7)碱+盐 -------- 另一种碱+另一种盐65.氢氧化钠与硫酸铜:2NaOH CuSO4 ==== Cu(OH)2↓ Na2SO466.氢氧化钠与氯化铁:3NaOH FeCl3 ==== Fe(OH)3↓ 3NaCl67.氢氧化钠与氯化镁:2NaOH MgCl2 ==== Mg(OH)2↓ 2NaCl68. 氢氧化钠与氯化铜:2NaOH CuCl2 ==== Cu(OH)2↓ 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 Na2CO3 === CaCO3↓ 2NaOH(8)盐+盐 ----- 两种新盐70.氯化钠溶液新概念英语第二册和硝酸银溶液:NaCl +AgNO3 ==== AgCl↓+ NaNO371.硫酸钠和氯化钡:Na2SO4+ BaCl2 ==== BaSO4↓+ 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2+ H2O === H2CO373.生石灰溶于水:CaO+ H2O === Ca(OH)274.氧化钠溶于水:Na2O +H2O ==== 2NaOH75.三氧化硫溶于水:SO3 +H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO4 5H2O77.无水硫酸铜作干燥剂:CuSO4+ 5H2O ==== CuSO4·5H2化学方程式反应现象应用2Mg+ O点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg +O点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+ O点燃或Δ2CuO 红色金属变为黑色固体4Al+ 3O点燃或Δ2Al2O3银白金属变为白色固体3Fe+ 2O点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热 4Fe +3O2高温2Fe2O3C+ O2点燃CO2剧烈燃烧、白光、放热、使石灰水变浑浊S +O2点燃SO2剧大学英语四级烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2 O2点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P +5O2 点燃2P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O点燃2H2O+ CO2蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+ 5O点燃2H2O +4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO2、Δ2KCl +3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气2KMnO4Δ K2MnO4 MnO2 +O2↑ 紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧论文气2HgOΔ2Hg+ O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+ O2↑ 水通电分解为氢气和氧气电解水Cu2(OH)2CO3Δ2CuO +H2O+ CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3ΔNH3↑+ H2O+ CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+ H2SO4=ZnSO4+H2↑ 有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe +H2SO4=FeSO4 +H2↑ 有大量气泡产生、金属颗粒逐渐溶解Mg +H2SO4 =MgSO4 +H2↑ 有大量气泡产生、金属颗粒逐渐溶解2Al+ 3H2SO4=Al2(SO4)3+ 3H2↑ 有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2Δ 2Fe +3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4+4H2 Δ3Fe+ 4H2O 黑色逐渐变为银白色英语翻译、试管壁有液体冶炼金属、利用氢气的还原性WO3 +3H2Δ W +3H2O 冶炼金属钨、利用氢气的还原性MoO3 +3H2ΔMo +3H2O 冶炼金属钼、利用氢气的还原性2Na+ Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2 +Cl2点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4 +2NaOH=Cu(OH)2↓+ Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C +O点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2CO +O点燃2CO2蓝色火焰煤气燃烧C+ CuO 高温2Cu+ CO2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+ 3C 高温4Fe+ 3CO2↑ 冶炼金属Fe3O4 +2C高温3Fe+ 2CO2↑ 冶炼金属C+ CO2 高温2COCO2+H2O = H2CO3碳酸使石蕊变红证明碳酸的酸性小学三语文教学论文H2CO3 ΔCO2↑+ H2O 石蕊红色褪去Ca(OH)2 +CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3 +H2O+ CO2 = Ca(HCO3)2 白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2Δ CaCO3↓+ H2O +CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3+ H2O +CO2↑ 产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3 高温 CaO +CO2↑ 工业制备二氧化碳和生石灰CaCO3 +2HCl=CaCl2+ H2O +CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢初中化学方程式汇总一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg+ O2点燃 2MgO2. 铁在氧气中燃烧:3Fe+ 2O2点燃 Fe3O43. 铜在空气中受热:2Cu+ O2加热 2CuO4. 铝在空气中燃烧:4Al +3O2 点燃2Al2O35. 氢气中空气中燃烧:2H2 +O2 点燃 2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P +5O2点燃 2P2O57. 硫粉在空气中燃烧: S +O2 点燃 SO28. 碳在氧气中充分燃烧:C +O2点燃 CO29. 碳在氧气中不充分燃烧:2C +O2点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+O2点燃 2CO211. 甲烷在空气中燃烧:CH4 +2O2点燃 CO2 +2H2O12. 酒精在空气中燃烧:C2H5OH +3O2点燃 2CO2 +3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验 2HgO 加热 Hg +O2 ↑14.加热高锰酸钾:2KMnO4加热 K2MnO4+ MnO2+O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应: H2O2 MnO22H2O+ O2↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电 2H2↑+O2 ↑17.生石灰溶于水英语六级作文:CaO +H2O == Ca(OH)218.二氧化碳可溶于水: H2O+CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg+ O2点燃 2MgO20.铁和硫酸铜溶液反应:Fe+ CuSO4 === FeSO4+ Cu21.氢气还原氧化铜:H2 +CuO 加热 Cu +H2O22. 镁还原氧化铜:Mg+ CuO 加热 Cu +MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2点燃 CO224.木炭还原氧化铜:C + 2CuO 高温 2Cu+ CO2↑25.焦炭还原氧化铁:3C + 2Fe2O3高温 4Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C +O2 点燃 CO227.煤炉的中层:CO2+ C 高温 2CO28.煤炉的上部蓝色火焰的产生:2CO +O2点燃 2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3+ 2HCl == CaCl2+ H2O +CO2↑30.碳酸不稳定而分解:H2CO3 == H2O +CO2↑31.二氧化碳可溶于水: H2O +CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3高温 CaO+ CO2↑ 33.石灰水与中学历史教学园地二氧化碳反应(鉴别二氧化碳):Ca(OH)2 +CO2 === CaCO3↓+H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO 加热 Cu +CO235.一氧化碳的可燃性:2CO +O2点燃 2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 2HCl == 2NaCl+ H2O +CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 +2O2点燃 CO2 +2H2O 38.酒精在空气中燃烧:C2H5OH +3O2 点燃 2CO2 +3H2O 39.氢气中空气中燃烧:2H2+ O2点燃 2H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg+ O2点燃 2MgO41.铁在氧气中燃烧:3Fe +2O2点燃 Fe3O442. 铜在空气中受热:2Cu +O2加热 2CuO43. 铝在空气中形成氧化膜:4Al+ 3O2 = 2Al2O3(2)金属单质酸 -------- 盐氢气(置换反应)44. 锌和稀硫酸Zn+ H2SO4 = ZnSO4+ H2↑45. 铁和稀硫酸Fe +H2SO4 = FeSO4 +H2↑46. 镁和稀硫酸Mg +H2SO4 = MgSO4+ H2↑47. 铝和稀硫酸2Al+ 3H2SO4 = Al2(SO4)3 +3H2↑48. 锌和稀盐酸Zn+ 2HCl == ZnCl2+ H2↑49. 铁和稀盐酸Fe +2HCl == FeCl2 +H2↑50. 镁和稀盐酸Mg +2HCl == MgCl2+ H2↑51.铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑(3)金属单质盐怎样学好高中物理(溶液) ------- 新金属新盐52. 铁和硫酸铜溶液反应:Fe +CuSO4 == FeSO4 +Cu53. 锌和硫酸铜溶液反应:Zn +CuSO4 ==ZnSO4 +Cu54. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2 == Cu(NO3)2 +Hg(3)金属铁的治炼原理:55.3CO +2Fe2O3 高温 4Fe +3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸金属 -------- 盐氢气(见上)(2)酸金属氧化物-------- 盐水56. 氧化铁和稀盐酸反应:Fe2O3 +6HCl ==2FeCl3 +3H2O57. 氧化铁和稀硫酸反应:Fe2O3 +3H2SO4 == Fe2(SO4)3 +3H2O58. 氧化铜和稀盐酸反应:CuO +2HCl ==CuCl2 +H2O59. 氧化铜和稀硫酸反应:CuO+ H2SO4 == CuSO4+ H2O(3)酸碱 -------- 盐水(中和反应)60.盐酸和烧碱起反应:HCl +NaOH == NaCl+H2O61. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 == CaCl2+2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 == AlCl3 +3H2O63. 硫酸和烧碱反应:H2SO4+ 2NaOH == Na2SO4 +2H2O(4)酸盐 -------- 另一种酸另一种盐64.大理石与稀盐酸反应:CaCO3+2HCl == CaCl2 +H2O+ CO2↑ 65.碳酸钠与稀盐酸反应: Na2CO3 +2HCl == 2NaCl+ H2O+ CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 +HCl== NaCl+H2O+ CO2↑ 67. 硫酸和氯化钡溶液反应:H2SO4 +BaCl2 == BaSO4↓+2HCl 2、碱的幼儿园小班音乐教案化学性质(1)碱非金属氧化物 -------- 盐水68.苛性钠暴露在空气中变质:2NaOH+CO2 == Na2CO3+ H2O 69.苛性钠吸收二氧化硫气体:2NaOH +SO2 == Na2SO3 +H2O 70.苛性钠吸收三氧化硫气体:2NaOH+ SO3 == Na2SO4 +H2O 71.消石灰放在空气中变质:Ca(OH)2+ CO2 == CaCO3↓+H2O 72. 消石灰吸收二氧化硫:Ca(OH)2 +SO2 == CaSO3↓+ H2O (2)碱酸-------- 盐水(中和反应,方程式见上)(3)碱盐 -------- 另一种碱另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 +Na2CO3 == CaCO3↓+ 2NaOH 3、盐的化学性质(1)盐(溶液)金属单质------- 另一种金属另一种盐74. 铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4 +Cu(2)盐酸-------- 另一种酸另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 +2HCl == 2NaCl +H2O+ CO2↑ 碳酸氢钠与稀盐酸反应:NaHCO3 +HCl== NaCl+ H2O +CO2↑ (3)盐碱 -------- 另一种碱另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 +Na2CO3 == CaCO3↓+ 2NaOH (4)盐盐 ----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl +AgNO3== AgCl↓+NaNO378.硫酸钠和氯化钡:Na2SO4 +BaCl2== BaSO4↓+2NaCl。
初中常见化学式及化学方程式大全

初中常见化学式及化学方程式常见的化学式一、常见单质氢气H2氮气N2氯气Cl2氧气O2臭氧O3氦气He 氖气Ne氩气Ar碳C硅Si硫S磷P碘I2钾K钙Ca钠Na镁Mg铝Al锌Zn 铁Fe铜Cu汞Hg银Ag二、化合物1、氧化物水H2O三氧化硫SO3一氧化碳CO二氧化碳CO2五氧化二磷P2O5过氧化氢H2O2二氧化氮NO2二氧化硫SO2氧化钙CaO氧化亚铁FeO氧化铁Fe2O3四氧化三铁Fe3O4氧化镁MgO氧化锌ZnO二氧化锰MnO22、其他化合物3、常见有机化合物初中化学方程式全(已配平).一、化合反应1、镁在空气中燃烧:2Mg+ O2点燃2MgO2、铁在氧气中燃烧:3Fe +2O2点燃Fe3O43、铝在空气中燃烧:4Al+ 3O2点燃2Al2O34、氢气在空气中燃烧:2H2 +O2点燃2H2O5、红磷在空气中燃烧:4P +5O2点燃2P2O56、硫粉在空气中燃烧:S+ O2点燃SO27、碳在氧气中充分燃烧:C +O点燃CO28、碳在氧气中不充分燃烧:2C +O2点燃2CO9、二氧化碳通过灼热碳层:C +CO2高温2CO10、一氧化碳在氧气中燃烧:2CO +O点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 +H2O === H2CO312、生石灰溶于水:CaO+ H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 +5H2O ==== CuSO4·5H2O14、钠在氯气中燃烧:2Na+ Cl2点燃2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O +O2↑16、加热高锰酸钾:2KMnO加热K2MnO4 + MnO2+O2↑17、水在直流电的作用下分解:2H2O 通电2H2↑+O2↑18、碳酸化学物理学报不稳定而分解:H2CO3 === H2O +CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温CaO+ CO2↑三、置换反应20、铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4 +Cu21、锌和稀硫酸反应(实验室制氢气):Zn+ H2SO4 == ZnSO4+H2↑22、镁和稀盐酸反应:Mg +2HCl === MgCl2 +H2↑23、氢气还原氧化铜:H2 +CuO 加热Cu +H2O24、木炭还原氧化铜:C+ 2CuO 高温2Cu +CO2↑25、甲烷在空气中燃烧:CH4 +2O点燃CO2+2H2O26、水蒸气通过灼热碳层:H2O +C 高温H2 +CO27、焦炭还原氧化铁:3C +2Fe2O3高温4Fe +3CO2↑其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+ CuSO4 == Cu(OH)2↓+ Na2SO429、甲烷在空气中燃烧:CH4 +2O2点燃CO2 +2H2O30、酒精在空气中燃烧:C2H5OH+ 3O2点燃2CO2 +3H2O31、一氧化碳还原氧化铜:CO +CuO 加热Cu+ CO232、一氧化碳还原氧化铁:3CO+ Fe2O3高温2Fe+ 3CO233、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+ CO2 ==== CaCO3 ↓+ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+ CO2 ==== Na2CO3 +H2O35、石灰石(或小学音乐教案大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 +2HCl === CaCl2 +H2O +CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3+ 2HCl === 2NaCl +H2O +CO2↑ 一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg+ O2点燃2MgO2. 铁在氧气中燃烧:3Fe+ 2O2点燃Fe3O43. 铜在空气中受热:2Cu+ O2加热2CuO4. 铝在空气中燃烧:4Al +3O2 点燃2Al2O35. 氢气中空气中燃烧:2H2 +O2点燃2H2O6. 红磷在空气中燃烧:4P+ 5O2点燃2P2O57. 硫粉在空气中燃烧:S +O点燃SO28. 碳在氧气中充分燃烧:C+ O2点燃CO29. 碳在氧气中不充分燃烧:2C+ O2点燃2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+ O2点燃2CO211. 甲烷在空气中燃烧:CH4 +2O2点燃CO2 2H2O12. 酒精在空气中燃烧:C2H5OH +3O2点燃2CO2+3H2O二.几个分解反应:13. 水在直流电的作用下分新概念英语第一册解:2H2O 通电2H2↑+ O2↑14. 加热碱式碳酸铜:Cu2(OH)2CO3加热2CuO +H2O +CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl+ 3O2↑16. 加热高锰酸钾:2KMnO4加热K2MnO4 +MnO2 +O2↑17. 碳酸不稳定而分解:H2CO3 === H2O +CO2↑18. 高温煅烧石灰石:CaCO高温CaO +CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2+ CuO 加热Cu+ H2O20. 木炭还原氧化铜:C+ 2CuO 高温2Cu +CO2↑2 初三化学方程式大合集21. 焦炭还原氧化铁:3C+ 2Fe2O高温4Fe+ 3CO2↑22. 焦炭还原四氧化三铁:2C +Fe3O4高温3Fe+ 2CO2↑23. 一氧化碳还原氧化铜:CO +CuO 加热Cu+ CO224. 一氧化碳还原氧化铁:3CO+ Fe2O3高温2Fe +3CO225. 一氧化碳还原四氧化三铁:4CO +Fe3O4高温3Fe+ 4CO2四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+酸-------- 盐+氢气(置换反应)26. 锌和稀硫酸Zn+ H2SO4 = ZnSO4+ H2↑27. 铁和稀硫酸Fe +H2SO4 = FeSO4+ H2↑28. 镁和稀硫酸Mg +H2SO4 = MgSO4 +H2↑29. 铝和稀硫酸2Al+ 3H2SO4 = Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn +2HCl === ZnCl2+ H2↑31. 铁和稀盐酸Fe+ 2HCl === FeCl2+ H2↑32. 镁和稀盐酸Mg +2HCl === MgCl2+ H2↑33. 铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑(2)金属单质+盐(溶液)------- 另一种金属+另一种盐34. 铁和硫酸铜溶液反应:Fe+ CuSO4 === FeSO4+ Cu35. 锌和硫酸铜溶液反应:Zn+ CuSO4 === ZnSO4+ Cu36. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2 === Cu(NO3)2 +Hg (3)碱性氧化物+酸-------- 盐+水37. 氧化铁和稀盐酸反应:Fe2O3+ 6HCl === 2FeCl3+ 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 +3H2SO4 === Fe2(SO4)3+ 3H2O39. 氧化铜和稀盐酸反应:CuO +2HCl ==== CuCl2 +H2O40. 氧化铜和稀硫酸反应:CuO +H2SO4 ==== CuSO4+ H2O41. 氧化镁和稀硫酸反应:MgO+ H2SO4 ==== MgSO4+ H2O42. 氧化钙和稀盐酸反应:CaO +2HCl ==== CaCl2 +H2O(4)酸性氧化物+碱-------- 盐+水43.苛性钠暴露在空气中变质:2NaOH +CO2 ==== Na2CO3+H2O 44.苛性钠吸收二氧化硫气体:2NaOH +SO2 ==== Na2SO3 +H2O 45.苛性钠吸收三氧化硫气体:2NaOH+ SO3 ==== Na2SO4+ H2O 46.消石灰放在空气中变质:Ca(OH)2+ CO2 ==== CaCO3 ↓+ H2O 47. 消石灰吸收二氧化硫:Ca(OH)2 +SO2 ==== CaSO3↓+H2O(5)酸+碱-------- 盐+水48.盐酸和烧碱起反应:HCl+ NaOH ==== NaCl+ H2O49. 盐酸和氢氧化钾反应:HCl+ KOH ==== KCl+H2O50.盐酸和氢氧化初中家长会课件铜反应:2HCl+ Cu(OH)2 ==== CuCl2 +2H2O51. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 ==== CaCl2 +2H2O52. 盐酸和氢氧化铁反应:3HCl+ Fe(OH)3 ==== FeCl3 +3H2O53.氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 ==== AlCl3 +3H2O54.硫酸和烧碱反应:H2SO4 +2NaOH ==== Na2SO4 +2H2O55.硫酸和氢氧化钾反应:H2SO4 +2KOH ==== K2SO4 +2H2O56.硫酸和氢氧化铜反应:H2SO4 +Cu(OH)2 ==== CuSO4 +2H2O57. 硫酸和氢氧化铁反应:3H2SO4 +2Fe(OH)3==== Fe2(SO4)3+ 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸+盐-------- 另一种酸+另一种盐59.大理石与稀盐酸反应:CaCO3 +2HCl === CaCl2 H2O +CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 +2HCl === 2NaCl +H2O+ CO2↑61.碳酸镁与稀盐酸反应: MgCO3 +2HCl === MgCl2 +H2O+CO2↑62.盐酸和硝酸银溶液反应:HCl+ AgNO3=== AgCl↓+ HNO363.硫酸和碳酸钠反应:Na2CO3 +H2SO4 === Na2SO4 +H2O +CO2↑64.硫酸和氯化钡溶液反应:H2SO4 +BaCl2 ==== BaSO4↓+ 2HCl(7)碱+盐-------- 另一种碱+另一种盐65.氢氧化钠与硫酸铜:2NaOH CuSO4 ==== Cu(OH)2↓ Na2SO466.氢氧化钠与氯化铁:3NaOH FeCl3 ==== Fe(OH)3↓ 3NaCl67.氢氧化钠与氯化镁:2NaOH MgCl2 ==== Mg(OH)2↓ 2NaCl68. 氢氧化钠与氯化铜:2NaOH CuCl2 ==== Cu(OH)2↓ 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 Na2CO3 === CaCO3↓ 2NaOH(8)盐+盐----- 两种新盐70.氯化钠溶液新概念英语第二册和硝酸银溶液:NaCl +AgNO3==== AgCl↓+ NaNO3 71.硫酸钠和氯化钡:Na2SO4+ BaCl2 ==== BaSO4↓+ 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2+ H2O === H2CO373.生石灰溶于水:CaO+ H2O === Ca(OH)274.氧化钠溶于水:Na2O +H2O ==== 2NaOH75.三氧化硫溶于水:SO3 +H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热CuSO4 5H2O77.无水硫酸铜作干燥剂:CuSO4+ 5H2O ==== CuSO4·5H2化学方程式反应现象应用2Mg+ O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg +O点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+ O点燃或Δ2CuO 红色金属变为黑色固体4Al+ 3O点燃或Δ2Al2O3银白金属变为白色固体3Fe+ 2O点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热4Fe +3O2高温2Fe2O3 C+ O2点燃CO2剧烈燃烧、白光、放热、使石灰水变浑浊S +O2点燃SO2剧大学英语四级烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2 O2点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P +5O2 点燃2P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2点燃2H2O+ CO2蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+ 5O点燃2H2O +4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO2、Δ2KCl +3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气2KMnO4Δ K2MnO4 MnO2 +O2↑ 紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧论文气2HgOΔ2Hg+ O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+ O2↑ 水通电分解为氢气和氧气电解水Cu2(OH)2CO3Δ2CuO +H2O+ CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3ΔNH3↑+ H2O+ CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+ H2SO4=ZnSO4 +H2↑ 有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe +H2SO4=FeSO4 +H2↑ 有大量气泡产生、金属颗粒逐渐溶解Mg +H2SO4 =MgSO4 +H2↑ 有大量气泡产生、金属颗粒逐渐溶解2Al+ 3H2SO4=Al2(SO4)3+ 3H2↑ 有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2Δ 2Fe +3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4 +4H2 Δ3Fe+ 4H2O 黑色逐渐变为银白色英语翻译、试管壁有液体冶炼金属、利用氢气的还原性WO3 +3H2Δ W +3H2O 冶炼金属钨、利用氢气的还原性MoO3 +3H2ΔMo +3H2O 冶炼金属钼、利用氢气的还原性2Na+ Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2 +Cl2点燃或光照2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4 +2NaOH=Cu(OH)2↓+ Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C +O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2CO +O点燃2CO2蓝色火焰煤气燃烧C+ CuO 高温2Cu+ CO2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+ 3C 高温4Fe+ 3CO2↑ 冶炼金属Fe3O4 +2C高温3Fe+ 2CO2↑ 冶炼金属C+ CO2 高温2COCO2+H2O = H2CO3碳酸使石蕊变红证明碳酸的酸性小学三语文教学论文H2CO3 ΔCO2↑+ H2O 石蕊红色褪去Ca(OH)2 +CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3 +H2O+ CO2 = Ca(HCO3)2 白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2Δ CaCO3↓+ H2O +CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3+ H2O +CO2↑ 产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO高温CaO +CO2↑ 工业制备二氧化碳和生石灰CaCO3 +2HCl=CaCl2+ H2O +CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢初中化学方程式汇总一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg+ O2点燃2MgO2. 铁在氧气中燃烧:3Fe+ 2O2点燃Fe3O43. 铜在空气中受热:2Cu+ O2加热2CuO4. 铝在空气中燃烧:4Al +3O2 点燃2Al2O35. 氢气中空气中燃烧:2H2 +O点燃2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P +5O2点燃2P2O57. 硫粉在空气中燃烧:S +O点燃SO28. 碳在氧气中充分燃烧:C +O2点燃CO29. 碳在氧气中不充分燃烧:2C +O2点燃2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+O2点燃2CO211. 甲烷在空气中燃烧:CH4 +2O2点燃CO2 +2H2O12. 酒精在空气中燃烧:C2H5OH +3O2点燃2CO2 +3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验2HgO 加热Hg +O2 ↑14.加热高锰酸钾:2KMnO4加热K2MnO4+ MnO2 +O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应:H2O2 MnO22H2O+ O2↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电2H2↑+O2 ↑ 17.生石灰溶于水英语六级作文:CaO +H2O == Ca(OH)218.二氧化碳可溶于水:H2O+CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg+ O2点燃2MgO20.铁和硫酸铜溶液反应:Fe+ CuSO4 === FeSO4+ Cu21.氢气还原氧化铜:H2 +CuO 加热Cu +H2O22. 镁还原氧化铜:Mg+ CuO 加热Cu +MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2点燃CO224.木炭还原氧化铜:C + 2CuO 高温2Cu+ CO2↑25.焦炭还原氧化铁:3C + 2Fe2O3高温4Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C +O点燃CO227.煤炉的中层:CO2+ C 高温2CO28.煤炉的上部蓝色火焰的产生:2CO +O2点燃2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3+ 2HCl == CaCl2+ H2O +CO2↑30.碳酸不稳定而分解:H2CO3 == H2O +CO2↑31.二氧化碳可溶于水:H2O +CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3高温CaO+ CO2↑ 33.石灰水与中学历史教学园地二氧化碳反应(鉴别二氧化碳):Ca(OH)2 +CO2 === CaCO3↓+H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO 加热Cu +CO235.一氧化碳的可燃性:2CO +O2点燃2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 2HCl == 2NaCl+ H2O +CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 +2O2点燃CO2 +2H2O 38.酒精在空气中燃烧:C2H5OH +3O2 点燃2CO2 +3H2O 39.氢气中空气中燃烧:2H2+ O2点燃2H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg+ O2点燃2MgO41.铁在氧气中燃烧:3Fe +2O2点燃Fe3O442. 铜在空气中受热:2Cu +O2加热2CuO43. 铝在空气中形成氧化膜:4Al+ 3O2 = 2Al2O3(2)金属单质酸-------- 盐氢气(置换反应)44. 锌和稀硫酸Zn+ H2SO4 = ZnSO4+ H2↑45. 铁和稀硫酸Fe +H2SO4 = FeSO4 +H2↑46. 镁和稀硫酸Mg +H2SO4 = MgSO4+ H2↑47. 铝和稀硫酸2Al+ 3H2SO4 = Al2(SO4)3 +3H2↑48. 锌和稀盐酸Zn+ 2HCl == ZnCl2+ H2↑49. 铁和稀盐酸Fe +2HCl == FeCl2 +H2↑50. 镁和稀盐酸Mg +2HCl == MgCl2+ H2↑51.铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑(3)金属单质盐怎样学好高中物理(溶液)------- 新金属新盐52. 铁和硫酸铜溶液反应:Fe +CuSO4 == FeSO4 +Cu53. 锌和硫酸铜溶液反应:Zn +CuSO4 ==ZnSO4 +Cu54. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2 == Cu(NO3)2 +Hg (3)金属铁的治炼原理:55.3CO +2Fe2O3 高温4Fe +3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸金属-------- 盐氢气(见上)(2)酸金属氧化物-------- 盐水56. 氧化铁和稀盐酸反应:Fe2O3 +6HCl ==2FeCl3 +3H2O57. 氧化铁和稀硫酸反应:Fe2O3 +3H2SO4 == Fe2(SO4)3 +3H2O58. 氧化铜和稀盐酸反应:CuO +2HCl ==CuCl2 +H2O59. 氧化铜和稀硫酸反应:CuO+ H2SO4 == CuSO4+ H2O(3)酸碱-------- 盐水(中和反应)60.盐酸和烧碱起反应:HCl +NaOH == NaCl+H2O61. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 == CaCl2+2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 == AlCl3 +3H2O63. 硫酸和烧碱反应:H2SO4+ 2NaOH == Na2SO4 +2H2O(4)酸盐-------- 另一种酸另一种盐64.大理石与稀盐酸反应:CaCO3+2HCl == CaCl2 +H2O+ CO2↑ 65.碳酸钠与稀盐酸反应: Na2CO3 +2HCl == 2NaCl+ H2O+ CO2↑ 66.碳酸氢钠与稀盐酸反应:NaHCO3 +HCl== NaCl+H2O+ CO2↑ 67. 硫酸和氯化钡溶液反应:H2SO4 +BaCl2 == BaSO4↓+2HCl2、碱的幼儿园小班音乐教案化学性质(1)碱非金属氧化物-------- 盐水68.苛性钠暴露在空气中变质:2NaOH+CO2 == Na2CO3+ H2O 69.苛性钠吸收二氧化硫气体:2NaOH +SO2 == Na2SO3 +H2O 70.苛性钠吸收三氧化硫气体:2NaOH+ SO3 == Na2SO4 +H2O 71.消石灰放在空气中变质:Ca(OH)2+ CO2 == CaCO3↓+H2O 72. 消石灰吸收二氧化硫:Ca(OH)2 +SO2 == CaSO3↓+ H2O (2)碱酸-------- 盐水(中和反应,方程式见上)(3)碱盐-------- 另一种碱另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 +Na2CO3 == CaCO3↓+ 2NaOH 3、盐的化学性质(1)盐(溶液)金属单质------- 另一种金属另一种盐74. 铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4 +Cu(2)盐酸-------- 另一种酸另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 +2HCl == 2NaCl +H2O+ CO2↑碳酸氢钠与稀盐酸反应:NaHCO 3 +HCl== NaCl+ H 2O +CO 2↑(3)盐 碱 -------- 另一种碱 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 +Na 2CO 3 == CaCO 3↓+ 2NaOH(4)盐 盐 ----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl +AgNO 3 == AgCl↓+NaNO 378.硫酸钠和氯化钡:Na 2SO 4 +BaCl 2 == BaSO4↓+2NaCl一、其他反应类型1、二氧化碳通入澄清石灰水中:CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O2、氢氧化钠在空气中变质:CO 2+ 2NaOH = Na 2CO 3 + H 2O3、氢氧化钠溶液吸收二氧化硫:SO 2 + 2NaOH ==Na 2SO 3+ H 2O4、一氧化碳还原氧化铜:CO + CuO Cu + CO 25、酒精燃烧:C 2H 5OH + 3O 2 2CO 2 + 3H 2O6、甲烷燃烧:CH 4 + 2O 2 CO 2 + 2H 2O △点点。
初中常见化学式及化学方程式大全

初中常见化学式一、常见单质二、化合物1、氧化物2、其他化合物3、常见有机化合物初中化学方程式全(已配平).一、化合反应1、镁在空气中燃烧:2Mg+O点燃2MgO2、铁在氧气中燃烧:3Fe+2O点燃Fe3O43、铝在空气中燃烧:4Al+3O点燃2Al2O34、氢气在空气中燃烧:2H2+O点燃2H2O5、红磷在空气中燃烧:4P+5O点燃2P2O56、硫粉在空气中燃烧:S+O点燃SO27、碳在氧气中充分燃烧:C+O点燃CO28、碳在氧气中不充分燃烧:2C+O点燃2CO9、二氧化碳通过灼热碳层:C+CO高温2CO10、一氧化碳在氧气中燃烧:2CO+O点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O===H2CO312、生石灰溶于水:CaO+H2O===Ca(OH)213、无水硫酸铜作干燥剂:CuSO4+5H2O====CuSO4·5H2O14、钠在氯气中燃烧:2Na+Cl点燃2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2MnO22H2O+O2↑16、加热高锰酸钾:2KMnO加热K2MnO4+MnO2+O2↑17、水在直流电的作用下分解:2H2O通电2H2↑+O2↑18、碳酸化学物理学报不稳定而分解:H2CO3===H2O+CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO高温CaO+CO2↑三、置换反应20、铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu21、锌和稀硫酸反应(实验室制氢气):Zn+H2SO4==ZnSO4+H2↑22、镁和稀盐酸反应:Mg+2HCl===MgCl2+H2↑23、氢气还原氧化铜:H2+CuO加热Cu+H2O24、木炭还原氧化铜:C+2CuO高温2Cu+CO2↑25、甲烷在空气中燃烧:CH4+2O点燃CO2+2H2O26、水蒸气通过灼热碳层:H2O+C高温H2+CO27、焦炭还原氧化铁:3C+2Fe2O高温4Fe+3CO2↑其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+CuSO4==Cu(OH)2↓+Na2SO429、甲烷在空气中燃烧:CH4+2O点燃CO2+2H2O30、酒精在空气中燃烧:C2H5OH+3O点燃2CO2+3H2O31、一氧化碳还原氧化铜:CO+CuO加热Cu+CO232、一氧化碳还原氧化铁:3CO+Fe2O高温2Fe+3CO233、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+CO2====CaCO3↓+H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+CO2====Na2CO3+H2O35、石灰石(或小学音乐教案大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3+2HCl===CaCl2+H2O+CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理):Na2CO3+2HCl===2NaCl+H2O+CO2↑一.物质与氧气的反应:(1)单质与氧气的反应:1.镁在空气中燃烧:2Mg+O点燃2MgO2.铁在氧气中燃烧:3Fe+2O点燃Fe3O43.铜在空气中受热:2Cu+O加热2CuO4.铝在空气中燃烧:4Al+3O点燃2Al2O35.氢气中空气中燃烧:2H2+O点燃2H2O6.红磷在空气中燃烧:4P+5O点燃2P2O57.硫粉在空气中燃烧:S+O点燃SO28.碳在氧气中充分燃烧:C+O点燃CO29.碳在氧气中不充分燃烧:2C+O点燃2CO(2)化合物与氧气的反应:10.一氧化碳在氧气中燃烧:2CO+O点燃2CO211.甲烷在空气中燃烧:CH4+2O点燃CO22H2O12.酒精在空气中燃烧:C2H5OH+3O点燃2CO2+3H2O二.几个分解反应:13.水在直流电的作用下分新概念英语第一册解:2H2O通电2H2↑+O2↑14.加热碱式碳酸铜:Cu2(OH)2CO加热2CuO+H2O+CO2↑15.加热氯酸钾(有少量的二氧化锰):2KClO3====2KCl+3O2↑16.加热高锰酸钾:2KMnO4加热K2MnO4+MnO2+O2↑17.碳酸不稳定而分解:H2CO3===H2O+CO2↑18.高温煅烧石灰石:CaCO高温CaO+CO2↑三.几个氧化还原反应:19.氢气还原氧化铜:H2+CuO加热Cu+H2O20.木炭还原氧化铜:C+2CuO高温2Cu+CO2↑2初三化学方程式大合集21.焦炭还原氧化铁:3C+2Fe2O高温4Fe+3CO2↑22.焦炭还原四氧化三铁:2C+Fe3O高温3Fe+2CO2↑23.一氧化碳还原氧化铜:CO+CuO加热Cu+CO224.一氧化碳还原氧化铁:3CO+Fe2O高温2Fe+3CO225.一氧化碳还原四氧化三铁:4CO+Fe3O高温3Fe+4CO2四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+酸--------盐+氢气(置换反应)26.锌和稀硫酸Zn+H2SO4=ZnSO4+H2↑27.铁和稀硫酸Fe+H2SO4=FeSO4+H2↑28.镁和稀硫酸Mg+H2SO4=MgSO4+H2↑29.铝和稀硫酸2Al+3H2SO4=Al2(SO4)3+3H2↑30.锌和稀盐酸Zn+2HCl===ZnCl2+H2↑31.铁和稀盐酸Fe+2HCl===FeCl2+H2↑32.镁和语文教案格式稀盐酸Mg2HCl===MgCl2+H2↑33.铝和稀盐酸2Al+6HCl==2AlCl3+3H2↑(2)金属单质+盐(溶液)-------另一种金属+另一种盐34.铁和硫酸铜溶液反应:Fe+CuSO4===FeSO4+Cu35.锌和硫酸铜溶液反应:Zn+CuSO4===ZnSO4+Cu36.铜和硝酸汞溶液反应:Cu+Hg(NO3)2===Cu(NO3)2+Hg (3)碱性氧化物+酸--------盐+水37.氧化铁和稀盐酸反应:Fe2O3+6HCl===2FeCl3+3H2O38.氧化铁和稀硫酸反应:Fe2O3+3H2SO4===Fe2(SO4)3+3H2O39.氧化铜和稀盐酸反应:CuO+2HCl====CuCl2+H2O40.氧化铜和稀硫酸反应:CuO+H2SO4====CuSO4+H2O41.氧化镁和稀硫酸反应:MgO+H2SO4====MgSO4+H2O42.氧化钙和稀盐酸反应:CaO+2HCl====CaCl2+H2O(4)酸性氧化物+碱--------盐+水43.苛性钠暴露在空气中变质:2NaOH+CO2====Na2CO3+H2O44.苛性钠吸收二氧化硫气体:2NaOH+SO2====Na2SO3+H2O45.苛性钠吸收三氧化硫气体:2NaOH+SO3====Na2SO4+H2O46.消石灰放在空气中变质:Ca(OH)2+CO2====CaCO3↓+H2O47.消石灰吸收二氧化硫:Ca(OH)2+SO2====CaSO3↓+H2O(5)酸+碱--------盐+水48.盐酸和烧碱起反应:HCl+NaOH====NaCl+H2O49.盐酸和氢氧化钾反应:HCl+KOH====KCl+H2O50.盐酸和氢氧化初中家长会课件铜反应:2HCl+Cu(OH)2====CuCl2+2H2O51.盐酸和氢氧化钙反应:2HCl+Ca(OH)2====CaCl2+2H2O52.盐酸和氢氧化铁反应:3HCl+Fe(OH)3====FeCl3+3H2O53.氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)3====AlCl3+3H2O54.硫酸和烧碱反应:H2SO4+2NaOH====Na2SO4+2H2O55.硫酸和氢氧化钾反应:H2SO4+2KOH====K2SO4+2H2O56.硫酸和氢氧化铜反应:H2SO4+Cu(OH)2====CuSO4+2H2O57.硫酸和氢氧化铁反应:3H2SO4+2Fe(OH)3====Fe2(SO4)3+6H2O58.硝酸和烧碱反应:HNO3+NaOH====NaNO3+H2O(6)酸+盐--------另一种酸+另一种盐59.大理石与稀盐酸反应:CaCO3+2HCl===CaCl2H2O+CO2↑60.碳酸钠与稀盐酸反应:Na2CO3+2HCl===2NaCl+H2O+CO2↑61.碳酸镁与稀盐酸反应:MgCO3+2HCl===MgCl2+H2O+CO2↑62.盐酸和硝酸银溶液反应:HCl+AgNO3===AgCl↓+HNO363.硫酸和碳酸钠反应:Na2CO3+H2SO4===Na2SO4+H2O+CO2↑64.硫酸和氯化钡溶液反应:H2S O4+BaCl2====BaSO4↓+2HCl(7)碱+盐--------另一种碱+另一种盐65.氢氧化钠与硫酸铜:2NaOHCuSO4====Cu(OH)2↓Na2SO466.氢氧化钠与氯化铁:3NaOHFeCl3====Fe(OH)3↓3NaCl67.氢氧化钠与氯化镁:2NaOHMgCl2====Mg(OH)2↓2NaCl68.氢氧化钠与氯化铜:2NaOHCuCl2====Cu(OH)2↓2NaCl69.氢氧化钙与碳酸钠:Ca(OH)2Na2CO3===CaCO3↓2NaOH(8)盐+盐-----两种新盐70.氯化钠溶液新概念英语第二册和硝酸银溶液:NaCl+AgNO3====AgCl↓+NaNO371.硫酸钠和氯化钡:Na2SO4+BaCl2====BaSO4↓+2NaCl五.其它反应:72.二氧化碳溶解于水:CO2+H2O===H2CO373.生石灰溶于水:CaO+H2O===Ca(OH)274.氧化钠溶于水:Na2O+H2O====2NaOH75.三氧化硫溶于水:SO3+H2O====H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O加热CuSO45H2O77.无水硫酸铜作干燥剂:CuSO4+5H2O====CuSO4·5H2化学方程式反应现象应用2Mg+O点燃或Δ2MgO剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg+O点燃或Δ2HgO银白液体、生成红色固体拉瓦锡实验2Cu+O点燃或Δ2CuO红色金属变为黑色固体4Al+3O点燃或Δ2Al2O3银白金属变为白色固体3Fe+2O点燃Fe3O4剧烈燃烧、火星四射、生成黑色固体、放热4Fe+3O2高温2Fe2O3C+O点燃CO2剧烈燃烧、白光、放热、使石灰水变浑浊S+O点燃SO2剧大学英语四级烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2O点燃2H2O淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P+5O2点燃2P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2点燃2H2O+CO2蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+5O点燃2H2O+4CO2蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO2、Δ2KCl+3O2↑生成使带火星的木条复燃的气体实验室制备氧气2KMnO4ΔK2MnO4MnO2+O2↑紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧论文气2HgOΔ2Hg+O2↑红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+O2↑水通电分解为氢气和氧气电解水Cu2(OH)2CO3Δ2CuO+H2O+CO2↑绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3ΔNH3↑+H2O+CO2↑白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+H2SO4=ZnSO4+H2↑有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe+H2SO4=FeSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解Mg+H2SO4=MgSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解2Al+3H2SO4=Al2(SO4)3+3H2↑有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2Δ2Fe+3H2O红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4+4H2Δ3Fe+4H2O黑色逐渐变为银白色英语翻译、试管壁有液体冶炼金属、利用氢气的还原性WO3+3H2ΔW+3H2O冶炼金属钨、利用氢气的还原性MoO3+3H2ΔMo+3H2O冶炼金属钼、利用氢气的还原性2Na+Cl2Δ或点燃2NaCl剧烈燃烧、黄色火焰离子化合物的形成、H2+Cl点燃或光照2HCl点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4+2NaOH=Cu(OH)2↓+Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C+O点燃2CO煤炉中常见反应、空气污染物之一、煤气中毒原因2CO+O点燃2CO2蓝色火焰煤气燃烧C+CuO高温2Cu+CO2↑黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+3C高温4Fe+3CO2↑冶炼金属Fe3O4+2C高温3Fe+2CO2↑冶炼金属C+CO2高温2COCO2+H2O=H2CO3碳酸使石蕊变红证明碳酸的酸性小学三语文教学论文H2CO3ΔCO2↑+H2O石蕊红色褪去Ca(OH)2+CO2=CaCO3↓+H2O澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3+H2O+CO2=Ca(HCO3)2白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2ΔCaCO3↓+H2O+CO2↑白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3+H2O+CO2↑产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO高温CaO+CO2↑工业制备二氧化碳和生石灰CaCO3+2HCl=CaCl2+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢初中化学方程式汇总一、氧气的性质:(1)单质与氧气的反应:(化合反应)1.镁在空气中燃烧:2Mg+O点燃2MgO2.铁在氧气中燃烧:3Fe+2O点燃Fe3O43.铜在空气中受热:2Cu+O加热2CuO4.铝在空气中燃烧:4Al+3O2点燃2Al2O35.氢气中空气中燃烧:2H2+O点燃2H2O6.红磷在空气中燃烧(研究空气组成的实验):4P+5O点燃2P2O57.硫粉在空气中燃烧:S+O点燃SO28.碳在氧气中充分燃烧:C+O点燃CO29.碳在氧气中不充分燃烧:2C+O点燃2CO(2)化合物与氧气的反应:10.一氧化碳在氧气中燃烧:2CO+O点燃2CO211.甲烷在空气中燃烧:CH4+2O点燃CO2+2H2O12.酒精在空气中燃烧:C2H5OH+3O点燃2CO2+3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验2HgO加热Hg+O2↑14.加热高锰酸钾:2KMnO加热K2MnO4+MnO2+O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应:H2O2MnO22H2O+O2↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O通电2H2↑+O2↑17.生石灰溶于水:CaO+H2O==Ca(OH)218.二氧化碳可溶于水:H2O+CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg+O点燃2MgO20.铁和硫酸铜溶液反应:Fe+CuSO4===FeSO4+Cu21.氢气还原氧化铜:H2+CuO加热Cu+H2O22.镁还原氧化铜:Mg+CuO加热Cu+MgO四、碳和碳的氧化物:(1)碳的化学性质23.碳在氧气中充分燃烧:C+O点燃CO224.木炭还原氧化铜:C+2CuO高温2Cu+CO2↑25.焦炭还原氧化铁:3C+2Fe2O高温4Fe+3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C+O点燃CO227.煤炉的中层:CO2+C高温2CO28.煤炉的上部蓝色火焰的产生:2CO+O点燃2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3+2HCl==CaCl2+H2O+CO2↑30.碳酸不稳定而分解:H2CO3==H2O+CO2↑31.二氧化碳可溶于水:H2O+CO2==H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO高温CaO+CO2↑33.石灰水与中学历史教学园地二氧化碳反应(鉴别二氧化碳):Ca(OH)2+CO2===CaCO3↓+H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+CuO加热Cu+CO235.一氧化碳的可燃性:2CO+O点燃2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO32HCl==2NaCl+H2O+CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4+2O点燃CO2+2H2O38.酒精在空气中燃烧:C2H5OH+3O2点燃2CO2+3H2O39.氢气中空气中燃烧:2H2+O点燃2H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg+O点燃2MgO41.铁在氧气中燃烧:3Fe+2O点燃Fe3O442.铜在空气中受热:2Cu+O加热2CuO43.铝在空气中形成氧化膜:4Al+3O2=2Al2O3(2)金属单质酸--------盐氢气(置换反应)44.锌和稀硫酸Zn+H2SO4=ZnSO4+H2↑45.铁和稀硫酸Fe+H2SO4=FeSO4+H2↑46.镁和稀硫酸Mg+H2SO4=MgSO4+H2↑47.铝和稀硫酸2Al+3H2SO4=Al2(SO4)3+3H2↑48.锌和稀盐酸Zn+2HCl==ZnCl2+H2↑49.铁和稀盐酸Fe+2HCl==FeCl2+H2↑50.镁和稀盐酸Mg+2HCl==MgCl2+H2↑51.铝和稀盐酸2Al+6HCl==2AlCl3+3H2↑(3)金属单质盐怎样学好高中物理(溶液)-------新金属新盐52.铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu53.锌和硫酸铜溶液反应:Zn+CuSO4==ZnSO4+Cu54.铜和硝酸汞溶液反应:Cu+Hg(NO3)2==Cu(NO3)2+Hg(3)金属铁的治炼原理:55.3CO+2Fe2O3高温4Fe+3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸金属--------盐氢气(见上)(2)酸金属氧化物--------盐水56.氧化铁和稀盐酸反应:Fe2O3+6HCl==2FeCl3+3H2O57.氧化铁和稀硫酸反应:Fe2O3+3H2SO4==Fe2(SO4)3+3H2O58.氧化铜和稀盐酸反应:CuO+2HCl==CuCl2+H2O59.氧化铜和稀硫酸反应:CuO+H2SO4==CuSO4+H2O(3)酸碱--------盐水(中和反应)60.盐酸和烧碱起反应:HCl+NaOH==NaCl+H2O61.盐酸和氢氧化钙反应:2HCl+Ca(OH)2==CaCl2+2H2O62.氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)3==AlCl3+3H2O63.硫酸和烧碱反应:H2SO4+2NaOH==Na2SO4+2H2O(4)酸盐--------另一种酸另一种盐64.大理石与稀盐酸反应:CaCO3+2HCl==CaCl2+H2O+CO2↑65.碳酸钠与稀盐酸反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3+HCl==NaCl+H2O+CO2↑67.硫酸和氯化钡溶液反应:H2SO4+BaCl2==BaSO4↓+2HCl2、碱的幼儿园小班音乐教案化学性质(1)碱非金属氧化物--------盐水68.苛性钠暴露在空气中变质:2NaOH+CO2==Na2CO3+H2O 69.苛性钠吸收二氧化硫气体:2NaOH+SO2==Na2SO3+H2O 70.苛性钠吸收三氧化硫气体:2NaOH+SO3==Na2SO4+H2O 71.消石灰放在空气中变质:Ca(OH)2+CO2==CaCO3↓+H2O 72.消石灰吸收二氧化硫:Ca(OH)2+SO2==CaSO3↓+H2O(2)碱酸--------盐水(中和反应,方程式见上)(3)碱盐--------另一种碱另一种盐73.氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH3、盐的化学性质(1)盐(溶液)金属单质-------另一种金属另一种盐74.铁和硫酸铜溶液反应:Fe+CuSO 4==FeSO 4+Cu(2)盐酸--------另一种酸另一种盐75.碳酸钠与稀盐酸反应:Na 2CO 3+2HCl==2NaCl+H 2O+CO 2↑ 碳酸氢钠与稀盐酸反应:NaHCO 3+HCl==NaCl+H 2O+CO 2↑(3)盐碱--------另一种碱另一种盐76.氢氧化钙与碳酸钠:Ca(OH)2+Na 2CO 3==CaCO 3↓+2NaOH(4)盐盐-----两种新盐77.氯化钠溶液和硝酸银溶液:NaCl+AgNO 3==AgCl↓+NaNO 378.硫酸钠和氯化钡:Na 2SO 4+BaCl 2==BaSO4↓+2NaCl一、其他反应类型1、二氧化碳通入澄清石灰水中:CO 2+Ca(OH)2==CaCO 3↓+H 2O2、氢氧化钠在空气中变质:CO 2+2NaOH=Na 2CO 3+H 2O3、氢氧化钠溶液吸收二氧化硫:SO 2+2NaOH==Na 2SO 3+H 2O4、一氧化碳还原氧化铜:CO+CuOCu+CO 25、酒精燃烧:C 2H 5OH+3O 22CO 2+3H 2O6、甲烷燃烧:CH 4+2O 2CO 2+2H 2O △点燃 点燃。
初中历史常见物质化学式书写练习

初中历史常见物质化学式书写练习
在研究历史的过程中,了解常见物质的化学式是十分重要的。
通过了解这些物质的化学式,我们可以更好地理解它们的性质和作用。
以下是一些常见物质的化学式书写练。
1. 氧气:
氧气是一种气体,化学式为O2。
氧气是生物体进行呼吸所必需的。
它还与其他物质反应,例如火焰燃烧以及金属氧化。
2. 二氧化碳:
二氧化碳是一种无色无味的气体,化学式为CO2。
它是空气中的一部分,也是动物呼吸排出的废气。
二氧化碳还参与植物光合作用,并在燃烧过程中产生。
3. 水:
水是一种无色透明的液体,化学式为H2O。
水是地球上最常见的物质之一,也是生命存在的基础。
它具有很高的溶解性,是许多化学反应的媒介。
4. 盐:
盐是一种晶体,化学式为NaCl。
它是一种常见的调味品,同时也是一种重要的食物添加剂。
盐在食物加工和保存中起到了重要作用。
5. 金属铁:
金属铁是一种坚固的金属,化学式为Fe。
它是地球上最常见的金属之一,被广泛用于制造工具和建筑材料。
铁还参与了一些重要的化学反应,例如铁的氧化和腐蚀。
通过对这些常见物质的化学式书写练,我们可以更深入地了解它们的性质和作用。
这有助于我们在研究历史时更好地理解其中的化学过程和联系。
初中常见化学式及化学方程式大全
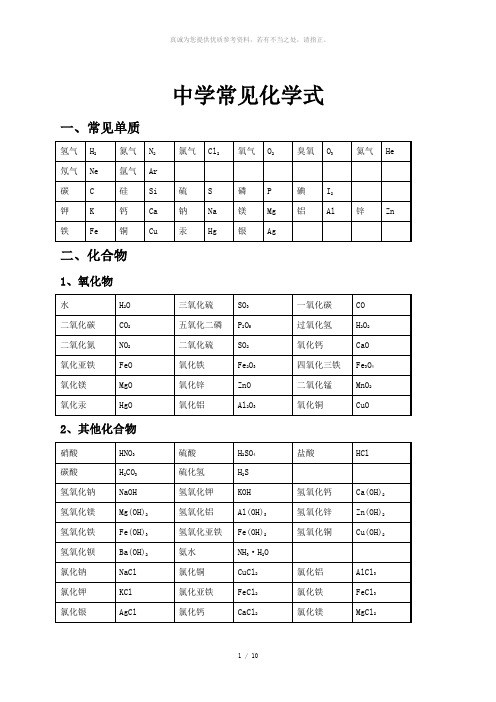
中学常见化学式一、常见单质二、化合物1、氧化物2、其他化合物3、常见有机化合物初中化学方程式汇总一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg+ O2点燃 2MgO2. 铁在氧气中燃烧:3Fe+ 2O2点燃 Fe3O43. 铜在空气中受热:2Cu+ O2加热 2CuO4. 铝在空气中燃烧:4Al +3O2 点燃2Al2O 35. 氢气中空气中燃烧:2H2 +O2点燃 2H2O6. :4P +5O2点燃 2P2O57. 硫粉在空气中燃烧: S +O2 点燃 SO28. 碳在氧气中充分燃烧:2点燃 CO29. 碳在氧气中不充分燃烧:2C +O2点燃 2CO (2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+O2点燃 2CO211. 甲烷在空气中燃烧:CH4 +2O2点燃 CO2+2H2O12. 酒精在空气中燃烧:C2H52点燃 2CO2+3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验 2HgO 加热 Hg +O2↑14.加热高锰酸钾:2KMnO4加热 K242+O2↑(实验室制氧气原理1)15 H2O2MnO22H2O+ O2↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电 2H2↑+O2↑17.生石灰溶于水英语六级作文:CaO+H2O == Ca(OH)218.二氧化碳可溶于水: H2O+CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg+ O2点燃 2MgO20.铁和硫酸铜溶液反应:44+ Cu21.氢气还原氧化铜:H2 +CuO 加热 Cu +H2O22. 镁还原氧化铜:Mg+ CuO 加热 Cu +MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2点燃 CO224.木炭还原氧化铜:C + 2CuO 高温 2Cu+ CO2↑25.焦炭还原氧化铁:3高温 4Fe + 3CO2↑(2)煤炉中发生的三个反应:26.煤炉的底层:C +O2 点燃 CO227.煤炉的中层:CO2+ C 高温 2CO282CO +O2点燃 2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3+ 2HCl == CaCl2+ H2O +CO2↑30.碳酸不稳定而分解:H2CO3== H2O +CO2↑31.二氧化碳可溶于水: H2O +CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3高温 CaO+ CO2↑33:Ca(OH)2 +CO2=== CaCO3↓+H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO 加热 Cu +CO235.一氧化碳的可燃性:2CO +O2点燃 2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO32HCl == 2NaCl+ H2O +CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 +2O2点燃 CO2+2H2O38.酒精在空气中燃烧:C2H5OH +3O2 点燃 2CO2+3H2O39.氢气中空气中燃烧:2H2+ O2点燃 2H2六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg+ O2点燃 2MgO41.铁在氧气中燃烧:3Fe +2O2点燃 Fe3O442. 铜在空气中受热:2Cu +O2加热 2CuO43. 铝在空气中形成氧化膜:2 = 2Al2O3(2)金属单质酸 -------- 盐氢气(置换反应)44. 锌和稀硫酸Zn+ H 2SO 4 = ZnSO 4+ H 2↑45. 铁和稀硫酸Fe +H 2SO 4 = FeSO 4 +H 2↑ 46. 镁和稀硫酸Mg +H 2SO 4 = MgSO 4+ H 2↑47. 铝和稀硫酸2Al+ 3H 2SO 4 = Al 2(SO 4)3 +3H 2↑ 48. 锌和稀盐酸Zn+ 2HCl == ZnCl 2+ H 2↑ 49. 铁和稀盐酸Fe +2HCl == FeCl 2 +H 2↑ 50. 镁和稀盐酸Mg +2HCl == MgCl 2+ H 2↑ 51.铝和稀盐酸2Al+ 6HCl == 2AlCl 3 +3H 2↑(3)金属单质 盐怎样学好高中物理(溶液) ------- 新金属 新盐 52. 铁和硫酸铜溶液反应:Fe +CuSO 4 == FeSO 4 +Cu 53. 锌和硫酸铜溶液反应:Zn +CuSO 4 ==ZnSO 4 +Cu54. 铜和硝酸汞溶液反应:Cu +Hg(NO 3)2 == Cu(NO 3)2 +Hg (3)金属铁的治炼原理:55.3CO +2Fe 2O 3 高温 4Fe +3CO 2↑七、酸、碱、盐1、酸的化学性质(1)酸 金属 -------- 盐 氢气(见上) (2)酸 金属氧化物-------- 盐 水56. 氧化铁和稀盐酸反应:Fe 2O 3 +6HCl ==2FeCl 3 +3H 2O57. 氧化铁和稀硫酸反应:Fe 2O 3 +3H2SO4 == Fe 2(SO4)3 +3H 2O 58. 氧化铜和稀盐酸反应:CuO +2HCl ==CuCl 2 +H2O 59. 氧化铜和稀硫酸反应:CuO+ H 2SO4 == CuSO 4+ H 2O (3)酸 碱 -------- 盐 水(中和反应)60.盐酸和烧碱起反应:HCl +NaOH == NaCl+H 2O61. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 == CaCl 2+2H 2O62. 氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 == AlCl 3 +3H 2O 63. 硫酸和烧碱反应:H 2SO 4+ 2NaOH == Na 2SO 4 +2H 2O (4)酸 盐 -------- 另一种酸 另一种盐64.大理石与稀盐酸反应:CaCO 3+ 2HCl == CaCl 2 +H 2O+ CO 2↑ 65.碳酸钠与稀盐酸反应: Na 2CO 3 +2HCl == 2NaCl+ H 2O+ CO 2↑ 66.碳酸氢钠与稀盐酸反应:NaHCO 3 +HCl== NaCl+H 2O+ CO 2↑ 67. 硫酸和氯化钡溶液反应:H 2SO 4 +BaCl 2 == BaSO 4↓+2HCl 2、碱的幼儿园小班音乐教案化学性质 (1) 碱 非金属氧化物 -------- 盐 水68.苛性钠暴露在空气中变质:2NaOH+CO 2 == Na 2CO 3+ H 2O 69.苛性钠吸收二氧化硫气体:2NaOH +SO 2 == Na 2SO 3 +H 2O 70.苛性钠吸收三氧化硫气体:2NaOH+ SO 3 == Na 2SO 4 +H 2O 71.消石灰放在空气中变质:Ca(OH)2+ CO 2 == CaCO 3↓+H 2O 72. 消石灰吸收二氧化硫:Ca(OH)2 +SO 2 == CaSO 3↓+ H 2O (2)碱 酸-------- 盐 水(中和反应,方程式见上) (3)碱 盐 -------- 另一种碱 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 +Na2CO3== CaCO3↓+ 2NaOH3、盐的化学性质(1)盐(溶液)金属单质------- 另一种金属另一种盐74. 铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4+Cu(2)盐酸-------- 另一种酸另一种盐75.碳酸钠与稀盐酸反应: Na2CO3+2HCl == 2NaCl +H2O+ CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 +HCl== NaCl+ H2O +CO2↑(3)盐碱 -------- 另一种碱另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 +Na2CO3== CaCO3↓+ 2NaOH(4)盐盐 ----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl +AgNO3== AgCl↓+NaNO378.硫酸钠和氯化钡:Na2SO4+BaCl2== BaSO4↓+2NaCl其他反应类型1、二氧化碳通入澄清石灰水中:CO2 + Ca(OH)2== CaCO3↓+ H2O2、氢氧化钠在空气中变质:CO2+ 2NaOH = Na2CO3+ H2O3、氢氧化钠溶液吸收二氧化硫:SO2 + 2NaOH==Na2SO3+ H2O4、一氧化碳还原氧化铜:CO + CuO Cu + CO25、酒精燃烧:C2H5OH + 3O22CO2+ 3H2O6、甲烷燃烧:CH4 + 2O2CO2+ 2H2O化学方程式反应现象应用1. 2Mg+ O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2. 2Hg +O点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验3. 2Cu+ O点燃或Δ2CuO 红色金属变为黑色固体点燃或Δ2Al2O3银白金属变为白色固体5. 3Fe+ 2O点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热6. C+ O2点燃CO2剧烈燃烧、白光、放热、使澄清石灰水变浑浊7. S +O2点燃SO2剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰8. 2H2 O2点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料9. 4P +5O2 点燃2P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量10. CH4+2O点燃2H2O+ CO2蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4甲烷和天然气的燃烧11. 2C2H2+ 5O点燃2H2O +4CO2蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4氧炔焰、焊接切割金属12. 2KClO3MnO2、Δ2KCl +3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气13. 2KMnO4Δ K2MnO42+O2↑ 紫色变为黑色、生成使带火星木条复燃的气体实验室14. 2HgOΔ2Hg+ O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验△点燃点燃15. 2H2O通电2H2↑+ O2↑ 水通电分解为氢气和氧气电解水16. Cu223Δ2CuO +H2O+ CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热17. NH4HCO3ΔNH3↑+ H2O+ CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体碳18. Zn+ H2SO4=ZnSO4+H2↑ 有大量气泡产生、锌粒逐渐溶解实验室制备氢气19. Fe +H2SO4=FeSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解20. Mg +H2SO4=MgSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解21. 2Al+ 3H2SO4=Al2(SO4)3+ 3H2↑ 有大量气泡产生、金属颗粒逐渐溶解22. Fe2O3+3H2Δ 2Fe +3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性23. Fe3O4+4H2Δ3Fe+ 4H2O 黑色逐渐变为银白色英语翻译、试管壁有液体冶炼金属、24. WO3 +3H2Δ W +3H2O 冶炼金属钨、利用氢气的还原性25. MoO32ΔMo +3H2O 冶炼金属钼、利用氢气的还原性26. 2Na+ Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、27. H2+Cl2点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸28. CuSO4 +2NaOH=Cu(OH)2↓+ Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验29. 2C +O点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因点燃2CO2蓝色火焰煤气燃烧31. C+ CuO 高温2Cu+ CO2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属32. 2Fe2O3+ 3C 高温4Fe+ 3CO2↑ 冶炼金属33. Fe3O4+2C高温3Fe+ 2CO2↑ 冶炼金属34. C+ CO2 高温2CO35. CO2+H223碳酸使石蕊变红证明碳酸的酸性小学三语文教学论文36. H2CO3ΔCO2↑+ H2O 石蕊红色褪去2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁38. CaCO3 +H2O+ CO2= Ca(HCO3)2白色沉淀逐渐溶解溶洞的形成,石头的风化39. Ca(HCO3)2Δ CaCO3↓+ H2O +CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.40. 2NaHCO3ΔNa2CO3+ H2O +CO2↑ 产生使澄清石灰水变浑浊的气体小苏打蒸馒头41. CaCO3 高温 CaO +CO2↑ 工业制备二氧化碳和生石灰42. CaCO3 2+ H2O +CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢温馨提示:最好仔细阅读后才下载使用,万分感谢!。
初中常见化学式及化学方程式大全
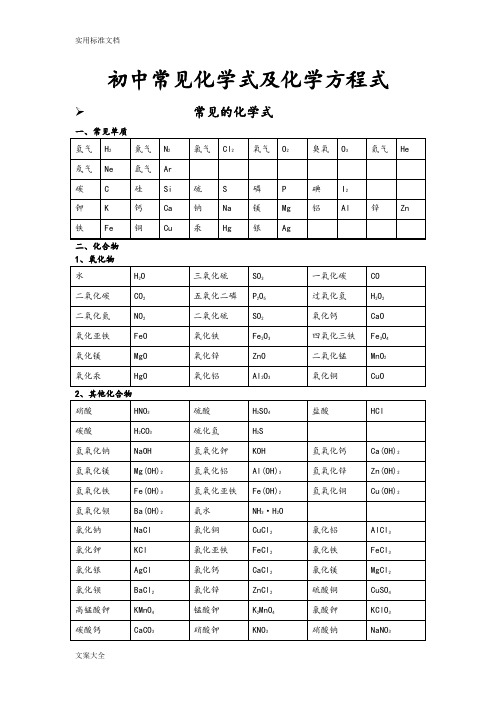
初中常见化学式及化学方程式➢常见的化学式一、常见单质二、化合物1、氧化物2、其他化合物3、常见有机化合物初中化学方程式全(已配平).一、化合反应1、镁在空气中燃烧:2Mg+ O2点燃 2MgO2、铁在氧气中燃烧:3Fe +2O2点燃 Fe3O43、铝在空气中燃烧:4Al+ 3O2点燃 2Al2O34、氢气在空气中燃烧:2H2 +O2点燃 2H2O5、红磷在空气中燃烧:4P +5O2点燃 2P2O56、硫粉在空气中燃烧: S+ O2点燃 SO27、碳在氧气中充分燃烧:C +O2 点燃 CO28、碳在氧气中不充分燃烧:2C +O2点燃 2CO9、二氧化碳通过灼热碳层: C +CO2高温2CO10、一氧化碳在氧气中燃烧:2CO +O2 点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 +H2O === H2CO312、生石灰溶于水:CaO+ H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4+5H2O ==== CuSO4·5H2O14、钠在氯气中燃烧:2Na+ Cl点燃 2NaCl二、分解反应15、实验室用双氧水制氧气:16、加热高锰酸钾:17、水在直流电的作用下分解:18、碳酸化学物理学报不稳定而分解:19、高温煅烧石灰石(二氧化碳工业制法):三、置换反应铁和硫酸铜溶液反应:锌和稀硫酸反应(实验室制氢气):镁和稀盐酸反应:21、氢气还原氧化铜:22、木炭还原氧化铜:23、甲烷在空气中燃烧:24、水蒸气通过灼热碳层:25、焦炭还原氧化铁:26、氢氧化钠溶液与硫酸铜溶液反应:27、甲烷在空气中燃烧:30、酒精在空气中燃烧:C2H5OH+ 3O2点燃 2CO2 +3H2O31、一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO232、一氧化碳还原氧化铁:3CO+ Fe2O3高温 2Fe+ 3CO233、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+ CO2 ==== CaCO3 ↓+ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+ CO2 ==== Na2CO3 +H2O35、石灰石(或小学音乐教案大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 +2HCl === CaCl2 +H2O +CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3+ 2HCl === 2NaCl +H2O +CO2↑一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg+ O2点燃 2MgO2. 铁在氧气中燃烧:3Fe+ 2O2点燃 Fe3O43. 铜在空气中受热:2Cu+ O2加热 2CuO4. 铝在空气中燃烧:4Al +3O2 点燃 2Al2O35. 氢气中空气中燃烧:2H2 +O2点燃 2H2O6. 红磷在空气中燃烧:4P+ 5O2点燃 2P2O57. 硫粉在空气中燃烧: S +O2 点燃 SO28. 碳在氧气中充分燃烧:C+ O2点燃 CO29. 碳在氧气中不充分燃烧:2C+ O2点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+ O2点燃 2CO211. 甲烷在空气中燃烧:CH4 +2O2点燃 CO2 2H2O12. 酒精在空气中燃烧:C2H5OH +3O2点燃 2CO2+3H2O二.几个分解反应:13. 水在直流电的作用下分新概念英语第一册解:2H2O 通电 2H2↑+ O2↑14. 加热碱式碳酸铜:Cu2(OH)2CO3加热 2CuO +H2O +CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl+ 3O2↑16. 加热高锰酸钾:2KMnO4 加热 K2MnO4 +MnO2 +O2↑17. 碳酸不稳定而分解:H2CO3 === H2O +CO2↑18. 高温煅烧石灰石:CaCO3 高温 CaO +CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2+ CuO 加热 Cu+ H2O20. 木炭还原氧化铜:C+ 2CuO 高温 2Cu +CO2↑2 初三化学方程式大合集21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe+ 3CO2↑22. 焦炭还原四氧化三铁:2C +Fe3O4高温 3Fe+ 2CO2↑23. 一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO224. 一氧化碳还原氧化铁:3CO+ Fe2O3高温 2Fe +3CO225. 一氧化碳还原四氧化三铁:4CO +Fe3O4高温 3Fe+ 4CO2四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+酸 -------- 盐+氢气(置换反应)26. 锌和稀硫酸Zn+ H2SO4 = ZnSO4+ H2↑27. 铁和稀硫酸Fe +H2SO4 = FeSO4+ H2↑28. 镁和稀硫酸Mg +H2SO4 = MgSO4 +H2↑29. 铝和稀硫酸2Al+ 3H2SO4 = Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn +2HCl === ZnCl2+ H2↑31. 铁和稀盐酸Fe+ 2HCl === FeCl2+ H2↑32. 镁和语文教案格式稀盐酸Mg 2HCl === MgCl2+ H2↑33. 铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑(2)金属单质+盐(溶液) ------- 另一种金属+另一种盐34. 铁和硫酸铜溶液反应:Fe+ CuSO4 === FeSO4+ Cu35. 锌和硫酸铜溶液反应:Zn+ CuSO4 === ZnSO4+ Cu36. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2 === Cu(NO3)2 +Hg (3)碱性氧化物+酸 -------- 盐+水37. 氧化铁和稀盐酸反应:Fe2O3+ 6HCl === 2FeCl3+ 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 +3H2SO4 === Fe2(SO4)3+ 3H2O39. 氧化铜和稀盐酸反应:CuO +2HCl ==== CuCl2 +H2O40. 氧化铜和稀硫酸反应:CuO +H2SO4 ==== CuSO4+ H2O41. 氧化镁和稀硫酸反应:MgO+ H2SO4 ==== MgSO4+ H2O42. 氧化钙和稀盐酸反应:CaO +2HCl ==== CaCl2 +H2O (4)酸性氧化物+碱 -------- 盐+水43.苛性钠暴露在空气中变质:2NaOH +CO2 ==== Na2CO3+H2O44.苛性钠吸收二氧化硫气体:2NaOH +SO2 ==== Na2SO3 +H2O 45.苛性钠吸收三氧化硫气体:2NaOH+ SO3 ==== Na2SO4+ H2O 46.消石灰放在空气中变质:Ca(OH)2+ CO2 ==== CaCO3 ↓+ H2O 47. 消石灰吸收二氧化硫:Ca(OH)2 +SO2 ==== CaSO3↓+H2O(5)酸+碱 -------- 盐+水48.盐酸和烧碱起反应:HCl+ NaOH ==== NaCl+ H2O49. 盐酸和氢氧化钾反应:HCl+ KOH ==== KCl+H2O50.盐酸和氢氧化初中家长会课件铜反应:2HCl+ Cu(OH)2==== CuCl2 +2H2O51. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 ==== CaCl2 +2H2O52. 盐酸和氢氧化铁反应:3HCl+ Fe(OH)3 ==== FeCl3 +3H2O53.氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 ==== AlCl3 +3H2O54.硫酸和烧碱反应:H2SO4 +2NaOH ==== Na2SO4 +2H2O55.硫酸和氢氧化钾反应:H2SO4 +2KOH ==== K2SO4 +2H2O56.硫酸和氢氧化铜反应:H2SO4 +Cu(OH)2 ==== CuSO4 +2H2O57. 硫酸和氢氧化铁反应:3H2SO4 +2Fe(OH)3==== Fe2(SO4)3+ 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸+盐 -------- 另一种酸+另一种盐59.大理石与稀盐酸反应:CaCO3 +2HCl === CaCl2 H2O +CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 +2HCl === 2NaCl +H2O+ CO2↑61.碳酸镁与稀盐酸反应: MgCO3 +2HCl === MgCl2 +H2O+CO2↑62.盐酸和硝酸银溶液反应:HCl+ AgNO3 === AgCl↓+ HNO363.硫酸和碳酸钠反应:Na2CO3 +H2SO4 === Na2SO4 +H2O +CO2↑64.硫酸和氯化钡溶液反应:H2S O4 +BaCl2 ==== BaSO4↓+ 2HCl (7)碱+盐 -------- 另一种碱+另一种盐65.氢氧化钠与硫酸铜:2NaOH CuSO4 ==== Cu(OH)2↓ Na2SO466.氢氧化钠与氯化铁:3NaOH FeCl3 ==== Fe(OH)3↓ 3NaCl 67.氢氧化钠与氯化镁:2NaOH MgCl2 ==== Mg(OH)2↓ 2NaCl68. 氢氧化钠与氯化铜:2NaOH CuCl2 ==== Cu(OH)2↓ 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 Na2CO3 === CaCO3↓ 2NaOH(8)盐+盐 ----- 两种新盐70.氯化钠溶液新概念英语第二册和硝酸银溶液:NaCl +AgNO3 ==== AgCl↓+ NaNO371.硫酸钠和氯化钡:Na2SO4+ BaCl2 ==== BaSO4↓+ 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2+ H2O === H2CO373.生石灰溶于水:CaO+ H2O === Ca(OH)274.氧化钠溶于水:Na2O +H2O ==== 2NaOH75.三氧化硫溶于水:SO3 +H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO4 5H2O77.无水硫酸铜作干燥剂:CuSO4+ 5H2O ==== CuSO4·5H2化学方程式反应现象应用2Mg+ O点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg +O点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+ O点燃或Δ2CuO 红色金属变为黑色固体4Al+ 3O点燃或Δ2Al2O3银白金属变为白色固体3Fe+ 2O点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热 4Fe +3O2高温2Fe2O3C+ O2点燃CO2剧烈燃烧、白光、放热、使石灰水变浑浊S +O2点燃SO2剧大学英语四级烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2 O2点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P +5O2 点燃2P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O点燃2H2O+ CO2蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+ 5O2点燃2H2O +4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO2、Δ2KCl +3O2↑生成使带火星的木条复燃的气体实验室制备氧气2KMnO4Δ K2MnO4 MnO2 +O2↑紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧论文气2HgOΔ2Hg+ O2↑红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+ O2↑水通电分解为氢气和氧气电解水Cu2(OH)2CO3Δ2CuO +H2O+ CO2↑绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3ΔNH3↑+ H2O+ CO2↑白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+ H2SO4=ZnSO4 +H2↑有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe +H2SO4=FeSO4 +H2↑有大量气泡产生、金属颗粒逐渐溶解Mg +H2SO4 =MgSO4 +H2↑有大量气泡产生、金属颗粒逐渐溶解2Al+ 3H2SO4=Al2(SO4)3+ 3H2↑有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2Δ 2Fe +3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4 +4H2 Δ3Fe+ 4H2O 黑色逐渐变为银白色英语翻译、试管壁有液体冶炼金属、利用氢气的还原性WO3 +3H2Δ W +3H2O 冶炼金属钨、利用氢气的还原性MoO3 +3H2ΔMo +3H2O 冶炼金属钼、利用氢气的还原性2Na+ Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2+Cl2点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4 +2NaOH=Cu(OH)2↓+ Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C +O点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2CO +O点燃2CO2蓝色火焰煤气燃烧C+ CuO 高温2Cu+ CO2↑黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+ 3C 高温4Fe+ 3CO2↑冶炼金属Fe3O4 +2C高温3Fe+ 2CO2↑冶炼金属C+ CO2 高温2COCO2+H2O = H2CO3碳酸使石蕊变红证明碳酸的酸性小学三语文教学论文H2CO3 ΔCO2↑+ H2O 石蕊红色褪去Ca(OH)2 +CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3 +H2O+ CO2 = Ca(HCO3)2 白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2Δ CaCO3↓+ H2O +CO2↑白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3+ H2O +CO2↑产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3 高温 CaO +CO2↑工业制备二氧化碳和生石灰CaCO3 +2HCl=CaCl2+ H2O +CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢初中化学方程式汇总一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg+ O2点燃 2MgO2. 铁在氧气中燃烧:3Fe+ 2O2点燃 Fe3O43. 铜在空气中受热:2Cu+ O2加热 2CuO4. 铝在空气中燃烧:4Al +3O2 点燃2Al2O35. 氢气中空气中燃烧:2H2 +O2 点燃 2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P +5O2点燃 2P2O57. 硫粉在空气中燃烧: S +O2 点燃 SO28. 碳在氧气中充分燃烧:C +O2点燃 CO29. 碳在氧气中不充分燃烧:2C +O2点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+O2点燃 2CO211. 甲烷在空气中燃烧:CH4 +2O2点燃 CO2 +2H2O12. 酒精在空气中燃烧:C2H5OH +3O2点燃 2CO2 +3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验 2HgO 加热 Hg +O2 ↑14.加热高锰酸钾:2KMnO4加热 K2MnO4+ MnO2 +O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应: H2O2MnO22H2O+ O2↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电 2H2↑+O2 ↑17.生石灰溶于水英语六级作文:CaO +H2O == Ca(OH)2 18.二氧化碳可溶于水: H2O+CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg+ O2点燃 2MgO20.铁和硫酸铜溶液反应:Fe+ CuSO4 === FeSO4+ Cu 21.氢气还原氧化铜:H2 +CuO 加热 Cu +H2O22. 镁还原氧化铜:Mg+ CuO 加热 Cu +MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2点燃 CO224.木炭还原氧化铜:C + 2CuO 高温 2Cu+ CO2↑25.焦炭还原氧化铁:3C + 2Fe2O3高温 4Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C +O2 点燃 CO227.煤炉的中层:CO2+ C 高温 2CO28.煤炉的上部蓝色火焰的产生:2CO +O2点燃 2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3+ 2HCl == CaCl2+ H2O +CO2↑30.碳酸不稳定而分解:H2CO3 == H2O +CO2↑31.二氧化碳可溶于水: H2O +CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3高温 CaO+ CO2↑33.石灰水与中学历史教学园地二氧化碳反应(鉴别二氧化碳):Ca(OH)2 +CO2 === CaCO3↓+H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO 加热 Cu +CO235.一氧化碳的可燃性:2CO +O2点燃 2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 2HCl == 2NaCl+ H2O +CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 +2O2点燃 CO2 +2H2O38.酒精在空气中燃烧:C2H5OH +3O2 点燃 2CO2 +3H2O39.氢气中空气中燃烧:2H2+ O2点燃 2H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg+ O2点燃 2MgO41.铁在氧气中燃烧:3Fe +2O2点燃 Fe3O442. 铜在空气中受热:2Cu +O2加热 2CuO43. 铝在空气中形成氧化膜:4Al+ 3O2 = 2Al2O3(2)金属单质酸 -------- 盐氢气(置换反应)44. 锌和稀硫酸Zn+ H2SO4 = ZnSO4+ H2↑45. 铁和稀硫酸Fe +H2SO4 = FeSO4 +H2↑46. 镁和稀硫酸Mg +H2SO4 = MgSO4+ H2↑47. 铝和稀硫酸2Al+ 3H2SO4 = Al2(SO4)3 +3H2↑48. 锌和稀盐酸Zn+ 2HCl == ZnCl2+ H2↑49. 铁和稀盐酸Fe +2HCl == FeCl2 +H2↑50. 镁和稀盐酸Mg +2HCl == MgCl2+ H2↑51.铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑(3)金属单质盐怎样学好高中物理(溶液) ------- 新金属新盐52. 铁和硫酸铜溶液反应:Fe +CuSO4 == FeSO4 +Cu53. 锌和硫酸铜溶液反应:Zn +CuSO4 ==ZnSO4 +Cu54. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2 == Cu(NO3)2 +Hg(3)金属铁的治炼原理:55.3CO +2Fe2O3 高温 4Fe +3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸金属 -------- 盐氢气(见上)(2)酸金属氧化物-------- 盐水56. 氧化铁和稀盐酸反应:Fe2O3 +6HCl ==2FeCl3 +3H2O57. 氧化铁和稀硫酸反应:Fe2O3 +3H2SO4 == Fe2(SO4)3 +3H2O58. 氧化铜和稀盐酸反应:CuO +2HCl ==CuCl2 +H2O59. 氧化铜和稀硫酸反应:CuO+ H2SO4 == CuSO4+ H2O(3)酸碱 -------- 盐水(中和反应)60.盐酸和烧碱起反应:HCl +NaOH == NaCl+H2O61. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 == CaCl2+2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 == AlCl3 +3H2O63. 硫酸和烧碱反应:H2SO4+ 2NaOH == Na2SO4 +2H2O(4)酸盐 -------- 另一种酸另一种盐64.大理石与稀盐酸反应:CaCO3+2HCl == CaCl2 +H2O+ CO2↑65.碳酸钠与稀盐酸反应: Na2CO3 +2HCl == 2NaCl+ H2O+ CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 +HCl== NaCl+H2O+ CO2↑67. 硫酸和氯化钡溶液反应:H2SO4 +BaCl2 == BaSO4↓+2HCl2、碱的幼儿园小班音乐教案化学性质(1)碱非金属氧化物 -------- 盐水68.苛性钠暴露在空气中变质:2NaOH+CO2 == Na2CO3+ H2O 69.苛性钠吸收二氧化硫气体:2NaOH +SO2 == Na2SO3 +H2O 70.苛性钠吸收三氧化硫气体:2NaOH+ SO3 == Na2SO4 +H2O 71.消石灰放在空气中变质:Ca(OH)2+ CO2 == CaCO3↓+H2O72. 消石灰吸收二氧化硫:Ca(OH)2 +SO2 == CaSO3↓+ H2O(2)碱酸-------- 盐水(中和反应,方程式见上)(3)碱盐 -------- 另一种碱另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 +Na2CO3 == CaCO3↓+ 2NaOH3、盐的化学性质(1)盐(溶液)金属单质------- 另一种金属另一种盐74. 铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4 +Cu(2)盐酸-------- 另一种酸另一种盐75.碳酸钠与稀盐酸反应: Na 2CO 3 +2HCl == 2NaCl +H 2O+ CO 2↑ 碳酸氢钠与稀盐酸反应:NaHCO 3 +HCl== NaCl+ H 2O +CO 2↑ (3)盐 碱 -------- 另一种碱 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 +Na 2CO 3 == CaCO 3↓+ 2NaOH (4)盐 盐 ----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl +AgNO 3 == AgCl ↓+NaNO 3 78.硫酸钠和氯化钡:Na 2SO 4 +BaCl 2 == BaSO4↓+2NaCl一、其他反应类型1、二氧化碳通入澄清石灰水中:CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O2、氢氧化钠在空气中变质:CO 2+ 2NaOH = Na 2CO 3 + H 2O3、氢氧化钠溶液吸收二氧化硫:SO 2 + 2NaOH ==Na 2SO 3+ H 2O4、一氧化碳还原氧化铜:CO + CuO Cu + CO 25、酒精燃烧:C 2H 5OH + 3O 2 2CO 2 + 3H 2O6、甲烷燃烧:CH 4 + 2O 2 CO 2 + 2H 2O△点燃 点燃。
常见化学式和化学方程式含答案

常见化学式和化学方程式含答案【常见化学式和化学方程式含答案】化学式和化学方程式是化学中常见的表达方式,用于表示化学物质的组成和反应过程。
它们是化学语言的基础,有助于我们理解和描述化学现象。
本文将介绍一些常见的化学式和化学方程式,并提供相应的答案。
一、常见化学式1. 金属氧化物:金属氧化物是由金属原子和氧原子结合形成的化合物,常见的有氧化钠(Na2O)、氧化铁(Fe2O3)、氧化铝(Al2O3)等。
2. 盐类化合物:盐类是由阳离子和阴离子组成的化合物,常见的有氯化钠(NaCl)、硫酸铜(CuSO4)、硝酸铵(NH4NO3)等。
3. 碱金属:碱金属是指周期表第一族元素,常见的有锂(Li)、钠(Na)、钾(K)等。
它们的化学式为Li、Na、K。
4. 酸类:酸是指能够产生H+离子的化合物,常见的有盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)等。
5. 水:水的化学式为H2O,它是一种无色、无味、无臭的液体,是地球上最常见的化合物。
二、常见化学方程式1. 酸碱中和反应:酸与碱反应会产生盐和水,简称为酸碱中和反应。
例如,盐酸与氢氧化钠的反应方程式为HCl + NaOH → NaCl + H2O。
2. 金属与酸反应:金属与酸反应会产生盐和氢气。
例如,锌与硫酸的反应方程式为Zn + H2SO4 → ZnSO4 + H2。
3. 双替换反应:双替换反应是指两种化合物中的阳离子和阴离子交换的反应。
例如,氯化银与硝酸钠的反应方程式为AgCl + NaNO3 → AgNO3 + NaCl。
4. 氧化还原反应:氧化还原反应是指物质失去电子(氧化)和物质获得电子(还原)的过程。
例如,铜与硝酸的反应方程式为Cu +2HNO3 → Cu(NO3)2 + H2O + NO2。
三、答案1. Na2O2. Fe2O33. Al2O34. NaCl5. CuSO46. NH4NO37. Li8. Na9. K10. HCl11. H2SO412. HNO313. H2O14. HCl + NaOH → NaCl + H2O15. Zn + H2SO4 → ZnSO4 + H216. AgCl + NaNO3 → AgNO3 + NaCl17. Cu + 2HNO3 → Cu(NO3)2 + H2O + NO2总结:本文介绍了一些常见的化学式和化学方程式,并提供了相应的答案,帮助读者更好地理解化学语言的表达方式。
初中常见化学式及化学方程式大全
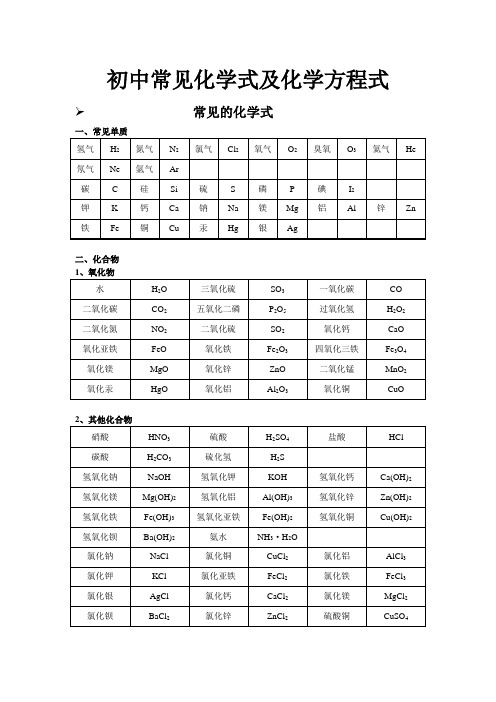
初中常见化学式及化学方程式 常见的化学式一、常见单质二、化合物初中化学方程式全(已配平).一、化合反应1、镁在空气中燃烧:2Mg + O2点燃 2MgO2、铁在氧气中燃烧:3Fe + 2O2点燃 Fe3O43、铝在空气中燃烧:4Al + 3O2点燃 2Al2O34、氢气在空气中燃烧:2H2 + O2点燃 2H2O5、红磷在空气中燃烧:4P +5O2点燃 2P2O56、硫粉在空气中燃烧: S + O2点燃 SO27、碳在氧气中充分燃烧:C + O2 点燃 CO28、碳在氧气中不充分燃烧:2C + O2点燃 2CO9、二氧化碳通过灼热碳层: C + CO2高温 2CO10、一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO312、生石灰溶于水:CaO + H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2O14、钠在氯气中燃烧:2Na + Cl点燃 2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O + O2↑16、加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑17、水在直流电的作用下分解:2H2O 通电 2H2↑+ O2↑18、碳酸不稳定而分解:H2CO3 === H2O + CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温 CaO + CO2↑三、置换反应20、铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu21、锌和稀硫酸反应(实验室制氢气):Zn + H2SO4 == ZnSO4 +H2↑22、镁和稀盐酸反应:Mg + 2HCl === MgCl2 + H2↑23、氢气还原氧化铜:H2 + CuO 加热 Cu + H2O24、木炭还原氧化铜:C + 2CuO 高温 2Cu + CO2↑25、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O26、水蒸气通过灼热碳层:H2O + C 高温 H2 + CO27、焦炭还原氧化铁:3C + 2Fe2O3高温 4Fe + 3CO2↑其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH + CuSO4 == Cu(OH)2↓+ Na2SO429、甲烷在空气中燃烧:CH4 + 2O2点燃 CO2 + 2H2O30、酒精在空气中燃烧:C2H5OH + 3O2点燃 2CO2 + 3H2O31、一氧化碳还原氧化铜:CO + CuO 加热 Cu + CO232、一氧化碳还原氧化铁:3CO + Fe2O3高温 2Fe + 3CO233、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH + CO2 ==== Na2CO3 + H2O35、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法): CaCO3 + 2HCl === CaCl2 + H2O + CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理):Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg + O2点燃 2MgO2. 铁在氧气中燃烧:3Fe + 2O2点燃 Fe3O43. 铜在空气中受热:2Cu + O2加热 2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O35. 氢气中空气中燃烧:2H2 + O2点燃 2H2O6. 红磷在空气中燃烧:4P + 5O2点燃 2P2O57. 硫粉在空气中燃烧: S + O2 点燃 SO28. 碳在氧气中充分燃烧:C + O2点燃 CO29. 碳在氧气中不充分燃烧:2C + O2点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2点燃 2CO211. 甲烷在空气中燃烧:CH4 + 2O2点燃 CO2 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2点燃 2CO2+3H2O二.几个分解反应:13. 水在直流电的作用下分解:2H2O 通电 2H2↑+ O2↑14. 加热碱式碳酸铜:Cu2(OH)2CO3加热 2CuO + H2O + CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl + 3O2↑16. 加热高锰酸钾:2KMnO4加热 K2MnO4 + MnO2 + O2↑17. 碳酸不稳定而分解:H2CO3 === H2O + CO2↑18. 高温煅烧石灰石:CaCO3 高温 CaO + CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2 + CuO 加热 Cu + H2O20. 木炭还原氧化铜:C + 2CuO 高温 2Cu + CO2↑21. 焦炭还原氧化铁:3C + 2Fe2O3 高温 4Fe + 3CO2↑22. 焦炭还原四氧化三铁:2C + Fe3O4高温 3Fe + 2CO2↑23. 一氧化碳还原氧化铜:CO + CuO 加热 Cu + CO224. 一氧化碳还原氧化铁:3CO + Fe2O3高温 2Fe + 3CO225. 一氧化碳还原四氧化三铁:4CO + Fe3O4高温 3Fe + 4CO2四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+ 酸 ----- 盐+ 氢气(置换反应)26. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑27. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑28. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑29. 铝和稀硫酸2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑30. 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑31. 铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑32. 镁和稀盐酸Mg + 2HCl === MgCl2 + H2↑33. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑(2)金属单质+盐(溶液) ------- 另一种金属+ 另一种盐34. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu35. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg (3)碱性氧化物+ 酸 -------- 盐+水37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O41. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O (4)酸性氧化物+ 碱 -------- 盐+ 水43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O 44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O 45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O 47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3↓+ H2O (5)酸+ 碱 -------- 盐+ 水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl + H2O49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl + H2O50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O58. 硝酸和烧碱反应:HNO3 + NaOH ==== NaNO3 + H2O(6)酸+ 盐 ------另一种酸+ 另一种盐59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 H2O + CO2↑ 60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑ 61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 +H2O + CO2↑ 62.盐酸和硝酸银溶液反应:HCl + AgNO3=== AgCl↓+ HNO363.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑64.硫酸和氯化钡溶液反应:H2SO4 +BaCl2 ==== BaSO4↓+ 2HCl(7)碱+ 盐 -------- 另一种碱+ 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓+ Na2SO4 66.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓+ 3NaCl 67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓+ 2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓+ 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH (8)盐+盐 ----- 两种新盐70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3==== AgCl↓+ NaNO3 71.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓+ 2NaCl 五.其它反应:72.二氧化碳溶解于水:CO2 + H2O === H2CO373.生石灰溶于水:CaO + H2O === Ca(OH)274.氧化钠溶于水:Na2O + H2O ==== 2NaOH75.三氧化硫溶于水:SO3 + H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO4 + 5H2O 77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2O化学方程式反应现象应用2Mg + O点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg + O点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu + O点燃或Δ2CuO 红色金属变为黑色固体4Al + 3O点燃或Δ2Al2O3银白金属变为白色固体3Fe + 2O点燃Fe3O4剧烈燃烧、火星四射、生成黑色固体、放热4Fe + 3O高温2Fe2O3C + O2点燃CO2剧烈燃烧、白光、放热、使石灰水变浑浊S + O2点燃SO2剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2 + O2点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P + 5O2 点燃2P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4 +2O点燃2H2O + CO2蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2 + 5O点燃2H2O + 4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3 MnO2、Δ2KCl + 3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气2KMnO4 Δ K2MnO4 + MnO2 + O2↑ 紫色变为黑色、生成使带火星木条复燃的气体2HgOΔ2Hg + O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+ O2↑ 水通电分解为氢气和氧气电解水Cu2(OH)2CO3Δ2CuO + H2O+ CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3ΔNH3↑+ H2O + CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn + H2SO4=ZnSO4 + H2↑ 有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe + H2SO4=FeSO4 + H2↑ 有大量气泡产生、金属颗粒逐渐溶解Mg + H2SO4 =MgSO4 + H2↑ 有大量气泡产生、金属颗粒逐渐溶解2Al + 3H2SO4=Al2(SO4)3 + 3H2↑ 有大量气泡产生、金属颗粒逐渐溶解Fe2O3 + 3H2Δ 2Fe + 3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4 + 4H2 Δ3Fe + 4H2O 黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性WO3 + 3H2Δ W + 3H2O 冶炼金属钨、利用氢气的还原性MoO3 +3H2ΔMo + 3H2O 冶炼金属钼、利用氢气的还原性2Na + Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2 + Cl2点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4 + 2NaOH=Cu(OH)2↓+ Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C + O点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2CO + O点燃2CO2蓝色火焰煤气燃烧C + CuO 高温2Cu + CO2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3 + 3C 高温4Fe + 3CO2↑ 冶炼金属Fe3O4 + 2C高温3Fe + 2CO2↑ 冶炼金属C + CO2高温2COCO2 + H2O = H2CO3碳酸使石蕊变红证明碳酸的酸性H2CO3 ΔCO2↑+ H2O 石蕊红色褪去Ca(OH)2 + CO2 = CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3 + H2O + CO2 = Ca(HCO3)2 白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2Δ CaCO3↓+ H2O + CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3 + H2O + CO2↑ 产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3 高温 CaO + CO2↑ 工业制备二氧化碳和生石灰CaCO3 + 2HCl=CaCl2 + H2O + CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢初中化学方程式汇总一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg + O2点燃 2MgO2. 铁在氧气中燃烧:3Fe + 2O2点燃 Fe3O43. 铜在空气中受热:2Cu + O2加热 2CuO4. 铝在空气中燃烧:4Al + 3O2点燃2Al2O35. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2点燃 2P2O57. 硫粉在空气中燃烧: S + O2 点燃 SO28. 碳在氧气中充分燃烧:C + O2点燃 CO29. 碳在氧气中不充分燃烧:2C + O2点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2点燃 2CO211. 甲烷在空气中燃烧:CH4 +2O2点燃 CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2点燃 2CO2 + 3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验 2HgO 加热 Hg + O2 ↑14.加热高锰酸钾:2KMnO4加热 K2MnO4 + MnO2 + O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应:H2O2 MnO22H2O + O2↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电 2H2↑+ O2 ↑17.生石灰溶于水:CaO + H2O == Ca(OH)218.二氧化碳可溶于水: H2O + CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg + O2点燃 2MgO20.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu21.氢气还原氧化铜:H2 + CuO 加热 Cu + H2O22. 镁还原氧化铜:Mg + CuO 加热 Cu + MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2点燃 CO224.木炭还原氧化铜:C + 2CuO 高温 2Cu + CO2↑25.焦炭还原氧化铁:3C + 2Fe2O3高温 4Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C + O2 点燃 CO227.煤炉的中层:CO2 + C 高温 2CO28.煤炉的上部蓝色火焰的产生:2CO + O2点燃 2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3 + 2HCl == CaCl2 + H2O + CO2↑30.碳酸不稳定而分解:H2CO3 == H2O + CO2↑31.二氧化碳可溶于水: H2O + CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3高温 CaO + CO2↑ 33.石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH)2 + CO2 === CaCO3↓+ H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO + CuO 加热 Cu + CO2 35.一氧化碳的可燃性:2CO + O2点燃 2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 + 2O2点燃 CO2 + 2H2O 38.酒精在空气中燃烧:C2H5OH + 3O2点燃 2CO2 + 3H2O 39.氢气中空气中燃烧:2H2 + O2点燃 2H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg + O2点燃 2MgO41.铁在氧气中燃烧:3Fe + 2O2点燃 Fe3O442. 铜在空气中受热:2Cu + O2加热 2CuO43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3(2)金属单质 + 酸 -------- 盐 + 氢气(置换反应)44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑47. 铝和稀硫酸2Al + 3H2SO4 = Al2(SO4)3 +3 H2↑48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑50. 镁和稀盐酸Mg + 2HCl == MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑(3)金属单质 + 盐------- 新金属 + 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg(3)金属铁的治炼原理:55.3CO + 2Fe2O3 高温4Fe + 3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸 + 金属 -------- 盐 + 氢气(见上)(2)酸 + 金属氧化物-------- 盐 + 水56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O(3)酸 + 碱 -------- 盐 + 水(中和反应)60.盐酸和烧碱起反应:HCl + NaOH == NaCl + H2O61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O63. 硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O64.大理石与稀盐酸反应:CaCO3 +2HCl == CaCl2 + H2O + CO2↑ 65.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑ 66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑ 67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4↓+ 2HCl 2、碱的化学性质(1)碱 + 非金属氧化物 -------- 盐 + 水68.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O 69.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O 70.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O 71.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3↓+ H2O 72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3↓+ H2O(2)碱 + 酸-------- 盐 + 水(中和反应,方程式见上)(3)碱 + 盐 -------- 另一种碱 +另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH 3、盐的化学性质(1)盐(溶液)+ 金属单质------- 另一种金属 + 另一种盐74. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu(2)盐 + 酸-------- 另一种酸 + 另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑ 碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na 2CO 3 == CaCO 3↓+ 2NaOH (4)盐 + 盐 ----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl + AgNO 3 == AgCl↓+ NaNO 3 78.硫酸钠和氯化钡:Na 2SO 4 + BaCl 2 == BaSO 4↓+ 2NaCl 一、其他反应类型1、二氧化碳通入澄清石灰水中:CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O2、氢氧化钠在空气中变质:CO 2 + 2NaOH = Na 2CO 3 + H 2O3、氢氧化钠溶液吸收二氧化硫:SO 2 + 2NaOH ==Na 2SO 3 + H 2O4、一氧化碳还原氧化铜:CO + CuO Cu + CO 25、酒精燃烧:C 2H 5OH + 3O 2 2CO 2 + 3H 2O6、甲烷燃烧:CH 4 + 2O 2 CO 2 + 2H 2O△ 点燃点燃。
初中化学方程式练习试题

化学方程式的专项练习一、写出下列反应的化学方程式:1、镁在空气中燃烧:______________________ _____2、铁在氧气中燃烧:____________________ _______3、铜在空气中受热:______________ _____________4、铝在空气中燃烧:_________________ __________5、氢气中空气中燃烧:__________ _______________6、红磷在空气中燃烧:_______________ ___ ______7、硫粉在空气中燃烧:__________________ _______11、利用过氧化氢和二氧化锰的混合物制氧气:____________________________12、水在直流电的作用下分解:___________________________________________13、加热氯酸钾:_______________________________________________________14、加热高锰酸钾:____________________________________________________二、配平下列化学方程式:(一) 最小公倍数法:1、 Al + O2—— Al2O32、 Al + Fe3O4—— Fe + Al2O33、 Fe + O2—— Fe3O44、 Al + MnO2—— Mn + Al2O35、 N2 + H2—— NH36、 Al + H2SO4—— Al2(SO4)3 + H2(二) 观察法:1、 CO + Fe2O3 —— Fe + CO22、 C + Fe2O3—— Fe + CO23、 CO + Fe3O4 —— Fe + CO24、 C + Fe3O4—— Fe + CO25、 H2 + Fe2O3—— Fe + H2O6、 H2 + Fe3O4—— Fe + H2O10、H2+ WO3——W + H2O 11、CO + O2——CO212、 Fe + H2O—— H2 + Fe3O4 13、 Al(OH)3+ HCl —— AlCl3 + H2O(三) 奇数配偶法:1、 FeS2 + O2 —— Fe2O3 + SO22、 C2H2 + O2——CO2+ H2O3、 C + Fe2O3—— Fe + CO24、 MnO2 + HCl—— MnCl2 + Cl2 + H2O5、 Cl2 + Ca(OH)2—— CaCl2 + Ca(ClO)2 + H2O(四) 归一法:1、 C2H2 + O2——CO2 + H2O2、C6H6 + O2—— CO2 + H2O3、 C22H46 + O2——CO2 + H2O4、 NH3 + Cl2 —— NH4Cl + N25、 As2O3+ Zn + HCl——AsH3+ ZnCl2+ H2O6、C X H Y+ O2——CO2+ H2O三、题型变化:1、3Cu+8HNO3 ==3Cu(NO3)2+2X↑+4 H2O,求X的化学式为。
初中常见物质化学式的书写

一、单质
氢气
氧气
氮气
臭氧
氯气
炭
硅
磷
硫
铁
镁
铝
铜
锌
钠
金
银
汞
氦气
氖气
二、氧化物
氧化钠 氧化镁 氧化铝
氧化亚铁 四氧化三 铁 氧化钾
二氧化锰 二氧化硫 三氧化硫
一氧化碳 二氧化硅 五氧化二磷
氧化锌
氧化钡
二氧化氮
水
氧化铜
氧化钙
一氧化氮
过氧化氢
氧化铁
氧化汞
二氧化碳
三、酸: H + 酸根离子
碳酸
硫酸
盐酸 醋酸
氢氧化钙 氨水
氯化镁 氯化亚铁 氯化铵 硝酸铝 硝酸银 硫酸钾 硫酸铝 硫酸铜 碳酸钠 碳酸钡
甲烷
一、化合反应:由多变一 磷燃烧
上册常见的化学方程式
现象
硫燃烧
现象
碳燃烧(充分)
现象
碳燃烧(不充分)
铁燃烧
现象
镁燃烧 铜在氧气 中加热 氢气燃烧
现象 现象 现象
一氧化碳燃烧
现象
CO2和H2O反应 CO2和C反应 CaO和H2O反应 二、分解反应:由一变多 KMnO4制氧气 KClO3制氧气 H2O2制氧气 水通电
现象
碳燃烧(不充分)
铁燃烧
现象
镁燃烧
现象
铜在氧气中加热
现象
氢气燃烧
现象
一氧化碳燃烧
现象
CO2和H2O反应 CO2和C反应 CaO和H2O反应 二、分解反应:由一变多 KMnO4制氧气 KClO3制氧气 H2O2制氧气 水通电
工业制CO2
H2CO3不稳定分解
初中化学化学式和化学方程式
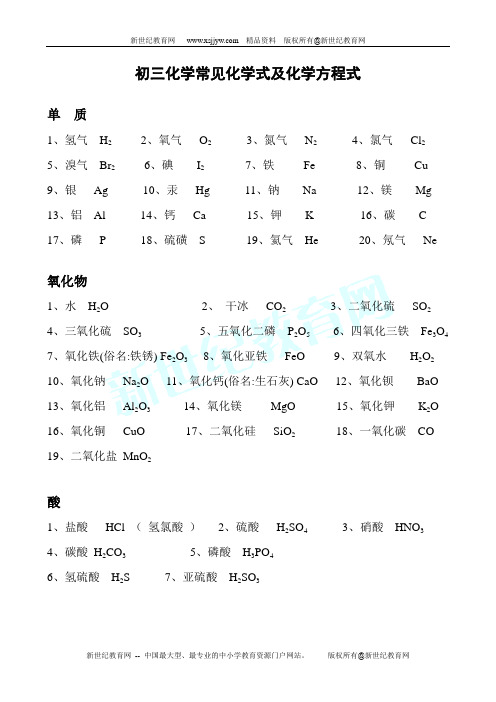
初三化学常见化学式及化学方程式单质1、氢气H22、氧气O23、氮气N24、氯气Cl25、溴气Br26、碘I27、铁Fe8、铜Cu9、银Ag 10、汞Hg 11、钠Na 12、镁Mg 13、铝Al 14、钙Ca 15、钾K 16、碳 C 17、磷P 18、硫磺S 19、氦气He 20、氖气Ne氧化物1、水H2O2、干冰CO23、二氧化硫SO24、三氧化硫SO35、五氧化二磷P2O56、四氧化三铁Fe3O47、氧化铁(俗名:铁锈) Fe2O38、氧化亚铁FeO9、双氧水H2O2 10、氧化钠Na2O 11、氧化钙(俗名:生石灰) CaO 12、氧化钡BaO 13、氧化铝Al2O3 14、氧化镁MgO 15、氧化钾K2O 16、氧化铜CuO 17、二氧化硅SiO218、一氧化碳CO 19、二氧化盐MnO2酸1、盐酸HCl (氢氯酸)2、硫酸H2SO43、硝酸HNO34、碳酸H2CO35、磷酸H3PO46、氢硫酸H2S7、亚硫酸H2SO3碱1、氢氧化钠(俗名:火碱、苛性钠、烧碱)NaOH2、氢氧化钾KOH3、氢氧化钡Ba(OH)24、氨水NH3·H2 O (NH4OH)5、氢氧化钙(俗名:熟生灰、消石灰) Ca(OH)26、氢氧化铜Cu(OH)27、氢氧化铝(胃舒平主要成分)Al(OH)38、氢氧化铁Fe(OH)39、氢氧化镁Mg(OH)210、氢氧化亚铁Fe(OH)2盐1、氯化钠(俗名:食盐)NaCl2、氯化钡BaCl23、氯化铝AlCl34、氯化铜CuCl25、氯化银AgCl6、氯化铁FeCl3 氯化亚铁FeCl27、硝酸钾KNO38、硝酸钠NaNO39、硝酸镁Mg(NO3)210、硝酸银AgNO3 11、硝酸铁Fe(NO3)312、碳酸钠Na2CO3(俗名:纯碱、苏打)13、碳酸钡BaCO314、碳酸钾K2CO315、硝酸钡Ba(NO3)2 16、碳酸钙CaCO3(俗名:石灰石、大理石、汉白玉)17、草木灰K2CO3 18、硫酸钠NaSO419、硫酸钾K2SO420、硫酸钡BaSO421、硫酸钙CaSO422、五水硫酸铜CuSO4·5H2O(俗名:胆矾、蓝矾)23、硫酸铜CuSO424、小苏打NaHCO325、硫酸亚铁FeSO426、硫酸铁Fe2(SO4)327、硫酸铵(NH4)2SO428、磷酸铵(NH4)3PO4 29、硝酸铵NH4NO330、明矾KAl(SO4)2·12H2O31、碱式碳酸铜Cu2(OH)2CO3 (俗名:铜绿、铜锈)32、硫酸氢钠NaHSO4 33、碳酸氢铵NH4HCO3 34、碳酸钠晶体Na2CO3·10H2O35、高锰酸钾KMnO436、锰酸钾K2MnO4。
初中常见化学式及化学方程式大全
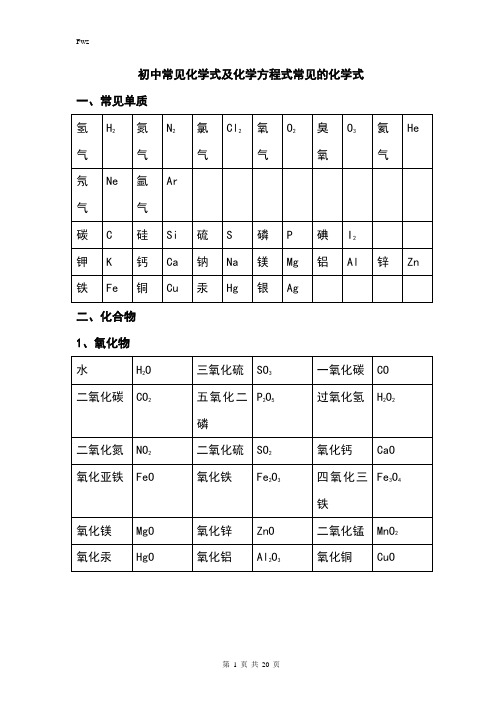
初中常见化学式及化学方程式常见的化学式一、常见单质二、化合物1、氧化物2、其他化合物3、常见有机化合物初中化学方程式全(已配平).一、化合反应1、镁在空气中燃烧:2Mg+ O2点燃 2MgO2、铁在氧气中燃烧:3Fe +2O2点燃 Fe3O43、铝在空气中燃烧:4Al+ 3O2点燃 2Al2O34、氢气在空气中燃烧:2H2 +O2点燃 2H2O5、红磷在空气中燃烧:4P +5O2点燃 2P2O56、硫粉在空气中燃烧: S+ O2点燃 SO27、碳在氧气中充分燃烧:C +O2 点燃 CO28、碳在氧气中不充分燃烧:2C +O2点燃 2CO9、二氧化碳通过灼热碳层: C +CO2高温 2CO10、一氧化碳在氧气中燃烧:2CO +O2 点燃 2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 +H2O === H2CO312、生石灰溶于水:CaO+ H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 +5H2O ==== CuSO4·5H2O14、钠在氯气中燃烧:2Na+ Cl点燃 2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O +O2↑16、加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 +O2↑17、水在直流电的作用下分解:2H2O 通电 2H2↑+O2↑18、碳酸化学物理学报不稳定而分解:H2CO3 === H2O +CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温 CaO+ CO2↑三、置换反应20、铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4 +Cu21、锌和稀硫酸反应(实验室制氢气):Zn+ H2SO4 == ZnSO4+H2↑22、镁和稀盐酸反应:Mg +2HCl === MgCl2 +H2↑23、氢气还原氧化铜:H2 +CuO 加热 Cu +H2O24、木炭还原氧化铜:C+ 2CuO 高温 2Cu +CO2↑25、甲烷在空气中燃烧:CH4 +2O2 点燃 CO2+2H2O26、水蒸气通过灼热碳层:H2O +C 高温 H2 +CO27、焦炭还原氧化铁:3C +2Fe2O3高温 4Fe +3CO2↑四。
初中常见化学式及化学方程式大全

初中常见化学式及化学方程式 常见的化学式一、常见单质二、化合物1、氧化物2、其他化合物3、常见有机化合物初中化学方程式全(已配平).一、化合反应1、镁在空气中燃烧:2Mg+ O2点燃 2MgO2、铁在氧气中燃烧:3Fe +2O2点燃 Fe3O43、铝在空气中燃烧:4Al+ 3O2点燃 2Al2O34、氢气在空气中燃烧:2H2 +O2点燃 2H2O5、红磷在空气中燃烧:4P +5O2点燃 2P2O56、硫粉在空气中燃烧: S+ O2点燃 SO27、碳在氧气中充分燃烧:C +O点燃 CO28、碳在氧气中不充分燃烧:2C +O点燃 2CO9、二氧化碳通过灼热碳层: C +CO2高温2CO10、一氧化碳在氧气中燃烧:2CO +O点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 +H2O === H2CO312、生石灰溶于水:CaO+ H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4+5H2O ==== CuSO4·5H2O14、钠在氯气中燃烧:2Na+ Cl点燃 2NaCl二、分解反应15、实验室用双氧水制氧气:16、加热高锰酸钾:17、水在直流电的作用下分解:18、碳酸化学物理学报不稳定而分解:19、高温煅烧石灰石(二氧化碳工业制法):三、置换反应铁和硫酸铜溶液反应:锌和稀硫酸反应(实验室制氢气):镁和稀盐酸反应:21、氢气还原氧化铜:22、木炭还原氧化铜:23、甲烷在空气中燃烧:24、水蒸气通过灼热碳层:25、焦炭还原氧化铁:26、氢氧化钠溶液与硫酸铜溶液反应:27、甲烷在空气中燃烧:30、酒精在空气中燃烧:C2H5OH+ 3O2点燃 2CO2 +3H2O31、一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO232、一氧化碳还原氧化铁:3CO+ Fe2O3高温 2Fe+ 3CO233、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+ CO2 ==== CaCO3 ↓+ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+ CO2 ==== Na2CO3 +H2O35、石灰石(或小学音乐教案大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 +2HCl === CaCl2 +H2O +CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3+ 2HCl === 2NaCl +H2O +CO2↑一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg+ O2点燃 2MgO2. 铁在氧气中燃烧:3Fe+ 2O2点燃 Fe3O43. 铜在空气中受热:2Cu+ O2加热 2CuO4. 铝在空气中燃烧:4Al +3O点燃 2Al2O35. 氢气中空气中燃烧:2H2 +O点燃 2H2O6. 红磷在空气中燃烧:4P+ 5O2点燃 2P2O57. 硫粉在空气中燃烧: S +O点燃 SO28. 碳在氧气中充分燃烧:C+ O2点燃 CO29. 碳在氧气中不充分燃烧:2C+ O2点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+ O2点燃 2CO211. 甲烷在空气中燃烧:CH4 +2O2点燃 CO2 2H2O12. 酒精在空气中燃烧:C2H5OH +3O2点燃 2CO2+3H2O二.几个分解反应:13. 水在直流电的作用下分新概念英语第一册解:2H2O 通电 2H2↑+ O2↑14. 加热碱式碳酸铜:Cu2(OH)2CO3加热 2CuO +H2O +CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl+ 3O2↑16. 加热高锰酸钾:2KMnO4 加热 K2MnO4 +MnO2 +O2↑17. 碳酸不稳定而分解:H2CO3 === H2O +CO2↑18. 高温煅烧石灰石:CaCO高温 CaO +CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2+ CuO 加热 Cu+ H2O20. 木炭还原氧化铜:C+ 2CuO 高温 2Cu +CO2↑2 初三化学方程式大合集21. 焦炭还原氧化铁:3C+ 2Fe2O高温 4Fe+ 3CO2↑22. 焦炭还原四氧化三铁:2C +Fe3O4高温 3Fe+ 2CO2↑23. 一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO224. 一氧化碳还原氧化铁:3CO+ Fe2O3高温 2Fe +3CO225. 一氧化碳还原四氧化三铁:4CO +Fe3O高温 3Fe+ 4CO2四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+酸 -------- 盐+氢气(置换反应)26. 锌和稀硫酸Zn+ H2SO4 = ZnSO4+ H2↑27. 铁和稀硫酸Fe +H2SO4 = FeSO4+ H2↑28. 镁和稀硫酸Mg +H2SO4 = MgSO4 +H2↑29. 铝和稀硫酸2Al+ 3H2SO4 = Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn +2HCl === ZnCl2+ H2↑31. 铁和稀盐酸Fe+ 2HCl === FeCl2+ H2↑32. 镁和语文教案格式稀盐酸Mg 2HCl === MgCl2+ H2↑33. 铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑(2)金属单质+盐(溶液) ------- 另一种金属+另一种盐34. 铁和硫酸铜溶液反应:Fe+ CuSO4 === FeSO4+ Cu35. 锌和硫酸铜溶液反应:Zn+ CuSO4 === ZnSO4+ Cu36. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2 === Cu(NO3)2 +Hg (3)碱性氧化物+酸 -------- 盐+水37. 氧化铁和稀盐酸反应:Fe2O3+ 6HCl === 2FeCl3+ 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 +3H2SO4 === Fe2(SO4)3+ 3H2O39. 氧化铜和稀盐酸反应:CuO +2HCl ==== CuCl2 +H2O40. 氧化铜和稀硫酸反应:CuO +H2SO4 ==== CuSO4+ H2O41. 氧化镁和稀硫酸反应:MgO+ H2SO4 ==== MgSO4+ H2O42. 氧化钙和稀盐酸反应:CaO +2HCl ==== CaCl2 +H2O(4)酸性氧化物+碱 -------- 盐+水43.苛性钠暴露在空气中变质:2NaOH +CO2 ==== Na2CO3+H2O 44.苛性钠吸收二氧化硫气体:2NaOH +SO2 ==== Na2SO3 +H2O 45.苛性钠吸收三氧化硫气体:2NaOH+ SO3 ==== Na2SO4+ H2O 46.消石灰放在空气中变质:Ca(OH)2+ CO2 ==== CaCO3 ↓+ H2O 47. 消石灰吸收二氧化硫:Ca(OH)2 +SO2 ==== CaSO3↓+H2O(5)酸+碱 -------- 盐+水48.盐酸和烧碱起反应:HCl+ NaOH ==== NaCl+ H2O49. 盐酸和氢氧化钾反应:HCl+ KOH ==== KCl+H2O50.盐酸和氢氧化初中家长会课件铜反应:2HCl+ Cu(OH)2==== CuCl2 +2H2O51. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 ==== CaCl2 +2H2O52. 盐酸和氢氧化铁反应:3HCl+ Fe(OH)3 ==== FeCl3 +3H2O53.氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 ==== AlCl3 +3H2O54.硫酸和烧碱反应:H2SO4 +2NaOH ==== Na2SO4 +2H2O55.硫酸和氢氧化钾反应:H2SO4 +2KOH ==== K2SO4 +2H2O56.硫酸和氢氧化铜反应:H2SO4 +Cu(OH)2 ==== CuSO4 +2H2O57. 硫酸和氢氧化铁反应:3H2SO4 +2Fe(OH)3==== Fe2(SO4)3+ 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸+盐 -------- 另一种酸+另一种盐59.大理石与稀盐酸反应:CaCO3 +2HCl === CaCl2 H2O +CO2↑ 60.碳酸钠与稀盐酸反应: Na2CO3 +2HCl === 2NaCl +H2O+ CO2↑61.碳酸镁与稀盐酸反应: MgCO3 +2HCl === MgCl2 +H2O+CO2↑ 62.盐酸和硝酸银溶液反应:HCl+ AgNO3=== AgCl↓+ HNO363.硫酸和碳酸钠反应:Na2CO3 +H2SO4 === Na2SO4 +H2O +CO2↑64.硫酸和氯化钡溶液反应:H2S O4 +BaCl2 ==== BaSO4↓+ 2HCl (7)碱+盐 -------- 另一种碱+另一种盐65.氢氧化钠与硫酸铜:2NaOH CuSO4 ==== Cu(OH)2↓ Na2SO466.氢氧化钠与氯化铁:3NaOH FeCl3 ==== Fe(OH)3↓ 3NaCl 67.氢氧化钠与氯化镁:2NaOH MgCl2 ==== Mg(OH)2↓ 2NaCl68. 氢氧化钠与氯化铜:2NaOH CuCl2 ==== Cu(OH)2↓ 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 Na2CO3 === CaCO3↓ 2NaOH(8)盐+盐 ----- 两种新盐70.氯化钠溶液新概念英语第二册和硝酸银溶液:NaCl +AgNO3 ==== AgCl↓+ NaNO371.硫酸钠和氯化钡:Na2SO4+ BaCl2 ==== BaSO4↓+ 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2+ H2O === H2CO373.生石灰溶于水:CaO+ H2O === Ca(OH)274.氧化钠溶于水:Na2O +H2O ==== 2NaOH75.三氧化硫溶于水:SO3 +H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO4 5H2O77.无水硫酸铜作干燥剂:CuSO4+ 5H2O ==== CuSO4·5H2化学方程式反应现象应用2Mg+ O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg +O点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+ O点燃或Δ2CuO 红色金属变为黑色固体4Al+ 3O点燃或Δ2Al2O3银白金属变为白色固体3Fe+ 2O点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热 4Fe +3O2高温2Fe2O3C+ O2点燃CO2剧烈燃烧、白光、放热、使石灰水变浑浊S +O2点燃SO2剧大学英语四级烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2 O2点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P +5O2 点燃2P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O点燃2H2O+ CO2蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+ 5O2点燃2H2O +4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO MnO2、Δ2KCl +3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气2KMnOΔ K2MnO4 MnO2 +O2↑ 紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧论文气2HgOΔ2Hg+ O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+ O2↑ 水通电分解为氢气和氧气电解水Cu2(OH)2COΔ2CuO +H2O+ CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCOΔNH3↑+ H2O+ CO2↑白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+ H2SO4=ZnSO4 +H2↑ 有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe +H2SO4=FeSO4 +H2↑ 有大量气泡产生、金属颗粒逐渐溶解Mg +H2SO4 =MgSO4 +H2↑ 有大量气泡产生、金属颗粒逐渐溶解2Al+ 3H2SO4=Al2(SO4)3+ 3H2↑ 有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2Δ 2Fe +3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4 +4HΔ3Fe+ 4H2O 黑色逐渐变为银白色英语翻译、试管壁有液体冶炼金属、利用氢气的还原性WO3 +3HΔ W +3H2O 冶炼金属钨、利用氢气的还原性MoO3 +3H2ΔMo +3H2O 冶炼金属钼、利用氢气的还原性2Na+ ClΔ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2+Cl2点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4 +2NaOH=Cu(OH)2↓+ Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C +O点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2CO +O点燃2CO2蓝色火焰煤气燃烧C+ CuO 高温2Cu+ CO2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+ 3C 高温4Fe+ 3CO2↑ 冶炼金属Fe3O4 +2C高温3Fe+ 2CO2↑ 冶炼金属C+ CO2 高温2COCO2+H2O = H2CO3碳酸使石蕊变红证明碳酸的酸性小学三语文教学论文H2COΔCO2↑+ H2O 石蕊红色褪去Ca(OH)2 +CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3 +H2O+ CO2 = Ca(HCO3)2 白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)Δ CaCO3↓+ H2O +CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCOΔNa2CO3+ H2O +CO2↑ 产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO高温 CaO +CO2↑ 工业制备二氧化碳和生石灰CaCO3 +2HCl=CaCl2+ H2O +CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢初中化学方程式汇总一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg+ O2点燃 2MgO2. 铁在氧气中燃烧:3Fe+ 2O2点燃 Fe3O43. 铜在空气中受热:2Cu+ O2加热 2CuO4. 铝在空气中燃烧:4Al +3O2 点燃2Al2O35. 氢气中空气中燃烧:2H2 +O2 点燃 2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P +5O2点燃 2P2O57. 硫粉在空气中燃烧: S +O点燃 SO28. 碳在氧气中充分燃烧:C +O2点燃 CO29. 碳在氧气中不充分燃烧:2C +O2点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+O2点燃 2CO211. 甲烷在空气中燃烧:CH4 +2O2点燃 CO2 +2H2O12. 酒精在空气中燃烧:C2H5OH +3O2点燃 2CO2 +3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验 2HgO 加热 Hg +O2 ↑14.加热高锰酸钾:2KMnO4加热 K2MnO4+ MnO2 +O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应: H2O2MnO2H2O+ O2↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2通电2H2↑+O2 ↑17.生石灰溶于水英语六级作文:CaO +H2O == Ca(OH)218.二氧化碳可溶于水: H2O+CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg+ O2点燃 2MgO20.铁和硫酸铜溶液反应:Fe+ CuSO4 === FeSO4+ Cu21.氢气还原氧化铜:H2 +CuO 加热 Cu +H2O22. 镁还原氧化铜:Mg+ CuO 加热 Cu +MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2点燃 CO224.木炭还原氧化铜:C + 2CuO 高温 2Cu+ CO2↑25.焦炭还原氧化铁:3C + 2Fe2O高温 4Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C +O点燃 CO227.煤炉的中层:CO2+ C 高温 2CO28.煤炉的上部蓝色火焰的产生:2CO +O2点燃 2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3+ 2HCl == CaCl2+ H2O +CO2↑30.碳酸不稳定而分解:H2CO3 == H2O +CO2↑31.二氧化碳可溶于水: H2O +CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3高温 CaO+ CO2↑ 33.石灰水与中学历史教学园地二氧化碳反应(鉴别二氧化碳):Ca(OH)2 +CO2 === CaCO3↓+H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO 加热 Cu +CO235.一氧化碳的可燃性:2CO +O2点燃 2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 2HCl == 2NaCl+ H2O +CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 +2O2点燃 CO2 +2H2O38.酒精在空气中燃烧:C2H5OH +3O2 点燃 2CO2 +3H2O39.氢气中空气中燃烧:2H2+ O2点燃 2H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg+ O2点燃 2MgO41.铁在氧气中燃烧:3Fe +2O2点燃 Fe3O442. 铜在空气中受热:2Cu +O2加热 2CuO43. 铝在空气中形成氧化膜:4Al+ 3O2 = 2Al2O3(2)金属单质酸 -------- 盐氢气(置换反应)44. 锌和稀硫酸Zn+ H2SO4 = ZnSO4+ H2↑45. 铁和稀硫酸Fe +H2SO4 = FeSO4 +H2↑46. 镁和稀硫酸Mg +H2SO4 = MgSO4+ H2↑47. 铝和稀硫酸2Al+ 3H2SO4 = Al2(SO4)3 +3H2↑48. 锌和稀盐酸Zn+ 2HCl == ZnCl2+ H2↑49. 铁和稀盐酸Fe +2HCl == FeCl2 +H2↑50. 镁和稀盐酸Mg +2HCl == MgCl2+ H2↑51.铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑(3)金属单质盐怎样学好高中物理(溶液) ------- 新金属新盐52. 铁和硫酸铜溶液反应:Fe +CuSO4 == FeSO4 +Cu53. 锌和硫酸铜溶液反应:Zn +CuSO4 ==ZnSO4 +Cu54. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2 == Cu(NO3)2 +Hg(3)金属铁的治炼原理:55.3CO +2Fe2O3 高温 4Fe +3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸金属 -------- 盐氢气(见上)(2)酸金属氧化物-------- 盐水56. 氧化铁和稀盐酸反应:Fe2O3 +6HCl ==2FeCl3 +3H2O57. 氧化铁和稀硫酸反应:Fe2O3 +3H2SO4 == Fe2(SO4)3 +3H2O58. 氧化铜和稀盐酸反应:CuO +2HCl ==CuCl2 +H2O59. 氧化铜和稀硫酸反应:CuO+ H2SO4 == CuSO4+ H2O(3)酸碱 -------- 盐水(中和反应)60.盐酸和烧碱起反应:HCl +NaOH == NaCl+H2O61. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 == CaCl2+2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 == AlCl3 +3H2O63. 硫酸和烧碱反应:H2SO4+ 2NaOH == Na2SO4 +2H2O(4)酸盐 -------- 另一种酸另一种盐64.大理石与稀盐酸反应:CaCO3+2HCl == CaCl2 +H2O+ CO2↑ 65.碳酸钠与稀盐酸反应: Na2CO3 +2HCl == 2NaCl+ H2O+ CO2↑ 66.碳酸氢钠与稀盐酸反应:NaHCO3 +HCl== NaCl+H2O+ CO2↑ 67. 硫酸和氯化钡溶液反应:H2SO4 +BaCl2 == BaSO4↓+2HCl2、碱的幼儿园小班音乐教案化学性质(1)碱非金属氧化物 -------- 盐水68.苛性钠暴露在空气中变质:2NaOH+CO2 == Na2CO3+ H2O 69.苛性钠吸收二氧化硫气体:2NaOH +SO2 == Na2SO3 +H2O 70.苛性钠吸收三氧化硫气体:2NaOH+ SO3 == Na2SO4 +H2O 71.消石灰放在空气中变质:Ca(OH)2+ CO2 == CaCO3↓+H2O72. 消石灰吸收二氧化硫:Ca(OH)2 +SO2 == CaSO3↓+ H2O(2)碱酸-------- 盐水(中和反应,方程式见上)(3)碱盐 -------- 另一种碱另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 +Na2CO3 == CaCO3↓+ 2NaOH3、盐的化学性质(1)盐(溶液)金属单质------- 另一种金属另一种盐74. 铁和硫酸铜溶液反应:Fe+ CuSO 4 == FeSO 4 +Cu(2)盐 酸-------- 另一种酸 另一种盐75.碳酸钠与稀盐酸反应: Na 2CO 3 +2HCl == 2NaCl +H 2O+ CO 2↑ 碳酸氢钠与稀盐酸反应:NaHCO 3 +HCl== NaCl+ H 2O +CO 2↑(3)盐 碱 -------- 另一种碱 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 +Na 2CO 3 == CaCO 3↓+ 2NaOH(4)盐 盐 ----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl +AgNO 3 == AgCl↓+NaNO 378.硫酸钠和氯化钡:Na 2SO 4 +BaCl 2 == BaSO4↓+2NaCl一、其他反应类型1、二氧化碳通入澄清石灰水中:CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O2、氢氧化钠在空气中变质:CO 2+ 2NaOH = Na 2CO 3 + H 2O3、氢氧化钠溶液吸收二氧化硫:SO 2 + 2NaOH ==Na 2SO 3+ H 2O4、一氧化碳还原氧化铜:CO + CuO Cu + CO 25、酒精燃烧:C 2H 5OH + 3O 2 2CO 2 + 3H 2O6、甲烷燃烧:CH 4 + 2O 2 CO 2 + 2H 2O△ 点燃 点燃。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初中常见化学式和化学方程式➢常见的化学式
➢常见的化学方程式
一、化合反应
1、红磷在空气(或氧气)中燃烧:
2、氢气在空气中燃烧生成水:
3、硫磺在空气(或氧气)中燃烧:
4、镁条在空气(或氧气)中燃烧:
5、铁丝在氧气中燃烧:
6、木炭在空气(或氧气)中完全燃烧:
7、木炭不充分燃烧:
8、一氧化碳燃烧:
9、二氧化碳和水反应生成碳酸:
10、二氧化碳通过灼热的炭层:
二、分解反应
11、高锰酸钾制氧气:
12、氯酸钾制氧气:
13、双氧水制氧气:
14、电解水:
15、碳酸分解:
16、高温煅烧石灰石:
三、置换反应
18、铁和硫酸铜溶液反应:
19、锌和硫酸反应制取氢气:
20、铝和稀硫酸反应:
21、木炭还原氧化铁:
木炭还原氧化铜:
四、复分解反应
(一)酸 + 碱→盐 + 水
22、氢氧化钠与盐酸反应:
23、氢氧化钠与硫酸反应:
24、氢氧化铝治疗胃酸过多:
25、氢氧化镁与硫酸反应:
(二)酸 + 盐→另一种酸 + 另一种盐26、盐酸与硝酸银溶液反应:
27、氯化钡溶液与硫酸溶液反应:
28、碳酸钠与稀盐酸:
29、石灰石与稀盐酸反应制取二氧化碳:
(三)碱 + 盐→另一种碱 + 另一种盐30、硫酸铜溶液和氢氧化钠溶液反应:
31、氯化铁溶液和氢氧化钠溶液反应:
(四)盐 + 盐→两种新盐
32、硝酸银溶液与氯化钠溶液反应:
33、氯化钡溶液与碳酸钠溶液反应:
(五)金属氧化物 + 酸→盐 + 水34、稀盐酸清洗铁锈:
五、其他反应类型
36、二氧化碳通入澄清石灰水中:
37、氢氧化钠在空气中变质:
38、氢氧化钠溶液吸收二氧化硫:
39、一氧化碳还原氧化铜:
40、酒精燃烧:
41、甲烷燃烧:。
