高考化学微测试系列专题29化学平衡常数及化学平衡相关计算含解析1
化学反应的平衡常数计算方法和公式例题

化学反应的平衡常数计算方法和公式例题化学反应的平衡常数是指在恒定温度下,反应物和生成物之间的浓度之比的乘积。
平衡常数的大小决定了反应的方向和反应的强弱,因此对于化学反应的平衡常数的计算方法和公式掌握至关重要。
本文将介绍平衡常数的计算方法,并给出一些例题,帮助读者更好地理解。
1. 平衡常数的定义平衡常数(K)是指在给定温度下,在一个封闭的系统中,反应物浓度与生成物浓度之比的乘积。
对于一般化学反应的平衡常数表达式为:aA + bB ⇌ cC + dD则反应的平衡常数表达式为:K = [C]^c[D]^d / [A]^a[B]^b其中,[X]表示物质X的浓度。
2. 平衡常数的计算方法(1)根据已知量的浓度计算平衡常数:如果在平衡状态下,反应物和生成物的浓度已知,就可以直接根据反应式中的系数来计算平衡常数。
例如,对于以下反应:2NO2 ⇌ N2O4若已知反应物NO2和生成物N2O4的浓度分别为0.2mol/L和0.1mol/L,则平衡常数为:K = [N2O4] / [NO2]^2 = 0.1 / (0.2)^2 = 2.5(2)根据反应物和生成物的反应度计算平衡常数:反应度是指单位时间内反应物消耗或生成物产生的物质的量。
若反应物和生成物的反应度已知,则可以通过反应度来计算平衡常数。
例如,对于以下反应:N2 + 3H2 ⇌ 2NH3若已知速度常数k1、k2和速度v1、v2,其中k1、k2分别表示反应物和生成物在正向和反向反应的速度常数,v1、v2分别表示正向和反向反应的速度,则平衡常数为:K = (v2 / (v1)^2) * (1 / (k1 * k2))3. 平衡常数的单位平衡常数的单位取决于反应式中物质的浓度单位。
一般来说,如果浓度用摩尔浓度表示(mol/L),则平衡常数不带单位;如果浓度用摩尔分数表示,则平衡常数带有浓度单位。
4. 平衡常数的意义和应用平衡常数的大小决定了反应的方向和反应的强弱。
化学平衡的相关计算

化学平衡的相关计算化学平衡是指在化学反应中,反应物转化为产物的速度与产物转化为反应物的速度达到平衡的状态。
在化学平衡中,反应物和产物的浓度以及温度都是重要的因素,通过这些因素可以进行相关的计算。
本文将介绍化学平衡的相关计算方法。
一、化学平衡常数的计算方法化学平衡常数是描述化学平衡位置的物理量,用K表示。
对于一般的化学反应:aA+bB↔cC+dD反应物的浓度的分子数乘积除以产物的浓度的分子数乘积的比值,即可得到化学平衡常数K:K=([C]^c[D]^d)/([A]^a[B]^b)其中,[C]、[D]、[A]、[B]分别表示产物C、D和反应物A、B的浓度。
二、反应浓度的计算反应物和产物的浓度是进行化学平衡计算的重要因素。
根据反应物和产物的摩尔化学计量关系以及它们在平衡状态下的浓度,可以计算出平衡反应物和产物的浓度。
三、平衡常数的影响因素与计算1.温度:随着温度的升高,化学反应速率会增加,使得平衡位置发生变化。
根据反应热力学原理,可以利用反应焓变和温度的关系,计算出在不同温度下的平衡常数。
ΔG=ΔH-TΔS其中,ΔG表示反应的标准自由能变化,ΔH表示反应的标准焓变,T表示温度,ΔS表示反应的标准熵变。
2.压力:对于涉及气体的反应,可以通过改变压力来影响平衡位置。
根据Le Chatelier原理,当反应物和产物中有气体参与反应时,压力增大会使平衡位置向低压方向移动,反之亦然。
根据反应物和产物的分压与平衡常数的关系,可以计算出平衡常数与压力之间的关系。
3.浓度:根据浓度与平衡常数之间的关系,可以计算出化学平衡位置与浓度之间的关系。
当反应物或产物的浓度发生变化时,根据Le Chatelier原理,平衡位置会发生变化,使得浓度变化的方向尽量减小。
四、平衡计算实例以下为一个平衡计算的实例:反应为:2SO2(g)+O2(g)↔2SO3(g)假设在其中一温度下,反应物SO2和O2的初始浓度分别为0.2mol/L,产物SO3的初始浓度为0.1mol/L,求平衡浓度以及平衡常数。
高中化学平衡常数计算题解析与技巧分享

高中化学平衡常数计算题解析与技巧分享在高中化学学习中,平衡常数计算题是一个重要的考点。
通过解析和分享一些解题技巧,希望能够帮助高中学生或他们的父母更好地理解和应对这类题目。
一、平衡常数的定义和计算方法平衡常数是指在化学反应达到平衡时,反应物与生成物浓度之比的乘积,其数值表示了反应的平衡倾向性。
在计算平衡常数时,我们需要知道反应物和生成物的化学方程式以及各自的浓度。
例如,对于以下反应:2A + 3B ⇌ C + 2D其平衡常数表达式为:Kc = [C] * [D]^2 / ([A]^2 * [B]^3)其中,[A]、[B]、[C]、[D]分别表示反应物A、B和生成物C、D的浓度。
二、平衡常数计算题的解析与技巧1. 确定平衡常数表达式在解答平衡常数计算题时,首先要根据给定的化学方程式,确定平衡常数的表达式。
这个表达式是根据反应物和生成物的物质的量关系推导出来的。
2. 确定各物质的浓度在计算平衡常数时,需要知道反应物和生成物的浓度。
这些浓度可以通过题目中给出的信息直接得到,也可以通过已知的物质的物质的量和体积计算得到。
需要注意的是,在计算浓度时,要将给定的物质的物质的量和体积转化为摩尔和升。
3. 填入数值计算平衡常数将已知的浓度代入平衡常数的表达式中,计算得到平衡常数的数值。
在计算过程中,要注意单位的转换和计算的准确性。
4. 判断平衡常数的大小和平衡倾向性通过计算得到的平衡常数的数值,可以判断反应的平衡倾向性。
当平衡常数大于1时,表示生成物浓度较大,反应向右偏;当平衡常数小于1时,表示反应物浓度较大,反应向左偏。
平衡常数越大,反应越倾向于生成物;平衡常数越小,反应越倾向于反应物。
三、举一反三通过以上的解析和技巧分享,我们可以举一反三,应用到更多的平衡常数计算题中。
例如,对于以下反应:N2 + 3H2 ⇌ 2NH3已知反应物氮气(N2)的浓度为0.2 mol/L,氢气(H2)的浓度为0.5 mol/L,氨气(NH3)的浓度为0.1 mol/L。
高考化学热点题型训练有关化学平衡常数的计算含解析

有关化学平衡常数的计算1. T℃,分别向10ml浓度均为1mol/L的两种弱酸HA、HB中不断加水稀释,并用pH传感器测定溶液pH。
所得溶液pH的两倍(2pH) 与溶液浓度的对数(1gc) 的关系如图所示。
下列叙述正确的是己知:(1)HA的电离平衡常数K a=[c(H+)·c(A-)]/[c(HA)-c(A-)]≈c2(H+)/c(HA);(2)pK a=-lgK aA. 弱酸的K a随溶液浓度的降低而增大B. a 点对应的溶液中c(HA)=0.1mol/L,pH=4C. 酸性:HA<HBD. 弱酸HB的pK a=5【答案】B【解析】K a为温度的函数,温度不变,K a就不变,A错误;a 点对应的溶液中1gc=-1,则 c(HA)=0.1mol/L,对应的pH=4,B正确;通过图像看出,如果两种酸的浓度相等时,HA溶液的pH小于HB溶液的pH,所以酸性HA>HB,C错误;根据图像看出,当1gc=0时,c(HB)=1mol/L, c(H+)=1×10-5mol/L,HB的电离平衡常数K a=c2(H+)/c(HB)=(1×10-5)2/1=1×10-10, pK a=-lgK a=-lg×10-10=10,D错误。
2.乙烯气相直接水合反应制备乙醇:C 2H4(g)+H2O(g) C2H5OH(g)。
乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。
下列分析不正确...的是A. 乙烯气相直接水合反应的∆H<0B. 图中压强的大小关系为:p1>p2>p3C. 图中a点对应的平衡常数K =5 16D. 达到平衡状态a 、b 所需要的时间:a >b 【答案】B【分析】依据图像分析,在同一个压强下,随着温度的升高,乙烯平衡转化率降低,不利于平衡向正反应方向进行,可知该反应正方向为放热反应;根据C 2H 4(g)+H 2O(g)C 2H 5OH(g)可知,该反应是气体分子数减小的体系,再结合平衡常数表达式及压强与温度对速率与平衡的影响作答。
化学平衡的平衡常数计算

化学平衡的平衡常数计算化学平衡是指在一定的条件下,反应物与生成物的浓度或压力不再发生变化的状态。
平衡常数则是用来描述反应的平衡程度,可以通过该常数来确定反应的方向以及反应物与生成物的浓度或压力比例。
本文将介绍化学平衡的平衡常数的计算方法。
一、平衡常数的定义平衡常数(Keq)是在一定温度下,反应物与生成物浓度的比例的乘积的指数与各物质的摩尔浓度比例之积的比值。
对于一般反应aA + bB ⇌ cC + dD,其平衡常数可以表示为:Keq = [C]^c[D]^d / [A]^a[B]^b其中,[A]、[B]、[C]、[D]分别表示反应物A、B和生成物C、D的浓度。
二、浓度和压力的影响平衡常数的数值与反应物和生成物的浓度(或压力)直接相关。
当平衡常数的值大于1时,生成物的浓度相对较多,而当平衡常数的值小于1时,反应物的浓度相对较多。
对于已知反应物和生成物的浓度,可以通过平衡常数来计算未知物质的浓度。
在计算平衡常数时,需要注意物质的浓度要以摩尔浓度表示,即物质的摩尔数与溶液体积的比值。
三、酸碱反应中的平衡常数计算在酸碱反应中,平衡常数被称为酸碱反应常数(Ka或Kb)。
酸碱反应的平衡常数可以通过酸解离常数(Ka)和碱解离常数(Kb)来计算。
对于一般的酸碱反应为HA + H2O ⇌ H3O+ + A-,其酸解离常数Ka 的计算公式如下:Ka = [H3O+][A-] / [HA]其中,[HA]表示酸的浓度,[H3O+]表示氢离子(H+)的浓度,[A-]表示酸根离子的浓度。
类似地,碱解离常数Kb的计算公式如下:Kb = [OH-][BH+] / [B]其中,[B]表示碱的浓度,[BH+]表示氢氧根离子(OH-)的浓度,[OH-]表示氢氧根离子的浓度。
四、气体平衡反应中的平衡常数计算在气体平衡反应中,平衡常数可以使用浓度或压力来计算。
当选择使用压力来计算平衡常数时,需要根据气体的分压来确定平衡常数的数值。
对于一般的气体反应aA + bB ⇌ cC + dD,平衡常数可以通过反应物和生成物的分压比例来计算。
《高考化学复习专题》化学平衡常数及简单计算

2NO(g)+Cl2(g) 2ClNO(g) K2 ΔH2<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数 K= (用 K1、K2 表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向 2 L 恒容密闭
容器中加入 0.2 mol NO 和 0.1 mol Cl2,10 min 时反应(Ⅱ)达到平衡。测得 10
min 内 v(ClNO)=7.5×10-3 mol·L-1·min-1,则平衡后 n(Cl2)=
mol,NO
的转化率 α1=
。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平
衡时 NO 的转化率 α2
α1(填“>”“<”或“=”),平衡常数 K2
(填
“增大”“减小”或“不变”)。若要使 K2 减小,可采取的措施
COCl2(g) Cl2(g)+CO(g) ΔH=+108 kJ·mol-1
④比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率 (平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示)的大小 ____________________; ⑤比较反应物COCl2在5~6 min和15~16 min时平均反应速率的大 小;v(5~6)________v(15~16)(填“<”、“>”或“=”),原因 是____________________。
起始浓度
甲乙丙
c(H2)(mol/L) 0.010 0.020 0.020 c(CO2)(mol/L) 0.010 0.010 0.020
下列判断不正确的是( C )
A.平衡时,乙中 CO2 的转化率大于 60% B.平衡时,甲中和丙中 H2 的转化率均是 60% C.平衡时,丙中 c(CO2)是甲中的 2 倍,是 0.012 mol/L D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
高考化学热点:化学平衡常数及平衡转化率的计算
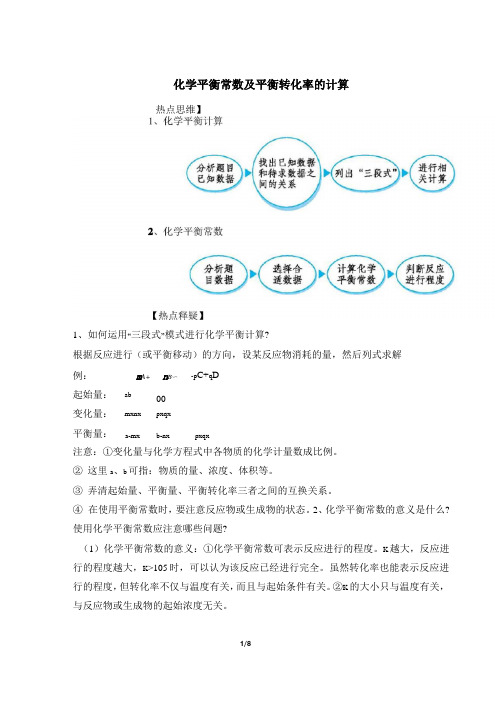
化学平衡常数及平衡转化率的计算热点思维】1、如何运用“三段式”模式进行化学平衡计算?根据反应进行(或平衡移动)的方向,设某反应物消耗的量,然后列式求解例:m A+n B〜-p C+q D起始量:ab00变化量:mxnx pxqx平衡量:a-mx b-nx pxqx注意:①变化量与化学方程式中各物质的化学计量数成比例。
②这里a、b可指:物质的量、浓度、体积等。
③弄清起始量、平衡量、平衡转化率三者之间的互换关系。
④在使用平衡常数时,要注意反应物或生成物的状态。
2、化学平衡常数的意义是什么?使用化学平衡常数应注意哪些问题?(1)化学平衡常数的意义:①化学平衡常数可表示反应进行的程度。
K越大,反应进行的程度越大,K>105时,可以认为该反应已经进行完全。
虽然转化率也能表示反应进行的程度,但转化率不仅与温度有关,而且与起始条件有关。
②K的大小只与温度有关,与反应物或生成物的起始浓度无关。
(2)在使用化学平衡常数时应注意:①不要把反应体系中纯固体、纯液体以及稀溶液中水的浓度写进平衡常数表达式中,但非水溶液中,若有水参加或生成,则此时水的浓度不可视为常数,应写进平衡常数表达式中。
②同一化学反应,化学反应方程式写法不同,其平衡常数表达式及数值亦不同。
因此书写平衡常数表达式及数值时,要与化学反应方程式相对应,否则就没有意义。
【热点考题】【典例】【2014年高考四川卷第7题】在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)=M(g)+N(g),所得实验数据如下表:下列说法正确的是A.实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率u(N)1.0x10」2mol/(L・min)B.实验②中,该反应的平衡常数K=2.0C.实验③中,达到平衡是,X的转化率为60%D.实验④中,达到平衡时,b>0.060【答案】C【解析】取冥验①中,若血in时测得n(M)=0.050mol;浓度是0.0050mol/L^贝H根据反应的化学方程式可知,同时主成的N的物质的量也是O.OOBOmol/L,因此0至血山时间内,用M 表示的平均反应辭U(N)=0.0050mol/L-r-5min=l.OX10_3mol/(L■min);A不正确;E、实验②中,平衡时M的浓度是0.OOSOmol/L;则同时生成的N的浓度是0.OOSOmol/L,'消耗X与Y的浓度均是0.0080moL/L,因此平衡时蓝和Y的浓度分别为0.01mol/L-0.0080jnoL/L=0.002jnoL/L,0.04mol/L-0.0080mol/L=0.032mol/L,因此反应的平衡常数^To02X0.032°=b B 不正确'亡、根据反应的化学方程式可灿如果X的转化率为旳虬则X(g)+Y(g)亍二M(g)+N(g)转化浓度(mol/L)0.0120.0120.0120.012为砂緞C 正确;70013时X(g)++N(g)起始液度(mol/L)0.040 0.010 0 转化液度(mol/ll)0.009 0.009 0.009 平衡浓度(mol/L)0.031 0.0010.0090 0.009 0.0090.009x0.0090.031x0.001 =2.9>1,这说明升高温度平衡常数减小,温度不变,平衡常数不变,则在;:鶯;囂=1,即反应达到平衡状态,因此最终平衡时蓝的转化率即平衡向逆反应方向移动,因此正方应是放热反应。
高考化学(全国通用):平衡常数与计算及反应进行方向(PPT讲解版)

答案解析2
解析:
由题意,列三段式,得
N2 + 3H2 ⇌ 2NH3
起始量(mol) 5 8
0
转化量(mol) 2 6
4
2min后(mol) 3 2
4
v(H ) 2
(1)
c(H ) 2 t
6mol 5L 2 min
0.6mol / (L min)
(2) (N2)
n转 (N2 ) n起 (N2 )
100%
0
0
px
qx
px
qx
5、恒温恒容容器,平衡时气体总压强与起始时气体总n 压强的比
PV nRT(恒温恒容)
P与n成正比,得 P平衡 = 平衡
P 起始
n起始
故
6、恒温恒压容器,平衡时气体m密度与起始时气体密度的比 n
PV nRT(恒温恒压)和 = 气 V
与n成反比,得
平衡 起始
=n平起衡始
P平衡 = a-mx+b-nx+px+qx
PART 1
构建平衡常数&计算及反应进行方向 知识网络图
帮你快速了解本节课主题,清楚注意事项,对学习收获了然于心
DREAM OF THE FUTURE
平衡常数&计算及反应进行方向 知识网络图:
化学平衡常数
相关计算题型
可逆反应 mA(g) nB(g) 压强)分别为a、b。
pC(g) qD(g),令物质A、B的起始物质的量(或浓度或气体体积或气体
100%
由a:b>m:n知A过量,则理论可获得物质C的物质的量为
bp,故 n
W
(C )
px bp
100%
n
相关计算题型
化学反应的平衡常数计算公式和例题

化学反应的平衡常数计算公式和例题化学反应的平衡常数是描述反应在达到平衡状态下各物质浓度的数值。
在化学反应中,平衡常数是非常重要的指标,可以帮助我们了解反应的进行方向和程度。
本文将介绍平衡常数的计算公式和通过例题来解释其应用。
一、平衡常数的基本概念和计算公式在化学反应中,平衡常数(K)定义为在特定温度下,反应物和生成物浓度的乘积之比。
对于一般的反应方程式:aA + bB ⇌ cC + dD,平衡常数计算公式如下:K = [C]^c[D]^d / [A]^a[B]^b其中,方括号表示物质的浓度,上标表示物质的摩尔系数。
平衡常数是与温度密切相关的,反应在不同温度下其平衡常数也会有所不同。
此外,平衡常数与反应物和生成物的物质摩尔比有关,可以通过确定平衡浓度来计算。
平衡常数的数值可以告诉我们反应的方向和程度。
当K大于1时,表示反应向生成物的方向进行,生成物浓度高于反应物浓度;当K小于1时,表示反应向反应物的方向进行,反应物浓度高于生成物浓度;当K等于1时,反应物和生成物的浓度相等,反应处于平衡状态。
二、平衡常数计算公式的应用举例下面通过例题来进一步说明平衡常数计算公式的应用。
例题1:对于反应方程式H2(g) + I2(g) ⇌ 2HI(g),在25℃下,平衡浓度为[H2] = 1.0mol/L,[I2] = 0.5mol/L,[HI] = 2.0mol/L,请计算平衡常数K的数值。
根据平衡常数计算公式K = [HI]^2 / [H2][I2],代入浓度数值得:K = (2.0mol/L)^2 / (1.0mol/L)(0.5mol/L) = 8.0mol/L因此,在25℃下,反应H2(g) + I2(g) ⇌ 2HI(g)的平衡常数K为8.0mol/L。
例题2:对于反应方程式2NO2(g) ⇌ N2O4(g),在特定温度下,平衡常数为K = 2.0。
已知平衡时,[NO2] = 0.1mol/L,请计算平衡时[N2O4]的浓度。
高中化学平衡常数计算题型解析及应用

高中化学平衡常数计算题型解析及应用一、引言化学平衡常数计算是高中化学中的重要内容之一,也是考试中常见的题型。
掌握平衡常数计算方法对于学生来说至关重要,本文将对平衡常数计算题型进行解析,并给出一些应用示例,帮助高中学生更好地掌握这一知识点。
二、平衡常数计算题型解析1. 平衡常数的定义平衡常数(K)是指在特定温度下,反应物浓度的乘积与生成物浓度的乘积之比。
对于一般的化学反应aA + bB ↔ cC + dD,平衡常数的表达式为K =[C]^c[D]^d / [A]^a[B]^b,其中方括号表示物质的浓度。
2. 平衡常数的计算平衡常数的计算需要根据题目给出的反应方程式和浓度信息进行推导。
以下通过两个具体的例子来说明。
例1:已知反应方程式2A + B ↔ 3C,平衡时A的浓度为0.2 mol/L,B的浓度为0.3 mol/L,C的浓度为0.5 mol/L,求平衡常数K。
解析:根据平衡常数的定义,K = [C]^3 / [A]^2[B]。
代入已知数据,得K = (0.5)^3 / (0.2)^2(0.3) = 31.25。
例2:已知反应方程式N2 + 3H2 ↔ 2NH3,平衡时N2的浓度为0.4 mol/L,H2的浓度为0.6 mol/L,NH3的浓度为0.8 mol/L,求平衡常数K。
解析:根据平衡常数的定义,K = [NH3]^2 / [N2][H2]^3。
代入已知数据,得K = (0.8)^2 / (0.4)(0.6)^3 = 1.481。
通过以上两个例子,我们可以看出平衡常数的计算方法是根据反应方程式和给定浓度,将浓度代入平衡常数的表达式中进行计算。
三、平衡常数计算的应用平衡常数计算不仅仅是为了解答题目,更重要的是应用于实际问题的解决。
以下通过两个应用示例来说明。
应用示例1:利用平衡常数计算反应方向已知反应方程式N2 + 3H2 ↔ 2NH3,平衡时N2的浓度为0.4 mol/L,H2的浓度为0.6 mol/L,NH3的浓度为0.8 mol/L。
人教版高三化学重难点强化训练:化学平衡常数及计算、等效平衡(word版含答案)

化学平衡常数及计算、等效平衡知识归纳化学平衡常数1、概念:在一定温度下,一个可逆反应达到化学平衡时,生成物浓度幂之积与生成物浓度幂之积的比值是一个常数,用符号K表示。
2、表达式:对于一般的可逆反应:mA(g)+nB(g)pC(g)+qD(g),在一定温度下达到平衡时:3、意义(1)(2)化学平衡常数是指某一具体反应方程式的平衡常数。
①若反应方向改变,则平衡常数改变。
②若方程式中各物质的计量数等倍扩大或缩小,尽管是同一反应,平衡常数也会改变。
等效平衡及其应用在相同条件下(定温、定容或定温、定压),同一可逆反应体系,不管是从正反应开始,还是从逆反应开始,只要按化学计量数之比投入反应物或生成物,在达到化学平衡状态时,所建立起来的化学平衡状态都是相同的,这样的化学平衡互称为等效平衡。
1、等效平衡的标志我们所说的“等效平衡”与“完全相同的平衡状态”不同;“完全相同的平衡状态”在达到平衡状态时,任何组分的物质的量分数(或体积分数)对应相等,并且反应的速率等也相同;而“等效平衡”只要求平衡混合物中各组分的物质的量分数(或体积分数)对应相同,反应的速率、压强等可以不同。
2、等效平衡的分类在等效平衡中比较常见并且重要的类型主要有以下几种:(1)定温、定容条件下的等效平衡:①化学反应前后气体分子数改变的等效平衡。
②化学反应前后气体分子数不变的等效平衡。
(2)定温、定压条件下的等效平衡。
化学平衡相关的计算1、分析三个量:即起始量、变化量、平衡量。
2、明确三个关系:(1)对于同一反应物,起始量-变化量=平衡量。
(2)对于同一生成物,起始量+变化量=平衡量。
(3)各转化量之比等于各反应物的化学计量数之比。
3、计算方法:三段式法化学平衡计算模式:对以下反应:m A(g)+n B(g) p C(g)+q D(g),令A、B起始物质的量(mol)分别为a、b,达到平衡后,A的消耗量为mx,容器容积为V L。
m A(g) +n B(g) p C(g)+q D(g)起始(mol) a b0 0变化(mol) mx nx px qx平衡(mol) a-mx b-nx px qx化学平衡常数的理解和应用1、化学平衡常数表达式(1)能代入平衡常数表达式的气体、溶液中的溶质,固体与纯液体浓度可看为常数,不能代入。
高考化学复习 化学平衡常数及其计算习题含解析

高考化学复习 化学平衡常数及其计算1.随着汽车数量的逐年增多,汽车尾气污染已成为突出的环境问题之一。
反应:2NO(g)+2CO(g)2CO 2(g)+N 2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K 时平衡常数为1×1059。
下列说法正确的是( )A .提高尾气净化效率的最佳途径是研制高效催化剂B .提高尾气净化效率的常用方法是升高温度C .装有尾气净化装置的汽车排出的气体中不再含有NO 或COD .570 K 时,及时抽走CO 2、N 2,平衡常数将会增大,尾气净化效率更佳解析:提高尾气净化效率的最佳途径是研制高效催化剂,加快反应速率,A 正确,B 错误;题中反应为可逆反应,装有尾气净化装置的汽车排出的气体中仍然含有NO 或CO ,C 错误;改变浓度对平衡常数无影响,平衡常数只与温度有关,D 错误。
答案:A2.在淀粉KI 溶液中存在下列平衡:I 2(aq)+I -(aq)I -3(aq)。
测得不同温度下该反应的平衡常数K 如表所示。
下列说法正确的是( )t /℃ 5 15 25 35 50 K1 100841689533409A.反应I 2(aq)+I -(aq)I -3(aq)的ΔH >0B .其他条件不变,升高温度,溶液中c (I -3)减小C .该反应的平衡常数表达式为K =c (I 2)·c (I -)c (I -3)D .25 ℃时,向溶液中加入少量KI 固体,平衡常数K 小于689解析:A 项,温度升高,平衡常数减小,因此该反应是放热反应,ΔH <0,错误;B 项,温度升高,平衡逆向移动,c (I -3)减小,正确;C 项,K =c (I -3)c (I 2)· c (I -),错误;D 项,平衡常数仅与温度有关,25 ℃时,向溶液中加入少量KI 固体,平衡正向移动,但平衡常数不变,仍然是689,错误。
答案:B3.(2019·深圳质检)对反应:a A(g)+b B(g)c C(g)+d D(g) ΔH ,反应特点与对应的图象的说法不正确的是( )A.图①中,若P1>P2,则该反应在较低温度下有利于自发进行B.图②中,若T2>T1,则ΔH<0 且a+b=c+dC.图③中t1时刻改变的条件一定是使用了催化剂D.图④中,若ΔH<0,则纵坐标不可能表示的是反应物的转化率解析:A项,由分析图①可知,温度升高,A%增大,说明平衡逆移动,则正反应为放热反应,若P1>P2,P1时A%低于P2,压强增大,平衡正向移动,则反应前气体分子数小于反应后气体分子数,ΔS<0,则该反应在较低温度下有利于自发进行,正确;B项,图②中,压强增大,A的转化率不变,平衡不移动,则a+b=c+d,若T2>T1,A的转化率降低,平衡逆移动,则正反应为放热反应,ΔH<0,正确;C项,图③中t1时刻改变的条件可能是使用了催化剂,也可能是增大压强(当a+b=c+d时),错误;D项,图④中,T1>T2,若ΔH<0,升高温度平衡逆向移动,转化率减小,则纵坐标不可能表示的是反应物的转化率,D正确。
高考化学真题化学平衡计算

高考化学真题化学平衡计算化学平衡是化学反应达到动态平衡时的状态,它可以通过化学平衡常数K来描述。
在高考化学考题中,化学平衡的计算题目非常常见,需要根据已知的条件进行计算。
本文将通过几个例子,详细介绍高考化学真题中的平衡计算问题。
例一:已知氮氧化合物N2O4与NO2在400K时达到平衡,试计算该温度下N2O4与NO2的平衡常数K。
解析:在400K时,N2O4与NO2达到平衡,可以写出平衡反应式:N2O4(g) ⇌2NO2(g)首先,根据平衡反应式可以确定平衡常数表达式为:K = [NO2]^2/[N2O4]其中,[NO2]表示NO2的浓度,[N2O4]表示N2O4的浓度。
根据题目已知条件,可以设定NO2和N2O4的浓度为x和y。
根据反应式中物质的摩尔之比,可以得到:x = 2y在400K时,根据热力学第一定律,平衡时物质的化学势相等,可以得到方程:ΔG = ΔH - TΔS = 0其中,ΔH是反应的焓变,T是温度,ΔS是反应的熵变。
根据题目已知条件,可以得到ΔH = 60 kJ/mol,T = 400K。
而熵变ΔS可以通过标准摩尔熵值来计算,已知N2O4与NO2的标准摩尔熵值分别为100 J/K·mol和150 J/K·mol,可以得到熵变ΔS = (2×150)-100 - 2×(100)= 100 J/K·mol。
将以上已知数据代入方程,可以得到:60 - 400×100×10^-3 = 0可以解得ΔG = -40 kJ/mol根据ΔG与K之间的关系,可以得到:ΔG = -RT lnK其中,R为气体常数,T为温度。
代入已知数据,可以解得:-40×10^3 = -8.314×400×lnK可以解得lnK = 12.037最后,求得K = e^12.037 ≈ 166701.6因此,在400K时,N2O4与NO2的平衡常数K约等于166701.6。
化学平衡计算高考题及答案

常考点高考题——化学平衡计算掌握可逆反应中各种物质的初始量、变化量及平衡量,以及它们间的关系,就能解答一般化学平衡的计算题。
只不过对于特殊的平衡有其特殊的规律,可进行特殊解法或技巧解题。
一般化学平衡问题的计算1.某体积可变的密闭容器,盛有适量的A 和B 的混合气体,在一定条件下发生反应:A +3B 2C 若维持温度和压强不变,当达到平衡时,容器的体积为V L ,其中C 气体的体积占有10%,下列推断正确的是 ( )① 原混合气体的体积为1.2V L ② 原混合气体的体积为1.1V L③ 反应达平衡时气体A 消耗掉0.05V L ④ 反应达平衡时气体B 消耗掉0.05V LA. ②③B. ②④C. ①③D. ①④2.在5 L 的密闭容器中充入2 mol A 气体和1 mol B 气体,在一定条件下发生反应:2A (g )+B (g )2C (g ),达平衡时,在相同温度下测得容器内混合气体的压强是反应前的65,则A 的转化率为 ( ) A . 67% B . 50% C . 25% D . 5%(99广东)3.在一密闭溶器中,用等物质的量的A 和B 发生如下反应:A(g)+2B(g) 2C(g)反应达到平衡时,若混合气体中A 和B 的物质的量之和与C 的物质的量相等,则这时A 的转化率为 ( )A. 40%B. 50%C. 60%D. 70%4.在373K 时,把0.5 mol N 2O 4气通入体积为5 L 的真空密闭容器中,立即出现棕色。
反应进行至2 s 时,NO 2的浓度为0.02 mol / L 。
在60 s 时,体系已达平衡,此时容器内压强为开始时的1.6倍。
下列说法正确的是 ( )A . 前2 s ,以N 2O 4的浓度变化表示的平均反应速率为0.01 mol / (L ·s )B . 在2 s 时体系内的压强为开始时的1.1倍C . 在平衡时体系内含N 2O 40.25 molD . 平衡时,如果压缩容器体积,则可提高N 2O 4的转化率(90MCE )5.m mol C 2H 2跟n mol H 2在密闭容器中反应,当其达到平衡时,生成p mol C 2H 4,将平衡混和气体完全燃烧生成CO 2和H 2O ,所需氧气的物质的量是 ( )A. 3m +n molB.52m +12n -3p mol C. 3m +n +2p mol D.52m +12n mol6.X 、Y 、Z 为三种气体,把a mol X 与b mol Y 充入一密闭容器中,发生反应X +2Y 2Z ,达到平衡时,若它们的物质的量满足:n (X)+n (Y)=n (Z),则Y 的转化率为( ) A. 5b a +×100% B. b b a 5)(2+×100% C. 5)(2b a +×100% D. ab a 5+×100% 7. 将等物质的量的A 、B 、C 、D 四种物质混和,发生如下反应:a A +b Bc C(s)+d D当反应进行一定时间后,测得A 减少了n mol ,B 减少了12n mol ,C 增加了32n mol ,D增加了n mol ,此时达到化学平衡:(1) 该化学方程式中各物质的化学计量数为:a = 、b = 、 c = 、d = 。
化学平衡与化学平衡常数、转化率及相关计算(解析版)

化学平衡与化学平衡常数、转化率及相关计算1某温度下,在容积为2L的密闭容器中,X(g)、Y(g)、Z(g)三种物质的物质的量随时间变化的曲线如图所示,已知4min时改变了一个条件。
下列说法错误的是()A.反应进行到a点时,Z的转化率为14%B.该反应的化学方程式为2Z(g)+Y(g) 3X(g)C.该温度下,反应的平衡常数为2564D.4min时改变的条件是压缩体积答案:D解析:本题主要考查化学反应速率与平衡,侧重考查学生对基础知识的应用能力。
由图像中各物质的变化趋势,X为生成物,Y、Z为反应物,根据方程式的计量数之比等于各物质的物质的量变化之比,3min时反应达到平衡,△Y=0.2mol,△Z=0.4mol,△X=0.6mol,则该反应方程式为2Z (g)+Y(g) 3X(g)。
A.列三段式:2Z(g)+Y(g) 3X(g)起始(mol) 2.0 1.20.4转化(mol)0.280.140.42a点(mol) 1.72 1.060.82,则Z的转化率=0.282.0×100%=14%,A正确;B.由图像中各物质的变化趋势,X为生成物,Y、Z为反应物,根据方程式的计量数之比等于各物质的物质的量变化之比,3min时反应达到平衡,△Y=0.2mol,△Z=0.4mol,△X=0.6mol,则该反应方程式为2Z(g)+Y(g) 3X(g),B正确;C.列三段式:2Z(g)+Y(g) 3X(g)起始(mol) 2.0 1.20.4转化(mol)0.40.20.6a点(mol) 1.6 1.0 1.0,则反应的平衡常数K=1mol2L 1.6mol2L1mol2L()3()2×()=2564,C正确;D.压缩体积,Z(g)的物质的量不会瞬间增大且平衡不会移动,D项错误。
2研究催化剂对2NH3 [解析失败]N2+3H2反应速率的影响。
恒温、恒容时,c(NH3)随时间的变化如下。
下列说法不正确的是()A.使用催化剂Ⅰ,0~20min 的平均反应速率v (N 2)=1.00×10-5mol ·L -1·min -1B.使用催化剂Ⅱ,达平衡后容器内的压强是初始时的116倍C.相同条件下,使用催化剂Ⅱ可使该反应的活化能降低更多,反应更快D.相同条件下,使用催化剂Ⅱ可使该反应的化学平衡常数更大答案:D解析:A .使用催化剂Ⅰ,0~20min 的平均反应速率v (N 2)=2.40mol ·L -1-2.00mol ·L -12×20min=1.00×10-5mol ·L -1·min -1,A 正确;B .根据压强之比等于物质的量之比,列三段式:2NH 3 [解析失败]N 2+3H 2初始(mol ·L -1) 2.4000转化(mol ·L -1)2.001.003.00平衡(mol ·L -1)0.40 1.00 3.00则P (平衡)P (初始)=n 总(平衡)n 总(初始)=0.4V +1.00V +3.00V 2.4V =116,B 正确;C .相同条件下,使用催化剂Ⅱ时60min 达到平衡,说明使用催化剂Ⅱ时的反应速率>使用催化剂Ⅰ时的反应速率,C 正确;D .使用催化剂,不影响平衡,所以相同条件下,使用催化剂Ⅱ和使用催化剂Ⅰ该反应的化学平衡常数一样,D 错误;3NO x 的排放来自汽车尾气,研究利用反应C (s )+2NO (g ) N 2(g )+CO 2(g )△H =-34.0kJ ∙mol -1,用活性炭可对其进行吸附。
高中化学平衡难点突破--化学平衡常数及其计算(带解析)

【知识精讲】1.化学平衡常数(1)平衡常数只与温度有关,与反应物或生成物的浓度、反应速率无关,但与转化率有关。
反应物或生成物中有固体或纯液体时,由于其浓度可看作“1”而不代入平衡常数公式。
(2)化学平衡常数是指在一定温度下,某一具体的可逆反应的平衡常数。
若反应方向改变,则平衡常数也改变;若化学方程式中各物质的化学计量数等倍扩大或缩小,尽管是同一反应,平衡常数也改变。
(3)平衡常数越大,反应向右进行的程度越大。
化学平衡常数与转化率紧密相联。
定性来讲,K值越大,反应物的转化率越大,反应进行的程度越大;定量来讲,转化率的计算离不开化学平衡常数,可以通过平衡常数表达式求得平衡时物质的物质的量浓度,从而求得转化率。
(4)浓度商Q与平衡常数K的关系:①Q>K,反应向逆反应方向进行;②Q=K,反应处于平衡状态;③Q<K,反应向正反应方向进行。
2.有关化学反应速率及平衡的计算,如果不能一步得出答案,一般可用“三部曲”(始态、反应、终态)进行求解,但应该注意:(1)参加反应消耗或生成的各物质的浓度比一定等于化学方程式中对应物质的化学计量数之比,由于始态时,是人为控制的,故不同物质的始态、终态各物质的量的比值不一定等于化学方程式中的化学计量数之比;若反应物始态时各反应物的浓度成计量数比,则各反应物的转化率相等,且终态时,反应物的浓度也成计量数比。
(2)始态、反应、终态中的物理量要统一,要么都用物质的量,要么都用物质的量浓度,要么都用气体的体积。
(3)计算化学平衡常数时,一定要运用各物质的“平衡浓度”来计算,且勿利用各物质的“物质的量”或“非平衡时的浓度”进行计算。
(4)平衡常数的表达式与方程式的书写形式有关,对于同一个反应,当化学方程式中的计量数发生变化时,平衡常数的数值及单位均发生变化,当方程式逆写时,平衡常数是原平衡常数的倒数。
【经典例析】例1. (1) 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)其化学平衡常数K和温度T的关系如下表:T/℃ 700 800 830 1000 1200K 0.6 0.9 1.0 1.7 2.6①该反应的化学平衡常数表达式为K= 。
高考(人教)化学复习:化学平衡的计算题解法小结(一).docx

高中化学学习材料唐玲出品一、有关化学平衡计算的依据和一般程序1.化学平衡常数的意义及应用平衡常数数值的大小可以反映可逆反应进行的程度大小,K值越大,反应进行越完全,反应物转化率越高,反之则越低。
2.有关化学平衡的基本计算(1)物质浓度的变化关系反应物:平衡浓度=起始浓度-转化浓度生成物:平衡浓度=起始浓度+转化浓度各物质的浓度变化之比(或者物质的量变化之比)等于它们在化学方程式中物质的计量系数之比。
(2)反应的转化率(α):α=×100%(3)在密闭容器中有气体参加的可逆反应,在计算时经常用到阿伏伽德罗定律的两个推论:恒温、恒容时:;恒温、恒压时:(4)计算模式(“三段式”)A的转化率:α(A)=(ax/m)×100%C的物质的量分数:ω(C)=×100%二、解题技巧归纳1.三步法:化学平衡计算的一般格式,根据题意和恰当的假设列出起始量、转化量、平衡量。
注:计算的单位必须保持统一,可用mol、mol/L,也可用L (气体)。
【例1】X、Y、Z为三种气体,把amol X和bmol Y充入一密闭容器中,发生反应X+2Y2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为()。
A.B.C.D.解析:故答案:B。
2.差量法:在计算中可以是体积差量、压强差量、物质的量差量等。
【例2】某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A+3B2C,若维持温度和压强不变,当达到平衡时,容器的体积为VL,其中C气体的体积占10%,下列推断正确的是()。
①原混合气体的体积为1.2VL ②原混合气体的体积为1.1VL③反应达平衡时,气体A消耗掉0.05VL ④反应达平衡时,气体B消耗掉0.05VLA.②③B.②④C.①③D.①④解析:所以原混合气体的体积为VL+0.1VL=1.1VL。
由此可得:气体A消耗掉0.05VL,气体B消耗掉0.15VL。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题29 化学平衡常数及化学平衡相关计算(满分60分时间25分钟)姓名:班级:得分:1.已知某化学反应的平衡常数表达式为K=()222()())••(c CO c Hc CO c H O,在不同的温度下该反应的平衡常数如表所示:t/℃700 800 830 1 000 1 200K 1.67 1.11 1.00 0.60 0.38下列有关叙述不正确的是()A.该反应的化学方程式是CO(g)+H2O(g)CO2(g)+H2(g)B.上述反应的正反应是放热反应C.若在1L的密闭容器中通入CO2和H2各1mol,5min后温度升高到830℃,此时测得CO2为0.4mol时,该反应达到平衡状态D.若平衡浓度符合下列关系式:)(5)()(3)(222HcOHcCOcCOc=,则此时的温度为1000℃【答案】C变化量(mol) 0.4 0.4 0.4 0.4平衡量(mol) 0.4 0.4 0.6 0.6反应前后气体物质的量不变,可以用其他物质的量代替平衡浓度计算,Q=0.60.60.40.4⨯⨯=2.25≠1,此时反应没有达到平衡状态,故C错误;D、依据平衡常数表达式和平衡常数数值计算分析,温度为1000℃平衡常数K=()222()())••(c CO c H c CO c H O =0.6=35,若平衡浓度符合下列关系式:()2()3c CO c CO =225()()c H O c H ,说明反应达到平衡状态,故D 正确;故选C 。
考点:考查了平衡常数计算和影响因素的相关知识。
2. .700℃时,向容积为2L 的密闭容器中充入一定量的CO 和H 2O ,发生反应:CO(g)+H 2O(g)CO 2+H 2(g),反应过程中测定的部分数据见下表(表中t 2>t 1):反应时间/min n(CO)/mol H 2O/mol 0 1.20 0.60 t 1 0.80 t 20.20下列说法正确的是A .反应在t 1min 内的平均速率为v(H 2)=0.40/t 1 mol•L -1•mim -1B .温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应C .保持其他条件不变,向平衡体系中再通入0.20molH 2O ,0.4molH 2,则v(正)>v(逆)D .保持其他条件不变,起始时向容器中充入0.60mol CO 和 1.20mol H 2O ,到达平衡时n(CO 2)=0.40mol 【答案】Dk=0.20.20.40.1⨯⨯=1,温度升至800℃,上述反应平衡常数为0.64,说明温度升高,平衡常数减小,平衡是向左移动的,那么正反应应为放热反应,故B 错误;C .保持其他条件不变,向平衡体系中再通入0.20molH 2O ,0.4molH 2,c(H 2O)=0.42mol L =0.2mol/L ,c(H2)=0.82molL=0.4mol/L,Qc=0.20.40.40.2⨯⨯=1=K,平衡不移动,则v(正)=v(逆),故C错误;D.CO与H2O按物质的量比1:1反应,充入0.60 mol CO和1.20 mol H 2O与充入1.20 molCO和0.6mol H2O,平衡时生成物的浓度对应相同,t1min时n(CO)=0.8mol,n(H2O)=0.6mol-0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,根据化学方程式可知,则生成的n(CO2)=0.4mol,故D正确;故选D。
【考点定位】考查化学平衡的计算;化学平衡的影响因素;化学平衡常数的应用【名师点晴】本题主要考查了化学反应速率的计算、平衡常数概念与计算、平衡移动等知识点,难度中等,答题时注意平衡移动原理的灵活运用。
对于可逆反应,在一定的温度的任意时刻,生成物浓度的化学计量数次幂与反应物的化学计量数次幂的比值叫做反应的浓度商,用Q c表示。
Q c<K时,向正反应方向进行;Q c=K时,反应平衡;Q c>K时,向逆反应方向进行。
3.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:下列说法错误..的是:()A.反应达到平衡时,X的转化率为50%B.反应可表示为X + 3Y2Z,其平衡常数为1600C.改变温度可以改变此反应的平衡常数D.增大压强使平衡向生成Z的方向移动,平衡常数增大【答案】D平衡常数K===1600,B正确;C.平衡常数只受温度的影响,改变温度可以改变此反应的平衡常数,C正确;D.平衡常数只与温度有关系,改变压强不能改变平衡常数,D错误;答案选D。
考点:考查外界条件对平衡状态的影响及有关计算4.t℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为:)()()()(222W c Z c Y c X c K ⋅⋅=,有关该平衡体系的说法正确的是( )A .升高温度,平衡常数K 一定增大B .升高温度,若混合气体的平均相对分子质量变小,则正反应是放热反应C .增大压强,W(g)质量分数增加D .增大X(g)浓度,平衡向正反应方向移动 【答案】B【考点定位】考查化学平衡、平衡常数等知识。
【名师点睛】考查化学平衡常数和化学平衡的考查,这是高考的热点,化学平衡常数:化学反应达到平衡,生成物浓度的幂之积与反应物浓度幂之积的比值;对确定的反应方程式,化学平衡常数只受温度的影响,温度改变,则化学平衡常数改变,化学平衡常数表示可逆反应进行的程度、以及判断反应进行的方向,此题属于中档题。
5.在2 L 的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)2C(g)+D(s) △H=akJ ·mol -1,实验内容和结果分别如表和图所示,下列说法正确的是A .实验Ⅰ中,10 min 内平均速率v(B)=0.06 mol ·L -1·min -1B .上述方程式中a =-160C .600 ℃时,该反应的平衡常数是0.45D.向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率减小【答案】B考点:考查外界条件对平衡状态的影响以及有关计算6.在一定温度下,将气体X和气体Y 各0.16 mol充入10 L 恒容密闭容器中,发生反应X(g)+ Y(g)2Z(g)△H < 0,一段时间后达到平衡。
反应过程中测定的数据如下表。
下列说法正确的是( )t / min 2 4 7 9n(Y)/mol 0.12 0.11 0.10 0.10 A.反应前2min的平均速率v(Z)=2.0×10-5 mol/(L·min)B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v (正)C.该温度下此反应的平衡常数K=1.44D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大【答案】C考点:考查化学反应速率和化学平衡常数的计算等知识。
7.汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务。
在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物进行相互反应,生成无毒物质;或者使用新型燃料电池作汽车动力,减少汽车尾气污染。
(1)H2或CO可以催化还原NO以达到消除污染的目的。
已知:N2(g) + O2(g) = 2NO(g) △H = +180.5 kJ·mol-12H2(g) + O2(g) = 2H2O(l) △H =-571.6 kJ·mol-1则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是。
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。
下图表示在其他条件不变时,反应:2CO(g)+2NO(g) 2CO2(g)+N2(g) 中NO的浓度c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
①该反应的△H 0 (填“>”或“<”)。
②若催化剂的表面积S1>S2 ,在右图中画出c (NO) 在T1、S2 条件下达到平衡过程中的变化曲线。
(3)在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:时间/s 0 1 2 3 4c (NO)(×10-3mol·L-1) 1.00 0.50 0.20 0.10 0.10c (CO)(×10-3mol·L-1) 3.00 2.50 2.20 2.10 2.10不考虑温度变化对催化剂催化效率的影响,按要求完成以下计算(写出计算过程,只写出计算结果的不给分):①计算前2s内的△c (CO2) ;②计算前2s内的平均反应速率v (N2) ;③计算达到平衡时NO的转化率。
【答案】(1)2H2(g) +2NO(g) =N2(g)+2H2O(l) △H =-752.1kJ·mol-1 (2 ①△c (CO2)= 0.80 mol·L-1;②v (N2)= △c (N2)/ △t=0.20 mol·L-1·s-1;③平衡时NO的转化率为(1.00-0.10)/1.00×100%=90%。
考点:考查了热化学方程式的书写;化学平衡的计算的相关知识。
8.在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:t℃700 800 830 1000 1200K 1.7 1.1 1.0 0.6 0.4回答下列问题:(1)该反应的化学平衡常数表达式为K=__________,该反应为__________反应(填吸热或放热)。
若改变条件使平衡向正反应方向移动,则平衡常数_____________(填序号)①一定不变②一定减小③可能增大④增大、减小、不变皆有可能(2)能判断该反应是否达到化学平衡状态的依据是___________。
(a)容器中压强不变(b)混合气体中c(CO)不变(c)v逆(H2)=v正(H2O) (d)c(CO)=c(CO2)(3)将不同量的CO (g) 和H2O (g) 分别通入到体积为2 L的恒容密闭容器中,进行反应CO (g) + H2O (g)CO2 (g) + H2 (g),得到如下三组数据:起始量/mol 平衡量/mol 达到平衡所需时间实验组温度/℃/minH2O CO CO2COA 650 2 4 1.6 2.4 5B 900 1 2 0.4 1.6 3C 900 a b c d t①实验A中以υ(H2) 表示的反应速率为。
②通过计算可知,CO的转化率实验A 实验B(填“大于”、“等于”或“小于”),该反应的正反应为(填“吸”或“放”)热反应。
