江苏2012小高考化学知识点集锦
2012高考化学复习要点总结!!!!

第一节 物质分类【高考目标导航】【基础知识梳理】一、简单分类法及其应用1.分类的方法[来源:] (1)单一分类法:对分类的对象只用一种标准进行分类归纳的分类方法。
如若按组成元素的性质可以把氧化物分为金属氧化物和非金属氧化物;按氧化物的性质可以把氧化物分为酸性氧化物、碱性氧化物、两性氧化物和特殊氧化物(如CO 、NO 等等)。
(2)交叉分类法:交叉分类法是将被分类的对象应用多种不同的单一分类法进行分类。
如分子中是否含有氧元素、酸的强弱、酸的元数,硫酸分别属于含氧酸、强酸和二元酸。
如:[来源:](3)树状分类法:树状分类法就是根据被分对象的整体与分支的类型间的关系,以陈列式的形状(像树)来定义的。
2.应用(1)可以帮助我们更好地认识物质的性质,找出各类物质之间的关系。
如:化学方程式分别为:①2Ca+O2===2CaO,②CaO+H2O===Ca(OH)2③Ca(OH)2+CO2===CaCO3↓+H2O④C+O2===CO2⑤CO 2+H2O H2CO3⑥H2CO3+Ca(OH)2===CaCO3↓+2H2O(2)可以帮助我们对无机反应进行分类,充分认识各类物质之间的转化关系。
二.分散系及胶体1.分散系:化学上指由一种(或几种)物质分散到另一种物质里所形成的混合物。
依据分散质粒子的大小不同,分散系可分为溶液、胶体、浊液。
2.胶体的定义:分散质粒子的直径介于1~100 nm 之间的分散系。
胶体的性质:【技巧】使胶体聚沉的方法主要有:(1)加热;(2)加入电解质溶液;(3)加入带相反电荷的胶体粒子3.Fe(OH)3胶体的制备(1)原理:FeCl3+3H2O Fe(OH)3(胶体)+3HCl(化学方程式)(2)方法:用烧杯取少量蒸馏水,加热至沸腾,然后逐渐向沸水中滴加1 mo1·L-1(或饱和)的FeCl3溶液,并继续煮沸至液体呈透明的红褐色的氢氧化铁胶体。
(3)注意事项:a.不能用自来水,自来水中有电解质会使胶体发生聚沉,应用蒸馏水。
2012高考化学知识点汇总

2012高考化学复习:有关水的反应小结1.水在氧化还原反应中的作用(1)、水作氧化剂水与钠、其它碱金属、镁等金属反应生成氢气和相应碱:水与铁在高温下反应生成氢气和铁的氧化物(四氧化三铁):水与碳在高温下反应生成“水煤气”:铝与强碱溶液反应:(2)、水做还原剂水与F2的反应:(3)、水既做氧化剂又做还原剂水电解:(4)、水既不作氧化剂也不作还原剂水与氯气反应生成次氯酸和盐酸水与过氧化钠反应生成氢氧化钠和氧气水与二氧化氮反应生成硝酸和一氧化氮2.水参与的非氧化还原反应:(1)、水合、水化:水与二氧化硫、三氧化硫、二氧化碳、五氧化二磷等酸性氧化物化合成酸。
(能与二氧化硅化合吗?)水与氧化钠、氧化钙等碱性氧化物化合成碱。
(氧化铝、氧化铁等与水化合吗?)氨的水合、无水硫酸铜水合(变色,可检验液态有机物中是否含水)、浓硫酸吸水、工业酒精用生石灰吸水然后蒸馏以制无水酒精、乙烯水化成乙醇(2)、水解:卤代烃水解、乙酸乙酯水解、油脂水解(酸性水解或皂化反应)、水与碳化物——电石反应制乙炔、盐类的水解、氮化物水解、糖类的水解、氢化物——氢化钠水解3.名称中带“水”的物质(一)、与氢的同位素或氧的价态有关的“水”。
蒸馏水—H2O重水—D2O超重水—T2O双氧水—H2O2(二)、水溶液氨水—(含分子:NH3,H2O,NH3·H2O,含离子:NH4+,OH-,H+)氯水—(含分子:Cl2,H2O,HClO,含离子:H+,Cl-,ClO-,OH-)卤水—常指海水晒盐后的母液或粗盐潮解所得溶液,含NaCl、MgCl2、NaBr等王水—浓硝酸和浓盐酸的混合物(1∶3)生理盐水—0.9%的NaCl溶液(三)、其它水银—Hg水晶--SiO2水煤气—CO、H2的混合气、水玻璃—Na2SiO3溶液2012高考化学复习:生成氧气的反应小结(1)、氯酸钾热分解(二氧化锰催化)(2)、高锰酸钾热分解(3)、过氧化氢分解(二氧化锰催化)(4)、电解水(5)、氧化汞热分解(6)、浓硝酸分解(7)、次氯酸分解(光)(8)、氟与水置换反应(9)、过氧化钠与水反应(10)、过氧化钠与二氧化碳反应(11)、光合作用以上1~3适合实验室制取氧气,但一般所谓“实验室制取氧气”是指1、2两种方法。
江苏小高考化学__知识点集锦
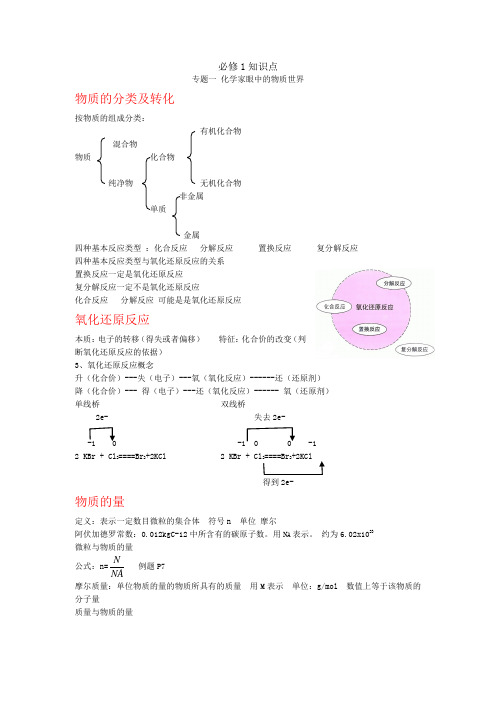
必修1知识点专题一 化学家眼中的物质世界物质的分类及转化按物质的组成分类:有机化合物 混合物物质 化合物纯净物 无机化合物 非金属 单质金属四种基本反应类型 :化合反应 分解反应 置换反应 复分解反应 四种基本反应类型与氧化还原反应的关系置换反应一定是氧化还原反应 复分解反应一定不是氧化还原反应化合反应 分解反应 可能是是氧化还原反应氧化还原反应本质:电子的转移(得失或者偏移) 特征:化合价的改变(判断氧化还原反应的依据) 3、氧化还原反应概念升(化合价)---失(电子)---氧(氧化反应)------还(还原剂) 降(化合价)--- 得(电子)---还(氧化反应)------ 氧(还原剂) 单线桥 双线桥2e- 失去2e--1 0 -1 0 0 -1 2 KBr + Cl 2====Br 2+2KCl 2 KBr + Cl 2====Br 2+2KCl得到2e-物质的量定义:表示一定数目微粒的集合体 符号n 单位 摩尔阿伏加德罗常数:0.012kgC-12中所含有的碳原子数。
用N A 表示。
约为6.02x1023微粒与物质的量 公式:n=NAN例题P7 摩尔质量:单位物质的量的物质所具有的质量 用M 表示 单位:g/mol 数值上等于该物质的分子量质量与物质的量公式:n=Mm例题P7 物质的体积决定:①微粒的数目②微粒的大小③微粒间的距离微粒的数目一定 固体液体主要决定②微粒的大小 气体主要决定③微粒间的距离 体积与物质的量 公式:n=VmV例题P10 标准状况下 ,1mol 任何气体的体积都约为22.4l阿伏加德罗定律:同温同压下, 相同体积的任何气体都含有相同的分子数 物质的量浓度:单位体积溶液中所含溶质B 的物质的量。
符号CB 单位:mol/l 公式:C B =VnB物质的量浓度的配制 配制前要检查容量瓶是否漏水步骤:1. 计算 m=c ×v ×M 2.称量 3. 溶解 4。
化学小高考知识点整理

化学小高考知识点整理一、化学物质及其变化。
1. 物质的分类。
- 混合物:由两种或多种物质混合而成,如空气(含有氮气、氧气等多种气体)、溶液(如食盐水,溶质氯化钠和溶剂水组成)。
- 纯净物:由一种物质组成。
- 单质:由同种元素组成的纯净物,如金属单质(铁Fe、铜Cu等)和非金属单质(氧气O₂、氢气H₂等)。
- 化合物:由不同种元素组成的纯净物,如氧化物(二氧化碳CO₂、水H₂O 等)、酸(盐酸HCl、硫酸H₂SO₄等)、碱(氢氧化钠NaOH、氢氧化钙Ca(OH)₂等)、盐(氯化钠NaCl、碳酸钠Na₂CO₃等)。
- 氧化物:由两种元素组成,其中一种元素是氧元素的化合物,分为金属氧化物(如氧化镁MgO)和非金属氧化物(如二氧化硫SO₂)。
2. 离子反应。
- 电解质与非电解质。
- 电解质:在水溶液里或熔融状态下能够导电的化合物,如酸、碱、盐等。
例如,氯化钠在水溶液中或熔融状态下都能导电。
- 非电解质:在水溶液里和熔融状态下都不能导电的化合物,如蔗糖、酒精等。
- 电离方程式:表示电解质电离过程的式子。
例如,HCl = H⁺+Cl⁻,NaOH = Na ⁺ + OH⁻,Na₂CO₃=2Na⁺+CO₃²⁻。
- 离子反应:有离子参加或生成的反应。
发生的条件是生成沉淀(如Ba²⁺ + SO₄²⁻=BaSO₄↓)、气体(如2H⁺+CO₃²⁻ = H₂O+CO₂↑)或水(H⁺+OH⁻ = H₂O)。
3. 氧化还原反应。
- 氧化还原反应的本质:电子的转移(得失或偏移)。
- 氧化还原反应的特征:元素化合价的升降。
- 氧化剂:在反应中得到电子(化合价降低)的物质,如氧气在许多反应中是氧化剂,反应时氧元素化合价从0价降低。
- 还原剂:在反应中失去电子(化合价升高)的物质,如金属单质在反应中常作还原剂,如铁与硫酸铜反应,铁作还原剂,铁元素化合价从0价升高到 + 2价。
- 氧化反应:物质所含元素化合价升高的反应;还原反应:物质所含元素化合价降低的反应。
2012年高考化学120个关键知识点分模块解析汇总

“元素化合物”知识模块1.碱金属元素原子半径越大,熔点越高,单质的活泼性越大错误,熔点随着原子半径增大而递减2.硫与白磷皆易溶于二硫化碳、四氯化碳等有机溶剂,有机酸则较难溶于水3.在硫酸铜饱和溶液中加入足量浓硫酸产生蓝色固体正确,浓硫酸吸水后有胆矾析出4.能与冷水反应放出气体单质的只有是活泼的金属单质或活泼的非金属单质错误,比如2Na2O2+2H2O→O2↑+4NaOH5.将空气液化,然后逐渐升温,先制得氧气,余下氮气错误,N2的沸点低于O2,会先得到N2,留下液氧6.把生铁冶炼成碳素钢要解决的主要问题是除去生铁中除Fe以外各种元素,把生铁提纯错误,是降低生铁中C的百分比而不是提纯7.虽然自然界含钾的物质均易溶于水,但土壤中K%不高,故需施钾肥满足植物生长需要错误,自然界钾元素含量不低,但以复杂硅酸盐形式存在难溶于水8.制取漂白粉、配制波尔多液以及改良酸性土壤时,都要用到熟石灰正确,制取漂白粉为熟石灰和Cl2反应,波尔多液为熟石灰和硫酸铜的混合物9.二氧化硅是酸性氧化物,它不溶于酸溶液错误,SiO2能溶于氢氟酸10.铁屑溶于过量盐酸,再加入氯水或溴水或碘水或硝酸锌,皆会产生Fe3+错误,加入碘水会得到FeI2,因为Fe3+的氧化性虽然不如Cl2,Br2,但是强于I2,在溶液中F eI3是不存在的11.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应错误,钝化是化学性质,实质上是生成了致密的Al2O3氧化膜保护着铝罐12.NaAlO2、Na2SiO3、Na2CO3、Ca(ClO)2、NaOH、C17H35COONa、C6H5ONa等饱和溶液中通入CO2出现白色沉淀,继续通入CO2至过量,白色沉淀仍不消失错误,Ca(ClO)2中继续通入CO2至过量,白色沉淀消失,最后得到的是Ca(HCO3)213.大气中大量二氧化硫来源于煤和石油的燃烧以及金属矿石的冶炼正确14.某澄清溶液由NH4Cl、AgNO3、NaOH三种物质混合而成,若加入足量硝酸必产生白色沉淀正确,NH4Cl、AgNO3、NaOH混合后发生反应生成[Ag(NH3)2]+加入足量硝酸后生成A gCl和NH4NO315.为了充分利用原料,硫酸工业中的尾气必须经净化、回收处理错误,是为了防止大气污染16.用1molAl与足量NaOH溶液反应,共有3mol电子发生转移正确17.硫化钠既不能与烧碱溶液反应,也不能与氢硫酸反应错误,硫化钠可以和氢硫酸反应: Na2S+H2S=2NaHS18.在含有较高浓度的Fe3+的溶液中,SCN-、I-、AlO-、S2-、CO32-、HCO3-等不能大量共存正确,Fe3+可以于SCN-配合,与I-和S2-发生氧化还原反应,与CO32-,HCO3-和AlO2-发生双水解反应19.活性炭、二氧化硫、氯水等都能使品红褪色,但反应本质有所不同正确,活性炭是吸附品红,为物理变化,SO2是生成不稳定的化合物且可逆,氯水是发生氧化还原反应且不可逆20.乙酸乙酯、三溴苯酚、乙酸钠、液溴、玻璃、重晶石、重钙等都能与烧碱反应错误,重晶石(主要成分BaSO4)不与烧碱反应21.在FeBr2溶液中通入一定量Cl2可得FeBr3、FeCl2、Br2错误,Fe2+和Br2不共存22.由于Fe3+和S2-可以发生氧化还原反应,所以Fe2S3不存在错误,在PH=4左右的Fe3+溶液中加入Na2S可得到Fe2S3,溶度积极小23.在次氯酸钠溶液中通入少量二氧化硫可得亚硫酸钠与次氯酸错误,次氯酸可以氧化亚硫酸钠,会得到NaCl和H2SO424.有5.6g铁与足量酸反应转移电子数目为0.2NA错误,如果和硝酸等强氧化性酸反应转移0.3NA25.含有最高价元素的化合物不一定具有强氧化性正确,如较稀的HClO4,H2SO4等26.单质的还原性越弱,则其阳离子的氧化性越强错误,比如Cu的还原性弱于铁的,而Cu2+的氧化性同样弱于Fe3+27.CuCO3可由Cu2+溶液中加入CO32-制得错误,无法制的纯净的CuCO3,Cu2+溶液中加入CO32-会马上有Cu2(OH)2CO3生成28.单质X能从盐的溶液中置换出单质Y,则单质X与Y的物质属性可以是:(1)金属和金属;(2)非金属和非金属;(3)金属和非金属;(4)非金属和金属;错误,(4)非金属和金属不可能发生这个反应29.H2S、HI、FeCl2、浓H2SO4、Na2SO3、苯酚等溶液在空气中久置因发生氧化还原反应而变质错误,H2SO4是因为吸水且放出SO3而变质30.浓硝酸、浓硫酸在常温下都能与铜、铁等发生反应错误,浓硫酸常温与铜不反应"基本概念基础理论"知识模块1.与水反应可生成酸的氧化物都是酸性氧化物错误,是"只生成酸的氧化物"才能定义为酸性氧化物2.分子中键能越大,分子化学性质越稳定。
(完整word版)江苏省化学小高考常考必背知识点汇总

高中化学学业水平测试复习纲要—-必修11.托盘天平精确到0.1g,量筒精确到0。
1mL。
2.可直接加热的仪器:试管﹑蒸发皿、坩埚。
3.点燃可燃气体(氢气、甲烷等)前要验纯.4.酒精着火应迅速用湿抹布盖灭,钠、钾着火用细沙盖灭。
5.分离提纯的装置:依次为:过滤、蒸发、蒸馏、萃取(分液)。
6.(1)过滤用于分离固体和液体的混合物,主要仪器:漏斗。
(2)蒸发的主要仪器:蒸发皿。
当蒸发皿中出现较多的固体时,停止加热.不可加热至蒸干。
(3)蒸馏用于分离液体混合物,(主要仪器包括蒸馏烧瓶,冷凝管)如:乙醇和水的混合物。
冷凝水“下进上出”。
(4)萃取可用于提取碘水中的碘单质。
主要仪器:分液漏斗;萃取剂不能溶于水,如四氯化碳,不可使用酒精。
(5)分液用于分离互不相溶的液体,如:乙酸乙酯和饱和Na2CO3溶液,植物油和水.主要仪器:分液漏斗。
使用时注意“下层放、上层倒”。
7.摩尔(mol)是物质的量的单位,摩尔质量的单位g/mol或g.mol-1数值与该物质的相对分子(原子)量相同(如氯化氢相对分子量为:36.5,摩尔质量为:36。
5g/mol)8.22.4mol/L的使用条件:①标准状况下(0℃ 101KPa);②气体。
(注:水在标准状况下为液体)9.物质的量的计算的四个公式:n=10.溶液稀释的公式:c(浓)·V(浓)= c(稀)·V(稀)的仪器:××mL容量瓶、烧杯、玻璃棒、胶头滴管.11.配制一定物质的量浓度溶液必需..12.有关物质的量在化学方程式计算中的应用做题步骤:(1),将已经m,V气,c、V液计算成n,(2)列化学方程式将已知与待求的物质建立联系,求出待出物质的n(3)将求出的n转化为最终要求的m,V气,c、V液13.分散系包括:分散系分散质粒子大小是否有丁达尔现象举例浊液大于100nm—泥水溶液小于1nm—NaCl溶液胶体1~100nm有Fe(OH)3胶体14.Fe(OH)3胶体的制备方法:是FeCl3+沸水,不是FeCl3+NaOH;区分胶体与溶液的方法是:丁达尔效应(用光束照射有光亮的通路)。
小高考化学知识点总结

小高考化学知识点总结一、基本概念与原理1. 物质的组成- 原子与分子- 元素与化合物- 同位素与同素异形体2. 化学反应- 反应类型(合成、分解、置换、还原、氧化还原等) - 化学方程式- 反应条件与催化剂3. 化学计量- 摩尔概念- 物质的量与质量的关系- 气体定律(波义耳定律、查理定律、阿伏伽德罗定律)二、元素与化合物1. 周期表- 元素的周期性- 主族与副族元素- 过渡元素与镧系、锕系元素2. 常见元素及其化合物- 碱金属与卤素- 氧族元素及其氧化物- 碳族元素与硅酸盐3. 酸碱与盐- 酸碱理论(阿伦尼乌斯、布朗斯特-劳里) - pH与pOH- 常见酸碱与指示剂- 盐的水解与双水解三、溶液与胶体1. 溶液的组成与性质- 溶质与溶剂- 溶解度与温度的关系- 饱和溶液与不饱和溶液2. 胶体与界面现象- 胶体的定义与分类- 表面张力与表面活性剂- 乳化与分散四、能量变化与热化学1. 能量守恒与转化- 化学能与热能- 能量的测量与计算- 热化学方程式2. 电化学- 电池与电解- 电势与电化学系列- 法拉第电解定律五、实验技能与安全1. 常见化学实验操作- 实验器材的使用与维护- 溶液的配制与标定- 常见化学反应的实验观察2. 实验室安全- 化学品的分类与标识- 个人防护与紧急处理- 实验室废弃物的处理以上是小高考化学知识点的一个基本框架。
每个部分都需要根据具体的教学大纲和考试要求进行详细扩展,包括具体的化学方程式、实验操作步骤、数据分析等。
实际文档应保持清晰、准确,格式规范,确保无乱码、无错乱字符段落,以便阅读者下载后易于编辑和使用。
小高考化学必考知识点江苏扬州

小高考化学必考知识点江苏扬州江苏扬州的一、化学的基本概念化学是自然科学的一门重要学科,研究物质的组成、结构、性质及其变化规律。
在江苏扬州的小高考中,化学是必考科目之一,以下将介绍一些小高考中常考的化学知识点。
二、物质的分类物质可分为纯物质和混合物两大类。
纯物质又可分为元素和化合物。
元素是由相同类型的原子组成的物质,化合物是由不同类型的原子以一定比例结合而成的物质。
混合物是由两种或两种以上不同物质按一定比例混合而成的物质。
三、化学方程式化学方程式是用化学式表示化学反应过程的方法。
反应物在化学方程式的左侧,产物在右侧。
化学方程式中需要满足物质的质量守恒和电荷守恒。
在小高考中,常常考察化学方程式的平衡以及计算反应物和产物的物质的质量关系。
四、溶液的浓度溶液的浓度是指单位体积溶液中溶质的质量或物质的量。
常用的浓度单位有质量分数、摩尔浓度和体积分数。
在小高考中,经常会涉及到计算溶液的浓度以及溶质在溶液中的质量关系。
五、酸碱性与中和反应酸和碱是常见的化学物质,它们能够互相中和并产生盐和水。
酸具有酸性氢离子(H+),碱具有碱性氢氧根离子(OH-)。
在小高考中,常考察酸碱溶液的性质、中和反应的化学方程式以及计算酸碱质量关系等知识点。
六、氧化还原反应氧化还原反应是指物质中原子的氧化态和还原态发生变化的反应。
原子失去电子为氧化,原子获得电子为还原。
在小高考中,常考察氧化还原反应的特征、化学方程式以及计算电子转移的数量等知识点。
七、化学能量与化学反应化学反应过程中会伴随着能量的变化,包括放热反应和吸热反应。
放热反应是指反应过程中释放出能量,吸热反应是指反应过程中吸收能量。
在小高考中,常考察化学反应的能量变化、计算能量变化以及能量利用等知识点。
八、有机化合物的命名有机化合物是由碳元素和氢元素以及其他元素构成的化合物。
在小高考中,常考察有机化合物的命名方式,包括根据结构式给出分子式和命名有机功能团等知识点。
九、常见元素的性质和应用小高考中还会考察一些常见元素的性质和应用。
江苏化学小高考知识点(全)

化学小高考必修1知识点专题一 化学家眼中的物质世界物质的分类及转化按物质的组成分类: 有机化合物 混合物物质 化合物纯净物 无机化合物非金属单质金属四种基本反应类型 :化合反应 分解反应 置换反应 复分解反应四种基本反应类型与氧化还原反应的关系置换反应一定是氧化还原反应复分解反应一定不是氧化还原反应化合反应 分解反应 可能是是氧化还原反应氧化还原反应本质:电子的转移(得失或者偏移) 特征:化合价的改变(判断氧化还原反应的依据)3、氧化还原反应概念升(化合价)---失(电子)---氧(氧化反应)------还(还原剂)降(化合价)--- 得(电子)---还(氧化反应)------ 氧(还原剂)单线桥 双线桥2e- 失去2e--1 0 -1 0 0 -12 KBr + Cl 2====Br 2+2KCl 2 KBr + Cl 2====Br 2+2KCl得到2e-物质的量定义:表示一定数目微粒的集合体 符号n 单位 摩尔阿伏加德罗常数:0.012kgC-12中所含有的碳原子数。
用N A 表示。
约为6.02x1023微粒与物质的量公式:n=NAN 例题P7 摩尔质量:单位物质的量的物质所具有的质量 用M 表示 单位:g/mol 数值上等于该物质的分子量质量与物质的量公式:n=Mm 例题P7 物质的体积决定:①微粒的数目②微粒的大小③微粒间的距离微粒的数目一定 固体液体主要决定②微粒的大小 气体主要决定③微粒间的距离体积与物质的量公式:n=VmV 例题P10 标准状况下 ,1mol 任何气体的体积都约为22.4l阿伏加德罗定律:同温同压下, 相同体积的任何气体都含有相同的分子数物质的量浓度:单位体积溶液中所含溶质B 的物质的量。
符号CB 单位:mol/l公式:C B = VnB 物质的量浓度的配制 配制前要检查容量瓶是否漏水步骤:1. 计算 m=c ×v ×M 2.称量 3. 溶解 4。
江苏省化学小高考常考必背知识点汇总

高中化学学业水平测试复习纲要——必修11.托盘天平精确到0.1g,量筒精确到0.1mL。
2.可直接加热的仪器:试管﹑蒸发皿、坩埚。
3.点燃可燃气体(氢气、甲烷等)前要验纯。
4.酒精着火应迅速用湿抹布盖灭,钠、钾着火用细沙盖灭。
5.分离提纯的装置:依次为:过滤、蒸发、蒸馏、萃取(分液)。
6.(1)过滤用于分离固体和液体的混合物,主要仪器:漏斗。
(2)蒸发的主要仪器:蒸发皿。
当蒸发皿中出现较多的固体时,停止加热。
不可加热至蒸干。
(3)蒸馏用于分离液体混合物,(主要仪器包括蒸馏烧瓶,冷凝管)如:乙醇和水的混合物。
冷凝水“下进上出”。
(4)萃取可用于提取碘水中的碘单质。
主要仪器:分液漏斗;萃取剂不能溶于水,如四氯化碳,不可使用酒精。
(5)分液用于分离互不相溶的液体,如:乙酸乙酯和饱和Na2CO3溶液,植物油和水。
主要仪器:分液漏斗。
使用时注意“下层放、上层倒”。
7.摩尔(mol)是物质的量的单位,摩尔质量的单位g/mol或g.mo l-1数值与该物质的相对分子(原子)量相同(如氯化氢相对分子量为:36.5,摩尔质量为:36.5g/mol)8.22.4mol/L的使用条件:①标准状况下(0℃ 101KPa);②气体。
(注:水在标准状况下为液体)9.物质的量的计算的四个公式:n=10.溶液稀释的公式:c(浓)·V(浓) = c(稀)·V(稀)11.配制一定物质的量浓度溶液必需..的仪器:××mL容量瓶、烧杯、玻璃棒、胶头滴管。
12.有关物质的量在化学方程式计算中的应用做题步骤:(1),将已经m,V气,c、V液计算成n,(2)列化学方程式将已知与待求的物质建立联系,求出待出物质的n(3)将求出的n转化为最终要求的m,V气,c、V液13.分散系包括:分散系分散质粒子大小是否有丁达尔现象举例浊液大于100nm —泥水溶液小于1nm —NaCl溶液胶体1~100nm 有Fe(OH)3胶体14.Fe(OH)3胶体的制备方法:是FeCl3+沸水,不是FeCl3+NaOH;区分胶体与溶液的方法是:丁达尔效应(用光束照射有光亮的通路)。
江苏小高考复习 元素、水、无机盐

二、细胞中的无机盐
1.存在形式:大多数离子状态。如Na+、K+、 存在形式:大多数离子状态。 存在形式 Ca2+、Mg2+、Fe2+、Cl-、PO432.含量:很少 含量: 含量 3.功能: 功能: 功能
①构成细胞的化合物。如 Mg2+、Fe2+ 、 构成细胞的化合物。 CaCO3。 。 ②维持细胞和生物体的生命活动有重要作 用。 ③维持细胞的渗透压和酸碱平衡非常重要 维持细胞的渗透压和酸碱平衡非常重要
3.功能: 功能: 功能 构成细胞的化合物。 、 ①构成细胞的化合物。如 Mg2+、Fe2+ 、
②维持细胞和生物体的生命活动有重要作用。 维持细胞和生物体的生命活动有重要作用。
如:哺乳动物钙离子过少出现抽搐等症状
③维持细胞的渗透压和酸碱平衡非常重要 维持细胞的渗透压和酸碱平衡非常重要
如: Na+,Cl- 如:HCO3-和HPO42-
(2)脂肪的鉴定 ) 花生子叶或向日葵种子 常用材料: 常用材料: 苏丹Ⅲ或苏丹Ⅳ 苏丹Ⅲ或苏丹Ⅳ染液 试剂: 试剂: 注意事项: 注意事项: ①切片要薄,如厚薄不均就会导致观察时有的地方清晰, 切片要薄,如厚薄不均就会导致观察时有的地方清晰, 有的地方模糊。 有的地方模糊。 ②酒精的作用是: 洗去浮色 酒精的作用是: ③需使用显微镜观察 ④ 使用不同的染色剂染色时间不同 Ⅲ)或红色 颜色变化:橘黄色(苏丹Ⅲ)或红色(苏丹Ⅳ) 颜色变化:橘黄色(苏丹Ⅲ)或红色(苏丹Ⅳ)
细胞中的元素和化合物
一、组成细胞的元素 种类:主要有 种 种类:主要有20种
大量元素: 、 、 、 、 、 、 、 、 大量元素: C、H、O、N、P、S、K、Ca、Mg 、 、 、 、 微量元素: 、 微量元素: Fe、Mn、Zn、Cu、B、Mo 主要元素: 、 、 、 、 、 主要元素: C、H、O、N、P、S C、H、O、N 、 、 、 基本元素: 基本元素: 最基本元素: 最基本元素:C 鲜重下含量最高元素: 鲜重下含量最高元素:O 元素
江苏化学小高考知识点

江苏化学小高考知识点一、有机化学1.有机化合物的命名-烷烃及卤代烷烃-烯烃及环烷烃-醇及醇的衍生物-酮及酮的衍生物-羧酸及羧酸的衍生物-酯及酯的衍生物-胺及胺的衍生物2.有机化合物的性质与反应-饱和烃的性质-烯烃及环烷烃的性质-醇的性质-酮的性质-羧酸及酯的性质-胺的性质3.碳的共价键和立体化学-碳的共价键构型-立体化学中的构型-光学异构体4.耐热塑料与合成纤维-聚乙烯、聚丙烯和聚氯乙烯-聚酯纤维和聚酰胺纤维二、无机化学1.元素与化合价-元素周期表及元素的原子结构-元素的化合价2.无机化合物的性质与反应-金属与非金属元素的化合物-卤素的性质及反应-硫化物和氧化物的性质及反应-碳酸盐的性质及反应3.盐酸、硫酸、硝酸和氢氧化钠的性质及应用-盐酸及其反应-硫酸及其反应-硝酸及其反应-氢氧化钠及其反应三、物理化学1.物质的组成与分子结构-分子式和分子量-元素与化合物的摩尔质量-化学方程式及反应计量关系2.配位化学-配合物的定义与命名-配合物的性质和结构3.化学反应中的能量变化-燃烧反应的能量变化-化学反应的能量变化-化学反应的速率4.酸碱溶液-酸和碱的定义-酸碱溶液的酸碱性质-酸碱滴定反应总结:江苏化学小高考知识点主要包括有机化学、无机化学和物理化学。
在有机化学方面,了解有机化合物的命名、性质和反应;在无机化学方面,了解元素的化合价、无机化合物的性质和反应;在物理化学方面,了解物质的组成与分子结构、配位化学、化学反应中的能量变化和酸碱溶液等知识点。
掌握这些知识点能够帮助学生在化学小高考中取得良好的成绩。
江苏化学小高考知识点总结

江苏化学小高考知识点总结化学作为一门基础科学,是我们日常生活中不可或缺的一部分。
江苏化学小高考是检验学生对化学知识的掌握程度的重要考试之一。
下面我将对江苏化学小高考中常见的知识点进行总结,希望能给各位同学提供一些有益的指导。
一、物质和化学变化在化学中,物质被认为是构成一切事物的基本单位。
而化学变化则指的是物质的组成或性质的改变,是化学研究的核心内容之一。
1.原子和分子原子是构成化学元素的最小单位,不可再分。
元素是由相同类型的原子组成的物质。
分子是由两个或更多原子结合而成的物质。
2.化合物和混合物化合物是由两种或更多不同类型的原子化学结合而成的物质。
混合物是由两种或更多不同类型的物质粗略地混合在一起而成的物质。
3.物质的三态物质存在于固态、液态和气态三种正常条件下的形态。
固态的物质有固定的形状和体积,分子之间的相互作用力较大。
液态的物质没有固定的形状,但有固定的体积,分子之间的相互作用力较弱。
气态的物质没有固定的形状和体积,分子之间的相互作用力极小。
二、离子和离子反应离子是带有正电荷或负电荷的原子或分子。
离子反应指的是由离子之间的吸引力或斥力引起的化学反应。
1.阳离子和阴离子阳离子是带有正电荷的离子,常见的阳离子有钠离子(Na+)和铵离子(NH4+)。
阴离子是带有负电荷的离子,常见的阴离子有氯离子(Cl-)和硫酸根离子(SO42-)。
2.离子方程式和离子反应离子方程式是将离子在化学反应中的转化过程写成离子式的方程式。
离子反应是指在化学反应中离子之间的相互作用和转化。
三、化学反应和化学方程式化学反应是指物质之间发生的变化,包括物质的构成、结构以及性质的改变。
1.化学方程式的表示化学方程式是用符号和化学式表示化学反应的过程。
反应物在反应式的左边,产物在反应式的右边。
反应物和产物之间用化学式和符号连接。
2.化学反应的类型常见的化学反应类型包括酸碱反应、氧化还原反应、置换反应和合成反应等。
四、化学平衡和反应速率化学平衡是指化学反应中反应物浓度和产物浓度保持恒定的状态。
2012年江苏小高考教案(十一)化学必修1学科导学案

龙文教育学科导学案教师:朱士兵学生:马毅日期: 2012 星期:时段:科目:化学课题化学必修1总复习学习目标与考点分析复习化学实验的基本方法和实验仪器物质结构基础复习金属及其化合物以及非金属及其化合物学习重点金属、非金属及其化合物的主要性质学习方法讲练结合学习内容与过程(一)知识梳理第一章从实验学化学1、化学实验基本方法化学实验包括:(一)气体的制备、净化与干燥、收集和尾气处理。
(二)物质的分离与提纯:1、物理方法:溶解、过滤,蒸发浓缩法,结晶、重结晶法、蒸馏法、分馏法、萃取法、分液法,吸附法,升华法,水洗法,液化法,渗析法,盐析法;2、化学方法:酸、碱处理法,热分解法,吸收法,转化法,沉淀法,氧化还原法,离子交换法,电解法。
(三)化学实验方案设计。
例题1:给50mL某液体加热的操作中,以下仪器必须用到的是①试管②烧杯③酒精灯④试管夹⑤石棉网⑥铁架台⑦泥三角⑧坩埚⑨铁三脚架A. ②③⑤⑧B. ③⑥⑦⑧C. ①③④⑥D. ②③⑤⑥练习1:加热固体试剂时,不能使用的仪器是A. 试管B. 烧杯C. 蒸发皿D. 坩埚例题2:某学生发现滴瓶中的溶液有悬浮物,拟用右图所示操作进行过滤,操作上错误的地方有A.4 处B.3 处C.2 处D.1 处例题3:为了除去氯化钠溶液中少量的溴化钠,常用的方法是往溶液中加入少量的氯水,然后加入苯或四氯化碳,经振荡、静置、分液,将氯化钠溶液加热排除溶解在水中的氯分子,得到氯化钠溶液。
分析判断,正确的是A.加入苯或四氯化碳操作叫萃取 B.苯层在下层或四氯化碳在上层C.可以用酒精代替苯或四氯化碳 D.氯水是氯化剂练习2:萃取和分液都要使用的仪器是A.漏斗和烧杯B.分液漏斗和烧杯C.容量瓶和烧杯D.锥形瓶和烧杯2、化学计量在实验中的应用n 、N 、N A 之间的关系: n 、m 、M 之间的关系:n=AN N n=M m 标准状况(0℃,101P a )下,气体: 溶液中n (B )、c (B )、V 的关系:n=mV V V m =22.4L/mol c (B )=V B n )( 例题4:下列关于阿佛加德罗常数(NA )的说法中正确的是:A 、2.3克Na 由原子变为Na +时,共失去的电子数为0.1N AB 、18克H 2O 所含有的电子数为8N AC 、28克氮气所含的原子数为N AD 、在20℃,1.01×105Pa 时,11.2LO 2所含的原子数为N A练习3:4gNaOH 溶于水配成1L 的溶液,该氢氧化钠溶液的物质的量浓度 ;将3. 65g HCl 通入此溶液中反应后,求所得溶液的物质的量溶度 。
2012江苏省会考化学提纲

江苏省2012年高中化学学业水平测试复习资料一、基础实验与基本实验操作(一)物质的分离与提纯的基本实验方法1、过滤:适用于分离一种组分可溶,另一种不溶的固态混合物的分离。
如:粗盐与泥沙的分离提纯。
主要仪器:漏斗、玻璃棒、烧杯。
2、蒸发结晶:适用于混合物中各组分物质在溶剂中溶解性的差异的分离提纯如:NaCl中混有KNO3分离提纯。
主要仪器:蒸发皿、玻璃棒、酒精灯。
3、蒸馏法:适用于分离各组分互溶,但沸点不同的液态混合物。
如:酒精与水的分离。
主要仪器:蒸馏烧瓶、冷凝器。
4、分液:分离互不相容的两种液体。
主要仪器:分液漏斗、铁架台、铁圈。
5、萃取:溶质在互不相溶的溶剂里溶解度不同,利用萃取剂将溶质从另一溶液中分离出来。
主要仪器:分液漏斗。
1、Na+焰色反应-黄色2、K+焰色反应-透过蓝色钴玻璃为紫色3、NH4+加入强碱,加热可产生可使湿润红色石蕊试纸变蓝色的气体NH4++OH-NH3↑+H2O4、Fe3+检验:加入KSCN 溶液后溶液变成红色溶液(非沉淀) Fe3++3SCN―=Fe(SCN)35、Cl-加入用稀HNO3酸化(排除CO32-等离子的干扰)的AgNO3,有白色沉淀产生。
Ag++Cl―=AgCl↓6、SO42-加入足量稀HCl酸化(排除CO32-和SO32-等离子的干扰),然后加入BaCl2溶液,有白色沉淀产生。
2H++CO32-= CO2↑+H2OBa2++SO42-=BaSO4↓7、CO32-加入H+,产生能无色无气味(排除SO32-离子的干扰)且能使澄清石灰水变混浊的气体。
2H++CO32-=CO2↑+H2OCO2+Ca2++2OH-=CaCO3↓+H2O(三)定量实验——物质的量浓度溶液的配制1、物质的量浓度的配制所需的仪器:烧杯、容量瓶、玻璃棒、胶头滴管、托盘天平、药匙、量筒。
配制前要检查容量瓶是否漏水2、配制步骤:①. 计算 m=c×v×M ②.称量③. 溶解④.转移⑤. 洗涤(2-3次洗涤液转入容量瓶)⑥.定容⑦.摇匀⑧.装瓶贴签3、仰视、俯视对溶液浓度有何影响?(1)俯视刻度线,实际加水量未到刻度线,使溶液的物质的量浓度增大;(2)仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减小。
化学小高考知识点大全(自己按照考点整理的)

化学小高考知识点大全(自己按照考点整理的)1、有机高分子化合物在生活中扮演着重要角色。
天然有机高分子化合物如淀粉、纤维素和蛋白质,而合成有机高分子化合物则包括塑料、合成橡胶和合成纤维等。
人造高分子化合物如粘胶纤维也是常见的。
2、高分子化合物可以分为线型和体型两种,分别对应着热塑性和热固性。
例如,天然橡胶是线型分子,因此在工业上通常会硫化成体型网状的硫化橡胶。
3、常见的复合材料有玻璃钢、石棉瓦、碳纤维和钢筋混凝土等。
4、三大硅酸盐产品为水泥、玻璃和陶瓷。
5、石灰石是生产水泥和玻璃所需的共同原料,其化学式为CaCO3.6、生产普通玻璃的原料包括纯碱、石灰石和石英,最终成分为硅酸钙、硅酸钠和石英。
7、水泥的主要原料为石灰石、黏土和石膏。
8、水体污染处理方法包括混凝法、沉淀法和中和法等。
9、垃圾无害化处理常用方法包括卫生填埋和封闭式焚烧,但最好的方法是垃圾分类和回收利用。
10、营养物质主要包括糖类、油脂、蛋白质、维生素、水和无机盐。
11、糖类包括单糖、二糖和多糖。
葡萄糖和果糖是不能再水解的单糖,而蔗糖和麦芽糖是互为同分异构体的二糖。
淀粉和纤维素则是互为同分异构体的多糖。
12、葡萄糖在体内氧化分解的方程式为C6H12O6 + 6O2→ 6CO2 + 6H2O + 能量。
13、检验葡萄糖的方法包括在碱性条件下加银氨溶液或在早碱性条件下加新制的Cu(OH)2.如果产生银镜,则说明有葡萄糖糖生成。
常用的防腐剂包括苯甲酸钠、山梨酸钾和亚硝酸钠,其中亚硝酸钠既可用作防腐剂,也可用作发色剂。
阿司匹林具有解热镇痛的功效。
青霉素是一种重要的抗生素和消炎药,能够抑制或杀灭某些微生物的生长,但在使用前需要进行皮肤敏感试验以防止过敏反应的发生。
需要注意的是,抗生素对病毒引起的疾病无治疗效果。
碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁等常见的抗酸药成分能够与胃酸反应生成相应的化合物,如碳酸氢钠与盐酸反应生成NaCl、H2O和CO2等。
(化学)2012年小高考复习提纲资料(冲B)

1ⶹ䆚⚍ϧ乬ϔ ⴐЁⱘ⠽䋼Ϫ⬠ˊ⠽䋼ⱘ ㉏ 䕀 ⠽ ⏋ ⠽ ⠽䋼 ⠽㒃 ⠽ ⠽䴲䞥䋼䞥⾡ ㉏ ˖ 㾷 㕂 㾷⾡ ㉏ Ϣ⇻ 䖬 ⱘ ㋏˖㕂 ϔ ⇻ 䖬㾷 ϔ ϡ ⇻ 䖬䋼 ⱘ 䋼⫳ ⱘ 㾷 ⇻ 䖬⇻ 䖬䋼˖⬉ ⱘ䕀⿏˄ 㗙 ⿏˅ ⡍ ˖ Ӌⱘ ˄ ⇻ 䖬 ⱘձ ˅ ⬉ ˈӋ 催ˈ㹿⇻ ˈ 䖬 ˗ ⬉ ˈӋ䰡Ԣˈ㹿䖬 ˈ ⇻㒓ḹ 㒓ḹH H.%U &O %U .&O .%U &O %U .&OH⠽䋼ⱘ䞣Н˖㸼⼎ϔ Ⳃ ㉦ⱘ䲚 ԧDŽ ヺ ˖Q ˈ ԡ˖˄ ˅䰓ӣ 㔫 ˖ NJ& Ё ⱘ⺇ DŽ⫼1$㸼⼎DŽ 㑺Ў [㉦Ϣ⠽䋼ⱘ䞣 ˖Q NAN ˄ ˅ 䋼䞣˖ ԡ⠽䋼ⱘ䞣ⱘ⠽䋼 ⱘ䋼䞣 ⫼0㸼⼎ ԡ˖J PRO ϞㄝѢ䆹⠽䋼ⱘ 䞣 䋼䞣Ϣ⠽䋼ⱘ䞣 ˖QM m ˄ ˅⠽䋼ⱘԧ⿃ ˖ķ ㉦ⱘ Ⳃ ĸ ㉦ⱘ Ĺ ㉦䯈ⱘ䎱⾏ԧ⿃Ϣ⠽䋼ⱘ䞣 ˖QVm V2⢊ ϟ ˈ PRO ӏԩ⇨ԧⱘԧ⿃䛑㑺Ў O䰓ӣ 㔫 ˖ ⏽ ϟˈⳌ ԧ⿃ⱘӏԩ⇨ԧ䛑 Ⳍ ⱘ˄ ˅⠽䋼ⱘ䞣⌧ ˖ ԡԧ⿃⒊⎆Ё ⒊䋼%ⱘ⠽䋼ⱘ䞣DŽヺ ˖& ˈ ԡ˖PRO O˖&% VnB ˄ ˅⠽䋼ⱘ䞣⌧ ⱘ䜡 䜡 㽕Ẕ 䞣⫊ ⓣ∈ℹ偸˖ 䅵ㅫ ⿄䞣 ⒊㾷 䕀⿏ ˄⋫⍸ ⋫⍸⎆䕀 䞣⫊˅㺙⫊䌈ㅒ⠽䋼ⱘ ㋏⒊ ⎆ 㛊ԧ ⌞⎆䋼 ̚ !㛊ԧⱘ 䋼⡍ϕ䖒 ⦄䈵˖ ҂ⱘ䗮䏃 ⒊⎆Ϣ㛊ԧ⬉㾷䋼˖ ∈⒊⎆Ё 㗙❨ ⢊ ϟ㛑 ⬉ⱘ ⠽䴲⬉㾷䋼˖ ∈⒊⎆Ё ❨ ⢊ ϟ㛑 ⬉ⱘ ⠽ 㫫㊪ 䜦㊒ 62 &2 1+ ㄝ ⬉㾷䋼˖ ∈⒊⎆Ё㛑 䚼⬉⾏ⱘ⬉㾷䋼 䝌 +&O + 62 +12⺅ 1D2+ .2+ &D 2+ %D˄2+˅ⱘⲤ⬉㾷䋼˖ ∈⒊⎆Ё㛑䚼 ⬉⾏ⱘ⬉㾷䋼 䝌⺅⠽䋼ⱘ ⾏Ϣ 㒃 ∈䖛Ⓒ⊩˖䗖⫼Ѣ ⾏ϔ⾡㒘 ⒊ˈ ϔ⾡ϡ⒊ⱘ ⏋ ⠽ ㉫Ⲥⱘ 㒃, 1D&O 0Q2 㒧 ˖⏋ ⠽Ё 㒘 ⠽䋼 ⒊ Ё⒊㾷 ⱘ .12 1D&O㪌佣⊩˖䗖⫼Ѣ ⾏ 㒘 Ѧ⒊ˈԚ⊌⚍ϡ ⱘ⎆ ⏋ ⠽DŽ ˖䜦㊒Ϣ∈ⱘ ⾏, Џ㽕Ҿ ˖ 㪌佣⚻⫊ ㅵ 䫹 ⫊ 䜦㊒♃⎆˖ ⾏ѦϡⳌ⒊ⱘϸ⾡⎆ԧ ∈ &&O㧗 ˖⒊䋼 ѦϡⳌ⒊ⱘ⒊ 䞠⒊㾷 ϡ ⒈∈ &&O Ϟ 㡆 ϟ 㑶㡆˄㣃 Ϟ 㡆 ϟ 㡆 ˅ ϡ⫼䜦㊒㧗✄㡆 䪖ϱ⫼Ⲥ䝌⋫⍸ ✊ 䜦㊒♃➗⚻㟇 㡆 㰌 ⌟⎆䩴✄㡆˖咘㡆 䪒ⱘ✄㡆˖㋿㡆 ˄䗣䖛㪱㡆䪈⦏⩗˅&2 Ẕ偠 ⿔+&O ѻ⫳㛑Փ╘⏙♄∈ ⌥⌞ⱘ⇨ԧ&O Ẕ偠 ˖ ⸱䝌䫊ѻ⫳ⱘⱑ㡆≝⎔ϡ⒊㾷Ѣ⿔⸱䝌6R Ẕ偠 ⿔+&O %D&O ѻ⫳ⱑ㡆≝⎔1+ Ẕ偠 1D2+ ⛁ѻ⫳⇨ԧՓ⍺ⱘ㑶㡆㬞䆩㒌 㪱)H Ẕ偠˖ .6&1 ⦄㸔㑶㡆⒊⎆ )H 6&1 )H˄6&1˅ 1D2+ ⦄㑶㻤㡆≝⎔ $O Ẕ偠˖ 1D2+ ⦄ⱑ㡆≝⎔ ≝⎔⍜&X Ẕ偠 1D2+ ⦄㪱㡆≝⎔=$;䋼䞣 䋼 Ё Ḍ⬉㥋 䋼 Ḍ ⬉3 ԡ ˖ Ⳍ 䋼 ϡ Ё ⱘϡ Ѧ⿄ ԡ + + +ϧ乬Ѡ Ң⍋∈Ё㦋 ⠽䋼∃⇨⠽⧚ 䋼˖∃⇨ 咘㓓㡆ǃ ▔ ⇨ ǃ㛑⒊Ѣ∈ǃ ↨ぎ⇨ ǃ ⎆ ⱘ ↦⇨ԧDŽ2. 䋼˖∃⇨ ⇻ ˈ˄ ˅㛑䎳䞥 ˄ Na ǃFe ǃㄝ˅˖2Na + Cl 2== 2Na Cl 2Fe+3Cl 2===2FeCL 3˄ ˅ 䴲䞥 ˄ H 2˅ ˖+ &O ==2HCl ➗⚻ⱘ☿✄ 㢡ⱑ㡆ⱘˈ⫊ ⱑ䳒 ѻ⫳DŽ˄ ˅ ∈ⱘ ˖&O + 2 +&O +&O2∃䝌ⱘ 䋼˖˄ 䝌 ǃϡ〇 ǃ ⇻ ˅∃∈ 㾕 㾷 +&O2 +&O 2 Ėˈ ẩ㡆䆩 ⫊Ёˈ ∃∈ + 2 &O +FO2 + &O B &O2B Й㕂∃∈Џ㽕 Ў⿔+&ODŽ˄ ˅Ϣ⺅ⱘ ˖ 1D2+ &O 1D&O 1D&O2 + 2 ˄⫼Ѣ ⇨ ⧚˅ⓖⱑ㉝ ⧚ⱘ &O &D 2+ &D&O &D &O2 + 2ⓖⱑ㉝ⱘ &D &O2 &D&O &D &O2 DŽⓖⱑ㉝ ⫳⫼ⱘ &D &O2 &2 + 2 &D&2 Ę +&O2∃⇨ 䲚˖ Ϟ ぎ⇨⊩ 䲚˗Ẕ偠˖Փ⍺ⱘ⎔㉝ 䪒䆩㒌 㪱˗ ⇨ ⧚˖⫼⇶⇻ 䩴⒊⎆ ⇨DŽ4.⒈ǃⱘ (1) 2KI + C12 ==2KCl + I 2 (2)2KI + Br 2 = 2KBr+I 2 (3) 2KBr + Cl 2 ==2KCl+Br 25.䩴˄1˅䩴ⱘ⠽⧚ 䋼˖ 䫊ⱑ㡆ǃ 䞥 ⋑ⱘ ԧˈ⛁ǃ⬉ⱘ㡃 ԧˈ䋼 䕃 ǃ ǃ❨⚍Ԣ˄2˅䩴Ϣ∈ ⱘ⦄䈵 㾷䞞˖ķ⍂˖˄䇈 䩴ⱘ ↨∈ⱘ ˅ĸ❨˖˄䇈 䩴ⱘ❨⚍ Ԣ ˗䆹 Ў ⛁ ˅Ĺ␌˖˄䇈 ⇨ԧѻ⫳˅ĺ ˖˄䇈 ⇨ԧѻ⫳˅Ļ㑶˖⒊⎆ЁⓈ 䜮䜲 㑶㡆˗˄䇈 ⫳ ⱘ⒊⎆ ⺅ ˅DŽ˄3˅䩴Ϣ∈ ⱘ Ў 2Na+2H 2O=2NaOH+H 2Ė ˈ ⾏ Ў2Na+2H 2O=2Na + +2OH -+H 2ĖDŽ˄4˅Ϣ⇻⇨ ˖4Na+O 2==2Na 2O 2Na+O 2= =Na 2O 2˄5˅4Na+TiCl 4== 4NaCl+ Ti ˄6˅Na ⱘ⫼䗨ķ 䩴ⱘ䞡㽕 ⠽ ĸЎЁ ⱘ⛁Ѹ Ĺ ⚐Ti.䪠䫚䩦ㄝ䞥 ĺ䩴 ⑤˄7˅⺇䝌䩴Ϣ⺇䝌⇶䩴ⱘ↨䕗⿄⺇䝌䩴 ⺇䝌⇶䩴Na 2CO 3 NaHC O 3㒃⺅ 㢣 㢣 买㡆ǃ⢊⒊㾷⒊㾷 ↨⺇䝌䩴 ⛁〇üüü 2NaHC O 3== Na 2CO 3 +H 2O+CO Ė ϢⲤ䝌 Na 2CO 3+2HCl==2NaCl+H 2O+CO Ė ↨Na 2CO 3 ⚜NaHCO 3+HCl==NaCl+H 2O+CO Ė ϢNaOHüüü NaHCO 3+NaOH==Na CO 3+H 2O ⳌѦ䕀˄ ˅䰸 ˖Na 2CO 3 ԧ˄NaHCO 3˅ ⛁ Na 2CO 3⒊⎆˄NaHCO 3˅ NaOH4䡈 ⺇䝌䩴 ⺇䝌⇶䩴ⱘ ⊩˖ǃ ⛁ ⦄⇨ԧ ⺇䝌⇶䩴ǃ 䝌 ⦄⇨ԧⱘ ⺇䝌⇶䩴 ≵⇨ԧ ⦄⇨ԧⱘ ⺇䝌䩴ǃ CaCl 2⒊⎆ѻ⫳ⱑ㡆≝⎔ⱘ ⺇䝌䩴ǃ⾏ ⫳ⱘ ӊ˖˄ ˅⫳ 䲒⒊⠽ ˄ ˅⫳ ⱘ⠽䋼˄ ˅⫳ 䲒⬉⾏⠽䋼 ˊ㛑ℷ⹂к 㾕ⱘ⾏ DŽк ℹ偸˖ ˄ ⒊ ⬉⾏⠽䋼 ⾏ ˈ䲒⒊䲒⬉⾏ⱘ⠽䋼ˈ⇨ԧǃ 䋼ǃ⇻ ⠽ ⬭ ˅ ˄⬉㥋 㸵ˈ Ͼ ˅ 䰘˖㛑 ⾏ ⱘ ˖˄ ˅ϝ 䝌 +&O + 62 +12˄ ˅ ⺅ 1D2+ .2+ &D 2+ %D˄2+˅˄ ˅ ⒊ ⱘⲤ˄ķ䪒䩴䫉⸱⒊ ĸⲤ䝌Ⲥ AgCl, ⸿䝌Ⲥ BaSO 4˅ˊ⾏+ Ϣ 2+B &2 B 62 B +&2 B ϡ㛑2+B Ϣ+ 1+ 0J $O )H )H =Q &X +&2 B ϡ㛑$J Ϣ&O B &D Ϣ&2 B %D Ϣ&2 B %D Ϣ62 B )H Ϣ6&1B Ϣϡ㛑&X 㪱㡆 )H ⌙㓓㡆 )H 咘㡆 0Q2 B ㋿㡆䬕ⱘ䬕ⱘ˄ ˅0J&O &D˄2+˅ 0J˄2+˅ Ę &D &O ˄ ˅0J˄2+˅ +&O 0J&O + 2 ˄ ˅⬉㾷0J&O 0J &O Ė䬕 䋼 䋼0J 1 0J 1 0J +&O 0J&O + Ė 0J &2 0J2 &ϧ乬ϝҢⷓ⠽ ⸔ϔ Ң䪱 ⷓ 䪱 䞥䪱 Ё ⱘ䞥 ㋴ˈЏ㽕 ҹ ˈ䪱 ⷓЏ㽕 $O 2$O 2 ϸ ⇻ ⠽Ϣ⸿䝌 Al 2O 3+3H 2SO 4==Al 2˄SO 4˅3+3H 2OϢ⇶⇻ 䩴Al 2O 3+2NaOH==2NaAlO 2+H 2O⾏ Al 2O 3+2OH -==2AlO 2-+H 2OAl ˄OH ˅3ϸ ⇶⇻ ⠽˄1˅Al ˄OH ˅3+3HCl==3AlCl 3+3H 2O Al ˄OH ˅3+NaOH==NaAlO 2+2H 2O⾏ : Al ˄OH ˅3+OH -==AlO 2-+2H 2O⛁ 㾷 2Al ˄OH ˅3== Al 2O 3+3H 2O˄2˅ NaOH Ⓢ AlCl 3⒊⎆Ё㟇䖛䞣⦄䈵˖ ⱑ㡆≝⎔ ≝⎔⍜ DŽ偠 ⫼䪱ⲤϢ䎇䞣⇼∈ Al ˄OH ˅3 ˄ ˅ ⷒ˖ Ѡ∈ ⸿䝌䪱䪒>.$O 62 g + 2@ ⒊Ѣ∈ˈ⒊Ѣ∈ 䝌 ˈ ⷒ ⫼ ∈ ˈ Ў䪱⾏ ∈㾷⫳ ⇶⇻ 䪱 㗠⇶⇻ 䪱 䰘 њ∈Ё ⍂⠽ 㗠ϟ≝ DŽ䪱ⱘ 䋼˄ ˅⠽⧚ 䋼 䫊ⱑ㡆䞥 ԧˈ J FP 䕗 ⱘ䶻 ǃ 㡃 ⱘ ⛁ ⬉˄ ˅ 䋼䪱 ↨䕗⌏⋐ⱘ䞥 ˈ 䕗 ⱘ䖬ķϢ⇻⇨⏽ϟϢぎ⇨Ёⱘ⇻⇨ ⫳ ⱘ⇻ 㝰ˈ ҹ䪱 㡃 ⱘ 㜤㱔㛑$O 2 $O 2ĸ䪱Ϣ ∈ϡĹϢ䴲⇻ 䝌$O +&O $O&O + Ė $O + 62 $O ˄62 ˅ + Ė⏽ϟ䪱Ϣ⌧⸿䝌⌧⸱䝌䩱ĺϢ ⺅$O 1D2+ + 2 1D$O2 + Ė˄ ϔⱘϔϾ˅Ļ䪱⛁2Al+ Fe2O3===2 Fe + Al 2O3 ⛞ 䪕䔼Ѡ 䪕ǃ䪰ⱘ㦋 ⫼䪰ⱘ 䋼⠽⧚ 䋼 䞥 ⋑ⱘ㋿㑶㡆䞥 J FP 䋼䕃ˈ 㡃 ⱘ ⬉ ⛁ 䋼Ϣ⇻⇨2Cu+O2===2CuO CuO+2HCl==H2O+CuCl2(2)Ϣ ⇻ ⱘ䝌Cu+2H2SO4===CuSO4+SO Ė+H2O 3Cu+8HNO3==3Cu˄NO3˅2+2NOĖ+4H2O 3Cu+2HNO3⌧==Cu˄NO3˅2+2NO2Ė+4H2O(3)ϢⲤCu+2FeCl3==CuCl2+2FeCl2 Cu+2AgNO3==Cu(NO3)2+2Ag䪕ⱘ 䋼( 䪕ⱘ⠽⧚ 䋼䞥 ⋑ⱘ䫊ⱑ㡆䞥 ,䋼䕃\ 㡃 ⱘ ⬉ ⛁ 㛑㹿⺕䪕(2) 䋼ķϢ⇻⇨ 3Fe+2O2==Fe3O4 ĸϢ䴲䞥 2Fe+3Cl2==2FeCl3ĹϢ∈ 3Fe+4H2O(g)== Fe3O4+4H2ĖĺϢ䝌 Fe+H2SO4== FeSO4+ H2ĖĻϢⲤ Fe+CuSO4==FeSO4+Cu Fe+2HCl== FeCl2+ H2ĖFe2O3Ϣ䝌 Fe2O3+6HCl==2FeCl3+3H2OFe3+ⱘẔ偠:ϢKSCN ⦄㸔㑶㡆⒊⎆)H )H П䯈ⱘⳌѦ䕀)H )H )H )H⇻ 䖬2FeCl2+Cl2==2FeCl3 2FeCl3 +Fe==3FeCl2 Cu+2FeCl3==CuCl2+2FeCl2⇶⇻ 䪕 : FeCl3 +3NaOH==Fe(OH)3+3NaCl ⛁ 㾷2Fe˄OH˅3== Fe2O3+3H2O䩶䪕ⱘ㜤㱔: 䩶䪕Ϣ ⠽䋼 㾺 ⫳ 㗠㹿 㱔 㗫⬉ 㜤㱔: ϡ㒃䞥 㾺⬉㾷䋼⒊⎆ѻ⫳ ⬉⌕㗠 ⫳⇻ 䖬 1.㸼䴶㽚Ⲫ5䞥 䰆㜤ⱘ ⊩ 2. 䚼㒧⬉ ⊩ϝ ⸙ⷓ⠽Ϣ6L2 䋼 ϡ⌏⋐ 㗤催⏽㗤㜤㱔ķϡϢ∈ 䝌 䰸+) 6L2 +) 6L) Ė + 2 ⦏⩗⫊ϡ㛑㺙+)䝌ĸϢ⺅ ⇻ ⠽ 6L2 &D2 &D6L2ĹϢ⺅ 6L2 1D2+ 1D 6L2 + 2 偠 㺙1D2+ⱘ䆩 ⫊⫼‵Ⲃ 㗠ϡ㛑⫼⦏⩗⸙ ㋴ 㞾✊⬠ҹ6L2 ⸙䝌Ⲥⱘ ˈⶹ䘧 ԧ⸙ 㡃 ⱘ ԧ ⸙⠽⧚ 䋼 ԧ⸙ ⦄♄咥㡆 䞥 ⋑⹀㗠㛚ⱘ ԧ㡃 ⱘ ԧ6L2 & &2Ė 6L ㉫⸙ 6L &O 6L&O 6L&O + 6L +&Oϧ乬 ⸿ǃ∂ 㓁ϔ ⸿ ⠽ⱘ 䋼 ⫼ϔǃѠ⇻ ⸿ⱘ 䋼Ϣ⫼1ǃ⠽⧚ 䋼˖ 㡆 ▔ ⇨ ⱘ ↦⇨ԧ ↨ぎ⇨2ǃ 䋼˄1˅Ϣ∈ SO2+H2O==H 2SO3 䗚 H2SO3ⱘϡ〇 H2SO3 2 H2SO4˄2˅䖬 2SO2+O2 2SO3˄3˅ⓖⱑ ˖SO2 㛑Փ 㑶⒊⎆㻾㡆 ⧚˖Ϣ 㡆⠽䋼㒧 ⫳ ϡ〇 㡆⠽䋼˄ⓖⱑ˅∃∈∌Й ⓖⱑ ⧚˖HClO ⇻ ˈ 㡆⠽䋼⇻ ⫳ 〇 ⱘ 㡆⠽䋼3ǃ䝌䲼˖PHLJ5.6 ℷ 䲼∈PH 㑺Ў6 ˈ∈Ё⒊㾷 CO2⸿䝌 䝌䲼ⱘ ˖ SO2⑤˖˄Џ㽕˅ ➗ ѻ ⱘ➗⚻DŽ˄㽕˅ ⸿䞥 ⷓ⠽ⱘ ⚐ǃ⸿䝌⫳ѻѻ⫳ⱘ ⇨䰆⊏˖ 㛑⑤ˈ ⸿➗ 䖯㸠㜅⸿ ⧚ˈ 催⦃ ⱘ 䆚㾕ⱘ⦃ 䯂乬˖䝌䲼˖SO2 NO2 ˈ⏽ ˖CO2ˈ ⚳䳒˖NO NO2 O3ˈ㟁⇻ ぎ⋲˖∃⇳⚗ˈⱑ㡆 ˖ ˈ 䜦˖CH3OH ˈ ∵ ˖⬆䝯ˈ䌸╂˖⻋⋫㸷㉝ˈCO ϢNO Ϣ㸔㑶㲟ⱑ㒧 㗠 ↦ˈ⬉∴˖䞡䞥 ⾏ ∵ DŽѠǃ⸿䝌ⱘ Ϣ 䋼1ǃ 㾺⊩ ⸿䝌⧚˖˄1˅⸿⻎˄⸿ⷓ˅Ϣ⇻⇨ ⫳ SO2 S+O2==SO2 4FeS2+11O2===2Fe2O3+8SO2˄2˅SO2Ϣ⇻⇨ ⫳ SO3 2SO2+O2 2SO3˄3˅SO3䕀 Ў⸿䝌SO3+H2O==H2SO42ǃ⸿䝌ⱘ 䋼⌧⸿䝌ⱘ⡍ Ł ∈ ˖⌧⸿䝌 䰘ⴔ ⠽䋼㸼䴶 䚼ⱘ ∈ 㒧 ∈ⱘ 㛑DŽ⎆ԧⱘ ➹ DŽϡ㛑 ➹⺅ ⇨ԧNH3ł㜅∈ ˖㫫㊪ⱘ⚁ ⌧⸿䝌Ⓢ Ⲃ㙸Ϟ ⧚˖ ⫼ DŽ ⫼ 䞣ⱘ∈ ⋫˄3˅⌧⸿䝌ⱘ ⇻6Ϣ䪰 ˖2H2SO4˄⌧˅+Cu CuSO4+SO2Ė+2H2O 㹿䖬 ⱘ⸿䝌 ⸿䝌ⱘϢ⺇ ˖C+2H2SO4˄⌧˅ SO2Ė+ CO2Ė+2H2O⏽ϟˈ⌧⸿䝌Փ䪕䪱䩱Ѡ ⫳ѻ⫳⌏Ёⱘ ∂ ⠽1ˊN2⬉⚳䳒 NO22ˊ⇼⇨ⱘ⫳ѻ Փ⫼⠽⧚ 䋼˖ 㡆 ▔ ⇨ ⱘ⇨ԧˈ ↨ぎ⇨ ˈ ⎆˄1˅Ϣ∈⇼⒊Ѣ∈ ˈ 䚼 ⇼ ∈ ϔ∈ ⇼ˈNH g+ 2ϡ〇 ˈ ⛁ 㾷Ў⇼⇨ ∈NH3+H2O NH g+ 2NH4++OH- NH g+NH Ė+H2O⇼∈ ˖NH3 H2O NH g+ 2 ⾏ ˖NH4+ O H- 䞣H+⇼⇨㛑Փ⍺ⱘ㑶㡆㬞䆩㒌 㪱⎆⇼Ϣ⇼∈ⱘ ˖⎆⇼⇼⇨ⱘ⎆ԧ⢊ 㒃 ⠽ϡ㛑Փ⍺ⱘ㑶㡆㬞䆩㒌 㪱⇼∈⇼⇨⒊㾷Ѣ∈⏋ ⠽㛑Փ⍺ⱘ㑶㡆㬞䆩㒌 㪱˄2˅⇼ ҹϢ䝌˄⸿䝌ˈ⸱䝌ˈⲤ䝌˅ ⫳ ⲤNH3+HCl==NH4Cl ˄ⱑ⚳˅ NH3+HNO3===NH4 NO3˄ⱑ⚳˅NH3+H+==NH4+3ˊ䫉Ⲥ䫉Ⲥ ⒊㾷Ѣ∈˄ ˅ ⛁ 㾷 NH4Cl NH Ė +&OĖ 1+ +&2 NH Ė + 2 &2 Ė˄2˅䫉ⲤϢ⺅ ⇼⇨NH4Cl+NaOH NaCl+NH Ė+H2O⊼ ˖䫉 ∂㙹㽕䙓 Ϣ⺅ 㙹 ⏋ Փ⫼ƾ1+ + Ẕ偠˖ NaOH ⛁ѻ⫳ⱘ⇨ԧ㛑Փ⍺ⱘ㑶㡆㬞䆩㒌 㪱4ˊ⸱䝌ⱘ Ϣ 䋼Ϯ ˖˄1˅⇼ ⱘ⫼ϟϢ⇻⇨ ⫳ ˈ⫳NO4NH3 + 5O2 4 NO+6 H2O˄2˅NOϢ⇻⇨ ⫳ NO2 2NO+O2=== 2NO2˄3˅⫼∈ NO2⫳ ⸱䝌 3NO2 + H2O ˙ 2HNO3+NO䋼˖ Cu + 4HNO3(⌧)=== Cu˄NO3˅2+2NO2Ė+2H2O3Cu + 8HNO3(⿔)==Cu˄NO3˅2+2NOĖ+4H2OC+ 4HNO3(⌧)=== CO2Ė+2NO2Ė+2H2O⏽ϟˈ⌧⸱䝌Փ䪕䪱䩱7ⶹ䆚⚍ϧ乬ϔ 㾖㒧 Ϣ⠽䋼ⱘ ḋϔ Ḍ ⬉ϔǃḌ ⬉1ˊ ㋴˖ Ⳍ 䋼 ϔ㉏ ⿄DŽḌ㋴˖ ϔ Ⳃ䋼 ϢЁ ⱘ ˄=$;˅ ԡ㋴˖ 䋼 ϡ Ё ⱘ ϔ⾡ ㋴ⱘϡ Ѧ⿄䋼䞣 ˖䋼 ϢЁ ПˊḌ ⬉ 㾘 ˖ķ 㛑 㒇8Ͼ⬉ ˄⇺ 2 Ͼ˅˗ĸ 㛑 㒇 18 Ͼ⬉ ˗Ĺ ϝ 㛑 㒇32 Ͼ⬉ ˗ĺ↣Ͼ⬉ 㛑 㒇 2n2 Ͼ⬉ DŽˈ⬉ 㛑䞣 Ԣⱘ⬉ 䞠˗ǃ ̚ ㋴ⱘ 㒧 ⼎ˊ ㋴ ˖ ㋴ⱘ 䋼䱣ⴔ Ḍ⬉㥋 ⱘ䗦 㗠 ⦄ ⱘ㾘㋴ ㋴Ḍ ⬉ 䱣 ㋴Ḍ⬉㥋 ⱘ䗦 ⱘ ✊㒧˄ ˅ 䱣ⴔ Ḍ⬉㥋 ⱘ䗦 ⱘ ⬉ ⬉ ⦄䰸 ǃ ㋴ ˈ ⬉ Ϟⱘ⬉ 䞡 ⦄ 䗦 ⱘ˄ ˅䱣ⴔ Ḍ⬉㥋 ⱘ䗦 ⦄㋴ˈҢ ˈ ˈ˄ ˅䱣ⴔ Ḍ⬉㥋 ⱘ䗦 ㋴ⱘЏ㽕 Ӌ ⦄催ℷ ӋҢ 䗤⏤ ˈ Ԣ䋳Ӌⱘ㒱 䗤⏤㋴ⱘ 催ℷ Ӌ== ⱘ ⬉ ˗ 催ℷ ӋϢ䋳 Ӌⱘ㒱 П = 8 DŽ˄ ˅䱣ⴔ Ḍ⬉㥋 ⱘ䗦 ㋴ⱘ䞥 䴲䞥 ⦄ˈҢ ㋴ⱘ䞥 䗤⏤ ˈ ㋴ⱘ䴲䞥 䗤⏤Na Mg Al Si P S Cl 䞥 ˖Na˚Mg˚Al 䞥 䗤⏤ 䴲䞥 䗤⏤ 䴲䴲䞥 ˖Cl˚S˚P˚Siˈ˄5˅ķ ㋴ⱘ䞥 䍞 ˈ 催Ӌ⇻ ⠽ ⱘ∈ ⠽˄⇶⇻ ⠽˅⺅ 䍞 ˈ䞥䞥 ˖Na˚Mg˚Alˈ⇶⇻ ⠽⺅ ЎNaOH > Mg(OH)2> Al(OH)3DŽĸ ㋴ⱘ䴲䞥 䍞 , 催Ӌ⇻ ⠽ ⱘ∈ ⠽˄ ⇻䝌˅䝌 䍞 ˈ䴲䞥 ˖Si <P< S< Clˈ䝌 H3PO4 <H2SO4<HClO4㋴ⱘ䴲䞥 䍞 ˈ ⱘ⇶ ⠽䍞〇 ˗⇶ ⠽ⱘ〇 ЎSiH4<PH3<H2S<HCl5ˊ ㋴ 㸼ⷁ 1ǃ2ǃ3䭓 4ǃ5ǃ6˄1˅㒧 ϡ 7Џ ĉ$̚ď$ĉ%̚ď%Đ ǃ ǃ ⇨ԧ˄ ˅ ⬉ Џ ⬉˄ ˅↣ϔ Ң ˈ 䗤⏤ ˗Џ㽕 ӋҢ +1̚ +7˄FǃO ℷӋ˅ˈ䞥89 䗤⏤ ˈ䴲䞥 䗤⏤ DŽ↣ϔЏ ҢϞ ϟ ˈ 䗤⏤ ˗䞥 䗤⏤ ˈ䴲䞥 䗤⏤ DŽˊ 䬂˖⠽䋼ЁⳈ Ⳍ䚏ⱘ ⾏ П䯈 ⚜ⱘⳌѦ⫼˄ ˅⾏ 䬂˖Փ Ⳍ ⬉㥋ⱘ䰈ǃ䰇⾏ 㒧 ⱘⳌѦ⫼⾏ ⠽˖䰈ǃ䰇⾏ 䗮䖛䴭⬉⫼Ⳍ ⱘ ⠽⾏ 䬂˖⌏⋐ⱘ䞥 Ϣ⌏⋐ⱘ䴲䞥 䫉ḍ⾏ Ϣ䝌ḍ⾏˄ ˅ Ӌ䬂˖ П䯈䗮䖛 ⫼⬉ ⱘ ⚜ⱘⳌѦ⫼Ӌ ⠽˖䗮䖛 ⫼⬉ ⱘ ⠽Ӌ䬂˖䴲䞥 ㋴П䯈䴲 䬂˖Ⳍ ˊˊⱘ䴲䞥 ㋴П䯈 䬂 ϡ ˊˊⱘ䴲䞥 ㋴П䯈 ˊ⬉˄1˅ ϟ ⠽䋼ⱘ⬉ ˖H2Cl 2N 2HCl H 2O CO 2 NH 3 CH NaCl MgCl 2 NaO H Na +⫼⬉ 㸼⼎ϟ ⠽䋼ⱘ 䖛˖˄1˅ HCl ˖ ˄2˅NaCl ˖(3) MgCl 2 : ___________________________8ˊ ㋴ ԧ˖ ⾡ ㋴ ⱘϡ ⾡ 䋼DŽ ˖䞥 ˈ ϢC 60 㑶⻋Ϣⱑ⻋9ˊ⺇ Ͼ⬉ ˈϔϾ⺇ ҹ Ͼ Ӌ䬂ˈ ҹ & &ǃ& &ǃ&į&10ˊ ԧ˖ Ⳍ 㒧 ϡ ⱘ ⠽Ѧ⿄ ԧC 4H 10 CH 3CH 2CH 2CH 3 CH 3CHCH 3 ϕ⛋ℷϕ⛋ CH 3 CH 3C 5H 12 CH 3CH 2CH 2 CH 2 CH 3 CH 3CHCH 2 CH 2 CH 3C CH 3⛋ CH 3 CH 32-⬆ ϕ⛋ 2ˈ2-Ѡ⬆ ϭ⛋ϧ乬Ѡ Ϣ㛑䞣ϔ䗳⥛Ϣ 䰤ϔǃ 䗳⥛ˊ Н˖ 䗳⥛ ⫼ 㸵䞣 䖯㸠 ⱘ⠽⧚䞣ˈ ⫼ ԡ䯈 ⠽⌧ ⱘ ⫳ ⠽⌧ ⱘ 㸼⼎ˈ 㸼䖒 㸼⼎Ў tc V '' ԡ PR/ ˄/gV˅ ⊼ ˖ ⠽䋼㸼⼎ⱘ䗳⥛↨ㄝѢ䆹 ЁⳌ ⱘ䅵䞣㋏ ↨ˊ 䗳⥛ⱘ ㋴˄ ˅ ˖ ⠽ⱘ 䋼˄Џ㽕˅˄ ˅ Ҫ ӊϡ10ķ⏽ ˖⏽ 䍞催 䗳⥛䍞 ˅ĸ ˖ Ѣ ⇨ԧ ⱘ ˈ 䗳⥛䍞Ĺ⌧ ˖⌧ 䍞 䗳⥛䍞ĺ ˖Փ⫼ℷ 䗳⥛Ҫ˖ 㾺䴶⿃ⱘ ǃ ԧ ⠽ⱘ乫㉦ ǃ ✻ǃ䍙 ⊶ǃ⬉⺕⊶ǃ⒊ㄝ 䗳⥛г DŽѠǃ 䰤ǃ 䗚 ˖ ϔ ӊϟˈ ҹ ℷ 䖯㸠ˈ ҹ 䗚 䖯㸠DŽ 䗚 ϔ 䰤 ˈ ⠽ϡ 㛑 䕀 Ў⫳ ⠽DŽ ՟ ˖&O + 2 +&O +&O2 )H , )H ,ǃ 㸵⢊ ˖ ϔ ӊϟⱘ 䗚 䞠ˈ ℷ 䗳⥛ㄝѢ䗚 䗳⥛ˈ⠽ ⫳ ⠽ⱘ⌧ ϡ ⱘ⢊⡍ ˖˖ 㸵 9ℷĮ ˈ 9䗚Įㄝ˖9ℷ 9䗚˖ 㒘 ⱘ⌧ ϡ ˄ϡ Ⳍㄝˈгϡ㛑 ⾡↨՟˅˗ ӊ ˈ 㸵 ⫳⿏Ѡ Ёⱘ㛑䞣Ёⱘ⛁䞣⛁ ˖ Ϟ ⛁䞣 ⱘ ⠽ⱘ 㛑䞣!⫳ ⠽ⱘ 㛑䞣䬂 ⱘ㛑䞣 Ѣ 䬂 ⱘ㛑䞣ǃ ⛁ ˖ Ϟ ⛁䞣ⱘ ⫳ ⠽ⱘ 㛑䞣! ⠽ⱘ 㛑䞣䬂 ⱘ㛑䞣 Ѣ 䬂 ⱘ㛑䞣Ƹ+ЎĀ ā 㗙Ƹ+ ˈЎ ⛁ Ƹ+ЎĀ ā 㗙Ƹ+! ˈ Ў ⛁㾕ⱘ ⛁ ˖➗⚻ǃ䝌⺅Ё ǃ䞥 Ϣ䝌ⱘ ǃ⇻ 䩭Ϣ∈㾕ⱘ ⛁ ˖&D&2 催⏽ 㾷ˈ& &2 ⱘ ˈ⇶⇻ 䩭Ϣ∃ 䫉 ԧϝ 㛑Ϣ⬉㛑ⱘ䕀ϔǃ ⬉∴Н˖ 㛑䕀 Ў⬉㛑ⱘ㺙㕂⧚˖⇻ 䖬䕗⌏⋐ⱘ䞥 ⫳⇻ ˈ⬉ Ң䕗⌏⋐ⱘ䞥 ˄䋳 ˅⌕ 䕗ϡ⌏⋐ⱘ䞥䴲䞥 ԧ˄ℷ ˅⬉䫠 䪰 ⬉∴䋳 ˖ =Q H =Qℷ ˖ ˎˤ ˎ́˙ˤˎĖ˖˶̊ ˎˤ ˙˙˶̊ˎ ˤˎĖ11⇶⇻➗⚻⬉∴Ӭ⚍˖˄ ˅㛑䞣䕀 ⥛催 ˄ ˅⋕ ǃ ∵ ǃ ䷇Ԣǃ䱤㬑 ˄ ˅ 㒧 DŽ䗖 ϡ ⥛㽕∖♉⌏ ˄ ˅↨ ⥛ ˈ↨㛑䞣催ˈ 䋳䕑ⱘ䗖 㛑 ˄ ˅ ⦄⛁ǃ⬉ǃ㒃∈ǃ㘨ѻѠǃ⬉㾷∴⬉㛑䕀 Ў 㛑ⱘ㺙㕂՟ ⬉㾷&X&O ǃ⬉㾷∈ǃ⬉㾷亳Ⲥ∈ǃ⬉㾷㊒⚐䪰ϧ乬ϝ ⠽ⱘ㦋 Ϣ ⫼ϔ ➗ Ϣ ⠽ϔˊ ➗➗ ˖✸ǃ⊍ǃ ✊⇨✊⇨ⱘЏ㽕 ˖&+⊍ⱘ㒘 ㋴Џ㽕 ⺇ ⇶ˈ 䖬 6ǃ2ǃ1ㄝDŽЏ㽕 ⾡⎆ ⱘ⺇⇶ ⠽ˈ䖬⒊ ⇨ ⱘ⺇⇶ ⠽✸ ⠽ ⠽ 㒘 ⱘ ⱘ⏋ ⠽DŽ✸ⱘ 䞣 & +ǃ2Ѡˊ㒧ˊ⬆⛋˖ ˖&+ 㒧 ˖ ⬉ℷ 䴶ԧ ✊⇨ϝ ˖⊐⇨ǃ ⇨ǃ ✊⇨ˊ 䋼 ϔ㠀 ϟˈ 䋼〇 ˈ䎳 䝌ǃ ⺅ ⇻ ϡ˄ ˅⇻&+ 2o ⚍➗&2 + 2˗Ƹ+ &+ ϡ㛑Փ䝌 催䬄䝌⬆㻾㡆˄ ˅ ҷҷ ˖ ⠽ ⱘ ⾡ ˄ ˅㹿 ϔ⾡ ˄ ˅ ҷⱘ CH 4+Cl 2 o ✻CH 3Cl+HCl CH 3Cl+Cl 2 o ✻ CH 2Cl 2+ HClCH 2Cl 2+Cl 2 o ✻ CHCl 3+ HCl CHCl 3+Cl 2 o ✻ CCl 4+ HCl˄ ˅Џ㽕⫼䗨˖ ǃ ѻ ǃ ✊⇨ǃ⊐⇨ ⫼ϝˊЭ⛃⊍⚐ ˖⊍ 佣ǃ 㺖 ǃ㺖㾷㺖 ˖Ⳍ 䞣䕗 ǃ⊌⚍䕗 ⱘ⚗12㺖㾷˖Э⛃ǃϭ⛃㗕ㄝ⇨ ⷁ䫒⚗⊍ⱘ㺖㾷 Ў⫳ѻЭ⛃ⱘЏ㽕 ⊩ˊЭ⛃ ˖& + 㒧 ㅔ ˖&+ &+ 㒧 ˖ˊЭ⛃ⱘ Ϯ ⊩ ⠽⧚ 䋼 Ͼ ϔ 䴶ϞϮ ⊩˖ ⊍⠽⧚ 䋼⏽ϟЎ 㡆ǃ ⇨ԧˈ↨ぎ⇨⬹䕏ˈ䲒⒊Ѣ∈䋼˄ ˅⇻ķ ➗⦄䈵˖☿✄ ҂ˈ 咥⚳ ˖ ⺇䞣催ĸ Փ䝌 催䬄䝌䪒⒊⎆㻾㡆˄ ˅⠽ Ё 䬂˄ 䬂˅ϸッⱘ⺇ ϞϢ Ҫⱘ Ⳉ 㒧 ⫳ ⱘ ⠽ⱘ⦄䈵˖⒈∈㻾㡆&+ &+ + 2o&+ &+ 2+ 㘮㘮 ˖⬅Ⳍ 䞣 ⱘ ⠽ѦⳌ㒧 Ⳍ 䞣 ⱘ ⠽DŽ䖭⾡⬅ ⫳ⱘ㘮 㘮Э⛃ 㘮Э⛃⫼䗨˖ ǃ⊍ ⸔ ǃỡ⠽⫳䭓䇗㡖 ❳䆘ӋϔϾ Э⛃ Ϯⱘ ∈ 㒣 Ў㸵䞣䖭Ͼ ⊍ Ϯⱘ䞡㽕 Пϔˊ✸ⱘ㓐 ⫼ 㣃ˊ ✸ⱘ⇨ ǃ⎆ 佣 ✸㓐 ⫼ⱘЏ㽕 ⊩✸ⱘ⇨ ˖ ✸䕀 Ў⇨ԧˈЎ➗ ⇨✸ⱘ⎆ ˖➗ ⊍佣ˊ㣃13˄ ˅⠽⧚ 䋼㡆 ⡍⅞⇨ ⱘ⎆ԧˈ❨⚍ ć⊌⚍ ćˈ ˈϡ⒊Ѣ∈ ⒊Ѣ䜦㊒ㄝ ⒊ ˄ ˅ 䋼ķ⇻Dˊ➗⚻& + 2 o ⚍➗&2 + 2%ˊϡ㛑Փ䝌 催䬄䝌䪒⒊⎆㻾㡆ĸ ҷ ⸱⫼䗨˖ ⸔ ǃ⫼Ѣ⫳ѻ㣃㛎ǃ㣃䜮ǃ 啭ㄝѠ 亳 Ёⱘ ⠽ϔˊЭ䝛ˊ㒧㒧 ㅔ ˖&+ &+ 2+ 㛑 2+⭫⍜↦䜦㊒ˊ⇻ķ ➗&+ &+ 2+ 2 o ⚍➗&2 + 2ĸ ⇻&+ &+ 2+ 2 o '&+ &+2 + 2 ǃ 䬂&+ &+2 2 o&+ &22+ˊϢ䩴&+ &+ 2+ 1D o &+ &+ 21D + Ė⫼䗨˖➗ ǃ⒊ ǃ ˈ ˄ԧ⿃ ˅ⱘ䜦㊒ ⍜↦ѠˊЭ䝌ˊ㒧˖& + 2 ˈ㒧 ˖ 㒧 ㅔ &+ &22+ˊ䝌 ˗&+ &22+&+ &22 + 䝌 &+ &22+!+ &2&+ &22+ 1D &2 o &+ &221D + 2 &2 Ė14䝛 䝌䍋⫼⫳ 䝃 ∈ⱘ 䝃ƾ &+ &+ 2+ &+ &22+ o '&+ &22&+ &+ + 2㉏ ˖ ҷ 䋼˖䝌㜅㕳 䝛㜅⇶⌧⸿䝌˖ ∈佅 ⺇䝌䩴⒊⎆ⱘ⫼˖˄ ˅Ё ⱘЭ䝌˄ Ѣ䯏Э䝌Э䝃ⱘ⇨ ˅˄ ˅ ⱘЭ䝛 ˄ ˅䰡ԢЭ䝌Э䝃ⱘ⒊㾷ϝˊ䝃 ⊍㛖㒧 ˖5&225Ą ∈ ǃ㢅 㢇佭⇨⊍˖ỡ⠽⊍ ˄⎆ ˅⊍㛖㛖˖ ⠽㛖㙾˄ ˅⊍㛖 䝌 ⺅ ӊϟ∈㾷 ⱖ ˖⊍㛖 ⺅ ӊϟ∈㾷⫬⊍⫼˖˄1˅亳⫼˄2˅ 㙹ⱖǃ⫬⊍ǃҎ䗴 ⊍ǃ㛖㙾䝌ㄝˊ㊪㉏ 䗮 Cn ˄H 2O ˅m1ˊ ㉏㊪˖㨵㧘㊪C 6H 12O 6㊪㉏ Ѡ㊪˖㫫㊪˖C 12H 22O 11㊪˖⎔㉝ǃ㑸㓈㋴˄C 6H 10O 5˅n2ˊ 䋼㨵㧘㊪˄1˅⇻㨵㧘㊪㛑 ⫳䫊䬰 ˄ ҂ⱘ䫊䬰˅ Ϣ Cu ˄OH ˅2 ˄㑶㡆≝⎔˅䆕 㨵㧘㊪ⱘ Ẕ偠⮙Ҏⱘ ⎆Ё㨵㧘㊪ⱘ 䞣 催˄2˅Ҏԧ㒘㒛Ёⱘ⇻ կ⫳ ⌏ 䳔㽕ⱘ㛑䞣C 6H 12O 6˄S ˅+6O 2˄g ˅==6CO 2+6H 2O ˄l ˅ Ƹ+ .-gPROC 6H 12O 6 o ଜൻ䝊2C 2H 5OH+2CO Ė⎔㉝ⱘ∈㾷15Ѩˊ㲟ⱑ䋼Ϣ⇼ 䝌1ǃ㒘 ㋴˖C ǃH ǃO ǃN ㄝˈ ⱘ S ǃP2ǃ 䋼˄1˅㲟ⱑ䋼 催 ⠽ˈⳌ 䋼䞣˄2˅ƾⲤ ˖㲟ⱑ䋼⒊⎆Ё ⌧ⱘ Ⲥ⒊⎆ˈՓ㲟ⱑ䋼ⱘ⒊㾷 䰡ԢҢ㗠˄3˅ƾ ˖㲟ⱑ䋼 ⫳ 㘮 ⠽䋼㗠˄4˅买㡆 ˖㲟ⱑ䋼䎳䆌 䆩 ⫳买㡆 ˄ 䘛⌧⸱䝌 ⼎咘㡆˅˄5˅⇨ ˖㲟ⱑ䋼♐⚻ ⚻⛺㖑↯ⱘ⡍⅞⇨˄6˅㲟ⱑ䋼∈㾷⫳ ⇼ 䝌 㲟ⱑ䋼⇼ 䝌1ˊ⇼ 䝌 㒧 䗮 ˖⫬⇼䝌 ϭ⇼䝌㛑 ˖㕻 ˄-COOH ˅ˈ⇼ (-NH 2)䳔⇼ 䝌˖Ҏԧϡ㛑 ˈ 乏䗮䖛亳⠽ϱ⇼䝌ǃ㔀⇼䝌ǃ䌪⇼䝌ǃ ҂⇼䝌ǃ㣃ϭ⇼䝌ǃ㲟⇼䝌ǃ҂⇼䝌ǃ㢣⇼䝌ϝ Ҏ ⠽ϔ⊼ ⫳ѻĀ㓓㡆 āѠǃ 催1ǃЭ⛃ 㘮Э⛃------亳 㺙㹟ǃ 䰽㝰2ǃ㘮㣃Э⛃ ----- ⥽ ǃ⊵≿16n3㘮∃Э⛃----㭘㝰Ϣ⫳⌏üüⶹ䆚⚍ϧ乬ϔ⋕ ⱘ⫳ ⦃ϔ ぎ⇨䋼䞣ⱘϔǃ ぎ⇨䋼䞣˄ϔ˅ǃぎ⇨䋼䞣䆘Ӌ ˖Ѡ⇻ ⸿˄SO 2˅ǃѠ⇻ ∂˄NO 2˅ǃ 乫㉦⠽ぎ⇨∵ ˖ḍ ぎ⇨ЁѠ⇻ ⸿˄SO 2˅ǃѠ⇻ ∂˄NO 2˅ǃ 乫㉦⠽ㄝ∵ ⠽ⱘ⌧ 䅵ㅫ ⱘ DŽ佪㽕∵ ԡ䆹 ⱘぎ⇨∵˄Ѡ˅ǃ ⇨Џ㽕∵ ⠽1ǃ⏽˄1˅ ˖ķ ⧗ ➗ ⫼䞣⣯ 䞣ⱘCO 2˗ĸхⷡхӤ 㟈Ể 䴶⿃ ˈ CO 2㛑 ϟ䰡DŽ2ǃЏ㽕 ˖˄1˅ ❨ ˈՓ⍋ 䴶Ϟ ˄2˅ ⧗Ϟⱘ⮙㰿 ˄3˅⇨ ˈ⍋⋟亢 ˄4˅ ˈ≭⓴ 䴶⿃ DŽ3ǃ ⏽ ⱘ˄1˅䗤ℹ䇗 㛑⑤㒧 ˈ ⫼ 䰇㛑ǃ亢㛑ǃḌ㛑ǃ ⛁㛑ǃ╂∤㛑ㄝˈ ➗ ⱘ➗⚻˗˄2˅䖯ϔℹỡ 䗴 ǃ ǃ䕀 ぎ⇨ЁⱘCO 22ǃ䝌䲼˄1˅ ˖䝌 ⇻ ⠽˄SO 2ǃNO 2˅SO 2+H 2O H 2SO 3 2H 2SO 3+O 2==2H 2SO 4˄2˅䰆ℶ ⊩˖ķ 㛑⑤˄ 䰇㛑ǃ亢㛑ǃḌ㛑ㄝ˅ĸ ➗ ЁS ⱘ 䞣䩭 㜅⸿ CaCO 3==CaO+CO 2 CaO +SO 2==CaSO 3 2CaSO 3+O 2==2CaSO 4Ĺ ぎ⇨ЁⱘSO ĺ ⦃ 㚆ǃ 䔺 ⇨∵ ˖ ⇨ 㺙㕂 12 &21 &2ǃ&2 㛑 Ҏԧⱘ㸔㑶㲟ⱑ㒧 Փ㛑Ё↦ǃ 乫㉦⠽˖䴭⬉ǃ ぎ⇨∵ ⠽˖⬆䝯ǃ㣃 㣃ⱘ ㋏⠽ǃ⇵ㄝ˖⬆䝯 Ҏԧ ⱘ ˄㙱 㛑 ㄝ˅ǃⱑ㡆∵ ⱘ ˖ķ⸈ 㒧 ĸ䰡Ԣ 㙹 Ĺ∵ ϟ∈ĺ ⍋⋟⫳⠽ⱘ⫳17Ѡ ∈䌘⑤ⱘ ⧚ ⫼ϔǃ㞾 ∈ ∈ⱘϔ㠀ℹ偸⏋ ≝䰡䖛Ⓒ ⌏ ⺇ 䰘∴䰸 㦠⍜↦ ⷒ Ⳃⱘ˖ ∈ ⧚˖$O + 2$O˄2+˅ ˄㛊ԧ˅ + $O˄2+˅ ˄㛊ԧ˅ 䰘 䰘∈Ё 䋼 ≝䰡⌏ ⺇Ⳃⱘ˖ 䰸 DŽ ⧚˖ 䰘⎆∃Ⳃⱘ˖ 㦠⍜↦&O + 2HCl+HClO ˄ ⇻ ˅Ѡǃ ∵∈ ⧚Ё ⊩ ⧚∵∈ ⧚ 㾕 ⠽⧚ ⊩ǃ ⊩ǃ⫳⠽ ⊩1ǃ ⊩ Ё ⊩ ⇻ 䖬 ⊩≝⎔⊩˄ ˅Ё ⊩ 䗖 Ѣ ⧚䝌 ∵∈˄ ˅⇻ 䖬 ⊩ 䗖 ⧚⊍㉏ǃ∄ ⠽ǃ⸿ ⠽ㄝ ˄ぎ⇨ǃ㟁⇻ǃ∃⇨˅ 㾕⇻ ˄ ˅≝⎔⊩ 䗖 Ѣ ⧚ 䞡䞥 ⾏ ∵∈˄ 䗖䞣ⱘ⺅ ∈ⱘ3+ ˅ϝ ⫳⌏ ⱘ ㉏ ⧚⧚ ⛮⚻⊩ǃ ⫳ ⊩ǃ ⡍⅞ ⧚⧚ 䌘⑤ ⧚ ѻ⫳⊐⇨ǃ ǃ ⦏⩗ⱘ ⫼ϧ乬Ѡ㧹 㸵ϢҎԧϔ Ҏԧ 䳔ⱘ ㋴ϔǃҎԧ 乏 ㋴㾕 䞣 ㋴Ca ˖ч Mg ˖㬀㦰 ⠽ 㛣 P ˖剐㉏ F ˖㤊 Fe ˖㋿㦰 Cu ˖㨵㧘 ⸦˖㙝㉏1. ⲤϢ㸹 ⲤЁҹKIO 3 㔎⮛⢊˖ 䍋 ⬆⢊㝎㚓2ǃ䪕 䝅⊍Ϣ㸹䪕㛑˖ 㸔㑶㲟ⱑǃ㙠㑶㲟ⱑⱘ 㽕 ˈ㔎䪕⮛⢊˖䋿㸔ˈ ス㔎䪕 㟈 㚆䖳㓧 㸹⊏ ˖ķ 䪕Є ⱘ亳⠽ˈ ⠽ 㛣ǃ ⠽ 㸔ǃ㙝㉏ǃ剐㉏ǃ㲟㉏ĸ 㸹䪕 Ĺ䪕 䝅⊍3ǃ啟啓Ϣ ⇳⠭㝣㔎⇳˖䗴 啟啓ˈ 䍋㗕 偼䋼⭣⧚˖Ca 5˄PO 4˅3OH ˄s ˅5Ca 2+˄aq ˅+3PO 43-˄aq ˅+OH -˄aq ˅㊪ 䝊ⱘ⫼ϟ⫳ 䝌 ⠽䋼ˈ 㟈Ϟ䗄⒊㾷 㸵 Ca 5˄PO 4˅3OH ⒊㾷 ⿏ ˈF 㛑ϢCa 2+ ǃPO 43- 〇 ⱘCa 5˄PO 4˅3F DŽ4ǃ 䫠ⱘ亳⠽Ϣ㸹䫠㔎䫠˖ 㟈⫳䭓 㚆ϡ㡃ˈ Ԣϟˈ亳℆ϡ ˈ ⭿ 㛑䗔 ˈ DŽ㸹 ˖ 䫠ⱘ亳⠽ ˖⯺㙝ǃ⣾㙱ǃ叵㲟ǃ⠵㲢ㄝˈ咘䈚ǃ⥝㉇ǃ ㉇ǃḌḗǃ ǃ 䫠г䕗 DŽ˄1˅ 㥃㸹˖Ϲ䞡㔎䫠⮙Ҏ ⫳㽕∖ ⫼ϔѯ㸹䫠㥃⠽ˈ 㨵㧘㊪䝌䫠18Ѡ կ㛑䞣Ϣ㧹 ⱘ亳⠽ϔǃ ㊪㉏(1)㊪㉏˖㨵㧘㊪ǃ㫫㊪ǃ呺㢑㊪ǃч㊪ǃ⎔㉝ 㑸㓈㋴ˈѠ㊪ҹ ㊪ ⿔⸿䝌 Ҏԧ䝊ⱘ ⫼ϟˈ ⫳∈㾷 DŽ˄C 6H 10O 5˅n+ n H 2O n C 6H 12O 6⎔㉝ 㨵㧘㊪C 6H 12O 6˄s ˅+6O 2 ˄g ˅ 䝊 6CO 2˄g ˅+6H 2O ˄l ˅ƸH=--2803K -gPROѠǃ⊍㛖 催㑻㛖㙾䝌 ⫬⊍⫳ ⱘ䝃ЎҎ㉏ կ⛁䞣 䳔ⱘ㛖㙾䝌䝊ⱘ⫼ϟ∈㾷Ў催㑻㛖㙾䝌 ⫬⊍ 㒧 ˖ϝǃ㲟ⱑ䋼1ǃ∈㾷 㒜⫳ ⇼ 䝌 a ⇼ 䝌 䗮2ǃ㲟ⱑ䋼Ⲥ ˖㲟ⱑ䋼+ Ⲥ⒊⎆˄˄NH 4˅2SO 4 Na 2SO 4ǃĺ≝䰡 +∈ĺ⒊㾷 ˄ ⾏ 㒃㲟ⱑ䋼˅3ǃ ˖ 䝌ǃ ⺅ǃ䞡䞥 Ⲥǃ⬆䝯ǃ ⛁ㄝˈ ⫳ 㒧 ⌏ DŽ ϡ 䗚4ǃ8⾡ 䳔⇼ 䝌˖ ҎԧЁϡ㛑 ˈ 乏 亳⠽Ё㸹㒭5ǃ 㲟ⱑ䋼ⱘ亳⠽˖䈚㜤ǃ剐ǃ叵㲟ǃ⠯ǃ㓈⫳㋴1ǃ㓈⫳㋴A ˖㛖⒊ 㓈⫳㋴㔎 Ҏ Ⳇ⮛ǃ ⴐ⮙ㄝⴐ⮒DŽ 䗨 ˖㚵㧱 ㄝ㬀㦰 剐㙱⊍Ё3ǃ㓈⫳㋴C ˖ ⿄ 㸔䝌ˈ∈⒊ 㓈⫳㋴䰆ℶ 㸔⮙ˈ 䕗䕗 ⱘ䖬 ˈ 㹿⇻ ˈ䘛⛁ 㾷DŽ 䗨 ˖ 剰㬀㦰 ∈ Ё˄⣩⤈ḗǃ䕷Ủ˅䋼 㒧˖˄1˅䖬 ˄ I 2ǃFe 3+䖬 ˅˄2˅ ˄3˅䝃˄4˅䘛⛁ 㾷ϝ Ӭ 亳 䋼ⱘ⏏˄1˅ⴔ㡆 ˄ ✊㡆㋴ǃҎ 亳⫼㡆㋴˅ 㡆 ⸱䝌Ⲥ Ѯ⸱䝌Ⲥ˄Ѯ⸱䝌ϡ㛑䖛䞣亳⫼˅(2)䇗(3)⭣ ⺇䝌⇶䩴ǃ⺇䝌⇶䫉ǃ ⭣ ㄝDŽ˄ 䴶 㢣 ˅(4)䰆㜤 㣃⬆䝌ǃ㣃⬆䝌䩴ǃ Ṽ䝌ǃ Ṽ䝌䪒ǃϭ䝌䩭ㄝ 䗴⽣Ҏ㉏ ⱘ 㥃⠽ϔǃ⫳⌏Ё 㾕ⱘ㥃⠽1ǃ 䝌㥃⊏⭫㚗䝌(Џ㽕 Ⲥ䝌) ⊠䖛 DŽ㚗㟦 ϔЏ㽕 ⇶⇻ 䪱ˈϢ㚗䝌Ё DŽ2ǃ㾷⛁䬛⮯㥃䰓 üüЏ㽕 ӑЭ䝄∈ 䝌ˈ㾷⛁䬛⮯ ♢ǃ 亢 ⫼DŽ3ǃ 㦠㥃⻎㛎㉏㥃⠽ 䝌ǃ䇎⇳≭ ǃ⦃ϭ≭ DŽ4ǃ ⫳㋴⫼˖ ѯ ⫳⠽ⱘ⫳䭓ˈ ♁ ѯ ⫳⠽DŽ ⫼㥃˖䴦䳝㋴ǃ㕳⇼㢘䴦䳝㋴(䰓㥿㽓 )䰓㥿㽓 ˖ 䘧 ǃ 䏃 ǃ⍜ 䘧 㚗♢ 㡃 ⭫Ѡǃ ⫼㥃 䙉✻ 㥃䇈 к 㽕 䴲 㥃(0TC) 㒱↦ϧ乬ϝЄ ⱘ⫳⌏ϔ ⫼ ⊯ⱘ䞥ϔǃ䞥 ⱘ 䋼 ⫼1ǃAl 㔤ⱘЏ㽕˄1˅Ϣ⇻⇨ ⏽ϟ⫳ ⇻ 㝰 㜤㱔㛑˄2˅ϢCuSO4 2Al+ 3CuSO4== Al2˄SO4˅3+ 3Cu˄3˅Ϣ⺅ 2Al+2NaO H+2H2O==NaAlO2+3+ Ė˄4˅ ⏽ϟϢ⌧⸿䝌 ⌧⸱䝌䩱Ѡǃ 䞥1ǃ Н˖ ϸ⾡ ⾡䞥 ˄ 䞥 Ϣ䴲䞥 ˅❨ 㗠 ⱘ 䞥 ⌏ ⱘ⠽䋼2ǃ 䕗 ⱘ⠽⧚ 㛑㒃䪱 㒃䪕䋼 䕃ˈ ⊩ 䗴 䕑䋳㥋ⱘ㒧 䳊ӊϝǃ䞥 㜤㱔1ǃ 㜤㱔˖䞥 䎳 㾺 ⱘ⠽䋼Ⳉ ⫳ 㗠 䍋ⱘ㜤㱔2ǃ⬉ 㜤㱔˖ϡ㒃ⱘ䞥 䞥Ϣ⬉㾷䋼⒊⎆ 㾺ˈӮ ⫳ ⬉∴ ˈ↨䕗⌏⋐ⱘ䞥 ⬉ 㹿⇻ ⱘ㜤㱔3ǃFe-2e-ėFe2+ėFe(OH)2ėFe(OH)3ėFe2O g;+ 24ǃ䞥 䰆 ⱘ ⾡䞡㽕 ⊩ķ 䞥 㸼䴶㽚Ⲫ DŽ˄⚸㪱ǃ⊍ⓚㄝ˅ĸ 䞥 䚼ⱘ㒘㒛㒧 ˈ 䞥DŽ˄ϡ䫜䩶˅Ĺ⬉ ⊩ˈ 䞥 Ў ⬉∴ⱘℷ Ϣ⬉⑤䋳 Ⳍ䖲DŽѠ 㛑 ⱘ 䴲䞥ϔǃ ⫳⌏Ёⱘ⸙䝌Ⲥ1ǃ䱊⫋˖ üü咣 ˄Џ㽕 ⸙䝌Ⲥ˅2ǃ⦏⩗˖ üü㣅ⷖǃ㒃⺅˄⺇䝌䩴˅ǃ♄˄⺇䝌䩭˅üü⸙䝌䩴ǃ⸙䝌䩭ǃѠ⇻ ⸙䆒 üü❨♝ ˖ˈ⡍⾡⦏⩗˖㣅⦏⩗ǃ ⦏⩗ǃ Ҿ ǃ 㡆⦏⩗ǃ 㡆⦏⩗ǃ䩶 ⦏⩗⦏⩗ 㢅 ˖3ǃ∈⊹˖ üü咣 ǃ♄˄⺇䝌䩭˅üü⸙䝌Ѡ䩭ǃ⸙䝌ϝ䩭ǃ䪱䝌ϝ䩭19䆒 üü 䕀づ⫼㝣˄Ѡ∈ ⸿䝌䩭˅䇗㾷∈⹀䩶ㄟ⏋ ˖∈⊹ǃ≭ǃǃ∈ ↨՟⏋Ѡǃ 㑸㓈 䱊⫋1ǃ 㑸㓈ⱘ ˖ 䞣 ǃӴ䗳 ǃⳕ䞥2ǃ 䱊⫋˖㒧 䱊⫋˄ 㒇㉇䱊⫋˅㛑䱊⫋˄ ⫳⠽䱊⫋˅ϝ 催ϔǃ1ǃ㘮 ˖ 㘮 ˄ 㘮Э⛃ǃ㘮ϭ⛃ǃ㘮∃Э⛃ǃ㘮㣃Э⛃˅㓽㘮 ˄ 䜮䝯 㛖˅㘮∃Э⛃㭘㝰ϡ㛑⫼ 㺙亳 ˈ 䆹⫼㘮Э⛃ϡ㉬䫙 ⍖ ⱘ 㘮 ⇳Э⛃2ǃ ԧ˖⫼ 㘮 ⠽ⱘ⠽䋼ˈϸ⾡ҹϞ ԧ䯈ⱘ 㘮 㘮 DŽѠǃ 㑸㓈1ǃ ✊㑸㓈˖ỡ⠽㑸㓈˄ ẝ㢅ˈ Ў㑸㓈㋴ˈ Ѣ㊪㉏˅⠽㑸㓈˄ 㕞↯ǃ㱩ϱˈ Ў㲟ⱑ䋼˅2ǃ 㑸㓈˖Ҏ䗴㑸㓈˄ ✊㑸㓈ⱘ ˈ ㉬㛊㑸㓈˅㑸㓈˄ ⬅Ҏ 䗴ˈ 啭˅ˈ 啭 ⿄䫺㒊ˈ Ҏ㉏ϔ䞛⫼䴲㑸㓈 ˈ䗮䖛 ⊩ ⱘ 㑸㓈DŽϝǃ ‵㛊1ǃ ✊‵㛊˖ҹ ✊ч㛊˄Џ㽕Ң‵㛊 ˅Ў ˈ Ў㘮 Ѡ⛃ˈ 㒓 DŽ⸿ ‵㛊ˈ Ё Ѡ⸿䬂ˈՓ㒓 䕀 Ўԧ 㔥⢊ ˈ Ϩϡ DŽ2ǃ ‵㛊˖ ϕ㣃‵㛊ㄝǃ 㑸㓈ǃ ‵㛊 ⿄ϝǃ 㛑催⾡㉏ ˈ 催 ∈ ˈ ⫼Ѣ 㒌 ǃ Ϯ ∈ ǃ⊍ 㜅∈Ѩǃ1ǃ Н˖⬅ϸ⾡ ϸ⾡ҹϞ 䋼ϡ ⱘ 㒘 㗠 ⱘ ˈ䗮 ↨ Ӭ䍞ⱘ 㛑DŽ 䩶ㄟ⏋ ǃẝ⪺ǃ⦏⩗䩶2ǃ㒘 ˖ ԧ ǃ ˈ ⺇㑸㓈20。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
必修1知识点专题一化学家眼中的物质世界物质的分类及转化按物质的组成分类:有机化合物混合物物质化合物纯净物无机化合物非金属单质金属四种基本反应类型:化合反应分解反应置换反应复分解反应四种基本反应类型与氧化还原反应的关系置换反应一定是氧化还原反应复分解反应一定不是氧化还原反应化合反应分解反应可能是是氧化还原反应氧化还原反应本质:电子的转移(得失或者偏移)特征:化合价的改变(判断氧化还原反应的依据)3、氧化还原反应概念升(化合价)---失(电子)---氧(氧化反应)------还(还原剂)降(化合价)--- 得(电子)---还(氧化反应)------ 氧(还原剂)单线桥双线桥2e- 失去2e--1 0 -1 0 0 -12 KBr + Cl2====Br2+2KCl 2 KBr + Cl2====Br2+2KCl得到2e-物质的量定义:表示一定数目微粒的集合体符号n 单位摩尔阿伏加德罗常数:0.012kgC-12中所含有的碳原子数。
用N A表示。
约为6.02x1023微粒与物质的量N公式:n=NA摩尔质量:单位物质的量的物质所具有的质量用M表示单位:g/mol 数值上等于该物质的分子量质量与物质的量m公式:n=M物质的体积决定:①微粒的数目②微粒的大小③微粒间的距离微粒的数目一定固体液体主要决定②微粒的大小气体主要决定③微粒间的距离体积与物质的量V公式:n=Vm标准状况下,1mol任何气体的体积都约为22.4l阿伏加德罗定律:同温同压下,相同体积的任何气体都含有相同的分子数物质的量浓度:单位体积溶液中所含溶质B的物质的量。
符号CB 单位:mol/lnB公式:C B=V物质的量浓度的配制配制前要检查容量瓶是否漏水步骤:1. 计算 m=c×v×M 2.称量 3. 溶解 4。
转移(洗涤2---3 洗涤液转入容量瓶)5.定容 6。
摇匀7 装瓶贴签物质的分散系溶液胶体浊液分散质大小 <10-9 10-9 ~10-7 >10-7胶体的本质特征丁达儿现象:光亮的通路区分溶液与胶体电解质:在水溶液中或者熔化状态下能导电的化合物非电解质:在水溶液中和熔化状态下不能导电的化合物蔗糖酒精 SO2 CO2 NH3等强电解质:在水溶液中能全部电离的电解质强酸HCl H2SO4 HNO3强碱NaOH KOH Ba(OH)2大多数的盐弱电解质:在水溶液中能部分电离的电解质弱酸HCl H2SO4 HNO3弱碱NaOH KOH Ba(OH)2物质的分离与提纯水过滤法:适用于分离一种组分可溶,另一种不溶的固态混合物粗盐的提纯蒸发结晶:混合物中各组分物质在溶剂中溶解性的差异蒸馏法:适用于分离各组分互溶,但沸点不同的液态混合物。
如:酒精与水的分离仪器蒸馏烧瓶冷凝器分液:分离互不相容的两种液体萃取:溶质在互不相溶的溶剂里溶解度不同溴水 CCl4分层上层无色下层橙红色不用酒精萃取离子的检验焰色反应铂丝用盐酸洗涤然后在酒精灯燃烧至无色再蘸取待测液钠焰色:黄色钾的焰色:紫色(透过蓝色钴玻璃)Cl-检验:加硝酸银产生的白色沉淀不溶解于稀硝酸So42--检验: 加Ba(NO3)2产生的白色沉淀不溶解于稀硝酸NH4+检验:加入NaOH加热产生气体使湿润的红色石蕊试纸变蓝Fe3+检验:加入KSCN 出现红色溶液 Fe3++3SCN-==Fe(SCN)3Al3+检验:加入NaOH先出现白色沉淀后沉淀消失质子 Z原子核原子Z A X 中子 A核外电子质量数=质子数+中子数核电荷数==质子数==核外电子数同位素:有相同质子数不同中子数不同原子互称11H 12H 13H (核素)专题二从海水中获得化学物质1.氯气物理性质:氯气是黄绿色、有刺激性气味、能溶于水、密度比空气大、易液化的有毒气体。
2.化学性质:氯气具有强氧化性,(1)能跟金属(如Na、Fe、等):2Na + Cl2== 2Na Cl2Fe+3Cl2===2FeCL3(2)和非金属(如H2)反应:H2 + Cl2==2HCl燃烧的火焰是苍白色的,瓶口有白雾产生。
(3)和水的反应:Cl2 + H2O==HCl+HClO次氯酸的性质:(弱酸性、不稳定性、强氧化性)氯水易见光分解方程式2HClO==2HCl+O2↑,保存在新制氯水含 ___________________________,久置氯水主要成分为 _______________。
(4)与碱的反应:2NaOH+Cl2=NaCl+NaClO+H2O (用于尾气处理)漂白粉制取原理的反应方程式是。
漂白粉的成分是有效成分是。
漂白粉发生作用的是。
3.氯气的实验室制法:反应原理:MnO2+ 4HCl(浓)===MnCl2 + Cl2↑+2H2O;发生装置:圆底烧瓶、分液漏斗等;除杂:用饱和食盐水吸收HCl气体;用浓H2SO4吸收水;收集:向上排空气法收集;检验:使湿润的淀粉碘化钾试纸变蓝;尾气处理:用氢氧化钠溶液吸收尾气。
氯化氢极易溶于水,其水溶液俗称盐酸。
4、溴、碘的提取(1) 2KI + C12 ==2KCl + I2(2) 2KI + Br2 = 2KBr+I2(3) 2KBr + Cl2 ==2KCl+Br25、钠(1)钠的物理性质:银白色、有金属光泽的固体,热、电的良导体,质软、密度小、熔点低(2)钠与水反应的现象及解释:①浮:(说明钠的密度比水的密度小)②熔:(说明钠的熔点低;该反应为放热反应)③游:(说明有气体产生)④响:(说明有气体产生)⑤红:溶液中滴入酚酞显红色;(说明生成的溶液碱性)。
(3)钠与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑,离子方程式为2Na+2H2O=2Na+ +2OH-+H2↑。
(4)与氧气反应:4Na+O2==2Na2O 2Na+O2=点燃=Na2O2(5)4Na+TiCl4== 4NaCl + Ti(6)Na的用途①制取纳的重要化合物②作为中子反应堆的热交换剂③冶炼Ti.铌锆钒等金属④钠光源(7)碳酸钠与碳酸氢钠的比较名称碳酸钠碳酸氢钠化学式Na2CO3NaHCO3俗名纯碱苏打小苏打颜色、状态溶解性溶解度比碳酸钠小热稳定性———2NaHCO3== Na2CO3 +H2O+CO2↑与盐酸反应Na2CO3+2HCl==2NaCl+H2O+CO2↑比Na2CO3剧烈NaHCO3+HCl==NaCl+H2O+CO2↑与NaOH反应———NaHCO3+NaOH==Na CO3+H2O 相互转化(8)除杂:Na2CO3固体(NaHCO3)加热Na2CO3溶液(NaHCO3)NaOH鉴别碳酸钠和碳酸氢钠的方法。
加热出现气体是碳酸氢钠或着加酸先出现气体的是碳酸氢钠先没气体后出现气体的是碳酸钠6、离子反应及其发生的条件:(1)生成难溶物(2)生成挥发性的物质(3)生成难电离物质7、能正确书写常见的离子方程式。
书写步骤:1.写2.改(易溶易电离物质改成离子形式,难溶难电离的物质,气体、单质、氧化物保留化学式)3.删4.查(电荷守衡,原子个数守恒)8、离子方程式的常见错误举例:Cl2与水反应 H2O+Cl2==2H++Cl-+ClO- 碳酸钙溶于盐酸CO32-+2H+==CO2↑+H2O铁与氯化铁反应 Fe+Fe3+==2Fe2+ 硫酸与氢氧化钡反应 H++OH-==H2O9、镁的提取与应用镁的提取(1)MgCl2+Ca(OH)2 ==Mg(OH)2↓+ Ca Cl2(2)Mg(OH)2+2HCl== MgCl2+2H2O (3)电解MgCl2 === Mg +Cl2↑镁单质化学性质3Mg + N2== Mg3N2 Mg + 2HCl== MgCl2+H2 2Mg + CO2== 2MgO+C专题三从矿物到基础材料第一单元从铝土矿到铝合金1.铝是地壳中最多的金属元素,主要是以化合态存在,铝土矿主要成分是Al2O3Al2O3两性氧化物与硫酸反应Al2O3+3H2SO4==A l2(SO4)3+3H2O与氢氧化钠Al2O3+2NaOH==2NaAlO2+H2O离子方程式Al2O3+2OH-==2AlO2-+H2O2.Al(OH)3两性氢氧化物(1)Al(OH)3+3HCl==3AlCl3+3H2O Al(OH)3+NaOH==NaAlO2+2H2O离子反应: Al(OH)3+OH-==AlO2-+2H2O受热分解2Al(OH)3== Al2O3+3H2O(2)将NaOH滴加入AlCl3溶液中至过量现象:先有白色沉淀后沉淀消失。
实验室常用铝盐与足量氨水制取Al(OH)3(3)明矾:十二水合硫酸铝钾[KAl(SO4)2·12H2O] 易溶于水,溶于水后显酸性,是因为Al3++3H2O==AL(OH)3+3H+,因此明矾常用作净水剂,是因为铝离子水解生成氢氧化铝、而氢氧化铝具有吸附性吸收了水中悬浮物而下沉。
3.铝的性质(1)物理性质银白色金属固体,密度2.70g/cm3较强的韧性、延展性良好的导热导电性(2)化学性质铝是比较活泼的金属,具有较强的还原性①与氧气反应常温下与空气中的氧气反应生成坚固的氧化膜,所以铝有良好的抗腐蚀能力4Al+3O2====2Al2O3②铝与冷水不反应,与热水缓慢反应 2 Al2O3+6H2O=====2Al(OH)3↓一般情况下。
铝表面的氧化膜阻止了与水的反应③与非氧化性酸反应2Al+6HCl==2AlCl3+3H2↑ 2Al+3H2SO4==Al2(SO4)3+3H2↑常温下铝与浓硫酸浓硝酸钝化④与强碱反应2Al + 2 NaOH + 2H2O===2NaAlO2+3H2↑(唯一的一个)⑤铝热反应2Al+ Fe2O3===2 Fe + A l 2O3 焊接铁轨实验室制取用氨水转化关系HCl AlCl3NaOH Al(OH)3Al2O3 电解AlNaOH 2NaA lO2第二单元铁、铜的获取及应用铜的性质1、物理性质:有金属光泽的紫红色金属密度8.92 g/cm3质软,具有良好的导电导热性延展性2、化学性质1、与氧气反应2Cu+O2===2CuO CuO+2HCl==H2O+CuCl22、Cu与强氧化性的酸反应Cu+2H2SO4===CuSO4+SO2↑+H2O 3Cu+8HNO3==3Cu(NO3)2+2NO↑+4H2O 3Cu+2HNO3浓==Cu(NO3)2+2NO2↑+4H2O3、与盐反应Cu+2FeCl3==CuCl2+2FeCl2 Cu+2AgNO3==Cu(NO3)2+2Ag(1)铁的物理性质有金属光泽的银白色金属,质软\有良好的导电导热性延展性能被磁铁吸引(2)化学性质①与氧气反应3Fe+2O2==Fe3O4 ②与非金属反应2Fe+3Cl2==2FeCl3 Fe+S==FeS③与水反应3Fe+4H2O(g)== Fe3O4+4H2↑④与酸反应Fe+H2SO4== FeSO4+ H2↑⑤与盐反应Fe+CuSO4==FeSO4+Cu Fe+2HCl== FeCl2+ H2↑Fe2O3与酸反应Fe2O3+6HCl==2FeCl3+3H2OFe3+的检验:与KSCN反应出现血红色溶液Fe3+和Fe2+之间的相互转化Fe2+ Fe3+ Fe3+ Fe2+氧化剂还原剂2FeCl2+Cl2==2FeCl3 2FeCl3 +Fe==3FeCl2 Cu+2FeCl3==CuCl2+2FeCl2氢氧化铁制备: FeCl3 +3NaOH==Fe(OH)3+3NaCl 受热分解2Fe(OH)3== Fe2O3+3H2O钢铁的腐蚀: 钢铁与周围物质接触发生反应而被侵蚀损耗电化学腐蚀: 不纯金属接触电解质溶液产生微电流而发生氧化还原反应 1.表面覆盖保护层铁及其物质的转化关系HCl FeCl2Fe Fe Cl2 金属防腐的方法 2.改变内部结构Cl2FeCl33. 电化学保护法第三单元含硅矿物与信息材料SiO2化学性质不活泼,耐高温耐腐蚀①不与水酸(除HF)反应SiO2+4HF==SiF4↑+2H2O 玻璃不装HF酸②与碱性氧化物反应SiO2+CaO==CaSiO3③与碱反应SiO2+2NaOH==Na2SiO3+H2O 实验室装NaOH的试剂瓶用橡皮塞硅元素在自然界以SiO2及硅酸盐的形式存在,知道晶体硅是良好的半导体材料硅物理性质:晶体硅呈现灰黑色,有金属光泽硬而脆的固体良好的半导体SiO2+2C==2CO↑+Si(粗硅) Si+2Cl2==SiCl4 SiCl4+2H2===Si+4HCl专题四硫、氮和可持续发展第一单元含硫化合物的性质和应用一、二氧化硫的性质与作用1、物理性质:无色有刺激性气味的有毒气体密度比空气大2、化学性质(1)与水反应 SO2+H2O==H2SO3 可逆反应 H2SO3的不稳定性2H2SO3 +O2==2H2SO4(2)还原性 2SO2+O2 2SO3(3)漂白性:SO2 能使品红溶液褪色原理:与有色物质结合反应生成无色物质,该物质不稳定(暂时性漂白)氯水永久性漂白原理:HClO 具有强氧化性3、酸雨:PH〈5.6 正常性雨水PH值大约为6 ,水中溶解有CO2硫酸性酸雨的形成原因: SO2来源:(主要)化石燃料及其产品的燃烧。
