高中化学氧族元素方程式默写
氧族元素知识归纳
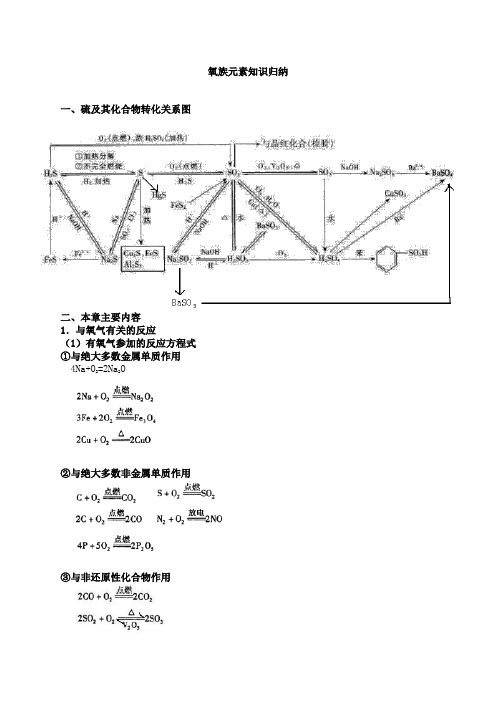
氧族元素知识归纳一、硫及其化合物转化关系图二、本章主要内容1.与氧气有关的反应(1)有氧气参加的反应方程式①与绝大多数金属单质作用4Na+O2=2Na2O②与绝大多数非金属单质作用③与非还原性化合物作用2NO+O2=2NO24FeS2+11O22Fe2O3+8SO2④与有机物作用⑤在空气中易被氧化而变质的物质a.氢硫酸或可溶性硫化物:2H2S+O2=2S↓+2H2Ob.亚硫酸及其可溶性盐2H2SO3+O2=2H2SO4,2Na2SO3+O2=2Na2SO4c.亚铁盐、氢氧化亚铁4Fe(OH)2+O2+2H2O=4Fe(OH)3d.苯酚e.氢碘酸及其可溶性碘化物4HI+O2=2H2O+2I2⑥吸氧腐蚀(如:铁生锈)负极:2Fe—4e—=2Fe2+正极:O2+4e—+2H2O=4OH—Fe2++2OH—=Fe(OH)24Fe(OH)2+O2+2H2O=4Fe(OH)32Fe(OH)3=Fe2O3+3H2O(2)生成氧气的反应方程式2.氧气和臭氧的比较3.硫元素的化学反应(1)硫单质的反应④S+Hg=HgS⑥S+2Ag=Ag2S⑦3S+6KOH=2K2S+K2SO3+3H2O⑩S+6HNO3(浓)=H2SO4+6NO2↑+2H2O(2)H2S的反应①H2S H2+S↓②③H 2S+X 2=2HX+S ↓(X 2是指卤素单质,即Cl 2,Br 2,I 2) ④H 2S+Pb(Ac)2=PbS ↓+2HAc ⑤H 2S+CuSO 4=CuS ↓+H 2SO 4⑦FeS+2HCl=FeCl 2+H 2S ↑(H 2S 的实验室制法) (3)SO 2的反应①SO 2+2H 2S=3S ↓+2H 2O②③SO 2+Na 2O=Na 2SO 3 ④SO 2+Na 2O 2=Na 2SO 4⑤SO 2+2NaOH=Na 2SO 3+H 2O ⑥Na 2SO 3+SO 2+H 2O=2NaHSO 3⑦2NaHCO 3+SO 2=Na 2SO 3+2CO 2+H 2O⑧Na 2CO 3+SO 2=Na 2SO 3+CO 2⑨⑩SO 2+X 2+2H 2O=H 2SO 4+2HXNa 2SO 3+X 2+H 2O=Na 2SO 4+2HX(X 2=Cl 2,Br 2,I 2)2FeCl 3+SO 2+2H 2O=2FeCl 2+2HCl+H 2SO 4SO 2+NH 3·H 2O=NH 4HSO 3Na 2SO 3+H 2SO 4=Na 2SO 4+SO 2↑+H 2O2Na 2SO 3+O 2=2Na 2SO 4(亚硫酸易被氧化而变质)(4)浓H 2SO 4有关反应(稀H 2SO 4具有酸的通性)4.硫化物的溶解性5.浓硫酸的氧化性和稀硫酸的氧化性的区别浓硫酸具有强氧化性,其氧化性是由硫酸分子中处于最高价态的+6价的硫产生的,加热能氧化许多金属、非金属及某些具有还原性的化合物,浓硫酸的还原产物一般为二氧化硫。
人教版必修一化学方程式默写及答案

人教版必修一化学方程式默写及答案【人教版必修一化学方程式默写及答案】本篇文章将为大家逐一列举人教版必修一化学中的方程式默写及其答案。
通过默写方程式,有助于加深对化学反应的理解与记忆,并为后续学习提供坚实的基础。
请各位同学准备好纸笔,跟随文章中的提示进行默写。
【单质与化合物】1. 氢气的制取:反应式: Zn + H2SO4 → ZnSO4 + H2↑答案: 锌 + 硫酸→ 硫酸锌 + 氢气↑2. 氧气的制取:反应式: 2KClO3 → 2KCl + 3O2↑答案: 氯酸钾→ 氯化钾 + 氧气↑3. 氮气的制取:反应式: Cu + 2HNO3 → Cu(NO3)2 + NO↑ + H2O答案: 铜 + 硝酸→ 硝酸铜 + 一氧化氮↑ + 水4. 二氧化碳的制取:反应式: CaCO3 → CaO + CO2↑答案: 碳酸钙→ 氧化钙 + 二氧化碳↑5. 硫化氢的制取:反应式: FeS + 2HCl → FeCl2 + H2S↑答案: 硫化铁 + 盐酸→ 氯化铁 + 硫化氢↑【化学方程式及配平】1. 酸碱反应方程式:反应式: H2SO4 + 2N aOH → Na2SO4 + 2H2O答案: 硫酸 + 氢氧化钠→ 硫酸钠 + 水2. 沉淀反应方程式:反应式: AgNO3 + NaCl → AgCl↓ + NaNO3答案: 硝酸银 + 氯化钠→ 氯化银↓ + 硝酸钠3. 酸化反应方程式:反应式: CO2 + H2O → H2CO3答案: 二氧化碳 + 水→ 碳酸酸4. 燃烧反应方程式:反应式: CH4 + 2O2 → CO2 + 2H2O答案: 甲烷 + 氧气→ 二氧化碳 + 水5. 加热反应方程式:反应式: 2HgO → 2Hg + O2↑答案: 氧化汞→ 汞 + 氧气↑【酸和碱】1. 简单酸的电离方程式:反应式: HCl + H2O → H3O+ + Cl-答案: 盐酸 + 水→ 氢氧离子 + 氯离子2. 碱的电离方程式:反应式: NaOH + H2O → Na+ + OH- + H2O答案: 氢氧化钠 + 水→ 钠离子 + 氢氧根离子 + 水3. 碱中金属氧化物:反应式: CaO + H2O → Ca(OH)2答案: 氧化钙 + 水→ 氢氧化钙4. 羧酸与碱的中和反应:反应式: CH3COOH + NaOH → CH3COONa + H2O答案: 乙酸 + 氢氧化钠→ 乙酸钠 + 水5. 化学方法区分酸、碱:反应式: NaCl + HNO3 → NaNO3 + HCl答案: 氯化钠 + 硝酸→ 硝酸钠 + 盐酸【氧化还原反应】1. 氧化反应方程式:反应式: 4NH3 + 5O2 → 4NO + 6H2O答案: 氨 + 氧气→ 一氧化氮 + 水2. 还原反应方程式:反应式: 2KMnO4 + 3H2C2O4 + 5H2SO4 → K2SO4 + 2MnSO4 + 10CO2 + 8H2O答案: 高锰酸钾 + 草酸 + 硫酸→ 硫酸钾 + 二氧化锰 + 二氧化碳+ 水3. 氧化还原反应判别:反应式: Zn + 2HCl → ZnCl2 + H2↑答案: 锌 + 盐酸→ 氯化锌 + 氢气↑4. 化学反应电位:反应式: Zn + CuSO4 → ZnSO4 + Cu答案: 锌 + 硫酸铜→ 硫酸锌 + 铜5. 氧化物和还原物的基本特点:反应式: 2CuO + C → 2Cu + CO2↑答案: 氧化铜 + 碳→ 铜 + 二氧化碳↑以上就是人教版必修一化学中方程式的默写及答案。
高考化学一轮复习氧族元素方程式

2019高考化学一轮复习氧族元素方程式
氧族元素是元素周期表上ⅥA族元素,这一族包含氧(O)、硫(S)、硒(Se)、碲(Te)、钋(Po)、鉝(Lv)、Uhh七种元素以下是氧族元素方程式,请考生牢记。
S + H2 == H2S (加热) Fe + S == FeS (加热)
2O3 == 3O2 3O2 == 2O3 (放电)
2H2O2 == 2H2O + O2(MnO2催化) H2S == H2 + S (高温)
2H2S + 3O2 == 2H2O +2SO2 2H2S + O2 == 2H2O +2S 均点燃
FeS + 2HCl == FeCl2 + H2S FeS + H2SO4 == FeSO4 + H2S SO2 + H2O == H2SO4 (可逆) SO3 + H2O == H2SO4
Cu + S == Cu2S(黑固) H2O2 + H2S == S+ H2O
NaSO3 + H2SO4 == NaSO4 + SO2+ H2O 实验室制二氧化硫2H2SO4浓+ Cu == CuSO4 + 2H2O + SO2 加热
2H2SO4浓+ C == CO2 + 2H2O + 2SO2 加热
2SO2 + O2 ==2SO3 (需加热、催化剂并可逆)
H2S + H2SO4(浓)== S + SO2 + 2H2O
H2S +2HNO3(浓)== 3S + 2NO + 4H2O
氧族元素方程式的内容就是这些,查字典化学网希望考生可以更好的复习化学。
2019年高考第一轮复习备考专题已经新鲜出炉了,专题包含高考各科第一轮复习要点、复习方法、复习计划、复习试题,
大家来一起看看吧~。
高一化学知识点氧族元素方程式-word文档资料

宋以后,京师所设小学馆和武学堂中的教师称谓皆称之为“教谕”。至元明清之县学一律循之不变。明朝入选翰林院的进士之师称“教习”。到清末,学堂兴起,各科教师仍沿用“教习”一称。其实“教谕”在明清时还有学官一意,即主管县一级的教育生员。而相应府和州掌管教育生员者则谓“教授”和“学正”。“教授”“学正”和“教谕”的副手一律称“训导”。于民间,特别是汉代以后,对于在“校”或“学”中传授经学者也称为“经师”。在一些特定的讲学场合,比如书院、皇室,也称教师为“院长、西席、讲席”等。S + H2 == H2S (加热) Fe + S == FeS (加热)
这个工作可让学生分组负责收集整理,登在小黑板上,每周一换。要求学生抽空抄录并且阅读成诵。其目的在于扩大学生的知识面,引导学生关注社会,热爱生活,所以内容要尽量广泛一些,可以分为人生、价值、理想、学习、成长、责任、友谊、爱心、探索、环保等多方面。如此下去,除假期外,一年便可以积累40多则材料。如果学生的脑海里有了众多的鲜活生动的材料,写起文章来还用乱翻参考书吗?2H2S + 3O2 == 2H2O +2SO2 2H2S + O2 == 2H2O +2S均点燃
唐宋或更早之前,针对“经学”“律学”“算学”和“书学”各科目,其相应传授者称为“博士”,这与当今“博士”含义已经相去甚远。而对那些特别讲授“武事”或讲解“经籍”者,又称“讲师”。“教授”和“助教”均原为学官称谓。前者始于宋,乃“宗学”“律学”“医学”“武学”等科目的讲授者;而后者则于西晋武帝时代即已设立了,主要协助国子、博士培养生徒。“助教”在古代不仅要作入流的学问,其教书育人的职责也十分明晰。唐代国子学、太学等所设之“助教”一席,也是当朝打眼的学官。至明清两代,只设国子监(国子学)一科的“助教”,其身价不谓显赫,也称得上朝廷要员。至此,无论是“博士”“讲师”,还是“教授”“助教”,其今日教师应具有的基本概念都具有了。2O3 == 3O2 3O2 == 2O3 (放电)
2016年浙江高考化学考前必记的化学方程式(默写)

2016年浙江高考化学考前必记的化学方程式一、非金属元素的反应1. 卤族元素 (1)氯气H 2+Cl 2=====点燃 Fe + Cl 2=====点燃Cl 2+H 2O=== NaOH +Cl 2=== Ca(OH)2+ Cl 2=== FeBr 2+ Cl 2=== FeBr 2+ Cl 2===(2)含氯化合物HClO=====光照Ca(ClO)2+CO 2+H 2O===MnO 2+ HCl(浓)=====△(3)卤素单质间的置换反应Cl 2+ NaBr=== Cl 2+ NaI=== Br 2+ KI=== NaBr+AgNO 3 = NaI + AgNO 3 ===2. 氧族元素(1)硫的氧化物SO 2+ NaOH=== SO 2+NaOH===SO 2+O 2 催化剂加热SO 3+H 2O===SO 2+ Fe 3++ H 2O=== SO 2+Br 2+ H 2O=== (2)浓硫酸Cu + H 2SO 4(浓)=====△ C + H 2SO 4(浓)=====△3. 氮族元素(1)氮气及氧化物N 2+O 2=====放电 Mg +N 2=====点燃NO +O 2=== NO 2 NO 2 NO 2+H 2O=== NO 2+O 2+ H 2O=== NO + O 2+ H 2O===(2)氨与铵盐NH 3+H 2O NH 3+HCl===NH 3+ O 2=====催化剂△NH 4HCO 3=====△NH 4Cl +Ca(OH)2=====△(3)硝酸HNO 3=====光照或△Cu +HNO 3(浓)===Cu + HNO 3(稀)=== C + HNO 3(浓)=====△4. 碳族元素(1)碳及其化合物C +O 2=====点燃 C +CO 2=====△ C +SiO 2=====高温 CaCO 3=====高温 CO 2+ NaOH=== , CO 2+NaOH===CO 2+Na 2SiO 3+H 2O=== CO 2+ NaAlO 2+ H 2O=== CO 2+Na 2CO 3+H 2O===(2)硅及其化合物Si +O 2=====△SiO 2+HF===SiO 2+ NaOH===SiO 2+CaO=====高温SiO 2-3+H +=== Na 2SiO 3+CO 2+H 2O===二、金属元素的反应1. 碱金属(1)碱金属单质的化学反应①与水反应Na + H 2O=== Na +CuSO 4+H 2O===②与氧气反应Na +O 2=== Na +O 2=====点燃(2)碱金属化合物的化学反应①Na 2O 2H 2O + Na 2O 2=== CO 2+ Na 2O 2=== ; SO 2+Na 2O 2=== ②Na 2CO 3Na 2CO 3+ HCl(过量)=== Na 2CO 3+HCl(不足)=== Na 2CO 3+CO 2+H 2O=== Na 2CO 3+Ca(OH)2=== ③NaHCO 3NaHCO 3=====△NaHCO 3+HCl=== NaHCO 3+NaOH=== NaOH +H 2SO 4=== CO 2+ NaOH(过量)=== CO 2(过量)+NaOH===2. 铝及其化合物(1)Al 单质Al + O 2=====点燃Al + HCl=== Al + NaOH + H 2O===Al +Fe 2O 3=====高温(2)Al 2O 3、Al(OH)3Al 2O 3+ HCl=== Al 2O 3+ NaOH=== Al 2O 3=====熔融电解Al(OH)3 +HCl=== Al(OH)3+NaOH===(3)铝盐和偏铝酸盐Al 3++ NH 3·H 2O=== AlCl 3+NaOH=== AlCl 3+ NaOH===NaAlO 2+HCl +H 2O===NaAlO 2+ HCl=== 足量盐酸)AlO -2+CO 2+ H 2O=== (足量CO 2)Al 3++ AlO -2+ H 2O=== Al 3++H 2O 3. 铁及其化合物(1)铁单质Fe + O 2=====点燃 ; Fe +S=====△ Fe + Cl 2=====点燃Fe + H 2O(g)=====高温Fe + H +===Fe + HNO 3(稀)===Fe + HNO 3(稀)===Fe +CuSO 4=== FeCl 3+Fe===(2)铁的化合物FeCl 2+ NaOH=== Fe(OH)2+O 2+ H 2O=== FeCl 2+Cl 2=== Fe 2++H 2O 2+ H +=== Fe 2++ H ++NO -3=== Fe 3++ SCN -=== FeCl 3+ H 2O(沸水)=====△氢氧化铁胶体的制备) 4. 其他金属元素(1)铜及其化合物Cu +O 2=====△ ; Cu +S=====△ ; Cu +Cl 2=====点燃Cu +FeCl 3===(2)镁及其化合物Mg +O 2=====点燃 ; Mg +N 2=====点燃 ; Mg +CO 2=====点燃三、物质制备反应1. 化学工业所涉及的制备反应(1)工业上利用FeS 2(黄铁矿)制硫酸① FeS 2+ O 2=====高温 (反应装置:沸腾炉) ② SO 2+O 2 催化剂(反应装置:接触室) ③SO 3+H 2O=== (反应装置:吸收塔;用98.3%的浓硫酸吸收)(2)工业上合成氨 N 2+ H 2 高温、高压催化剂(3)工业上制硝酸 ① NH 3+ O 2=====催化剂△② NO +O 2===③ NO 2+H 2O===(5)工业上制氯气(即电解饱和食盐水) NaCl + H 2O=====电解(6)工业上制纯碱NaCl +CO 2+NH 3+H 2O=== NaHCO 3=====△(7)工业上冶炼铝 Al 2O 3(熔融)=====电解冰晶石(8)工业上冶炼镁 MgCl 2=====电解2. 实验室制备反应(1)实验室制备H 2 Zn + HCl===(2)实验室制备O 2KMnO 4=====△ KClO 3=====催化剂△H 2O 2=====催化剂(3)实验室制备CO 2 CaCO 3+ HCl===(4)实验室制备SO 2 Na 2SO 3+H 2SO 4===(6)制备NH 3 NH 4Cl +Ca(OH)2=====△NH 3·H 2O(浓)=====CaO 或NaOH△。
氧族元素方程式

氧族元素方程式S + H2 == H2S (加热) Fe + S == FeS (加热)2O3 == 3O2 3O2 == 2O3 (放电)2H2O2 == 2H2O + O2↑(MnO2催化) H2S == H2 + S (高温)2H2S + 3O2 == 2H2O +2SO2 2H2S + O2 == 2H2O +2S 均点燃FeS + 2HCl == FeCl2 + H2S↑ FeS + H2SO4 == FeSO4 + H2S↑SO2 + H2O == H2SO4 (可逆) SO3 + H2O == H2SO4Cu + S == Cu2S(黑固)H2O2 + H2S == S↓+ H2ONaSO3 + H2SO4 == NaSO4 + SO2↑+ H2O 实验室制二氧化硫2H2SO4浓+ Cu == CuSO4 + 2H2O + SO2↑ 加热2H2SO4浓+ C == CO2↑ + 2H2O + 2SO2↑ 加热2SO2 + O2 ==2SO3 (需加热、催化剂并可逆)H2S + H2SO4(浓)== S↓ + SO2 + 2H2OH2S +2HNO3(浓)== 3S↓ + 2NO + 4H2O卤素化学方程式Cu + Cl2 == CuCl2 (点燃) H2 +Cl2 == 2HCl (点燃)Cl2 + H2O == HCl + HClO 2NaOH +Cl2== NaClO +NaCl +H2O2HClO == H2O + Cl2O(CuCl2催化)CH4 +2O2 == CO2 +2H2O (点燃)3HClO == 2HCl + HClO3(加热)3HCl + Fe(OH)3 == FeCl3 + 3H2O2Ca(OH)2 + 2Cl2 == Ca(ClO)2 + CaCl2 + 2H2O 工业制漂粉精Ca(ClO)2 + CO2 + H2O == CaCO3↓+ 2HClO 漂白粉消毒原理4HCl浓+ MnO2 == MnCl2 + 2H2O + Cl2↑ 实验室制氯气NaCl + H2SO4(浓)== NaHSO4 + HCl↑(加热) 实验室制氯化氢2KMnO4 + 6HCl(浓)== 2KCl + 2MnCl2 + 5Cl2↑+ 8H2OH2 + F2 == 2HF H2 + Br2 == 2HBr (500℃)H2 + I2 == 2HI (加热且可逆) Cl-+ Ag+== AgCl↓(Br-、I-同样) 2HCl + F2 == 2HF + Cl2(颜色变深)碱金属化学方程式2Na + O2 == Na2O2(点燃)2Na + S == Na2S2Na + 2H2O == 2NaOH + H2↑ 2Na2O2 + 2CO2 == 2Na2CO3 + O2 2N a2O2 + 2H2O == 4NaOH +O2↑ 4Li + O2 == 2Li2O (点燃)Na2CO3 +2HCl == 2NaCl +H2O +CO2↑ 2K + 2H2O == 2KOH + H2↑NaHCO3 + HCl ==NaCl + H2O + CO2↑2NaHCO3 == Na2CO3 + H2O + CO2↑(加热)2Na + CuSO4 +2H2SO4 == Cu(OH)2↓ + Na2SO4 + H2↑2NaHCO3 + Ca(OH)2 == Na2CO3 +CaCO3↓ + 2H2O碳族元素方程式SiO2 + 2NaOH == Na2SiO3 + H2O Si + O2 == SiO2↑(加热)SiO2 + 2C == Si + 2CO↑(高温) SiO2 + CaO == CaSiO3 (高温)C +2Cl2 == CCl4 (加热)C + Si == SiC (高温)2H2SO4(浓)+ C == CO2↑ + 2H2O + 2SO2↑ 加热C + 4HNO3(浓)== CO2↑ + 4NO2↑ + 2H2OSiO2 + 4HF == SiF4 + H2O 制磨砂玻璃NaCO3 + SiO2 == Na2SiO3 + CO2↑CaCO3 + SiO2 == CaSiO3 + CO2↑ 此二者需高温,为制造玻璃的步骤金刚石、晶体硅:原子晶体石墨:混合晶体8一些别称:苛性钠NaOH 纯碱、苏打Na2CO3 小苏打NaHCO3 漂白粉Ca(ClO)2 碱石灰CaO、NaOH的混合物石膏CaSO4"2H2O 生石膏2CaSO4"H2O 高岭石Al2(Si2O5)(OH)4 石英SiO2。
高考化学元素化合物主要的方程式总结

高考化学元素化合物主要的方程式总结一、卤族元素1、铁与氯气点燃:2Fe +3Cl 2 −−→−点燃2FeCl 32、铜与氯气点燃:Cu +Cl 2−−→−点燃 CuCl 23、钠与氯气点燃:2Na +Cl 2−−→−点燃 2NaCl4、氢气与氯气点燃或光照:H 2+Cl 2−−→−点燃 2HCl5、氯气与水:Cl 2+H 2O HCl +HClO6、氯气与硫化氢:H 2S +Cl 2→S ↓+2HCl7、氯化亚铁溶液与氯气:2FeCl 2 + Cl 2→2FeCl 38、氯气与二氧化硫1:1溶于水:SO 2+Cl 2+2H 2O →2HCl +H 2SO 49、SO 2使溴水褪色:SO 2+Br 2+2H 2O →2HBr +H 2SO 410、SO 2使碘水褪色:SO 2+I 2+2H 2O →2HI +H 2SO 411、氯气和NaOH 溶液:Cl 2+2NaOH →NaCl +NaClO +H 2O12、工业制漂粉精:2Cl 2+2Ca(OH)2→CaCl 2+Ca(ClO)2+2H 2O13、漂粉精漂白原理(用盐酸):Ca(ClO)2+2HCl →CaCl 2 +2HClO14、漂粉精溶液中通CO 2: Ca(ClO)2 +2CO 2+2H 2O →Ca(HCO 3)2 +2HClO15、工业制氯气: 2NaCl +2H 2O −−→−通电H 2↑+Cl 2↑+2NaOH 16、次氯酸的不稳定性: 2HClO −−→−光照2HCl+O ₂↑ 17、次氯酸的电离方程式: HClO ⇌H ++ClO - 18、实验室制氯气: 4HCl(浓)+MnO 2−→−∆MnCl 2+Cl 2↑+2H 2O 19、高锰酸钾和浓盐酸不加热制氯气: 2KMnO 4+16HCl(浓)→2KCl+2MnCl 2+5Cl 2↑+8H 2O 20、工业制盐酸: 2NaCl +2H 2O −−→−通电H 2↑+Cl 2↑+2NaOH ,H 2+Cl 2−−→−点燃2HCl 21、实验室制盐酸: H 2SO 4(浓)+2NaCl (s )−→−∆Na 2SO 4+2HCl↑ 22、铁和盐酸: Fe+2HCl →FeCl 2+ H 2↑23、氢氟酸电离方程式: HF ⇌H + + F -24、氟气和水: 2F 2+2H 2O →4HF+O 2 ↑25、锌和碘蒸气 : Zn + I 2 → ZnI 226、氟气和氢气: H +F →2HF27、溴和氢气: Br 2 + H 2 −→−∆ 2 HBr28、碘蒸气和氢气:I 2 + H 2 ⇌ 2 HI29、氯气和溴化钠:Cl 2+2NaBr →Br 2+2NaCl30、氯气和碘化钾:Cl 2+2KI →2KCl+I 231、溴和碘化钾:2KI + Br 2 →2KBr + I 232、铁和溴:2Fe +3Br 2 →2FeBr 333、碘和铁: Fe +I 2→FeI 234、氯化亚铁和溴单质:6FeCl 2+3Br 2→2FeBr 3 + 4FeCl 335、少量氯气和溴化亚铁:6FeBr 2+3Cl 2→2FeCl 3 + 4FeBr 336、足量氯气和溴化亚铁: 2FeBr 2+3Cl 2→2FeCl 3 + 2Br 237、少量氯气与碘化亚铁:FeI 2+Cl 2→FeCl 2+I 238、用硝酸银和稀硝酸检验X-(离子方程式):Cl- + Ag + → AgCl↓ 39、AgX 见光分解:AgX −−→−光照Ag+X 2 二、氧族元素 1、硫和铁加热: Fe + S −→−∆FeS 2、硫和铜加热:2Cu+S −→−∆Cu 2S 3、氯气和过量的铁加热:2Fe+3Cl 2−→−∆2FeCl 3 4、氯气和铜点燃:Cu+Cl 2−−→−点燃CuCl 2 5、铁和氧气点燃:3Fe + 2O 2 −−→−点燃 Fe 3O 4 6、铜和氧气点燃:2Cu + O 2−→−∆2CuO 7、汞和硫:HgS+O 2−→−∆Hg+SO 2 8、硫和氧气:S+O 2−−→−点燃SO 2 9、硫和氢气点燃: S+H 2−→−∆H 2S 10、硫和浓硫酸反应:S+2H 2SO 4(浓)−→−∆2H 2O+3SO 2↑ 11、用氯酸钾制氧气:2KClO 3 −−→−∆2MnO 2KCl+3O 2↑ 12、用双氧水制氧气:2H 2O 2 −−→−2MnO 2H 2O + O 2↑13、氯气和氢硫酸:H 2S+Cl 2→S+2HCl14、氢硫酸在空气中变浑浊:2H 2S+O 2 →2S↓+2H 2O15、硫化氢气体在足量的氧气中燃烧:2H 2S+3O 2→2H 2O+2SO 216、硫化氢气体在少量的氧气中燃烧: 2H 2S+O 2→2H 2O+2S ↓17、SO 2和H 2S 混合:2H 2S+SO 2→2H 20+3S ↓18、SO 2 被氧气氧化: 2SO 2 + O 2 ⇌ 3SO 319、SO 2 被水吸收:H 2O+SO 2→H 2SO 3→20、SO2 和氯气1:1通入水中:Cl 2+SO 2+2H 2O →2HCl+H 2SO 421、SO 2 使溴水褪色:SO 2 + Br 2 +2H 2O →H 2SO 4 +2HBr22、SO 2 使碘水褪色:SO 2+2H 2O+I 2→H 2SO 4+2HI.23、SO 2 通入足量澄清石灰水:SO 2+Ca(OH)2→CaSO 3↓+H 2O24、实验室制取H 2S :FeS+2HCl → FeCl 2+H 2S ↑25、实验室检验H 2S :CuSO 4+H 2S →CuS↓+H 2SO 426、实验室吸收H 2S :CuSO 4+H 2S →CuS↓+H 2SO 427、实验室制取SO 2:Na 2SO 3+H 2SO 4(浓)→Na 2SO 4+SO 2↑+H 2O28、实验室吸收SO 2;:SO 2+2NaOH →Na 2SO 3+H 2O29、 NaOH 和过量SO 2:SO 2+NaOH →NaHSO 330、铜和浓硫酸: Cu+2H 2SO 4(浓)−→−∆CuSO 4+2H 2O+SO 2↑ 31、碳和浓硫酸: C+2H 2SO 4(浓)−→−∆CO 2↑+2SO 2↑+2H 2O 32、硫化氢和浓硫酸:H 2S+3H 2SO4 →4SO 2↑+4H 2O三、氮族1、氮气和氧气:N 2+O 2→2NO2、氮气和氢气::N 2+3H 2−−−−−−→−高温、高加压、催化剂2NH 3 3、氮气和金属镁高温: N 2+3Mg −−→−高温Mg 3N 2 4、NO 和氧气:2NO+O 2→2NO 25、NO 2 和水: 3NO 2+H 2O →2HNO 3+NO6、工业制氨气:N 2+3H 2−−−−−−→−高温、高加压、催化剂2NH 3 7、实验室制氨气:2NH 4Cl+Ca(OH)2−→−∆ CaCl 2+2NH 3↑+2H 2O8、氨气和水: NH 3+H 2O ⇌NH 3.H 2O9、一水合氨的电离:NH 3.H 2O ⇌NH4+ + OH -10、一水合氨受热分解: NH 3·H 2O −→−∆NH 3↑+ H 2O 11、氨气和氯化氢气体:HCl+NH 3→NH 4Cl12、氨气和硫酸: H 2SO 4 +2 NH 3 → (NH4)2SO 413、氨气和硝酸:HNO 3 + NH 3 → NH 4NO 3 14、氨气和氧气: 4NH 3+3O2−−→−点燃2N 2+6H 2O 15、氯化铵受热分解:NH 4Cl −→−∆NH 3+HCl 16、碳酸氢铵受热分解:NH 4HCO 3−→−∆NH 3↑+CO 2↑+H 2O 17、硝酸见光分解: 4HNO 3−−→−光照 4NO 2 ↑+ O 2↑ + 2H 2O 18、铜和浓硫酸: Cu+2H 2SO 4(浓)−→−∆CuSO 4+2H 2O+SO 2↑ 19、铜和稀硝酸(离子方程式):3Cu+8H ++ 2NO 3-→3Cu 2+ +2NO↑+4H 2O 20、碳和浓硝酸加热:Cu+4HNO 3(浓)−→−∆Cu(NO 3)2+2NO 2↑+2H 2O 四、碳族 1、碳和氧气(不足)加热:2C+O 2−−→−点燃2CO 2、氧气(充足)加热:C+O 2−−→−点燃 CO 2 3、碳和浓硝酸加热:C+4HNO 3(浓)−→−∆CO 2↑+4NO 2↑+2H 2O 4、工业上用CO 还原氧化铁冶炼铁:Fe 2O 3+3CO −−→−高温. 2Fe+3CO 2 5、CO 和氧化铜: CuO + CO −→−∆ Cu + CO 2 6、工业上制取CO 2:CaCO 3−−→−高温CaO+CO 2↑ 7、实验室制取CO 2 : CaCO 3+2HCl →CaCl 2+H 2O+CO 2↑8、NaOH 溶液中通入少量CO 2(离子): CO 2+2OH -→CO 32-+H 2O 9、NaOH 溶液中通入过量CO 2(离子):CO 2+ OH -→HCO 3- 10、澄清石灰水中通入少量CO 2(离子):Ca 2++ 2OH - +CO 2→CaCO 3↓+ H 2O11、澄清石灰水中通入过量CO 2(离子): OH - + CO 2→HCO 3-12、Na 2SiO 3溶液中通入少量CO 2:Na 2SiO 3+CO 2+H 2O →Na 2CO 3+H 2SiO 3↓13、Na 2SiO 3溶液中通入过量CO 2:Na 2SiO 3+2CO 2+2H 2O →2NaHCO 3+H 2SiO 3↓14、NaAlO 2溶液中通入少量CO 2(离子):2AlO 2- + CO 2 (少)+ 3H 2O →2Al(OH)3↓ + CO 32-15、NaAlO 2溶液中通入过量CO 2(离子):AlO 2- + CO 2 (过)+ 2H 2O →Al(OH)3↓ + HCO 3-16、Mg 和CO 2高温:2Mg+CO 2−−→−高温2MgO+C 17、CO2和水反应:CO 2 + H 2O → H 2CO 318、碳酸电离方程式:H 2CO 3 ⇌H ++HCO 3-; HCO 3- -⇌(H +)+(CO 3)2-19、CaC 2制乙炔气体: CaC 2+2H 2O →Ca(OH)2+C 2H 2↑五、镁和铝 1、Mg + O 2:2Mg + O 2 −−→−点燃2MgO 2、Mg+H2O :Mg+H 2O →Mg(OH)2+H 2↑ 3、Mg+N 2:3Mg+N 2−−→−点燃Mg 3N 2 4、Mg+CO 2 : 2Mg+CO 2−−→−点燃2MgO+C 5、MgCl 2 和氨水:MgCl 2+2NH 3•H 2O →Mg (OH )2↓+2NH 4Cl 6、氢氧化镁受热分解:Mg(OH)2−−→−加热MgO + H 2O 7、铝和氧气: 4 Al + 3 O 2−−→−点燃 2 Al 2O 3 8、铝和水: 2Al+6H 2O →2Al(OH)3↓+3H 2↑ 9、铝和硫加热:2Al+3S −−→−加热Al 2S 3 10、铝和稀硫酸:2Al+3H 2SO 4→Al 2(SO 4)3+3H 2↑11、铝和氢氧化钠溶液:2 Al+2NaOH+2H 2O →2NaAlO 2+3H 2↑ 12、铝和四氧化三铁::8Al+3Fe 3O 4−−→−高温4Al 2O 3+9Fe 13、铝和二氧化锰:4Al+3MnO 2−→−∆2Al 2O 3+3Mn 14、铝和浓硫酸加热:发生钝化15、铝和硝酸汞: 2Al + 3Hg(NO 3)2 → 2Al(NO 3)3 +3Hg 16、铝和稀硝酸加热:Al +4HNO 3 −→−∆Al(NO 3)3 +NO ↑ +2H 2O 17、Al 2O 3+H 2SO 4:Al 2O 3+3H 2SO 4→Al 2(SO 4)3+3H 2O18、Al 2O 3+NaOH(离子):Al 2O 3+2OH -→2AlO 2-+H2O . 19、氢氧化铝和硫酸(离子):Al(OH)+3H + →Al 3+ + 3H O20、氢氧化铝和氢氧化钠:Al(OH)3 + NaOH →NaAlO 2 + 2H 2O21、氢氧化铝电离:Al(OH)3 ⇌Al 3+ + 3OH -22、氯化镁溶液呈酸性(离子):Mg 2++H 2O ⇌Mg(OH)2+2H +23、氯化铝呈酸性(离子):Al 3++3H 3O ⇌Al (OH )3+3H +24、氯化铝和少量氢氧化钠(离子):Al 3+ +3OH -→Al(OH)3↓25、氯化铝和足量氢氧化钠(离子):Al 3+ + 4OH - → AlO 2- + 2H 2O26、氯化铝和足量氨水(离子):Al 3++3NH 3H 2O →Al(OH)3↓+3NH 4+27、偏铝酸钠和少量盐酸(离子):AlO 2- +H 2O+H +→Al(OH)3↓28、偏铝酸钠和足量盐酸(离子):AlO 2- +4H +→Al 3+ +2H 2O29、偏铝酸钠和少量二氧化碳(离子): 2AlO 2- +CO 2+3H 2O →2Al(OH)3↓+CO 32-30、偏铝酸钠和足量二氧化碳(离子): AlO 2- +CO 2+2H 2O →Al(OH)3↓+ HCO 3-31、偏铝酸钠和氯化铝: AlCl 3 + 3NaAlO 2 + 6H 2O → 3NaCl + 4Al(OH)3 ↓32、工业炼钠: 2NaCl (熔融)−−→−通电2Na+Cl 2↑ 33、工业冶炼镁: MgCl 2(熔融)−−→−通电Mg+Cl 2↑ 34、工业冶炼铝: 2Al ₂O ₃−−→−通电4Al + 3O ₂↑ 六、铁和铜 1、铁和氧气: 3Fe+2O 2−−→−点燃Fe 3O 4 2、铜和氧气: 2Cu+O 2−→−∆2CuO 3、铁和氯气: 2Fe+3Cl 2−−→−点燃2FeCl 3 4、铜和氯气: Cu+Cl 2−−→−点燃CuCl 2 5、铁和硫加热: Fe + S −→−∆FeS 6、铜和硫: 2Cu+S −→−∆Cu 2S 7、铁和液溴: 2Fe +3Br 2 →2FeBr 38、铁和碘蒸气: I 2+Fe →FeI 29、铁和稀盐酸: Fe+2HCl →FeCl 2+H 2↑ 10、Fe+H2O(气): 3Fe+4H 2O −→−∆Fe 3O 4+4H 2 11、铁和氯化铜: Fe+CuCl 2→FeCl 2+Cu12、铁和硫酸铁(离子): Fe + 2Fe 3+ → 3Fe 2+13、铜和硫酸铁(离子): 2Fe 3+ + Cu → 2Fe 2+ + Cu 2+14、铁锈和盐酸: Fe 2O 3+6HCl →2FeCl 3+3H 2O15、铜和浓硫酸(加热): Cu+2H 2SO 4(浓)−→−∆CuSO 4+SO 2↑+2H 2O 16、铜和浓硝酸: Cu+4HNO 3(浓)→Cu(NO 3)2+2NO 2↑+2H 2O17、铜和稀硝酸(离子方程式): 3Cu + 2 NO 3 - + 8 H + →3 Cu 2+ + 2 NO(气体) + 4 H 2O18、氯化亚铁和氢氧化钠(离子方程式): Fe 2+ + 2OH -→Fe (OH )24Fe (OH )2+O 2+2H 2O →4Fe (OH )↓19、氢氧化亚铁和氧气、水反应: 4Fe(OH)₂+O ₂+2H 2O →4Fe(OH)₃↓ 20、氢氧化铁(分解): 2Fe(OH)3−→−∆Fe 2O 3+3H 2O 21、硫酸亚铁呈酸性的原因(离子): Fe 2++2H 2O ⇌Fe(OH)2+2H +22、氯化铁水解(离子方程式): Fe 3++3H 2O →Fe(OH)3↓+3H +23、三价铁离子检验(三种方法):①加KSCN,离子方程式②使淀粉碘化钾试纸离子方程式 ③加氢氧化钠或氨水,离子方程式:① Fe 3+ +3SCN - →Fe(SCN)3 ②2Fe 3+ +2I - →2Fe 2+ +I 2③ Fe 3+ + 3NH 3·H 2O → Fe(OH)3↓+ 3NH 4+24、二价铁离子检验:加氢氧化钠或氨水,离子方程式: Fe 2+ + 2NH 3.H 2O →Fe(OH)2↓+ 2NH 4+25、氯化铜和硫化氢: H 2S+CuCl 2→CuS↓+2HCl26、工业炼铁: Fe 2O 3+3CO −−→−高温2Fe+3CO 2。
氧族元素(氧硫硒碲)化学方程式总结

第16章氧族元素(氧硫硒碲)氧 1. 氧化汞受热分解:2HgO△2Hg+O2↑2. 过氧化钡受热分解:2BaO2△2BaO+O2↑3. 硝酸钠受热分解:2NaNO3△2NaNO2+O2↑4. 氯酸钾受热分解:2KClO3MnO2△2KCl+3O2↑5. 氧气与镁:2Mg+O2点燃2MgO6. 氧气与硫:S+O点燃SO27. 氧气与硫化氢:3O2+2H2S点燃2SO2+2H2O8. 氧气与氨气:3O2+4NH点燃2N2+6H2O9. 臭氧分解:2O3=3O210. 臭氧与硫化铅:4O3+PbS=PbSO4+4O211. 臭氧与碘离子:O3+2I-+H2O=I2+O2+2OH-12. 氧气与磷:5O2+4P点燃P4O1013. 氧气与磷:3O2+4P点燃P4O614. 氢氧化铜受热分解:Cu(OH)2△CuO+H2O15. 碳酸钙分解:CaCO高温CaO+CO2↑16. 硝酸铅分解:2Pb(NO3)2△2PbO+4NO2↑+O2↑17. 氧化铜分解:4CuO高温2Cu2O+O2↑18. 五氧化二钒与氢气:V2O5+2H2△V2O3+2H2O19. 过氧化钠与硫酸:Na2O2+H2SO4+10H2O=Na2SO4·10H2O+H2O220. CH3CH(OH)CH3+O2=CH3COCH3+H2O221. 电解硫酸氢根:2HSO-通电H2+S2O82-22. (NH4)2S2O8+2H2SO4=H2S2O8+2NH4HSO423. 过二硫酸与水:H2S2O8+2H2O=H2O2+2H2SO424. 氧气与氢气:H2+O22-乙基蒽醌,钯H2O225. 过氧化氢与碘离子:H2O2+2I-+2H+=I2+2H2O26. HO2-+Mn(OH)2=MnO2+OH-+H2O27. 2[Cr(OH)4]-+3HO2-=2CrO42-+OH-+5H2O28. 过氧化氢与硫化铅:4H2O2+PbS=PbSO4+4H2O29. 过氧化氢与高锰酸根:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O30. 过氧化氢与氧化银:H2O2+Ag2O=2Ag+O2↑+H2O31. 过氧化氢与氯气:H2O2+Cl2=2Cl-+O2+2H+硫 1. 电解硫酸氢铵:2NH4HSO电解(NH4)2S2O8+H2↑2. 三氧化硫与碘化钾:SO3+2KI高温K2SO3+I23. 亚硫酸与硫化氢:H2SO3+2H2S=3S↓+3H2O4. 焦硫酸钾与三氧化二铝:3K2S2O7+Al2O共融Al2(SO4)3+3K2SO45. 2NaHSO3+H2SO3+Zn=Na2S2O4+ZnSO3+2H2O6. 硫化汞与硫化钠:HgS+Na2S=Na2[HgS2]7. 硫酸亚铁受热分解:2FeSO4△Fe2O3+SO3↑+SO2↑8. 焦硫酸钾与三氧化二铁:3K2S2O7+Fe2O共融Fe2(SO4)3+3K2SO49. 硫代硫酸钠与氯化亚铜:2Na2S2O3+CuCl=Na3[Cu(S2O3)2]+NaCl10. 焦硫酸钾分解:2K2S2O8△2K2SO4+2SO3↑+O2↑11. 亚硫酰氯与水:SOCl2+H2O=2HCl+SO2↑12. 三氧化硫与盐酸:SO3+HCl=HSO3Cl13. 硫离子与亚硫酸根离子:2S2-+SO32-+6H+=3S↓+3H2O14. 硫代硫酸钠与碘:2Na2S2O3+I2=Na2S4O6+2NaI15. 硫代硫酸根与氯气:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+16. Na2S2+2HCl=NaCl+S↓+H2S17. H2S+6H++2[Ag(S2O3)2]3-=Ag2S↓+4S↓+4SO2+4H2O18. 硫化亚铁与稀盐酸:FeS+2HCl(稀)=FeCl2+H2S↑19. 硫代硫酸钠与盐酸:Na2SO3+2HCl=2NaCl+SO2↑+H2O20. 硫酸钙分解:CaSO4△CaO+SO3↑21. 浓硫酸与碘化钠:8NaI+9H2SO4(浓)=4I2+8NaHSO4+H2S+4H2O22. 浓硫酸与锌:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O23. 硫与氧气:S+O2=SO224. 4FeS2+11O2=2Fe2O3+8SO225. 二氧化硫与氧气:2SO2+O2V2O3△2SO326. 硫化钠与碳酸钠:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO227. 硫与氢氧化钙:3S+3Ca(OH)2=2CaS+CaSO3+3H2O28. 硫与硫化钙:(x-1)S+CaS=CaSx (橙色)29. 硫与亚硫酸钙:S+CaSO3=CaS2O330. 二硫化碳与氧气:CS2+3O2=CO2+2SO231. 二氧化硫与碳酸氢钠:SO2+2NaHCO3=Na2SO3+2CO2+H2O32. 三氧化硫与氢氧化钾:SO3+2KOH=K2SO4+H2O33. 电解硫酸氢钾:2KHSO电解K2S2O8+H2↑34. 过二硫酸钾与水:K2S2O8+2H2OH2SO42KHSO4+H2O235. 二氧化硫与碳酸钠:2SO2(过量)+Na2CO3+H2O=2NaHSO3+CO2↑36. 亚硫酸钠与氢氧化钠:NaHSO3+2NaOH=Na2SO4+H2O37. 亚硫酸钠与硫:Na2SO3+S=Na2S2O338. 硫代硫酸根与银离子:S2O32-+2Ag+=Ag2S2O3↓39. 硫代硫酸银与硫代硫酸根:Ag2S2O3+3S2O32-=2[Ag(S2O3)2]3-40. 亚硫酸与硫化氢:H2SO3+2H2S=3S↓+3H2O41. 亚硫酸氢钠与亚硫酸氢钠:2NaHSO3=Na2S2O5+H2O42. 3FeS2+12C+8O煅烧Fe3O4+12CO+6S43. 硫与铁:Fe+S△FeS44. 硫与汞:Hg+S△HgS45. 硫与碳:2S+C△CS246. 硫与浓硝酸:S+2HNO3(浓)=H2SO4+2NO↑47. 硫与浓硫酸:S+2H2SO4(浓) △3SO2↑+2H2O48. 硫与氢氧化钠:3S+6NaOH△2Na2S+Na2SO3+3H2O49. 硫化铁与稀硫酸:FeS+H2SO4(稀)=H2S↑+FeSO450. 硫化钠与稀硫酸:Na2S+H2SO4(稀)=H2S↑+Na2SO451. 硫化氢与碘:H2S(aq)+I2=S+2HI52. 硫化氢与铁离子:H2S(aq)+2Fe3+=2Fe2++S↓+2H+53. 硫化氢与二氧化硫:2H2S(aq)+SO2=3S+2H2O54. 硫化氢与碘:H2S(aq)+4I2+4H2O=H2SO4+8HI55. 硫化氢氧气:2H2S+3O点燃2SO2+2H2O56. 硫化氢与氧气:2H2S+O点燃2S+2H2O57. 硫化钠与水:2Na2S+2H2O=NaOH+NaOH+2NaHS58. 硫化钙与水:2CaS+2H2O=Ca(OH)2+Ca(HS)259. 硫氢化钙与水:Ca(HS)2+2H2O△Ca(OH)2+2H2S60. 三硫化二砷与硫化钠:As2S3+3Na2S(aq)=2Na2AsS361. 硫化汞与硫化钠:HgS+Na2S(aq)=Na2[HgS2]62. SnS+Na2S2(aq)=SnS2+Na2S63. SnS2+Na2S(aq)=Na2SnS364. 硫化钠与硫:Na2S(aq)+(x-1)S=Na2Sx65. As2S3+2Na2S2(aq)=As2S5+2Na2S66. M2S x+2H+=2M++(x-1)S↓+H2S67. 二氧化硫与一氧化碳:SO2+2CO铝矾土773K2CO2+S68. 二氧化硫与氯气:SO2+Cl活性炭SO2Cl269. 硫酸钙与碳:2CaSO4+C高温2CaO+2SO2↑+CO2↑70. 浓硫酸与锌:2H2SO4(浓)+Zn=ZnSO4+SO2↑+2H2O71. 三氧化硫与磷:5SO3+2P高温5SO2+P2O572. 硫与铜:S+2Cu△Cu2S73. 亚硫酸碘与水:H2SO3+I2+H2O=H2SO4+2HI74. 亚硫酸与铁离子与水:H2SO3+2Fe3++H2O=H2SO4+2Fe2++2H+75. 硫代硫酸钠与氧气:2Na2SO3+O2=2Na2SO476. 硫代硫酸钠分解:4Na2SO3(S) △3Na2SO4+Na2S77. 亚硫酸分解:3H2SO3△2H2SO4+S+H2O78. 亚硫酸氢钠分解:2NaHSO3△Na2S2O5+H2O79. 硫酸与硝酸钠:H2SO4+NaNO3(s)=NaHSO4+HNO3↑80. 硫酸与氯化钠:H2SO4+NaCl(s) △NaHSO4+HCl↑81. 浓硫酸与铜:2H2SO4(浓)+Cu=CuSO4+SO2↑+2H2O82. 浓硫酸与碘化钠:9H2SO4(浓)+8NaI=4I2+8NaHSO4+H2S↑+4H2O83. 硫酸镁分解:MgSO4△MgO+SO3↑84. 硫酸银分解:4Ag2SO4△8Ag+2SO3↑+2SO2↑+3O2↑85. 硫酸亚铁分解:2FeSO4△Fe2O3+SO3↑+SO2↑86. 过二硫酸与水反应:H2S2O7+H2O=2H2SO487. 2KHSO4△K2S2O7+H2O88. 硫代硫酸钠与盐酸:Na2S2O3+2HCl(aq)=2NaCl+S↓+SO2↑+H2O89. 硫代硫酸钠与碘:2Na2S2O3(aq)+I2(aq)=Na2S4O6+2NaI90. Na2S2O3+4Cl2+5H2O=Na2SO4+H2SO4+8HCl91. 硫代硫酸银与水:Ag2S2O3+H2O=Ag2S+H2SO492. 硫代硫酸钠与溴化银:2Na2S2O3(aq)+AgBr=Na3[Ag(S2O3)2]+NaBr93. 2Na2S2O3(aq)+CuCl=Na3[Cu(S2O3)2]+NaCl94. 2[Ag(S2O3)2]3-+4H+=Ag2S↓+SO42-+3S↓+3SO2↑+2H2O95. 过二硫酸钾与铜:K2S2O8(aq)+Cu=CuSO4+K2SO496. 5S2O82-+2Mn2++8H2OAg+2MnO4-+10SO42-+16H+97. 过二硫酸钾分解:2K2S2O8△2K2SO4+2SO3↑+O2↑98. 2K2S2O8+2H2O△4KHSO4+O2↑99. 过二硫酸铵与水:2(NH4)2S2O8+2H2O△4NH4HSO4+O2↑100. 亚硫酸与二氧化锰:2H2SO3+MnO2=H2S2O6+Mn(OH)2101. 硫代硫酸钠与过氧化氢:2Na2S2O3+4H2O2=Na2S3O6+Na2SO4+4H2O 102. H2S x+2SO乙醚H2S x+2O6 (x=3~8)103. 2NaHSO3+H2SO3+Zn=Na2S2O4+ZnSO3+2H2O104. 连二亚硫酸钠与氧气:2Na2S2O4+O2+2H2O=4NaHSO3105. 连二亚硫酸钠与氧气:Na2S2O4+O2+H2O=NaHSO3+NaHSO4 106. 连二亚硫酸与水:2H2S2O4+H2O=H2S2O3+2H2SO3107. 硫代硫酸分解:H2S2O3=S↓+H2SO3108. 加热连二亚硫酸钠:2Na2S2O4△Na2S2O3+Na2SO3+SO2↑109. 连二亚硫酸钠:2Na2S2O4+H2O△Na2S2O3+2NaHSO3110. 二氧化硫与五氯化磷:SO2+PCl5=SOCl2+POCl3111. S+Fe△FeS112. SO2Cl2+2H2O=H2SO4+2HCl↑113. 三氧化硫与盐酸:SO3+HCl=HSO3Cl114. HSO3Cl+H2O=H2SO4+HCl↑硒 1. 二氧化硒与水:SeO2+H2O=H2SeO3H2SeO3+2SO2+H2O=Se↓+2H2SO42. 硒酸与盐酸:H2SeO4+2HCl=H2SeO3+Cl2↑+H2O3. 二氧化硒与二氧化硫:SeO2+2SO2+2H2O=Se↓+2SO42-+4H+3. 硒与氢气:Se+H2673KH2Se4. 三硒化二铝与水:Al2Se3+6H2O=2Al(OH)3↓+3H2Se↑5. H2SeO3+Cl2+H2O=H2SeO4+2HCl碲 1. 三碲化二铝与氢离子:Al2Te3+6H+=2Al3++3H2Te↑2. 三氧化碲与浓氢氧化钾:TeO3+2KOH(浓)=K2TeO4+H2O3. 碲酸与盐酸:H6TeO6+2HCl(aq)=H2TeO3+Cl2↑+3H2O。
氧族元素的基本规律及常考化学反应方程式

氧族元素的基本规律及常考反应化学方程式1、氧族元素的相似性和递变性最外层均为6个电子,电子层数依次增加,次外层O 为2个,S 为8个,Se 、Te 均为18个电子。
氧通常显-2价,硫、硒、碲常见的化合物为:-2价、+4价、+6价,都能与多数金属反应。
氧化物有两种RO 2和RO 3,其对应水化物H 2RO 3、H 2RO 4均为含氧酸,具有酸的通性。
它们的氢化物除H 2O 外,其余的H 2S 、H 2Se 、H 2Te 均为气体,有恶臭、有毒,溶于水形成无氧酸,都具有还原性。
核电荷数增加,电子层数依次增多,原子半径逐渐增大,核对最外层电子的引力逐渐减弱,原子得电子能力逐渐减弱,而失电子的能力逐渐增强。
单质的状态由气态到固态,熔沸点也依次升高,非金属性逐渐减弱,金属性逐渐增强,氧化性依次减弱。
含氧酸的酸性依次减弱,气态氢化物的稳定性逐渐减弱,还原性逐渐增强。
2、硫酸根离子的检验值得注意的是,检验SO 42-时会受到许多离子的干扰。
⑴Ag +干扰:用BaCl 2 溶液或盐酸酸化时防止Ag +干扰,因为Ag ++Cl -=== AgCl ↓。
⑵CO 32-、SO 32-、PO 43-干扰:因为BaCO 3、BaSO 3、Ba 3(PO 4)2也是白色沉淀。
与BaSO 4白色沉淀所不同的是,这些沉淀溶于强酸中。
因此检验SO 42—时,必须用酸酸化。
如:BaCO 3+2H +=== H 2O +CO 2↑+Ba 2+ 但不能用硝酸酸化,同理所用钡盐也不能是Ba(NO 3)2溶液,因为在酸性条件下SO 32-、HSO 3—、SO 2等会被溶液中的NO 3—氧化为SO 42-,从而可使检验得出错误的结论。
为此,检验SO 42-离子的正确操作为:被检液加足量的盐酸酸化取清液滴加BaCl 2溶液有无白色沉淀(有无SO 42-) 由此可见,浓硫酸和稀硫酸都具有氧化性,但产生氧化性的原因是不同的,因此其氧化能力也有强与弱的差别,被还原产物也不相同。
高考化学一轮复习氧族元素方程式

高考化学一轮复习氧族元素方程式
氧族元素是元素周期表上ⅥA族元素,这一族包含氧(O)、硫(S)、硒(Se)、碲(Te)、钋(Po)、鉝(Lv)、Uhh七种元素以下是氧族元素方程式,请考生牢记。
S + H2 == H2S (加热) Fe + S == FeS (加热)
2O3 == 3O2 3O2 == 2O3 (放电)
2H2O2 == 2H2O + O2(MnO2催化) H2S == H2 + S (高温)
2H2S + 3O2 == 2H2O +2SO2 2H2S + O2 == 2H2O +2S 均点燃
FeS + 2HCl == FeCl2 + H2S FeS + H2SO4 == FeSO4 + H2S
SO2 + H2O == H2SO4 (可逆) SO3 + H2O == H2SO4
Cu + S == Cu2S(黑固) H2O2 + H2S == S+ H2O
NaSO3 + H2SO4 == NaSO4 + SO2+ H2O 实验室制二氧化硫
2H2SO4浓+ Cu == CuSO4 + 2H2O + SO2 加热
2H2SO4浓+ C == CO2 + 2H2O + 2SO2 加热
2SO2 + O2 ==2SO3 (需加热、催化剂并可逆)
H2S + H2SO4(浓)== S + SO2 + 2H2O
H2S +2HNO3(浓)== 3S + 2NO + 4H2O
氧族元素方程式的内容确实是这些,查字典化学网期望考生能够更好的复习化学。
2021年高考第一轮复习备考专题差不多新奇出炉了,专题包含高考各科第一轮复习要点、复习方法、复习打算、复习试题,大伙儿来一起看看吧~。
高中化学 卤素、氧族元素化学方程式文本素材

卤素、氧族元素化学方程式氯气1、NaCl 2Cl Na 22−−→−+点燃2、22CuCl Cl Cu −−→−+点燃 3、32FeCl 2Cl 3Fe 2−−→−+点燃 4、HCl 2Cl H 22−−−−→−+点燃(光照)5、32PCl 2Cl 3P 2−−→−+点燃6、523PCl Cl PCl →+7、HClO HCl O H Cl 22+→+8、O H 2CaCl ClO Ca Cl 2OH Ca 222222++→+)()( 9、HClO 2CaCO O H CO ClO Ca 3222+↓→++)( 10、O H NaCl NaClO Cl NaOH 222++→+ 11、↑++−→−+∆2222Cl O H 2MnCl MnO HCl 4 12、O H 8Cl 5KCl 2MnCl 2HCl 16KMnO 22224+↑++→+(浓) 13、2O HCl 2HClO 2+−−→−见光第二节 氯化氢 14、↑+→+HCl NaHSO SO H NaCl 442(浓) 16、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓) 18、33NaNO AgCl AgNO NaCl +↓→+ 20、↑++→+2223CO O H CaCl CaCO HCl 2 卤族元素29、HF 2F H 22→+30、HBr 2Br H 22→+31、HI 2I H 22→+32、22Br NaCl 2Cl NaBr 2+→+33、22I KCl 2Cl KI 2+→+34、22I KBr 2Br KI 2+→+35、33NaNO AgBr AgNO NaBr +↓→+ 36、33KNO AgI AgNO KI +↓→+37、2Br Ag 2AgBr 2+−−→−光照第三章 硫 硫酸第一节 硫 46、S Cu S Cu 22−→−+∆47、FeS S Fe −→−+∆ 48、S H H S 22−→−+∆49、2CS C S −−→−+高温 50、22SO O S −−→−+点燃 51、O H 3SO K S K 2KOH 6S 32422++−→−+∆第二节 硫的氢化物和氧化物 53、2222SO 2O H 2(O 3S H 2+−−→−+点燃足)54、↓+−−→−+S 2O H 2(O S H 2222点燃不足) 56、HBr 2S Br S H 22+↓→+57、↑+→+S H FeCl HCl 2FeS 2258、4224SO H CuS S H CuSO +↓→+59、HAc 2PbS S H PbAc 22+↓→+63、HCl 2FeCl 2S FeCl 2S H 232++↓→+65、3222SO H O H SO ⇔+68、↑++→+22424232SO O H SO Na SO H SO Na 69、O H SO Na NaOH 2SO 2322+→+70、32CaSO CaO SO →+71、O H CaSO OH Ca 2SO 2322+↓→+)(72、23232HSO Ca O H CaSO SO )(→++73、O H 2S 3S H 2SO 222+↓→+74、42222SO H HCl 2O H 2Cl SO +→++ 75、42222SO H HBr 2O H 2Br SO +→++ 76、42424422SO H 2SO K MnSO KMnO 2O H 2SO 5++→++第三节 硫酸的工业制法77、↑+−−→−+23222SO 8O Fe 2O 11FeS 4高温78、3OV 22SO 2O SO 252∆−−→←+ 79、4232SO H SO O H →+第四节 硫酸 硫酸盐80、O H 2SO 2CO SO H 2C 22242+↑+↑−→−+∆(浓) 81、O H 2SO 3SO H 2S 2242+↑−→−+∆(浓) 83、O H 2SO S SO H S H 22422++−→−+∆(浓) 84、O H 2SO CuSO SO H 2Cu 22442+↑+−→−+∆(浓) 85、HCl 2BaSO SO H BaCl 4422+↓→+ 87、NaCl 2BaCO CO Na BaCl 3322+↓→+ 88、↑++→+2223CO O H BaCl HCl 2BaCO92、42232SO Na 2O SO Na 2→+ 93、423CaSO 2O CaSO 2→+94、O H 6SO 3SO Fe SO H 6Fe 22234242+↑+−→−+∆)((浓) 95、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓) 96、O H SO Na SO Br SO H 2NaBr 22422242++↑+−→−+∆(浓) 97、O H 11C 12O H C 2SOH 11221142+−−−→−浓。
氧族元素化学方程式总结

氧族元素化学方程式总结1. 3 Fe +2 O2= Fe3O42. 2 Cu +O2 =2 CuO3. Fe +S= FeS4. 2 Cu +S =Cu2S5. Hg +S =HgS6. S +O2 =SO27. H2 +S =H2S8. SO2 +H2O =H2SO39. H2SO3 =H2O +SO2↑10. SO2 +2 H2S =3 S↓+2 H2O11. 4 FeS2 +11O2 =2 Fe2O3 +8 SO212. 2 SO2 +O2 =2 SO313. SO3 +H2O =H2SO414. C12H22O11 =12 C +11 H2O 浓H2SO4的脱水性15. NaCl(固)+H2SO4(浓)=NaHSO4 +HCl↑ 高沸点酸制低沸点酸16. Cu +2 H2SO4(浓)= CuSO4 +SO2↑ +2 H2O17. C +2 H2SO4(浓)=CO2↑ +2 SO2↑ +2 H2O18. Na2CO3 +BaCl2 =BaCO3↓+2 NaCl19. Na2SO3 +BaCl2 =BaSO3↓+2 NaCl20. Na2SO4 +BaCl2= BaSO4↓+2 NaCl21. BaCO3 +2 HCl =BaCl2 +H2O +CO2↑22. BaSO3 +2 HCl =BaCl2 +H2O +SO2↑23. 2 NaOH +SO2 =Na2SO3 +H2O 实验室SO2尾气的吸收24. Na2SO3 +SO2 +H2O =2 NaHSO325. NaOH +SO2(过量)= NaHSO326. Ca(OH)2 +SO2 =CaSO3↓+H2O27. CaSO3 +SO2 +H2O =Ca(HSO3)228. Ca(OH)2 +2 SO2(过量)=Ca(HSO3)229. 2 Fe +6 H2SO4(浓)= Fe2(SO4)3 +3 SO2↑ +6 H2O30. H2S +Pb(Ac)2 = PbS↓ +2 HAc 用湿润的醋酸铅试纸检验H2S气体31. FeS +H2SO4(稀)=FeSO4 +H2S↑ 实验室制取H2S气体32. Na2S +H2SO4(稀)=Na2SO4 +H2S↑ 强酸制弱酸33. 2 H2S +O2 2 S↓ +2 H2O = H2S在空气中变质,产生浅黄色浑浊34. 2 H2S +3 O2(充足)=2 SO2 +2 H2O H2S气体的可燃性(淡蓝色火焰)35. H2SO3 +2 H2S =3 S↓ +3 H2O36. H2S +X2 =S↓ +2 HX37. H2S +H2SO4(浓)=S↓ +SO2↑ +2 H2O 不能用浓H2SO4干燥H2S气体38. 2 NaOH +H2S =Na2S +2 H2O 实验室H2S尾气的吸收39. Na2S +H2S =2 NaHS X=Cl、Br、I40. NaOH +H2S(过量)=NaHS +H2O41. H2S +CuSO4 =CuS↓ +H2SO4 (弱酸制强酸)42. Na2SO3(固)+H2SO4(浓)= Na2SO4 +H2O +SO2↑ 实验室制取SO2气体43. 2 H2SO3 +O2 =2 H2SO4 H2SO3在空气中变质44. H2SO3 +Cl2 +H2O =H2SO4 +2 HCl45. 2 Na2SO3 +O2 =2 Na2SO4 亚硫酸盐在空气中变质46. SO2 +X2 +2 H2O =H2SO4 +2 HXX=Cl、Br、I,漂白时Cl2和SO2不能同时使用47. S +2 H2SO4(浓)=3 SO2↑ +2 H2O48. 3 S +6 NaOH(浓)=2 Na2S +Na2SO3 +3 H2O49. Na2S2O3 +2 HCl =S↓ +SO2↑ +2 NaCl +H2O50. Na2S2O3 +H2SO4 =S↓ +SO2↑ +Na2SO4 +H2O。
氧族化学方程式化学竞赛知识点高中

氧族化学方程式化学竞赛知识点高中化学竞赛知识点高中1、二氧化硫与水反应SO2+H2o=H2SO32、二氧化硫通入足量石灰水中SO2+Ca(OH)2=CaSO3+H2o3、二氧化硫与足量氢氧化钠溶液SO2+2NaOH=Na2SO3+H2o4、二氧化硫通入饱和碳酸氢钠溶液SO2+NaHCO3=NaHSO3+CO25、二氧化硫催化氧化2SO2+O2=2SO3(加热,催化剂)6、二氧化硫通入氯水Cl2+SO2+2H2o=H2SO4+2HCl7、浓硫酸与铜反应Cu+2H2SO4=CuSO4+SO2↑+2H2o8、浓硫酸与炭反应C+2H2SO4=CO2↑+2SO2↑+2H2o高中化学竞赛碳族元素方程式知识点碳族元素方程式知识点SiO2 + 2NaOH == Na2SiO3 + H2O Si + O2 == SiO2↑(加热) SiO2 + 2C == Si + 2CO↑(高温) SiO2 + CaO == CaSiO3 (高温)C +2Cl2 == CCl4 (加热) C + Si == SiC (高温)2H2SO4(浓)+ C == CO2↑ + 2H2O + 2SO2↑ 加热C + 4HNO3(浓)== CO2↑ + 4NO2↑ + 2H2OSiO2 + 4HF == SiF4 + H2O 制磨砂玻璃NaCO3 + SiO2 == Na2SiO3 + CO2↑CaCO3 + SiO2 == CaSiO3 + CO2↑ 此二者需高温,为制造玻璃的步骤金刚石、晶体硅:原子晶体石墨:混合晶体8一些别称:苛性钠NaOH 纯碱、苏打Na2CO3 小苏打NaHCO3 漂白粉Ca(ClO)2碱石灰CaO、NaOH的混合物石膏CaSO4"2H2O 生石膏2CaSO4"H2O高岭石Al2(Si2O5)(OH)4 石英SiO2高中化学竞赛有机化学知识点有机化学知识点1.羟基官能团可能发生反应类型:取代、消去、酯化、氧化、缩聚、中和反应正确,取代(醇、酚、羧酸);消去(醇);酯化(醇、羧酸);氧化(醇、酚);缩聚(醇、酚、羧酸);中和反应(羧酸、酚)2.最简式为CH2O的有机物:甲酸甲酯、麦芽糖、纤维素错误,麦芽糖和纤维素都不符合3.分子式为C5H12O2的二元醇,主链碳原子有3个的结构有2种正确4.常温下,pH=11的溶液中水电离产生的c(H+)是纯水电离产生的c(H+)的10^4倍错误,应该是10^(-4)5.甲烷与氯气在紫外线照射下的反应产物有4种错误,加上HCl一共5种6.醇类在一定条件下均能氧化生成醛,醛类在一定条件下均能氧化生成羧酸错误,醇类在一定条件下不一定能氧化生成醛,但醛类在一定条件下均能氧化生成羧酸与C3H8O在浓硫酸作用下脱水,最多可得到7种有机产物正确,6种醚一种烯8.分子组成为C5H10的烯烃,其可能结构有5种正确9.分子式为C8H14O2,且结构中含有六元碳环的酯类物质共有7种正确10.等质量甲烷、乙烯、乙炔充分燃烧时,所耗用的氧气的量由多到少正确,同质量的烃类,H的比例越大燃烧耗氧越多11.棉花和人造丝的主要成分都是纤维素正确,棉花、人造丝、人造棉、玻璃纸都是纤维素12.聚四氟乙烯的化学稳定性较好,其单体是不饱和烃,性质比较活泼错误,单体是四氟乙烯,不饱和13.酯的水解产物只可能是酸和醇;四苯甲烷的一硝基取代物有3种错误,酯的水解产物也可能是酸和酚14.甲酸脱水可得CO,CO在一定条件下与NaOH反应得HCOONa,故CO是甲酸的酸酐错误,甲酸的酸酐为:(HCO)2O15.应用取代、加成、复原、氧化等反应类型均可能在有机物分子中引入羟基正确,取代(卤代烃),加成(烯烃),复原(醛基),氧化(醛基到酸也是引入-OH)16.由天然橡胶单体(2-甲基-1,3-丁二烯)与等物质的量溴单质加成反应,有三种可能生成物正确, 1,2 1,4 3,4 三种加成方法17.苯中混有己烯,可在加入适量溴水后分液除去错误,苯和1,2-二溴乙烷可以互溶18.由2-丙醇与溴化钠、硫酸混合加热,可制得丙烯错误,会得到2-溴丙烷19.混在溴乙烷中的乙醇可加入适量氢溴酸除去正确,取代后分液20.应用干馏方法可将煤焦油中的苯等芳香族化合物别离出来错误,应当是分馏21.甘氨酸与谷氨酸、苯与萘、丙烯酸与油酸、葡萄糖与麦芽糖皆不互为同系物错误,丙烯酸与油酸为同系物22.裂化汽油、裂解气、活性炭、粗氨水、石炭酸、CCl4、焦炉气等都能使溴水褪色正确,裂化汽油、裂解气、焦炉气(加成)活性炭(吸附)、粗氨水(碱反应)、石炭酸(取代)、CCl4(萃取)23.苯酚既能与烧碱反应,也能与硝酸反应正确24.常温下,乙醇、乙二醇、丙三醇、苯酚都能以任意比例与水互溶错误,苯酚常温难溶于水25.利用硝酸发生硝化反应的性质,可制得硝基苯、硝化甘油、硝酸纤维错误,硝化甘油和硝酸纤维是用酯化反应制得的26.分子式C8H16O2的有机物X,水解生成两种不含支链的直链产物,则符合题意的X 有7种正确,酸+醇的碳数等于酯的碳数27.1,2-二氯乙烷、1,1-二氯丙烷、一氯苯在NaOH醇溶液中加热分别生成乙炔、丙炔、苯炔错误,没有苯炔这种东西28.甲醛加聚生成聚甲醛,乙二醇消去生成环氧乙醚,甲基丙烯酸甲酯缩聚生成有机玻璃错误,乙二醇取代生成环氧乙醚,甲基丙烯酸甲酯加聚生成有机玻璃29.甲醛、乙醛、甲酸、甲酸酯、甲酸盐、葡萄糖、果糖、麦芽糖、蔗糖都能发生银镜反应错误,蔗糖不是复原性糖,不发生银镜反应30.乙炔、聚乙炔、乙烯、聚乙烯、甲苯、乙醛、甲酸、乙酸都能使KMnO4(H+)(aq)褪色错误,聚乙烯、乙酸不能使酸性高锰酸钾溶液褪色高中化学竞赛氮族化学方程式知识点氮族化学方程式1、氮气和氢气N2+3H2=2NH3(高温高压催化剂)2、氮气和氧气N2+O2=2NO(放电)3、氨的催化氧化4NH3+5O2=4NO+6H2O4、氨气和氯化氢NH3+HCl=NH4Cl5、氨气和水NH3+H2O=NH3·H2O(可逆)6、氯化铁和氨水FeCl3+3NH3·H2O=Fe(OH)3(↓)+3NH4Cl(不太肯定是不是会发生氧化复原)7、氯化铝和氨水AlCl3+3NH3·H2O=Al(OH)3(↓)+3NH4Cl8、实验室制氨气Ca(OH)2 +2NH4Cl=CaCl2+2NH3(↑)+H2O9、一氧化氮和氧气2NO+O2=2NO210、氯化铵受热分解NH4Cl=NH3↑+HCl↑11、碳酸氢铵受热分解NH4HCO3===NH3↑+CO2↑+H2O12、浓硝酸长久放置4HNO3=4NO2↑+O2↑+H2o(光照或加热)13、铜和浓硝酸:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2o14、铜和稀硝酸:3Cu+8HNO3=3Cu(NO3)3+2NO↑+4H2o15、锌和浓硝酸:Zn+4HNO3=Zn(NO3)2+2NO2↑+2H2o16、碳和浓硝酸:C+4HNO3=CO2↑+4NO2↑+2H2o17、浓硝酸受热分解4HNO3=4NO2↑+O2↑+H2o(光照或加热)高中化学竞赛知识点碱金属化学方程式高中化学竞赛知识点2Na + O2 == Na2O2(点燃) 2Na + S == Na2S2Na + 2H2O == 2NaOH + H2↑ 2Na2O2 + 2CO2 == 2Na2CO3 + O22Na2O2 + 2H2O == 4NaOH +O2↑ 4Li + O2 == 2Li2O (点燃)Na2CO3 +2HCl == 2NaCl +H2O +CO2↑ 2K + 2H2O == 2KOH + H2↑NaHCO3 + HCl ==NaCl + H2O + CO2↑2NaHCO3 == Na2CO3 + H2O + CO2↑(加热)2Na + CuSO4 +2H2SO4 == Cu(OH)2↓ + Na2SO4 + H2↑2NaHCO3 + Ca(OH)2 == Na2CO3 +CaCO3↓ + 2H2O高中化学竞赛原子结构知识点化学竞赛原子结构知识点质子(Z个)原子核注意:中子(N个) 质量数(A)=质子数(Z)+中子数(N)1.原子( A X ) 原子序数=核电荷数=质子数=原子的核外电子数核外电子(Z个)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
氧族元素化学方程式总结

氧族元素化学方程式总结 1. 3 Fe + 3O 42. 2 Cu +3. Fe + S4. 2 Cu + 2S5. Hg + HgS6. S + SO 27. H 2 + H 2S8. SO 2 + H O H 2SO 39. H 2SO 3H 2O + SO 2↑10. SO 2 + 2 H 2S3 S ↓+ 2 H 2O 11.4 FeS 2 + 2O 3 + 8 SO 2 12. 2 SO 2 + O 2313. SO 3 + 14. C 12H 22O 浓H 2SO 4的脱水性 15. NaCl NaHSO 4 + HCl ↑ 高沸点酸制低沸点酸 16. Cu + + SO 2↑+ 2 H 2O17. C + 2 SO 2↑+ 2 H 2O 18. Na 2CO 3 + BaCl 2BaCO 3↓+ 2 NaCl 19. Na 2SO 3 + BaCl 2BaSO 3↓+ 2 NaCl 20. Na 2SO 4 + BaCl 2BaSO 4↓+ 2 NaCl 21. BaCO 3 + 2 HClBaCl 2 + H 2O + CO 2↑ 22. BaSO 3 + 2 HClBaCl 2 + H 2O + SO 2↑ 23. BaCO 3 + H 2SO 4BaSO 4↓+ H 2O + CO 2↑ 24. BaSO 3 + H 2SO 4BaSO 4↓+ H 2O + SO 2↑ 25. BaCO 3 + 2 HNO 3Ba(NO 3)2 + H 2O + SO 2↑26. 3 BaSO 3 + 2 HNO 3(稀)3 BaSO 4↓+ 2 NO ↑+ H 2O 27. 2 NaOH + SO 2Na 2SO 3 + H 2O 实验室SO 2尾气的吸收28. Na 2SO 3 + SO 2 + H 2O 2 NaHSO 329. NaOH + SO 2(过量)NaHSO 330. NaOH + NaHSO 3Na 2SO 3 + H 2O 31. Ca(OH)2 + SO 2CaSO 3↓+ H 2O 32. CaSO 3 + SO 2 + H 2O Ca(HSO 3)2 33. Ca(OH)2 + 2 SO 2(过量)Ca(HSO 3)234. Ca(OH)2 +Ca(HSO 3)23↓+ 2 H 2O35. 2 Fe + 6 H 2SO 4(浓)2(SO 4)3 + 3 SO 2↑+ 6 H 2O 36. H 2S + Pb(Ac)2 PbS ↓+ 2 HAc 用湿润的醋酸铅试纸检验H 2S 气体37. FeS + H 2SO 4(稀)FeSO 4 + H 2S ↑ 实验室制取H 2S 气体38. Na 2S + H 2SO 4(稀)Na 2SO 4 + H 2S ↑ 39. 2 H 2S + O 2 2 S ↓+ 2 H 2O H 2S 在空气中变质,产生浅黄色浑浊40. 2 H 2S + 3 O 2 2 SO 2 + 2 H 2O H 2S 气体的可燃性(淡蓝色火焰)41. H 2SO 3 + 2 H 2S3 S ↓+ 3 H 2O 42. H 2S + X 2S ↓+ 2 HX X =Cl 、Br 、I43. H 2S + H 2SO 4(浓)S ↓+ SO 2↑+ 2 H 2O 不能用浓H 2SO 4干燥H 2S 气体 44. 2 NaOH + H 2S Na 2S + 2 H 2O 实验室H 2S 尾气的吸收45. Na 2S + H 2S 2 NaHS46. NaOH + H 2S (过量)NaHS + H 2O47. NaOH + NaHS Na 2S + H 2O48. H 2S + CuSO 4CuS ↓+ H 2SO 4 弱酸制强酸49. Na 2SO 3(固)+ H 2SO 4(浓)Na 2SO 4 + H 2O + SO 2↑ 实验室制取SO 2气体 50. 2 H 2SO 3 + O 22 H 2SO 4 H 2SO 3在空气中变质 51. 2 Na 2SO3 + O 22 Na 2SO 4 亚硫酸盐在空气中变质 52. SO 2 + X 2 + 2 H 2O H 2SO 4 + 2 HXX =Cl 、Br 、I ,漂白时Cl 2和SO 2不能同时使用53. H 2SO 3 + Cl 2 + H 2OH 2SO 4 + 2 HCl 54. S + 2 H 2SO 4(浓)2↑+ 2 H 2O 55. 3 S + 6 NaOH (浓)2 Na 2S + Na 2SO3 + 3 H 2O 56. Na 2S 2O 3 + 2 HClS ↓+ SO 2↑+ 2 NaCl + H 2O 57. Na 2S 2O 3 + H 2SO 4 S ↓+ SO 2↑+ Na 2SO 4 + H 2O。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1. 空气中高压放电产生臭氧
2. 臭氧与硫化铅反应
3. 臭氧与碘化钾反应
4.过氧化钡与稀硫酸反应
5.过氧化氢稳定性差,分解
6.硫和铜反应
7.硫和铁反应
8.硫和汞反应
9.硫和氢气反应
10硫和氧气反应
11.硫化氢在氧气中充分燃烧
12.硫化氢在氧气中不充分燃烧
13.硫化氢与二氧化硫反应
14.硫化亚铁和盐酸反应
15.硫化亚铁和稀硫酸反应
16.二氧化硫转化为三氧化硫
17.二氧化硫和水反应
18.亚硫酸钠与稀硫酸反应
19. 硫铁矿在空气中燃烧
20.三氧化硫和水反应
21.铜和浓硫酸反应
22.碳和浓硫酸反应
23.蔗糖脱水
24 稀硫酸与氯化钡离子方程式24 碳酸钠与氯化钡离子方程式。
