一次性使用口罩批生产记录汇总
一次性医用口罩检验记录表
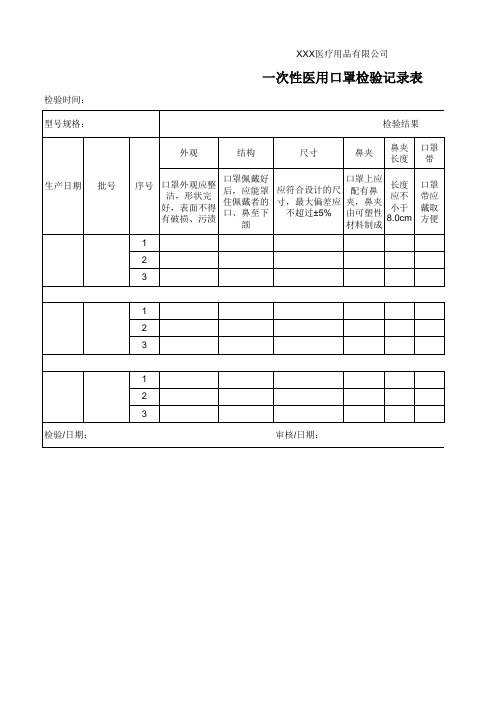
长度 应不 小于 8.0cm
口罩 带应 戴取 方便
1 2 3
1 2 3
1 2 3 检验/日期:
审核/日期:
录表
结果
文件编号: 断裂强力 单位:N
每根口罩带与口罩体 连接点的断裂强力应
不小于10N
检验结论
备注
批准/日期:
检验时间: 型号规格:
生产日期 批号
XXX医疗用品有限公司
一次性医用口罩检验记录表
检验结果
外观
结构
尺寸
ห้องสมุดไป่ตู้
鼻夹
鼻夹 口罩 长度 带
序号
口罩外观应整 洁,形状完 好,表面不得 有破损、污渍
口罩佩戴好 后,应能罩 住佩戴者的 口、鼻至下
颌
应符合设计的尺 寸,最大偏差应
不超过±5%
口罩上应 配有鼻 夹,鼻夹 由可塑性 材料制成
医疗器械公司 医用防护口罩批生产记录

3.挑选出耳带未焊接好和焊接不牢固的口罩,后执行《耳带点焊机》自动生产开始进行手动点焊。
5.将合格的口罩计数装袋,不合格的口罩置不合品筐内。
全自动一拖一外耳带平面口罩机:设备型号:设备编码:
物料平衡=(产成合格品数量a×每只重量b+不合格品c×每只重量b +
尾料量d+废料量e)÷1000÷领用总量h×100%
物料平衡范围:98%--102%
物料平衡=(a×b+c×b+d+e)÷1000÷h×100%
3、设备、模具、器具清洁、待用。
4、计量器具清洁、待用,有校验合格标志,且在校验周期内。
5、温度18~28℃,相对湿度45~65%。
6、房间压差应当保持相对负压。
7、物料符合生产指令。
8、现场有相关文件和空白记录。
1.符合规定()1.不符合规定()
2.符合规定() 2.不符合规定()
3.符合规定() 3.不符合规定()
=
操作人:复核人:
QA监控员:
递交
1、将已经制作好的医用防护口罩移入车间暂存间待验。
名称
产品批号
数量(只)
总件数
递交人
接收人
递交时间
医用防护口罩
异常情况
处理
医用防护口罩本体制作工序生产记录
工序
本体制作
尺寸
110×165mm
批号
批量
生产日期
劳动防护用品 验收记录

劳动防护用品验收记录劳动防护用品验收记录日期:2021年9月1日验收人员:张经理工作单位:某某公司劳动防护用品验收记录:我公司为了保护员工的安全和健康,在劳动防护用品的采购和使用上非常重视。
为此,我在公司要求的劳动防护用品到货后进行了验收。
以下是对劳动防护用品的验收情况的详细记录。
1. 一次性口罩我公司的办公区有30名员工,每人每天需要使用一次性口罩。
根据我公司的需求,我订购了300个一次性口罩作为初次采购量。
我对这些一次性口罩进行了验收,与供应商提供的样品进行了对比。
我发现所有的一次性口罩外观无任何破损,无异味,并且有合格的生产日期和标识。
因此,我确认这批一次性口罩符合我公司的要求,并立即将其发放给员工使用。
2. 防护手套我公司有一批从事实验室工作的员工,他们需要经常接触化学制品。
为了保护员工的手部免受化学品的伤害,我定购了500双化学防护手套。
对于这批手套的验收,我首先检查了手套的材质。
这些手套由耐化学溶剂的合成橡胶制成,符合我公司对手套防护性能的要求。
我还检查了手套的尺寸,确保不同尺寸的员工都能合适地使用。
在验收过程中,我没有发现任何质量问题或破损情况。
因此,我确认这批手套符合我公司的要求,并将其分发给需要的员工。
3. 安全帽我公司在施工现场有一些工人需要佩戴安全帽。
为了确保他们的安全,我采购了100个合格的安全帽。
这些安全帽的颜色鲜艳,外观完好,没有任何裂纹或其他物理缺陷。
我还检查了安全帽的头盔带和调节系统,确保工人戴上安全帽后可以得到良好的头部保护。
对于每个安全帽,我还检查了生产日期和标识。
我确认这批安全帽质量合格,并将其分发给需要佩戴的工人。
4. 防护眼镜在某些工作场景中,员工需要佩戴防护眼镜,以防止眼部受到异物的侵害。
为此,我采购了100副防护眼镜。
在验收过程中,我检查了每副眼镜的镜片和框架,确保没有明显的瑕疵或损坏。
我还检查了鼻托和耳托,以确保员工佩戴时的舒适度。
所有眼镜的生产日期和标识也得到了确认。
新年度个人防护用品发放使用记录

新年度个人防护用品发放使用记录为了做好新冠疫情防控工作,保护员工的身体健康和生命安全,公司特别提出了关于个人防护用品的使用要求,并进行了发放。
以下是新年度个人防护用品的发放和使用记录。
1. 发放时间公司在2021年1月初进行了一次个人防护用品的发放,同时还进行了培训,详细介绍了防护用品的使用方法和注意事项。
2. 发放范围公司为所有员工进行了发放,包括生产线上的工人、行政人员、销售人员等,每人发放了一次性口罩、防护眼镜、手套、消毒液等防护用品。
3. 发放数量公司根据员工的工作要求和实际需要,对各项防护用品的数量进行了科学合理的计算,并在发放时按照每人一定数量进行了分配,确保了员工的个人防护要求。
4. 使用记录公司为方便管理,对员工使用的个人防护用品进行了记录,主要记录以下内容:(1) 发放时间:2021年1月初。
(2) 发放范围:公司全体员工。
(3) 发放数量:一次性口罩:每人100个。
防护眼镜:每人1副。
手套:每人50双。
消毒液:每人1瓶。
(4) 使用情况:员工自发合理使用,按照使用说明书使用个人防护用品,并及时更换、消毒,保持用品的良好状态。
在日常工作中,员工必须全程佩戴一次性口罩和防护眼镜,对于需要进行较长时间的工作,员工应该每4小时更换一次口罩。
对于需要进行接触性环节的员工,必须在工作前佩戴好手套,并在接触完成后及时更换或消毒手套。
消毒液主要用于办公区域、设施设备、交通工具等公共场所的清洁消毒,员工需要通过学会正确使用方法来进行清洁消毒。
以上是新年度个人防护用品的发放和使用记录。
公司将继续关注员工个人防护用品的使用情况,合理管理和有效监督,确保员工的身体健康和生命安全,确保企业生产经营的稳定和正常运转。
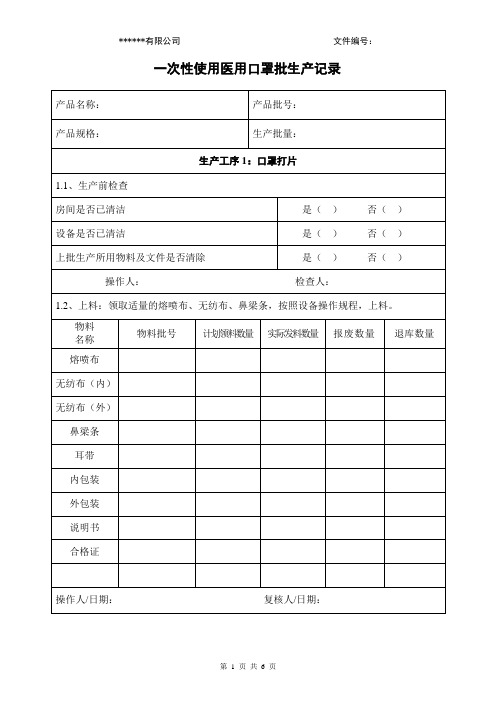
一次性使用医用口罩批生产记录(客户需要根据实际修改)
合格数量
不合格数量
报废数量
备注
操作人/日期:复核人/日期:
备注:
记录人/日期:
一次性使用医用口罩批生产记录
生产工序3:内包装
3.1、内包装:按照工艺规程的相关参数,调试设备,开始封口,封口的质量由生产人员及质量人员不定时抽检,并记录抽检的检查情况。
3.2、生产使用的设备
设备名称:设备编号:
口罩成品取样数量:取样人/日期:
口罩留样数量:留样人/日期:
口罩成品总数量:
一次性使用医用口罩批生产记录
工序名称:清场记录
清场批号
清场日期
生产结束后将“生产中”换挂“待清场”状态标志,按相关操作程序进行清场。
清场内容
清场要求
清场人自查
QA 检 查
本批产品相关记录
清 理
是( )否( )
合格( )不合格( )
设备状态标志
及时更换
是( )否( )
合格( )不合格( )
室内废弃物
清除干净
是( )否( )
合格( )不合格( )
设 备
贴签机清洁
是( )否( )
合格( )不合格( )
房 间
清洁干净
是( )否( )
合格( )不合格( )
不能使用包材
在QA的监督下销毁并做好记录
是( )否( )
合格( )不合格( )
QA检查结论
温度:湿度:
设备运行参数:
3.3、封口过程的抽检
检查时间
1
2
3
4
5
生产部抽检人/日期:质量部抽检人/日期:
3.3口罩封口数量
口罩计划生产数量
内包规格
kn95防护口罩生产管理记录

kn95防护口罩生产管理记录KN95防护口罩生产管理巡查表本表由班组长和操作人员共同填写,按照每天每班次进行填写。
1.生产前的检查在生产前,需要核实设备操作人员是否有资格,环境是否符合要求,温湿度是否合格(温度:18-26℃,湿度:≤65%),设备是否已清洁并试运转正常。
同时,还需要核对将要生产产品的品名、批号、规格、数量与物料标示卡、指令、上一工序交接单是否一致。
操作间需要处于已清洁状态,并在清场有效期内。
计量器具需要在校验有效期内,检定标签清晰。
文件需要准备好本批生产使用的记录、标识卡,外箱标签,并核实所使用文件、记录均已备案,保证生产现场无与本批生产无关的物资。
2.首件复核首件复核需要对KN95防护口罩的尺寸、生产日期、工序、批量进行检查,检查结果需要在相应的项目中打“√”或“×”。
复核内容需要填写首件复核原因相对应的序号,并在备注栏中填写异常原因。
同时,需要进行签名确认。
3.中间控制检查在正常生产后,应每30分钟进行中间控制检查,每次抽样5个样本。
检查项目包括口罩外观、结构与尺寸、鼻梁条,检查方法包括目视检测、手试弯曲、量具测量等。
检查结果需要在相应的项目中打“√”或“×”,若有异常需要在备注栏中填写原因。
操作人和复核人需要进行确认并签名。
以上是KN95防护口罩生产管理巡查表,需要按照规定进行填写,确保生产质量。
物料汇总:本批口罩的品名为【】,批号为【】。
投料总量为【】kg,折为【】片,取样量为【】片。
尺寸、生产日期、工序、批量等信息详见物料汇总表。
物料平衡与收率汇总:本批口罩的可见损耗量为【】片,产出口罩合格数量为【】万片,可再制品为【】片。
平衡率为【%】,工序收率为【%】。
结论为□合格□不合格。
清场记录:清场日期为【年月日】,清场内容包括清文件、清物料、清设备、清场地、清具、清洁具等。
操作人需按要求填写状态标示牌,并对现场进行彻底清洁和消毒。
清场后的物料、设备和废弃物需按规定处理。
最新医用口罩检验规程(附全套生产及检验用记录表格)

医用口罩检验规程1目的建立口罩检验规程,明确口罩产品的检验依据和检验方法,以确保检验员能正确理解口罩的检验标准及有效的执行检验、测试工作。
2范围适用于公司所有医用口罩的生产检验、测试。
3参考资料GB2626-2019 呼吸防护用品自吸过滤式防颗粒物呼吸器GB/T 32610-2016 日常防护型口罩技术规范GB19083-2010 医用防护口罩技术要求YY0469-2011 医用外科口罩YY/T0969-2013 一次性使用医用口罩4职责品质部:负责制订/修订/执行本文件。
5检验规程5.1外观检查5.1.1 外观缺陷等级判定标准5.1.1.1致命缺陷(CRI)口罩所使用的材料中不得有非设计要求的金属物质镶入、锐利凸起或对使用者构成危险的其它情况。
5.1.1.2主要缺陷(Maj)a)口罩的形状结构应完整并符合设计要求不得有缺少部件现象,不得有破洞(穿孔)、拉裂、滑脱现象,不得有非材质气味,整个口罩主体不允许有昆虫躯体和毛发。
b)口罩超声线均匀整齐,纹路应符合图纸要求,不允许出现穿孔。
c)口罩带(耳带)不允许有缺口、断带、纱线滑脱现象。
口罩带正反面使用正确,焊接位置准确,与口罩连接的端点应在超声压痕范围内。
d)鼻夹规格应符合图面要求,植入的硬材质鼻夹位置应正确,无锐利凸起。
软材质鼻夹粘贴位置应在规定的范围,用手翻动应不出现脱落现象。
e)呼气阀超声位置符合图面要求,超声牢固,偏位应控制在5mm以内。
带印刷LOGO的呼气阀超声后LOGO的方向应符合图面要求,倾斜的角度应在15度以内。
f)调节扣(耳扣)应规格正确、结构完整并按照图纸要求安装于口罩带上,不得漏装.g)移印、丝印不得有漏印、模糊不清/断线、错位现象;印刷位置、颜色与样板一致。
5.1.1.3次要缺陷(Min)a)口罩主体表面应整洁。
尘点(含异色点)面积应在0.3mm2以内,同一个口罩上允许有3处缺陷,但距离需大于50mm。
b)口罩裁切边缘应整齐,左右对称,超声线与边缘的距离应控制在2.5mm~3.5mm之间,中缝熔合线与边缘的距离应控制在0.5mm~2 mm之间(或按照客户要求)。
劳动防护用品进场验收记录

劳动防护用品进场验收记录劳动防护用品是保障员工工作安全和身体健康的重要设备。
为了确保进场的劳动防护用品符合国家和行业的标准,并且能够满足企业实际需求,对劳动防护用品进行进场验收是必不可少的环节。
下面是一份劳动防护用品进场验收记录,供参考。
劳动防护用品进场验收记录验收日期:2022年5月1日经办人:XXX验收人:XXX序号产品名称规格型号单位数量生产厂家批号备注1 一次性口罩 175mm*95mm 个 20000 XXX公司20220501 无2 防护手套 L号双 500 XXX公司 20220501 无3 防护眼镜无个 100 XXX公司 20220501 无4 无尘衣 L号件 100 XXX公司 20220501 无5 防护鞋 42号双 50 XXX公司 20220501 无以上是我们在2022年5月1日的劳动防护用品进场验收记录。
根据国家标准和企业实际需求,我们从XXX公司采购了各类劳动防护用品。
验收情况:1. 一次性口罩:规格为175mm*95mm,共进场20000个,生产厂家为XXX公司,批号为20220501。
口罩无外观破损、沾污等现象,符合正常要求。
2. 防护手套:规格为L号,共进场500双,生产厂家为XXX 公司,批号为20220501。
手套无明显划痕、破损等现象,符合正常要求。
3. 防护眼镜:规格为无,共进场100个,生产厂家为XXX公司,批号为20220501。
眼镜无明显划痕、毛刺等现象,符合正常要求。
4. 无尘衣:规格为L号,共进场100件,生产厂家为XXX公司,批号为20220501。
无尘衣无明显破损、开线等现象,符合正常要求。
5. 防护鞋:规格为42号,共进场50双,生产厂家为XXX公司,批号为20220501。
鞋子无明显破损、剥落等现象,符合正常要求。
经验人签字:_______________验收人签字:_______________此次劳动防护用品进场验收记录共涉及五类劳动防护用品,经过验收发现符合国家和企业的相关标准。
最新医用口罩检验规程(附全套生产及检验用记录表格)

医用口罩检验规程1目的建立口罩检验规程,明确口罩产品的检验依据和检验方法,以确保检验员能正确理解口罩的检验标准及有效的执行检验、测试工作。
2范围适用于公司所有医用口罩的生产检验、测试。
3参考资料GB2626-2019 呼吸防护用品自吸过滤式防颗粒物呼吸器GB/T 32610-2016 日常防护型口罩技术规范GB19083-2010 医用防护口罩技术要求YY0469-2011 医用外科口罩YY/T0969-2013 一次性使用医用口罩4职责品质部:负责制订/修订/执行本文件。
5检验规程5.1外观检查5.1.1 外观缺陷等级判定标准5.1.1.1致命缺陷(CRI)口罩所使用的材料中不得有非设计要求的金属物质镶入、锐利凸起或对使用者构成危险的其它情况。
5.1.1.2主要缺陷(Maj)a)口罩的形状结构应完整并符合设计要求不得有缺少部件现象,不得有破洞(穿孔)、拉裂、滑脱现象,不得有非材质气味,整个口罩主体不允许有昆虫躯体和毛发。
b)口罩超声线均匀整齐,纹路应符合图纸要求,不允许出现穿孔。
c)口罩带(耳带)不允许有缺口、断带、纱线滑脱现象。
口罩带正反面使用正确,焊接位置准确,与口罩连接的端点应在超声压痕范围内。
d)鼻夹规格应符合图面要求,植入的硬材质鼻夹位置应正确,无锐利凸起。
软材质鼻夹粘贴位置应在规定的范围,用手翻动应不出现脱落现象。
e)呼气阀超声位置符合图面要求,超声牢固,偏位应控制在5mm以内。
带印刷LOGO的呼气阀超声后LOGO的方向应符合图面要求,倾斜的角度应在15度以内。
f)调节扣(耳扣)应规格正确、结构完整并按照图纸要求安装于口罩带上,不得漏装.g)移印、丝印不得有漏印、模糊不清/断线、错位现象;印刷位置、颜色与样板一致。
5.1.1.3次要缺陷(Min)a)口罩主体表面应整洁。
尘点(含异色点)面积应在0.3mm2以内,同一个口罩上允许有3处缺陷,但距离需大于50mm。
b)口罩裁切边缘应整齐,左右对称,超声线与边缘的距离应控制在2.5mm~3.5mm之间,中缝熔合线与边缘的距离应控制在0.5mm~2 mm之间(或按照客户要求)。
次性使用口罩批生产记录汇总

汕头市泰恩康医用器材厂有限公司批生产指令单编码:kh-sc-001汕头市泰恩康医用器材厂有限公司灭菌指令单编码:SC-03汕头市泰恩康医用器材厂有限公司领 /退料单汕头市泰恩康医用器材厂有限公司一次性使用口罩称量、备料工序生产记录编码:SC-32称量人:复核人:汕头市泰恩康医用器材厂有限公司清场工作记录汕头市泰恩康医用器材厂有限公司一次性使用口罩本体制作工序生产记录编码:SC-33汕头市泰恩康医用器材厂有限公司中间产品交接单汕头市泰恩康医用器材厂有限公司中间产品交接单汕头市泰恩康医用器材厂有限公司清场工作记录汕头市泰恩康医用器材厂有限公司一次性使用口罩耳带点焊工序生产记录编码:SC-36操作人:复核人:汕头市泰恩康医用器材厂有限公司中间产品交接单汕头市泰恩康医用器材厂有限公司中间产品交接单中间产品交接单汕头市泰恩康医用器材厂有限公司中间产品交接单中间产品交接单汕头市泰恩康医用器材厂有限公司中间产品交接单中间产品交接单汕头市泰恩康医用器材厂有限公司中间产品交接单清场工作记录一次性使用口罩包装工序批包装记录清场工作记录汕头市泰恩康医用器材厂有限公司环氧乙烷灭菌记录编码:SC-39时间:2013年月日灭菌批号:二、灭菌室初始状态:温度:℃压力: MPa三、用气量:环氧乙烷: Kg四、过程:详见环氧乙烷灭菌参数记录。
五、总结:开始时间:日时分结束时间:日时分灭菌时间:共时分效果初步鉴定:灭菌标志由红变操作人:环氧乙烷灭菌记录编码:SC-39时间2013年月日灭菌批号:二、灭菌室初始状态:温度:℃压力: MPa三、用气量:环氧乙烷: Kg四、过程:详见环氧乙烷灭菌参数记录。
五、总结:开始时间:日时分结束时间:日时分灭菌时间:共时分效果初步鉴定:灭菌标志由红变操作人:环氧乙烷灭菌记录编码:SC-39时间: 2013年月日灭菌批号:二、灭菌室初始状态:温度:℃压力: MPa三、用气量:环氧乙烷: Kg四、过程:详见环氧乙烷灭菌参数记录。
口罩检验原始记录

江西**医疗器械有限公司检验报告样品编号:****批准:****审核:***** 主检:****签发日期:2012年4月10日盖章:江西**医疗器械有限公司检验记录检品编号:*******检品名称:一次性使用口罩规格:灭菌批号:******** 批号:检验依据:YZB/赣***** 灭菌日期:*****检验时间: 年月日至年月日4.1口罩的规格尺寸。
年月日温度:____℃湿度:____%仪器直尺编号口罩由非织造布组成。
单位:㎝(规定:由非织造布和携带组成,长17.5 ×宽17 ± 10% 松紧长≥10cm、带子≥20cm)结论:符合规定4.2 外观整洁、形状完好、表面无污渍、无破损。
(规定:口罩外观应整洁、形状完好,表面不得有破损、污渍)结论:符合规定缝制口罩缝制平直、无明显波浪和倾斜状、不脱线、不跳针。
;缝制线针密度是 9 针/3cm,缝纫边距 0.5cm;机压成型口罩牢固(规定:口罩缝制应平直,无明显波浪和倾斜状,不应脱线、跳针。
缝制线密度不少于8针/3cm,缝纫边距应不小于0.2cm。
机压成型口罩热合应牢固)结论:符合规定4.3 鼻夹口罩上必须配有鼻夹,鼻夹由可弯折的可塑性材料制成,以通用或专用量具测量,鼻夹长度应 10 cm 。
规定:口罩上必须配有鼻夹,鼻夹由可弯折的可塑性材料制成,鼻夹长度应不小于8.0cm 。
结论:符合规定4.4携带以拉力计进行测量,记录口罩带连接点处断裂时所需的强力 15 N规定:每根携带与口罩体连接点处的断裂强力应不小于10N结论:符合规定4.7无菌:详见第附页结论:符合规定4.8环氧乙烷残留量:详见附页结论:符合规定7.1.2口罩用塑料袋密封包装,包装袋上有下列标志:a) 生产单位名称、地址、商标、联系电话、邮编;b) 产品名称、规格、数量c) 生产企业许可证号、产品注册证号、注册产品标准号;d) 生产日期或批号;e) 使用说明;f) 灭菌有效期;g) “无菌”的字样或标记应符合YY0466的规定;h) “切勿再次使用”的字样或标记应符合YY0466的规定。
医疗物资生产情况汇报

医疗物资生产情况汇报尊敬的领导:根据贵公司要求,我对医疗物资的生产情况进行了汇报。
截止到**日期**,我公司的医疗物资生产情况如下:一、口罩生产情况:本期我公司总计生产了**X**万只口罩,比上期增长了**X%**。
其中包括**X**万只医用口罩和**X**万只普通口罩。
目前,我公司主要采用自动化流水线生产方式,每天能够生产约**X**万只。
同时,为了保证质量,我公司采取了严格的生产控制措施。
我们从原材料的选择、检测到成品的包装,都确保符合相关的标准和要求。
此外,我们还与相关监管部门合作,建立了质量抽检制度,每批次产品都进行严格检测,并对不合格品质进行追踪溯源。
二、防护服生产情况:本期我公司共生产了**X**套防护服,比上期增长了**X%**。
我们的防护服采用高质量的防水材料制作,能够有效抵抗病毒和液体的渗透,并且具备透气性能,以提供最佳的穿戴舒适度。
在生产过程中,我公司严格遵守相关的质量控制要求,确保每件防护服都符合国家标准,并通过了必要的质量检测。
我们采取了分段生产的方式,以确保生产效率和质量。
此外,我们还与医院等机构建立了合作关系,保证防护服的供应及时、稳定。
三、一次性手套生产情况:本期我公司共生产了**X**万只一次性手套,比上期增长了**X%**。
作为医疗物资中的重要组成部分,一次性手套对于医护人员保护至关重要。
因此,我们高度重视手套的生产质量,确保每只手套都符合相关标准。
为了提高生产效率和质量,我公司采取自动化生产线,能够每天生产大量的一次性手套。
同时,我们还加大了原材料的采购量,以应对市场需求。
目前,我公司的一次性手套供应稳定,能够满足市场的需求。
综上所述,我公司在医疗物资生产方面做到了货源充足、质量可靠。
我们将继续加强与相关监管部门和合作伙伴的合作,确保医疗物资的生产和供应。
如果对本次汇报有任何疑问或建议,请随时与我联系。
谢谢!此致敬礼!**你的名字**。
一次性医用外科口罩试验数据原始记录

SOP-QC-055
SOP-QC-056
SOP-QC-057
将2ml合成血以 120mmHg压力喷向 口罩外表面沾
测试要求 口罩样品外侧面 水等级应不低
后,口罩内侧面不 于3级。
应出现渗透。
口罩两侧面气体交换的压力 差ΔP≤ 49 Pa/cm2。
口罩移离火焰后继续 燃烧应不超过5秒。
口罩带与口罩体连接 点的断裂强力应不小 于10N。
吸气阻力 呼气阻力 ΔP
检测数据:
1
2
3
4பைடு நூலகம்
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
单项结论 备注: 1)材料单位克重参考进货检验记录,成品不需要再次测量。 2)血液穿透测试,不渗透打“”有血液渗透打“” 。
检验人:
日期:
复核 人:
日期:
生效日期:2016年05月18日
KANGGU
口罩物理性能测试原始记录
嘉兴康谷医用材料有限公司 QMR-049-00
产品名称
产品批号
产品代码/型号
批数量
检验依据
《一次性医用外科口罩》
抽样方法
S-2/AQL:2.5%
S-2/AQL:4.0%
抽样方案
测试项目 合成血液穿透 表面抗湿性
气流交换
阻燃性能
口罩带拉力
测试依据 SOP-QC-054 SOP-QC-053
一次性使用口罩批生产记录汇总

批生产指令单编码:kh-sc-001灭菌指令单编码:SC-03汕头市泰恩康医用器材厂有限公司领/退料单汕头市泰恩康医用器材厂有限公司一次性使用口罩称量、备料工序生产记录编码:SC-32汕头市泰恩康医用器材厂有限公司清场工作记录汕头市泰恩康医用器材厂有限公司一次性使用口罩本体制作工序生产记录编码:SC-33汕头市泰恩康医用器材厂有限公司中间产品交接单汕头市泰恩康医用器材厂有限公司清场工作记录汕头市泰恩康医用器材厂有限公司一次性使用口罩耳带点焊工序生产记录编码:SC-36汕头市泰恩康医用器材厂有限公司中间产品交接单中间产品交接单中间产品交接单中间产品交接单清场工作记录一次性使用口罩包装工序批包装记录清场工作记录汕头市泰恩康医用器材厂有限公司环氧乙烷灭菌记录编码:SC-39时间:2013年月日灭菌批号:二、灭菌室初始状态:温度:℃压力: MPa三、用气量:环氧乙烷: Kg四、过程:详见环氧乙烷灭菌参数记录。
五、总结:开始时间:日时分结束时间:日时分灭菌时间:共时分效果初步鉴定:灭菌标志由红变操作人:环氧乙烷灭菌记录编码:SC-39时间2013年月日灭菌批号:二、灭菌室初始状态:温度:℃压力: MPa三、用气量:环氧乙烷: Kg四、过程:详见环氧乙烷灭菌参数记录。
五、总结:开始时间:日时分结束时间:日时分灭菌时间:共时分效果初步鉴定:灭菌标志由红变操作人:环氧乙烷灭菌记录编码:SC-39时间: 2013年月日灭菌批号:二、灭菌室初始状态:温度:℃压力: MPa三、用气量:环氧乙烷: Kg四、过程:详见环氧乙烷灭菌参数记录。
五、总结:开始时间:日时分结束时间:日时分灭菌时间:共时分效果初步鉴定:灭菌标志由红变操作人:汕头市泰恩康医用器材厂有限公司领/退料单汕头市泰恩康医用器材厂有限公司一次性使用口罩生产过程工艺质量监控记录编码:SC-38汕头市泰恩康医用器材厂有限公司成品请验单汕头市泰恩康医用器材厂有限公司成品请验单汕头市泰恩康医用器材厂有限公司第 一 联 : 车 间 存汕头市泰恩康医用器材厂有限公司一次性使用口罩批生产记录审核表汕头市泰恩康医用器材厂有限公司成品放行审核单。
一次性使用医用口罩出厂检验报告书
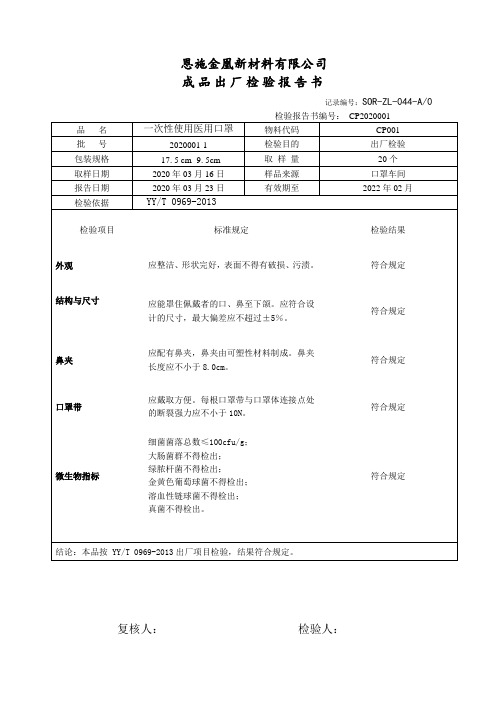
结构与尺寸
应能罩住佩戴者的口、鼻至下颌。应符合设计的尺寸,最大偏差应不超过±5%。
符合规定
鼻夹
应配有鼻夹,鼻夹由可塑性材料制成。鼻夹长度应不小于8.0cm。
符合规定
口罩带
应戴取方便。每根口罩带与口罩体连接点处的断裂强力应不小于10N。
符合规定
微生物指标
细菌菌落总数≤100cfu/g;
大肠菌群不得检出;
物料代码
CP001
批号
2020001-3
检验目的
出厂检验
包装规格
17. 5 cm×9. 5cm
取样量
20个
取样日期
2020年03月16日
样品来源
口罩车间
报告日期
2020年03月23日
有效期至
2022年02月
检验依据
YY/T 0969-2013
检验项目
标准规定
检验结果
外观
应整洁、形状完好,表面不得有破损、污渍。
绿脓杆菌不得检出;
金黄色葡萄球菌不得检出;
溶血性链球菌不得检出;
真菌不得检出。
符合规定
结论:本品按YY/T 0969-2013出厂项目检验,结果符合规定。
复核人:检验人:
符合规定
结构与尺寸
应能罩住佩戴者的口、鼻至下颌。应符合设计的尺寸,最大偏差应不超过±5%。
符合规定
鼻夹
应配有鼻夹,鼻夹由可塑性材料制成。鼻夹长度应不小于8.0cm。
符合规定
口罩带
应戴取方便。每根口罩带与口罩体连接点处的断裂强力应不小于10N。
符合规定
微生物指标
细菌菌落总数≤100cfu/g;
大肠菌群不得检出;
物料代码
一次性使用医用口罩半成品检验记录(点带)
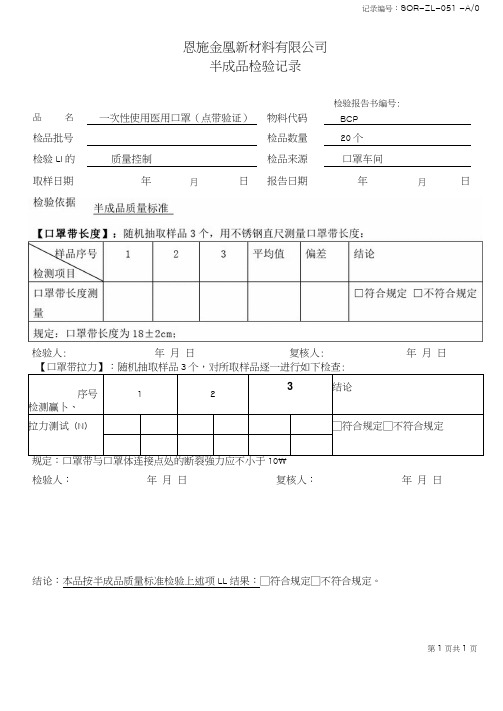
记录编号:SOR-ZL-051 -A/0
恩施金凰新材料有限公司
半成品检验记录
【口罩带拉力】:随机抽取样品3个,对所取样品逐一进行如下检查
:
序号
检测赢卜、 1
2
3
结论
拉力测试(N )
□符合规定□不符合规定
规定:口罩带与口罩体连接点处的断裂強力应不小于
10\
检验人: 年 月 日 复核人: 年 月 日
结论:本品按半成品质量标准检验上述项LL 结果:□符合规定□不符合规定。
第1页共1页
品
名
一次性使用医用口罩(点带验证)
物料代码 检品批号
检品数量
检验LI 的
质量控制
检品来源 取样日期 年
月
日
报告日期
20个
口罩车间
年
月
日
检验报告书编号:
BCP 检验人: 年 月 日 复核人:
年 月 日。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
汕头市泰恩康医用器材厂有限公司
批生产指令单
编码:kh-sc-001
产品名称规格批号批量生产日期指令下达人下达日期审核人
产品质量重点说明
序
号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
备注:
汕头市泰恩康医用器材厂有限公司
灭菌指令单
编码:SC-03
汕头市泰恩康医用器材厂有限公司
领/退料单
仓管员:批准人:领料人:
汕头市泰恩康医用器材厂有限公司
一次性使用口罩称量、备料工序生产记录编码:SC-32
称量人:复核人:
汕头市泰恩康医用器材厂有限公司
清场工作记录
汕头市泰恩康医用器材厂有限公司
一次性使用口罩本体制作工序生产记录编码:SC-33
汕头市泰恩康医用器材厂有限公司
中间产品交接单
汕头市泰恩康医用器材厂有限公司
中间产品交接单
汕头市泰恩康医用器材厂有限公司
清场工作记录
汕头市泰恩康医用器材厂有限公司
一次性使用口罩耳带点焊工序生产记录
编码:SC-36
操作人:复核人:
汕头市泰恩康医用器材厂有限公司
中间产品交接单
汕头市泰恩康医用器材厂有限公司
中间产品交接单
中间产品交接单
汕头市泰恩康医用器材厂有限公司
中间产品交接单
中间产品交接单
汕头市泰恩康医用器材厂有限公司
中间产品交接单
中间产品交接单
汕头市泰恩康医用器材厂有限公司
中间产品交接单
清场工作记录
一次性使用口罩包装工序批包装记录
清场工作记录
汕头市泰恩康医用器材厂有限公司
环氧乙烷灭菌记录
编码:SC-39
时间:2013年月日灭菌批号:
二、灭菌室初始状态:
温度:℃
压力: MPa
三、用气量:
环氧乙烷: Kg
四、过程:详见环氧乙烷灭菌参数记录。
五、总结:
开始时间:日时分
结束时间:日时分
灭菌时间:共时分
效果初步鉴定:灭菌标志由红变
操作人:
环氧乙烷灭菌记录
编码:SC-39
时间2013年月日灭菌批号:
二、灭菌室初始状态:
温度:℃
压力: MPa
三、用气量:
环氧乙烷: Kg
四、过程:详见环氧乙烷灭菌参数记录。
五、总结:
开始时间:日时分
结束时间:日时分
灭菌时间:共时分
效果初步鉴定:灭菌标志由红变
操作人:
环氧乙烷灭菌记录
编码:SC-39
时间: 2013年月日灭菌批号:
二、灭菌室初始状态:
温度:℃
压力: MPa
三、用气量:
环氧乙烷: Kg
四、过程:详见环氧乙烷灭菌参数记录。
五、总结:
开始时间:日时分
结束时间:日时分
灭菌时间:共时分
效果初步鉴定:灭菌标志由红变
操作人:
汕头市泰恩康医用器材厂有限公司
领/退料单
仓管员:批准人:领料人:
汕头市泰恩康医用器材厂有限公司
一次性使用口罩生产过程工艺质量监控记录编码:SC-38
汕头市泰恩康医用器材厂有限公司
成品请验单
汕头市泰恩康医用器材厂有限公司
成品请验单
汕头市泰恩康医用器材厂有限公司
成品请验单
汕头市泰恩康医用器材厂有限公司
仓库: 生产车间:
汕头市泰恩康医用器材厂有限公司
编码:SC-26
仓库: 生产车间:
第 一 联 : 车 间 存
第 二 联 : 仓 库 存
汕头市泰恩康医用器材厂有限公司
一次性使用口罩批生产记录审核表
车间主任:年月日质管部:年月日
汕头市泰恩康医用器材厂有限公司
成品放行审核单。
