石河子大学大学有机化学第十四章 胺
有机化学第十四章

第十四章 β-二羰基化合物
教材:徐寿昌 主编 高等教育出版社 教材:
第十四章 β-二羰基化合物 二羰基化合物
• 分子中含有两个羰基官能团的化合物叫二羰基化合物; 分子中含有两个羰基官能团的化合物叫二羰基化合物; 其中两个羰基为一个亚甲基 相间隔的化合物叫β 二羰 亚甲基相间隔的化合物叫 其中两个羰基为一个 亚甲基 相间隔的化合物叫 β -二羰 基化合物。 二羰基化合物 由于共轭效应 二羰基化合物, 共轭效应, 基化合物。 β-二羰基化合物,由于共轭效应,烯醇式 的能量低,因而比较稳定: 的能量低,因而比较稳定:
(4)克诺文格尔缩合反应 *——制备α,β-不饱和酸 制备α 制备 不饱和酸
• 醛、酮还可以和β-二羰基化合物(一般是丙二酸及 二羰基化合物( 酮还可以和β 二羰基化合物 其衍生物),在弱碱(氨或胺)作用下缩合: ),在弱碱 其衍生物),在弱碱(氨或胺)作用下缩合:
亲核加成-消除 亲核加成 消除
14.5 乙酰乙酸乙酯在有机合成上的应用 (1)酮式与烯醇式的平衡 )
(3)酮与酯在乙醇钠作用下的反应 ) 类似克莱森( 缩合反应: 类似克莱森(酯)缩合反应:
酮α -H活泼
• 常用丙酮或其他甲基酮和酯缩合来合成β -二酮。 常用丙酮或其他甲基酮和酯缩合来合成β 二酮 二酮。 • 注意:与羟醛缩合反应不同(稀碱条件下,生成 注意: 羟醛缩合反应不同 稀碱条件下, 反应不同( 不饱和醛)。 α,β-不饱和醛)。 286 不饱和醛)。P
•乙酰乙酸乙酯的特点 乙酰乙酸乙酯的特点 1、与金属钠作用发出H2;生成钠盐;2、使溴水褪色;3、 、与金属钠作用发出 生成钠盐; 、使溴水褪色; 、 作用显色。 与FeCl3作用显色。 注意: 二羰基化合物中的亚甲基 注意:若β-二羰基化合物中的亚甲基均被烷基取代则无 二羰基化合物中的亚甲基均被烷基取代则无 烯醇结构(即不能使溴水褪色);也不与FeCl3显色。 );也不与 显色。 烯醇结构(即不能使溴水褪色);也不与
有机化学:第十四章氨基酸

H
R C COOH
NH2
(一)、氨基酸的酸-碱性—— 两性与等电点
• 氨基酸分子中的氨基是碱性的,而羧基是酸 性的,因而氨基酸既能与酸反应,也能与碱 反应,是一个两性化合物。
R CH COOH NH3
H R C COOH
NH2
1. 脱羧反应:
RCHCOOH
NH2
Ba(OH)2 △
RCH2NH2 + CO2
• 氨基酸与氢氧化钡共热,可以脱去羧基生成
相应的胺类化合物。
2. 成肽反应:[重点]
H2NCHCOOH + H2NCHCOOH
R1
R2
- H2O
H2NCHCO
R1
NHCHCOOH R2
• 在适当条件下,氨基酸分子间的氨基和羧基相 互脱水缩合生成的一类化合物叫作 肽。
CH3
CH2OH
CH2C6H5
NH2 CH C NH CH C NH CH COOH
O
O
丙氨酰丝氨酰苯丙氨酸 (丙 丝 苯丙)
• 很多多肽都采用俗名,如催产素、胰岛素等。
二、肽键的结构:
1. 肽单位:肽键与相邻的两个α-碳原子所组 成的基团;
2. 肽键平面:肽单位中的6个原子处于同一平 面;两个α-碳原子呈反式分布;
H
OH
R CH COOH
R CH COO
NH2
NH2
1. 两性:
• 氨基酸在一般情况下不是以游离的羧基或氨基 存在的,而是两性电离,在固态或水溶液中形 成内盐。
R CH COOH
R CH COO
蛋白质化学(石河子大学生物化学试题库)

蛋白质化学(客观题带答案)蛋白质化学一、名词解释1.氨基酸(amino acids):是含有一个碱性氨基和一个酸性羧基的有机化合物,氨基一般连接在α-碳上。
氨基酸是肽和蛋白质的构件分子。
2.必需氨基酸(essential amino acids):指人(或其它脊椎动物)自己不能合成,需要从饮食中获得的氨基酸,例如赖氨酸、苏氨酸等氨基酸。
3.等电点(pI,isoelectric point):使分子处于兼性分子状态,在电场中不迁移(分子的净电荷为零)的pH值。
4.茚三酮反应(ninhydrin reaction):在加热条件下,氨基酸或肽与茚三酮反应生成紫色(与脯氨酸反应生成黄色)化合物的反应。
5.肽键(peptide bond):一个氨基酸的羧基与另一个氨基酸的氨基缩合,除去一分子水形成的酰胺键。
6.肽(peptides):两个或两个以上氨基酸通过肽键共价连接形成的聚合物。
蛋白质一级结构(primary structure):指蛋白质中共价连接的氨基酸残基的排列顺序。
7.Edman降解(Edman degradation):从多肽链游离的N末端测定氨基酸残基的序列的过程。
N末端氨基酸残基被苯异硫氰酸酯修饰,然后从多肽链上切下修饰的残基,再经层析鉴定,余下的多肽链(少了一个残基)被回收再进行下一轮降解循环。
8.同源蛋白质(homologous proteins):来自不同种类生物、而序列和功能类似的蛋白质。
例如血红蛋白。
9.酰胺平面(肽单位peptide unit):又称之肽基(peptide group),是肽链主链上的重复结构。
是由参与肽键形成的氮原子和碳原子和它们的4个取代成分:羰基氧原子、酰胺氢原子和两个相邻的α-碳原子组成的一个平面单位。
10.蛋白质二级结构(protein secondary structure):在蛋白质分子中的局部区域内氨基酸残基的有规则的排列,常见的二级结构有α-螺旋和β-折叠。
有机化学 第十四章 胺及其他含氮化合物

第十四章 胺
机理:
+
O
OH
+
H
+
N HO H
N H
+
H2O
N _H2O
+
N H
¾ 烯胺遇水逆向反应分解为原来的酮。
_H+
N
+
N
N -¾ 烯胺β-C上带有部分负电荷,具有亲核性。
¾ 常用的环仲胺有:
N
N
H
H
四氢吡咯 四氢吡啶
O
N H
吗啉
Organic Chemistry
© 2015 02 27
5
第十四章 胺
问:不同的脂肪胺,其碱性大小有什么规律?
R3N > R2NH > RNH2 > NH3 结构因素 在水中测得结果不同,显然水对胺的碱性有一定影响。
H
R_
+
N
H
H
OH2 OH2 OH2
+ H OH2 R2N H OH2
+
R3N H OH2
水中共轭酸稳定性:RN+ H3
>
+
R2NH2
>
+
R3NH
因氢键的形成,胺的碱性强弱为:RNH2 > R2NH > R3N
© 2015 02 27
第十四章 胺
弱酸碱性
..
亲核性
R—NH2
烃化反应 酰化反应 亚硝化反应
氧化反应 (Cope消去)
两个重要反应——烯胺的应用,霍夫曼消去
Organic Chemistry
© 2015 02 27
1
第十四章 胺
高等有机化工工艺学14胺-精选文档
在冷的情况下,二氧化硫仅可还原脂肪胺氧化物
第二节 N—烃化反应 一、卤代烃的胺解
卤代烷与六亚甲基四胺反应
卤代烷与六亚甲基四胺反应,首先形成季铵盐,而后在乙醇的浓盐酸溶液中加 热分解成伯胺。 本合成法仅适用于伯卤代烃,不适用于仲、叔卤代烃。 在伯卤代烃中尤以活泼卤代烃为佳,如烯丙基卤、节苄基卤、α-卤丙酮和碘代 烷等。 若用活泼性较差的溴代烷或氮代烷,最好加入碘化钠以催化其反应。 本方法的优点是试剂易得,反应条件较为温和,操作简单。 可以用来合成某些苄胺、 α-氨基酮、 α- 氨基酰胺等、氨基酸等化合物。
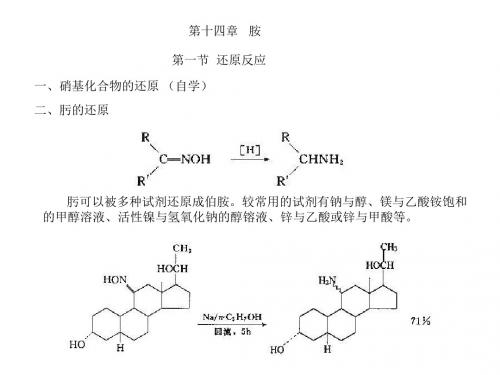
第十四章 胺 第一节 还原反应 一、硝基化合物的还原 (自学)
二、肟的还原
肟可以被多种试剂还原成伯胺。较常用的试剂有钠与醇、镁与乙酸铵饱和 的甲醇溶液、活性镍与氢氧化钠的醇镕液、锌与乙酸或锌与甲酸等。
金属氢化物如氢化铝常用于肟的还原。 硼氢化钠通常不用于肪的还原,但在催化剂四氯化锆、氯化锂及酸性离子交 换树的存在下,硼氢化钠亦能还原肟成伯胺。 硼烷作还原剂,于四氢呋喃中在较低温度下反应,可形成羟胺;但在沸腾的 四氢呋喃中回流,则可还原脂至伯胺。
七、亚胺的还原
一般的亚胺不够稳定,但碳—氮双键上的碳原子或氮原子上连有一个或一个 以上的芳基时则稳定。 亚胺容易被多种还原剂还原成相应的胺,因此亚胺的还原也是制备芳胺的 重要方法。 常用的还原剂有催化氢化、金属氢化物、活泼金属以及其他还原剂。 催化氢化是亚胺还原成胺的有效方法,除多相催化剂外,均相催化剂也是 有效的氢化催化剂。在过渡金属络合物的存在下,亚胺能顺利地还原成胺。
将N,N-二甲基-2,2-二甲基丙酰胺的四氢呋喃溶液慢慢加至冷的乙硼烷的四氢 呋喃溶液中,然后回流反应,即得相应的胺,
将乙硼烷的四氢呋喃溶液慢馒加到N-(2,4,6—三甲基苯基)丁二酰亚胺的四 氢呋喃溶液中,然后回流反应6h,即得相应的胺,
有机化学:第十四章 羰基α-取代反应和缩合反应

R CO
R'
NC H R'' MgX
3、先加成后消去--酸或碱催化 如:胺、
HO H
氨及氨的衍生物
NaO3S H
注意:
以上反应除与有机金属化合物的反应之外, 均为平衡过程 讨论参数:平衡常数
羰基化合物的结构特征之二: 羰基C=O的吸电子作用使得α-H具有明显的酸性,在碱性条件 下可以解离,生成烯醇负离子,从而成为亲核试剂,进攻羰基 碳或卤代烃,发生亲核加成反应、亲核取代反应。
酰卤可以发生该反应。
2. 烯醇负离子作为亲核试剂,进攻卤代烃的缺电子碳,则发生亲核取代反
应;进攻羰基碳则发生亲核加成反应。
O CC
O CC
烯醇负离子
X-X 亲电取代
O
R-Cl
CC
亲核取代 R
O
OH O
C
CCC
亲核 加成 O
-羟基酮
烷基化反应
a ld ol -反应 羟醛反应
O
R Y OO
C C -卤代反应 亲核取代
?
?
Kinetic enolate
Thermodynamic enolate Generally:
低温有利于形成动力学产物 高温则主要得到热力学产物
强碱有利于形成动力学控制的少取代烯醇负离子。 酸性有利于形成热力学控制的多取代烯醇。 对于弱碱条件下则影响因素会更多,选择性不高。
O CH3
O
CH3
C HO
加成-缩合
,-不饱和酮
1, 5-二羰基化合物
Michael 加成
Robinson成环
本章主要内容
一、α-氢的酸性及烯醇、烯醇负离子形成 二、α-卤代反应 三、Aldol 反应和 Aldol 缩合 四、酮和酯的烷基化反应 五、酮和酯的酰基化反应 六、α,β-不饱和羰基的亲核加成 七、β-二羰基化合物的反应与应用 八、其它缩合反应
第十四章 胺

胺的命名,胺的碱性,Hoffman消除反应
教学内容
胺的分类和结构 胺的物理性质 胺的化学性质
胺的成盐反应 Hoffmann消除反应 胺的酰化 胺的氧化 胺与亚硝酸反应 Gabriel反应 重氮甲烷 胺的制备(自学)
一. 胺的分类和结构
1.分类
定义:氨基(amino):相当于无机氨分子去掉一个氢原子剩余 部分; 胺相当于烃分子中的氢原子被氨基取代: 用RNH2 或 ArNH2表示:
R3
R3
N R2
R1
N
R2 R1
E = 25.104kJ·mol-1
已拆分出一对对映体
二. 胺的物理性质
(1) 溶解度:低级脂肪胺在水中溶解度极大 (与水形成氢键)
(2) 沸 点:伯胺、仲胺比相应的醇低(氢键弱) 叔胺与烷烃接近(无氢键)
(3) 气 味:低级脂肪胺臭鱼味,肉腐烂产生极臭且 剧毒的丁二胺(腐胺)及戊二胺(尸胺)
几种特殊的 芳香胺命名
甲胺
NH2
甲基乙基环丙胺
NHCH3
NH2
苯胺 aniline
N-甲基苯胺 N-methylaniline
CH3 p-甲基苯胺
p-toluidine
b.复杂胺的系统命名(IUPAC)
选择含有氨基最长的碳链作为主链,称为某胺,若为复杂的胺,则氨基 作为取代基;当氮上含有多个取代基,用N定其位。对多元胺称为二元、 三元。 英文名称:将烃名称去掉词尾“e”,用“amine”代替。二元胺、三元胺 用“diamine, triamine”,亚胺用imine。氨基用“amino”,亚胺基用 “imino”。
注意:
氨——氨基、亚氨基 胺——氨的烃基衍生物 铵——季铵类化合物
第十四章 胺2——复旦大学有机化学课件
反应选择性(Hofmann取向):
H3CH2C CH O N CH3
CH3 CH3
H3CH2C CH 67%
CH2
+
H3CHC
CHCH3
trans: 21% cis: 12%
小结: • HNO2 与各类胺的反映结果不同,其中脂肪族伯胺的 反应经过正碳离子中间体 • 季铵盐在合成中的应用:作为相转移催化剂 • 季铵碱的消除:Hofmann消除、消除的取向、在合 成中的应用 • Cope消除及取向
N(CH3)3 OH H3C CH2 CH2 CH 98% CH2 + H3C CH2 CH 2% CH CH3
Hofmann取向
比较:卤代烷的消除反应取向 —— Saytzeff 取向
CH3 CH2 CH2 CH X CH3 CH2 CH2 CH 次要 CH2 + CH CH3 2 CH CH CH3 ' CH3 NaOC2H5
强碱,碱性类似于 NaOH、KOH
+
AgX
季铵碱的反应 —— Hofmann消除反应
H3C CH2 N CH2 CH CH3 H (-消除) CH3 R OH H3C N CH3 + CH2 CH R
Hofmann消除的选择性 —— 主要生成取代基少的烯烃
H3C CH2 CH2 CH ' CH3
OH R C C R R
O C C R
类似Pinacol重排
• 例:环酮的扩环
HO CH2NH2 HO HNO2 CH2 O
HO
CN
O + HCN
(2) 芳香族胺与 HNO2 的反应
NaNO2 / HCl 0-5 C 重氮盐 NO NHR HNO2 N R 油状物 HNO2 NR2 ON NR2 H+ ON 溶解于酸 NR2 X H
有机化学第十四章杂环化合物讲课文档

S —NO2
为什么不用硝酸而用硝基乙酸酯呢?
原因:
1、硝酸是强氧化剂,容易使呋喃、噻吩、吡咯氧化。
2、硝酸是强酸,呋喃、吡咯环的稳定性较差,容易开 环,形成聚合物。
第十九页,共47页。
3、磺化 + SO3
O
吡啶
N —SO3H
O —SO3H
+ H2SO4
S
N +(CF3CO) 2O
第十五页,共47页。
(一)吡咯的酸碱性
+ KOH
N H
pKb: 13.6
N + H2O
K+
(二)吡咯、呋喃和噻吩的亲电取代反应
乙醚 Br—
—Br
+ Br2
N
Br— —Br N
H
H
第十六页,共47页。
问题:为什么吡咯、呋喃和噻吩的稳定性比苯小, 且苯>噻吩>吡咯>呋喃?
电负性
S 2.58 N 3.04 O 3.44 C 2.55 S电负性小,容易给环提供电子
第九页,共47页。
确定基本环的原则是:
(1)碳环与杂环组成的稠杂环,
S
以杂环为基本环。例如:
苯并噻吩
cd f e
b
aN
苯并[f]喹啉
(2)由大小不同的两个杂环组成的 N N
稠杂环,以大环为基本环,例如:
H
吡咯并吡啶
(3)大小相同的两个单杂环组成稠 杂环时,基本环按所含杂原子N、O、
S
N H
S顺序优先确定。例如:
一、分类
单杂环
杂环化合物 多杂环
五元环 六元环 五元环 六元环
N
O
H
N
N
N H
N N
S
o
有机化学a2教学课件第十四章芳香胺-输出

(3 ) C 2 N 是 亲 核 H 试 H 剂 ,应 发 生 亲 核 取 代 反 应 .
离 去 基 为Br
NO 2 NO 2
N
H-N
NO 2
- OH-H 2 O
OH NO 2
CH 3 ONa
OCH 3 NO 2
Na 2 S
SNa NO 2
(二) 芳香胺
NH 2 N sp3杂化,
..
N H
H
氨 基 的 给 电 子 共 轭 ,使 苯 环 的 电 荷 密 度 增 加 , 是 亲 电 取 代 反 应 的 活 化 基 ,是 邻 对 位 定 位 基 .
叔 (三 级 )芳 胺 与 酚 相 似 (邻 对 位 ):
+
N(3 )2 CH
N 2 C -+l
H 3 O +
0 ℃
N = N
N(3 )2 C
一 级 ,二 级 芳 胺 :
+
NN+ H 2 N
R H 3 O +
H
N=N-N
R
互变异构
H
N-N=N
R
+
-
NH 3Cl
40℃
H3O+ -N 2
N2H +HO R
3 .1 苯 环 上 的 亲 电 取 代 反 应
3.1.1 卤化
NH2
Br2 H2O
NH2
Br
Br
Br
若 要 进 行 一 取 代 ,则 应 使 - N H 2 成 为 弱 的 活 化 基 .
NH 2
O NHC CH 3
N参加与羰基的共轭,电荷密度降低,给电子性降低, 苯环上的电子云密度降低,亲电取代活性降低。
有机化学基础知识点整理胺的亲电取代反应与缩合反应

有机化学基础知识点整理胺的亲电取代反应与缩合反应有机化学基础知识点整理——胺的亲电取代反应与缩合反应胺是有机化合物中含有氨基(NH2)基团的一类化合物。
胺的亲电取代反应以及缩合反应是有机化学中重要的反应类型。
我们将在本文中对胺的亲电取代反应和缩合反应进行详细的整理和讨论。
一、胺的亲电取代反应亲电取代反应是有机化学中常见的反应类型,它涉及到一个亲电子试剂与胺发生反应,产生新的化学键。
胺的亲电取代反应的机理主要有两个:亲核取代和电子转移。
1. 亲核取代亲核取代是指亲电子试剂中的亲核试剂攻击胺分子中的亲电子中心,并与之形成新的化学键。
常见的亲电取代试剂包括卤素、醇、水和卤代烷等。
以卤代烷为例,当卤代烷与胺反应时,胺中的氮原子亲电子性强,易被卤代烷中的卤素攻击,形成适当的胺盐。
此时,胺盐可以通过加热、浓碱等条件来回复到相应的胺。
2. 电子转移电子转移是指亲电子试剂中的亲电子离子或亲电子原子与胺分子中的电子对发生重新分配,形成新的化学键。
常见的电子转移试剂包括亚硝酸、叔丁基过氧化物等。
以亚硝酸为例,亚硝酸在反应中会发生电子转移,并与胺分子中的氨基发生作用,形成相应的亚硝基化合物。
这种反应常用于合成具有特定化学活性的化合物。
二、胺的缩合反应胺的缩合反应是指两个或更多胺分子之间发生的反应,其中一个分子失去一个氨基(NH2)基团,而另一个分子失去一个氢原子,形成一个新的分子。
1. 胺与醛/酮的缩合反应胺与醛或酮的缩合反应又称为Mannich反应。
在反应中,胺中的亲电子中心攻击醛分子中的羰基,生成一个中间体,然后中间体失去一个氨基和一个氢原子,形成缩合产物。
Mannich反应在有机合成中广泛应用,可以合成多种具有生物活性的化合物,如药物和天然产物。
2. 胺与羧酸的缩合反应胺与羧酸的缩合反应通常需要在酸性条件下进行。
胺中的亲电子攻击羧酸中的羰基,形成酰胺化合物。
此反应也被称为酰胺合成反应。
酰胺化合物是有机化学中重要的结构单元,广泛存在于药物和生命体系中。
有机化学之胺类化合物

三级胺与卤代烷加热形成四级铵盐即季铵盐。
R3N + R'I
R3N+R I-
CH2Cl + (CH3)3N
CH2N+(CH3)3Cl-
季铵盐易溶于水、熔点高。 季铵盐与氢氧化钠(钾)作用形成平衡体系:
R4N+I- + KOH
R4N Cl AgOH
R4N+OH- + KI
R4N OH AgCl
3) 烷基化 氨或胺与卤代烃作用
(CH3CH2)2NH CH3CH2I (CH3CH2)2NH+I- NH3 (CH3CH2)3N NH4I
.................................
总之,反应得到的是混合物,一般用于制备的意义不大。在实 际中,可通过控制反应物的量来控制生成物。
4) 酰化与磺酰化 •酰化:酰基取代胺氮原子上氢的反应。
RNH2 (Ar)
R'COCl or (R'CO)2O
RNHCO R'
R2NH
R'COCl
R2NCO R'
NHCH 3 CH3COCl
R3N (Ar)3N
R'COCl or (R'CO)2O
NCO CH3 CH3
注意
1. 胺的酰化反应比烷基化反应简单,不发生二次酰化. 2. 酸酐(酰氯)常用来为胺的酰基化试剂. 3. 伯、仲胺可以被酰化,叔胺不被酰化,可分离叔胺. 4. 芳胺的酰基化与脂肪胺类似,但前者酰基化的活性低于后者
•气态时,仅有烷基的供电子效应,烷基越多,供电子效应越大。 •在水溶液中,碱性的强弱决定于电子效应、溶剂化效应等。 溶剂化效应——铵正离子与水的溶剂化作用(胺的氮原子上的氢与水形成氢 键的作用)。胺的氮原子上的氢越多,溶剂化作用越大,铵正离子越稳定, 胺的碱性越强。
大学有机化学第14章

编辑ppt
35
15.6.5 从霍夫曼酰胺降解反应——少一个碳的伯胺
有时用 NaOH,Br2
15.6.6 从盖布瑞尔合成法
•是合成纯伯胺的方法
例1
编辑ppt
36
例2:盖布瑞尔法合成——-氨基酸
编辑ppt
37
•邻苯二甲酰亚胺的制备 • 具体历程见:P339-340
• 氧化偶氮苯如进一步还原可得偶氮苯或氢化偶氮苯. 这些产物如经强烈还原条件下进一步还原,最后都可得 到苯胺.
编辑ppt
14
•芳香族多硝基化合物用碱金属的硫化物或多硫化物,硫 氢化铵、硫化铵或多硫化铵为还原剂,可以选择性还原 其中的一个硝基成为氨基:
选择性还原其 中的一个硝基 成为氨基.
编辑ppt
编辑ppt
18
•迈森海默络合物的共振式:
稳定
• 络合物稳定,也就是生成这个这个络合物的活化能也 越低,所以反应容易进行。
编辑ppt
19
(2)对酚类酸性的影响
• 苯酚的酸性比碳酸弱;随着苯环上引入硝基,增强了 酚的酸性;2,4,6-三硝基苯酚的酸性几乎与强无机酸 相近.
• 硝基苯氧负离子的共振结构:
32
(2) 酰胺用氢化锂铝还原成胺: • 此法特别适用于仲胺和叔胺
芳胺类若N上有H, 则不发生傅-克反应 ,但酰基化反应后 可发生!(补例)
芳胺类若N上无H,
如: Ph(CH3)2, 则在 温和条件下可以发
生傅-克反应!
编辑ppt
33
补充例题:
酰基化反应 后可发生傅克反应!
还原?
编辑ppt
34
有机化学 第十四章 答案

第十四章1.CH 2CH 2NHC 2H 5ON(CH 3)2(1)(2)CH 2NHCH 2(3)(4)H 2NCH 2CCH 2NH 2CH 3CH 3(5)(6)C 6H26H 5H 2或CH 3CH 3CH 3+NCH 2PhCl -(7)N-甲基-2-丙胺 (8)(R )-反-3-戊烯-2-胺 (9)N,N-二甲基苯胺(10)1,5-己二胺 (11)3-甲氧基苯胺 (12)(S )-3-甲基-2-氨基-1-丁醇 2.OCH 3(1)(2)(3)NHNCH 2CH 3OCH 3H N(4)(5)CH 3COCH 2N(CH 2C 6H 5)2H 3C3CH 2+N(CH 3)3(6)N NO(7)CH 3NH 2CH 3CH 3H N CH 3CH 3H N CH 3Cl ON EtOEtBrNH 2(8)Br(9)CNNO 2FF(10)OHN=N(11)(12)CH 3H 3CH 3CPh NOOCH 3CH 2CN(13)OCH 3H 3CO OCH 3CH 2CH 2NH 2OCH 3H 3CO(14)C CHHBrBr(15)CH 3(CH 2)5NHCH 2CCHO(16)OOCH 3CH 3N(CH 3)23.(1)H 3C ->H 2N ->HO ->F -(2)N -N -N -OOO<<(3) 3,4-二氯苯胺 > 3-硝基-4-氯苯胺 > 2-硝基-4-氯苯胺 (4) 二甲胺 > N–甲基苯胺 > 二苯胺:N(5)>CH 2CH 3CH 2CH 32CH 34.(碱性或亲核性:脂肪胺 > 苯胺 > 酰胺)N N+H 3CH 3C H 3C OCNHCH 3OI -5. (1)化合物(A )能形成分子间氢键,而(B )不能形成分子间氢键。
N+N +C(CH 3)3HCH 2PhH 3CC(CH 3)3HCH 3PhH 2CCl -Cl -+(2)(3)脂肪族重氮盐极不稳定,即使在低温下也能很快分解,放出氮气,生成相应的谈正离子。
氨基酸、蛋白质、核酸

40
核酸水解 由合算水解所得到的戊糖有两种,即核糖和2-脱氧核糖
41
按水解后得到的戊糖的不同,核酸可分为两类。 水解后得到核糖的,叫做核糖核酸(简称RNA)。 水解后得到2-脱氧核糖的,叫做脱氧核糖核算(简称 DNA)。
蛋白质溶液与水合茚三酮溶液作用,也有颜色反 应。但颜色与氨基酸的不太一样。
32
此外,蛋白质容易水解,酸、碱、酶能促进蛋白 质的水解。可得到多种α-氨基酸的混合物。如果部分 水解则得到分子较小的多肽。
33
四、 蛋白质的结构
蛋白质的一级结构 多肽链中氨基酸的组成和排列次序. 蛋白质的二级结构 多肽链在空间不是任意排布的,由于某些基团之间的 氢键作用,肽链具有一定的构象.
22
多肽概述
多肽是含有多个氨基酸单元的聚合物。由两个氨基 酸单元构成的是二肽,由三个氨基酸单元构成的是三 肽,········余类推。它们统称多胎,或简称肽。
通过氨基和羧基之间脱水缩合而形成连接氨基酸单元 的酰胺键(—CO—NH—)又叫做肽键。
许多多肽本身有重要的生理作用
后叶催产素——八肽 胰岛素——五十一肽
分类
纤维蛋白(丝、毛、皮、角、爪和甲等) 球蛋白、酶和蛋白激素(溶于水、盐水、酸碱溶液
和乙醇等) 结合蛋白(与核酸、糖、脂肪及血红素等结合)
29
二、 蛋白质的分类和功能
按溶解度分类:一类不溶于水的纤维状蛋白质;一类 是能溶于水、酸、碱或盐溶液的球状蛋白质。
蛋白质的功能
一方面是起组织结构的作用。例如,角蛋白组成 皮肤、肌肉等。另一面,蛋白质起调节作用。例如: 毛发、指甲、头角:骨胶蛋白组成腱、骨;肌球蛋白 组成各种酶对生物化学反应起催化作用;血红蛋白在 血液中,输送氧气;胰岛素调节葡萄糖的代谢;等等 在生物体内起重要调节作用的各种酶,都是蛋白质。
有机化学之胺类化合物PPT文档22页

41、学问是异常珍贵的东西,从任何源泉吸 收都不可耻。——阿卜·日·法拉兹
42、只有在人群中间,才能认识自 己。——德国
43、重复别人所说的话,只需要教育; 而要挑战别人所说的话,则需要头脑。—— 玛丽·佩蒂博恩·普尔
44、卓越的人一大优点是:在不利与艰 难的遭遇里百折不饶。——贝多芬
1、不要轻言放弃,否则对不起自己。
2、要冒一次险!整个生命就是一场冒险。走得最远的人,常是愿意 去做,并愿意去冒险的人。“稳妥”之船,从未能从岸边走远。-戴尔.卡耐基。
梦 境
3、人生就像一杯没有加糖的咖啡,喝起来是苦涩的,回味起来却有 久久不会退去的余香。
有机化学之胺类化合物 4、守业的最好办法就是生多么美丽,我不愿失 去今生对你的记忆,我不求天长地久的美景,我只要生生世世的轮 回里有你。
有机化学B教材第二版课后习题解析第十四章 氨基酸蛋白质核糖核酸课后习题参考答案

氨基酸和蛋白质课后习题参考答案习题1,各小题答案如下:(1)pH=4.80小于半胱氨酸等电点5.02,氨基酸以正离子形式存在,电场中向负极移动。
HSCH2CH(NH3+)COOH(2)pH=10.95大于精氨酸等电点1076,氨基酸以负离子形式存在,电场中向正极移动。
H2NC(=NH)(NH)CH2CH2CH2CH(NH2)COO-(3)pH=6.0小于赖氨酸等电点9.74,氨基酸以正离子形式存在,电场中向负极移动。
H2NCH2 CH2CH2CH2CH(NH3+)COOH习题2,缬氨酸,pI大于pH=6,酸性溶液中,正离子形式存在,电场中向负极移动。
谷氨酸,pI小于pH=6,碱性溶液中,负离子形式存在,电场中向正极移动。
赖氨酸,pI大于pH=6,酸性溶液中,正离子形式存在,电场中向负极移动。
习题3,中性、碱性、酸性氨基酸是依据其分子中羧基和氨基(碱基)个数来确定的,而氨基酸的水溶液的pH值要依据其电离常数进行计算,所以上述说法不正确。
习题4,各名词含义如下:α-螺旋结构是指肽链的肽平面在空间分布呈螺旋形的卷曲状。
变性作用是智蛋白质在高温、紫外线、重金属离子或其它物质作用下蛋白质的二、三、四级结构被破坏,从而失去了蛋白质生理活性,蛋白质变性不可逆。
三级结构是指具有二级结构蛋白质肽链在空间的分布(折叠或卷曲)状态。
脂蛋白是指蛋白质分子与脂肪分子结合而形成的一种结合蛋白。
等电点是指某种氨基酸(或可溶性蛋白质)分子在某种pH值溶液中,分子内所负正电荷和负电荷相等,在电场中不向电极的任何一方移动,该溶液的pH值就是某氨基酸(或某蛋白质)的等电点。
不可逆沉淀是指蛋白质在变性条件下发生的沉淀现象。
由于变性不可逆,所以沉淀蛋白质也会不再溶解,故称为不可逆沉淀。
必须氨基酸是指人(或动物)在生命活动中不可缺少的氨基酸。
中性氨基酸是指在氨基酸分子中羧基的个数与碱基(氨基)个数相等。
中性氨基酸的水溶液pH不一定是中性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3NH2
NH2
CH3 N
CH2CH3
methylamine
aniline
cyclopropylethylmethylamine
甲胺
苯胺
甲基乙基环丙胺
2. IUPAC命名法:
选含氮最长的碳链为母体,称某胺。 N上其它烃基为取代基,并用N定其位
CH3NH2
methylamine
甲胺
CH3
H3C
N
C2H5
介绍二个结构
R-N
氮宾
O R-C-N
酰基氮宾
(2)反应机理
O RC NH
H
O
X
NaO-X+ RC N
H
NaOH
O
X
RC N -
O
重排
RC N
酰基氮宾
R-N=C=O
异氰酸酯
OH H2O R-N=C-OH
O R-NH-C-OH
胺基甲酸
O R-N+ H-C-O-
H
RNH2 + CO2
讨论
1. 只有1o 酰胺能发生霍夫曼重排 2. 迁移碳构型不变 3. 异氰酸酯与烯酮结构类似,易水解。
第十四章 胺
exit
本章提纲
第一节 胺的分类、命名、物性和 光谱特征
第二节 胺的制备 第三节 胺的反应 第四节 重氮甲烷
第一节 胺的分类、命名、物性和光谱特征
一 胺的分类:
胺根据在氮上的取代基的数目,可分为一级(伯), 二级(仲),三级(叔)胺和四级(季)铵盐
二 胺的命名:
1 普通命名法:可用胺为官能团,如:
非对映体利用溶解度等物理性质上的差别予以分离。
ON
N+ O
O
N+ O
NO2
NO2
(1)
(2)
(2)比(1)的碱性强4万倍
具体分析时,既要考虑N上取代基的影响, 也要考虑苯环上取代基的影响。
二 胺的成盐反应
胺有碱性,遇酸能形成盐。
RNH2 + CH3COOH
CH3COO- +NH3R
成盐反应的应用
1. 用于分离提纯
HCl RNH2 不溶于水
+ - NaOH RNH3Cl
(3)影响碱性强弱的因素: 电子效应:3o胺 > 2o胺 > 1o胺 空间效应:1o胺 > 2o胺 > 3o胺 溶剂化效应:NH3 > 1o胺 > 2o胺 > 3o胺
溶剂化效应是给电子的,N上的H越多, 溶剂化效应越大,形成的铵正离子就越稳定。 不同溶剂的溶剂化效应是不同的。
H R-+N-H
H
H OH
C6H11
H
NH2
CH3
(R)
四 硝基化合物的还原(制备1o胺)
还原剂
反应式: RNO2
RNH2
还原剂的分类:
1 酸性还原剂: 酸+金属 (Fe+HCl, Zn+HCl, Sn+HCl, SnCl2+HCl)
2 中性还原剂:催化氢化,常用的催化剂有 Ni, Pt, Pd. 3 碱性还原剂:Na2S, NaHS, (NH4)2S, NH4HS, LiAlH4
( NaBH4 和 B2H6 不能还原硝基)
应用: 制备1o胺
五 腈、酰胺、肟的还原
腈 RC≡N
还原剂
RCH2NH2
1°胺
O
还原剂
酰胺 RCNH2
RCH2NH2
1°胺
O
还原剂
RCNHR'
RCH2NHR’
2°胺
O
还原剂
RCNR'2
RCH2NR’2
3°胺
NOH
Ni / H2
NH2
肟 CH3(CH2)4CCH3 6-8MPa, 75-80oC CH3(CH2)4CHCH3 1°胺
还原剂 (RCH2)3N
常用的还原剂是催化氢化或其它提供氢的氢化试剂
2 刘卡特反应
醛、酮在高温下与甲酸铵反应生成一级胺。 该反应称为刘卡特反应。
O CCH3
O HCONH 4
185oC (高温)
NH2 CHCH 3
O HCONH 4
HCOOH + NH3
甲酸铵的作用是提供NH3和还原剂甲酸, 甲酸既提供H+,又提供H-。
溴化四乙铵
CH2CH3
+
CH3CH2-N-CH2CH3
OH -
CH2CH3
Tetraethylammonium hydrooxide
氢氧化四乙铵
三 胺的物性
低级胺为气体或易挥发性液体; 高级胺为固体; 芳香胺为高沸点的液体或低熔点的固体; 胺具有特殊的气味; 胺能与水形成氢键; 一级胺和二级胺本身分子间也能形成氢键;
H OH
H OH
综合上述各种因素, 在水溶液中,胺的碱性强弱次序为:
脂肪胺(2°>1°>3°)>氨>芳香胺
在氯苯中,脂肪胺的碱性强弱次序为: 3°> 2°> 1°
(4)芳香胺碱性强弱的分析
首先考虑N上的孤电子对,能不能与苯环 共轭,能共轭,碱性弱,不能共轭,碱性强。HH Fra bibliotekN ON
N
O
O
H3C CH3
七 从羧酸及其衍生物制胺
1 霍夫曼重排
(1)定义:
酰胺与次卤酸盐的碱溶液(或卤素的氢氧化 钠溶液)作用时,放出二氧化碳,生成比酰胺少 一个碳原子的一级胺的反应。
O
H2O
RCNH2 + Br2 + NaOH
RNH2 + CO2 + 2NaBr
O
ROH H2O
RCNH2 + Br2 + NaOR
RNH2 + CO2 + 2NaBr
RNH2 + H2O + NaCl
溶于水
不溶于水
溶于水
2. 用于鉴定
所有的铵盐都具有一定的熔点或分解点。
3. 析解消旋体
许多天然有机胺都具有光活性,可用来析解一对消旋的有机酸。
有机酸(±)+ 光活性有机胺(-) 外消旋体
铵 (+)酸(-)胺 盐 (-) 酸(-)胺
HCl HCl
有机酸(+) 有机酸(-)
反应式:
HCOOH
HCOOH
RNH2 + HCHO 过量 RNHCH3 过量 RN(CH3)2
一级胺
二级胺
三级胺
反应机理:(由同学自己写出)
从反应机理可知: (1)甲醛是一个甲基化试剂 (2)甲酸是一个还原剂,在反应中既提供 正氢,也提供负氢。
反应特点: 操作简便、条件温和(100℃左右),产率高。
O
O
RCCl + NaN3
RCN3
O
O
O
RCOR NH2NH2 RCNHNH2 HNO2 RCN3
O
惰性溶剂
RCN3
R
N C O H2O
-N2
O
重排
RCN
RNH2 + CO2
3 希密特重排
定义:叠氮酸在强酸的存在下,分别与羧酸、醛、 酮作用,生成相应的胺、腈或甲酰胺、酰胺的反应。
O
H+
R-C-R
O
5 制备环状胺
Br(CH2)n Br NH3 n=4-6
(CH2)n NH
Br(CH2)n Br
(CH2)n
N+
Br-
(CH2)n
NH3
Br
Br Br Br
Br Br
N
+ 3 HBr
6 介绍一个常用的四级铵盐
(C2H5)3N + C6H5CH2Cl
[ (C2H5)3NCH2C6H5 ]+Cl -
TEBA (氯化三乙基苄基铵)
(3)当氮与三个不同基团相连时,有一对对映体。
R3
N R2
R1
R3
N R2
R1
E = 25.104kJ/mol
CH3
+
C6H5 N C2H5
CH2CH=C H2
已拆分出一对对映体。
2 胺的碱性
(1)产生碱性的原因: N上的孤对电子
(2)判别碱性的方法: 碱的pKb;其共轭酸的pKa; 形成铵正离子的稳定性。
2,5-双(三氟甲基)苯胺
3. 胺盐和四级铵化合物的命名:
CH3NH2 HCl methylamine hydrochloride
甲胺盐酸盐
CH3CH2NH2 HOAc ethylamine acetate
乙胺醋酸盐
CH2CH3
+
CH3CH2-N-CH2CH3
Br -
CH2CH3
Tetraethylammonium bromide
-NH4X-
RI > RBr > RCl > RF 1°RX > 2°RX, 3°RX 以消除为主。
氨或胺的烷基化的具体应用
1 工业制备(结合高效率的分馏塔)
2 利用电子效应和原料配比的调节,可以制备1°胺
CH3CHCOOH + NH3 Br
1mol
70mol
CH3CHCOO-
N+ H3 65 % -70%
RN+H3X- OH- RNH2 + H2O + X-
NH3 RNH2 + N+H4X-
RX + NH3
OH- RNH2 RX OH- R2NH RX
OH-
R3N RX R4+NX-
