原子物理学,第五章多电子原子
原子物理第五章 多电子原子泡利原理

例:两电子分别处于f 态和d 态,则 l1 3 , l2 1 ,合成总
轨道角动量为 Pl , 由于l1>l2,所以L的取值总数为2l2+1=3。那么L=4、3、2。
Pl1 12 Pl2 2 L 4 , 3 , 2
PL L(L 1) 20 , 12 , 6
3P2
总轨道
L=2 1D2
l1 1 , l2 2 L3 , 2 ,1
L=3
1F3
3D3 3F4
单态
S=1
3P1
3P0
3D2
3D1
3F3
3F2
三重态
•电子组态和原子态
例如:对于1s2p组态,由L-S耦合可以构成原子态3P2.1.0和1P1。 而对于3s3p组态,由L-S耦合可以构成原子态3P2.1.0和1P1。
5、一种电子态对应于多种原子态。 不仅氦 的能级和光谱有上述特点,人们发现,元素 周期表中第二族元素:
Be(4)、Mg(12)、Ca(20)、Sr(38)、 Ba(56)、Ra(88)、Zn(30)、Cd(48)、Hg(80) 的光谱都与氦有相同的线系结构。
谱线 能级
即
原子实+2个价电子。
由此可见,能级和光谱的形成都是二个价电子 各种相互作用引起的.
次壳层电子的数目
2(2l+1)
角动量 l
0
1
2
3
4
符号
s
p
d
f
g
状态数 2(2l+1) 2
6
10 14 18
壳层电子的数目
n1
Nn 22l 1 2n2 l 0
原子物理学 第五章 多电子原子:Pauli原理
,
1 2
0
大连理工大学物理系
原子物理学
pp组态
两个电子都处于l 1态
L—S耦合
s1
1 2
,s2
1 2
,l1
1,l2
1
S=0, 1, L 2,1,0
S=0 J= 2,1,0
1S0,1P1,1D2
大连理工大学物理系
原子物理学
S=1, L 2
J 3, 2, 1 3D3,2,1 S=1, L 1
构成6种相互作用:
G1 s1s2 、G2 l1l2 、G3 l1s1 G4 l2s2 、G5 l1s2 、G6 l2s1
G5 l1s2 、G6 l2s1 相互作用较弱
大连理工大学物理系
原子物理学
L—S耦合
G1 s1s2 、G2 l1l2
LS耦合一般出现大部分 原子中
大连理工大学物理系
大连理工大学物理系
原子物理学
4)选择规则
li
1
i
j—j 耦合
j 0, 1 J 0, 1
大连理工大学物理系
原子物理学
5)由电子的组态到原子态 ss组态
L—S耦合
s1
1 2
,s2
1 2
,l1
0,l2
0
S=0, 1, L 0
J 0,1
1S0,3S1
J—J耦合
s1
1 2
,s2
1 2
,l1
0,l2
原子物理学
J—J耦合
G3 l1s1 、G4 l2s2
由元素组态的能级实 际情况可判断原子态 属哪种耦合。
JJ 耦 合 一 般 出 现 在 某 些 高激发态和较重的原子 中
大连理工大学物理系
《原子物理学》(褚圣麟)第五章多电子原子

(1)重数最高的,亦即S值最大的能级位置最低;
(2)从同一电子组态形成的,具有相同S值的能级中那些具 有最大L值的位置最低。
2. 对于同科电子,即同nl,不同J值的诸能级顺序是:当同
科 电子数≤闭合壳层电子占有数一半时,以最小J值(|L-S|)
的能级为最低,称正常次序。同科电子数>闭层占有数之一 半 时,以最大J(=L+S)的能级为最低,称倒转次序。
第5章 多电子原子
耦合实质:产生附加的运动
PJ
PL
PL 2
PL1
PS 2
PS
LS耦合的矢量图
PS1
第5章 多电子原子
(5) 原子态的标记法
(S=0 )1 (S=1 )3
L 2S 1 J
L+1, L, L-1(S=1) L(S=0)
01234 S P DF G
第5章 多电子原子
例、(1)求nsn´p电子组态的原子态
一、电子组态 二、 L-S耦合 三、 氦原子能级和光谱 四、 j-j耦合
第5章 多电子原子
一、电子组态:
电子组态:
处于一定状态的若干个(价)电子的组合 (n1l1 n2l2 n3l3…) 。
例:氦原子基态: 1s1s
镁原子基态: 3s3s
第一激发态: 1s2s
第一激发态: 3s3p
两个电子之间的相互作用:
第一辅线系
~ P nD ~ P nD ~ P nD ~ P nD ~ P nD ~ P nD
r ps1
s1(s1 1),
r ps2
s2(s2 1)
它们耦合的总角动量的大小由量子数S表示为
r PS S(S 1)
原子物理讲义 第五章 多电子原子

第五章 多电子原子:泡利原理(YCS )§5-1 氦光谱和能级氦原子是1868年分析日全蚀光谱时发现的,30年后在地球矿物中找到.实验表明,氦及元素周期表第二族元素铍、镁、钙、锶、钡、镭、锌、镉、汞的光谱结构相仿.氦原子光谱的特点(详见P.213氦原子能级图)(氦能谱的以上4个特点分别包含着4个物理概念):1)明显地分成两套谱线系,左边一套为单层,右边一套多为三层;两套能级间无跃迁,各自内部的跃迁产生了两套独立的光谱.每一套都象碱金属原子光谱一样含有主线系,辅线系和伯格曼系等.但两套线系的构成截然不同.2)存在几个亚稳态,表明某种选择规则限制了这些态以自发辐射的形式发生衰变;3)基态01S 1与第一激发态13S 2间能量相差很大,为eV.7719;电离能也是所有元素中最大的,为eV .5824;4)在三层结构那套能级中没有来自2(1S)的能级.§5-2 电子组态和原子态1.电子组态:原子中各电子状态的组合描述一个电子的状态可用s l m m l n 、、、四个量子数.考虑电子的自旋-轨道相互作用,s l m m 、不再有确定值,则电子的状态用j j m l n 、、、描述.氢原子只有一个电子,在不考虑原子核运动时,电子状态就表示原子状态.对于碱金属原子,理论上可证明原子实的总角动量为0且不易被激发,被激发的只是价电子,可认为价电子的状态就表示碱金属原子状态.多电子原子则必须考虑电子间的相互作用,原子的状态是价电子运动状态的耦合.由于轨道运动的能量只取决于量子数l n 、,所以常用nl 来标记电子状态.例如:氢原子处于基态时,电子处于01=、=l n 的状态,记为s 1;氦原子处于基态时,两个电子都处于s 1态,则用两个电子状态的组合s 1s 1或21s 来表示;若一个原子有3个电子,其中两个处在0,2==l n 的状态,另一个处在1,2==l n 的状态,则电子组态为p s222.在给定的电子组态中,各电子的轨道角动量大小是确定的,但其轨道角动量和自旋角动量的方向不确定.因此每一个电子组态可耦合成若干原子态,由同一电子组态耦合成的不同原子态将且具有不同的能量,因为不同的角动量耦合产生的附加能量不同. 2.价电子间的相互作用价电子间的相互作用除电子自身的轨道与自旋耦合外,电子间的轨道与轨道、自旋与自旋、轨道与自旋等角动量都要发生耦合作用.如两个价电子间可有6种耦合方式(如图示):),(),(),(),(),(),(126215224113212211s l G s l G s l G s l G s s G l l G 、、、、、.这6种耦合的强弱不等,一般情况下,65G G 、较弱可不考虑.下面考虑两种极端情况. 1)S L -耦合:21G G 、较43G G 、强得多,将两个轨道角动量和两个自旋角动量分别合成总轨道角动量L 和总自旋角动量S ,再将L 和S合成总角动量J .(S L -耦合对于较轻元素的低激发态成立,适用性较广)2)j j -耦合:43G G 、较21G G 、强得多,将各个电子的轨道与自旋耦合成各个电子的总角动量1j 和2j,再将其耦合成原子的总角动量J .(j j -耦合则较少见,只在较重元素的激发态中出现)对于多电子耦合的情况可记为:⎩⎨⎧==-==-J j j j l s l s l s j j JL S l l l s s s S L )())()((:),(),,)(,,(:3233221132132113.S L-耦合的原子态21l l L +=.L的大小为: 212121,,1,,)1(l l l l l l L L L L --++=+= 21s s S +=.S 的大小为:⎩⎨⎧=±=+=01,)1(21s s S S S S原子的总角动量S L J+=,量子数S L S L S L J --++=,,1,对于具有两个价电子的原子,当L 给定时,对应于0,1==S S 的两种情况,J 的取值分别为:1)0=S时,L J =,表示原子只有一个可能的角动量状态,所以是单态. 2)1=S 时,1,,1-+=L L L J ,所以原子是三重态.由以上分析知,具有两个价电子的原子都有单态和三重态的能级结构. 例:原子有两个价电子,其角动量状态分别为 21,2;21,12211====s l s l ,用S L-耦合确定其原子态.总自旋量子数1,0=S ,3,2,1=L ,则当0=S 时,3,2,1==L J ;原子态为11P 、21D 、31F当1,1==L S 时,⎪⎩⎪⎨⎧=012J ,原子态为⎪⎩⎪⎨⎧031323P P P ;当2,1==L S 时, ⎪⎩⎪⎨⎧=123J ,原子态为⎪⎩⎪⎨⎧132333D D D ;当3,1==L S 时,⎪⎩⎪⎨⎧=234J ,原子态为⎪⎩⎪⎨⎧233343F F F共有12种可能的原子态.为了简洁,可排列成右上表.S L-耦合方法用于氦原子,即可证实其状态.(此略) 4.j j -耦合组成的原子态当每个电子自身的自旋-轨道耦合作用强,而电子间的耦合作用很弱时,采用j j -耦合.设第i 个电子的轨道角动量和自旋角动量分别为i l 和i s ,则第i 个电子的总角动量为i i i s l j +=,按量子力学规则,每个电子的总角动量的量子数为:ii i i i i i s l s l s l j --++=,,1,原子的总角动量为:21j j J +=其大小为)1(+=J J J ,212121,,1,j j j j j j J --++=j j -耦合组成的原子态常用符号J j j ),(21表示.如pd 电子组态形成的原子态为:1,22,30,1,2,31,2,3,4)23,21(;)25,21(;)23,23(;)25,23(,也是12种可能的原子态.结论:同一电子态,用S L -耦合形成的原子态与用j j -耦合形成的原子态的个数相等.5.两个角动量耦合的一般法则(以轨道角动量为例说明)⎪⎪⎩⎪⎪⎨⎧--++=+=+=+=⇒+=21212122211121,1,,)1()1()1(l l l l l l l l l L l l L l l L L L L其中若21l l >,则l 共有)12(2+l 个取值.(见下例)例:两个电子的角动量为⎩⎨⎧-=-=⎩⎨⎧==101101z ,112111,,m ,,m l l l l 方向的投影分别为在.因角动量相加只要将其投影值相加即可(详见教材中例子).6.电子组态变动的跃迁选择定则: 原子中各电子的量子数之和∑il为偶(奇)数时原子具有偶(奇)宇称.辐射跃迁只能发生在不同的宇称状态之间.即:偶宇称态⇔奇宇称态 7.耦合的选择定则:S L -耦合的选择定则:⎪⎩⎪⎨⎧→±=∆±=∆=∆)00(1,010除外J L Sj -j 耦合的选择定则:⎩⎨⎧→±=∆±=∆)00(1010j 除外,,J耦合的选择规则决定了氦原子的能谱.由于S L -耦合中0=∆S ,决定了氦的两套能级间不可能发生相互跃迁.对于氦,两个价电子的原子态有单态(0S =)和三重态(1S =)两类,选择定则0=∆S 要求两类能级之间不能发生跃迁(须注意0=∆S 这一规则并非对所有原子适用),好像这两类能级属于不同原子一样,因而产生两套谱线系.人们把产生单重线的叫仲氦,产生多重线的叫正氦.实际上,仲氦是两电子自旋取向相反(0S =)的氦原子,而正氦是两电子自旋取向相同(1S =)的氦原子.氦原子之间可通过相互碰撞来交换能量,这不必服从选择规则,故正常的氦气是“正氦”与“仲氦”的混合.关于氦的三重态谱线,有著名的黄色3D 线,1868年8月18日在太阳日珥的光谱中观察到这条线,从而发现了氦.用高分辨仪器可看出此线有三成分.从光谱看三重态和单态间没有跃迁,有一条很弱的06.591A =λ的线,最初认为是氦的三重态和单态间间的跃迁,后来证实这是氖的谱线.§5-3 泡利不相容原理1.历史回顾:玻尔对元素周期系的解释作了很多工作,曾特别讨论了氦原子内层轨道的“填满”问题,关于为什么每一轨道上只能放有限数目电子的问题,玻尔猜测:“只有当电子和睦时,才可能接受具有相同量子数的电子”,否则就“厌恶接受”.(牵强解释)泡利于1921年(时年21岁)涉足原子内电子的填充问题,他意识到,元素周期系的背后隐藏着一个重要的原理.至1925年,泡利通过对原子光谱和强磁场内的塞曼效应的分析,建立了他的不相容原理,使玻尔的解释有了牢固的基础.1940年泡利又证明了不相容原理对自旋为半整数的粒子不是附加的新原理,而是相对论性波动方程的必然结果. 2.不相容原理(1925年):在一个原子中不可能有两个或两个以上的电子具有完全相同的四个量子数(s l m m l n ...),即原子中的每一个状态只能容纳一个电子.另一种更普通的表述:在费米子(自旋为21的奇数倍的微观粒子)组成的系统中,不能有两个或更多的粒子处于完全相同的状态.(电子、质子、中子等均为费米子)泡利不相容原理是微观粒子运动的基本规律之一.利用它可解释原子内部的电子分布状况和元素周期律.泡利不相容原理反映的这种严格的排斥性的物理本质是什么?至今仍是个谜. 3.泡利不相容原理的应用1)氦原子的基态按L -S 耦合规则,氦的基态应有01S 和13S 两个态,但实际上只有1S ,这是因为两个电子的lm l n ,,相同(0,0,1===l m ln ),但s m 必定不能相同之故,不可能出现三重态13S .2)原子的大小玻尔曾认为原子的半径随Z 的增大而减小(核外电子都要占据能量最低的轨道,故受到的引力相等;Z 增大,核外电子受到的引力增大导致离核的距离减小).这是错误的.按泡利原理,虽第一层的轨道半径小了,但电子是分层排列的,但轨道层数增加了,原子的大小随Z 而变的变更甚微.所以原子的大小几乎都一样.(这是经典物理和旧量子论解释不了的)3)金属中的电子对金属加热过程中,核与核外电子得到的能量不均匀,几乎全由原子核得到.为什么?金属中,要使底层电子得到能量而激发十分困难,因为它附近的能态已被占满.而加热1万度才能给电子约1eV 的能量,但实际上,当加热到几百度时,金属的晶格点阵就被破坏而熔解了.所以金属中除最外层电子能从加热中得到少许能量外,其余能量均被核吸收了.4)原子核内独立核子运动按泡利原理,密度甚高的原子核内,基态附近的状态均被占满,核子之间没有相互碰撞,表现为独立的运动. 5) 核子内的有色夸克基本粒子中约95%的粒子为强子,强子的性质比较有规律,这说明强子的内部结构有相似之处.在海森堡的核子同位旋概念、坂田昌一(1956年)的强子内部对称性模型基础上,1961年美国的盖尔曼和奈曼提出对强子进行分类的“八重法”,据其理论预言的重子-Ω于1964年被实验所证实.盖尔曼进一步的研究使他提出了“夸克模型”,使这种对称性理论得到真正的进展.盖尔曼用具有一定对称性的上夸克(u )、下夸克(d )和奇异夸克(s )替换了坂田模型中的三种粒子.夸克是自然界中更为基本的物质微粒,所有的强子都由这三种夸克u 、d 、s 及其反粒子粲夸克(c )、底夸克(b )和顶夸克(t )组成.人们推测具有相同性质的粒子必定成批出现的,并且根据已知的一些粒子的性质可以预见尚未发现的其它粒子.夸克模型能成功地解释许多事实,把曾经很复杂的问题简单化了.夸克是自旋为21的费米子,设这三个夸克均处于基态,当两个夸克的自旋方向确定后,第三个夸克的取向必与前两个中的一个相同,这显然违反了泡利原理.但这种危机并未发生,这是因为基于夸克有适当的全同粒子的对称性,人们以红、绿、蓝三种颜色作为描写夸克量子状态的量子数(即三维自由度),解决了这一问题,并由此生发了描述强相互作用的量子色动力学. 4.同科电子*n 和l 相同的电子称同科电子.由于受泡利原理的限制,同科电子形成的原子态要少得多,这是因为对于同科电子,本来可能有的角动量状态由于泡利原理被去除了,从而使同科电子产生的状态数目大大减少.例如:0111S s s →,而1301,21S S s s →斯莱特图解法:例如:具有相同n 的两个电子,其组态为2np ,依泡利原理,两组量子数),,,(s l m m l n 不能全同,因1,0±=l m 有3个取值,21±=s m 有两个取值,则得到可能的l m 和s m 的取值见表26.1(教材P.223)(注意:经典物理中两个粒子可区分,但量子物理中两个全同电子是不可区分,不可加以“标记”的,这是经典物理与量子物理的原则区别之一)将表26.1数据用LS M M -图表示,图中每一小方块相应于不同的L S M M -值,方块中数字代表状态数,(a )一共有15种可能的状态,与表相符.(b)、(c)、(d)分别代表三种态项.3np 组态的电子合成的态项详见P.225.同科电子的态项与非同科电子的态项(详见P.225表)§5-4 元素周期表1.元素性质的周期性19世纪中叶人们已认识到元素的许多性质随着原子核的电荷数Z 的增加呈周期性的变化,这是原子结构随Z 的增加而呈周期性变化的结果.如摩尔体积、熔点、线胀系数、原子光谱、电离能等.元素的电离能随Z 的变化关系(详见P.226图示):表明元素的化学性质的周期变化特性. 2.元素周期表人们将化学性质相近的金属元素和卤族元素分别列为两个元素族.1869年,门捷列夫提出元素周期表,将当时所知道的62个元素按原子量(现在认识到应按原子序数)增加的次序排列,则原子的属性表现出有规律的重复,从而完成对所有元素的分族.当时有不少空缺的元素尚待发现,但可预言这些未知元素的性质.1874-1875年,化学家据预言发现了三个元素:钪、镓、锗,随后又陆续发现一些,元素周期表不断得到充实.到目前这止,公认的共109种元素.元素周期表中,每行称为一个周期,共有七个周期.同一列的元素称为一族,同族元素具有具有相似的化学性质和物理性质.左起第一族为碱金属,化合价为正1价,原子光谱都具有双重结构,电离能最小.第二族为碱土金属,化合价为正2价,原子光谱有单重和三重结构两套线系.最右一族为惰性气体,化学性质不活泼,电离能最大.元素周期表提出后的50余年内.人们不能对元素的周期性做出满意解释.玻尔在提出氢原子的量子理论后,就致力于周期表的解释.他凭直觉提出原子内的电子是按壳层排列的,同一壳层的电子具有相同的主量子数n.他的设想被证实,但他未说明为什么每一壳层只能容纳一定数量的电子.直至1925年泡利提出不相容原理后,才认识到元素的周期性是电子组态的周期性反映,而电子组态的周期性则联系于特定轨道的可容性.这样,化学性质的周期性用原子结构的物理图象得到了说明,使化学概念“物理化”,化学不再是一门和物理学互不相通的学科了.3.原子中电子的壳层中结构(结合元素电离能随Z 而变的规律分析)决定原子壳层结构(即电子所处状态)的两条准则: 1)泡利不相容原理.它决定壳层中电子的数目.2)能量最小原理.体系能量最低时,体系最稳定,它决定壳层的次序. 元素周期表就是按以上两条准则排列的.主量子数n 决定能量的主要部分,n 相同的电子分布在一个壳层上, ,3,2,1=n 的壳层分别称为K,L,M,N,O, …壳层.n 一定时,角量子数可取n 个值,对应于1,,3,2,1,0-=n l的支壳层分别用s,p,d,f,g,h …表示.l一定时,s m 有两种取向,l m 有)12(+l )种取值.因此每一角量子数为l 的支壳层中最多可容纳的电子数为:)12(2+=l N ln 一定时,)1(,,2,1,0-=n l ,共有n 个取值,因此每一壳层最多可容纳的电子数为:2122)12(22)12(2n n n l N n l n =-+=+=∑-=各支壳层和壳层中最多可容纳的电子数(见表)电子壳层的填充:按泡利原理从能量最低的状态开始填充,填满最低能态后才依次填充更高的能态.一般说来,n 越小或n 一定时l 越小,则能量越低. 某一特定壳层的电子能量,不仅取决于n ,还与l 有关,实际判断原子能级高低的经验规则:1))(l n +的值相同,则n 小的能级低;2) )(l n +的值不同,若n 相同,则l 小的能级低;若n 不同,则n 小的能级低.具体次序为: p d f s p d f s p d s p d s p s p s s 7,6,5,7,6,5,4,6.5,4,5,4.3,4,3.3,2,2,14.原子基态对于某一特定的原子,可按照其Z 确定其电子组态.一个电子组态可合成若干原子态,需按照泡利原理选出物理上允许的原子态,然后按洪特定则确定这些原子态的能量次序.其中能量最低的即为原子基态.1) 洪特定则(1925提出的经验规则):同一电子组态形成的原子态,(1)具有相同L 值的能级中, S 值最大(即重数最高)的能级位置最低;(2)具有相同S 值的能级中,具有最大L 值的能级位置最低.针对同科电子的洪特附加定则:对于同一l 值而J 值不同的能级,有以下两种情况 1)正常次序:当同科电子数小于或等于闭壳层占有数的一半时,具有最小J 值的能级(即SL -)处在最低;2)倒转次序:当同科电子数大于闭壳层占有数的一半时,具有最大J 值的能级(即SL -)处在最低2)朗德间隔定则:在三重态中,一对相邻能级间的间隔与两个J 值中较大的那个值成正比. 3)矢量合成法对由同科电子构成的组态,考虑到必须遵从泡利原理,通常不直接用S L-耦合的方法,而用合成投影合成法.要点如下:(1)按洪特定则,同科电子填入同一支壳层时,表现为尽可能以相同方向的自旋分别填入lm 不同的态,写出各电子的自旋量子数的值,求出总的自旋量子数:∑===Ni siS m M S1(2)在不违背泡利原理的前提下(即同科电子的si m 和li m 不全同),将各同科电子可能取的轨道磁量子数lim 的最大值相加,即得原子基态的总轨道量子数:∑===Ni li L m M L1(3)按洪特定则,决定原子基态光谱项的总角动量量子数,最后写出原子基态的光谱项.5.电离能变化的解释He 2:同一壳层的两个电子都受到e 2+的库仑力作用,结合能都很大;Li 3:由于静电屏蔽作用,最外层电子只受到e 1+的库仑力作用,且外层电子距核较远,结合能较小;而内层的两个电子受到e 3+的库仑力作用,其结合能较He 2中的电子要大;Be 4:最外层的两个电子受到e 2+的库仑力作用,…可见,随着壳层的增加,外层电子的结合能依次增高.如右图所示,Na 11的外层电子只受到一个有效正电荷的作用,而Ar 18外层的8个电子中的每一个都受到8个有效电荷的作用,因此,Ar 18要远比Na 11稳定.。
第5章多电子原子

如:氦原子基态: 1s1s 或 1s 2 镁原子基态: 3s3s 或 3s 2
第一激发态: 1s2s 第一激发态: 3s3p
具有两个价电子的原子, 具有两个价电子的原子,除基态外, 除基态外,所有能级都是一个电子 留在最低态, 另一个电子被激发所形成的。 留在最低态 ,另一个电子被激发所形成的 。单电子激发.
h 2π
PJ = J ( J + 1)
2.原子态符号
( j1 j 2 ) J
3.跃迁选择定则
∆j = 0, ±1
∆J = 0,±1
(0 → 0除外)
例4 用 j −
解:
j 耦合确定例2中 pd 电子组态的原子态。
l1 = 1, s1 =
1 3 1 , j1 = , 2 2 2
l 2 = 2, s 2 =
2.电子组态与能级的对应关系 2.电子组态与能级的对应关系
组态的主量子数和轨道角量子数不同, 组态的主量子数和轨道角量子数不同,会引起能量的差异; 会引起能量的差异; 如1s1s 与 1s2s对应的能量不同;1s2s 与1s2p对应 的能量也不同。 一般来说, 一般来说,主量子数不同, 主量子数不同,引起的能量差异较大, 引起的能量差异较大,主量子 数相同, 轨道角量子数不同, 引起的能量差异相对较小一些。 数相同 ,轨道角量子数不同 ,引起的能量差异相对较小一些 。
G3 和 G4 较强于 G1 和 G2
j − j 耦合
PJ = Pj1 + Pj2
推广到更多的电子系统:
j − j : ( s1 , l1 )( s2 , l2 )⋯ = ( j1 , j2 ⋯) = PJ
第五章多电子原子

❖
17、儿童是中心,教育的措施便围绕 他们而 组织起 来。上 午11时15分58秒上午11时15分11:15:5821.7.23
❖ 2、Our destiny offers not only the cup of despair, but the chalice of opportunity. (Richard Nixon, American President )命运给予我们的不是失望之酒,而是机会之杯。二〇二一年六月十七日2021年6月17日星期四
28
(5)洪特定则
每个原子态对应一定的能级。由多电子组态形成的原子态 对应的能级结构顺序有两条规律可循:
洪特定则: 从同一电子组态形成的诸能级中, (1)那重数最高的,亦即S值最大的能级位置最低; (2)从同一电子组态形成的,具有相同S值的能级中 那些具有最大L值的位置最低。
*对于同一L不同J的能级次序: 当最小J值(|L-S|)的能级
15
一、电子组态:
电子组态: 处于一定状态的若干个(价)电 子的组合(n1l1 n2l2 n3l3…) 。
例:氦原子基态: 1s1s
镁原子基态: 3s3s
第一激发态: 1s2s
第一激发态: 3s3p
两个电子之间的相互作用:
1# n1l1s1=1/2
l1
G3 l1, s1
s1
Gl1,l2
G5l1,s2
PS S(S 1)
其量子数S取值限定为
s1 s2; s1 s2 1 s1 s2
当ss11
s2取2s2 s2取2s1
1个值 1个值
PSz mS
mS取从 S到S共2S 1个值
21
当s1=s2=1/2时:
S=0, ms=0
原子物理学课件--第五章

• 为什么电子组态一定,有两套能级?
–两个电子,给定电子组态 合成的原子态分为两类: 一类为三重态,自旋平行(S=1) 一类为单一态,自旋反平行(S=0)
5.2.5.由电子组态到原子态(5)
• L-S 偶合与 j-j 偶合
– L-S偶合一般适用于较轻的原子和低激发态; – j-j偶合一般适用于较重的原子和高激发态
两种耦合得到的J值相同
两种耦合得到的原子态数相同
5.2.5.由电子组态到原子态(3)
• 例三: L-S 耦合pd 组态
l1 1, l2 2;
s1 s2 1/ 2
J 4,3, 2 3 F4 , 3 F3 , 3 F2 1 J 3 F3 J 3, 2,1 3 D , 3 D , 3 D 3 2 1 1 D2 J 2 J 2,1, 0 3 P , 3 P , 3 P 2 1 0 1 P 1 J 1
ml1 1, 0, 1 ml2 1, 0, 1
ml ml1 ml2
l l1 l2 , l1 l2 1,L ,| l1 l2 |
l1 = 1, l2 = 1 l = 2, 1, 0
5.2.4.选择规则(1)
• L-S 耦合选择规则
S = 0 L = 1 J = 0 , 1 ( 0 0 的跃迁除外)
5.1.3.理解能级图(2)
• 电子组态一定,有两套能级:
–单一态(S = 0),三重态(S = 1) –三重态能级小于单一态能级
• 选择定则: S 0
–单重态和三重态之间无跃迁; –套内跃迁两套线系: 仲氦(单一态), 正氦 (三 重态)
5.1.3.理解能级图(3)
• 三重态中,无 (1s)2 13S1 态 • 存在亚稳态
原子物理学第5章 多电子原子

2 1 2
G3 (l1 , s1 )
4
2
2
5 1
2
6
2
1
两个电子的自旋相互作用: 两个电子的自旋相互作用: 两个电子的轨道相互作用: 两个电子的轨道相互作用 一个电子的自旋轨道相互作用: 一个电子的自旋轨道相互作用
G1 ( s1 , s2 )
G2 (l1, l2 )
G3 (l1 , s1 )
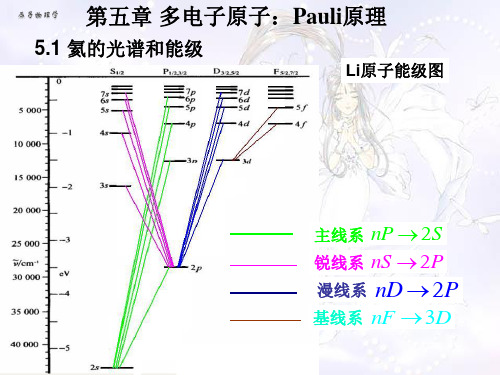
漫、基线系由六条谱线构成
氦原子的光谱由两套 谱线构成, 谱线构成,一套是单层 另一套是三层, 的,另一套是三层,这 两套能级之间没有相互 跃迁, 跃迁,它们各自内部的 跃迁便产生了两套独立 的光谱, 的光谱,早先人们以为 有两种氦, 有两种氦,把具有复杂 结构的氦称为正氦, 结构的氦称为正氦,而 产生单线光谱的称为仲 氦,现在认识到只有一 种氦, 种氦,只是能级结构分 为两套。 为两套。
第二辅线系: 第二辅线系:
六个成份Βιβλιοθήκη n≥3n≥3~ ν =23P0,1, 2 n3S1
三个成份
基线系: 基线系:
~ ν =33 D1 n 3F2 ~ 2 ν =3 D2 n 3F2,3 ~ 3 3 ν =3 D3 n F2,3, 4
六个成份
n≥4
三、能级和能级图的特点
1、能级分为两套,单层和三层能级间没有跃迁;氦的基态是 能级分为两套,单层和三层能级间没有跃迁; (1s1s)11S0; 2、状态(1s1s)13S1不存在,且基态(1s1s)11S0和第一激发态 状态(1s1s)1 不存在,且基态(1s1s)1 之间能差很大, 19.77eV; (1s2s)23S1 之间能差很大,为19.77eV;电离能也是所有元素中最 大的, 24.58eV; 大的,为24.58eV; 态都是单层的; 3、所有的3S1态都是单层的; 4、(1s2s)21S0和(1s2s)23S1是氦的两个亚稳态;(不能跃迁到更低能 是氦的两个亚稳态;( ;(不能跃迁到更低能 级的状态称为亚稳态,当原子处在亚稳态时, 级的状态称为亚稳态,当原子处在亚稳态时,必须将其激发到更高 能,方可脱离此态回到基态) 方可脱离此态回到基态) 5、一种电子态对应于多种原子态。不仅氦的能级和光谱有上述特 一种电子态对应于多种原子态。 点,人们发现,元素周期表中第二族元素的光谱都与氦有相同的 人们发现,元素周期表中第二族元素的光谱都与氦有相同的 线系结构。 线系结构。 由此可见,能级和光谱的形成都是二个价电子各种相互作用引起的。 由此可见,能级和光谱的形成都是二个价电子各种相互作用引起的。
中科大原子物理第五章 多电子原子(甲型)-2011

1s3p
1s3d
3D 1D
偶 宇 称
1s3p 1s4p He II (2S1/2)
1P° 1P°
2 1 0 3 2 1 2 1 1
185564.5620 185564.5840 185564.8547 186101.5463 186101.5488 186101.5930 186104.9668 186209.3651 191492.7120
eV
1
7.62
7 6
4s 6s 5s
S0
6p 5p 4p
1
P1
1
D2
6d 5d 4d 3d
1
F3
6f 5f 4f
3
S1
6p 5p 4p
3
P2
3
P1
3
P0
3
D3,2,1
3
F4,3,2
6f 5f 4f
cm -1 0
6s 5s
6d 5d 4d 3d
5000 10000
5
4s
3p
20000 30000
4.3 4
电子组态,Configuration
2s 1s 1s 1s 1s 2p
1s1s或1s2
1s2s
1s2p
3p
1s
3d
1s
1s3p
1s3d
球对称中心力场近似下的波函数
• 近似地认为原子中的电子是以核为中心、 并呈球对称分布的 • 每一个电子受到的所有其余电子的排斥作 用,就可以用这些电子所形成的球对称平 均势场对该电子的作用代替 • 每一个电子所受到的总作用,就等效于原 子中核的中心势场以及其余N-1个电子的 球对称平均势场对该电子的作用之和。
原子物理学_第五章-final
F3 2,3,4
j-j耦合
一个电子的轨道运动和另
G6 (l2s1) 一个电子自旋的相互作用
两个电子自 旋相互作用
G1 (s1s2)
G5 (l1s2)
较弱,可 以忽略
相互作用
两个电子轨 道相互作用
G2 (l1l2)
G4 (l2s2)
G3 (l1s1)
一个电子的轨道运动和它 自己的自旋的相互作用
j-j耦合
j-j耦合 (1)一个电子的自旋角动量和轨道角动量的耦合
j1 s1 l1
| s1 |
s1(s1 1) ,
s1
1 2
| l1 | l1(l1 1) , l1 0,1, (n 1)
| j1 |
j1( j1 1) ,
j1
l1
s1
l1
1 2
j-j耦合 (2)另一个电子的自旋角动量和轨道角动量的耦合
在1868年的一次日食观测时,法国天文学家皮埃尔·詹逊首次在太 阳的光谱中位于钠的谱线附近发现了这种发出黄色谱线的物质。
1895年,美国地质学家希尔布兰德观察到钇铀矿放在硫酸中加热 会产生一种不能自燃、也不能助燃的气体。他认为这种气体可能是氮 气或氩气,但没有继续研究。
拉姆赛(W.Ramsay)得知后,重复了实验,从钇铀矿中分离出 了氦,又请英国光谱专家克鲁克斯帮助检验,首次证明了在地球上也 存在这种元素。1895年3月,拉姆赛在《化学新闻》上首先发表了 在地球上发现氦的简报,同年在英国化学年会上正式宣布这一发现。
,
l1 1
p态电子:s2
1 2
,
l2 1
S= 0
1
L=0 1S0 1 1P1
2
1D2
第五章多电子原子

§5.3 原子的壳层结构
一. 原子的电子组态
由于在中心力场近似下,原子的势能函数具有球对称性,所 以原子的能量与Z轴的取向无关。
电子的能量和整个原子的能量由量子数 (ni , li ) 确定
可以用主量子数和角量子数表示原子状态的主要差别。
电子组态: 原子中各个电子所处状态 (ni , li ) 的集合。 nL
能量最小原理
外壳层电子先填充能级低的支壳层,
能量最低原理填充原则: (1)n+l 相同,先填n小的; (2)n+l不同,n相同,先填l小的;
n不同,先填n大的
能级高低的经验公式n+0.7l
不同支壳层中电子结合能 随原子序数的变化p175
三. 元素周期表
1869年,门捷列夫首先提出元素周期表。指出把元素按原子量 的顺序排列起来,它们的性质显示出周期性的变化。后来,人 们发现正确的排列顺序是把元素按核电荷数排列成元素周期表, 其物理、化学性质将出现明显的周期性。同族元素的性质基本 相同。
ni li
§5.2 泡利不相容原理
一.全同粒子波函数对称性
全同粒子(Identical Particles):
具有完全相同的内禀性质(如静止质量、电荷、自旋和平均 寿命等)的粒子。
全同性原理: 全同粒子具有不可分辨性。
考虑由两个全同粒子组成的系统 (1,2) (r1, sz1 ; r2 , sz2 ) 由全同性原理 (1,2) 2 (2,1) 2
➢ 各壳层所能容纳的最大电子数
n, l 相同的次壳层: Nl 2(2l 1)
ni、li 、mi 和 msi
n 1
n 相同的主壳层 : Nn 2(2l 1) 2n2
第五章 多电子原子

多电子原子
① LS耦合
S 0 L 0,1 J 0,1(0 0除外)
J p 0
② Jj偶合
或对换
j 0,1 J 0,1(0 0除外)
多电子原子 例、锌原子(Z=30) 的最外层电子有两个基态时的组态是 4s4s ,当其中有一个被激发,考虑两种情况:
j (0,2) 21D2
多电子原子
洪特定则:从同一电子组态 形成的能级中 (1)重数最高即S值最大的 能级位置最低; (2)重数相同即具有相同S 值的能级中,那具有最大L值 的位置最低。 朗德间隔定则:能级的二相 邻间隔同有关的二J值中较大 那一值成正比 例 3 P 三个能级的两个间隔 0,1, 2 (能级差)之比等于1:2 ;
3.轨道磁量子数
表示轨道角动量在外场方向的投影:
ml 0 1 2 3
l
ms
2l 1
4.自旋磁量子数
表示自旋角动量在外场方向的投影:共2个。
h Ps m s 2
1 ms 2
多电子原子 三、各壳层所能容纳的最大电子数 1.n、l相同的次壳层:
Nl 2(2l 1)
多电子原子 jj 耦合中得到的原子态也是4个
多电子原子
由元素组态的 能级实际情况 可判断原子态 属哪种耦合。 JJ耦合一般出 现在某些高激 发态和较重的 原子中 碳、硅、锗、 锡、铅在ps 组态中能级 的实际情况。
多电子原子
5.3 泡利原理与*同科电子
一、泡利不相容原理
在一个原子中,不可能有两个或两个以上的电子处在同一
在具有两个或两个以上价电子的原子中,状态的辐 射跃迁具有选择性。本节将陈述一套概括的选择定则, 即适用单电子原子,也适用多电子原子。
原子物理第五章

上页
下页
返回
结束
主线系: 主线系:
~ ν =11 S 0 −n1P1
基线系
第一辅线系: 第一辅线系: ν = 2 P 第五章 多电子原子 −n D2 1 ~ =31D −n1F ν 2 3 第二辅线系: ~ 第二辅线系: ν = 21P − n1S
1 1
~
1
0
三层能级 主线系(三个成分) 主线系(三个成分)
上页
下页
返回
结束
第五章 多电子原子
电势: =24.47伏特 =7.62伏特 电 离 电势: 氦=24.47伏特 镁=7.62伏特 第一激发态: =19.77伏特 =2.7伏特 第一激发态: 氦=19.77伏特 镁=2.7伏特 足见氦的基态是一个很稳定的结构。 足见氦的基态是一个很稳定的结构。
上页 下页 返回 结束
第五章 多电子原子
小
结:
1、氦和镁的光谱结构基本相同,因为都是二电子体系所产生的。 、氦和镁的光谱结构基本相同,因为都是二电子体系所产生的。
2、它们之间有些差异正反映了原子结构之间的差异。 、它们之间有些差异正反映了原子结构之间的差异。
上页
下页
返回
结束
第五章 多电子原子
§ 5.2 具有两个价电子的原子态
He:Z=2 He:Z=2 Be:Z=4 Be:Z=4=2×12+2 Mg:Z=12 12= )+2 Mg:Z=12=2×(12+22)+2 Ca:Z=20 20= )+2 Ca:Z=20=2×(12+22+22)+2 )+2 Sr:Z=38 38= Sr:Z=38=2×(12+22+32+22)+2 Ba:Z=56=2×(12+22+32+32+22)+2 Ba:Z=56= )+2 56 Ra:Z=88 88= )+2 Ra:Z=88=2×(12+22+32+42+32+22)+2
原子物理学第五章多电子原子
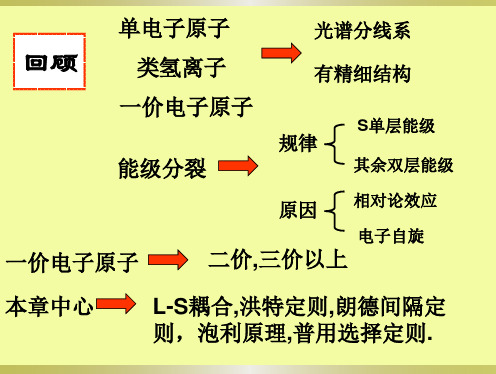
回顾
类氢离子
光谱分线系 有精细结构
一价电子原子
规律
能级分裂
S单层能级 其余双层能级
一价电子原子
原因 相对论效应
电子自旋
二价,三价以上
本章中心
L-S耦合,洪特定则,朗德间隔定 则,泡利原理,普用选择定则.
第五章 多电子原子
5.1氦及碱土金属的光谱和能级
碱土金属:Be,Mg,Ca,Sr,Ba,Ra,Zn,Ge,Hg,两个活跃的价电子
L = 0, S = 0 J = 0 1S0
可证 (1s)(1s) 3S1状态违反泡利原理
[例2] (1s)(2s) 组态的耦合
可耦合出状态 (1s)(2s) 3S1 (1s)(2s) 1S0
[例3] (1s)(2p) 组态的耦合
l1 = 0, l2 =1 L = 1 s1 =1/2, s2 =1/2 S = 1,0 L = 1, S = 1 J = 2,1,0 L= 1, S = 0 J = 1
j1 j2 1 1 原子态:
J
j1
j2
11 22
1
原子态:
j1 j2 1 0
(
3 2
,
1 2
)
2
(
1 2
,
1 2
)1
(
3 2
,
1 2
)1
(
1 2
,
1 2
)
0
两个价电子p和s在 j - j 耦合中形成的能级:
j
ps
分
裂
分裂为四条
31 J ( 2 , 2 )1
分
2.LS耦合下的原子态符号表示:
原子物理第五章

3Hale Waihona Puke 3P2朗德间隔定则
关于能级间隔的规律:在一个多重能级的结构中, 能级的二相邻间隔同有关的二J值中较大那个成正比。
EJ 1 EJ 2 L, S J 1
对于有的情况,LS耦合模型并不是很好的近似,
则朗德间隔定则就遵守得不好。
例如,由Si原子基态组态3 p 得到的 3 P 态中J=2,1,0。
np 组态通过LS耦合的三 例如, 3 个原子态是 1D , 3 P 和 1S ,其中, P的 S=1最大,它的能量最低,如图所示 2 是Si原子基态组态 3 p ,形成的三个 原子态,其中 3 P 态确实能量最低。 因此Si原子基态应为3 p 2 3P 。
再如,nd 2 组态的五个原子态中 3 P 和 3 F 的S=1最大,其中 3 F 的L=3比 3 P 的L=1大,因此,3 F 态能量最低。
洪特定则
1925年,洪特(Hund)提出了一个规则来判断其最低 能量项(基态),称为洪特定则,它只适用于LS耦合。可 以表述为:由同一个电子组态形成的能级中,S值最大的能 级位置最低;S相同的能级中,L值最大的能级位置最低; (对于同科电子) 当价电子数小于半满时,多重态中J值最 小的能量最低,当价电子数大于半满时,J值最大的能量最 低。 洪特定则是作为经验规律提出来的,应用量子力学可 以对它作出解释。这个定则只能判断LS耦合的各个原子态 中的最低能量状态,不能用来判断其他光谱项之间的能量 高低。大多数原子的基态可以用LS耦合来讨论,因此利用 洪特定则可以确定原子基态的量子数。
解:由电子的自旋及轨道总角动量量子数的表达 式可知,自旋总角动量量子数为S=1,0;轨道总角动 量量子数为L=1,2,3。进而可以得到总角动量量子 数J。如下表
原子物理学 第5章 多电子原子

0 即L 0的投影 1 即L 1的投影 1 2 即L 2的投影 1 0
l l1 l 2 , l1 l 2 1, l1 l 2
Manufacture: Zhu Qiao Zhong
由此图知, l 的取值的确是
第五章 多电子原子:泡利原理
20
6.电子组态变动的跃迁选择定则
6种耦合的强弱不等,一般情况 下G5、G6较弱,可不考虑.
Manufacture: Zhu Qiao Zhong
s1
G2
第五章 多电子原子:泡利原理
10
3.LS耦合的原子态
LS耦合: G1、G2较G3、G4 强得多时. 主要的耦合作用发 生在不同电子之间. LS耦合对于较轻元素的低 激发态成立,适用性较广. J L2
17
对于多电子耦合的情况可记为:
L S : ( s1 , s2 , s3 )( l1 , l 2 , l 3 ) ( S , L) J j j : ( s1 l1 )( s2 l 2 )( s3 l 3 ) ( j1 j2 j3 ) J
结论 1)同一电子态,LS耦合或jj耦合形成的原子态的数 目相等.即原子态的数目完全由电子的组态决定. 2)两个电子组合耦合后的状态总是分为两类:对应 于自旋平行的三重态和对应于自旋反平行的单态.
ji l i si , l i si 1, , l i si 原子的总角动量为: J j1 j2 J J ( J 1)
J j1
l1 s2 s1 l2
第五章 多电子原子:泡利原理
总量子数: J j1 j2 , j1 j2 1, , j1 j2 jj耦合组成的原子态:
( j1 , j2 ) J
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
空间为何会弯曲 那么,四维时空是否会弯曲呢?从常识看,说空间会弯曲似乎是天方夜谭。然而, 广义相对论告诉我们,大质量物体会引起时空弯曲。再次拿二维平面做类比,假设世 界是一张拉平的橡皮膜; 把一个大质量铅球放到膜上,橡皮膜便凹陷下去,出现明 显的弯曲;原本在膜上做直线运动的小质量高尔夫球到达这一区域,便会改变运动轨 迹,在弯曲空间做曲线运动。 同样道理,大质量物体也会造成四维时空的弯曲。质量越大,弯曲程度越大,相 关数据可用广义相对论的引力场方程算出来。在弯曲时空中,如果存在虫洞,人类进 入后就可能完成‚星际穿越‛。影片中几名宇航员乘飞船在虫洞中只过了一会儿,就 到达了另一个星系。 回到过去是否可能 虫洞不但是星际穿越的管道,还可能是‚时间隧道‛。实验已证明,在强引力场 或高速运动状态下,时间流逝会变慢。卞毓麟解释说,如果A点和B点相距20光年,而 虫洞让人用1年时间就从A点到达B点,那么他就超越了光速。比光运动得更快,使人 能够‚追‛上已逝去的光景,重见早先的情形,也就是回到了过去。 卞毓麟表示,虫洞在自然界中是否存在,科学界尚无定论,至少目前还未发现虫 洞存在的证据。通过虫洞能否回到过去,也是理论物理学界争论的一个问题。反对者 提出‚外祖父悖论‛:如果一个人回到过去,在他母亲出生前杀死外祖父,娶了外祖 母,那么他到底是谁?‚回到过去会扰乱因果律,而人们相信因果律是这个世界的普 遍规律。《星际穿越》中男主角看到了小时候的女儿和他争吵的场景,却无法改变他 当时做出的决定,避免了‘外祖父悖论’。‛
氦原子基态:
镁原子基态:
1s1s
激发态:
1s2s,1s2p,1s3s,
1s3p, ……
简记:3s 2 激发态: 3s3 p, 3s 4s, 3s3d ,......
1s 2 2s 2 2 p6 3s 2
电子组态仅反映了电子轨道运动的特征(库仑相互作用 );
对同一电子组态,即使库仑相互作用相同,但由于自旋-轨道 相互作用的不同,具有不同的总角动量,所以会产生不同能 量的原子状态。
一、光谱
分成主线系、 第一辅线系、 第二辅线系等, 每个线系有两 套谱线。 二、能级
He原子的能级 也分为两套, 一套是单层的, 一套是三层的。
1.单层能级之间跃迁产生一组谱线
~ 11S n1P 主线系: 0 1
n2
~ 21P n1S 第二辅线系: 1 0 ~ 31D n1F 基线系:
按量子化要求,总角动量量子数 J 如下确定:
J L S , L S 1,......, L S
当L>S时,每一对L和S共有2S+1个J值; 当L<S时,每一对L和S共有2L+1个J值.
S 0 时, J L
S 1 时, 如 L 0 则 J 1
如
L0
则
J L 1, L, L 1
3 1 4.存在两个亚稳态 (1s2s) S1,(1s2s) S0
5.电子组态相同的,三重态能级总低于单一态相应的能级;三重 能级结构中,同一 值的三个能级, 值大的能级低(倒转次 序)
j
这五个特点包含着五个物理概念。
二.Mg 原子光谱和能级
Mg 原子光谱和能级结构与He原子相似,也有差异。
5.2 具有两个价电子的原子态 一.电子组态
例题:电子组态nsnp,在j-j 耦合情况下,求可能的原子态。 电子组态nsnp:s1=1/2, l1=0;s2=1/2, l2=1 所以 j1=1/2, j2=1/2,3/2。
j2=1/2,
3/2
j1=1/2 (1/2,1/2)1,0,(1/2,3/2)2,1 与LS耦合下的原子态数和总 角动量J相同
4.朗德间隔定则
在L-S 耦合的多重态能级结构中,相邻的两能级间隔与 相应的较大的J 值成正比。因而两相邻能级间隔之比等 于两J值较大者之比。
例:
3 3
3 三个能级两个间隔之比为 2:1 P2 , 3P , 1 P 0
D1 , 3D2 , 3D3 三个能级两个间隔之比为 2:3 F4 , 3F3 , 3F2
一.He原子光谱和能级 He:Z=2 2+2 Be : Z=4=2 1 He及碱土金属原子光谱具有相仿的结构,具有原子光谱的一 2+22)+2 Mg : Z=12=2 (1 般特征,如:线状,谱线系。但也有特殊性。 Ca:Z=20=2(12+22+22)+2 1.两套光谱线系,两套能级 Sr:Z=38=2(12+22+32+22)+2 Ba:Z=56=2(12+22+32+32+22)+2 两套光谱线系都分别有类似碱金属原子光谱的主线系,一辅 系,二辅系,柏格曼系等。 Ra:Z=88=2(12+22+32+42+32+22)+2
2.两个电子间自旋-轨道相互作用的方式
G1 ( s1 , s2 ) G2 (1 , 2 )
G3 (1 , s1 ) G4 ( 2 , s2 )
自旋-自旋相互作用 轨道-轨道相互作用 自旋-轨道相互作用
G5 (1 , s2 ) G6 ( 2 , s1 )
一般来说, G5 (1, s2 ) 、 G6 ( 2 , s1 ) 比较弱,可以忽略。
L=0 1 2
3.LS耦合下的洪特规则
每个原子态对应一定的能级。由多电子组态形成的原子态 对应的能级结构顺序有两条规律可循: 洪特定则:1. 从同一电子组态形成的诸能级中, (1)那重数最高的,亦即S值最大的能级位置最低; (2)具有相同S值的能级中那些具有最大L值的位置最低。 P154 图5.4
2. 对于同科电子,即同nl,不同J 值的诸能级顺序是:当 同科 电子数≤闭壳层电子占有数一半时,以最小J 值(|L -S|)的能级为最低,称正常序。同科电子数>闭层占有数 的一半 时,以最大J(=L+S)的能级为最低,称倒转序。
S s1 s2
L 1 2
按量子化要求,量子数 L , S 如下确定:
L 1 2 , 1 2 1,......, 1 2
S s1 s2 , s1 s2 1,......, s1 s2 1, 0
J LS
j1 1 s1, 1 s1 1,...., 1 s1 j2 2 s2 , 2 s2 1,...., 2 s2 J j1 j2 , j1 j2 1,...., j1 j2
量子数:
2.j-j耦合下原子态标记
( j1 , j2 ) J
2.LS耦合下的原子态符号表示:
2 S 1
LJ
当 S 1,
3
J 2,1,0
例:ps电子组态形成的原子态
1 1 1, 2 0, s1 s2 2
3 3 P , P , P 2 1 0 三个原子态
当 S 0, J 1
1
S 1, 0 L 1
P 1 原子态
例题:求3p4p电子组态形成的原子态 S=1,0; L=2,1,0 S=0 (1S0) 1P 1 (1D2) S=1 3S 1 (3P2,1,0) 3D 3,2,1
176道激光模拟土星超高压强 压垮钻石 这个实验相当于把钻石‚放进‛土星 内核中,科学家观测被‚挤扁‛了的 钻石,就能增进对外星内核的了解。 学术杂志《自然》7月16日发表文章 称,科学家用176道激光模拟土星内 核的超高压强,集中挤压地球上最坚 硬的物质——钻石,将其轻松压垮。 科学家在美国国家点火装置(NIF)用激光集中照射一块几平方毫米的钻石,形成与 土星内核相当、约为地核压强的14倍的超高压强。钻石则被碾压到了前所未有的密度。 人类正忙于探索外星,而土星等星球的引力较大,内核压强也更高,可能影响物质结 构。这个实验相当于把钻石‚放进‛土星内核中,科学家观测被‚挤扁‛了的钻石,就能 增进对外星内核的了解。 美国国家点火装置共有198个激光发射器,本次实验动用了其中的176个,发出76万 焦耳的能量,在钻石内部诱发压力波,形成5兆帕(5000万帕斯卡尔)——相当于土星内 核——的超高压强,用来碾压钻石,并观测其变化。 论文第一作者雷 史密斯博士说:‚我们不知道木星和土星内核是什么模样,不过我 们头一次有机会研究在这种极端的压强和温度情况下的状况。我们的实验可以模拟太阳系 内外那些庞大星球的内部环境……而钻石——地球上已知最难以压缩的物质——照样被压 缩到了前所未有的密度。‛
1.电子组态的表示
处于一定状态的若干个(价)电子的组合 n11n2 2 n3 3 ....
Na : 基态电子组态: 1s 2 2s2 2p6 3s1
激发态电子组态:
简记:3s
1
1s 2s 2p 3p 2 2 6 1 1s 2s 2p 4s
2
2
6
1
简记: 3p 简记:4 s
1
1
................
3 ~ 2 P 第二辅线系: 0,1, 2 3
六个成份 n 3
n3
n S1
n4Biblioteka 三个成份~ 33D n3F 1 2 ~ 32 D n3F 2 2,3 ~ 33D n3F 3 2,3, 4
基线系:
六个成份
1.两套光谱线系,两套能级
2.两套能级间不产生跃迁
3 (1 s 1 s ) S1 态 3.不存在
J 1 2 s1 s2
G1, G2 G3 , G4 G3 , G4 G1 , G2
两种极端情形 : L-S 耦合 j-j 耦合
二、L-S 耦合
G1, G2 G3 , G4
L
J
2
1.耦合方式
1
s2 s1
S
LS耦合的矢量图
四.两种耦合模型的比较
