猪Ⅰ型口蹄疫FMDV-Ⅰ酶联免疫分析
猪口蹄疫的分析诊断和防控措施

口蹄疫(FMD)是偶蹄动物的一种高度传染性病毒病,本病以发热及口腔内、鼻口部、乳头和蹄部等部位出现水疱为重要特征。
易感动物发病率近100%。
除幼畜外,该病很少致死。
该病毒能感染所有野生和家养偶蹄动物,但主要感染牛和猪;绵羊和山羊常不作为严重的被感染对象。
该病是食用性动物的一种极重要的疾病,尤其对我国养猪业的影响较大,由FMD引起的经济损失巨大。
1病原FMD病毒是典型的小RNA病毒。
已发现7个不同血清型,分别称为O、A、C、SAT1、SAT2、SAT3和亚洲1型。
不同血清型病毒的基因差异大,而且同一血清型也存在许多不同的病毒亚型。
FMD病毒可在动物分泌物和产品中长期存活。
在>50℃条件下,该病毒被灭活,并对酸(pH<6.5)和碱(pH>10)敏感。
FMD对脂溶剂有抗性,1%的氢氧化钠被推荐作为该病暴发后的环境消毒剂。
多种动物对FMD病毒易感,并引起发病。
在家畜中,牛和猪最常被感染。
易感的实验动物有豚鼠、乳鼠、大鼠、家兔和仓鼠。
一些毒株已在鸡胚、一日龄雏鸡和几种禽类体内增殖。
FMD病毒能在多种牛、绵羊、地鼠肾细胞、兔和鼠细胞上复制。
2流行该病主要发生在发展中国家,大多数发达国家已没有该病。
在非洲、南美洲、欧洲部分地区和亚洲,FMD呈地方流行性。
北美和中美、英国、日本、澳大利亚、新西兰等地区目前已无FMD,虽然该地区的许多国家以前曾严重暴发,最近还有一些发生。
在以前无FMD的地区暴发后扩散很快,这是由于该病毒具有高度传染性,而且潜伏期短,感染动物的呼吸道分泌大量病毒,该病毒在环境中相对稳定。
病毒可通过直接接触、空气、排泄物及可能的节肢动物媒介传播。
可从全身的分泌/废弃物(眼泪、鼻、唾液、尿、粪、乳汁、精液和流产胎儿的胎盘)中分离到病毒。
在这类分泌物中,病毒的存活依赖于pH和温度。
FMD可通过感染动物或其产品远距离传播,在冷冻条件下,FMDV可存活3个月,在火腿、熏肉和某些香肠中可达2个月。
口蹄疫、猪瘟、高致病性猪繁殖与呼吸综合征三种疫苗同步两点免疫的临床应用

口蹄疫、猪瘟、高致病性猪繁殖与呼吸综合征三种疫苗同步两点免疫的临床应用施开创1,覃 勇2,尹彦文1,唐云姣2,黄百花2(1. 广西动物疫病预防控制中心,广西南宁 530001;2. 百色市动物疫病预防控制中心,广西百色 533000)摘 要:为评估猪口蹄疫(FMD)、猪瘟(CSF)、高致病性猪繁殖与呼吸综合征(HP-PRRS)疫苗不同免疫程序的免疫效果,2014—2016年广西省百色市在原有“333法”免疫程序(即FMD、CSF、HP-PRRS疫苗先后间隔14 d免疫)的基础上,采用“332法”(即先用FMD和CSF疫苗同时在颈部两侧注射,间隔14 d后再用HP-PRRS疫苗注射)和“321法”(即将CSF和HP-PRRS疫苗混合为1针在颈部一侧注射,FMD疫苗单独在颈部另一侧注射)免疫程序进行免疫;应用ELISA方法检测FMD、CSF和HP-PRRS抗体,应用RT-PCR方法检测FMD、CSF和HP-PRRS病原,并统计分析生猪免疫密度、发病率、死亡率、抗体阳性率、病原阳性率、免疫副反应率等指标。
结果显示:与“333法”免疫程序相比,“332法”和“321法”的HP-PRRS免疫密度和抗体阳性率显著提高(P<0.05),HP-PRRS病原阳性率、生猪发病率、死亡率显著下降(P<0.05);与“332法”免疫程序相比,“321法”的HP-PRRS免疫密度显著提高,病原阳性率以及生猪发病率、死亡率显著下降(P<0.05)。
结果表明:3种免疫程序的FMD、CSF免疫效果无显著差异,但HP-PRRS免疫效果差异显著;HP-PRRS免疫效果中,“332法”和“321法”均优于“333法”,而“321法”又优于“332法”。
因此,“321法”值得广泛推广应用。
关键词:口蹄疫;猪瘟;高致病性猪繁殖与呼吸综合征;免疫程序;田间应用;评估中图分类号:S851.3 文献标识码:A 文章编号:1005-944X(2018)04-0076-06DOI:10.3969/j.issn.1005-944X.2018.04.020Clinical Application of Simultaneous Two-point Immunizationwith Three Vaccines for FMD,CSF and HP-PRRSShi Kaichuang1,Qin Yong2,Yin Yanwen1,Tang Y unjiao2,Huang Baihua2(1. Guangxi Animal Disease Prevention and Control Center,Nanning,Guangxi 530001,China;2. Baise Animal Disease Prevention and Control Center,Baise,Guangxi 533000,China)Abstract:In order to evaluate the immune effects of different vaccination procedures for Foot-and-mouth disease(FMD),Classical swine fever(CSF)and Highly pathogenic porcine reproductive and respiratory syndrome(HP-PRRS),on the basis of the original immunization procedure of “333 method”(FMD,CSF and HP-PRRS vaccines were injected at 14-day intervals),135 townships in Baise City of Guangxi Zhuang Autonomous Region changed to adopt the“332 method”(FMD and CSF vaccines were simultaneously injected at different sides of the neck,HP-PRRS vaccine was injected 14 days later)and“321 method”(CSF and HP-PRRS vaccines were mixed together and injected in one side of the neck,FMD vaccine was simultaneously injected in another side of the neck)during 2014 to 2016. Then antibodies against FMD,CSF and HP-PRRS were detected by ELISA,while the pathogens of FMD,CSF and HP-PRRS were detected by RT-PCR. At last,the assessment indexes,including vaccination density,morbidity rate,mortality rate,antibody positive rate,pathogen positive rate,vaccination side-reaction rate and so on,were counted and analyzed. The results showed that,compared with the“333”procedure,the HP-PRRS vaccination density 基金项目:广西科学研究与技术开发计划项目(桂科转14125004-22);广西科技重大专项(桂科AA17204057)2018年第35卷第 4 期and antibody positive rate increased significantly(P<0.05)by the“332”and“321”vaccination procedure,accordingly,the HP-PRRS positive rate,morbidity rate and mortality rate decreased significantly. Compared with the“332”procedure,HP-PRRS vaccination density increased significantly(P<0.05)by the“321”procedure,and the HP-PRRS positive rate,morbidity rate and mortality rate decreased significantly(P<0.05). The results indicated that among the three vaccination procedures,there was no significant difference in immune effects of FMD and CSF,while there was significant difference in the immune effect of HP-PRRS. For the immune effect of HP-PRRS,both“332”and“321”procedures were better than“333”procedure,and“321”procedure was better than“332”procedure,therefore,the“321”procedure should be widely promoted and applied.Key words:FMD;CSF;HP-PRRS;vaccination procedure;field application;evaluation口蹄疫(Foot-and-mouth disease,FMD)、猪瘟(Classical swine fever,CSF)、高致病性猪繁殖与呼吸综合征(Highly pathogenic porcine reproductive and respiratory syndrome,HP-PRRS)是当前严重危害养猪业的重要疫病。
猪口蹄疫FMD酶联免疫分析ELISA
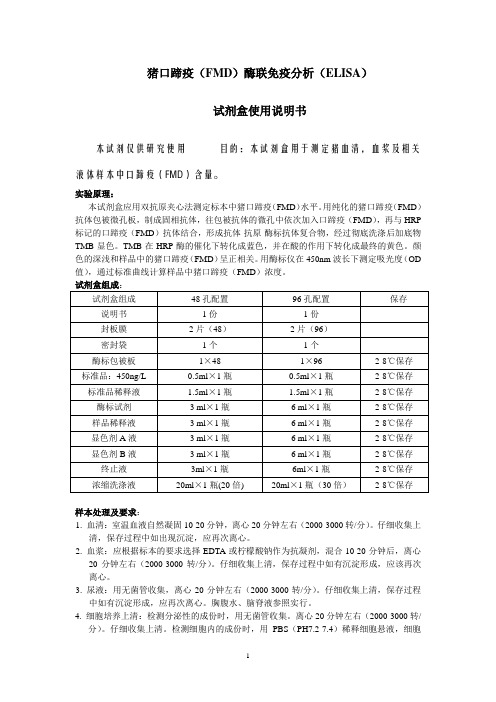
猪口蹄疫(FMD)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定猪血清,血浆及相关液体样本中口蹄疫(FMD)含量。
实验原理:本试剂盒应用双抗原夹心法测定标本中猪口蹄疫(FMD)水平。
用纯化的猪口蹄疫(FMD)抗体包被微孔板,制成固相抗体,往包被抗体的微孔中依次加入口蹄疫(FMD),再与HRP 标记的口蹄疫(FMD)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的猪口蹄疫(FMD)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD 值),通过标准曲线计算样品中猪口蹄疫(FMD)浓度。
试剂盒组成:样本处理及要求:1. 血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
2. 血浆:应根据标本的要求选择EDTA或柠檬酸钠作为抗凝剂,混合10-20分钟后,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应该再次离心。
3. 尿液:用无菌管收集,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应再次离心。
胸腹水、脑脊液参照实行。
4. 细胞培养上清:检测分泌性的成份时,用无菌管收集。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
检测细胞内的成份时,用PBS(PH7.2-7.4)稀释细胞悬液,细胞浓度达到100万/ml左右。
通过反复冻融,以使细胞破坏并放出细胞内成份。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
保存过程中如有沉淀形成,应再次离心。
5. 组织标本:切割标本后,称取重量。
加入一定量的PBS,PH7.4。
用液氮迅速冷冻保存备用。
标本融化后仍然保持2-8℃的温度。
加入一定量的PBS(PH7.4),用手工或匀浆器将标本匀浆充分。
猪口蹄疫疫苗的免疫反应观察

迟发型
02
注射疫苗后数天开始出现免疫反应。
长期型
03
ቤተ መጻሕፍቲ ባይዱ
注射疫苗后免疫反应持续数周或数月。
04
结论与讨论
结论概述
猪口蹄疫疫苗的免疫反应观察 表明,疫苗接种对猪的免疫应 答和健康状况具有积极影响。
疫苗接种可以显著降低猪口蹄 疫的发病率和死亡率,并提高 猪群的免疫力。
免疫反应观察结果表明,疫苗 接种对猪的健康状况和生产性 能没有负面影响。
猪口蹄疫疫苗的免疫反应观 察
2023-11-11
• 实验准备 • 实验过程 • 实验结果 • 结论与讨论 • 参考文献与致谢
01
实验准备
实验材料
01
02
03
猪口蹄疫疫苗
选择高质量的疫苗,确保 其抗原含量、纯度、佐剂 等指标符合实验要求。
免疫注射器具
选择适合猪只大小的注射 器,确保注射深度和部位 准确。
05
参考文献与致谢
参考文献
孟晓平. 猪口蹄疫疫苗的免疫反应观 察[J]. 农业科技与信息, 2020(10): 34-36.
陈芳. 猪口蹄疫疫苗在不同接种方式 下的免疫效果比较[J]. 中国畜牧兽医, 2018(6): 18-24.
王晓林. 猪口蹄疫疫苗的研制与应用 [J]. 动物医学进展, 2019(5): 23-27.
张军. 猪口蹄疫疫苗的安全性评价与 合理使用[J]. 兽医导刊, 2019(9): 4649.
致谢对象及内容
感谢国家自然科学基金对本研究的资助。 感谢实验室的同学们在实验过程中的帮助与支持。
感谢导师对本研究的精心指导与支持。 感谢饲养员对实验动物的精心照顾与喂养。
THANKS
感谢观看
猪口蹄疫(FMD)的鉴别和预防及治疗措施

猪口蹄疫(FMD)的鉴别和预防及治疗措施猪口蹄疫(FMD)的鉴别和预防及治疗措施(正大集团技术职能线二区昆明动保中心病理室罗银昌650301)口蹄疫(aphthae epizooticae ;food and mouth disease ,FMD)是由口蹄疫病毒引起的人畜共患的一中急性.,热性,高度接触性传染病,其主要的临床特征是在口腔黏膜,四肢下端及乳房等外皮肤形成水疱和烂斑。
该病只感染猪,牛,羊等偶蹄动物,但是传播迅速,流行面广,成年动物多取良性经过,幼年动物多因心机受损而死亡率比较高。
1 口蹄疫应与猪传染性水疱性口炎,猪传染性水疱性疾病相互区别:1.1 传染性水疱性口炎其特点流行范围小,发病率低,死亡则更少见,且马,骡,驴当蹄动物也能感染,必要是可以依赖动物进一步接种。
2.2 猪传染性水疱性疾病又称猪水疱病,本病仅猪易感染,牛,羊等动物则不感染。
解剖时猪水疱病无“虎斑心”的心肌变化,而口蹄疫,特别是仔猪发病时多大都具有这种典型的心脏病变。
2人与口蹄疫的关系口蹄疫病毒一般不传染给人,不会在人群中流行,人患口蹄疫病的主要传播途径大多是直接接触患病动物或挤奶时,病毒通过皮肤微小伤口进入人体发病,偶尔也可通过食用污染口蹄疫病毒的牛奶,奶酪,牛油或其它的乳制品而被感染发病,人与人之间很难很难相互传播。
根据资料(人感染口蹄疫的症状:发烧,呕吐,口腔组织发生红色溃疡腐烂(表面腐蚀性水疱),偶尔有皮肤小水疱。
口蹄疫病毒不耐热,只要在摄氏85度加热1分钟即可杀死,即只要充分加热烹食猪肉是没有问题的。
3 口蹄疫的特点3.1 发病特点猪口蹄疫主要是O型口蹄疫病毒引起的,具有明显的季节性,多发在的春寒冷的季节,在猪群中反复发生流行,对幼仔猪100%的发病,病死了80%,成年猪病死了不高;妊娠母猪发病可引起流产,部分死亡。
病猪和带毒猪是主要的传染源,经呼吸道,消化道及损伤的黏膜和皮肤而感染。
空气,人,及动物均可成为本病的传播媒介。
猪口蹄疫的诊断和防治方法探究

猪口蹄疫的诊断和防治方法探究
猪口蹄疫是一种瘟疫性疾病,对于养猪产业来说是一次灾难性的打击。
为了防止猪口蹄疫发生和传播,必须采取一系列有效的诊断和防治方法。
一、诊断方法
1. 临床症状法:普通性病症状表现是发热、不食、拉稀、呼吸急促,口、唇、鼻和蹄部肿大,溃疡路经形成,严重者出血等。
2. 实验室检测法:采用酶联免疫吸附试验(ELISA)、聚合酶链式反应(PCR)等方法进行检测,可保证快速、准确诊断。
3. 病原检测法:采取长螺旋体培养及培养基细胞中的特殊结构、酶学和血清学反应等方式,可有效检测病原体,有利于疾病的控制和治疗。
二、防治方法
1. 预防措施
(1)加强环境卫生:定期进行饲养场地和设施的消毒和清洗,降低细菌的数量。
(2)完善养猪管理制度:加强猪群保健,做好防疫措施。
(3)控制病媒传播:善于搜寻和消灭蚊虫、苍蝇等传媒,避免细菌通过传媒传播。
(4)分区分层管理:对于疫情高发地区,应该进行分区、分层管理,以防止疫情扩散。
2. 治疗措施
(1)尽早发现:猪口蹄疫发病以后,应及时对疫区进行调查,尽早发现病例。
(2)采取隔离措施:对于确诊病例应立即采取隔离措施防止病情发展。
(3)注射疫苗:针对猪口蹄疫的疫苗可有效防止猪患病。
(4)药物治疗:在疫情初期,药物治疗也是一种有效的治疗手段。
综上所述,猪口蹄疫是一种极其危害的疾病,需要养猪业者和相关管理部门共同努力进行预防和控制。
通过加强养殖环境卫生、完善养猪管理制度,以及及时发现病情并采取对应的防治措施,可以有效减少猪口蹄疫对猪群和养殖业的危害。
猪口蹄疫的诊断和防治方法探究

猪口蹄疫的诊断和防治方法探究猪口蹄疫是一种由病毒引起的猪类传染病,严重影响了猪的健康和养殖业的发展。
下面将探讨猪口蹄疫的诊断和防治方法。
一、猪口蹄疫的诊断方法猪口蹄疫的诊断方法主要包括临床观察、实验室检测和流行病学调查。
1. 临床观察猪口蹄疫的典型症状包括高热、厌食、蹄部红肿、溃疡和溃烂。
通过仔细观察猪群中是否有这些症状,可以初步判断是否存在口蹄疫的感染。
2. 实验室检测实验室检测是确定猪群中是否存在口蹄疫病毒的重要手段。
常用的实验室检测方法包括病毒分离、补体结合试验、酶联免疫吸附试验和PCR检测等。
病毒分离可以通过在感染猪体内提取病毒进行培养,观察是否存在病毒的生长,来确认猪群中是否存在口蹄疫病毒。
补体结合试验和酶联免疫吸附试验则通过检测感染猪体内是否产生了抗体,来判断是否存在口蹄疫的感染。
PCR检测则通过分析猪体内的核酸序列,来直接检测是否存在口蹄疫病毒。
3. 流行病学调查流行病学调查是诊断猪口蹄疫的重要手段之一。
通过调查猪群中是否存在相关症状、死亡率和临床表现的分布情况,以及与该病相关的环境因素和接触史,来初步判断是否存在口蹄疫的感染。
二、猪口蹄疫的防治方法猪口蹄疫的防治方法主要包括疫苗接种、隔离和卫生措施、杀菌消毒和宣传教育等。
1. 疫苗接种口蹄疫疫苗是防治口蹄疫的主要措施之一。
疫苗接种可以增强猪体的免疫力,减少猪群中的感染率和死亡率。
常用的口蹄疫疫苗有灭活疫苗和减毒疫苗两种,可以根据猪群的具体情况和疫情来选择适当的疫苗接种方法。
2. 隔离和卫生措施隔离和卫生措施是防治口蹄疫的关键措施之一。
在发现猪群中存在口蹄疫的感染时,应立即采取隔离措施,将感染猪与健康猪分开养殖,避免病毒的传播。
加强场地的卫生管理,定期清洗和消毒,可以有效地减少病毒的滋生和传播。
3. 杀菌消毒在猪群中存在口蹄疫的感染时,应及时进行杀菌消毒。
可以使用有效的消毒剂对猪栏、工具和设备进行彻底的消毒,以杀灭病毒和细菌,防止疫情的扩散。
生猪屠宰检疫中口蹄疫鉴别及诊断方法

生猪屠宰检疫中口蹄疫鉴别及诊断方法猪肉作为大众餐桌上的一大肉食种类,就像是人们对蔬菜水果有无农药残留的担忧一样,人们也会担心其是否健康。
当然,在1997年之后我国就对猪肉实行了定点屠宰,集中检疫的政策。
也就是说,居民在市场中购入的猪肉是经过安全检疫的,那么对于疫病检查的工作人员来说,如何更快,更准的对送检猪肉进行检查,保障人民的食品健康安全就成为了被研究的问题。
在对生猪的屠宰检疫中,会进行多项疫病的检验,其中就有口蹄疫病的检验。
本文以生猪屠宰检疫中的口蹄疫病为中心,深入分析实践中应当如何对口蹄疫病进行检查检验,希望能以此更好的投入检验工作中,为居民的餐桌安全保驾护航。
关键字:生猪屠宰;检疫;口蹄疫引言:随着人们经济水平的提升,大家对生活质量的要求一直在不断提高,“衣食住行”方方面面的安全都越来越受到人们的重视。
尤其是新冠疫情的爆发,为人们的饮食安全敲响了警钟,入口食品的安全性越来越受到人们的重视。
在非洲猪瘟之后,我国的猪肉市场价格也受到影响而节节攀升。
正是在这样的时候,猪肉的安全更加引起了人们的关注,检疫人员更加应当重视生猪屠宰检疫这一工作。
对于生猪屠宰检疫的技术分析有利于检疫工作的进行,更有利于保障人民的食品安全。
对口蹄疫的专项分析,更加有利于加强疫病检验人员的工作效率。
本文以生猪屠宰检疫中的口蹄疫为出发点,对口蹄疫进行介绍的基础上,将其与其他疫病的特征进行区分,以便于更好的了解口蹄疫病的特征,及时的进行诊断。
一、猪口蹄疫概述口蹄疫以其传播迅速和传染性强而闻名,一旦传播和爆发,往往会给畜牧业生产和畜产品贸易带来严重的影响。
世界动物卫生组织(OIE)将其列入A类烈性传染病,我国也将其划入严格控制、强制免疫的一类动物传染病。
1.口蹄疫的病原分析口蹄疫,英文全称foot and mouth disease,英文简称FMD,是一种由口蹄疫病毒感染偶蹄类动物而产生的疾病。
患有口蹄疫的動物会出现其口、足等部分部位出现水泡的现象。
ELISA法鉴定猪口蹄疫野毒与疫苗

ELISA法鉴定猪口蹄疫野毒与疫苗猪口蹄疫是由口蹄疫病毒引起偶蹄动物的一种急性、热性、高度接触性传染病,世界动物卫生组织(OIE)将该病列为A类家畜传染病之首,大多数亚洲、非洲、南美洲国家一直都通过注射灭活疫苗的办法来控制该病的流行。
从2001年英国暴发口蹄疫后,欧盟允许在暴发口蹄疫时进行疫苗的紧急接种。
因此,建立准确、快捷的鉴别口蹄疫野毒与疫苗的方法,对该病的控制、食品安全和进出口贸易十分重要。
以下就国内外ELISA法鉴别口蹄疫野毒与疫苗的技术介绍如下:中国农业科学院兰州兽医研究所朱彩珠等利用大肠杆菌表达的口蹄疫病毒(FMDV)非结构蛋白(NSP)3ABC多肽作为抗原,建立了一种可区分FMDV感染与接种灭活疫苗免疫牛的间接酶联免疫吸附试验(I-ELISA)。
通过对336份正常牛血清、508份注射疫苗牛血清、6O 份人工感染牛血清和58份豚鼠免疫血清的检测,确定了血清抗体阴性与阳性效价的临界值。
336份正常牛血清检测结果,特异性为98.21%;508份接种灭活疫苗1~2次后1~6个月的牛血清检测结果,特异性为98.62%;60份实验性感染牛血清的检测结果显示,I-ELISA 检出率为95.00%(按D值0.400为阳性统计)。
华中农业大学动物医学院阮力等利用大肠杆菌BL21(DE3)表达3B蛋白,建立了间接酶联免疫吸附试验(I-EIISA)区分口蹄疫病毒感染猪与注苗猪的方法。
上海市农业科学院畜牧兽医研究所潘洁等以大肠杆菌表达重组口蹄疫病毒非结构蛋白3AB为检测抗原,研制了口蹄疫病毒非结构蛋白ELISA检测试剂盒,该试剂盒可用于判定被检动物是否感染口蹄疫病毒。
在1746份免疫猪血清中,3AB-ELISA对免疫猪血清的特异性为98.68%;在1077份健康非免疫猪血清中,3AB-ELISA对健康非免疫猪血清的特异性为98.68%;在36份人工感染猪血清中,3AB-ELISA 对阳性检出率为100%。
猪亚洲l型口蹄疫免疫抗体检测与分析

猪亚洲l型口蹄疫免疫抗体检测与分析作者:邵胜勇来源:《畜牧兽医科学》 2018年第4期猪亚洲I型口蹄疫免疫抗体检测与分析邵胜勇(北京市顺义区动物疫病预防控制中心,北京 101300)摘要:口蹄疫是世界动物卫生组织(OIE)规定的A类烈性动物传染病,我国列为一类动物传染病。
口蹄疫共有7种血清型,亚洲I型是其中一种。
目前,国内还没有对猪亚洲I型口蹄疫进行强制免疫,我们通过2015-2017年对13958头猪进行亚洲I型口蹄疫免疫抗体的检测,旨在对本地区猪群通过免疫口蹄疫O型-亚I型疫苗产生的抗体进行监测,掌握群体免疫抗体水平,评价免疫疫苗的有效性,并对免疫效果进行总结,对生产中发现的问题进行分析,提出解决的对策。
方法为:猪群在免疫口蹄疫O型-亚洲I型二价灭活疫苗28d至4个月之间,免疫次数从一免至五免,采集猪血清,以亚洲I型口蹄疫抗体液相阻断ELISA检测试剂盒,定量检测样品抗体水品。
通过分析检测数据,得出如下结论:猪亚洲I型口蹄疫免疫抗体阳性率和抗体水平总体不高,但具备较好的保护力;商品猪免疫抗体阳性率和抗体水平均高于种猪;免疫抗体阳性率随免疫次数增加呈逐渐上升趋势,但四免后阳性率下降,到五免时则再次上升。
通过检测免疫抗体,分析其变化特征及规律,为猪亚洲I型口蹄疫的防控、研究及免疫提供依据。
关键词:口蹄疫;亚洲I型;免疫抗体;检测中图分类号:S858.28 文献标识码:B doi:10.3969/j.issn.2096-3637.2018.04.0021 方法1.1 疫苗疫苗均为口蹄疫O型-亚洲I型二价灭活疫苗,中牧实业股份有限公司兰州生药厂生产。
1.2 疫苗免疫及样品采集由于实际生产中不对猪进行亚洲I型口蹄疫单独免疫,因此免疫程序均按照口蹄疫O型-亚洲I型二价灭活疫苗的免疫程序进行免疫,即仔猪30日龄时首免,1个月后二免,之后每4个月免疫1次。
所检测血清样品均为免疫后28天至4个月以内的样品,免疫次数从一免至五免。
FMDV特性、感染机理以及免疫方案探讨

为8 3 个亚 型 。 口蹄 疫 的不 同 型 之 间 没有 交叉 免 疫 保 护
性 ,并 且 不 同 亚 型 之 间也 只 有 部分 交叉 免 疫 保 护 性 , 所 以 口蹄 疫 的 有 效 防 控 十 分 困 难 。 在 自然 条件 下 ,含 FMDV的 组织 和被 污 染 的饲 料 、饲 喂 用具 以 及土 壤 等 都 可 以使F MDV达 到 数周 到数 月 的感染 性 。
目前 已知 的 F M DV受 体 包 括 与 FMDV结 构 蛋 白
C 型 、南 非 1 型 、南 非2 型 、南 非3 型 和 亚 洲 1 型 。病 毒
极 易发生变异 ,在这个7 个 主型 之 下 ,至 少 还 可 以分
V P1 的G —H环 上 RG D基 序 相 互 作 用 的 四种 整 联 蛋 白
原 因。F MD V的非结构蛋白 ( N S P)是指 除了衣壳蛋
白1 A、 l B、1 C、 1 D和 它们 的 前 体 蛋 白之 外 的 所 有 由 病 毒 编 码 但 不 参 与病 毒 衣 壳 组 成 的 蛋 白 ,包 括 成 熟 蛋 白L、2 A、2 B、2 C、3 A、3 B、3 C、3 D以及 它 们 的前 体 。NS P参 与 病毒 的复 制 、多 聚 蛋 白的 裂解 和 病 毒 颗
1 . 2 F M D V  ̄ P 结构蛋白
FM DV粒 子 为 正 二 十 面 体 对 称 的 球 形 ,沉 降 系 数1 4 6 S,没 有 囊 膜 , 病 毒 粒 子 主 要 有 四 种 衣 壳 蛋 白 VP1 、VP2 、VP3 、VP 4 各6 0 个 拷 贝 组 成 ,这 也 是 目
猪口蹄疫的免疫与疫苗应用

口蹄疫(foot-and-mouth disease, FMD)是由口蹄疫病毒(foot-and-mouth disease Virus, FMDV)引起的一种急性、热性、高度接触传染性并可快速远距离传播的动物疫病,世界动物卫生组织(OIE)将其列为必须报告的动物疫病,我国规定为一类动物疫病。
其主要感染偶蹄兽,患病动物的口、舌、唇、蹄、乳房等部位发生水疱,破溃形成烂斑。
1 FMD-畜牧业的大敌猪、牛、羊等主要的家畜均可感染此病,并能形成大规模流行,该病的发病率几乎达100%,犊牛、仔猪以及动物发生恶性病型时,死亡率可达50%~100%。
由于该病传染性极强,对病畜和怀疑处于潜伏期间的同群动物必须紧急处理,对疫点周围的广大范围必须隔离封锁,禁止动物移动和畜产品调运流通。
由此导致该地区甚至该国家的畜产品进出口贸易停止,造成巨大的经济损失和政治影响。
2010年,日本因该病造成直接经济损失10亿美元,韩国11.41亿美元,是发达国家近10年来最严重的疫情。
我国每年因口蹄疫造成的损失平均在110亿~120亿元之间,约占畜牧业平均增加量的17%~18%。
FMDV 宿主广泛,变异性强,危害公共卫生;引起疫源争论,社会秩序混乱,进出口限制,造成不良社会影响;还是国际禁止生物武器核查对象,有一定军事危害。
2 病原口蹄疫病原是口蹄疫病毒,属小RNA 病毒科(Picornaviridae)口蹄疫病毒属(Aphthavirus),病毒粒子直径为20~25nm,呈大致的圆形或六角形,无囊膜。
FMDV 有A、O、C、SAT1、SAT2、SAT3以及Asia 1型7个血清型,猪口蹄疫的免疫与疫苗应用张淑刚,周绪斌(新疆天康畜牧生物技术股份有限公司,乌鲁木齐 830023)每个血清型又包含若干个亚型。
该病毒不仅在各型间没有交叉免疫性,同血清型的各亚型之间也仅有部分交叉免疫性[1]。
口蹄疫病毒在环境中有一定的存活能力,病毒在干燥粪便中存活14 d,泥浆中存活6个月,尿中存活39 d。
猪口蹄疫亚洲Ⅰ型病毒分离鉴定、VP1基因和疫苗免疫研究的开题报告

猪口蹄疫亚洲Ⅰ型病毒分离鉴定、VP1基因和疫苗免疫研
究的开题报告
猪口蹄疫是一种严重的病毒性疾病,可引起猪只的严重损失。
目前,已有多种疫苗在世界范围内得到了广泛应用,但口蹄疫病毒的不断变异和子型演化使得疫苗的有
效性受到影响。
因此,对猪口蹄疫病毒的分离、鉴定和疫苗的研究具有重要的理论和
应用价值。
本研究拟分离和鉴定猪口蹄疫亚洲Ⅰ型病毒,并对其VP1基因进行分析,探究其分异与演化规律。
同时,本研究将对相关疫苗进行研究,评估其抗体水平和保护率,
并比较其与目前常用疫苗的区别和优缺点。
具体研究内容包括以下几个方面:
1.从不同地域、不同年份的猪口蹄疫病原患者中收集样品,利用PCR方法对其进行检测,筛选出病原阳性样品,进行病毒分离和鉴定,确定其属于猪口蹄疫亚洲Ⅰ型
病毒。
2.设计并合成猪口蹄疫亚洲Ⅰ型病毒VP1基因特异性引物,对收集的样品进行基因扩增、测序和比对,分析其基因型与亚型的变异和演化规律。
3.选取多种疫苗,通过ELISA、中和试验等方法测试其在猪体内的抗体水平和保
护率,以及在不同时间、不同疫苗间的差异,比较其优缺点,为其在实际生产中的应
用提供参考。
预期研究结果将对口蹄疫的防控和疫苗的优化提供新的理论依据和实际应用价值。
猪口蹄疫的发病原因、临床症状和防治方法.doc

猪口蹄疫的发病原因、临床症状和防治方法概述:口蹄疫(Foot-and-mouthdisease,FMD)是由口蹄疫病毒(FMDV)引起的以患病动物的口、蹄部出现水疱性病症为特征的传染性疫病。
病原口蹄疫病毒对外界环境有较强的抵抗力,在干粪中病毒可存活14天,在粪浆中可存活6个月,在尿水中存活39天,在地表面,夏季存活3天,冬季存活28天。
口蹄疫病毒在动物组织、脏器和产品中存活时间较长。
在冷冻存放中,在脾、肺、肾、肠、舌内至少存活210天。
冷藏(4℃)胴体产酸能在3天内杀死病毒,但淋巴结、脊髓和大血管血凝块的酸化程度不够,如肌肉pH5.5时,附近淋巴结仍在pH6以上。
病毒可在淋巴结和骨髓中存活半年以上。
口蹄疫病毒对酸、碱、氧化剂和卤族消毒剂敏感,可根据实际条件进行选用。
临床症状口蹄疫发病初始,猪往往出现精神抑郁、发热、流涎、跛行,但特征性症状是口、鼻、蹄及乳房等无毛部位出现水疱,继而水疱破裂,形成溃疡、结痂,痂块脱落后形成斑痕。
防治措施国内外对口蹄疫防治积累了丰富经验,以下五项措施证明是有效的: 1.扑杀病畜及染毒动物扑杀动物的目的是消除传染源,病毒是最主要的传染源,其次是隐性感染动物和牛、羊等持续性感染带毒动物。
疫情发生后,可根据具体情况决定扑杀动物的范围,扑杀措施由宽到严的次序可为病畜→病畜的同群畜→疫区所有易感动物。
2.免疫接种目的是保护易感动物,提高易感动物的免疫水平,降低口蹄疫流行的严重程度和流行范围。
现行油佐剂灭活疫苗的注射密度达80%以上时,能有效遏制口蹄疫流行。
疫苗接种可分为常年计划免疫、疫区周围环状免疫和疫区单边带状免疫。
实施免疫接种应根据疫情选择疫苗种类、剂量和次数。
常规免疫应保证每年2~3次,每头份疫苗含3PD50以上。
紧急预防应将每头份疫苗提高到6PD50,并增加免疫次数。
3.限制动物、动物产品和其他染毒物品移动目的是切断传播途径。
小到一个养猪户,大到一个国家,要想保持无口蹄疫状态,必须对上述动物和物品的引入和进口保持高度警惕。
猪口蹄疫免疫抗体检测及防治措施

猪口蹄疫免疫抗体检测及防治措施
段俊英
【期刊名称】《中国畜禽种业》
【年(卷),期】2013(009)010
【摘要】口蹄疫(Foot-and-mouth disease,FMD)属于小RNA病毒科,口蹄疫病毒属,该病毒目前有O、A、C、SAT1、SAT2、SAT3(即南非1、2、3型)和Asia1(亚洲1型)7个血清型。
各型之间几乎没有免疫保护力,感染了一型口蹄疫的动物仍可感染另一型口蹄疫病毒而发病。
我国流行的口蹄疫主要为O、A、C三型及ZB型(云南保山型)。
该病是由口蹄疫病毒(FMDV)引起的以患病动物的口、
【总页数】1页(P88)
【作者】段俊英
【作者单位】河南省新野县动物疫病防控中心 473500
【正文语种】中文
【相关文献】
1.猪O型口蹄疫不同免疫次数免疫抗体检测分析试验 [J], 哈莉
2.天水市2014-2017年猪O型口蹄疫免疫抗体检测与结果分析 [J], 王美菊;王玙;成小莉
3.猪瘟、猪蓝耳病、猪口蹄疫免疫抗体检测分析 [J], 杨娴婧; 李松刚
4.外调猪、牛和羊口蹄疫液相阻断ELISA免疫抗体检测方法的改进和应用 [J], 张
雁; 邢作志
5.通过猪口蹄疫抗体检测浅析当前免疫现状及其影响因素 [J], 靳玉舒
因版权原因,仅展示原文概要,查看原文内容请购买。
合理免疫猪口蹄疫疫苗,防止母源抗体干扰造成免疫失败

合理免疫猪口蹄疫疫苗,防止母源抗体干扰造成免疫失败一、口蹄疫基本介绍口蹄疫(FMD)是由口蹄疫病毒(FMDV)引起的一种烈性、高度传染性疾病,临床特征是在蹄部、口腔粘膜和雌性动物乳房皮肤出现水泡。
世界动物卫生组织(OIE)将其列为必须报告的动物传染病,一但发生和流行,对养猪生产危害很大。
FMDV有7个血清型:O型,A型,C型,亚洲1型,南非1型、2型、3型,而同一个血清型中,又包括大量不同的毒株。
不同血清型之间没有交叉保护作用,而同一血清型的不同毒株之间也仅有部分交叉免疫性。
感染或接种一种血清型的FMDV无法抵抗其它血清型的感染。
FMDV血清型的分布具有明显的地域性,亚洲国家主要流行的血清型包括O型、A型与亚洲1型。
其中O型感染最为广泛,其次是A 型,亚洲1型很少见。
2005年世界口蹄疫参考实验室将全世界的O型口蹄疫划分为10个拓朴型(Topotype),常见的有东南亚型(缅甸98株)、中东南亚型(泛亚株)与Cathay(古典中国)型(猪毒毒株),当前我国流行的优势毒株属于缅甸98株。
二、免疫密度必须达到100%农业部将其列为强制免疫注射的首要病种。
为了有效防止猪口蹄疫的发生,每年的春秋两季都要进行强制免疫,要求应免动物的免疫密度达100%,免疫抗体合格率必须≧70%。
目前我国政府实施了推动FMD强制性免疫,在疫苗选择上,可选用政府免费提供的FMD疫苗,也可以使用商品化的高效FMD疫苗。
无论采用何种疫苗产品,免疫后的抗体水平监测与免疫效果评估都是必要的。
三、注意母源抗体的干扰猪口蹄疫的防疫是一项复杂而艰巨的工作,一些规模化猪场反映,使用猪O口蹄疫灭活疫苗进行免疫,即使母猪群每年免疫3-4次,仔猪群一生免疫2-3次,而到了生长育肥阶段抗体几乎全部为阴性,免疫完全失败。
为什么会出现这种现象?笔者怀疑很可能是我们猪场免疫程序不合理,由于母源抗体干扰所致。
母源抗体是指通过胎盘、初乳从动物母体直接传递给胎儿或新生动物的抗体。
用3AB-ELISA鉴别猪口蹄疫病毒感染与疫苗免疫猪的研究

用3AB-ELISA鉴别猪口蹄疫病毒感染与疫苗免疫猪的研究猪口蹄疫(FMD)是一种由病毒引起的急性、高度传染性的疾病,主要侵害猪、牛、羊和其他反刍动物。
这种疾病会导致生产力下降、经济损失,甚至危及食品安全。
病毒的传播速度快,传染性强,因而对其防控工作提出了很高的要求。
目前,疫苗预防与控制是最主要的手段之一,在疫苗接种后的猪群中,如何鉴别感染与疫苗免疫猪成为研究的一个热点问题。
本文旨在探讨3AB-ELISA鉴别猪口蹄疫病毒感染与疫苗免疫猪的研究成果。
猪口蹄疫病毒(FMDV)属于Aphthovirus属,是一种单股正链RNA病毒,拥有七个亚型:O、A、C、SAT1、SAT2、SAT3和Asia1。
FMDV的致病性主要依赖于其结构蛋白,包括VP1、VP2、VP3和VP4。
疫苗免疫猪的血清样本体内含有抗体,这些抗体与VP1蛋白有高度趋化。
而病毒感染后,3B蛋白(VPg)被释放并参与RNA合成,因此3AB蛋白非常重要。
3AB-ELISA是一种新型的鉴别方法,通过检测猪群血清中3AB蛋白的抗体水平,可以较为准确地鉴别感染与疫苗免疫猪。
研究表明,疫苗接种后,猪群血清样本中3AB蛋白的抗体水平会显著上升;而在疫苗未接种或感染后的猪群中,3AB蛋白的抗体水平较低。
3AB-ELISA成为了区分感染与疫苗免疫猪的一种有力工具。
除了3AB-ELISA,还有一些其他的方法可以用于鉴别感染与疫苗免疫猪。
病毒排除试验(Virus Isolation)和核酸检测(RT-PCR)可以直接检测病毒是否存在于样本中;血清中抗体水平的测定可以用于鉴别是否存在病毒感染或疫苗接种。
这些方法都存在一定的局限性,如Virus Isolation需耗时较长,RT-PCR可能会受到病毒突变的影响,抗体水平的测定需要建立严格的标准曲线和抗体水平。
与其他方法相比,3AB-ELISA有其独特的优势。
3AB-ELISA不仅可以鉴别疫苗免疫猪和感染猪,还可以在一定程度上区分不同FMDV亚型的感染,这对于疫情监测和溯源分析具有重要意义。
CSFV和FMDV共感染PK-15细胞的致病性研究

CSFV和FMDV共感染PK-15细胞的致病性探究猪病毒性疾病对农业产业和经济造成了严峻的恐吓。
猪瘟病毒(Classical Swine Fever Virus, CSFV)和口蹄疫病毒(Foot-and-Mouth Disease Virus, FMDV)是两种重要的猪病毒性疾病的病原体。
CSFV属于Flaviviridae家族,FMDV属于Picornaviridae家族。
这两种病毒在感染动物时可以引起严峻的致病性和经济损失。
本文将探讨这两种病毒共感染猪的肾细胞系(PK-15细胞)的致病性探究。
方法:1. 细胞培育:将PK-15细胞培育在含有DMEM培育基和10%胎牛血清的培育皿中, incubation在37℃的恒温培育箱内。
2. 病毒感染:将CSFV和FMDV分别注入PK-15细胞培育皿,使其共感染。
3. 细胞观察:利用显微镜对细胞进行观察,观察是否出现病毒感染的病态特征,例如细胞变形、细胞质内包涵体的产生等。
4. 细胞存活率检测:接受MTT法检测细胞存活率,评估病毒共感染对细胞的生存能力的影响。
5. 病毒复制和扩散探究:利用PCR技术和免疫荧光染色技术检测CSFV和FMDV在共感染PK-15细胞中的复制和扩散状况。
结果:1. 细胞观察:共感染后,PK-15细胞出现明显的病态特征,如变形、细胞质内包涵体的产生等。
2. 细胞存活率检测:共感染后,PK-15细胞的存活率明显下降,与单独感染相比,病毒共感染对细胞的生存能力产生了显著的影响。
3. 病毒复制和扩散探究:共感染后,CSFV和FMDV在PK-15细胞中得到了有效的复制和扩散。
谈论:通过本探究对CSFV和FMDV共感染PK-15细胞的致病性进行了探讨。
结果表明,CSFV和FMDV共感染对PK-15细胞产生了明显的病态特征,并且对细胞的生存能力产生了显著的影响。
此外,分子生物学检测结果显示,CSFV和FMDV在共感染细胞中得到了有效的复制和扩散。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
猪Ⅰ型口蹄疫(FMDV-Ⅰ)酶联免疫分析
试剂盒使用说明书
本试剂盒仅供研究使用。
检测范围:96T
2ng/L -90 ng/L
使用目的:
本试剂盒用于测定猪血清、血浆及相关液体样本中Ⅰ型口蹄疫(FMDV-Ⅰ)含量。
实验原理
本试剂盒应用双抗体夹心法测定标本中猪Ⅰ型口蹄疫(FMDV-Ⅰ)水平。
用纯化的猪Ⅰ型口蹄疫(FMDV-Ⅰ)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入Ⅰ型口蹄疫(FMDV-Ⅰ),再与HRP标记的Ⅰ型口蹄疫(FMDV-Ⅰ)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的Ⅰ型口蹄疫(FMDV-Ⅰ)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中猪Ⅰ型口蹄疫(FMDV-Ⅰ)浓度。
1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融
2.不能检测含NaN3的样品,因NaN3抑制辣根过氧化物酶的(HRP)活性。
操作步骤
1.标准品的稀释:本试剂盒提供原倍标准品一支,用户可按照下列图表在小试管中进行稀
释。
2.加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、
待测样品孔。
在酶标包被板上标准品准确加样50μl,待测样品孔中先加样品稀释液40μl,然后再加待测样品10μl(样品最终稀释度为5倍)。
加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。
3.温育:用封板膜封板后置37℃温育30分钟。
4.配液:将30倍浓缩洗涤液用蒸馏水30倍稀释后备用
5.洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30秒后弃去,如此
重复5次,拍干。
6.加酶:每孔加入酶标试剂50μl,空白孔除外。
7.温育:操作同3。
8.洗涤:操作同5。
9.显色:每孔先加入显色剂A50μl,再加入显色剂B50μl,轻轻震荡混匀,37℃避光显色
10分钟.
10.终止:每孔加终止液50μl,终止反应(此时蓝色立转黄色)。
11.测定:以空白空调零,450nm波长依序测量各孔的吸光度(OD值)。
测定应在加终止
液后15分钟以内进行。
操作程序总结:
计算
以标准物的浓度为横坐标,OD值为纵坐标,在坐标纸上绘出标准曲线,根据样品的OD值由标准曲线查出相应的浓度;再乘以稀释倍数;或用标准物的浓度与OD值计算出标
准曲线的直线回归方程式,将样品的OD值代入方程式,计算出样品浓度,再乘以稀释倍数,即为样品的实际浓度。
注意事项
1.试剂盒从冷藏环境中取出应在室温平衡15-30分钟后方可使用,酶标包被板开封后如未用完,板条应装入密封袋中保存。
2.浓洗涤液可能会有结晶析出,稀释时可在水浴中加温助溶,洗涤时不影响结果。
3.各步加样均应使用加样器,并经常校对其准确性,以避免试验误差。
一次加样时间最好控制在5分钟内,如标本数量多,推荐使用排枪加样。
4.请每次测定的同时做标准曲线,最好做复孔。
如标本中待测物质含量过高(样本OD值大于标准品孔第一孔的OD值),请先用样品稀释液稀释一定倍数(n倍)后再测定,计算时请最后乘以总稀释倍数(×n×5)。
5.封板膜只限一次性使用,以避免交叉污染。
6.底物请避光保存。
7.严格按照说明书的操作进行,试验结果判定必须以酶标仪读数为准.
8.所有样品,洗涤液和各种废弃物都应按传染物处理。
9.本试剂不同批号组分不得混用。
保存条件及有效期
1.试剂盒保存:;2-8℃。
2.有效期:6个月。
