高中有机化学方程式练习
重点高中有机化学方程式汇总(全)(已免费)

重点高中有机化学方程式汇总(全)(已免费)————————————————————————————————作者:————————————————————————————————日期:2光照光照 光照 光照 高温 CaO △催化剂加热、加压 催化剂催化剂 △ 催化剂 △催化剂 催化剂催化剂催化剂 △ 催化剂 催化剂浓硫酸 △△高中有機化學方程式匯總1. CH 4 + Cl 2 CH 3Cl + HCl2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 38. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br 9. CH 2 = CH 2 + H 2O CH 3CH 2OH10. CH 2 = CH 2 + HBr CH 3—CH 2Br 11. CH 2 = CH 2 + H 2 CH 3—CH 312. nCH 2 = CH 2 [ CH 2—CH 2 ] n13. nCH 2=CH-CH=CH 2 [CH 2-CH=CH-CH 2] n 14. 2CH 2 = CH 2 + O 2 2CH 3CHO 15. CH ≡CH + Br 2 CHBr = CHBr 16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 2 17. CH ≡CH + HCl H 2C = CHCl 18. nCH 2 = CH [ CH 2-CH ] n Cl Cl 19. CH ≡CH + H 2O CH 3CHO20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)2 21. + Br 2 Br + HBr 22. + HO -NO 2 NO 2 +H 2O23. + HO -SO 3H SO 3H+H 2OCH 3NO 2NO 2O 2N CH 3催化剂 NaOHH 2O醇 △ 催化剂 △浓硫酸 170℃浓硫酸 140℃OHBrBrOH催化剂 △ 催化剂 △△△ Br催化剂△ 24. + 3H 225. +3HO -NO 2 +3H 2O 26. 3CH ≡C H → 27. CH 3CH 2Br + H 2O CH 3CH 2OH + HBr 28. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr 29. CH 3CH 2Br+ NaOH CH 2 = CH 2 + NaBr +H 2O30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O32. CH 3CH 2OH CH 2 = CH 2↑+ H 2O33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O 34. OH+NaOH ONa+H 2O 35. OH+H 2O O -+H 3O + 36. ONa+H 2O+CO 2 OH+ NaHCO 337. +3Br 2 ↓ +3HBr38. CH 3CHO + H 2 CH 3CH 2OH 39. 2CH 3CHO + O 2 2CH 3COOH40. CH 3CHO+2Ag(NH 3)2OH CH 3COONH 4+2Ag ↓+3NH 3+H 2O41CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑ 43.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑44. CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑45. CH 3COOH + NaOH CH 3COONa + H 2O浓硫酸△催化剂催化剂催化剂催化剂催化剂△催化剂加热、加压+ 浓硫酸△+O OC — CO OCH2-CH246. 2CH3COOH + Cu(OH)2 (CH3COO)2Cu + 2H2O47.CH3COOH+CH3CH2OH CH3COOCH2CH3 +H2O48. CH3COOCH2CH3+NaOH CH3COONa+CH3CH2OH49. nOHCH2CH2COO H→[ OCH2CH2C ] n +H2O50. C6H12O6 (s) + 6O2 (g)6CO2 (g) + 6H2O (l)51. C6H12O62CH3CH2OH + 2CO252. C12H22O11+H2O C6H12O6+ C6H12O6蔗糖葡萄糖果糖53. C12H22O11 + H2O2C6H12O6麦芽唐葡萄糖54. (C6H10O5)n + nH2O n C6H12O6淀粉葡萄糖55. (C6H10O5)n + nH2O n C6H12O6纤维素葡萄糖56.C17H33COO-CH2C17H35COO-CH2C17H33COO-CH +3H2 C17H35COO-CHC17H33COO-CH2C17H35COO-CH257. C17H35COO-CH2CH2-OHC17H35COO-CH +3NaOH3C17H35COONa+ CH-OHC17H35COO-CH2CH2-OH58. CH2OH COOHCH2OH COOH1.HClClCHClCH+−→−+324光HClClCHClClCH+−→−+2223光2.3.4.5.6.7.8.222Br CH CH CH CH +=-=9.10.11.12. 13. 14.15.16.17.OH NH Ag CHO CHOH HOCH 2342)(2)(+ O H NH Ag COONH CHOH HOCH 2344232)(++↓+−→−∆18.19.20.21.高中有机化学知识点总结1.需水浴加热的反应有:(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
高中经典有机化学反应方程式

章末回顾排查专练(十二)排查一、重要有机反应方程式再书写1.2.2C 2H 5OH +2Na →2C 2H 5ONa +H 2↑; 3.CH 3CH 2OH ―――――――――→浓H 2SO 4170 ℃CH 2===CH 2↑+H 2O ; 4.C 2H 5OH +HBr ――→△ C 2H 5Br +H 2O ;5.2C 2H 5OH +O 2―――――――――→Cu 或Ag △2CH 3CHO +2H 2O ;9.2CH 3CHO +O 2―――――――――→催化剂△2CH 3COOH ; 10.CH 3CHO +H 2――――――――――→催化剂△CH 3CH 2OH ; 11.CH 3CHO +2Ag(NH 3)2OH ――→△ CH 3COONH 4+2Ag ↓+3NH 3+H 2O ;12.CH 3CHO +2Cu(OH)2――→△ CH 3COOH +Cu 2O ↓+2H 2O ;13.CH 3COOH +C 2H 5OH 浓H 2SO 4△CH 3COOC 2H 5+H 2O ;14.CH 3COOC 2H 5+H 2O 稀H 2SO 4△CH 3COOH +C 2H 5OH ;15.乙二醇和乙二酸生成聚酯16.排查二、常考易错再排查 1.按碳原子组成的分子骨架分,有机物可分为链状化合物和环状化合物,环状化合物又包括脂环化合物和芳香族化合物。
按官能团分,有机物可分为烃(烷烃、烯烃、炔烃、芳香烃)和烃的衍生物(卤代烃、醇、酚、醛、酸、酯等)。
( )2.具有相同分子式,不同结构的化合物互为同分异构体。
包括碳链异构(如CH 3CH 2CH 2CH 3与)、位置异构(如CH 3CH===CHCH 3与CH 3CH 2CH===CH 2)、官能团异构(如CH 3CH 2OH 与CH 3OCH 3)、顺反异构(顺2-丁烯与反2-丁烯)、手性异构等。
( )3.发生加成反应或加聚反应的有机物分子必须含有不饱和键。
高中有机化学方程式汇总(全)(已免费)

光照 光照 光照 光照 高温 CaO△ 催化剂加热、加压 催化剂催化剂△ 催化剂 △ 催化剂 催化剂催化剂 催化剂△ 催化剂催化剂浓硫酸△ △CH 3 NO 2O 2N CH 3催化剂△高中有機化學方程式匯總1. CH 4 + Cl 2 CH 3Cl + HCl2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 38. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br9. CH 2 = CH 2 + H 2O CH 3CH 2OH10. CH 2 = CH 2 + HBr CH 3—CH 2Br11. CH 2 = CH 2 + H 2 CH 3—CH 312. nCH 2 = CH 2 [ CH 2—CH 2 ] n13. nCH 2=CH-CH=CH 2 [CH 2-CH=CH-CH 2] n14. 2CH 2 = CH 2 + O 2 2CH 3CHO15. CH ≡CH + Br 2 CHBr = CHBr16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 217. CH ≡CH + HCl H 2C = CHCl18. nCH 2 = CH [ CH 2-CH ] nCl Cl19. CH ≡CH + H 2O CH 3CHO20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)221. + Br 2 Br + HBr22. + HO -NO 2 NO 2 +H 2O23. + HO -SO 3H SO 3H+H 2O24. + 3H 2催化剂NaOH H 2O 醇△ 催化剂 △ 浓硫酸 170℃ 浓硫酸140℃OH Br Br OH 催化剂 △ 催化剂△△ △ 浓硫酸△ Br25. +3HO -NO 2 +3H 2O26. 3CH ≡CH →27. CH 3CH 2Br + H 2O CH 3CH 2OH + HBr28. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr29. CH 3CH 2Br+ NaOH CH 2 = CH 2 + NaBr +H 2O30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O 32. CH 3CH 2OH CH 2 = CH 2↑+ H 2O 33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O 34. OH+NaOH ONa+H 2O35. OH+H 2O O -+H 3O +36. ONa+H 2O+CO 2 OH+ NaHCO 337. +3Br 2 ↓ +3HBr 38. CH 3CHO + H 2 CH 3CH 2OH39. 2CH 3CHO + O 2 2CH 3COOH 40. CH 3CHO+2Ag(NH 3)2OH CH 3COONH 4+2Ag ↓+3NH 3+H 2O41CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O 42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑43.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑44. CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑45. CH 3COOH + NaOH CH 3COONa + H 2O46. 2CH 3COOH + Cu(OH)2 (CH 3COO)2Cu + 2H 2O47.CH 3COOH+CH 3CH 2OH CH 3COOCH 2CH 3 +H 2O 48. CH 3COOCH 2CH 3+NaOH CH 3COONa+CH 3CH 2OH催化剂催化剂催化剂催化剂催化剂△催化剂加热、加压+ 浓硫酸△+ 2H2O O OC — CO OCH2-CH249. nOHCH2CH2COOH→ [ OCH2CH2C ] n +H2O50. C6H12O6 (s)+ 6O2 (g)6CO2 (g)+ 6H2O(l)51. C6H12O62CH3CH2OH + 2CO252. C12H22O11+H2O C6H12O6+ C6H12O6蔗糖葡萄糖果糖53. C12H22O11+ H2O2C6H12O6麦芽唐葡萄糖54. (C6H10O5)n+ nH2O n C6H12O6淀粉葡萄糖55. (C6H10O5)n+ nH2O n C6H12O6纤维素葡萄糖56.C17H33COO-CH2 C17H35COO-CH2C17H33COO-CH +3H2 C17H35COO-CHC17H33COO-CH2 C17H35COO-CH2 57. C17H35COO-CH2 CH2-OH C17H35COO-CH +3NaOH 3C17H35COONa+ CH-OHC17H35COO-CH2 CH2-OH 58. CH2OH COOHCH2OH COOH1.HClClCHClCH+−→−+324光2.3.4.5.6.7.8.9.10.11.12.13.14.15.16.17.18.19.20.21.高中有机化学知识点总结1.需水浴加热的反应有:(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
人教版(2019)高中化学选择性必修3:有机化学基础方程式练习题(含答案)

人教版(2019)高中化学选择性必修3:有机化学基础方程式练习题一、烷烃通式:C n H2n+21.氧化反应(1)甲烷的燃烧:2. 取代反应(1)甲烷和氯气在光照条件下发生取代反应(一氯取代)二、烯烃通式:C n H2n官能团名称:碳碳双键1. 加成反应(1)乙烯与溴水(Br2的CCl4溶液)加成:(2)乙烯与氢气加成:(3)乙烯与水加成:(4)丙烯与HBr加成:(5)1,3-丁二烯与Br2发生1,2-加成,1,4-加成:(6)1,3-丁二烯与乙烯发生环加成反应:2. 加聚反应(1)乙烯发生加聚反应生成聚乙烯:(2)丙烯发生加聚反应生成聚丙烯:3. 乙烯的制取(1)溴乙烷发生消去反应:(2)乙醇发生消去反应:三、炔烃通式:C n H2n-2 官能团名称:碳碳三键1. 乙炔的制取:2. 加成反应(1)乙炔与溴水(Br2的CCl4溶液)完全加成:(2)乙炔与HCl加成得到氯乙烯:四、苯和甲苯通式:C n H2n-61. 取代反应(1)苯和液溴发生取代反应:(2)苯和浓硝酸发生取代反应:(3)甲苯和浓硝酸发生取代反应:(4)甲苯和甲苯与氯气在光照条件下发生取代反应(一氯取代):(5)甲苯与氯气在FeCl3催化下发生对位取代反应:注意:甲苯在光照条件下发生侧链的取代,在催化剂条件下发生苯环上的取代。
2. 加成反应(1)苯和氢气发生加成反应:五、卤代烃(溴乙烷)官能团名称:卤素原子1. 水解反应(取代反应)(1)溴乙烷与氢氧化钠水溶液反应:2. 消去反应(2)溴乙烷与氢氧化钠醇溶液反应:1. 置换反应(1)乙醇与钠反应:2. 氧化反应(1)乙醇燃烧:(2)催化氧化①乙醇在铜或银催化下与氧气反应:②1-丙醇在铜或银催化下与氧气反应:③2-丙醇在铜或银催化下与氧气反应:3. 消去反应(1)乙醇发生消去反应:4. 取代反应(1)乙醇生成乙醚:(2)乙醇与浓氢溴酸反应生成溴乙烷:(3)乙醇与乙酸发生酯化反应生成乙酸乙酯:七、苯酚官能团名称:羟基1. 弱酸性(1)苯酚与氢氧化钠溶液反应:(2)往苯酚钠溶液中通入CO2气体:(3)苯酚与碳酸钠溶液反应:2. 取代反应(1)苯酚与浓溴水反应:3. 显色反应(1)苯酚能和FeCl3溶液反应,使溶液呈紫色。
高中化学苏教版必修二有机化合物化学方程式总结

高中化学苏教版必修二有机化合物化学方程式总结1.甲烷燃烧CH4+2O2→CO2+2H2O(条件为点燃)2.甲烷隔绝空气高温分解甲烷分解很复杂,以下是最终分解。
CH4→C+2H2(条件为高温高压,催化剂)3.甲烷和氯气发生取代反应CH4+Cl2→CH3Cl+HCl CH3Cl+Cl2→CH2Cl2+HCl CH2Cl2+Cl2→CHCl3+HCl CHCl3+Cl2→CCl4+HCl (条件都为光照。
)4.乙烯燃烧CH2=CH2+3O2→2CO2+2H2O(条件为点燃)5.乙烯和溴水CH2=CH2+Br2→CH2Br-CH2Br6.乙烯和水CH2=CH2+H20→CH3CH2OH (条件为催化)7.乙烯和氯化氢CH2=CH2+HCl→CH3-CH2Cl8.乙烯和氢气CH2=CH2+H2→CH3-CH3 (条件为催化剂)9.乙烯聚合nCH2=CH2→-[-CH2-CH2-]n- (条件为催化剂)10.乙炔燃烧C2H2+3O2→2CO2+H2O (条件为点燃)11.乙炔和溴水C2H2+2Br2→C2H2Br412.乙炔和氯化氢两步反应:C2H2+HCl→C2H3Cl--------C2H3Cl+HCl→C2H4Cl213.乙炔和氢气两步反应:C2H2+H2→C2H4→C2H2+2H2→C2H6 (条件为催化剂)14.苯燃烧2C6H6+15O2→12CO2+6H2O (条件为点燃)15.苯和液溴的取代C6H6+Br2→C6H5Br+HBr16.苯和浓硫酸浓硝酸C6H6+HNO3→C6H5NO2+H2O (条件为浓硫酸)17.苯和氢气C6H6+3H2→C6H12 (条件为催化剂)18.乙烷和氯气反应CH3-CH3+Cl2=CH3-CH2Cl+HC l。
高中有机化学方程式大全

光照 光照 光照 光照 高温 CaO △ 催化剂 加热、加压 催化剂催化剂 △ 催化剂 △ 一定 条件 一定 条件 催化剂 催化剂 △ 催化剂催化剂 浓硫酸 △ 高中有机化学方程式1. CH 4 + Cl 2 CH 3Cl + HCl2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 38. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br9. CH 2 = CH 2 + H 2O CH 3CH 2OH10. CH 2 = CH 2 + HBr CH 3—CH 2Br 11. CH 2 = CH 2 + H 2 CH 3—CH 3 12. nCH 2 = CH 2 [ CH 2—CH 2 ] n13. nCH 2=CH-CH=CH 2[CH 2-CH=CH-CH 2] n 14. 2CH 2 = CH 2 + O 2 2CH 3CHO15. CH ≡CH + Br 2 CHBr = CHBr16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 217. CH ≡CH + HCl H 2C = CHCl18. nCH 2 = CH [ CH 2-CH ] n (一定条件)Cl Cl19. CH ≡CH + H 2O CH 3CHO20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)221. + Br 2 Br + HBr22. + HO -NO 2 NO 2 +H 2OCH 3 NO 2NO 2 O 2N CH 3 催化剂 NaOH△ H 2O △ 醇 △ Cu/Ag △浓硫酸 170℃浓硫酸 140℃OH BrBr OH 催化剂 △催化剂 △△△ Br 催化剂 △ 23. + 3H 224. +3HO -NO 2 +3H 2O25. 3CH ≡C H → 26. CH 3CH 2Br + H 2O CH 3CH 2OH + HBr27. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr28. CH 3CH 2Br+ NaOH CH 2 = CH 2 + NaBr +H 2O 29. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑30. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O 31. CH 3CH 2OH CH 2 = CH 2↑+ H 2O 32.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O 33. OH+NaOH ONa+H 2O34. OH+H 2O O -+H 3O +35. ONa+H 2O+CO 2 OH+ NaHCO 336. +3Br 2 ↓+3HBr37. CH 3CHO + H 2 CH 3CH 2OH 38. 2CH 3CHO + O 2 2CH 3COOH 39. CH 3CHO+2Ag(NH 3)2OH CH 3COONH 4+2Ag ↓+3NH 3+H 2O40.CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O 41. 2CH 3COOH+2Na 2CH 3COONa+H 2↑42.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑43. CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑44. CH 3COOH + NaOH CH 3COONa + H 2O45. 2CH 3COOH + Cu(OH)2 (CH 3COO)2Cu + 2H 2O浓硫酸 △催化剂 催化剂 催化剂 催化剂 催化剂 △ 催化剂 加热、加压 + 浓硫酸 △ + 2H 2OO OC — C O O CH 2-CH 2 46.CH 3COOH+CH 3CH 2OH CH 3COOCH 2CH 3 +H 2O47. CH 3COOCH 2CH 3+NaOH CH 3COONa+CH 3CH 2OH48. nOHCH 2CH 2COO H → [ OCH 2CH 2C ] n +H 2O (一定条件)49. C 6H 12O 6 (s) + 6O 2 (g) 6CO 2 (g) + 6H 2O (l)50. C 6H 12O 6 2CH 3CH 2OH + 2CO 251. C 12H 22O 11+H 2O C 6H 12O 6+ C 6H 12O 6蔗糖 葡萄糖 果糖52. C 12H 22O 11 + H 2O 2C 6H 12O 6麦芽唐 葡萄糖53. (C 6H 10O 5)n + nH 2O n C 6H 12O 6淀粉 葡萄糖54. (C 6H 10O 5)n + nH 2O n C 6H 12O 6 纤维素 葡萄糖55.C 17H 33COO-CH 2 C 17H 35COO-CH 2 C 17H 33COO-CH +3H 2 C 17H 35COO-CH C 17H 33COO-CH 2 C 17H 35COO-CH 256. C 17H 35COO-CH 2 CH 2-OHC 17H 35COO-CH +3NaOH 3C 17H 35COONa+ CH-OHC 17H 35COO-CH 2CH2-OH 57. CH 2OH COOH CH 2OH COOH5859.222Br CH CH CH CH +=-=60.61.62.63.64.65.高中有机化学知识点总结1.需水浴加热的反应有:(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
高中有机化学方程式总结(练习题)

一、脂肪烃、卤代烃化学方程式
1、甲烷的燃烧:
2、乙烯的燃烧:
3、乙炔的燃烧:
4、苯的燃烧:
5、甲烷与氯气取代反应:;
;
6、乙烯与氢气加成:
7、乙烯与氯化氢加成:
8、乙烯与水加成:
9、乙烯与溴的四氯化碳溶液加成:
10、乙烯的加聚:
11、乙烯的实验室制法:
12、乙炔的实验室制法:
13、乙炔与氯化氢(1:1)加成:
14、氯乙烯的加聚:
15、苯与液溴取代:
16、苯的硝化反应:
17、苯与氢气加成:
18、甲苯的硝化反应:
19、溴乙烷的水解反应:
20、溴乙烷的消去反应:
二、烃的含氧衍生物化学方程式
21、乙醇与钠反应:
22、乙醇的催化氧化:
23、乙醇的消去反应:
24、乙醇的分子间脱水:
25、乙醇与钠反应:
26、乙醇的催化氧化:
27、乙醇与氢溴酸的取代反应:
28、乙醇的催化氧化:
29、苯酚与氢氧化钠反应:
30、苯酚与金属钠反应:
31、苯酚钠与盐酸反应:
32、苯酚钠溶液通入二氧化碳:
33、苯酚与饱和溴水的取代反应:
34、苯酚钠与盐酸反应:
35、苯酚钠溶液通入二氧化碳:
36、乙醛和氢气的加成反应:
37、乙醛的催化氧化:
38、乙醛和银氨溶液反应:
39、乙醛和新制氢氧化铜反应:
40、乙酸和金属钠反应:
41、乙酸和氢氧化钠反应:
42、乙酸和碳酸钠反应:
43、乙酸和乙醇反应:
44、乙酸乙酯在酸性环境下水解:
45、乙酸乙酯在碱性环境下水解:。
高考有机化学方程式训练过关
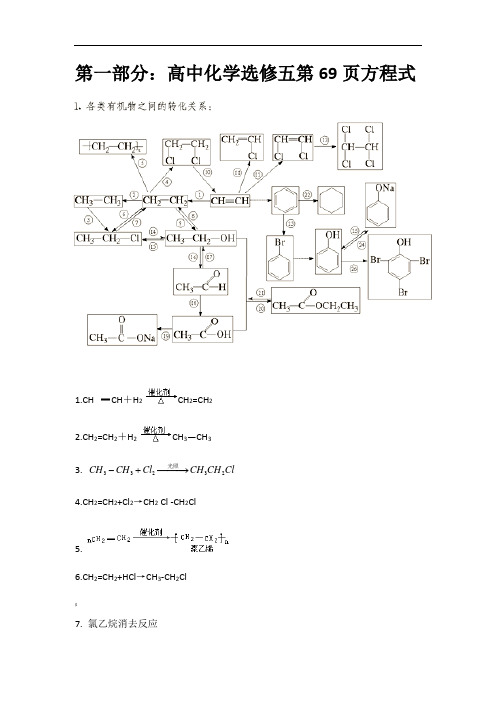
第一部分:高中化学选修五第69页方程式1.CH CH +H 2 CH 2=CH 22.CH 2=CH 2+H 2 CH 3—CH 33. 33232CH CH Cl CH CH Cl -+−−−→光照 4.CH 2=CH 2+Cl 2→CH 2 Cl -CH 2Cl5.6.CH 2=CH 2+HCl →CH 3-CH 2Cl$7. 氯乙烷消去反应CH3CH2 Cl +NaOH CH2=CH2↑+ Na Cl + H2O 8.9.CH2CH2+H—OH CH3CH2OH11. HC CH十HCl CH2=CHCl12.2CH CH Cl CHCl CHCl≡+→=[13.222CHCl CHCl Cl CHCl CHCl=+→-14.氯乙烷水解CH3CH2Cl+ NaOH CH3CH2OH + NaBr15.16. 乙醇催化氧化2CH3CH2OH + O2Cu∆−−→2CH3CHO + 2H2O》17.18.. 乙醛制乙酸2CH3CHO + O2催化剂△2CH3COOH19. CH3COOH+ NaOH→CH3COONa+ H2O20. 乙酸乙酯制取(用饱和碳酸钠溶液收集)CH3COOH + CH3CH2OH CH3COOC2H5+ H2O21.水解反应浓硫酸$H2O△醇△CH3COOC2H5+H2O CH3COOH+C2H5OH22.加成反应(环己烷)23. 取代反应+ Br2−−→−3FeBr+ HBr24. 苯酚与氢氧化钠溶液反应+ NaOH + H2O25. 苯酚钠溶液中通入二氧化碳!+ CO2+ H2O + NaHCO326.苯酚的取代反应(鉴别苯酚)1、将对应反应类型写到方程式后。
取代反应、加成反应、消去反应、聚合反应~氧化反应、还原反应、水解反应、酸碱反应2、观察以上26个转化及方程式,可知有如下常见的反应条件,试举例能发生什么反应。
(1)浓硫酸,加热。
—OH —ONa—ONa—OH(2)稀硫酸,加热(3)NaOH水溶液,加热(4)NaOH醇溶液,加热(5)Cu或Ag催化剂,加热(6)光照(7),(8)Fe或FeX3催化(9)溴水(10)浓溴水(11)银氨溶液Ag(NH3)2OH或 新制氢氧化铜悬浊液(12)酸性高锰酸钾溶液KMnO4(H+)(13)不需要条件即可转化3、官能团的引入或转化总结(1)产物中引入羟基-OH—(2)引入卤素原子-X[(3)引入碳碳双键?第二部分:高中有机化学方程式基础篇一、烃/1.乙烯乙烯的制取:(1)氧化反应高温乙烯的燃烧:H2C=CH2+3O22CO2+2H2O乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
高二有机化学方程式练习题

高二有机化学方程式练习题有机化学是化学学科中的一个重要分支,研究有机化合物的结构、性质和变化规律等。
其中,方程式是有机化学中非常重要的一部分,通过方程式可以描述化学反应的发生过程。
下面将提供一些高二有机化学方程式练习题,帮助同学们加深对有机化学方程式的理解和掌握。
1. 丙醇脱水生成丙烯的方程式是什么?答案:丙醇(C3H8O)在适当的条件下脱水反应生成丙烯(C3H6)的方程式如下:C3H8O → C3H6 + H2O2. 乙醚和二氯甲烷反应生成什么产物?写出反应方程式。
答案:乙醚(C4H10O)和二氯甲烷(CH2Cl2)反应生成甲醇(CH3OH)和氯乙烷(C2H5Cl)的方程式如下:C4H10O + CH2Cl2 → CH3OH + C2H5Cl3. 甲醛和甲胺反应生成什么产物?写出反应方程式。
答案:甲醛(CH2O)和甲胺(CH3NH2)反应生成甲肼(CH6N2)和甲酸(HCOOH)的方程式如下:2CH2O + 2CH3NH2 → CH6N2 + HCOOH4. 己二酸和乙醇反应生成什么产物?写出反应方程式。
答案:己二酸(C6H10O4)和乙醇(C2H5OH)反应生成乙酸己酯(C10H18O4)和水(H2O)的方程式如下:C6H10O4 + 2C2H5OH → C10H18O4 + 2H2O5. 碳酸氢钠和盐酸反应生成什么产物?写出反应方程式。
答案:碳酸氢钠(NaHCO3)和盐酸(HCl)反应生成二氧化碳(CO2)、水(H2O)和氯化钠(NaCl)的方程式如下:NaHCO3 + HCl → CO2 + H2O + NaCl6. 甲醇和乙酸反应生成什么产物?写出反应方程式。
答案:甲醇(CH3OH)和乙酸(CH3COOH)反应生成甲酸(HCOOH)和乙酸甲酯(CH3COOCH3)的方程式如下:CH3OH + CH3COOH → HCOOH + CH3COOCH3以上是一些高二有机化学方程式练习题,通过解答这些题目,可以加深对有机化学方程式的理解和记忆。
高中化学必修二有机化学方程式

高中化学必修二有机化学方程式篇一:必修2有机化学方程式汇总必修2有机化学方程式汇总1. CH4 + 2O CO2 + 2H2O 甲烷的燃烧反应2. CH4 + Cl2 CH3Cl + HCl3. CH3Cl + Cl2 CH2Cl2 + HCl4. CH2Cl + Cl光照CHCl3 + HCl 光照光照点燃甲烷的取代反应5. CHCl3 + Cl CCl4+ HCl6. CH4C +2H2 甲烷受热分解(隔绝空气)7. CH3COONa + NaOH △CH4↑+ Na2CO3甲烷的实验室制备(了解)8. C2H4 + 3O2 2CO2 + 2H2O乙烯的燃烧反应9. CH2 = CH2 + Br CH2Br—CH2Br10. CH2 = CH23CH2OH11. CH2 = CH2CaO 高温光照点燃3—CH2Br 乙烯的加成反应12. CH2 = CH23—CH313. nCH2 = CHCH2乙烯的加聚反应14. 2C6H6 +15O2 12CO2 + 6H2O苯的燃烧反应15. + Br2 苯的卤代反应16. + HO2 +H2O苯的硝化反应17. + HO3H+H2O苯的磺化反应(了解)18. + 3H2 △苯的加成反应Ni -NO2 2O 甲苯硝化反应制TNT(了解)20. C2H6O+ 3O2 2CO2 + 3H2O乙醇的燃烧反应21. 2CH3CH22CH3CH2ONa + H2↑乙醇的置换反应22. 2CH3CH2OH+O2Cu/Ag 2CH3CHO + 2H2O 乙醇的催化氧化△23. CH3CH2OH 浓硫酸 2 = C H2↑+ H2O 乙醇的消去反应(实验室制乙烯的原理)170℃24. C2H5OH+C2H5140℃C2H5OC2H5+H2O 分子间脱水成醚(了解)25. 2CH3COOH+2Na 2CH3COONa+H2↑26.2CH3COOH+Na2CO2CH3COONa+H2O+CO2↑ 27. CH33 CH3COONa+H2O+CO2↑28. CH3COOH + NaOH CH3COONa + H2O 29. 2CH3COOH + Cu(OH)(CHCOO)2Cu + 2H2O 30. CH3COOH+CH3CH23COOCH2CH3 +H2O 酯化反应31. CH3COOCH2CH33COONa+CH3CH2OH 酯的水解32. C6H12O6 (s) + 6O 6CO2 (g) + 6H2O (l) 生理氧化反应(有氧呼吸)33. C6H12O6 2CH3CH2OH + 2CO2发酵生成酒精34. C12H22O11+H2OC6H12O6+ C6H12O6蔗糖葡萄糖果糖 35. C12H22O11 + H2O 催化剂2C6H12O6麦芽唐葡萄糖催化剂催化剂浓硫酸乙酸的酸性(了解)36. (C6H10O5)n + nH2n C6H12O6淀粉葡萄糖37. (C6H10O5)n + nH2催化剂n C6H12O6 △纤维素葡萄糖催化剂双糖和多糖的水解篇二:必修2有机化学方程式汇总必修2有机化学方程式汇总1. CH4 + 2O CO2 + 2H2O 甲烷的燃烧反应2. CH4 + Cl2CH3Cl + HCl3. CH3Cl + Cl2CH2Cl2 + HCl4. CH2Cl + Cl光照CHCl3 + HCl 光照光照点燃甲烷的取代反应5. CHCl3 + Cl CCl4+ HCl6. CHC +2H2 甲烷受热分解(隔绝空气)7. CH3COONa + NaOH △CH4↑+ Na2CO3甲烷的实验室制备(了解)8. C2H4 + 3O2 点燃2CO2 + 2H2O乙烯的燃烧反应9. CH2 = CH2CH2Br—CH2B(来自: 小龙文档网:高中化学必修二有机化学方程式)r10. CH2 = CH23CH2OH11. CH2 = CH2CH3—CH2Br CaO 高温光照乙烯的加成反应12. CH2 = CH23—CH3 13. nCH2 CH 乙烯的加聚反应14. 2C6H6 +15O2 12CO2 + 6H2O苯的燃烧反应15. + Br2 苯的卤代反应16. NO2 +H2O苯的硝化反应17. 3H+H2O苯的磺化反应(了解)18. + 3H2 △苯的加成反应Ni 点燃-NO2 2O 甲苯硝化反应制TNT(了解)20. C2H6O+ 3O2点燃2CO2 + 3H2O乙醇的燃烧反应21. 2CH3CH2 2CH3CH2ONa + H2↑乙醇的置换反应22. 2CH3CH2OH+O2 Cu/Ag 2CH3CHO + 2H2O 乙醇的催化氧化△CH2 = CH2↑+ H2O 乙醇的消去反应23. CH3CH2OH 浓硫酸(实验室制乙烯的原理)170℃浓硫酸24. C2H5OH+C2H5 C2H5OC2H5+H2O 分子间脱水成醚(了解)140℃25. 2CH3 2CH3COO Na+H2↑26.2CH3COOH+Na232CH3COONa+H2O+CO2↑乙酸的酸性27. CH33 CH3COONa+H2O+CO2↑28. CH3 CH3COONa + H2O29. 2CH33COO)2Cu + 2H2O30. CH3COOH+CH3 CH3COOCH2CH3 +H2O 酯化反应31. CH3COOCH2CH33COONa+CH3CH2OH酯的水解32. C6H12O6 (s) + 6O 6CO2 (g) + 6H2O (l) 生理氧化反应(有氧呼吸)33. C6H12O催化剂6 2CH催化剂3CH 2OH + 2CO2发酵生成酒精(无氧呼吸)34. C12H22O11+H2O C6H12O6+ C6H12O6蔗糖葡萄糖果糖35. C催化剂12H22O11 + H22C6H12O6麦芽唐葡萄糖36. (C催化剂双糖和多糖的水解6H10O5)n + nH2 n C6H12O6淀粉葡萄糖37. (C催化剂6H10O5)n + nH2 △n C6H12O6纤维素葡萄糖(了解)篇三:必修二_有机化学_方程式总结必修二有机化学方程式总结甲烷和Cl2:CH4+Cl2光CH3Cl+HClCH3Cl+Cl2 CH2Cl2+HClCH2Cl2+Cl2 CHCl3+HClCHCl3+Cl2 CCl4+HCl 甲烷燃烧:CH4+2O2 2+2H2O 甲烷分解:CH4C+2H2乙烯燃烧:C2H4 +3O2 2CO2+2H2O 乙烯与Br2:C2H4+ BrC2H4Br2 乙烯与H2:C2H4+H2C2H6 乙烯与HX:C2H4+HX 3CH2X 乙烯与H2O:C2H4+H2O 3CH2OH 乙烯的加聚:nC2H4 2-CH 2 点12CO2+6H2O 3 NO2 +H2O +H2SO4(浓3H +H2O 苯与H2+3H2 Ni 乙醇和钠:2C2H5OH+2Na 2CH3COONa+H2 乙醇燃烧:C2H5OH+O2 2CO2+3H2O 乙醇催化氧化:2C2H5OH+O2CH3CHO+2H2O乙醇分子内脱水:C2H5OH浓H2SO4、170℃CH2=CH22O 乙醇分子间脱水:2C2H5OH浓H2SO4 、140℃CH3CH2OC2H5(乙醚)+H2O 注:一般醚以与氧相连的烃基加醚字命名乙醇与HX:C2H5OH+HX C2H5OX+H2O 乙酸与NaOH: CH3COOH+NaOH CH3COONa+H2O 乙酸Na2CO3:CH3COOH+Na2CO3 CH3COONa+H2O+CO2乙醇与乙酸:CH3COOH+ C2H5OH 浓硫酸、△CH3COOC2H5+H2O 乙酸乙酯水解:CH3COOC2H5+H2O CH3COOH+ C2H5OH乙酸乙酯皂化:CH3COOC2H5+NaO △CH3COONa+ C2H5OH 蔗糖水解:C12H22O11蔗+H2O 稀硫酸C6H10O6葡+ C6H10O6果麦芽糖水解:C12H22O11麦+H2O 催 2 C6H10O6葡纤维素水解:(C6H10O5)n纤+H2O 6H10O6葡淀粉水解:(C6H10O5)n淀+H2O nC6H10O6葡C17H35COOCH2 CH2OH (饱和)C17H352O 17H35COOH+CHOH C17H35COOCH2 CH2OH 软质酸甘油酯:C15H35COOCH2(不饱和)C15H35COOCH2C15H35COOCH2油酸甘油酯:C17H33COOCH2C17H33COOCH2相关热词搜索:有机化学方程式必修高中化学高二有机化学方程式必修5有机化学方程式。
高中有机化学方程式汇总(全)(已免费)

Ca催化催催化催化催催催高中有機化學方程式匯總1. CH 4 + Cl 2 CH 3Cl + HCl2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 3 8. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br 9. CH 2 = CH 2 + H 2O CH 3CH 2OH 10. CH 2 = CH 2 + HBr CH 3—CH 2Br 11. CH 2 = CH 2 + H 2 CH 3—CH 3 12. nCH 2 = CH 2 [ CH 2—CH 2 ] n 13. nCH 2=CH-CH=CH 2 [CH 2-CH=CH-CH 2] n 14. 2CH 2 = CH 2 + O 2 2CH 3CHO催化催NaO催化15. CH≡CH + Br2 CHBr = CHBr16. CHBr = CHBr+ Br2 CHBr2-CHBr217. CH≡CH + HCl H2C = CHCl18. nCH2 = CH [ CH2-CH ] nCl Cl19. CH≡CH + H2O CH3CHO20. CaC2 + 2H2O CH≡CH↑+ Ca(OH)2-2 +H2O-SO33H+H2O225. +3HO-NO22O26. 3CH≡H醇催化浓硫浓硫BrOH催化催化△27. CH3CH2Br + H2O CH3CH2OH + HBr28. CH3CH2Br + NaOH CH3CH2OH + NaBr29. CH3CH2Br+ NaOH CH2 = CH2 + NaBr +H2O30. 2CH3CH2OH+2Na 2CH3CH2ONa + H2↑31. 2CH3CH2OH+O2 2CH3CHO + 2H2O32. CH3CH2OH CH2 = CH2↑+ H2O+C2H5OH C2H5OC2H5+H2O34. OH+NaOH ONa+H2O2O O-+H3O+233738. CH3CHO + H2 CH3CH2OH39. 2CH3CHO + O2 2CH3COOH△催催催40. CH 3CHO+2Ag(NH 3)2OH CH 3COONH 4+2Ag ↓+3NH 3+H 2O 41CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O 42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑ +Na 2CO 3 2CH 3COONa+H 2O+CO 2↑44. CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑ 45. CH 3COOH + NaOH CH 3COONa + H 2O46. 2CH 33COO)2Cu + 2H 2O+CH 3CH 2OH CH 3COOCH 2CH 3 +H 2O48. CH 3COOCH 2CH 3+NaOH CH 3COONa+CH 3CH 2OH 49. nOHCH 2CH 2COOH → [ OCH 2CH 2C ] n +H 2O50. C 6H 12O 6 (s) + 6O 2 (g) 6CO 2 (g) + 6H 2O (l) 51. C 6H 12O 6 2CH 3CH 2OH + 2CO 252. C 12H 22O 11+H 2O C 6H 12O 6+ C 6H 12O 6蔗糖 葡萄糖 果糖 53. C 12H 22O 11 + H 2O 2C 6H 12O 6催催化催化+浓硫+ 2H O O C —O OCH -麦芽唐 葡萄糖 54. (C 6H 10O 5)n + nH 2O n C 6H 12O 6 淀粉 葡萄糖 55. (C 6H 10O 5)n + nH 2O n C 6H 12O 6 纤维素 葡萄糖 C 17H 35COO-CH 2C 17H 33COO-CH +3H 2 C 17H 35COO-CHC 17H 33COO-CH 2 C 17H 35COO-CH 2 57. C 17H 35COO-CH 2 CH 2-OH C 17H 35COO-CH +3NaOH 3C 17H 35COONa+ CH-OH C 17H 35COO-CH 2 CH 2-OH58. CH 2OH COOH CH 2OH COOH1.HCl Cl CH Cl CH +−→−+324光HCl Cl CH Cl Cl CH +−→−+2223光2.3.4.5.6.7.8.222Br CH CH CH CH +=-=9.10.11.12. 13.14.15.16.17.OH NH Ag CHO CHOH HOCH 2342)(2)(+ O H NH Ag COONH CHOH HOCH 2344232)(++↓+−→−∆18.19.20.21.高中有机化学知识点总结1.需水浴加热的反应有:(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
(完整版)高中有机化学方程式大全

(完整版)⾼中有机化学⽅程式⼤全光照光照光照光照⾼温 CaO △催化剂加热、加压催化剂△催化剂⾼中有机化学⽅程式⼤全1. CH 4 + Cl 2 CH3Cl + HCl 2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 38. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br9. CH 2 = CH 22OH10. CH 2 = CH 23—CH 2Br 11. CH 2 = CH 2CH 3 12. nCH 2 = CH 2 ] n13. nCH 2-CH=CH-CH 2] n14. 2CH 23CHO15. CH ≡CH + Br 2 CHBr = CHBr16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 217. CH ≡CH + HCl H 2C = CHCl18. nCH 2 = CH [ CH 2-CH ] nCl Cl19. CH ≡CH + H 2O CH 3CHO20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)2 + Br 222. + HO 2 +H 2O 23. + HO 3H+H 2O催化剂△浓硫酸170℃浓硫酸140℃催化剂△24.+ 3H2-NO22O26. 3CH≡C H27. CH3CH2Br + H228. CH3CH229. CH3CH22O30. 2CH3CH2OH+2Na 2CH3CH2ONa + H2↑31. 2CH3CH2OH+O2 2CH3CHO + 2H2O32. CH3CH2OH CH2 = CH2↑+ H2O33.C2H5OH+C2H5OH C2H5OC2H5+H2O34. 2O35. 2O -+H3O+233738. CH339. 2CH340. CH34+2Ag↓+3NH3+H2O 41CH3↓+2H2O42. 2CH3COOH+2Na 2CH3COONa+H2↑43.2CH3COOH+Na2CO32CH3COONa+H2O+CO2↑44. CH3COOH+NaHCO3 CH3COONa+H2O+CO2↑45. CH3COOH + NaOH CH3COONa + H2O浓硫酸△催化剂催化剂催化剂催化剂催化剂△催化剂加热、加压+ 浓硫酸△+ 2H2O O OC —CO OCH2-CH246. 2CH3COOH + Cu(OH)2 (CH3COO)2Cu + 2H2O47.CH3COOH+CH3CH2OH CH3COOCH2CH3 +H2O48. CH3COOCH2CH3+NaOH CH3COONa+CH3CH2OH49. nOHCH2CH2COO H→[ OCH2CH2C ] n +H2O50. C6H12O6 (s) + 6O2 (g)6CO2 (g) + 6H2O (l)51. C6H12O62CH3CH2OH + 2CO252. C12H22O11+H2O C6H12O6+ C6H12O6蔗糖葡萄糖果糖53. C12H22O11 + H2O2C6H12O6麦芽唐葡萄糖54. (C6H10O5)n + nH2O n C6H12O6淀粉葡萄糖55. (C6H10O5)n + nH2O n C6H12O6纤维素葡萄糖56.C17H33COO-CH2C17H35COO-CH2C17H33COO-CH +3H2 C17H35COO-CHC17H33COO-CH2C17H35COO-CH257. C17H35COO-CH2CH2-OHC17H35COO-CH +3NaOH3C17H35COONa+ CH-OHC17H35COO-CH2CH2-OH58. CH2OH COOHCH2OH COOH1.HClCl CH Cl CH+→+324光HCl Cl CH Cl Cl CH+→+2223光2.3.4.5.6.7.8.222Br CH CH CH CH +=-= 9.10.11.12.13.14.15.16.17. OH NH Ag CHO CHOH HOCH 2342)(2)(+O H NH Ag COONH CHOH HOCH 2344232)(++↓+?→??18.19.20.21.⾼中有机化学知识点总结1.需⽔浴加热的反应有:(1)、银镜反应(2)、⼄酸⼄酯的⽔解(3)苯的硝化(4)糖的⽔解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不⾼于100℃的条件下反应,均可⽤⽔浴加热,其优点:温度变化平稳,不会⼤起⼤落,有利于反应的进⾏。
《有机化学反应方程式》书写练习

寒假作业《有机化学反应方程式》书写练习一、取代反应1 .卤代反应(1CH4与Cl2在光照下反应:(2苯、液溴在铁屑催化下反应:(3苯酚溶液中加入过量浓溴水:2 .硝化反应(1由苯制硝基苯:(2由甲苯制TNT:3 .磺化反应由苯和浓硫酸共热制苯磺酸:4 .醇与氢卤酸共热下反应例如:乙醇与氢溴酸反应:5 .醇分子间脱水成醚例如:由乙醇制乙醚:6 .卤代烃的水解例如:溴乙烷与NaOH溶液共热:7 .酯的水解(1乙酸乙酯与稀H2SO4共热:(2乙酸乙酯与NaOH溶液共热:。
8 .酯化反应(1乙酸与乙醇在浓硫酸下共热制乙酸乙酯:。
(2苯甲酸、甲醇、浓硫酸三者混合后共热:。
二、加成反应1.烯烃的加成(1C2H4加成H2:。
(2C2H4加H2O:。
(3C2H4通入溴水中:现象为:。
2.炔烃的加成(1C2H2与足量H2加成:。
(2C2H2通入溴水中:。
(3C2H2水化法制乙醛:。
(4C2H2与HCl制氯乙烯:H23.例如:苯加成H2:。
4 .乙醛加成氢气:。
5 .丙酮(CH3COCH3加成氢气:。
6 .油脂的硬化(或氢化:。
三、消去反应1 .部分卤代烃的消去反应结构要求为:;条件为:。
例如:溴乙烷、乙醇、NaOH三者混合共热:。
2 .部分醇的消去反应结构要求为:;条件为:。
例如:(1由乙醇制乙烯:。
(2符合分子组成为C7H15OH、不能发生消去反应的物质有种,其结构简式为:。
四、氧化反应1 .有机物的燃烧反应(1烃(C x H y完全燃烧的通式为:。
①天然气的完全燃烧:②乙烯完全燃烧:;_现_象_为_:③乙炔完全燃烧:;__现_象_为:_④苯完全燃烧:;现象为:。
(2含氧衍生物(c x H y o k完全燃烧的通式为:。
例如:酒精作燃料完全燃烧:。
葡萄糖的生理氧化:2.得氧或失氢方式的氧化反应(1乙烯氧化法制乙醛:。
(2由乙醇制乙醛:。
(3乙醛发生银镜反应:。
(4乙醛与新制氢氧化铜悬浊液共热:。
(5乙醛与氧气的催化氧化:。
高中有机化学方程式汇总(全)(已免费)

淀粉
葡萄糖
55.
(C6H10O5)n
+
nH
2O
催化剂 △
纤维素
n C6H12O6
葡萄糖
56.C 17H 33COO-CH 2
催化剂
C17H33COO-CH +3H 2 加热、加压
C17H33COO-CH 2
C17H35COO-CH 2 C17H 35 COO-CH C17H 35COO-CH 2
57. C 17H35COO-CH 2
C8H18 + C8H16
7. CH3COONa + NaOH CaO CH4↑+ Na2CO3
△
8. CH2 = CH2 + Br2
CH2Br—CH2Br
催化剂
9. CH2 = CH2 + H2O
CH3CH2OH
10. CH2 = CH2 + HBr 催化剂 CH3—CH2Br
△
11.
CH2
=
CH2
3 NH 3 H 2O
18. 19. 20. 21.
高中有机化学知识点总结
1 .需水浴加热的反应有: ( 1 )、银镜反应( 2)、乙酸乙酯的水解( 3 )苯的硝化( 4)糖的水解
( 5 )、酚醛树脂的制取( 6)固体溶解度的测定
凡是在不高于 100 ℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大
H 2O
28. CH3CH 2Br + NaOH
CH 3CH2OH + NaBr
29. CH3CH 2Br+ NaOH
醇 △
CH2 = CH2 + NaBr +H 2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中有机化学方程式练习班级姓名一、有机物的概述1、有机物的概念:_____________________________________________________2、组成元素:__________________________________________________________3、结构及性质特点:_____________________________________________________________________________________________________________________________ 练习1、大多数有机物分子里的碳原子与碳原子或碳原子与其他原子相结合的化学键是()A.只有非极性键B.只有极性键C.有非极性键和极性键D.只有离子键练习2、迄今为止,以下各族元素中生成化合物的种类最多的是()A.ⅡA族B.ⅢA族C.ⅣA族D.ⅤA族二、有机化学中几个重要的原理及概念1、“价键守恒”原理即碳四键、氧二键、氢一键,这是推导、书写结构式的重要依据。
(可用于判断有机物的结构简式是否正确)2、官能团原理:(决定有机物化学性质的原子或原子团)官能团决定性质,有什么样的官能团就有什么样的性质。
有机物是按官能团来分类的。
这一原理是进行有机物性质、结构推理的重要依据。
3、同系物和同分异构体同系物:_______相似,分子组成上相差_________________________的物质同系物的三要素:结构相似、组成相差、一般指有机物注意:由于同系物结构相似,所以_________相似。
同系物具有相同的通式,但通式相同的有机物不一定互为同分异构体。
同分异构体:________相同,_________不同的化合物(三要素)练习3、请判断下列物质的相互关系(A、同位素B、同素异形体C、同系物D、同分异构体)⑴O2与O3 ()⑵12C 与13C ()⑶CH4与C15H32()⑷C2H4与C20H40()⑸OH与CH2OH()⑹CH 3OH与CH 2OH( )练习4、下列有机物互为同分异构体的一组是( )A 与B 、 CH 3CH 2NO 2和 H 2N —CH 2—COOHC 、C 60 与C 70DCH 3CH 2 C CH 2CH 3CH 3CH 3和CH 3CH 2CH 3CH 2C CH 3CH 3常见同分异构体的类别及书写1、 类别:______________ 、___________________、______________________2、 书写:a 、碳链异构(碳链由长到短、支链由整到散、位置由心到边) b 、类别异构 c 、位置异构练习5下列各组物质与CH 3CH 2C(CH 3)2CH 2CH 3互为同分异构体的是( )A .CH 2CH 2CH 3CH 3CH 3C CH 3B.CH CH 2 CH 2CH 2 CH 3CH 3 CH 3C. CH CH 2CH 2CH 3CH 3CH 3CH 2 DC CH CH 2CH 3CH 3CH 3CH 2CI CF CI CI C F练习6、与CH CH CH CH 3 CH 3CH 3 互为同分异构体的是( )A 、CH CH CH 2CH 3CH 3B 、C CH 2CH 2CH 3CH 3CH 2C 、CH CH CH 2CH 2CH 3CH 3D 、CH CH2CH 2CH 2CH 2有机物的一氯代物的种类⑴方法:找出有多少种不同的氢原子 ⑵关键:对称氢原子的确定⑶规律:A:同一个碳原子上的氢原子是完全对称的B:与同一个碳原子相连的甲基上的氢原子是完全对称的 C:结构对称的碳原子上的氢原子练习7、下列有机物的一氯代物的同分异构体数目相等的是( )⑴CH CH CH 2CH 2CH 3CH 3CH 3C CH 3⑵CH 3CH 3⑶CH CH CH CH 3CH 3CH 3CH 3CH 3⑷CH 2CH 3CH 3三、有机物的命名及有机化学用语命名:习惯命名法和系统命名法 1、习惯命名法碳原子数在1~10之间的,依次用天干:_____________________________ 碳原子数大于10时,用十一,十二……还有戊烷(正、异、新) 2、 系统命名法步骤:选主链、定起点、(编号数)写名称原则:选主链——选有官能团在内的、最长的、支链最多的碳链为主链 定起点——离官能团(最简单的支链)最近的一端为起点,给主链编号(1、2、3、……)写命名——口诀:“支名前”、“母名后”、“支名同、要合并(用二、三、四……)”、“支名异、简在前”练习8、写出下列各物质的名称① ②③ ④________________________ ___________________________有机化学用语:包括最简式、分子式、电子式、结构式、结构简式,通式、化学方程式。
四、方程式书写 (1)取代反应 1、甲烷与氯气反应 2、苯与液溴反应 3、苯与浓硝酸反应 4、甲苯与浓硝酸反应 5、乙醇与金属钠反应 6、乙醇与溴化氢反应 7、苯酚与溴水反应8、乙醇在浓硫酸作用下加热到140℃ (2)、加成反应 1、乙烯与氢气加成 2、乙烯与氯化氢加成 3、乙烯与水加成 4、乙烯与氯气加成CH 3─C HH 5C 2 ─CH 2CH 3 CH CH 2CH 3C ─ 3CH 3 C ─ CH 2─ C H CH 3CH 3CH ─CH CH 3 CH 2 CH 3 CH ─CH CH 3 CH 3 ─CH 35、乙烯与溴水加成6、乙炔与氢气加成7、乙炔与溴水加成8、乙炔与氯化氢加成9、乙炔与水加成10、苯与氢气加成11、乙醛与氢气加成12、1,3丁二烯与溴水加成(3)、消去反应1、乙醇与浓硫酸混合共热到170℃2、氯乙烷与氢氧化钠醇溶液共热(4)、氧化反应1、乙醇氧化成乙醛2、乙醛与氧气反应生成乙酸3、银镜反应4、乙醛与新制氢氧化铜反应(5)、加聚反应1、丙烯聚合2、氯乙烯聚合3、1,3丁二烯聚合(6)、缩合反应1、乙二醇缩合2、苯酚与甲醛缩合(7)、其它反应1、苯酚与氢氧化钠溶液反应2、苯酚与碳酸钠溶液反应3、苯酚钠溶液中通入二氧化碳气体五.实验总结1.需水浴加热的反应有:(1)、﹍﹍﹍﹍﹍(2)﹍﹍﹍﹍﹍﹍﹍(3)﹍﹍﹍﹍﹍﹍﹍(4)糖的水解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
2.需用温度计的实验有:(1)、﹍﹍﹍﹍﹍(170℃)(2)、蒸馏(3)、固体溶解度的测定(4)、﹍﹍﹍﹍﹍(70-80℃)(5)、中和热的测定(6)﹍﹍﹍﹍﹍(50-60℃)〔说明〕:(1)凡需要准确控制温度者均需用温度计。
(2)注意温度计水银球的位置。
3.能与Na反应的有机物有:﹍,﹍,﹍等——凡含羟基的化合物。
4.能发生银镜反应的物质有:醛、﹍﹍﹍﹍﹍、﹍﹍﹍﹍﹍、﹍﹍﹍﹍﹍、葡萄糖、麦芽糖——凡含醛基的物质。
5.能使高锰酸钾酸性溶液褪色的物质有:(1)含有﹍﹍﹍﹍﹍的烃和烃的衍生物、苯的同系物(2)含有羟基的化合物如﹍﹍﹍﹍﹍类物质(3)含有醛基的化合物(4)具有还原性的无机物(如SO2、FeSO4、KI、HCl、H2O2等)6.能使溴水褪色的物质有:(1)含有﹍﹍﹍﹍﹍的烃和烃的衍生物(加成)(2)﹍﹍﹍﹍﹍等酚类物质(取代)(3)含醛基物质(氧化)(4)碱性物质(如NaOH、Na2CO3)(氧化还原――歧化反应)(5)较强的无机还原剂(如SO2、KI、FeSO4等)(氧化)(6)有机溶剂(如苯和苯的同系物、四氯甲烷、汽油、已烷等,属于萃取,使水层褪色而有机层呈橙红色。
)7.密度比水大的液体有机物有:溴乙烷、溴苯、硝基苯、四氯化碳等。
8、密度比水小的液体有机物有:烃、大多数酯、一氯烷烃。
9.能发生水解反应的物质有﹍﹍﹍﹍﹍、﹍﹍﹍﹍﹍、二糖、多糖、蛋白质(肽)、盐。
10.不溶于水的有机物有:烃、卤代烃、酯、淀粉、纤维素11.常温下为气体的有机物有:分子中含有碳原子数小于或等于4的烃(新戊烷例外)、一氯甲烷、甲醛。
12.浓硫酸、加热条件下发生的反应有:苯及苯的同系物的硝化、磺化、醇的脱水反应、酯化反应、纤维素的水解13.能被氧化的物质有:含有碳碳双键或碳碳叁键的不饱和化合物(KMnO4)、苯的同系物、醇、醛、酚。
大多数有机物都可以燃烧,燃烧都是被氧气氧化。
14.显酸性的有机物有:含有﹍﹍﹍,﹍﹍的化合物。
15.能使蛋白质变性的物质有:强酸、强碱、重金属盐、甲醛、苯酚、强氧化剂、浓的酒精、双氧水、碘酒、三氯乙酸等。
16.既能与酸又能与碱反应的有机物:具有酸、碱双官能团的有机物(氨基酸、蛋白质等)17.能与NaOH溶液发生反应的有机物:(1)﹍﹍﹍﹍﹍:(2)﹍﹍﹍﹍﹍:(3)卤代烃(水溶液:水解;醇溶液:消去)(4)﹍﹍﹍﹍﹍:(水解,不加热反应慢,加热反应快)(5)蛋白质(水解)18、有明显颜色变化的有机反应:1.苯酚与三氯化铁溶液反应呈紫色;2.KMnO4酸性溶液的褪色;3.溴水的褪色;4.淀粉遇碘单质变蓝色。
5.蛋白质遇浓硝酸呈黄色(颜色反应。
