嵌合抗原受体(CAR)治疗的安全性
CAR-T细胞治疗的挑战

CAR-T细胞治疗的挑战化疗、放疗和外科手术是最传统的癌症治疗方法,但它们的疗效较低,副作用严重。
因此,在过去的十年中,研究人员已经开发了新的策略,从而实现疾病的完全缓解。
目前,免疫疗法已经成为革命性的癌症治疗方法,有几种类型的免疫疗法用于治疗癌症,其中包括过继细胞疗法(ACT)。
嵌合抗原受体(CAR)T细胞疗法是一种ACT,自体T细胞通过基因工程表达CAR以特异性杀死肿瘤细胞。
CAR-T细胞疗法是治疗对其他一线癌症治疗无反应患者的一个机会,并且已经在血液恶性肿瘤的治疗中展现出优越的抗肿瘤效果。
然而,这类疗法作为一线临床治疗仍有许多挑战需要克服。
从药学的角度来看,这项新兴技术仍然被归类为先进疗法,因此,要应用这项技术,必须首先满足医药监管的某些要求。
因此,有必要分析CAR-T细胞技术的要素和挑战,并将基础、临床和实践等方面的因素考虑在内,采取应对策略,从而使CAR-T技术能够成为可负担的治疗模式。
CAR-T细胞发展简史回顾CAR-T的发展史,首先要提到1957年Thomas及其同事报告的首次白血病患者骨髓移植以及随后Miller等人发现了T细胞的起源。
然而,直到1986年Steven Rosenberg 报告了一项关于肿瘤浸润淋巴细胞(TIL)的研究,这才让人们将目光锁定在“患者自身的免疫细胞可以对抗自身癌症”的理念上。
1992年,Sadelain等人成功地建立了逆转录病毒介导的基因转移到T淋巴细胞的方法,使基因修饰成为在实验或治疗环境中控制免疫的手段。
几乎与此同时,ZeligEshhar及其同事利用抗体结合域和T细胞受体上免疫球蛋白的γ或ζ亚单位,通过嵌合单链设计了细胞毒性淋巴细胞的特异性激活,从而开发出第一代CAR-T细胞。
五年后,Sadelain博士的研究小组证明,将CD28等共刺激信号整合到CAR-T中可增强生存、增殖并保持活性,从而开发出第二代CAR。
随后,携带靶向CD19的CAR-T细胞被开发出来,并启动了慢性淋巴细胞白血病(CLL)和急性淋巴细胞白血病(ALL)的I期临床试验。
car-t技术原理

car-t技术原理CAR-T技术原理随着癌症的发病率不断增加,治疗癌症的方法也在不断进步。
CAR-T 技术作为一种新型的癌症免疫疗法,近年来备受关注。
它是通过改造患者自身的免疫细胞,使其具有更强的抗癌能力,从而达到治疗癌症的目的。
CAR-T技术的全称是嵌合抗原受体T细胞(Chimeric Antigen Receptor T cell)技术。
它的原理是将一种特殊的受体引入患者自身的T细胞中,使其能够识别并攻击癌细胞。
这种受体被称为嵌合抗原受体(CAR),它由两个部分组成:外部是能够识别癌细胞的抗原结合区域,内部是能够激活T细胞的信号传导区域。
CAR-T技术的关键步骤包括免疫细胞采集、基因修饰和细胞扩增。
首先,医生会从患者的血液中采集到T细胞,这些T细胞是人体免疫系统中重要的抗癌细胞。
然后,科学家会将CAR基因导入到采集到的T细胞中。
这一步骤通常通过病毒载体实现,将CAR基因导入细胞核,使其能够被T细胞内部所识别并表达。
最后,修饰过的T 细胞会在实验室中进行扩增,使其数量足够多,能够应对体内的癌细胞。
一旦经过扩增,CAR-T细胞就可以被注射到患者体内进行治疗。
CAR-T细胞会通过血液循环到达肿瘤部位,识别并攻击癌细胞。
它的工作原理是当CAR的抗原结合区域与癌细胞表面的特定抗原结合时,会激活T细胞内部的信号传导通路,使T细胞释放出细胞毒素,杀死癌细胞。
这种杀伤机制类似于自然的免疫应答,但CAR-T技术能够加强这一过程,使其更加有效。
CAR-T技术的优势在于其针对性和持久性。
由于CAR是专门设计用于识别癌细胞的抗原,因此CAR-T细胞能够更精确地攻击癌细胞,减少对健康细胞的伤害。
此外,CAR-T细胞具有持久性的效果,一旦注射到患者体内,它们可以在体内存活并持续攻击癌细胞,从而延长治疗效果。
然而,CAR-T技术也存在一些挑战和限制。
首先,CAR-T细胞治疗的成本较高,这主要是由于制备CAR-T细胞的复杂性和昂贵的生产过程。
嵌合抗原受体t细胞治疗药物临床应用技术规范

嵌合抗原受体t细胞治疗药物临床应用技术规范一、引言嵌合抗原受体T细胞治疗(CAR-T疗法)是一种精准医学的新技术,其原理是将T细胞介导的特异性免疫疗效引入免疫细胞治疗。
该技术能够激活免疫细胞,从而增强免疫系统的作用,改善患者的治疗效果。
在某些严重的疾病,特别是恶性肿瘤中,CAR-T表现出令人满意的疗效,其中许多患者在治疗后取得很大改善,这也使CAR-T疗法成为肿瘤治疗的创新之一。
二、CAR-T技术的应用CAR-T技术的应用是一项复杂的工程,而为了能够使其在临床上取得理想的疗效,必须遵循一系列有关的规范。
下面便介绍CAR-T技术的应用技术规范:在开展CAR-T技术的临床应用之前,需要对CAR-T技术的安全性进行认真评估,以防止临床使用中出现意外事故。
(二)T细胞选择必须准确筛选合适的T细胞,以保证治疗的准确性和有效性。
(三)材料选择在开展CAR-T技术的临床应用时,必须采用质量可靠的材料,以确保其治疗的安全性和有效性。
(四)个体化治疗对不同病人进行个体化治疗,以保证不同患者获得良好的临床治疗效果。
(五)过程控制在开展CAR-T临床试验时,必须建立严格的过程控制制度,以确保CAR-T技术的有效合理使用。
(六)再造疗效监测给患者注射CAR-T疗法后,必须对患者的再造疗效作出及时、有效的监测,以防止意外发生。
(七)安全性评估三、总结CAR-T技术的发展为治疗重症疾病提供了新的治疗方案,但其临床使用的安全性和有效性仍需要根据有关的技术规范进行深入的研究。
必须准确筛选T细胞和合格的材料,还要建立严格的过程控制制度,以确保CAR-T技术能够在临床安全、有效地使用。
只有按照这些技术规范进行CAR-T技术的临床应用,才能使患者在获得安全和有效的治疗后获得充足的护理以及最佳的疗程结果。
嵌合抗原受体t细胞 法规

嵌合抗原受体t细胞法规嵌合抗原受体(CAR)T细胞疗法是一种新型的癌症治疗方法,它利用患者自身的免疫系统,通过改造患者的T细胞,使其能够识别和攻击癌细胞。
由于其独特的治疗机制和显著的疗效,嵌合抗原受体T细胞疗法近年来备受关注。
然而,由于其复杂的技术和潜在的风险,该疗法受到了严格的监管和监管机构的审查。
本文将分步骤回答关于嵌合抗原受体T细胞疗法的法规问题。
第一步:了解嵌合抗原受体T细胞疗法的基本原理和应用范围。
嵌合抗原受体T细胞疗法是一种免疫细胞疗法,通过改造患者的T细胞,使其携带能够识别癌细胞的嵌合抗原受体,从而增强其攻击和破坏癌细胞的能力。
这种治疗方法被广泛应用于治疗血液系统恶性肿瘤,如急性淋巴细胞白血病(ALL)和非霍奇金淋巴瘤(NHL)。
嵌合抗原受体T细胞疗法在美国被批准用于治疗特定类型的B细胞相关的恶性血液病,并在其他国家和地区进行了临床试验。
第二步:了解嵌合抗原受体T细胞疗法的监管机构。
在美国,嵌合抗原受体T细胞疗法受到美国食品药品监督管理局(FDA)的监管。
FDA对该疗法进行了严格的审查和评估,以确保安全性和有效性。
此外,FDA还执行监管措施,例如要求临床试验和药物标签的规定,对于嵌合抗原受体T细胞疗法的使用和销售进行监督。
第三步:了解嵌合抗原受体T细胞疗法的法规要求。
FDA在监管嵌合抗原受体T细胞疗法方面提出了一系列的法规要求。
首先,任何从事嵌合抗原受体T细胞疗法的实验室和医疗机构必须遵守临床试验的规定。
这包括建立严格的实验室流程和质量控制措施,确保产品的一致性和安全性。
其次,治疗前必须进行详细的病例评估和风险评估,并获得患者和家属的书面同意。
第四步:了解嵌合抗原受体T细胞疗法的监督和批准过程。
嵌合抗原受体T细胞疗法的监督和批准过程是一个严格的审查程序。
要获得FDA的批准,嵌合抗原受体T细胞疗法必须通过临床试验,证明其在疾病治疗中的安全性和有效性。
这包括进行动物试验和人体试验,并提交临床试验结果和病例报告给FDA进行评估。
嵌合抗原受体T细胞治疗的研究进展

嵌合抗原受体T细胞治疗的研究进展摘要嵌合抗原受体(chimeric antigen receptor,CAR)是一种将抗体衍生的靶向片段与能激活细胞的信号传导结构域相连接而产生的重组免疫受体,可赋予T细胞不依赖于主要组织相容性复合体而直接识别肿瘤细胞表面抗原的能力。
目前,临床研究已证实表达CAR的T细胞(CAR T cells,CAR-T)能有效地用于治疗难治或复发性的急性B淋巴细胞白血病,且由此促进了CAR-T用于治疗其他血液系统恶性肿瘤及实体瘤的研究。
本文主要介绍CAR的基本设计,同时回顾CAR-T用于治疗B细胞白血病、淋巴瘤及数种实体瘤的研究结果,并讨论CAR-T治疗进一步发展所面临的主要挑战和如何提高其抗肿瘤效力问题。
ABSTRACT Chimeric antigen receptor (CAR)is a recombinant immunoreceptor combining an antibody-derived targeting fragment with signaling domains capable of activating cells,which endows T cells with the ability of recognizing tumorassociated surface antigens independent of the expression of major histocompatibility complex. Recent early-phase clinical trials of CAR T cells (CAR-T)for relapsed or refractory B cell acute lymphoblastic leukemia have demonstrated promising results. Given this success,broadening the clinical experience of CAR-T therapy beyond hematological malignancies has been actively investigated. Here we discuss the basic design of CAR and review the clinical results from the studies of CAR-T therapy in B cell leukemia and lymphoma,and several solid tumors. We additionally discuss the major challenges in the further development and strategies for increasing anti-tumor activity and safety.KEy WORDS chimeric antigen receptor T cell;hematological malignancies;solid tumors嵌合抗原受体(chimeric antigen receptor,CAR)由细胞外抗原识别结构域(通常是抗体单链可变片段scFv)与细胞内信号传导结构域(T细胞受体的CD3 ζ链)相连接而成,其细胞外部分可使T细胞具有识别特异性抗原的能力。
cart细胞疗法

cart细胞疗法CAR-T细胞疗法是一种新型的癌症治疗方法,被认为是革命性的技术。
本文将介绍CAR-T细胞疗法的原理、应用场景、安全性和治疗效果,并讨论其未来的发展前景。
一、CAR-T细胞疗法的原理CAR-T细胞疗法是一种采用人工修改的T细胞来攻击癌细胞的治疗方法。
它的原理是通过将人体的T细胞提取出来,然后在实验室里通过基因工程技术将其改造成CAR(嵌合抗原受体)T细胞,再将改造后的CAR-T细胞重新注入患者体内。
CAR-T细胞通常包含三个主要部分:第一部分是能够识别癌细胞的抗原受体(也称为抗原结合域);第二部分是连接抗原受体与T细胞活化信号的连接器;第三部分是能够激活T细胞杀伤机制的信号传导域。
当CAR-T细胞注入人体后,它们可以识别癌细胞上的抗原,激活T细胞的杀伤机制,并进一步杀死癌细胞。
二、CAR-T细胞疗法的应用场景CAR-T细胞疗法主要应用于治疗一些难以治愈的白血病和淋巴瘤等血液系统肿瘤。
特别是对于反复复发的、晚期的B细胞急性淋巴细胞性白血病(B-ALL)和B细胞非霍奇金淋巴瘤(B-NHL),CAR-T细胞疗法表现出了显著的治疗效果。
CAR-T细胞疗法的优势在于它是一种个体化、创新性的治疗方法。
传统的化疗和放疗对于某些白血病和淋巴瘤存在一定的局限性,而CAR-T细胞疗法可以针对每个患者的具体情况进行改造,提高治疗效果。
三、CAR-T细胞疗法的安全性和治疗效果CAR-T细胞疗法在治疗癌症方面取得了突破性的进展,但也存在一定的安全性问题。
由于CAR-T细胞具有强大的杀伤能力,可能会引发严重的不良反应,如细胞因子释放综合征(CRS)和神经毒性。
这些不良反应需要及时识别和处理,以减轻其对患者的不良影响。
然而,不容忽视的是,CAR-T细胞疗法在临床试验中展现出了惊人的治疗效果。
对于一些晚期、难以治愈的白血病和淋巴瘤患者,CAR-T细胞疗法可以实现完全缓解的治疗效果。
四、CAR-T细胞疗法的未来发展前景随着对CAR-T细胞疗法的深入研究和技术的不断进步,相信在未来该疗法的应用场景将不断扩大。
CAR-T疗法

CAR-T疗法CAR-T疗法就是嵌合抗原受体T细胞免疫疗法。
这是一种治疗肿瘤的新型精准靶向疗法,在临床肿瘤治疗上取得了很好的效果,是一种能够精准、快速、高效,且有可能治愈癌症的新型肿瘤免疫疗法。
T细胞也叫T淋巴细胞,是人体免疫细胞细胞的一种,产生于骨髓造血干细胞,在胸腺中发育成熟,然后转移到人体血液、淋巴和周围组织器官,发挥免疫防御功能。
其作用相当于人体内的"战士",能够抵御和消灭"敌人",如感染、肿瘤、外来异物等。
实验技术人员通过基因工程技术,给T细胞加入精准识别系统-CAR(肿瘤嵌合抗原受体),将普通的T细胞改造成能够精准识别的"超级战士",即CAR-T细胞,它利用其"精准识别系统"CAR,专门识别体内的肿瘤细胞,并通过免疫作用释放大量的多种效应因子,它们能高效地消灭肿瘤细胞,从而达到治疗恶性肿瘤的目的。
具体步骤如下:1、评估患者是否可以接受CAR-T治疗。
现在看来基本上绝大多数人还是可以的。
2、从患者的身上分离出一种免疫细胞-T细胞(我们身体中能够抵御疾病、感染、肿瘤的免疫细胞)。
3、利用基因工程技术对T细胞进行改造,需要在体外给它加入一个能识别肿瘤,并且同时激活T细胞的嵌合抗体CAR,这时候一个普通的T细胞就变成了一个带有精准识别系统的超级战士。
4、扩增。
通过体外培养获得大量的CAR-T细胞。
一般来讲,一个病人需要几十亿乃至上百亿个CAR-T细胞,通常体型越大的人需要的量就越多。
5、把培养好的CAR-T细胞回输到病人体内。
6、观察期,这段时间需要对病人严密监护,尤其回输的前几天,身体的反应是非常剧烈的,这时候一定要有医护人员帮助与指导。
可用于哪些患者:目前CAR-T治疗主要还是用于血液肿瘤中的某些肿瘤,比如说:淋巴瘤、多发性骨髓瘤、复发难治多发性骨髓瘤、急性淋巴细胞白血病等,目前主要这三大类疾病是CAR-T 治疗的适应症。
CAR-T治疗的安全性

CAR-T治疗的安全性
CAR-T(嵌合抗原受体T细胞)是一种新型的免疫治疗方式,
被广泛应用于肿瘤治疗领域。
然而,CAR-T治疗在提供疗效的同时,也存在一定的安全性问题。
1. 急性毒性反应
CAR-T治疗可能引发急性毒性反应,包括发热、寒战、低血压、呼吸急促等症状。
这些反应往往发生在CAR-T细胞输注后的数小
时内,可能严重影响患者的生命体征和器官功能。
2. 慢性毒性反应
除了急性反应外,CAR-T治疗还可能导致慢性毒性反应。
长期使用CAR-T细胞可能对正常细胞和组织造成损害,引发各种慢性
毒性反应,如免疫不耐受、细胞凋亡等。
3. 细胞增殖与转移
CAR-T细胞治疗过程中,CAR-T细胞的不受控制增殖可能导致治疗效果上的波动,甚至引发白血病等恶性疾病。
此外,CAR-T 细胞的转移也是安全性问题之一,转移到其他部位可能导致非预期的副作用。
4. 免疫系统副作用
CAR-T治疗采用自身免疫细胞改造而成的CAR-T细胞,对免疫系统产生一定程度的影响。
免疫系统副作用可能包括免疫过度激活、自身免疫反应、感染等,需要特别注意。
综上所述,CAR-T治疗虽然具有突破性的疗效,但安全性问题不可忽视。
在进行CAR-T治疗时,应该充分评估患者的安全性,并采取适当的措施来监测和减轻治疗过程中可能出现的副作用和安全隐患。
CAR-T细胞治疗产品中复制型病毒的风险分析及控制

中 图分 类号 : R392—33 文献标 识码 :A 文章 编号 :1002—7777(2018)07—0879—07 doi:10.16153 ̄.1002—7777.2018.07.006
880
中国药 事 2018年 7月 第 32卷 第 7期
of replication com petent virus detection and the detection methods,and putting forward the consideration for controlling RCR/RCL in the process of CAR—T cell production f or reference by CAR—T cell product developers.
摘 要 :嵌 合 抗 原 受体T细胞 (CAR—T细 胞 )因其 在 血 液肿 瘤 中的显 著疗 效 已成 为 肿瘤 免疫 治 疗领域 中的 国际研 究新热点,成为肿瘤治愈新的希望。 目前 ,在CAR—T细胞产品的生产中,通常是利用逆转录病毒 载体或慢病毒载体将CAR基 因高效地导入T细胞 中,但在使用这些病毒载体的同时也带来了CAR—T产品 污染复制型逆转录病毒 (RCR )或复制型慢病毒 (RCL)的潜在风险。虽然随着病毒载体设计及生产体 系的不 断 改进 ,这种 风 险 已大 大降低 ,但 仍 不 能 完全排 除 。 因此 ,监 管机 构要 求对 于临床 使 用 的慢病 毒 或逆 转 录病毒 载体 、转 导 的CAR—T细胞 产品 以及 患者 均要进 行 复制 型病 毒 的检 测 。本 文主要 通过 分析 复 制型病毒污染检测的必要性、降低复制型病毒污染风险的措施、复制型病毒检测的阶段 以及检测方法等 方 面 ,提 出在 CAR—T细胞 生 产过程 中控 制RCR/RCL的策略 ,以供 cAR—T细胞 产 品研 发 者参 考 。
嵌合抗原受体T细胞(CAR-T)免疫疗法:绝处逢生的利剑

嵌合抗原受体T细胞(CAR-T)免疫疗法:绝处逢生的利剑蔡亮;张凌华;杨子杰;裘丽珍【期刊名称】《自然杂志》【年(卷),期】2016(038)003【总页数】4页(P228-231)【作者】蔡亮;张凌华;杨子杰;裘丽珍【作者单位】复旦大学生物化学与分子生物学系,上海200433;复旦大学生物化学与分子生物学系,上海200433;复旦大学生物化学与分子生物学系,上海200433;复旦大学生物化学与分子生物学系,上海200433【正文语种】中文癌症,因癌细胞的内源性、异质性和突变抗药性而难以治愈,被称为“不可逆转的细胞损伤”。
目前癌症治疗的常规方法包括手术、放疗和化疗,都不能达到彻底治愈的效果。
同时,放疗和化疗都会对机体的正常细胞,尤其是生长分裂旺盛的细胞,如造血干细胞造成损伤。
癌症干细胞(cancer stem cell,CSC)的存在,也给术后的复发增添了风险。
作为一种针对人体免疫系统而非针对肿瘤的疗法,癌症免疫疗法(cancer immunotherapy)近年来取得的一系列突破性成果得到了广泛的关注。
在详细说明癌症免疫疗法的原理以及嵌合抗原受体T细胞免疫疗法(chimeric Antigen Receptor T-Cell Immunotherapy, CAR-T)技术的发展之前,需要阐明T细胞的免疫检查点共信号机制。
T细胞的激活依靠“双信号”进行精确调控。
一个特异性激活信号是主要组织相容性复合体(MHC)和T细胞受体(TCR)的结合,另一个则是来自共刺激信号受体CD28、CD134(OX40)或CD137 (4-1BB)的刺激信号,或者是来自共抑制信号受体CTLA4或PD-1的抑制信号。
如果把共刺激信号比作汽车的“油门”,共抑制信号就好比是“刹车”。
T细胞的免疫检查点就是一类抑制性的分子,通过调节免疫反应来避免对正常细胞造成破坏,而癌细胞往往利用这一机制来逃避免疫系统的攻击,如过表达PD-1的配体PD-L1。
cart技术疗法原理

CAR-T疗法:新型肿瘤免疫疗法的原理与应用肿瘤免疫疗法作为一种革命性的癌症治疗手段,近年来备受关注。
其中,CAR-T疗法(嵌合抗原受体T细胞疗法)以其独特的治疗原理和显著的治疗效果,为癌症患者带来了新的生机。
本文将详细介绍CAR-T疗法的原理、治疗过程、特异性和安全性,以及其在临床应用中的优势和挑战。
一、CAR-T疗法的发展历程与原理1.发展历程CAR-T疗法的发展可以追溯到20世纪80年代,当时科学家们发现,通过基因工程技术可以改变T细胞,使其具有识别和攻击肿瘤细胞的能力。
经过数十年的研究和实践,CAR-T疗法逐渐从实验室走向临床,成为一种具有广泛应用前景的肿瘤治疗方法。
2.原理CAR-T疗法的核心原理是利用基因工程技术,对患者自身的免疫系统进行改造,使其能够识别并攻击肿瘤细胞。
具体来说,这个过程可以分为两个主要步骤:提取T细胞和改造T细胞。
二、CAR-T疗法的治疗过程1.提取T细胞CAR-T疗法的第一步是从患者体内提取T细胞。
T细胞是人体内免疫系统的重要组成部分,具有对抗各种病原体、异己细胞和肿瘤细胞等入侵细胞的能力。
2.改造T细胞接下来,科学家们利用基因编辑技术对提取出的T细胞进行改造。
通过嵌合抗原受体(CAR)技术,人工制造出能够识别肿瘤细胞的蛋白质,并将其添加到T细胞上。
这个过程类似于给T细胞装上了一个“导航器”,使其能够精确地识别肿瘤细胞。
3.回输CAR-T细胞改造后的CAR-T细胞被注入患者体内。
在体内,这些CAR-T细胞会迅速找到肿瘤细胞并与之结合,引发免疫反应。
4.免疫反应与肿瘤细胞溶解免疫反应会导致肿瘤细胞的溶解和死亡,从而使患者获得治疗的效果。
值得注意的是,CAR-T细胞具有高度的特异性,它们只会攻击被CAR识别的特定抗原,而不会对正常细胞造成伤害。
三、CAR-T疗法的特异性和安全性1. 特异性CAR-T细胞具有高度的特异性,它们只会攻击被CAR识别的特定抗原,而不会对正常细胞造成伤害。
嵌合抗原受体T细胞(CAR-T)在疾病治疗中的研究进展

孙强等嵌合抗原受体T细胞(CAR-T)在疾病治疗中的研究进展第22期嵌合抗原受体T细胞(CAR-T)在疾病治疗中的研究进展孙强金宇亭黄晶(吉林大学第一医院,长春130000)中图分类号R730.51文献标志码A文章编号1000-484X(2021)22-2815-04[摘要]嵌合抗原受体T细胞(CAR-T)免疫疗法是一种细胞免疫治疗方法,是以CAR为基础的治疗恶性肿瘤的新模式。
此技术将抗原抗体的高度亲和性和T细胞杀伤作用相结合,通过基因修饰的手段,使T细胞能特异性识别并杀死肿瘤抗原,且不受主要组织相容性复合体(MHC)限制。
近几年来,CAR-T免疫疗法除了在治疗急性白血病、非霍奇金淋巴瘤中取得较好的疗效,也被用来治疗实体瘤、自身免疫性疾病和心脏病。
本文就目前CAR-T细胞免疫疗法的现状及其在疾病治疗中的应用进行综述。
[关键词]嵌合抗原受体T细胞;免疫治疗;恶性肿瘤Research progress of chimeric antigen receptor T cells(CAR-T)in disease treatmentSUN Qiang,JIN Yu-Ting,HUANG Jing.First Hospital of Jilin University,Changchun130000,China [Abstract]Chimeric antigen receptor T-cell immunotherapy is a therapeutic method of cellular immunity,which is a new mode of treatment of malignant tumor based on CAR.This technique combines the high affinity of antigen and antibody with the killing effect of T cells.By means of gene modification,T cells can specifically recognize and kill tumor antigens without being restricted by the major histocompatibility complex(MHC).In recent years,CAR-T immunotherapy has achieved good results not only in the treat‐ment of acute leukemia and non-Hodgkin's lymphoma,but also in the treatment of solid tumors,autoimmune diseases and heart dis‐ease.This article reviews the current status of CAR-T immunotherapy and its application in the treatment of malignant tumors.[Key words]CAR-T;Immunotherapy;Malignant tumor嵌合抗原受体T细胞(chimeric antigen receptor T-cell,CAR-T)免疫疗法自产生以来,在临床治疗中发挥重要作用,尤其对血液系统肿瘤及实体瘤来说是一种有效的治疗手段[1-2]。
生物医药技术CAR-T细胞治疗技术的发展现状分析与未来趋势预测

生物医药技术CAR-T细胞治疗技术的发展现状分析与未来趋势预测CAR-T细胞治疗技术是一种在肿瘤治疗领域具有革命性意义的生物医药技术。
CAR-T细胞治疗技术通过修改患者自身的T细胞,使其表达特异性的嵌合抗原受体(chimeric antigen receptor,CAR),从而使T细胞能够更有效地识别和杀灭癌细胞。
目前,CAR-T细胞治疗技术已经在某些白血病和淋巴瘤患者中取得了显著的临床疗效,但也面临着一些挑战和限制。
首先,CAR-T细胞治疗技术的临床应用仍然存在一定的风险和副作用。
由于CAR-T细胞具有高度的活性和特异性,使用CAR-T细胞治疗可能引发过度的免疫反应,导致严重的细胞毒性或细胞因子释放综合征等副作用。
此外,CAR-T细胞治疗还可能引发体内细菌和真菌感染、持久性细胞增殖和恶化,甚至导致死亡等严重后果。
其次,CAR-T细胞治疗技术的疗效和持续时间尚不稳定。
尽管CAR-T细胞治疗在一些白血病和淋巴瘤患者中取得了令人瞩目的疗效,但仍然有相当一部分患者在治疗后出现复发和耐药的现象。
此外,CAR-T细胞治疗的持续时间也有限,需要进一步的改进和优化,以实现更长时间的疗效。
然而,尽管面临着一些挑战和限制,CAR-T细胞治疗技术仍然被广泛认为是未来肿瘤治疗领域的重要方向和发展趋势。
首先,基于对CAR-T细胞治疗技术的不断改进和优化,相信可以进一步提高其疗效和稳定性,并减少不良反应的发生。
其次,随着基因编辑技术的不断发展和成熟,相信可以实现对CAR-T细胞的精确编辑和定向改造,以提高其特异性和生物安全性。
此外,结合其他治疗策略和手段,如放疗、化疗等,也有望进一步提高CAR-T细胞治疗的疗效和持续时间。
未来,CAR-T细胞治疗技术还有很大的发展空间和潜力。
首先,可以进一步扩大CAR-T细胞治疗的适应症范围,包括其他类型的白血病、实体肿瘤等,以满足更多患者的需求。
其次,随着技术的进一步成熟和进展,相信可以减少CAR-T细胞治疗的成本,并提高其制备和生产的效率。
CAR—T细胞免疫疗法的研究进展

CAR—T细胞免疫疗法的研究进展嵌合抗原受体(CAR)-T细胞免疫疗法是过继性细胞免疫疗法中最具有研究前景的方法,它是利用基因技术,在T细胞内导入一个可以将CAR表达于其表面的基因,并使T细胞发挥作用,克服肿瘤局部免疫抑制微环境、打破宿主免疫耐受状态,靶向杀伤肿瘤细胞。
本综述主要探讨CAR-T细胞免疫疗法及其原理、临床应用、存在的安全性问题和应对措施。
标签:嵌合抗原受体;T淋巴细胞;肿瘤免疫治疗嵌合抗原受体(CAR,Chimeric antigen receptor)-T细胞免疫疗法是一种肿瘤过继细胞免疫疗法,基本原理是利用基因工程修饰T淋巴细胞,使其表达嵌合抗原受体,以非MHC(major histocompatibility complex,主要组织相容性复合体)限制性的方式杀伤肿瘤细胞。
CAR的优点在于能非MHC依赖性识别肿瘤蛋白质和脂类抗原,不需要经过抗原递呈细胞(antigen-presenting cell,APC),目前已經发展到第四代,早期主要用于治疗B细胞急性淋巴细胞白血病(B-ALL),慢性淋巴细胞性白血病和B细胞非霍奇金淋巴瘤[2],近年来也用于治疗实体瘤、HIV等。
虽然CAR-T细胞在临床试验中取得了显著的效果,但同时也出现了诸多安全性问题,包括细胞因子释放综合征、肿瘤溶解综合征、神经毒性和脱靶效应等[3]。
1 CAR-T细胞免疫疗法及原理1.1 CAR-T设计原理正常T细胞的活化有赖于双信号:第一信号由TCR识别APC表面的抗原肽-MHC复合物(p-MHC)启动;第二信号由T细胞和APC间共刺激分子的相互作用启动(即B7/CD28协同刺激信号)[4]。
而CAR-T细胞技术的设计原理是使T细胞不需要依赖MHC分子和APC,将识别肿瘤相关抗原(TAA)的单链抗体(scFv)、跨膜的共刺激结构域(如CD28和CD4-1BB)和T细胞的活化基序结合为一体,通过基因转导的方法转染T淋巴细胞,经基因修饰的T细胞通过表达单链抗体增强结合肿瘤细胞的能力,同时激活T细胞,使其增殖并激活其细胞毒活性,使其能特异性地识别和杀伤肿瘤细胞[5]。
肿瘤免疫治疗的新方法CAR-T 细胞治疗
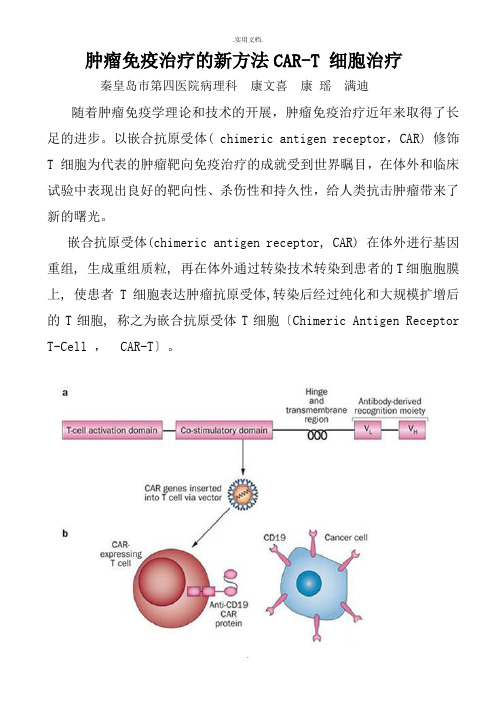
肿瘤免疫治疗的新方法CAR-T 细胞治疗秦皇岛市第四医院病理科康文喜康瑶满迪随着肿瘤免疫学理论和技术的开展,肿瘤免疫治疗近年来取得了长足的进步。
以嵌合抗原受体( chimeric antigen receptor,CAR) 修饰T 细胞为代表的肿瘤靶向免疫治疗的成就受到世界瞩目,在体外和临床试验中表现出良好的靶向性、杀伤性和持久性,给人类抗击肿瘤带来了新的曙光。
嵌合抗原受体(chimeric antigen receptor, CAR) 在体外进行基因重组, 生成重组质粒, 再在体外通过转染技术转染到患者的T细胞胞膜上, 使患者T细胞表达肿瘤抗原受体,转染后经过纯化和大规模扩增后的T细胞, 称之为嵌合抗原受体T细胞〔Chimeric Antigen Receptor T-Cell , CAR-T〕。
1989年Grooss等首次提出CAR-T细胞这一概念,多年来科学家经过不断的深入研究,CAR-T细胞技术已经研制出三代。
第一代CAR 由识别肿瘤外表抗原的单链抗体和免疫受体酪氨酸活化基序〔ITAM〕组成。
然而,ITAM 发出的激活信号只能引起 T 细胞短暂的分裂和较低水平的细胞因子分泌,不能提供长时间的多克隆扩增和持续的体内抗肿瘤效应。
给患者输注第一代 CAR-T细胞2天后, CAR-T细胞在体内可大量繁殖, 但1个月后迅速下降至难以检测的水平, 也没有观察到对肿瘤的免疫应答反响。
虽然对第一代CAR-T细胞的研究较多, 但是大多数试验在细胞扩增、体内存活时间、细胞因子分泌等方面还存在很多问题, 没有到达预期的临床效果。
研究说明, T细胞的完全活化有赖于双信号和细胞因子的作用。
其中第一信号为特异性信号, 由 TCR识别抗原递呈细胞外表的抗原肽-MHC 复合物所启动;第二信号为协同刺激信号, 通过CD28/B7等重要的共刺激分子, 促进IL-2合成, 并使T细胞充分活化及免于凋亡。
对于初始型T细胞(未与抗原接触的T细胞), 如果只有信号1而没有信号2, T 细胞就不能发挥正常作用;即使T细胞与抗原接触, 假设没有协同刺激信号, 细胞也不能发挥正常功能。
嵌合抗原受体抗原识别结构域

嵌合抗原受体抗原识别结构域1.引言1.1 概述嵌合抗原受体(chimeric antigen receptor,CAR)是一种由抗原识别结构域与信号传导域组成的蛋白质复合物,能够在体外或体内有效识别并与特定抗原结合,进而引发免疫应答。
CAR的研究和应用在肿瘤免疫治疗领域引起了广泛关注。
随着基因工程技术的发展,CAR-T细胞疗法已成为一种重要的肿瘤治疗策略。
CAR-T细胞通过将携带嵌合抗原受体的基因导入T细胞中,使其具备了识别和杀伤肿瘤细胞的能力。
这种革命性的治疗方法已经在治疗多种血液恶性肿瘤,如急性淋巴细胞白血病和非霍奇金淋巴瘤等方面取得了显著的突破。
抗原识别结构域是嵌合抗原受体中的关键组成部分,它决定了CAR-T 细胞的特异性和识别能力。
抗原识别结构域通常由单链抗体的变异结构域(scFv)组成,可以通过与抗原相互作用来实现肿瘤细胞的识别和结合。
由于抗原识别结构域的特异性和亲和力对CAR-T细胞疗效至关重要,因此对其结构和功能的深入理解非常重要。
本文将重点讨论嵌合抗原受体抗原识别结构域的特点和重要性,并对其潜在的应用前景进行探讨。
此外,我们还将探讨未来研究方向,以期能够进一步提高CAR-T细胞疗法的疗效和安全性,为肿瘤患者带来更有效的治疗选择。
通过深入探究嵌合抗原受体抗原识别结构域的特性和应用前景,我们可以为肿瘤免疫治疗领域的进一步发展提供有价值的参考。
1.2 文章结构本文将按照以下结构展开讨论嵌合抗原受体抗原识别结构域的相关内容。
首先,在引言部分将对文章的背景和目的进行概述。
接着,正文部分将详细阐述嵌合抗原受体的定义和作用,以及抗原识别结构域的重要性。
最后,在结论部分将展望嵌合抗原受体抗原识别结构域的应用前景,并提出未来研究方向。
在引言部分,我们将首先概述嵌合抗原受体抗原识别结构域的相关背景和研究现状。
我们会介绍嵌合抗原受体的概念以及其在免疫疗法中的作用,为读者提供一个全面的认识。
接下来,我们的重点将转移到抗原识别结构域的重要性。
嵌合抗原受体t细胞 法规

嵌合抗原受体t细胞法规
摘要:
1.嵌合抗原受体(CAR)T 细胞的概念和原理
2.CAR-T 细胞在肿瘤治疗中的应用
3.CAR-T 细胞治疗的优势和挑战
4.我国嵌合抗原受体T 细胞法规政策
5.未来展望
正文:
嵌合抗原受体(Chimeric Antigen Receptor, CAR)T 细胞是一种新型的免疫治疗策略,通过基因工程技术,将具有抗原特异性的嵌合抗原受体引入T 细胞中,使T 细胞具有特异性识别和清除肿瘤细胞的能力。
CAR-T 细胞疗法在多种肿瘤治疗中取得了显著的疗效,如血液肿瘤、实体瘤等。
与传统的化疗和放疗相比,CAR-T 细胞治疗具有以下优势:首先,CAR-T 细胞具有高度特异性,能够精确识别和清除肿瘤细胞,避免对正常细胞的损害;其次,CAR-T 细胞具有强大的抗肿瘤效应,能够有效地消除肿瘤细胞;最后,CAR-T 细胞治疗具有持久的疗效,有望实现长期缓解甚至治愈肿瘤。
尽管CAR-T 细胞治疗取得了显著的疗效,但仍面临许多挑战,如细胞制备过程中的安全性、有效性和质量控制问题,以及治疗过程中可能出现的严重不良反应等。
为了规范和推动CAR-T 细胞治疗的发展,我国政府和监管部门出台了一系列法规政策,如《细胞治疗产品研究与评价技术指导原则》、《免疫细胞治疗产品临床试验技术指导原则》等,为CAR-T 细胞治疗提供了明确的
监管要求和技术规范。
未来,随着嵌合抗原受体T 细胞技术的不断发展和完善,相信CAR-T 细胞治疗将在肿瘤治疗领域发挥越来越重要的作用。
car-t研发药效学评估指标

car-t研发药效学评估指标CAR-T细胞疗法是一种革命性的癌症治疗方法,它利用改造的T细胞来攻击癌细胞。
然而,为了确保CAR-T疗法的疗效和安全性,研发者需要准确评估CAR-T细胞治疗的药效学指标。
本文将为您介绍CAR-T研发中常用的药效学评估指标。
一、CAR-T细胞的表达和持续时间CAR-T细胞疗法通过将CAR(嵌合抗原受体)基因导入T细胞,使其产生特异性抗肿瘤效应。
因此,评估CAR-T细胞的表达水平和在体内的寿命对药效学至关重要。
研究人员常常使用流式细胞术等技术来检测CAR-T细胞的表达情况,并通过动物实验和临床试验来评估CAR-T细胞的寿命。
二、肿瘤细胞减少和消退时间CAR-T疗法的主要目标是通过攻击肿瘤细胞来实现肿瘤的减少和消退。
因此,评估CAR-T细胞疗法在消退肿瘤方面的药效学指标是必要的。
常用的方法包括肿瘤体积的测量、活检样本的分析以及影像学技术(如MRI和CT扫描)的应用。
这些指标可以帮助研究人员了解CAR-T细胞在不同时间点对肿瘤的影响。
三、生存期延长除了消退肿瘤之外,CAR-T细胞疗法还被用作肿瘤治疗的长期方案。
因此,评估CAR-T细胞疗法对患者生存期的延长也是非常重要的药效学指标。
在临床试验中,研究人员通常会记录患者的生存率和无进展生存期。
这些数据有助于评估CAR-T细胞疗法是否能够显著提高患者的生存期。
四、副作用的发生和管理虽然CAR-T细胞疗法具有巨大的潜力,但同样也伴随着一系列的副作用。
因此,准确评估和管理CAR-T细胞治疗过程中的副作用也是很重要的。
其中,常见的副作用包括细胞因子释放综合征(CRS)和神经毒性。
研究人员需要评估这些副作用的严重程度和持续时间,并寻找合适的管理措施,以确保患者的安全。
结论CAR-T研发药效学评估指标的准确性和全面性对于推动CAR-T细胞疗法的发展非常重要。
通过评估CAR-T细胞的表达和持续时间、肿瘤细胞减少和消退时间、生存期延长以及副作用的发生和管理,研究人员可以更好地了解CAR-T细胞疗法的疗效和安全性。
car-t细胞转导效率标准

car-t细胞转导效率标准CAR-T细胞疗法是一种创新型的免疫细胞治疗方法,通过修改患者的自身T细胞,使其表达特定的嵌合抗原受体(CAR),从而增强其与肿瘤细胞的识别和杀伤能力。
然而,CAR-T细胞疗法的转导效率是其成功应用和疗效的重要关键。
本文将从转导效率的定义、影响因素以及提高转导效率的方法进行综述。
转导效率是指向目标T细胞导入CAR基因的成功率。
转导效率的评价可以通过测定CAR-T细胞获得的嵌合抗原受体表达水平来进行。
提高转导效率有助于获得更多的CAR-T细胞,增加针对肿瘤细胞的杀伤能力,从而提高治疗效果。
转导效率受多种因素的影响。
首先,选择合适的载体是关键的。
常用的载体有病毒载体(如逆转录病毒、整合性逆转录病毒等)和非病毒载体(如电穿孔法、基因枪法等)。
病毒载体通常具有高转导效率,但可能造成免疫反应和基因插入随机性。
相比之下,非病毒载体虽然转导效率较低,但安全性较高。
因此,在选择载体时需要综合考虑转导效率和安全性的平衡。
其次,影响转导效率的因素还包括靶向T细胞的选择和分离方法。
一般来说,使用靶向性更强的T细胞亚群(如中央记忆性T细胞)能够提高转导效率。
此外,使用良好的T细胞分离方法以获得高纯度的T细胞也是提高转导效率的关键步骤之一另外,辅助因子的添加也能够提高转导效率。
例如,使用细胞转染试剂可以增加转导效率。
此外,还可以添加特定生长因子来促进CAR-T细胞的增殖和存活,从而提高转导效率。
最后,优化CAR的设计也能够提高转导效率。
选择合适的单链变异抗体、信号域和共刺激域可以增强CAR的结合能力和激活效果。
此外,合理设计CAR的表达水平和稳定性也是提高转导效率的重要因素。
总结来说,提高CAR-T细胞的转导效率是现阶段CAR-T细胞疗法研究的重要目标之一、选择适当的载体、靶向细胞的选择、辅助因子的添加、CAR的优化设计以及使用多种方法的组合都有助于提高转导效率。
通过不断的研究和优化,相信转导效率的标准将不断提高,为患者提供更加有效的CAR-T细胞疗法。
降低亲和力提高HER2-CAR-T细胞治疗的安全性

降低亲和力提高HER2-CAR-T细胞治疗的安全性章浩;叶真龙;钱其军【摘要】Objective To investigate whether decreasing affinity of CAR-T cells can increase their therapeutic outcome or not .Methods Moderate affinity La-G3HER2-CAR and high affinity Ha-G3HER2-CAR were constructed ,and electroporated to modify T cells .Western blot assay ,FCM assay and the RTCA DP cytotoxic equipment were applied to test the CAR expres-sion and cytotoxic function of CAR-T cells .Results 43000 and 58000 exogenous CD3ζfragments were expressed by both La-G3HER2-CAR-T cells and Ha-G3HER2-CAR-T cells with 58 .1% and 69 .0% transfection rate respectively .High affinity Ha-G3HER2-CAR-T cells effectively killed all target tumor cells by which HER2 was expressed at variable expression levels , while moderate affinity La-G3HER2-CAR-T cells specifically killed HER2 high-level expressing SK-OV-3 and BT474 cells ,and showed weaker cytotoxicity on HER2 moderate-level expressing MDA-MB-231 and HCC-202 cells ,and showed no cytotoxicity on HER2 low-level expressing MCF-7 and 293 cells .The underlying mechanic investigation found that La-G3HER2-CAR-T cells and Ha-G3HER2-CAR-T cells were differentially activated by co-culture with MDA-MB-231 (CD107a:8 .2% vs 71 .6% , IFN-γ:66 .3% vs 83 .4% ,TNF-α:73 .4% vs 94 .1% ) .Conclusio n Moderate affinity La-G3HER2-CAR-T cells have en-hanced specific cytotoxicity toward target tumor cells compared to high affinity Ha-G3HER2-CAR-T cells ,decreasing affinity of CAR-T cell is a promising strategy to increase the therapeuticoutcome of CAR-T cell based immunotherapies .%目的探讨降低CAR-T细胞亲和力是否能有效提高其杀伤特异性,减少"脱靶效应".方法构建靶向HER2的中等亲和力和高亲和力的La-G3HER2-CAR和Ha-G3HER2-CAR并电穿孔转染T细胞,采用Western Blot、FCM技术和xCELLigence RTCA DP进行CAR载体表达和杀伤功能检测.结果 La-G3HER2-CAR-T细胞和Ha-G3HER2-CAR-T细胞分别表达43000和58000的外源CAR载体片段,转染效率分别为58.1%和69.0%.高亲和力的Ha-G3HER2-CAR-T细胞对高、中、低水平表达HER2的6种靶细胞均有效杀伤,而低亲和力的La-G3HER2-CAR-T细胞高效杀伤HER2高表达的SK-OV-3和BT474细胞,对HER2中表达的MDA-MB-231和HCC-202的杀伤作用较弱,而对低水平表达HER2的MCF-7和293细胞不杀伤.进一步的机制研究发现,HER2中水平表达的MDA-MB-231细胞共培养对La-G3HER2-CAR-T细胞和Ha-G3HER2-CAR-T细胞激活和细胞因子分泌诱导水平不同(CD107a:8.2%vs 71.6%;IFN-γ:66.3%vs 83.4%;TNF-α:73.4%vs 94.1%).结论中等亲和力La-G3HER2-CAR-T细胞比高亲和力的Ha-G3HER2-CAR-T细胞的杀伤作用特异性更强,降低CAR-T细胞的亲和力可以提高治疗的安全性.【期刊名称】《药学实践杂志》【年(卷),期】2016(034)003【总页数】6页(P261-266)【关键词】人表皮生长因子受体2;嵌合抗原受体;T细胞;细胞免疫治疗【作者】章浩;叶真龙;钱其军【作者单位】第二军医大学东方肝胆外科医院病毒基因治疗实验室 ,上海200438;第二军医大学东方肝胆外科医院病毒基因治疗实验室 ,上海200438;第二军医大学东方肝胆外科医院病毒基因治疗实验室 ,上海200438【正文语种】中文【中图分类】R730.5·生物治疗·[DOI] 10.3969/j.issn.1006-0111.2016.03.018嵌合抗原受体(chimeric antigen receptor, CAR)修饰的T细胞(CAR-T cells)是近年来快速发展的过继免疫治疗新策略,CAR-T细胞在恶性肿瘤的治疗中已取得实质性的进展,特别是CTL019 CAR-T细胞治疗B系淋巴细胞白血病被FDA评价为突破性的疗法[1]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
嵌合抗原受体(CAR)治疗的安全性摘要:输注基因定向改造的嵌合抗原受体T细胞来识别并杀灭肿瘤,已经在许多I期临床试验中取得成功。
由于会产生非肿瘤靶向和细胞因子释放综合征,所以需要有预防或减轻严重不良反应的对策。
目前正积极研究通过药物治疗、自杀基因或其他新的办法,使其只针对恶性肿瘤有细胞毒性。
在这篇综述中,我们调查总结了嵌合抗原受体改造的T细胞的毒性,并重点发布这充满前景的细胞治疗方法的安全性策略。
关键词:嵌合抗原受体,自杀基因,安全开关,过继免疫治疗,细胞治疗1. 引言同种异体造血干细胞移植(allo-HCT)是免疫治疗中一种有效方法,通过天然免疫系统和获得性免疫系统协同产生抗肿瘤作用。
通过识别肿瘤相关抗原(TAAs)或次要组织相容性抗原(mHags),供体淋巴细胞输注(DLI)给移植后白血病复发的患者可介导抗肿瘤作用。
然而,由于大多数TAA自身蛋白表达异常,以致T细胞表达低亲和力T细胞受体(TCR),排斥反应可能比移植物抗肿瘤效应(GVT)更强。
虽然用于治疗慢性粒细胞性白血病效果很好,而急性白血病异体淋巴细胞输注疗效有限,其2年生存率不到20%。
此外,并发症移植物抗宿主病(GVHD)造成病人死亡或生活质量下降占显着比例,有报道显示接受匹配供体的造血干细胞移植的患者GVHD发生率高于50%。
虽然有报道称产生植物抗肿瘤效应(GVT)而没有发生移植物抗宿主病(GVHD)的情况,本文编译作者爱康得Paul认为两种机制的重叠,次要组织相容性抗原(mHags)介导了移植物抗肿瘤效应(GVT)和移植物抗宿主病(GVHD),可同时作用于造血和非造血组织。
临床试验中将次要组织相容性抗原(mHags)特异性T细胞扩增并过继输注到移植后疾病复发的患者身上,部分患者可获得暂时性完全缓解(CR),然而此方案因果规律复杂,并且T细胞在体外扩增长达12周。
长期的培养可导致T 细胞衰竭,这可能是其在患者体内持续性有限的一个潜在原因。
另一个方法是利用转基因TCR或嵌合抗原受体(CAR)基因修饰的T细胞。
然而TCR转导的T细胞受HLA限制,TCR和内源性TCR错配可导致亲和力降低或表达不期望的特异性。
而CAR可作为免疫治疗的通用平台,因为它不受HLA 限制。
在T细胞单链杀伤装置上负载特异性抗体,这种错配的风险很低。
另外,HLA识别抗原的独立机制,可以防止CAR-T细胞在抗原的处理加工中出现免疫逃避机制。
通常CAR-T只在正常细胞与肿瘤细胞间非多态地识别表面分子,以提高对其安全的正当关切。
事实上,输注CAR-T细胞使难治性白血病得到完全缓解的同时,也会伴有细胞因子释放综合征,在靶向肿瘤相关抗原(TAAs)的实体瘤时甚至可出现致命的非肿瘤靶向毒性。
这些问题促使美国国立卫生研究院重组DNA咨询委员会提供了一些临床建议,包括实施小剂量递增方案,共表达自杀基因来阻断不可控毒性的或控制远期毒性。
在这篇综述中,我们将讨论基因修饰的自体或异体T细胞,用于癌症免疫治疗的安全性的当前理念和应对措施。
2. CAR-T细胞的设计鉴于第一代CARs(图1A)有限的扩增和持久性,研究者在病毒特异性T 细胞表面导入CAR,为了可以让抗原递呈细胞交叉递呈的抗原产生共刺激。
11位患有进展期神经母细胞瘤的儿童给予disialoganglioside GD2第一代CAR修饰的EB病毒特异性CTL细胞。
基因修饰的细胞在几乎一半的病例体内持续了数周的转运与介导的客观反应,11患者中3/4获得完全缓解。
图1:CAR的结构和降低毒性的双靶向临床前策略。
(A)CAR的胞外结构包括先导序列,单链可变区(scFv)(H (重) 和L (轻) 链),通过接头(如SG,GS)连接。
间隔区(如人免疫球蛋白D分子铰链区)具有柔韧性并连接跨膜区(TM)。
跨膜区包括例如人免疫球蛋白G的恒定区,胞内结构域包括CD3ζ内切域(第一代的CARs),加上CD28域(第二代),或再加一个额外的共刺激域(第三代CARs)。
(B)用双靶向来减少毒性反应:(i)反式信号传导CAR将共刺激域和杀伤域分别靶向2种不同的肿瘤抗原,当只有1个抗原结合时限制CAR的激活,(ii)抑制性CAR是用抑制性信号域取代ζ链,抑制了共表达活化CAR 的激活信号,(iii)串联型CAR是由单结构靶向2个不同抗原的2个抗原结合片段组成的,当它们同时结合可产生协同效应。
CAR-1和CAR-2作为示例,分别识别抗原-1和抗原-2.为进一步提高CAR-T的扩增能力和持续性,研究人员在ζ链中加入了一种或多种共刺激信号域,这便分别出现了第二代和第三代CARs,主要提高CAR 修饰的T细胞扩增能力和避免T细胞诱导激活的细胞凋亡(图1A)。
确实,临床前模型证明这一尝试是成功的,后来的临床试验也证实了在CD19恶性淋巴瘤患者中使用的二代CD19 CAR-T细胞,其扩增能力和持久性高于第一代CD19 CAR-T细胞。
来自许多机构的临床试验报道了靶向复发性难治性急性淋巴细胞白血病(ALL)的惊人疗效。
总的来说,已报道的CD19 CAR-T细胞控制并缓解了患者的复发性难治性急性淋巴细胞白血病(ALL)。
大多数试验包括化疗清髓都是努力为了给T细胞扩增创造一个有利的内环境。
Davila等人报道在输注CD28共刺激域的CAR-T细胞,50%成人白血病患者获得了造血干细胞移植的效果,在最后一次随访时仍在持续缓解。
Maude报告了30名儿童和成人患者接受了4-1BB 共刺激域的CD19 CAR-T细胞治疗,其中27例患者(90%)获得完全缓解(CR),包含2名blinatumomab难治性和15名接受过造血干细胞移植的患者。
CAR-T细胞在患者体内应答扩增可通过血液,骨髓和脑脊液检测到。
6个月的无进展生存率为67%,总生存率为78%。
研究者证实在此项试验中,患者即使不进行同种异体造血干细胞移植,CAR治疗可能会让患者持续缓解长达2年以上。
Lee等人,以学龄儿童和年轻人为主的复发性难治性急性淋巴细胞白血病(ALL),通过CD28共刺激域的自体CD19 CAR-T治疗,70%B型急性淋巴细胞白血病(B-ALL)患者和60%MRD阴性的患者获得完全缓解。
12名治疗后MRD阴性患者中有10名接受了异体造血干细胞移植,在中位随访中保持无疾病状态10个月。
已有报道CD19 CAR治疗难治性慢性淋巴细胞白血病(CLL)患者的成功案例,而更大规模的CD19-CAR研究需要在非霍奇金淋巴瘤上进行,非霍奇金淋巴瘤的CD20 CAR-T细胞治疗初步获得了一些可喜的成绩。
本文编译作者爱康得Paul认为CAR-T治疗实体瘤的最佳疗效可能需要一些额外的修饰。
尽管晚期实体瘤患者接受抗间皮素mRNA电转导的T细胞治疗(RNA-CAR-T-meso cells)出现肿瘤消退的证据,而神经母细胞瘤患者使用GD2靶向的CAR-T细胞治疗可见疾病的完全缓解。
通过他优秀的综述可知,CAR的靶向抗原种类在迅速增加。
提高体外扩增的基因修饰的T细胞疗效的维持,自我更新,侵润以及归巢能力正在积极的研究中。
值得注意的是,在大部分研究中,T细胞激活用CD3/CD28小体而不是可溶的CD3-抗体,这可能有助于提高体内的疗效。
在临床试验中需要评估,幼稚细胞还是中央记忆细胞诱导的效应T细胞,能有更强的扩增能力、持久性和抗肿瘤活性。
意大利研究小组报道,在低浓度(IL)-7和IL-15中,用CD3和CD28抗体偶联小体激活的幼稚T细胞能促进T记忆干细胞(TSCM)的持续和扩增,分别连续植入小鼠中,提示有自我跟新的能力。
3.自体CAR T-Cells输注的副作用在临床试验中CAR-T细胞产生非肿瘤靶向作用和细胞因子释放综合征(CRS),以及在急性髓性白血病(AML)的临床前模型中有明显的骨髓抑制。
严重不良事件(SAEs)可能与一些因素相关,包括输注细胞的剂量,受治者体内的残留病灶以及靶抗原在正常组织中的表达量。
由于肿瘤相关性抗原也会在正常组织中表达,为了尽量降低基因重组T细胞的毒性风险,首先应选取肿瘤细胞特异性表达的抗原。
然而这样的抗原通常不易获得,当靶向目标抗原时,进行体外和(或)体内试验来尝试预测毒性的风险。
体外细胞毒性试验充满挑战,TAA重定向的T细胞与表达目的抗原的靶向肿瘤细胞,包括来源于正常组织的细胞,可能不会重现体内模型的三维立体复杂结构。
体内动物模型包括注射人基因转导的T细胞,表达人抗原的人源化抗原转基因小鼠模型,或在小鼠T细胞上导入CAR分子靶向鼠源相关抗原的小鼠模型。
尽管已在动物模型中对细胞因子释放综合征(CRS)和B细胞再生障碍进行了研究,但存在的一些局限性可能限制这些现象在人类中重现,人和动物的生物等效性和生物分布之间的关联存在不同,以及有不同抗原的表达,共刺激分子的表达和(或)细胞因子环境。
非灵长类动物模型也被用来评价基因修饰的T细胞对正常组织的毒性,其优点是它与人蛋白序列同源性程度较好。
正如之前所述,为尽力提高细胞在体内扩增和抗肿瘤活性,第二、三代CAR 被开发出来。
然而可以预料的是由于T细胞被高度活化和(或)协同刺激,输注第二、三代CAR-T细胞会导致毒性风险的增加。
事实上,输注第二代CAR-T 细胞会造成较高的严重细胞因子释放综合征(sCRS)发生率。
在治疗实体瘤中,由于肺上皮细胞表达低水平的HER-2,以及包含CD28和4-1BB共刺激分子的高效CAR,靶向HER-2抗原的第三代CAR-T细胞可引发致命的肺毒性。
CD19 CAR-T细胞研究中,B细胞再生障碍和细胞因子释放综合征(CRS)常被报道。
一些患者会发生令人担忧的但可逆的神经系统症状,如谵妄和癫痫发作,后者更像是全身T细胞介导的炎症反应,而不是CAR-T细胞直接导致的脑毒性。
CAR-T细胞应用于髓性白血病已在小鼠模型中测试,进一步的临床开发被严重的骨髓抑制所阻碍,因此必须找出克服这种严重不良反应的方法,例如备用正常的造血干细胞和成熟的造血祖细胞。
另一个潜在的严重不良反应是利用植入热点的整合型载体修饰的细胞,可能导致致癌基因失去调控而癌变。
虽然在时刻监控着输注的转导干细胞,但是在临床研究中,使用转基因T细胞导致这种严重的不良反应至今未有报道。
4. 美国国立卫生研究院重组DNA咨询委员会的建议这些建议为进行CAR-T临床研究的科学家提供指导。
这些建议对第一代CAR-T细胞的临床试验(不含EB病毒特异性细胞毒性T细胞)和第二、三代CAR-T细胞的临床试验进行了区分,在给药指导中,对细胞因子或预处理以及输注的剂量时间提供建议。
对于第一代CAR-T细胞,第一代CAR负载的EBV T 细胞,第二、三代CAR-T细胞,建议临床初始剂量分别为3×106/kg,3×106/kg,3×105/kg。
