嵌合抗原受体T细胞-1
嵌合抗原受体-T细胞治疗非小细胞肺癌的进展和局限性

嵌合抗原受体-T细胞治疗非小细胞肺癌的进展和局限性
李广源;郭彦伟
【期刊名称】《黑龙江医学》
【年(卷),期】2024(48)12
【摘要】近年来,手术治疗和常规放化疗一定程度上延长了非小细胞肺癌(NSCLC)
患者的总生存期,但多数患者在确诊时已发展为晚期阶段或已有远处转移,这导致NSCLC患者在接受当前这些治疗措施后的预后依然不容乐观。
嵌合抗原受体-T细胞(CAR-T细胞)是一种新兴的免疫细胞过继疗法,目前主要用于治疗血液系统恶性
疾病,这一治疗方法尚未在临床上施用于实体肿瘤中,不过在多项关于NSCLC的试
验中,CAR-T细胞表现出了一定的疗效,但同时多种限制性因素也在一定程度上抑制了CAR-T细胞发挥其效应功能。
文章概括了CAR-T细胞的基本结构、制备过程、作用机制以及应用于NSCLC治疗的进展和局限性。
【总页数】4页(P1528-1531)
【作者】李广源;郭彦伟
【作者单位】郑州大学第五附属医院肿瘤内科
【正文语种】中文
【中图分类】R734.2
【相关文献】
1.嵌合抗原受体T细胞治疗复发难治弥漫大B细胞淋巴瘤进展
2.嵌合抗原受体T
细胞治疗非小细胞肺癌的现状和挑战3.嵌合抗原受体NK细胞治疗肝细胞癌的研
究进展4.T细胞恶性肿瘤的嵌合抗原受体T细胞治疗研究进展5.嵌合抗原受体T 细胞免疫治疗所致细胞因子释放综合征相关细胞因子的研究进展
因版权原因,仅展示原文概要,查看原文内容请购买。
与嵌合抗原受体有关的t细胞表面分子的特点

与嵌合抗原受体有关的t细胞表面分子的特点
嵌合抗原受体(chimeric antigen receptor,CAR)是一种通过
基因工程技术产生的重组蛋白质,能够将T细胞和抗原结合
起来,从而增强T细胞对肿瘤细胞的识别和攻击能力。
与嵌合抗原受体有关的T细胞表面分子主要有以下几个特点:
1. 单链变异段(single-chain variable fragment,scFv):CAR
的关键部分是其外部刺激受体结构域,通常由单链变异段构成。
这个结构域通过与特定抗原结合,使CAR能够识别和定位肿
瘤细胞。
2. CD3ζ链:CD3ζ链是一个与CAR的内部信号传导相关的区域。
它能够通过与其他蛋白质相互作用,激活T细胞的抗肿
瘤效应。
3. 共刺激信号分子:为了激活CAR T细胞的功能,CAR通常
还会包含激活共刺激信号分子,如CD28或4-1BB。
这些共刺
激信号分子能够增强T细胞的存活能力和功能,提高对肿瘤
细胞的杀伤效果。
4. 载体:CAR通常通过质粒或病毒载体系统表达在T细胞表面。
这些载体能够将CAR的基因导入到目标T细胞中,从而
使其表达CAR,并增强T细胞对肿瘤细胞的识别和攻击能力。
总的来说,与嵌合抗原受体有关的T细胞表面分子具有特定
的结构域、信号传导区域和共刺激信号分子,能够增强T细
胞对肿瘤细胞的识别和攻击能力。
这些特点使得CAR T细胞
具有更强的抗肿瘤效应,被广泛研究和应用于肿瘤免疫治疗中。
car-t工作原理

car-t工作原理Car-T(嵌合抗原受体T细胞疗法)是一种新兴的癌症免疫治疗方法,通过改造患者的T细胞,使其能够识别和消灭肿瘤细胞。
它的工作原理可以总结为以下几个步骤:采集T细胞、设计和构建嵌合抗原受体、扩增和激活改造的T细胞、注入到患者体内。
首先,需要采集患者的T细胞。
这通常通过外周血或者肿瘤组织等途径完成。
采集到的T细胞会被送往实验室进行后续处理。
在实验室中,科研人员将设计和构建嵌合抗原受体(CAR)。
CAR 是一种蛋白质分子,由多个部分组装而成,包括外部的抗原结合区域和内部的信号传导区域。
抗原结合区域能够识别特定的肿瘤抗原,而信号传导区域能够激活和增强T细胞的抗肿瘤活性。
当CAR的设计和构建完成后,下一步是将其导入到T细胞内。
为了实现这一点,通常使用病毒载体。
这些病毒载体被改造成可携带CAR 的形式,并且具有足够的感染能力。
当T细胞与携带CAR的病毒载体接触时,病毒会将CAR的遗传信息导入到T细胞内。
这样,T细胞就被改造成拥有特定抗原识别能力的CAR-T细胞。
改造完成后,CAR-T细胞需要经过扩增和激活。
在实验室中,科研人员会提供适当的培养环境和刺激物,使CAR-T细胞能够大量增殖和活化。
这样可以获得大量数量和高度活性的CAR-T细胞。
最后一步是将改造后的CAR-T细胞注入到患者体内。
在注射之前,通常需要对患者进行一些预处理,如化疗或放疗,以减少肿瘤负荷和提高CAR-T细胞的生存率。
一旦注射完成,CAR-T细胞会在体内寻找和识别肿瘤细胞。
通过CAR与肿瘤抗原的结合,CAR-T细胞会释放细胞毒性物质并释放促凋亡信号,从而引发肿瘤细胞的死亡。
除了直接杀伤肿瘤细胞外,CAR-T细胞还具有其他作用。
它可以激活免疫系统中的其他免疫细胞,如自然杀伤细胞和巨噬细胞,以协同作用来清除肿瘤细胞。
此外,CAR-T细胞还具有一定的记忆效应,能够识别和杀伤肿瘤细胞的再现。
总的来说,CAR-T疗法通过改造患者的T细胞,使其能够识别和消灭肿瘤细胞。
CAR-T疗法

CAR-T疗法CAR-T疗法就是嵌合抗原受体T细胞免疫疗法。
这是一种治疗肿瘤的新型精准靶向疗法,在临床肿瘤治疗上取得了很好的效果,是一种能够精准、快速、高效,且有可能治愈癌症的新型肿瘤免疫疗法。
T细胞也叫T淋巴细胞,是人体免疫细胞细胞的一种,产生于骨髓造血干细胞,在胸腺中发育成熟,然后转移到人体血液、淋巴和周围组织器官,发挥免疫防御功能。
其作用相当于人体内的"战士",能够抵御和消灭"敌人",如感染、肿瘤、外来异物等。
实验技术人员通过基因工程技术,给T细胞加入精准识别系统-CAR(肿瘤嵌合抗原受体),将普通的T细胞改造成能够精准识别的"超级战士",即CAR-T细胞,它利用其"精准识别系统"CAR,专门识别体内的肿瘤细胞,并通过免疫作用释放大量的多种效应因子,它们能高效地消灭肿瘤细胞,从而达到治疗恶性肿瘤的目的。
具体步骤如下:1、评估患者是否可以接受CAR-T治疗。
现在看来基本上绝大多数人还是可以的。
2、从患者的身上分离出一种免疫细胞-T细胞(我们身体中能够抵御疾病、感染、肿瘤的免疫细胞)。
3、利用基因工程技术对T细胞进行改造,需要在体外给它加入一个能识别肿瘤,并且同时激活T细胞的嵌合抗体CAR,这时候一个普通的T细胞就变成了一个带有精准识别系统的超级战士。
4、扩增。
通过体外培养获得大量的CAR-T细胞。
一般来讲,一个病人需要几十亿乃至上百亿个CAR-T细胞,通常体型越大的人需要的量就越多。
5、把培养好的CAR-T细胞回输到病人体内。
6、观察期,这段时间需要对病人严密监护,尤其回输的前几天,身体的反应是非常剧烈的,这时候一定要有医护人员帮助与指导。
可用于哪些患者:目前CAR-T治疗主要还是用于血液肿瘤中的某些肿瘤,比如说:淋巴瘤、多发性骨髓瘤、复发难治多发性骨髓瘤、急性淋巴细胞白血病等,目前主要这三大类疾病是CAR-T 治疗的适应症。
PD-1敲除及GPC3修饰的嵌合抗原受体T细胞治疗肝癌的实验研究

DOI: 10.3969/j.issn.1673-713X.2021.01.004·论著·PD-1敲除及GPC3修饰的嵌合抗原受体T细胞治疗肝癌的实验研究姜舒,王冰,郭霞,张芸,谢亮,罗朝霞,刘赢滢【摘要】目的构建程序死亡受体1(PD-1)敲除及磷脂酰肌醇蛋白多糖-3(GPC3)修饰的嵌合抗原受体T 细胞(GPC3-PD1gRNA-CART cells),研究其对肝癌细胞株HepG2 的体外杀伤作用,以及其对肝癌动物模型的体内抗肿瘤作用。
方法制备GPC3-PD1gRNA-CART 细胞,用流式细胞仪检测PD-1、GPC3 CAR 的表达情况。
体外实验中,设立不同的效靶比(1:1、2:1、4:1),用LDH 法测定刀豆蛋白刺激后的GPC3-PD1gRNA-CART 细胞体外对HepG2 细胞株的杀伤率,检测刀豆蛋白刺激后的GPC3-PD1gRNA-CART 细胞和HepG2 细胞株共孵育18 h 后的细胞培养上清液中IFN-γ 的释放水平。
设置受刀豆蛋白 A 刺激的和未受刀豆蛋白 A 刺激的GPC3 修饰的CART 细胞(GPC3 CART cells)作为对照组。
于重度免疫缺陷小鼠(NDG 小鼠)皮下注射HepG2 细胞建立肝癌动物模型,观察GPC3-PD1gRNA-CART 细胞体内抑瘤作用。
实验分为模型组、实验组(GPC3-PD1gRNA-CART 组、GPC3 CART组),模型组和实验组通过皮下注射 1 × 106个HepG2 细胞造模,在肿瘤长径达3 mm 后实验组经尾静脉注射5 × 106个GPC3-PD1gRNA-CART 细胞或GPC3 CART 细胞,模型组经尾静脉注射0.9% NaCl,每周注射 1 次,共 3 周,注射体积均为0.2 ml。
每隔 2 天观测肿瘤体积情况,治疗 3 周后取皮下肿瘤组织,HE 染色检测肿瘤组织情况。
结果流式细胞术分析结果显示,GPC3 CAR 表达率为98.8%。
嵌合抗原受体T细胞

T-cells to help fight my le精u选keppmt ia.
21
Emily
2010年5月(5岁),ALL
2011年10月,复发
2012年1月,化疗
2012年2月,骨髓移植前一周复发
2012年2-3月,各种化疗
2012年4月,加入临床试验(CAR-T)
2012年5月,缓解
highly experimental but my mommy and daddy knew we
had to try something different to treat my cancer. I was
the first pediatric patient to receive genetically modified
宾夕法尼亚大学医院---成人试验---5名患者 ---26~66岁
精选ppt
15
患者治疗前情况
26名患者,B细胞ALL,有1~4次复发 3名患者, B细胞ALL,无复发 1名患者,复发的T细胞ALL,CD19阳性 18名患者,异源干细胞移植后复发 3名患者,以前使用过blinatumomab,无作
特异性识别肿瘤细胞,并且同时激活T细胞 杀死肿瘤细胞的嵌合抗体
精选ppt
3
精选ppt
4
精选ppt
5
精选ppt
6
CAR-T免疫疗法的优点
优点 靶向性强 适用范围广 降低耐药性产生的风
险
其他疗法 放疗 化疗 靶向治疗
精选ppt
7
CAR-T免疫疗法的缺点
细胞因子释放综合征(CRS)
急性白血病AL 急性淋巴细胞白血病
ALL 急性髓系白血病AML
慢性白血病CL 慢性淋巴细胞白血病
嵌合抗原受体T细胞免疫疗法
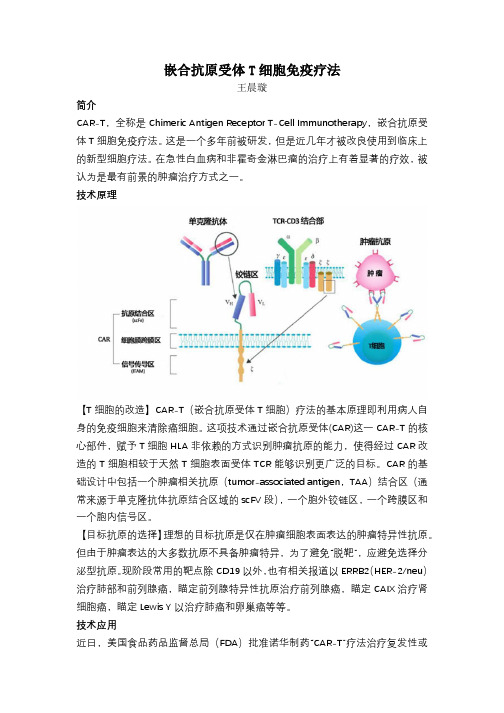
嵌合抗原受体T细胞免疫疗法王晨璇简介CAR-T,全称是Chimeric Antigen Receptor T-Cell Immunotherapy,嵌合抗原受体T细胞免疫疗法。
这是一个多年前被研发,但是近几年才被改良使用到临床上的新型细胞疗法。
在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被认为是最有前景的肿瘤治疗方式之一。
技术原理【T细胞的改造】CAR-T(嵌合抗原受体T细胞)疗法的基本原理即利用病人自身的免疫细胞来清除癌细胞。
这项技术通过嵌合抗原受体(CAR)这一CAR-T的核心部件,赋予T细胞HLA非依赖的方式识别肿瘤抗原的能力,使得经过CAR改造的T细胞相较于天然T细胞表面受体TCR能够识别更广泛的目标。
CAR的基础设计中包括一个肿瘤相关抗原(tumor-associated antigen,TAA)结合区(通常来源于单克隆抗体抗原结合区域的scFV段),一个胞外铰链区,一个跨膜区和一个胞内信号区。
【目标抗原的选择】理想的目标抗原是仅在肿瘤细胞表面表达的肿瘤特异性抗原。
但由于肿瘤表达的大多数抗原不具备肿瘤特异,为了避免“脱靶”,应避免选择分泌型抗原。
现阶段常用的靶点除CD19以外,也有相关报道以ERRB2(HER-2/neu)治疗肺部和前列腺癌,瞄定前列腺特异性抗原治疗前列腺癌,瞄定CAIX治疗肾细胞癌,瞄定Lewis Y以治疗肺癌和卵巢癌等等。
技术应用近日,美国食品药品监督总局(FDA)批准诺华制药“CAR-T”疗法治疗复发性或难治性儿童、青少年B-细胞急性淋巴细胞白血病。
同时,CAR-T技术治疗非霍奇金淋巴瘤、慢性淋巴瘤治疗白血病、胰腺间皮瘤、卵巢癌、B细胞癌症、成神经细胞瘤等技术也都在临床试验阶段。
CAR-T的治疗流程大致如下:1、分离:从癌症病人身上分离免疫T细胞。
2、修饰:用基因工程技术给T细胞加入一个能识别肿瘤细胞并且同时激活T细胞的嵌合抗体,也即制备CAR-T细胞。
3、扩增:体外培养,大量扩增CAR-T细胞。
2023年北京市各区(海淀朝阳丰台东西城等)高三下生物高考一模汇编10 免疫调节含详解

专题10 免疫调节1.(2023·北京海淀·统考一模)甲型流感病毒侵染人体后,人体多种免疫细胞发挥免疫防御作用。
下图是免疫细胞示意图,相关叙述正确的是()A.巨噬细胞和B淋巴细胞不具有抗原呈递功能B.T淋巴细胞产生抗体特异性结合甲流病毒抗原C.树突状细胞和巨噬细胞都参与构成第二道防线D.B淋巴细胞识别被感染细胞并导致其裂解死亡2.(2023·北京朝阳·统考一模)CD47在多种肿瘤细胞高表达,通过与巨噬细胞表面SIRPα互作使肿瘤细胞逃避吞噬清除。
研究者将CD47鼠源单克隆抗体与表达CD47的非肿瘤细胞共孵育后,加入荧光标记的SIRPα,检测细胞表面的荧光强度,结果如图。
相关说法正确的是()A.CD47通过与SIRPα互作提高了机体免疫监控能力B.制备鼠源单克隆抗体需将人B细胞与小鼠瘤细胞融合C.CD47鼠源单克隆抗体发挥阻断作用存在剂量依赖效应D.非肿瘤细胞替换成肿瘤细胞可检测肿瘤细胞被清除效果3.(2023·北京西城·统考一模)在正常孕妇的血清中,存在抗配偶淋巴细胞的特异性抗体(APLA),它可与胎儿细胞上源于父亲的抗原结合,阻止母体免疫系统对胚胎的识别和攻击。
缺乏APLA的孕妇常会发生习惯性流产。
下列叙述错误..的是()A.APLA由母体浆细胞分泌B.APLA能够增强母体对胚胎的免疫反应C.可通过抗原抗体杂交检测APLAD.可给患者接种适量的配偶淋巴细胞进行治疗4.(2023·北京石景山·统考一模)免疫制剂已经广泛应用于疾病的预防与治疗。
下列不属于...该范畴的是()A.口服“糖丸“预防脊髓灰质炎B.利用生长激素释放抑制激素治疗肢端肥大症C.利用免疫抑制剂治疗类风湿性关节炎D.注射破伤风免疫球蛋白治疗破伤风5.(2023·北京海淀·一模)接种疫苗是预防新冠肺炎的有效措施。
针对当前疫情形势,各地疫情防控指挥部建议符合条件的公众尽快全程接种新冠病毒疫苗(由灭活的新冠病毒制成),提倡完成全程免疫满6个月的公众进行加强免疫。
嵌合抗原受体抗原识别结构域

嵌合抗原受体抗原识别结构域1.引言1.1 概述嵌合抗原受体(chimeric antigen receptor,CAR)是一种由抗原识别结构域与信号传导域组成的蛋白质复合物,能够在体外或体内有效识别并与特定抗原结合,进而引发免疫应答。
CAR的研究和应用在肿瘤免疫治疗领域引起了广泛关注。
随着基因工程技术的发展,CAR-T细胞疗法已成为一种重要的肿瘤治疗策略。
CAR-T细胞通过将携带嵌合抗原受体的基因导入T细胞中,使其具备了识别和杀伤肿瘤细胞的能力。
这种革命性的治疗方法已经在治疗多种血液恶性肿瘤,如急性淋巴细胞白血病和非霍奇金淋巴瘤等方面取得了显著的突破。
抗原识别结构域是嵌合抗原受体中的关键组成部分,它决定了CAR-T 细胞的特异性和识别能力。
抗原识别结构域通常由单链抗体的变异结构域(scFv)组成,可以通过与抗原相互作用来实现肿瘤细胞的识别和结合。
由于抗原识别结构域的特异性和亲和力对CAR-T细胞疗效至关重要,因此对其结构和功能的深入理解非常重要。
本文将重点讨论嵌合抗原受体抗原识别结构域的特点和重要性,并对其潜在的应用前景进行探讨。
此外,我们还将探讨未来研究方向,以期能够进一步提高CAR-T细胞疗法的疗效和安全性,为肿瘤患者带来更有效的治疗选择。
通过深入探究嵌合抗原受体抗原识别结构域的特性和应用前景,我们可以为肿瘤免疫治疗领域的进一步发展提供有价值的参考。
1.2 文章结构本文将按照以下结构展开讨论嵌合抗原受体抗原识别结构域的相关内容。
首先,在引言部分将对文章的背景和目的进行概述。
接着,正文部分将详细阐述嵌合抗原受体的定义和作用,以及抗原识别结构域的重要性。
最后,在结论部分将展望嵌合抗原受体抗原识别结构域的应用前景,并提出未来研究方向。
在引言部分,我们将首先概述嵌合抗原受体抗原识别结构域的相关背景和研究现状。
我们会介绍嵌合抗原受体的概念以及其在免疫疗法中的作用,为读者提供一个全面的认识。
接下来,我们的重点将转移到抗原识别结构域的重要性。
CAR-T细胞疗法首次成功治疗红斑狼疮

最新CAR-T细胞疗法首次成功治疗红斑狼疮CAR-T 细胞疗法,全称是ChimeriC Antigen Receptor T-Cell I mmunotherapy ,指的是嵌合抗原受体T细胞免疫疗法。
简单来说说,就是把病人的T细胞在体外进行基因工程改造,令其识别肿瘤细胞表面抗原,然后把这些改造后的T细胞输回病人体内,达到识别和杀死癌细胞的治疗效果。
自2017年8月30日,FDA批准诺华公司的CAR-T疗法Kymriah (CTL-019)上市以来,全世界已经批准了5款CAR-T疗法上市,其中4款靶向CD19 , 1款靶向BCMA o值得一提的是,中国国家药监局(NMPA) 于2021年6月22日批准了复星凯特的CAR-T细胞治疗产品益基利仑赛注射液(又称阿基仑赛,代号:FKC876),标志着中国迎来首款获批上市的CAR-T细胞治疗产品。
2021年8月5日,德国埃尔朗根-纽伦堡大学的研究人员在《新英格兰医学期刊》(NEJM)上发表了题为:CD19-Targeted CAR T Cells i n Refractory Systemic Lupus Erythematosus 的文章。
研究团队对一名患有严重系统性红斑狼疮的20岁女性患者进行了 C AR-T细胞治疗,该疗法让他的病情很快得到缓解,且没有明显副作用。
该患者也成为了世界上首个接受CAR-T细胞治疗的狼疮患者。
研究团队表示,虽然只是一名患者,但试验结果显示,CAR-T疗法反应迅速,患者症状迅速消退,患者可以说是“完全康复”了,并且已经四个多月无需治疗了。
据悉,研究团队现在正在用CAR-T细胞治疗另外两名严重红斑狼疮患者。
The NEW ENGLAND JOURNAL oʃ M E DIC I N ECORRESPONDENCECD19-Targeted CAR T Cells in RefractorySystemic Lupus Erythematosus对于狼疮患者而言,他们的敌人不是肿瘤,而是自身的免疫系统,他们自身的免疫系统错误地产生抗体并攻击自己的身体组织。
CAR—T细胞治疗在血液系统恶性肿瘤中的研究新进展

CAR—T细胞治疗在血液系统恶性肿瘤中的研究新进展随着社会发展、环境改变等因素,血液系统恶性肿瘤患病人数不断增多,包括淋巴瘤、骨髓瘤、白血病等多种疾病,以往采取化疗等方式治疗,效果并不十分理想。
嵌合抗原受体T(CAR-T)细胞治疗属于新型方法,通过对患者输注足量的CAR-T细胞,达到识别肿瘤细胞、靶向杀伤的目的,应用价值较高,且不会出现严重不良后果,安全性、患者耐受性均相对较佳,其以自身免疫细胞对癌变细胞进行清除为基本原理。
通过一系列改进,目前以第四代CAR-T细胞治疗为主,其在前几代基础上,加入可选择性的标记,在T细胞修饰、T细胞扩增终止等方面均有其独特优势。
但CAR-T细胞疗法目前尚处于Ⅰ期研究,技术并不成熟,且多以B细胞恶性肿瘤疾病为主,在诸多抗原中,主要对CD19进行研究,而对T细胞恶性肿瘤疾病及其他抗原应用效果文献较少,还需扩大样本容量进一步深入探讨。
该研究对血液系统恶性肿瘤疾病采取CAR-T细胞治疗的研究进展进行如下综述,便于临床治疗工作的实施,为进一步研究奠定基础。
[Abstract] With the social development and environmental changes,the number of malignant tumors in the blood system constantly increases,including the lymphoma,myeloma,leukemia,and the effect of chemotherapy is not ideal,and the infusion of sufficient CAR-T cell of patients can reach the aim of identifying the tumor cells and targeted killing,with higher application value,without serious adverse outcomes,better safety and resistance,currently,the four-generation CAR-T cell by a series of improvement can be the main,it increases the selective markings on the basis of the generations before,which has the unique advantages in the T cell decoration and T cell expansion termination,but the CAR-T cell therapy is still at the stage I study,and the technology is not mature,mostly dominated by the B cell malignant tumor diseases,and in most antigens,the CD19 is the major research object,and the literatures of T cell malignant tumor diseases and application effect of other antigens were fewer,which needs the further study. The paper elaborates the new research progress of CAR-T cell treatment in the malignant tumors of blood system in order to provide convenience for the implementation of clinical treatment work thus laying foundation for the further study.[Key words] Blood system malignant tumor;CAR-T;Cell therapy近幾年来,血液系统恶性肿瘤疾病发生概率逐渐增高,对患者生活质量及生命安全造成严重影响,涉及淋巴瘤、骨髓瘤、白血病等,此疾病的发生与环境、遗传、化学药物等因素均有一定关系[1-3]。
肿瘤免疫治疗的新方法CAR-T-细胞治疗

肿瘤免疫治疗的新方法CAR-T 细胞治疗秦皇岛市第四医院病理科康文喜康瑶满迪随着肿瘤免疫学理论和技术的发展,肿瘤免疫治疗近年来取得了长足的进步。
以嵌合抗原受体( chimeric antigen receptor,CAR) 修饰T 细胞为代表的肿瘤靶向免疫治疗的成就受到世界瞩目,在体外和临床试验中表现出良好的靶向性、杀伤性和持久性,给人类抗击肿瘤带来了新的曙光。
嵌合抗原受体(chimeric antigen receptor, CAR) 在体外进行基因重组, 生成重组质粒, 再在体外通过转染技术转染到患者的T细胞胞膜上, 使患者T细胞表达肿瘤抗原受体,转染后经过纯化和大规模扩增后的T细胞, 称之为嵌合抗原受体T细胞(Chimeric Antigen Receptor T-Cell , CAR-T)。
1989年Grooss等首次提出CAR-T细胞这一概念,多年来科学家经过不断的深入研究,CAR-T细胞技术已经研制出三代。
第一代CAR 由识别肿瘤表面抗原的单链抗体和免疫受体酪氨酸活化基序(ITAM)组成。
然而,ITAM 发出的激活信号只能引起 T 细胞短暂的分裂和较低水平的细胞因子分泌,不能提供长时间的多克隆扩增和持续的体内抗肿瘤效应。
给患者输注第一代 CAR-T细胞2天后, CAR-T细胞在体内可大量繁殖, 但1个月后迅速下降至难以检测的水平, 也没有观察到对肿瘤的免疫应答反应。
虽然对第一代CAR-T细胞的研究较多, 但是大多数试验在细胞扩增、体内存活时间、细胞因子分泌等方面还存在很多问题, 没有达到预期的临床效果。
研究表明, T细胞的完全活化有赖于双信号和细胞因子的作用。
其中第一信号为特异性信号, 由 TCR识别抗原递呈细胞表面的抗原肽-MHC 复合物所启动;第二信号为协同刺激信号, 通过CD28/B7等重要的共刺激分子, 促进IL-2合成, 并使T细胞充分活化及免于凋亡。
对于初始型T细胞(未与抗原接触的T细胞), 如果只有信号1而没有信号2, T 细胞就不能发挥正常作用;即使T细胞与抗原接触, 若没有协同刺激信号, 细胞也不能发挥正常功能。
CAR—T细胞免疫疗法的研究进展

CAR—T细胞免疫疗法的研究进展嵌合抗原受体(CAR)-T细胞免疫疗法是过继性细胞免疫疗法中最具有研究前景的方法,它是利用基因技术,在T细胞内导入一个可以将CAR表达于其表面的基因,并使T细胞发挥作用,克服肿瘤局部免疫抑制微环境、打破宿主免疫耐受状态,靶向杀伤肿瘤细胞。
本综述主要探讨CAR-T细胞免疫疗法及其原理、临床应用、存在的安全性问题和应对措施。
标签:嵌合抗原受体;T淋巴细胞;肿瘤免疫治疗嵌合抗原受体(CAR,Chimeric antigen receptor)-T细胞免疫疗法是一种肿瘤过继细胞免疫疗法,基本原理是利用基因工程修饰T淋巴细胞,使其表达嵌合抗原受体,以非MHC(major histocompatibility complex,主要组织相容性复合体)限制性的方式杀伤肿瘤细胞。
CAR的优点在于能非MHC依赖性识别肿瘤蛋白质和脂类抗原,不需要经过抗原递呈细胞(antigen-presenting cell,APC),目前已經发展到第四代,早期主要用于治疗B细胞急性淋巴细胞白血病(B-ALL),慢性淋巴细胞性白血病和B细胞非霍奇金淋巴瘤[2],近年来也用于治疗实体瘤、HIV等。
虽然CAR-T细胞在临床试验中取得了显著的效果,但同时也出现了诸多安全性问题,包括细胞因子释放综合征、肿瘤溶解综合征、神经毒性和脱靶效应等[3]。
1 CAR-T细胞免疫疗法及原理1.1 CAR-T设计原理正常T细胞的活化有赖于双信号:第一信号由TCR识别APC表面的抗原肽-MHC复合物(p-MHC)启动;第二信号由T细胞和APC间共刺激分子的相互作用启动(即B7/CD28协同刺激信号)[4]。
而CAR-T细胞技术的设计原理是使T细胞不需要依赖MHC分子和APC,将识别肿瘤相关抗原(TAA)的单链抗体(scFv)、跨膜的共刺激结构域(如CD28和CD4-1BB)和T细胞的活化基序结合为一体,通过基因转导的方法转染T淋巴细胞,经基因修饰的T细胞通过表达单链抗体增强结合肿瘤细胞的能力,同时激活T细胞,使其增殖并激活其细胞毒活性,使其能特异性地识别和杀伤肿瘤细胞[5]。
car -t疗法制造工艺

car -t疗法制造工艺
"CAR-T疗法"(嵌合抗原受体T细胞疗法)是一种新型的免疫细胞治疗方法,以下是CAR-T疗法的制造工艺的一般流程:
1. T细胞采集:从患者体内提取外周血或骨髓等源头中的T细胞。
这可以通过采用外周血单个核细胞分离、骨髓穿刺或组织损伤之后的自愈过程中产生的间充质干细胞来实现。
2. T细胞扩增:将采集到的T细胞在体外培养并进行扩增。
通常使用适当的培养基和添加适量的细胞因子(如白介素-2)来促进T细胞的增殖和活化。
3. 基因转导:使用载有CAR(嵌合抗原受体)基因的适量病毒载体(如逆转录病毒或Lentivirus)将CAR基因导入到T细胞中。
CAR基因编码了能够识别肿瘤特异性抗原的受体。
4. CAR-T细胞培养:经过基因转导的T细胞在体外继续培养,以确保CAR的表达和功能。
5. CAR-T细胞纯化:通过利用CAR-T细胞上表达的特异性标志物,如CD19或CD20,对CAR-T细胞进行纯化,去除非转导的T细胞和其他细胞。
6. CAR-T细胞治疗产品制备:将纯化的CAR-T细胞与适当的载体(如冻存溶液)混合,制备成最终的CAR-T细胞治疗产品。
这个产品通常是冻结保存的,并在需要时解冻使用。
7. 患者治疗:将制备好的CAR-T细胞治疗产品通过输注等方式重新引入患者体内,使CAR-T细胞能够识别并攻击肿瘤细胞。
请注意,以上是一般的CAR-T疗法制造工艺流程的概述,具体的操作步骤和实施方法可能会有所不同,根据特定的治疗机构和技术要求来确定。
此外,制造CAR-T疗法还需要遵循相关的生物安全规范和质量控制要求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【页码】129-133
【摘要】嵌合抗原受体修饰的 T 细胞在 B 淋巴细胞性白血病的治疗上已经取得突破性进展。近来,美国的几个临床研究中心报道了在这群患者中取得高达60%~80%临床反应率的良好疗效。这一振奋人心的结果带来了人们对免疫治疗新的热情和随之而来的大型制药公司和投资机构对这一领域的关注。免疫治疗需要在加强有效性的基础上,发展出更多的免疫治疗方法以增加这一治疗的多样性,才会对癌症这一对人类健康具有重大挑战的疾病产生真正的影响。我们相信随着转化医学研究的不断深入,21世纪将是免疫治疗走向癌症治疗中心舞台的时代。
【ISSN】16摘要】肿瘤的细胞免疫治疗是一种新的治疗方法,嵌合抗原受体T细胞是一种基因工程改造的非MHC依赖的肿瘤特异性杀伤细胞.笔者将介绍这种细胞治疗在血液肿瘤中的研究进展,尤其是CD19嵌合抗原受体T细胞在淋巴细胞肿瘤中的应用.一些中心的Ⅱ期临床试验显示出不错的疗效,并初步探讨了提高疗效的方法,包括T细胞结构的优化、细胞回输前的预处理以及IL-2的应用等.
【DOI】10.3760/cma.j.issn.1673-419X.2014.01.019
2
【篇名】嵌合抗原受体T细胞肿瘤治疗的前生、今世和将来
【作者】张鸿声
【作者单位】同济大学医学院附属上海肺科医院转化医学中心, 上海,200433
【出处】转化医学杂志,Translational Medicine Journal2014,(3)
【DOI】10.7666/d.y2045491
4
【篇名】嵌合型抗原受体基因修饰的T细胞研究进展
【作者】钱磊,崔久嵬
【作者单位】吉林大学白求恩第一医院肿瘤中心,长春,130021
【出处】中国免疫学杂志,Chinese Journal of Immunology2014,(6)
【ISSN】1000-484X
【页码】850-853,857
【摘要】肿瘤免疫治疗在肿瘤治疗中发挥的作用日益受到重视,而作为肿瘤免疫治疗重要组成部分的过继性细胞治疗( Adoptive cellular therapy ,ACT),因其可在短时间内扩增和活化具有抗瘤活性的效应细胞,治疗副作用轻微等优点而在临床研究中备受关注。TIL、CIK、NK、NKT和γδT这些用于ACT的细胞在临床应用研究中取得一定的疗效,但是肿瘤抗原特异性强、亲和力好的免疫细胞来源困难、数量较少,以及杀瘤活性、体内持续时间未能达到临床应用的需求,在一定程度上制约了ACT的发展[1]。于是,研究者尝试使用基因修饰T细胞来解决这个问题,用来修饰 T 细胞的基因有 TCR、CAR ( Chimeric antigen receptor ,嵌合型抗原受体)、促进免疫细胞增殖的细胞因子(如IL-2、IL-15)等[2]。其中,嵌合型抗原受体基因修饰的 T 细胞( Chimeric antigen receptor-modified T cells,CART)是以能编码单链抗体-共刺激分子-免疫受体酪氨酸活化基序的嵌合分子的融合基因修饰T细胞而产生的一种基因修饰T细胞。因其具有肿瘤抗原识别特异性强、亲和力高、非MHC限制性及可在体内外大量扩增的优点而受到较多的关注,本文将对 CART 的研究进展予以综述。
【DOI】10.3969/j.issn.2095-3097.2014.03.001
3
【篇名】表达嵌合性抗原受体的T淋巴细胞介导的肿瘤过继性免疫治疗作用的临床前研究
【作者】宋德刚
【学位类型】博士
【授予单位】山东大学,
【导师】纪春岩
【年份】2011.
【摘要】第一部分 CD137(4-1BB)在表达靶向叶酸受体α嵌合抗原受体T细胞介导的肿瘤过继性免疫治疗中作用的研究<br> 研究背景:<br> 肿瘤的过继性免疫治疗是指通过体外培养、筛选并扩增肿瘤特异性T细胞进而回输患者体内,以达到放大机体抗肿瘤免疫目的的肿瘤治疗方法。目前主要包括两种获得肿瘤特异性T细胞的方法:一种是存在于患者肿瘤组织内的浸润性淋巴细胞(tumor infiltrating lymphocytes,TILs)的体外培养、扩增及肿瘤特异性的筛选;另一种是利用基因工程技术修饰外周血T细胞使其获得肿瘤特异性并在体外迅速扩增。其中,利用基因工程修饰外周血T细胞使其表达嵌合性抗原受体(chimeric angtigen receptor,CAR)来特异性识别肿瘤相关性抗原的方法是一种有前景的肿瘤免疫治疗策略。嵌合性抗原受体主要由细胞膜外抗原结合区和细胞内信号转导区两部分通过多肽接头(Linker)及跨膜区构成。膜外区具有特异性识别并结合肿瘤细胞表面抗原的功能,其构成是将单克隆抗体的重链可变区(VH)和轻链可变区(VL)用一可弯曲的多肽接头将VH和VL连接起来,构建成由单链可变区结构域(single chain variable fragment,scFv)组成的抗原结合区,其形式为VH-Linker-VL或VL-Linker-VH。细胞内信号转导区主要来源于T细胞受体的CD3ζ链。近年来,随着对嵌合性抗原受体结构及功能研究的发展,更多的研究者把CD28或CD137(4-1BB)协同共刺激信号分子与CD3ζ链的细胞内区顺式组成胞内信号转导区,使表达嵌合性抗原受体的T细胞与肿瘤表面抗原结合时更充分激活及免疫应答而杀伤肿瘤细胞。T细胞通过CAR与靶细胞结合后,胞内信号转导区将信号传入T细胞,从而激活T细胞,分泌细胞因子包括穿孔素、颗粒酶、INF-γ、TNF-α等发挥杀伤作用。同时,表达嵌合性抗原受体的T细胞具有MHC非限制性靶细胞识别功能。<br> 嵌合性抗原受体应用的关键是确定一种肿瘤相关抗原,这种抗原具有在肿瘤细胞表面过表达或高表达,而在正常组织无表达或低表达。人α型叶酸受体(alpha folate receptor,FRα)是一种通过聚糖磷脂酰肌醇(GPI)锚着于膜上的糖蛋白,对叶酸具有高度亲和力,在正常组织分布较少,而在多种上皮源性肿瘤包括上皮性卵巢癌、乳腺癌、子宫内膜癌、肾癌、肺癌、结肠癌和鼻咽癌中有过度表达或高表达。研究表明,FRα过度表达于90%上皮性卵巢癌中,可作为卵巢癌免疫治疗的一种有效的靶抗原。因此,构建靶向FRα的嵌合性抗原受体,对于过度表达FRα肿瘤的过继性T细胞免疫治疗具有重要临床前指导意义。<br> 目的:<br> 本研究旨在构建靶向FRα第一代(FR-CD3ζ)及第二代(FR-4-1BB-CD3ζ)嵌合性抗原受体及利用慢病毒载体将嵌合性抗原受体基因转导至人外周血T淋巴细胞;评价表达嵌合性抗原受体的T淋巴细胞体外及体内实验中的抗肿瘤作用以及4-1BB(CD137)在表达第二代嵌合性抗原受体T细胞中的共刺激信号作用的研究。<br> 方法:<br> 1.利用流式细胞仪技术检测肿瘤细胞表面FRα抗原的表达。<br> 2.构建靶向FRα的嵌合性抗原受体并利用慢病毒载体将嵌合性抗原受体基因转导至T淋巴细胞,并利用流式细胞仪技术检测T淋巴细胞表面嵌合性抗原受体的表达。<br> 3.检测表达嵌合性抗原受体的T淋巴细胞在体外抗肿瘤功能包括细胞因子释放及细胞杀伤试验。<br> 4.检测表达嵌合性抗原受体的T淋巴细胞在免疫缺陷小鼠SKOV3移植瘤模型中的体内抗肿瘤作用,包括WINN分析、小鼠皮下移植瘤、腹水及肺转移瘤模型。<br> 5.比较不同途径包括瘤内注射(intratumor injection,IT)、静脉注射(intravenousinjection,IV)及腹腔注射(intraperitoneal injection,IP)等输入表达嵌合性抗原受体的T淋巴细胞的抗肿瘤作用。<br> 6.比较接受表达FR-CD3z,FR-BBz,GFP以及CD19-BBζ CAR T细胞的荷瘤小鼠外周血中人CD4+和CD8+T细胞生存期。<br> 结果:<br> 1.流式细胞技术分析表明多数人卵巢癌细胞及乳腺癌细胞高表达FRα。<br> 2.靶向FRα的嵌合性抗原受体成功构建并高表达于T淋巴细胞表面。<br> 3.表达靶向FRα的嵌合性抗原受体的T细胞在体外能够特异性识别FRα(+)的肿瘤细胞,并主要释放Th1细胞因子,包括IFN-γ、TNF-α及IL-2,低表达Th2细胞因子包括IL-4和IL-10。表达靶向FRα的嵌合性抗原受体的T细胞能够杀伤并裂解FRα(+)的肿瘤细胞,但不能裂解FRα(-)的肿瘤细胞。<br> 4.表达靶向FRα嵌合性抗原受体含有CD137(4-1BB)协同刺激分子的T细胞与不含CD137(4-1BB)协同刺激分子的嵌合性抗原受体T细胞相比,在Winn分析中表现出明显抑制FRα(+)肿瘤细胞生长的活性(p=0.026)。在皮下移植肿瘤模型中,表达第一代FR-CD3z嵌合性抗原受体的T细胞只能延缓肿瘤生长,而表达第二代嵌合性抗原受体FR-BBz的T细胞却能使较大的FRα(+)皮下移植肿瘤缩小至消失(p<0.0001),而且这种肿瘤根除是抗原特异性的,因为靶向CD19-BBz T细胞不能抑制皮下移植肿瘤的生长。在FRα(+)肿瘤转移性腹水模型中,不论是IP或者IV途径注射表达FR-BBz嵌合性抗原受体的T细胞能够明显抑制小鼠腹水的形成,并提高治疗组小鼠的生存期(IP治疗组中位生存期68天,IV治疗组中位生存期52天),而对照组接受靶向CD19的嵌合性抗原受体T细胞治疗2-3周后小鼠却形成较大量的血型腹水(5-8ml),所有对照组小鼠由于大量腹水、行动迟缓而被处死(IP治疗组中位生存期9天,IV治疗组中位生存期12天)。在肺移植瘤转移模型中,表达FR-BBζ嵌合性抗原受体的T细胞能够快速使肿瘤缩小、甚至消失,80%(4/5)治疗组小鼠无证据显示肿瘤存在,而对照组小鼠肺转移肿瘤生长迅速,两组差异有统计学意义(p<0.01)。<br> 5.不论是IT、IP或者IV途径注射T细胞,与对照组接受gfp、FR-△z T细胞的荷瘤小鼠相比,人CD4+和CD8+T细胞计数在接受FR-BBz嵌合性抗原受体T细胞的荷瘤小鼠外周血中最高。值得注意的是,人CD4+和CD8+T细胞计数在接受注射FR-BBz嵌合性抗原受体T细胞的荷瘤小鼠外周血中高于接受MOv19-ζ T细胞的荷瘤小鼠(p<0.01)。这表明4-1BB(CD137)在小鼠体内可延长表达嵌合性抗原受体T细胞存活期。<br> 6.人CD4+和CD8+T细胞计数在接受FR-BBz嵌合性抗原受体T细胞的荷瘤小鼠外周血中高于与接受gfp及靶向CD19-BBz嵌合性抗原受体T细胞的荷瘤小鼠(p=0.009),提示抗原识别驱动了输入体内嵌合性抗原受体T细胞的增殖、扩增及存活。重要的是,人CD4+和CD8+T细胞计数在接受靶向CD19-BBζ嵌合性抗原受体T细胞的荷瘤小鼠外周血中高于接受gfp T细胞的荷瘤小鼠(p=0.012),提示嵌合性抗原受体T细胞存活期可以通过引入4-1BB(CD137)协同共刺激分子而延长。<br> 结论:<br> 1.FRα是多种上皮源性肿瘤中一种很有应用价值的靶向抗原,构建靶向FRα的嵌合性抗原受体为表达FRα肿瘤的过继性细胞免疫治疗提供了新的方法。<br> 2.表达FRα嵌合性抗原受体的T细胞能够特异性识别FRα阳性的肿瘤细胞并分泌Th1为主的细胞因子,并能够特异性识别并杀伤肿瘤细胞。<br> 3.表达FRα嵌合性抗原受体的T细胞在体内能够有效的抑制肿瘤生长。而且在体内转移移植瘤模型中,表达FRα嵌合性抗原受体的T细胞能够抑制小鼠腹水形成、提高生存期并且能控制肺移植瘤的发展。<br> 4.嵌合性抗原受体含有CD137(4-1BB)协同共刺激分子能够增加体内抗肿瘤能力及延长T细胞生存期。<br> 5.表达FRα-BBz嵌合性抗原受体的T细胞抗肿瘤能力为临床应用提供了实验基础,但其有效性及安全性需要进一步临床试验确认。
