预灌封注射器用氯化丁基橡胶活塞
预灌封注射器在标准YBB001120042015中有哪些检测项目
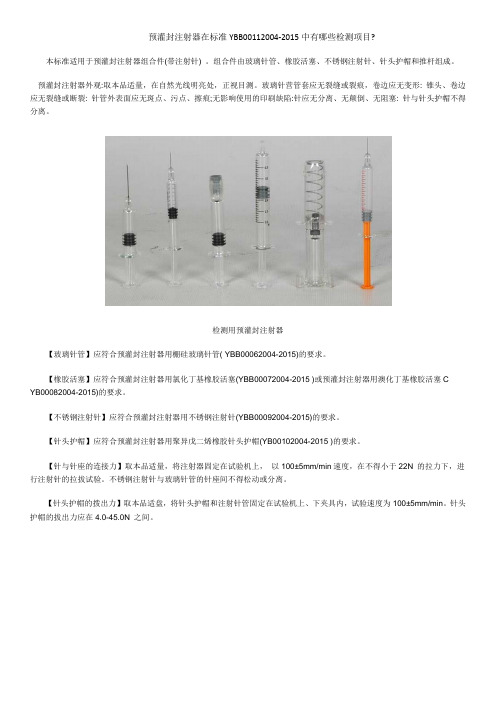
预灌封注射器在标准YBB00112004‐2015中有哪些检测项目?本标准适用于预灌封注射器组合件(带注射针) 。
组合件由玻璃针管、橡胶活塞、不锈钢注射针、针头护帽和推杆组成。
预灌封注射器外观:取本品适量,在自然光线明亮处,正视目测。
玻璃针营管套应无裂缝或裂痕,卷边应无变形: 锥头、卷边应无裂缝或断裂: 针管外表面应无斑点、污点、擦痕;无影响使用的印刷缺陷:针应无分离、无颠倒、无阻塞: 针与针头护帽不得分离。
检测用预灌封注射器【玻璃针管】应符合预灌封注射器用棚硅玻璃针管( YBB00062004-2015)的要求。
【橡胶活塞】应符合预灌封注射器用氯化丁基橡胶活塞(YBB00072004-2015 )或预灌封注射器用澳化丁基橡胶活塞CYB00082004-2015)的要求。
【不锈钢注射针】应符合预灌封注射器用不锈钢注射针(YBB00092004-2015)的要求。
【针头护帽】应符合预灌封注射器用聚异戊二烯橡胶针头护帽(YB00102004-2015 )的要求。
【针与针座的连接力】取本品适量,将注射器固定在试验机上,以100±5mm/min速度,在不得小于22N 的拉力下,进行注射针的拉拔试验。
不锈钢注射针与玻璃针管的针座间不得松动或分离。
【针头护帽的拨出力】取本品适盘,将针头护帽和注射针管固定在试验机上、下夹具内,试验速度为100±5mm/min。
针头护帽的拔出力应在4.0-45.0N 之间。
预灌封注射器测试仪器【活塞与推杆的配合性】(仅适用于带螺纹的活塞)取本品适量,将推杆和活塞相连接,把活塞完全插入经硅泊润滑过并装满一半水的预灌封注射器内,排除空气,在注射器上插上针头护帽,缓慢向后撤出约3 mm 的距离。
推杆应保持稳定,不应与活塞分离。
【活塞润滑性】取本品适量,将活塞插入硅泊润滑的注射器针管中,用推杆将活塞推入整个注射器针管中。
推杆活塞应平滑的移动,不应有突然的停顿。
【活塞滑动性能】取本品适量,将推杆活塞放入硅油润滑的针管中,以100±5mm/min的速度推动推杆。
预灌封注射器密封系统完整性研究

预灌封注射器密封系统完整性研究摘要目的:通过微生物侵入挑战性试验,确认采用预灌封注射器包装的小容量注射剂产品的密封完整性。
方法:按无菌生产要求在预灌封注射器内灌装胰胨大豆肉汤培养基,培养14 d后,置于大肠埃希菌菌悬液中浸泡4 h。
浸泡后样品继续培养7 d,观察细菌侵入情况。
结果:培养7 d后,注射器内培养基均无细菌生长。
结论:预灌封注射器密封系统能满足密封完好性的要求,可保证产品不受细菌侵入。
ABSTRACT Objective: Seal integrity of the prefilled syringes containing small volume of injection product was confirmed by the bacterial challenging test. Methods: According to production requirements, the pre-casting sterile syringe filling trypticase soy broth was incubated for 14 days, soaked in a suspension containing Escherichia coli for 4 hours. Bacterial contamination was observed after samples were incubated for 7 days. Results: The syringes were not contaminated by the tested E.coli. Conclusion: Prefilled syringes with sealing system can meet the requirements of integrity and protect the products from bacterial invasion.KEY WORDS prefilled syringes; bacterial invasion; integrity预灌封注射器是国内外20世纪90年代开发的一种新型药品包装形式,主要用于小容量注射剂的包装储存并直接用于注射或用于眼科、耳科、骨科等手术冲洗。
YBB药包材标准

YBB00342003药用玻璃成份分类及其试验方法
YBB00352003低硼硅玻璃管制药瓶
YBB00362003钠钙玻璃管制药瓶
YBB00372003抗生素瓶用铝塑组合盖
YBB00382003口服液瓶撕拉铝盖
YBB00392003外用液体药用高密度聚乙烯瓶
YBB00402003输液瓶用铝塑组合盖
YBB00142004笔式注射器用铝盖
YBB00152004笔式注射器用氯化丁基橡胶活塞和垫片
YBB00162004笔式注射器用溴化丁基橡胶活塞和垫片
YBB00172004口服固体药用低密度聚乙烯防潮组合瓶盖
YBB00182004铝/聚乙烯冷成型固体药用复合硬片
YBB00192004双向拉伸聚丙烯/真空镀铝流延聚丙烯药品包装用复合膜、袋
YBB00332003钠钙玻璃管制注射剂瓶
YBB00342003药用玻璃成份分类及其试验方法
YBB00352003低硼硅玻璃管制药瓶
YBB00362003钠钙Байду номын сангаас璃管制药瓶
YBB00372003抗生素瓶用铝塑组合盖
YBB00382003口服液瓶撕拉铝盖
YBB00392003外用液体药用高密度聚乙烯瓶
YBB00402003输液瓶用铝塑组合盖
YBB00242003121℃内表面耐水性测定法和分级
YBB00262003硼硅玻璃药用管
YBB00272003低硼硅玻璃药用管
YBB00282003钠钙玻璃药用管
YBB00292003硼硅玻璃输液瓶
YBB00302003低硼硅玻璃模制药瓶
YBB00312003硼硅玻璃模制注射剂瓶
YBB00322003低硼硅玻璃模制注射剂瓶
预灌封注射器用溴化丁基橡胶活塞英文标准

预灌封注射器用溴化丁基橡胶活塞英文标准The English standard for pre-filled syringes with bromobutyl rubber pistons can be described as follows:1. Piston Material: The piston material used in pre-filled syringes is bromobutyl rubber. Bromobutyl rubber is a synthetic rubber that is highly resistant to permeation by gases and moisture. It is also known for its excellent chemical resistance, stability, and low extractables.2. Piston Design: The piston design should ensure a proper seal within the syringe barrel and provide smooth movement during the injection process. The piston should have a tight fit to prevent leakage and maintain the sterility of the drug product.3. Physical Properties: The bromobutyl rubber piston should have specific physical properties to ensure its suitability for use in pre-filled syringes. These properties include good flexibility, high tensile strength, low compression set, and resistance to aging and degradation.4. Chemical Compatibility: The bromobutyl rubber piston should be chemically compatible with the drug product it contains. It should not react with the drug or leach any harmful substances into the drug solution. The piston material should be tested for its compatibility with a wide range of drugs to ensure safety and efficacy.5. Sterilization: The bromobutyl rubber piston should be sterilizable using common sterilization methods such as gamma irradiation or ethylene oxide gas. It should withstand the sterilization process without degrading or compromising its performance.6. Regulatory Standards: The bromobutyl rubber piston used in pre-filled syringes should comply with relevant international standards and regulations. These may include standards set by regulatory bodies such as the U.S. Food and Drug Administration (FDA), European Medicines Agency (EMA), or other national regulatory authorities.7. Quality Control: Manufacturers of pre-filled syringes with bromobutyl rubber pistons should implement stringent quality control measures to ensure the consistency and reliability of the product. This may involve testing the pistons for dimensional accuracy, physical properties, chemical compatibility, and sterility.It is important to note that the specific English standard for pre-filled syringes with bromobutyl rubber pistons may vary depending on the regulatory requirements of different countries or regions. Manufacturers and users of such syringes should refer to the applicable standards and regulations in their respective jurisdictions to ensure compliance and safety.。
丁基橡胶药用瓶塞检测SOP

丁基橡胶药用瓶塞检测SOP1. 目的为规范注射液用卤化丁基橡胶药用瓶塞的检定,特制定本SOP。
2. 范围本SOP适用于直接与注射剂接触的卤化丁基橡胶塞(注射液用卤化丁基橡胶塞、预灌封注射器用氯化丁基橡胶塞、预灌封注射器用溴化丁基橡胶塞)的检定。
3. 定义无4. 职责4.1.QC负责本规程的起草、修订、培训及执行。
4.2.QA、QC组长、质量管理部经理负责本规程的审核。
4.3.质量总监负责批准本规程。
4.4.QA负责本规程执行的监督。
5. 引用标准5.1.注射液用卤化丁基橡胶塞国家食品药品监督管理局直接接触药品的包装材料和容器标准汇编5.2.预灌封注射器用氯化丁基橡胶活塞国家食品药品监督管理局直接接触药品的包装材料和容器标准汇编5.3.预灌封注射器用溴化丁基橡胶活塞国家食品药品监督管理局直接接触药品的包装材料和容器标准汇编5.4.《中华人民共和国药典》6. 材料6.1.仪器设备天平,恒温水浴箱,分光光度计,pH计,恒温干燥箱,变温电炉,干燥器,电导率仪,高温炉。
6.2.试剂溶液标准铅溶液:购入;氯化铵铵溶液:取氯化铵10.5g,加水溶解使成100ml,即得;标准锌溶液:称取硫酸锌(ZnSO4·7H2O)0.440g,置1000ml量瓶中,加水溶解并稀释至刻度,摇匀,即得(每1ml相当于100µg的Zn);0.02mol/L高锰酸钾滴定液: 按《高锰酸钾滴定液配制及标定SOP》操作;0.1mol/L硫代硫酸钠滴定液:按《硫代硫酸钠滴定液配制及标定SOP》操作;碳酸氢钠:购入;硝酸:购入;硝酸银试液:取硝酸银17.5g,加水适量使溶解成1000ml,摇匀,即得;0.1%氯化钾溶液:取氯化钾0.1g,加水使溶解成100 ml,即得;稀硫酸:取硫酸57ml,加水稀释至1000ml,即得;淀粉指示液:取可溶性淀粉0.5g,加水5ml搅匀后,缓缓倾入100ml沸水中,随加随搅拌,继续煮沸2min,放冷,倾取上层清液,即得,本液应临用新制;碱性碘化汞钾试液:二氯化汞饱和水溶液:取二氯化汞7g,溶于100ml水中,摇匀。
浅谈预灌封注射器的基本知识

浅谈预灌封注射器的基本知识发布时间:2021-09-22T07:04:07.939Z 来源:《医师在线》2021年5月10期作者:贾惠鹏[导读]贾惠鹏(扬子江药业集团江苏紫龙药业有限公司;江苏常州213000)摘要:预灌封注射器是一种新型的药用注射剂包装形式,在国内外被越来越多的厂家选择与应用。
预灌封注射器这种包装方式具有用药剂量更准确、保护使用者不受药液伤害、使用方便,无污染等优势,未来前景广阔。
预灌封注射器最早由美国BD公司研制成功,国内企业起步较晚,但发展势头良好,市场认可度与占有率逐年提升。
预灌封注射器最由针管、胶塞、推杆等部分组成,国内生产一般按YBB质量标准要求执行。
1.背景介绍随着国内仿制药一致性评价工作的逐步深入,越来越多的口服制剂的仿制药一致性评价工作被国内制剂企业纳入计划。
注射制剂产品相对于口服固体制剂来说,质量风险明显提高,国家食品药品监督管理总局药品审评中心发布的《化学药品注射剂仿制药质量和疗效一致性评价技术要求(征求意见稿)》中要求,“注射剂使用的包装材料和容器的质量和性能不得低于参比制剂,以保证药品质量与参比制剂一致”,这就对包装材料的安全性与稳定性提出了要求,而预灌封注射器是一种新型的注射剂包装形式,开始被越来越多的国内厂家选择与应用。
而之后国家药品监督管理局发布的《国家药监局关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告》预灌封注射器发展提供了新的技术指导和法规依据。
2020年以来新冠疫情爆发,新冠疫苗的研发、生产在各主要国家蓬勃发展,作为包装材料的预灌封注射器需求量大增,带动了预灌封注射器产能全球供应不足,主要生产厂家纷纷制定扩产计划。
这一大趋势也刺激了中国预灌封注射器行业的发展,国内各大预灌封注射器生产企业也加大了资金投入力度,进行产能扩充。
2.产品优势预灌封注射器相比注射剂的其他包装形式,具有以下优点:(1)用药剂量更准确:对于粘度较大的注射液在使用过程中残留药液较多,预灌封式注射器可以最大限度的减少药液残留,用药剂量更加准确;(2)保护使用者不受药液伤害:对于一些特殊药物如果操作不当,易造成伤害。
预灌封注射器介绍

预灌封注射器介绍1.0预灌封注射器概述:预灌封注射器是国外九十年代开发的一种新型药品包装形式,经过十多年的推广使用,对于预防传染病的传播和医疗事业的发展,起到了很好的作用。
预灌封注射器主要用于高档药物的包装储存并直接用于注射或用于眼科、耳科、骨科等手术冲洗。
2.0 历史背景:用于人体注射的注射器在世界范围内先后经历了四代产品:1)多次使用的全玻璃注射器2)一次性使用的无菌塑料注射器3)一次性预灌封注射器4)氮气高压无针注射器。
目前,第一代全玻璃注射器已较少使用。
第二代一次性使用的无菌塑料注射器在全世界普遍使用,虽然具有成本低,使用方便的优点,但其自身也有缺陷,如不耐酸碱,回收使用,污染环境等。
因此,发达国家和地区已逐步推广使用第三代的预灌封注射器。
第四代产品还处于研制开发阶段。
预灌封注射器同时具有储存药物和普通注射两种作用,并且采用了兼容性和稳定性良好的材料,不但安全可靠,而且相比传统的”药瓶+注射器”的方式,最大限度地降低了从生产到使用中所耗费的人工和成本,给制药企业和临床使用带来许多方面的优势。
目前已经越来越多的被制药企业采用并应用于临床中,未来的几年中必然成为药品的主要包装方式,并渐渐取代普通注射器的地位。
3.0 产品特点:预灌封注射器作为一种新型的药品包装形式,其特点是:1) 采用高品质的玻璃和橡胶组件,与药物具有良好的相容性,可确保包装的药物的稳定性;2) 减少药物因储存及转移过程的吸附造成的浪费,尤其对于昂贵的生化制剂,具有十分重要的意义;3) 避免使用稀释液后反复抽吸,减少二次污染机会;4) 采用灌装机定量灌装药液的方式,比医护人员手工抽吸药液更加精确;5) 可在注射容器上直接注明药品名称,临床上不易发生差错;如果使用易剥离标签,还有利于保存患者用药信息;6) 操作简便,临床中比使用安瓿节省一半的时间,特别适合急诊患者。
4.0 产品分类和结构(见下页结构示意图)产品分为带注射针和不带注射针两类4.1 带注射针的为针头嵌入式,由玻璃针管,针头护帽,活塞和推杆组成;目前可以生产的规格有1ml标准/25G,1ml细长/27G, 1ml细长带刻度/27G, 2.25ml/27G;4.2不带针的分为锥头式和螺旋头式,锥头式由玻璃针管,锥头头护帽,活塞和推杆组成;螺旋头式由玻璃针管,螺旋头护帽,螺旋头,活塞和推杆组成;目前可以生产的规格有2.25ml 锥头式,2.25ml螺旋头式,3ml锥头式;5.0 材料组成部件名称 材料带注射针 I类中性玻璃/314不锈钢玻璃针管不带注射针 I类中性玻璃推杆(无色) PS(有色) PP/PE/色母料针头护帽 PP/聚异戊二烯橡胶护帽锥头护帽,螺旋头护帽 丁基橡胶活塞 ----- 氯化丁基橡胶6.0使用方法6.1制药企业灌装过程通过灌装机在玻璃针管(带有护帽)内灌装定量的药物,并将活塞压入或旋入,将药液密封,然后加装推杆,进行包装;不带注射针的产品,药厂还应配上相应的冲洗针。
直接接触药品的包装材料和容器标准汇编(1~6辑)

直接接触药品的包装材料和容器标准汇编(1~6辑)第一辑YBB00012002 低密度聚乙烯输液瓶(试行)YBB00022002 聚丙烯输液瓶(试行)YBB00032002 钠钙玻璃输液瓶(试行)废止,新标准号YBB00032005YBB00042002 药用氯化丁基橡胶塞(试行)2005年4月15日起废止,YBB00052002 药用溴化丁基橡胶塞(试行)2005年4月15日起废止,YBB00062002 低密度聚乙烯药用滴眼剂瓶(试行)YBB00072002 聚丙烯药用滴眼剂瓶(试行)YBB00082002 口服液体药用聚丙烯瓶(试行)YBB00092002 口服液体药用高密度聚乙烯瓶(试行)YBB00102002 口服液体药用聚酯瓶(试行)YBB00112002 口服固体药用聚丙烯瓶(试行)YBB00122002 口服固体药用高密度聚乙烯瓶(试行)YBB00132002 药品包装用复合膜、袋通则(试行)YBB00142002 药品包装材料与药物相容性试验指导原则(试行)第二辑YBB00152002 药品包装用铝箔YBB00162002 铝质药用软膏管YBB00172002 聚酯/铝/聚乙烯药品包装用复合膜、袋YBB00182002 聚酯/低密度聚乙烯药品包装用复合膜、袋YBB00192002 双向拉伸聚丙烯/低密度聚乙烯药品包装用复合膜袋YBB00202002 聚氯乙烯/聚乙烯/聚偏二氯乙烯固体药用复合硬片2005年2月2日起废止YBB00212002 聚氯乙烯固体药用硬片2005年2月2日起废止YBB00222002 聚氯乙烯/聚偏二氯乙烯固体药用复合硬片2005年2月2日起废止YBB00232002 聚氯乙烯/低密度聚乙烯固体药用复合硬片2005年2月2日起废止YBB00242002 聚酰胺/铝/聚氯乙烯冷冲压成型固体药用复合硬片YBB00252002 聚乙烯/铝/聚乙烯复合药用软膏管废止,新标准号YBB00252005YBB00262002 口服固体药用聚酯瓶YBB00272002 钠钙玻璃药瓶YBB00282002 低硼硅玻璃管制口服液体瓶YBB00292002 硼硅玻璃管制注射剂瓶废止,新标准号YBB00292005-1、YBB00292005-2 YBB00302002 低硼硅玻璃管制注射剂瓶YBB00312002 钠钙玻璃模制注射剂瓶YBB00322002 硼硅玻璃安瓿废止,新标准号YBB00322005-2YBB00332002 低硼硅玻璃安瓿YBB00342002 多层共挤输液用膜、袋通则第三辑YBB00012003 细胞毒性检查法YBB00022003 热原检查法YBB00032003 溶血检查法YBB00042003 急性全身毒性检查法YBB00052003 皮肤致敏检查法YBB00062003 皮内刺激检查法YBB00072003 原发性皮肤刺激检查法YBB00082003 气体透过量测定法YBB00092003 水蒸气透过量测定法YBB00102003 剥离强度测定法YBB00112003 拉伸性能测定法YBB00122003 热合强度测定法YBB00132003 密度测定法YBB00142003 氯乙烯单体测定法YBB00152003 偏二氯乙烯单体测定法YBB00162003 内应力测定法YBB00172003 耐内压力测定法YBB00182003 热冲击和热冲击强度测定法YBB00192003 垂直轴偏差测定法YBB00202003 平均线热膨胀系数的测定法YBB00212003 线热膨胀系数的测定法YBB00222003 砷、锑、铅浸出量的测定法YBB00232003 三氧化二硼测定法YBB00242003 121℃内表面耐水性测定法和分级YBB00252003 玻璃颗粒在121℃耐水性测定法和分级第四辑YBB00262003 硼硅玻璃药用管废止,新标准号YBB00012005-1、YBB00012005-2 YBB00272003 低硼硅玻璃药用管YBB00282003 钠钙玻璃药用管YBB00292003 硼硅玻璃输液瓶废止,新标准号YBB00022005-2YBB00302003 低硼硅玻璃模制药瓶YBB00312003 硼硅玻璃模制注射剂瓶废止,新标准号YBB00062005-2YBB00322003 低硼硅玻璃模制注射剂瓶YBB00332003 钠钙玻璃管制注射剂瓶YBB00342003 药用玻璃成份分类及其试验方法YBB00352003 低硼硅玻璃管制药瓶YBB00362003 钠钙玻璃管制药瓶YBB00372003 抗生素瓶用铝塑组合盖YBB00382003 口服液瓶撕拉铝盖YBB00392003 外用液体药用高密度聚乙烯瓶YBB00402003 输液瓶用铝塑组合盖第五辑YBB00012004 低硼硅玻璃输液瓶YBB00022004 硼硅玻璃管制口服液体瓶YBB00032004 钠钙玻璃管制口服液体瓶YBB00042004 硼硅玻璃管制药瓶YBB00052004 硼硅玻璃模制药瓶YBB00062004 预灌封注射器用硼硅玻璃针管YBB00072004 预灌封注射器用氯化丁基橡胶活塞YBB00082004 预灌封注射器用溴化丁基橡胶活塞YBB00092004 预灌封注射器用不锈钢注射针YBB00102004 预灌封注射器用聚异戊二烯橡胶针头护帽YBB00112004 预灌封注射器组合件(带注射针)YBB00122004 笔式注射器用硼硅玻璃珠YBB00132004 笔式注射器用硼硅玻璃套筒YBB00142004 笔式注射器用铝盖YBB00152004 笔式注射器用氯化丁基橡胶活塞和垫片YBB00162004 笔式注射器用溴化丁基橡胶活塞和垫片YBB00172004 口服固体药用低密度聚乙烯防潮组合瓶盖YBB00182004 铝/聚乙烯冷成型固体药用复合硬片YBB00192004 双向拉伸聚丙烯/真空镀铝流延聚丙烯药品包装用复合膜、袋YBB00202004 玻璃纸/铝/聚乙烯药品包装用复合膜、袋YBB00212004 药品包装用铝塑封口垫片通则YBB00222004 口服制剂用硅橡胶胶塞、垫片YBB00232004 药用合成聚异戊二烯垫片YBB00242004 塑料输液容器用聚丙烯组合盖YBB00252004 胶囊用明胶YBB00262004 包装材料红外光谱测定法YBB00272004 包装材料不溶性微粒测定法YBB00282004 乙醛测定法YBB00292004 加热伸缩率测定法YBB00302004 挥发性硫化物测定法YBB00312004 包装材料溶剂残留量测定法YBB00322004 注射剂用胶塞、垫片穿刺力测定法YBB00332004 注射剂用胶塞、垫片穿刺落屑测定法YBB00342004 玻璃耐沸腾盐酸浸蚀性的测定法和分级YBB00352004 玻璃耐沸腾混合碱水溶液浸蚀性的测定法和分级YBB00362004 玻璃颗粒在98℃耐水性测定法和分级YBB00372004 砷、锑、铅、镉浸出量测定法YBB00382004 抗机械冲击测定法YBB00392004 直线度测定法YBB00402004 药用陶瓷吸水率测定法YBB00412004 药品包装材料生产厂房洁净室(区)的测试方法YBB00202005 聚氯乙烯/聚乙烯/聚偏二氯乙烯固体药用复合硬片YBB00212005 聚氯乙烯固体药用硬片YBB00222005 聚氯乙烯/聚偏二氯乙烯固体药用复合硬片YBB00232005 聚氯乙烯/低密度聚乙烯固体药用复合硬片YBB00042005 注射液用卤化丁基橡胶塞YBB00052005 注射用无菌粉末用卤化丁基橡胶塞第六辑YBB00072005 药用低密度聚乙烯膜、袋YBB00082005 注射剂瓶用铝盖YBB00092005 输液瓶用铝盖YBB00102005 三层共挤输液用膜(I)、袋YBB00112005 五层共挤输液用膜(I)、袋YBB00122005 药用固体纸袋装硅胶干燥剂YBB00132005 药用聚酯/铝/聚丙烯封口垫片YBB00142005 药用聚酯/铝/聚酯封口垫片YBB00152005 药用聚酯/铝/聚乙烯封口垫片YBB00162005 药用口服固体陶瓷瓶YBB00032005 钠钙玻璃输液瓶替换YBB00032002YBB00292005-1 高硼硅玻璃管制注射剂瓶替换YBB00292002 YBB00292005-2 中性硼硅玻璃管制注射剂瓶替换YBB00292002 YBB00322005-2 中性硼硅玻璃安瓿替换YBB00322002YBB00012005-1 药用高硼硅玻璃管替换YBB00262003YBB00012005-2 药用中性硼硅玻璃管替换YBB00262003YBB00022005-2 中性硼硅玻璃输液瓶替换YBB00292003YBB00062005-2 中性硼硅玻璃模制注射剂瓶替换YBB00312003 YBB00252005 药用聚乙烯/铝/聚乙烯复合软膏管替换YBB00252002 YBB00172005 药用玻璃铅、镉、砷、锑浸出量限度YBB00182005 药用陶瓷容器铅、镉浸出量限度YBB00192005 药用陶瓷容器铅、镉浸出量测定法YBB00242005 环氧乙烷残留量测定法YBB00262005 橡胶灰分的测定法。
YBB药包材标准

YBB00022004硼硅玻璃管制口服液体瓶
YBB00032004钠钙玻璃管制口服液体瓶
YBB00042004硼硅玻璃管制药瓶
YBB00052004硼硅玻璃模制药瓶
YBB00062004预灌封注射器用硼硅玻璃针管
YBB00072004预灌封注射器用氯化丁基橡胶活塞
YBB00082004预灌封注射器用溴化丁基橡胶活塞
YBB00092004预灌封注射器用不锈钢注射针
YBB00102004预灌封注射器用聚异戊二烯橡胶针头护帽
YBB00112004预灌封注射器组合件(带注射针)
YBB00122004笔式注射器用硼硅玻璃珠
YBB00132004笔式注射器用硼硅玻璃套筒
YBB00132002药品包装用复合膜、袋通则(试行)
YBB00142002药品包装材料与药物相容性试验指导原则(试行)
YBB00152002药品包装用铝箔
YBB00162002铝质药用软膏管
YBB00172002聚酯/铝/聚乙烯药品包装用复合膜、袋
YBB00182002聚酯/低密度聚乙烯药品包装用复合膜、袋
YBB00332003钠钙玻璃管制注射剂瓶
YBB00342003药用玻璃成份分类及其试验方法
YBB00352003低硼硅玻璃管制药瓶
YBB00362003钠钙玻璃管制药瓶
YBB00372003抗生素瓶用铝塑组合盖
YBB00382003口服液瓶撕拉铝盖
YBB00392003外用液体药用高密度聚乙烯瓶
YBB00402003输液瓶用铝塑组合盖
YBB00302002低硼硅玻璃管制注射剂瓶
YBB00312002钠钙玻璃模制注射剂瓶
YBB30022012预灌封注射器用溴化丁基橡胶活塞

276
重金属 精密量取供试品溶液 10ml,加醋酸盐缓冲液(pH3.5) 2ml,依法检查(中国药典 2010 版二部附录Ⅷ H 第一法)测定,不得过百万分之一。
铵离子 精密量取供试品溶液 10 ml,加碱性碘化汞钾试液 2ml,放置 15 分钟,不得显色; 如显色,与氯化铵溶液(取氯化铵 31.5mg 加无氯水适量使溶解并稀释至 1000.0ml)2.0ml,加 空白提取液 8ml 与碱性碘化汞钾试液 2ml 制成的对照液比较,不得更深(0.0002%)。
电导率 在供试品溶液制备 5 小时内,用电导率仪测定:用水冲洗测定电极(光亮铂电极或 铂黑电极)数次,取空白对照溶液冲洗电极至少 2 次,测定空白对照溶液的电导率不得过 3.0µS/cm (20℃±1℃)。再用供试品溶液冲洗电极至少 2 次,测定供试品溶液的电导率,应不得过 40.0µS/cm。如果测定不是在 20℃±1℃下进行,则应对温度进行校正。
YBB30022012
预灌封注射器用溴化丁基橡胶活塞
Yuguanfengzhusheqiyong Xiuhuadingjiber Plungers for Prefilled Syringes
注射液用卤化丁基橡胶塞

YBB30062012注射液用卤化丁基橡胶塞Zhusheyeyong Luhuadingji XiangjiaosaiHalogenated Butyl Rubber Stopper for Injection本标准适用于直接与注射液接触的氯化或溴化丁基橡胶塞。
【外观】取本品数个,照表1 依法检查,应符合规定。
【规格尺寸】取本品数个,照表2 和表3 依法检查,应符合规定。
【鉴别】*(1)称取本品2.0g,剪成小颗粒,置坩锅中,加碳酸氢钠2.0g 均匀覆盖试样,置电炉上,缓缓加热至炭化,放冷,置马弗炉300℃加热至完全灰化,取出后,冷却至室温,加水10ml 使溶解,滤过,取续滤液1.5ml,置于试管中,加硝酸酸化,加入硝酸银试液1 滴,应产生白色或淡黄色沉淀。
(2)取本品适量,照包装材料红外光谱测定法(YBB60012012)第四法测定,应与对照图谱基本一致。
【穿刺落屑】取本品10 个,照注射剂用胶塞、垫片穿刺落屑测定法(YBB60082012)第一法测定,落屑数应不得过20 粒。
【穿刺力】取本品10 个,照注射剂用胶塞、垫片穿刺力测定法(YBB60072012)第一法测定,平均穿刺力不得过75N,且每个胶塞的穿刺力均不得过80N,穿刺过程中不应有胶塞被推入瓶内。
【密封性与穿刺器保持性】取本品10 个,置高压蒸汽灭菌器中(不浸水),121℃±2℃,保持30 分钟,冷却至室温,另取10 个与之配套的玻璃注射液瓶加水至标示容量,用上述胶塞,塞紧,再加上与之配套铝盖,压盖。
用符合注射剂用胶塞、垫片穿刺力测定法(YBB60072012)中图1 所示的穿刺器,向胶塞穿刺部位垂直穿刺,穿刺器刺穿胶塞,倒挂瓶,穿刺器悬挂0.5kg 重物,穿刺器应保持4 小时不被拔出,且瓶塞穿刺部位应无泄漏。
【灰分】取本品1.0g,照橡胶灰分测定法(YBB600212012)测定,不得过45%。
【挥发性硫化物】* 取本品,照挥发性硫化物测定法(YBB60052012)测定,应符合规定。
预灌封注射器介绍.

預灌封注射器介紹1.0預灌封注射器概述:預灌封注射器是國外九十年代開發的一種新型藥品包裝形式,經過十多年的推廣使用,對於預防傳染病的傳播和醫療事業的發展,起到了很好的作用。
預灌封注射器主要用於高檔藥物的包裝儲存並直接用於注射或用於眼科、耳科、骨科等手術沖洗。
2.0 歷史背景:用於人體注射的注射器在世界範圍內先後經歷了四代產品:1)多次使用的全玻璃注射器2)一次性使用的無菌塑膠注射器3)一次性預灌封注射器4)氮氣高壓無針注射器。
目前,第一代全玻璃注射器已較少使用。
第二代一次性使用的無菌塑膠注射器在全世界普遍使用,雖然具有成本低,使用方便的優點,但其自身也有缺陷,如不耐酸堿,回收使用,污染環境等。
因此,發達國家和地區已逐步推廣使用第三代的預灌封注射器。
第四代產品還處於研製開發階段。
預灌封注射器同時具有儲存藥物和普通注射兩種作用,並且採用了相容性和穩定性良好的材料,不但安全可靠,而且相比傳統的”藥瓶+注射器”的方式,最大限度地降低了從生產到使用中所耗費的人工和成本,給制藥企業和臨床使用帶來許多方面的優勢。
目前已經越來越多的被制藥企業採用並應用於臨床中,未來的幾年中必然成為藥品的主要包裝方式,並漸漸取代普通注射器的地位。
3.0 產品特點:預灌封注射器(帶注射針)作為一種新型的藥品包裝形式,其特點是:1) 採用高品質的玻璃和橡膠元件,與藥物具有良好的相容性,可確保包裝的藥物的穩定性;2) 減少藥物因儲存及轉移過程的吸附造成的浪費,尤其對於昂貴的生化製劑,具有十分重要的意義;3) 避免使用稀釋液後反復抽吸,減少二次污染機會;4) 採用灌裝機定量灌裝藥液的方式,比醫護人員手工抽吸藥液更加精確;5) 可在注射容器上直接注明藥品名稱,臨床上不易發生差錯;如果使用易剝離標籤,還有利於保存患者用藥資訊;6) 操作簡便,臨床中比使用安瓿節省一半的時間,特別適合急診患者。
4.0 產品分類和結構(見下頁結構示意圖)產品分為帶注射針和不帶注射針兩類4.1 帶注射針的為針頭嵌入式,由玻璃針管,針頭護帽,活塞和推杆組成;目前可以生產的規格有1ml標準/25G,1ml細長/27G, 1ml細長帶刻度/27G, 2.25ml/27G;4.2不帶針的分為錐頭式和螺旋頭式,錐頭式由玻璃針管,錐頭頭護帽,活塞和推杆組成;螺旋頭式由玻璃針管,螺旋頭護帽,螺旋頭,活塞和推杆組成;目前可以生產的規格有2.25ml 錐頭式,2.25ml螺旋頭式,3ml錐頭式;5.0 材料組成部件名稱材料帶注射針I類中性玻璃/314不銹鋼玻璃針管不帶注射針I類中性玻璃推杆(無色) PS(有色) PP/PE/色母料針頭護帽PP/聚異戊二烯橡膠護帽錐頭護帽,螺旋頭護帽丁基橡膠活塞----- 氯化丁基橡膠6.0使用方法6.1制藥企業灌裝過程通過灌裝機在玻璃針管(帶有護帽)內灌裝定量的藥物,並將活塞壓入或旋入,將藥液密封,然後加裝推杆,進行包裝;不帶注射針的產品,藥廠還應配上相應的沖洗針。
预灌封注射器介绍.

预灌封注射器介绍1.0预灌封注射器概述:预灌封注射器是国外九十年代开发的一种新型药品包装形式,经过十多年的推广使用, 对于预防传染病的传播和医疗事业的发展 , 起到了很好的作用。
预灌封注射器主要用于高档药物的包装储存并直接用于注射或用于眼科、耳科、骨科等手术冲洗。
2.0 历史背景:用于人体注射的注射器在世界范围内先后经历了四代产品:1多次使用的全玻璃注射器2一次性使用的无菌塑料注射器3一次性预灌封注射器4氮气高压无针注射器。
目前,第一代全玻璃注射器已较少使用。
第二代一次性使用的无菌塑料注射器在全世界普遍使用,虽然具有成本低,使用方便的优点,但其自身也有缺陷,如不耐酸碱,回收使用,污染环境等。
因此,发达国家和地区已逐步推广使用第三代的预灌封注射器。
第四代产品还处于研制开发阶段。
预灌封注射器同时具有储存药物和普通注射两种作用,并且采用了兼容性和稳定性良好的材料,不但安全可靠,而且相比传统的”药瓶+注射器”的方式,最大限度地降低了从生产到使用中所耗费的人工和成本,给制药企业和临床使用带来许多方面的优势。
目前已经越来越多的被制药企业采用并应用于临床中,未来的几年中必然成为药品的主要包装方式, 并渐渐取代普通注射器的地位。
3.0 产品特点:预灌封注射器作为一种新型的药品包装形式,其特点是:1 采用高品质的玻璃和橡胶组件,与药物具有良好的相容性,可确保包装的药物的稳定性;2 减少药物因储存及转移过程的吸附造成的浪费,尤其对于昂贵的生化制剂,具有十分重要的意义;3 避免使用稀释液后反复抽吸,减少二次污染机会;4 采用灌装机定量灌装药液的方式,比医护人员手工抽吸药液更加精确;5 可在注射容器上直接注明药品名称,临床上不易发生差错;如果使用易剥离标签, 还有利于保存患者用药信息;6 操作简便,临床中比使用安瓿节省一半的时间,特别适合急诊患者。
4.0 产品分类和结构(见下页结构示意图产品分为带注射针和不带注射针两类4.1 带注射针的为针头嵌入式,由玻璃针管,针头护帽,活塞和推杆组成;目前可以生产的规格有 1ml 标准/25G,1ml细长/27G, 1ml细长带刻度/27G, 2.25ml/27G;4.2不带针的分为锥头式和螺旋头式,锥头式由玻璃针管,锥头头护帽,活塞和推杆组成; 螺旋头式由玻璃针管,螺旋头护帽,螺旋头,活塞和推杆组成;目前可以生产的规格有 2.25ml 锥头式,2.25ml 螺旋头式,3ml 锥头式;5.0 材料组成部件名称材料带注射针 I 类中性玻璃/314不锈钢玻璃针管不带注射针 I 类中性玻璃(无色 PS推杆(有色 PP/PE/色母料针头护帽 PP/聚异戊二烯橡胶护帽锥头护帽,螺旋头护帽丁基橡胶活塞 ----- 氯化丁基橡胶6.0使用方法6.1制药企业灌装过程通过灌装机在玻璃针管(带有护帽内灌装定量的药物,并将活塞压入或旋入,将药液密封,然后加装推杆,进行包装;不带注射针的产品,药厂还应配上相应的冲洗针。
4043预灌封注射器通则公示稿

尊敬的用户:为了保障医疗器械在使用过程中的安全性和有效性,根据《医疗器械监督管理条例》等相关法律法规,现对预灌封注射器的通则进行公示,敬请广大用户和相关单位认真阅读,并提出宝贵意见和建议。
一、预灌封注射器的定义预灌封注射器是一种用于将液体药物注射入患者体内的医疗器械,其特点是药物预先灌封在注射器内,用户使用时只需将针头插入患者体内进行注射,方便快捷。
二、预灌封注射器的分类根据使用范围和注射方式的不同,预灌封注射器可分为常规预灌封注射器和特殊用途预灌封注射器两类。
1. 常规预灌封注射器:适用于一般注射和输液过程中的药物注射,如胰岛素、抗生素、疫苗等。
2. 特殊用途预灌封注射器:适用于特殊治疗需求的药物注射,如化疗药物、镇痛药物等。
三、预灌封注射器的要求1. 设计和制造要求:预灌封注射器应符合相关医疗器械的设计、生产和质量管理标准,保证产品的安全性和稳定性。
2. 包装和标识要求:预灌封注射器的包装应符合相关标准,标识清晰、准确,包括产品名称、规格、生产日期、有效期等信息。
3. 使用和储存要求:用户在使用过程中应按照说明书要求正确操作,同时在储存过程中注意避免光照和高温等因素对产品的影响。
四、预灌封注射器的检查和验收1. 购物时的检查:用户在购物预灌封注射器时,应认真检查产品的包装和标识是否完好,以及生产日期和有效期是否符合要求。
2. 使用前的验收:用户在使用预灌封注射器前,应再次检查产品的外观和标识,确保产品符合要求,避免使用过期或损坏的产品。
五、预灌封注射器的注意事项1. 使用时要求:用户在使用预灌封注射器时应按照操作说明正确使用,避免因操作不当引起的意外伤害或药物浪费。
2. 弃用后的处理:用户在使用完预灌封注射器后,应按照医疗废物的处理要求进行处理,避免对环境造成污染。
六、意见和建议征集为了进一步完善预灌封注射器的监管制度和使用管理规范,我部欢迎广大用户和相关单位就本通则稿提出宝贵意见和建议。
意见和建议可通过以下方式提交:1. 邮寄方式:将意见和建议以书面形式寄至相关位置区域,邮寄时间为公示期起至结束。
预灌封注射器通则

预灌封注射器通则
1.预灌封注射器(pre-filled syringe)是一种事先装有药物的注
射器,通常是预先充填好的药物,以便直接使用。
2.预灌封注射器的设计应符合国际标准和相关法规的要求,并
经过严格的质量控制和测试。
3.使用预灌封注射器时,应首先检查包装和注射器外观,确保
没有破损或泄漏。
4.在使用之前,应阅读药物的说明书,并遵循医生或医护人员
的指示。
5.预灌封注射器通常是一次性使用的,一旦使用过后,应将其
安全地处理掉。
6.在使用过程中,应采取适当的消毒措施,确保注射部位的清
洁和无菌。
7.注射时,应根据药物的类型和使用方法进行正确的注射技术,确保药物的有效输送。
8.使用预灌封注射器的过程中,应注意自己的安全和药物的安全,以避免任何意外发生。
9.使用预灌封注射器后,应注意观察注射部位和身体的反应,
如果有任何不适或异常反应,应立即向医生或医护人员咨询。
10.预灌封注射器在存储和运输过程中应避免受到过高或过低温度的影响,以确保药物的稳定性和有效性。
YY_0043-2005医用缝针标准

YY 0043-2005医用缝针标准YBB 0001-2004低硼硅玻璃输液瓶YBB 0002-2004硼硅玻璃管制口服液体瓶(试行)YBB 0003-2004纳钙玻璃管制口服液体瓶YBB 0003-2005钠钙玻璃输液瓶YBB 0004-2004硼硅玻璃管制药瓶YBB 0004-2005 注射液用卤化丁基橡胶塞YBB 0004-2005注射液用卤化丁基橡胶塞YBB 0005-2004硼硅玻璃模制药瓶YBB 0005-2005注射用无菌粉末用卤化丁基橡胶塞YBB 0006-2004预灌封注射器用硼硅玻璃针管YBB 0007-2004预灌封注射器用氯化丁基橡胶活塞YBB 0007-2005药用低密度聚乙烯膜、袋YBB 0008-2004预灌封注射器用溴化丁基橡胶活塞YBB 0008-2005注射剂瓶用铝盖YBB 0009-2004预灌封注射器用不锈钢注射针YBB 0009-2005输液瓶用铝盖YBB 0010-2004预灌封注射器用聚异戊二烯橡胶针头护帽YBB 0010-2005三层共挤输液用膜(Ⅰ)、袋YBB 0011-2004预灌封注射器组合件(带注射针)YBB 0011-2005五层共挤输液用膜(Ⅰ)、袋YBB 0012-2004笔式注射器用硼硅玻璃珠YBB 0012-2005药用固体纸袋装硅胶干燥剂YBB 0013-2004笔式注射器用硼硅玻璃套筒YBB 0013-2005药用聚酯-铝-聚丙烯封口垫片YBB 0014-2004笔式注射器用铝盖YBB 0014-2005药用聚酯-铝-聚酯封口垫片YBB 0015-2004笔式注射器用氯化丁基橡胶活塞和垫片YBB 0015-2005药用聚酯-铝-聚乙烯封口垫片YBB 0016-2004笔式注射器用溴化丁基橡胶活塞和垫片YBB 0016-2005药用口服固体陶瓷瓶YBB 0017-2004口服固体药用低密度聚乙烯防潮组合瓶盖YBB 0017-2005药用玻璃铅、镉、砷、锑浸出量限度YBB 0018-2004铝-聚乙烯冷成型固体药用复合硬片YBB 0018-2005药用陶瓷容器铅、镉浸出量限度YBB 0019-2004双向拉伸聚丙烯-真空镀铝流延聚丙烯药品包装用复合膜、袋YBB 0019-2005药用陶瓷容器铅、镉浸出量测定法YBB 0020-2004玻璃纸-铝-聚乙烯药品包装用复合膜、袋YBB 0020-2005聚氯乙烯-聚乙烯-聚偏二氯乙烯固体药用复合硬片YBB 0021-2004药品包装用铝塑封口垫片通则YBB 0021-2005聚氯乙烯固体药用硬片YBB 0022-2004口服制剂用硅橡胶胶塞、垫片YBB 0022-2005聚氯乙烯-聚偏二氯乙烯固体药用复合硬片YBB 0023-2004药用合成聚异戊二烯垫片YBB 0023-2005聚氯乙烯-低密度聚乙烯固体药用复合硬片YBB 0024-2004塑料输液容器用聚丙烯组合盖(拉环式)YBB 0024-2005环氧乙烷残留量测定法YBB 0025-2004胶囊用明胶YBB 0025-2005药用聚乙烯-铝-聚乙烯复合软膏管YBB 0026-2004包装材料红外光谱测定法YBB 0026-2005橡胶灰分测定法YBB 0027-2004包装材料不溶性微粒测定法YBB 0028-2004乙醛测定法YBB 0029-2004加热伸缩率测定法YBB 0030-2004挥发性硫化物测定法YBB 0031-2004包装材料溶剂残留量测定法YBB 0032-2004注射剂用胶塞、垫片穿刺力测定法YBB 0033-2004注射剂用胶塞、垫片穿刺落屑测定法YBB 0034-2004玻璃耐沸腾盐酸浸蚀性测定法YBB 0035-2004玻璃耐沸腾混合碱水溶液浸蚀性测定法YBB 0036-2004玻璃颗粒在98℃耐水性测定法YBB 0037-2004砷、锑、铅、镉浸出量测定法YBB 0038-2004抗机械冲击测定法YBB 0039-2004直线度测定法YBB 0040-2004药用陶瓷吸水率测定法YBB 0041-2004药品包装材料生产厂房洁净室(区)的测试方法YBB00122002口服固体药用高密度聚乙烯瓶YBB00132002YBB00132003YBB00152002药品包装用铝箔YBB00172002YBB00182002YBB00192002YBB00272004包装材料不溶性微粒测定方法YY0001-1990体外冲击波碎石机通用技术条件YY0002-1990一次性使用输液器用药液过滤器YY0003-1990病床YY0003-90YY0004-1990普通胸腔镊YY0005-1990单圈式钢塑宫内节育器YY0006-1990双翼阴道扩张器YY0007-1990200MA医用诊断X射线机YY0008-1990300MA医用诊断X射线机YY0009-1990500MA医用诊断X射线机YY0010-2002口腔X射线机YY0011-1990X射线摄影暗匣YY0012-1990防散射滤线栅YY0014-2005半自动生化分析仪YY0015-1990功量机YY0016-1993YY0016-1993低频电子脉冲治疗仪YY0017-2002骨接合植入物金属接骨板YY0018-2002骨接合植入物金属接骨螺钉YY0019-2002骨接合植入物金属髓内针YY0021-1990旁滤式离心机技术条件YY0027-1990电热恒温培养箱YY0028-1990一次性使用静脉输液针YY0029-1990一次性使用输血器用液过滤网YY0030-2004腹膜透析管YY0031-1990硅橡胶输液(血)管YY0032-2004血红蛋白计YY0033-2000无菌医疗器具生产管理规范YY0034-1990医药档案著录细则YY0035-1991食品添加剂葡萄糖酸亚铁YY0036-1991食品添加剂维生素C磷酸酯镁YY0037-1991饲料添加剂维生素预混料通则YY0038-1991饲料添加剂β-胡萝卜素YY0039-1991饲料添加剂乙氧基喹啉YY0040-1991饲料添加剂盐酸氯苯胍YY0041-1991饲料添加剂磺胺喹恶啉YY0042-1991高频喷射呼吸机YY0043-2005YY0043-2005医用缝合针YY0045-1991普通产床YY0046-1991医用伽玛照明机技术参数及测量方法YY0047-1991医疗器械产品图样及设计文件的术语YY0048-1991医疗器械产品工作图样的基本要求YY0049-1991医疗器械产品图样及设计文件格式YY0050-1991医疗器械产品图样及设计文件编号原则YY0051-1991医疗器械产品图样及其主要设计文件的完整性YY0052-1991医疗器械产品图样及设计文件的更改办法YY0052-1991医疗器械产品图样及设计文件的更改方法YY0053-1991空心纤维透吸器YY0054-2003血液透析、血液透析滤过和血液滤过设备YY0055-2002牙科设备光固化机YY0056-1991管制口服液瓶YY0057-1991固体药用聚烯烃塑料瓶YY0058-2004牙科病人椅YY0059.1-1991YY0059.1-1991牙科手机4号牙科直手机YY0059.2-1991YY0059.2-1991牙科手机7号牙科直手机YY0059.3-1991YY0059.3-1991牙科手机4、7号牙科弯手机YY0060-1991热敷灵YY0061-1991特定电磁波治疗器YY0062-2004X射线管组件固有滤过的测定YY0063-2000医用诊断X射线管组件-焦点特性YY0064-2004医用诊断旋转阳极X射线管电、热及负载特性YY0065-1992裂隙灯显微镜YY0066-1992眼科光学仪器名词术语YY0067-1992微循环显微镜YY0068-1992医用硬管内窥镜通用技术条件YY0069-1992气管窥镜YY0070-1992食管窥镜YY0071-1992直肠、乙状结肠窥镜YY0072-1992眼科用刀通用技术条件YY0073-1992泪囊牵开器YY0074-1992睑板腺襄肿镊YY0075-2005泪道探针YY0076-1992金属制件的镀层分类技术条件YY0077-1992喉钳通用技术条件YY0078-1992气管异物钳通用技术条件YY0079-2006外科值入物.金属夹YY0079-2006外科植入物金属夹YY0079.1-1992银类YY0079.2-1992银夹台YY0079.3-1992银夹钳YY0080-1992硬质合金镶片持针钳YY0081-1992筛窦钳YY0082-1992平端蝶形螺钉YY0083-1992医疗仪器设备用产品铭牌YY0084.1-1992圆形压力蒸汽灭菌器主要受压元件强度计算及其有关规定YY0084.2-1992矩形压力蒸汽灭菌器主要受压(力)元件强度计算及其有关规定YY0085.1-1992脉动真空压力蒸汽灭菌器YY0085.2-1992预真空压力蒸汽灭菌器YY0086-1992药品冷藏箱YY0087-1992电泳仪YY0087-2004电泳装置YY0088-1992微量进样器YY0089-1992病人监护系统专用安全要求YY0090-1992子宫刮匙YY0091-1992子宫颈扩张器YY0092-1992子宫颈活体取样钳YY0093-2004医用诊断X射线影像增强器YY0094-2004应用诊断X射线透视荧光屏YY0095-2004钨酸钙中速医用增感屏YY0096-1992钴--60远距离治疗机YY0097-1992YY0097-1992磁疗保健杯YY0099-1993电动流产吸引器YY0100-1993电动吸引器YY0101-1993脚踏吸引器YY0102-1993孔式手术无影灯YY0103-1993冷光单孔手术灯YY0104-1993三棱针YY0105-1993揿针YY0106-2004医用诊断X射线机通用技术条件YY0107-2005眼科A型超声测量仪YY0108-1993M型脉冲反射式超声诊断设备YY0109-2003医用超声雾化器YY0110-1993医用超声压电陶瓷材料YY0111-1993超声多普勒换能器技术要求和试验方法YY0111-2005超声多普勒换能器技术要求和试验方法YY0112-1993模拟口腔环境冷热疲劳试验方法YY0113-1993牙科复合树脂耐磨耗性能测试方法YY0114-1993医用输液,输血,注射器用聚乙烯专用料YY0115-1993一次性使用采血器YY0116-1993医用房间空气调节器YY0117.1-2005外科植入物—骨关节假体锻、铸件Ti6A14v钛合金锻件YY0117.1-2005外科植入物骨关节假体锻、铸件Ti6Al4V钛合金锻件YY0117.2-2005外科植入物——骨关节假体锻、铸件ZTi6A14V钛合金铸件YY0117.2-2005外科植入物骨关节假体锻、铸件ZTi6Al4V钛合金铸件YY0117.3-2005外科植入物故关节假体锻、铸件钴铬钼合金铸件YY0117.3-2005外科植入物骨关节假体锻、铸件钴铬钼合金铸件YY0118-1993髋关节假体YY0118-2005髋关节假体YY0119-2002骨接合植入物金属矫形用钉YY0120-2002骨接合植入物金属矫形用棒YY0122-1993药用中间体利福霉素S钠YY0123-1993药用中间体D-山梨醇溶液YY0124-1993药用中间体乙酰苯胺(退热冰)YY0125-1993药用辅料聚乙烯吡咯烷酮YY0126-1993滚压式搏动血泵YY0127.1-1993口腔材料生物试验方法溶血试验YY0127.10-2001口腔材料生物学评价第二单元∶口腔材料生物试验方法-鼠伤寒沙门式杆菌回复突变YY0127.11-2001YY0127.11-2001牙科学用于口腔的医疗器械生物相容性临床前评价第2单元∶口腔材料生物试验方法盖髓试验YY0127.2-1993口腔材料生物试验方法静脉注射急性全身毒性试验YY0127.3-1998口腔材料生物学评价第2单元∶口腔材料生物试验方法根管内应用试验YY0127.4-1998口腔材料生物学评价第2单元∶口腔材料生物试验方法骨埋植试验YY0127.5-1999口腔材料生物学评价第2单元∶口腔材料生物试验方法吸入毒性试验YY0127.6-1999口腔材料生物学评价第2单元∶口腔材料生物试验方法显性致死试验YY0127.7-2001口腔材料生物学评价第二单元∶口腔材料生物试验方法YY0127.8-2001口腔材料生物学评价第二单元∶口腔材料生物试验方法-皮下植入试验YY0127.9-2001口腔材料生物学评价第二单元∶口腔材料生物试验方法——细胞毒性试验(琼脂覆盖法及分子过滤法)YY0128-1993医用X射线防护装置及用具YY0128-2004医用诊断X射线辐射防护器具装置及用具YY0129-1993医用诊断X射线可变限束器技术要求及试验方法YY0130-1993医用X射线设备及用具标准体系表YY0131-1993口服液瓶撕拉铝盖YY0132-1993崩解仪YY0133-1993离心薄膜蒸发器YY0136-1993脱皮机YY0138-1993结晶器YY0141-1993医药工业洁净室和洁净区悬浮粒子的测试方法YY0142-1994一次性使用输液、输血器具用空气过滤器YY0143-1993药用辅料柠檬黄YY0144-1993药用辅料日落黄YY0145-1993药用辅料胭脂红YY0146-1993药用辅料苋菜红YY0147-1993药用辅料亮蓝YY0148-1993医用橡皮膏YY0148-2006医用胶带通刚要求YY0148-2006医用胶带通用要求YY0149-1993不锈钢医用器械耐腐蚀性能试验方法YY0149-2006YY0149-2006不锈钢医用器械.耐腐蚀性能试验方法YY0149-2006不锈钢医用器械耐腐蚀性能试验方法YY0150-1993医药工业企业能量平衡规则YY0151-1993医药工业企业能量平衡验收通则YY0152-1993医药工业企业能量审计通则YY0153-1993蒸汽疏水阀的选型、安装、使用、维护导则YY0154-2005压力蒸汽灭菌设备用弹簧式安全阀YY0155-1994电泳槽YY0156-1994微量振荡器YY0157-2005压力蒸汽灭菌设备用弹簧式放气阀YY0157-2005压力蒸汽灭菌设备用弹簧式放汽阀YY0158-2005压力蒸汽灭菌设备用密封垫圈YY0159-2005压力蒸汽灭菌设备用疏水阀YY0160-1994直管形石英紫外线低压汞消毒灯YY0161-1994安瓿机用燃烧器YY0162.1-1994医用超声设备档次系列第一部分∶B型超声诊断设备YY0163-1994医用超声测量水听器特性和校准YY0163-2005医用超声测量水听器特性和校准YY0165-1994热垫式治疗仪YY0166-2002带线缝合针YY0167-1998非吸收性外科缝线YY0167-2005YY0167-2005非吸收性外科缝线YY0168-1994血液冷藏箱YY0169.1-1994丁基橡胶输液瓶塞YY0169.2-1994丁基橡胶抗生素瓶塞YY0169.3-1994丁基橡胶药用瓶塞化学试验方法YY0170.1-1994牙挺YY0170.2-1994丁字形牙挺YY0171-1994手术器械包装通用技术条件YY0172-1994子宫探针YY0173.1-1994手术器械圆柱沉头鳃轴螺钉YY0173.10-1994手术器械圆柱沉头鳃轴铆钉YY0173.11-1994手术器械球面圆柱头鳃轴螺钉YY0173.12-1994手术器械圆柱头鳃轴螺钉YY0173.2-1994手术器械球面圆柱沉头鳃轴螺钉YY0173.3-1994手术器械钳用鳃轴YY0173.4-1994手术器械唇头钩YY0173.4-2005手术器械唇头钩唇头齿锁止牙蛋形指圈YY0173.5-1994手术器械唇头齿YY0173.6-1994手术器械锁止牙YY0173.7-1994手术器械柄花YY0173.8-1994手术器械蛋形指圈YY0173.9-1994手术器械小长方柄空心八角柄六角柄YY0174-2005手术刀片YY0175-2005手术刀柄YY0176-1994医用剪通用技术条件YY0176-2006医用剪.通用技术条件YY0176-2006医用剪通用技术条件YY0176.10-1997角膜剪YY0176.11-1997眼用手术剪YY0176.12-1997眼球摘出剪YY0176.2-1997普通手术剪YY0176.3-1997综合组织剪YY0176.4-1997心脏手术剪YY0176.5-1997纱布绷带剪YY0176.6-1997拆线剪YY0176.7-1997组织剪YY0176.8-1997脐带剪YY0176.9-1997虹膜剪YY0177-2005组织钳YY0178-1994直肠、乙状结肠活体取样钳YY0179-2005丁字式开口器YY0180-1994眼睑拉钩YY0181-1994输卵管提取板YY0182-1994宫内节育器取出钩YY0183-1994宫内节育器放置叉YY0184-1994输精管分离钳YY0185-1994输精管皮外固定钳YY0186-1994医用中心吸引系统通用技术条件YY0187-1994医用中心供氧系统通用技术条件YY0188.1-1995药品检验操作规程第1部分:药品检验操作通则YY0188.10-1995药品检验操作规程第10部分:制剂溶出度和释放度测定法YY0188.11-1995药品检验操作规程第11部分:澄明度检查法YY0188.2-1995药品检验操作规程第2部分:药品物理常数测定法YY0188.3-1995药品检验操作规程第3部分:化学原料药杂质检查法YY0188.4-1995药品检验操作规程第4部分:有机溶剂残留量测定法YY0188.5-1995药品检验操作规程第5部分:药品仪器分析法YY0188.6-1995药品检验操作规程第6部分:药品生物测定法YY0188.7-1995药品检验操作规程第7部分:化学原料药含量测定法YY0188.8-1995药品检验操作规程第8部分:制剂检查通则YY0188.9-1995药品检验操作规程第9部分:制剂含量测定法YY0189-1994鼻镜YY0190-1994筒形肛门镜YY0191-1994腹腔吸引管YY0192-1994制药机械标准体系表YY0193-1994医疗器械铝制件阳极氧化膜技术条件YY0194-1994医用钳头端摆动量测定方法YY0195-1994心电图机可靠性试验方法YY0196-1994一次性使用心电电极YY0196-2005YY0196-2005一次性使用心电电极YY0197.1-1995医用X射线管详细规范XD1-3-100X射线管YY0197.2-1995医用X射线管详细规范XD2-1-85X射线管YY0197.3-1995医用X射线管详细规范XD3-3.5-100X射线管YY0197.4-1995医用X射线管详细规范XD4-2.9-100X射线管YY0197.5-1995医用X射线管详细规范.XD51-20、40-100和XD51-20、40-125旋转阳极X射线管YY0198-199510mA医用诊断X射线机YY0199-199530mA医用诊断X射线机YY0200-199550mA医用诊断X射线机YY0201-1995100mA医用诊断X射线机YY0202-1995医用X射线体层摄影装置YY0202-2004医用诊断X射线体层摄影装置YY0203-1995药用铝瓶YY0204-1995药用辅料亚硫酸氢钠YY0205-1995药用辅料无水亚硫酸钠YY0206-1995药用辅料乙二胺四乙酸二钠YY0207-1995药用辅料L-酒石酸YY0208-1995药用辅料乙二胺YY0209-1995药用辅料氢氧化钾YY0210-1995药用中间体7-氨基-3-去乙酰氧基头孢烷酸YY0211-1995药用中间体青霉素钾YY0212-1995药用中间体孕甾双烯醇酮乙酸酯YY0213-1995药用中间体3-氯-4-氟苯胺YY0214-1995药用中间体乙脒盐酸盐(盐酸乙脒)YY0215.1-1995电热消毒柜安全、消毒效果通用技术条件YY0215.2-1995臭氧消毒柜安全、消毒效果通用技术条件YY0216-1995制药机械产品型号编制方法YY0218.1-1995履带式计数充填机YY0218.2-1995小丸瓶装机YY0218.3-1995塞纸机YY0218.4-1995塞塞封蜡机YY0218.5-1995旋盖机YY0218.6-1995转鼓贴标机YY0219-1995槽式混合机YY0223-1995蜜丸机YY0226-1995安瓿拉丝灌封机YY0231-1995药用玻璃拉管线YY0232-1995卧式安瓿机YY0233.1-1995立式安瓿生产线YY0233.2-1995立式安瓿机YY0235.5-1995玻璃输液瓶塞胶塞机YY0236-1996药品包装用复合膜(通则)YY0237-1996药用辅料磷酸氢二钠YY0238-1996药用辅料甲基纤维素YY0239-1996药用辅料乙基纤维素YY0240-1996药用辅料硅酸镁铝YY0241-1996药用中间体2,4-二氯氟苯YY0242-1996医用输液、输血、注射器用聚丙烯专用料YY0243-2003一次性使用无菌注射器用活塞YY0244-1996口腔材料生物试验方法短期全身毒性试验∶经口途径YY0245.1-1997吻(缝)合器通用技术条件YY0245.2-1996管型消化道吻合器YY0246-1996鼻咽活体取样钳YY0247-1996医药工业企业合理用能设计导则YY0248-1996药用玻璃窑炉经济运行管理规范YY0249-1996药用软膏铝管YY0251-1997微量青霉素试验方法YY0254-1997全自动硬胶囊充填机YY0257-1997三工位注吹式塑料药瓶机YY0260-1997制药机械产品分类与代码YY0267-1995血液净化装置的体外循环血路YY0268-2001用于口腔的医疗器械生物相容性临床前评价第1部分:评价与试验项目选择YY0269-1995牙科学牙釉质粘合树脂YY0270-1995牙科学义齿基托聚合物(义齿基托树脂)YY0270-2003牙科学--义齿基托聚合物YY0271-1995齿科水基水门汀YY0272-1995齿科氧化锌丁香酚水门汀YY0273-1995齿科银汞调合器YY0274.1-1995牙科洁刮器械洁治器YY0274.2-1995牙科洁刮器械刮治器YY0274.2-1995牙科洁刮器械洁治器YY0275-1995银汞合金充填器YY0276-1995水门汀充填器YY0277-1995牙根尖挺YY0278-1995根管充填器YY0279-1995口腔材料生物试验方法口腔粘膜刺激试验YY0279-1995口腔标准生物试验方法口腔粘膜刺激试验YY0280-1995YY0280-1995电热蒸馏水器YY0281-1995口腔科手术器械连接牢固度试验方法YY0282-1995注射针YY0283-1995纤维大肠镜YY0284-2004氦氖激光血管内照射治疗仪通用技术条件YY0285.1-1999一次性使用无菌血管内导管.第1部分_通用要求YY0285.1-2004一次性使用无菌血管内导管第1部分:通用要求YY0285.2-1999一次性使用无菌血管内导管第2部分∶造影导管YY0285.3-1999一次性使用无菌血管内导管第3部分∶中心静脉导管YY0285.4-1999一次性使用无菌血管内导管第4部分∶球囊扩张导管YY0285.5-2004一次性使用无菌血管内导管第5部分:套针外周导管YY0286-1996一次性使用滴定管式输液器YY0286.2-2006专用输液器第2部分-一次性使用滴定管式输液器重力输液式YY0286.2-2006专用输液器第2部分:一次性使用滴定管式输液器,重力输液式YY0286.4-2006专用输液器第4部分-一次性使用压力输液设备用输液器YY0286.4-2006专用输液器第4部分:一次性使用压力输液设备用输液器YY0287-2003医疗器械质量管理体系用于法规的要求YY0288-1996质量体系.医疗器械.GB-T19002—ISO9002应用的专用要求YY0288-1996质量体系医疗器械GB/T19002-ISO9002应用的专用要求YY0289-1996一次性使用微量采血吸管YY0290.1-1997人工晶体第1部分∶术语YY0290.2-1997人工晶体第2部分_光学性能及其测试方法YY0290.2-1997人工晶体第2部分∶光学性能及其测试方法YY0290.3-1997人工晶体第3部分∶机械性能及其测试方法YY0290.4-1997人工晶体第4部分∶标签和资料YY0290.5-1997人工晶体第5部分∶生物相容性YY0290.6-1997人工晶体第6部分∶有效期和运输试验YY0290.8-1997人工晶体第8部分∶基本要求YY0291-1997医用X射线设备环境要求及试验方法YY0291-2007医用X射线设备环境要求及试验方法YY0292.1-1997医用诊断X射线辐射防护器具第一部分∶材料衰减性能的测定YY0292.2-1997医用诊断X射线辐射防护器具第二部分∶防护玻璃板YY0293-1997无菌手术刀片YY0294.1-2005外科器械金属材料第1部分_不锈钢YY0294.1-2005外科器械金属材料第1部分:不锈钢YY0295.1-2005YY0295.1-2005医用镊通用技术条件YY0295.10-1997睫毛镊YY0295.11-1997晶体囊镊YY0295.12-1997耳用膝状镊YY0295.13-1997鼻用枪状镊YY0295.2-1997整形镊YY0295.3-1997组织镊YY0295.4-1997牙用镊YY0295.5-1997解剖镊YY0295.6-1997眼用镊YY0295.7-1997虹膜镊YY0295.8-1997固定镊YY0295.9-1997沙眼镊YY0296-1997一次性使用注射针识别色标YY0297-1997医疗器械临床调查YY0298-1998医用分子筛制氧设备通用技术规范YY0299-1998医用超声耦合剂YY0300-1998牙科学合成树脂牙YY0301-1998牙科学陶瓷牙YY0302-1998高速牙科车针YY0303-1998医用羟基磷灰石粉料YY0304-1998等离子喷涂羟基磷灰石涂层--钛基牙种植体YY0304-1998等离子喷涂羟基磷灰石涂层-钛基牙种植体YY0305-1998羟基磷灰石生物陶瓷YY0306-1998热辐射类治疗设备安全专用要求YY0307-2004连续波掺钕钇铝石榴石激光治疗机通用技术条件YY0308-2004医用透明质酸钠凝胶YY0309-1998医用电气设备.第2部分:X射线计算机体层摄影设备安全专用要求YY0310-1998X射线计算机体层摄影设备通用技术条件YY0311-1998一次性使用血路产品通用技术条件YY0312-1998性辅助器具通用技术条件YY0313-1998医用高分子制品包装、标志、运输和贮存YY0314-1999一次性使用静脉血样采集容器YY0315-1999纯钛人工牙种植体YY0316-2003医疗器械风险管理对医疗器械的应用YY0317-2000医用诊断X射线机通用技术条件YY0318-2000医用诊断X射线辐射防护器具第3部分:防护服和性腺防护器具YY0319-2000医用电气设备第二部分:医疗诊断用磁共振设备安全专用要求YY0320-2000麻醉机YY0321.1-2000一次性使用麻醉穿刺包YY0321.2-2000一次性使用麻醉穿刺针YY0321.3-2000一次性使用麻醉用过滤器YY0322-2000高频电灼治疗仪YY0323-2000红外治疗设备安全专用要求YY0324-2000红外乳腺检查仪YY0325-2002一次性使用无菌导尿管YY0326.1-2002一次性使用离心式血浆分离器第1部分:血浆分离怀YY0326.2-2002一次性使用离心式血浆分离器第2部分:血浆管理YY0326.3-2005一次性使用离心式血浆分离器第3部分-血浆袋YY0327-2002一次性使用紫外线透疗血液容器YY0328-2002一次性使用机用采血器YY0329-2002一次性使用去白细胞滤器YY0330-2002医用脱脂棉YY0331-2002医用脱脂纱布YY0331-2006YY0331-2006医用脱脂纱布YY0331-2006脱脂棉纱布、脱脂棉粘胶混纺纱布的性能要求和试验方法YY0331-2006脱脂棉纱布、脱脂棉粘胶混纺纱布的性能要求和试验方法YY0331-2006脱脂棉纱布脱脂棉粘胶混纺纱布的性能要求和试验方法YY0332-2002植入式给药装置YY0333-2002软组织扩张器YY0334-2002硅橡胶外科植入物通用要求YY0336-2002一次性使用无菌阴道扩张器YY0337.1-2002气管插管第1部分:常用型插管及接头YY0337.2-2002气管插管第2部分:柯尔(Cole)型插管YY0338.1-2002气管切开插管第1部分:成人用插管及接头YY0338.2-2002气管切开插管第2部分:小儿用气管切开插管YY0339-2002呼吸道用吸引导管YY0340-2002外科植入物基本原则YY0341-2002骨接合用非有源外科金属植入物通用技术条件YY0342-2002外科植入物接骨板弯曲强度和刚度的测定YY0343-2002外科金属植入物液体渗透检测YY0343-2002外科金属植入物液体渗透检验YY0345-2002骨接合植入物金属骨针YY0346-2002骨接合植入物金属股骨颈固定钉YY0347-2002微型医用X射线机通用技术条件YY0448-2003超声多普勒胎儿心率仪YY0449-2003超声多普勒胎儿监护仪YY0450.1-2003一次性使用无菌血管内导管辅件第1部分:导引器械YY0450.2-2003一次性使用无菌血管内导管辅件第2部分:套针周导管管塞YY0451-2003一次性使用输注泵YY0452-2003止血钳YY0453-2003拔牙钳通用技术条件YY0454-2003无菌塑柄手术刀YY0455-2003医用电气设备第2部分:婴儿辐射保暖台安全专用要求YY0456.1-2003血细胞分析仪应用试剂第1部分_清洗液YY0456.2-2003血细胞分析仪应用试剂第2部分_溶血剂YY0456.3-2003血细胞分析仪应用试剂第3部分:稀释液YY0457.1-2003医用电气设备光电X射线影像增强器特性第1部分:入射尺寸的测定YY0457.2-2003医用电气设备光电X射线影像增强器特性第2部分_转换系数的测定YY0457.3-2003医用电气设备光电X射线影像增强器特性第3部分:亮度分布和非均匀性测定YY0457.4-2003医用电气设备光电X射线影像增强器特性第4部分:影像失真的测定YY0457.5-2003医用电气设备光电X射线影像增强器特性第5部分:探测量子效率的测定YY0457.6-2003医用电气设备光电X射线影像增强器特性第6部分:对比度及炫光系数的测定YY0457.7-2003医用电气设备光电X射线影像增强器特性第7部分:调制传递函数的测定YY0458-2003超声多普勒仿血流体模的技术要求YY0459-2003外科植入物--丙烯酸类树脂骨水泥YY0460-2003超声洁牙设备YY0461-2003麻醉机和呼吸机用呼吸管路YY0462-2003牙科石膏产品YY0463-2003牙科磷酸盐铸造包埋材料YY0464-2003一次性使用血液灌流器YY0465-2003一次性使用空心纤维血浆分离器YY0466-2003医疗器械用于医疗器械标签、标记和提供信息的符号YY0467-2003医疗器械保障医疗器械安全和性能公认基本原则的标准选用指南YY0468-2003命名用于管理资料交流的医疗器械命名系统规范YY0469-2004医用外科口罩技术要求YY0470-2004一次性使用圆宫型宫内节育器放置器YY0471.1-2004接触性创面敷料试验方法第1部分:液体吸收性YY0471.2-2004接触性创面敷料试验方法第2部分:透气膜敷料水蒸气透过率YY0471.3-2004接触性创面敷料试验方法第3部分:阻水性YY0471.4-2004YY0471.4-2004接触性创面敷料试验方法第4部分_舒适性YY0471.5-2004YY0471.5-2004接触性创面敷料试验方法第5部分_阻菌性YY0471.6-2004YY0471.6-2004接触性创面敷料试验方法第6部分_气味控制YY0472.1-2004医用非织造敷布试验方法第1部分∶敷布生产用非织造布YY0472.2-2004医用非织造敷布试验方法第2部分∶成品敷布YY0473-2004外科植入物聚交酯共聚物和共混物体外降解试验YY0474-2004外科植人物用聚L-丙交酯树脂及制品体外降解试验YY0475-2004尿液化学分析仪通用技术条件YY0476-2004眼内冲洗灌注液YY0477-2004角膜塑形用硬性透气接触镜YY0478-2004干化学尿液分析试纸条通用技术条件YY0479-2004医用诊断旋转阳极X射线管最大对称辐射野的测定YY0480-2004诊断X射线成像设备通用及乳腺摄影防散射滤线栅的特性YY0481-2004医用诊断X射线设备-测定特性用辐射条件YY0482-2004医疗诊断用磁共振设备技术要求及试验方法YY0483-2004一次性使用肠营养导管、肠给养器及其连接件设计与试验方法YY0484-2004外科植入物双组分加成型硫化硅橡胶YY0485-2004一次性使用心脏停跳液贯注器YY0486-2004激光手术专用气管插管标志和提供信息的要求YY0487-2004一次性使用无菌脑积水分流器及其组件YY0488-2004一次性使用无菌直肠导管YY0489-2004一次性使用无菌引流导管及辅助器械YY0490-2004气管支气管插管推荐的规格标识合标签YY0491-2004心脏起搏器植入式心脏起搏器用的小截面连接器YY0492-2004植入式心脏起搏器电极导管YY0493-2004牙科学弹性体印模材料YY0494-2004牙科琼脂基水胶体印模材料YY0495-2004牙根管充填尖YY0496-2004牙科铸造蜡YY0497-2005一次性使用无菌胰岛素注射器YY0498.1-2004喉镜连接件第1部分:常规挂钩型手柄-窥视片接头YY0498.2-2004喉镜连接件第2部分:微型点灯螺纹和带常规窥视片的灯座YY0499-2004麻醉喉镜通用技术条件YY0500-2004心血管植入物人工血管YY0501-2004尿液分析质控物YY0502-2005膝关节假体YY0503-2005YY0503-2005环氧乙烷灭菌器YY0504-2005手提式压力蒸汽灭菌器YY0505-2005医用电气设备第1-2部分-安全通用要求并列标准-电磁兼容要求和试验YY0505-2005医用电气设备第1-2部分_安全通用要求-并列标准_电磁兼容—要求和试验YY0505-2005医用电气设备第1-2部分安全通用要求并列标准电磁兼容要求和试验YY0506.1-2005病人、医护人员和器械用手术单、手术衣和洁净服第1部分-制造厂、处理厂和产品的通用要求YY0506.1-2005病人、医护人员和器械用手术单、手术衣和洁净服第1部分_制衣厂、处理厂和产品的通用要求YY0506.1-2005病人、医护人员和器械用手术单、手术衣和洁净服第1部分:制衣厂、处理厂和产品的通用要求YY0506.3-2005病人、医护人员和器械用手术单、手术衣和洁净服第3部分-试验方法YY0506.3-2005病人、医护人员和器械用手术单、手术衣和洁净服第3部分_试验方法YY0506.3-2005病人、医护人员和器械用手术单、手术衣和洁净服第3部分:试验方法YY0506.4-2005病人、医护人员和器械用手术单、手术衣和洁净服第4部分-干态落絮试验方法YY0506.4-2005病人、医护人员和器械用手术单、手术衣和洁净服第4部分_干态落絮试验方法YY0567.1-2005医疗产品的无菌加工.第1部分_通用要求YY0567.1-2005医疗产品的无菌加工第1部分-通用要求YY0567.2-2005医疗产品的无菌加工.第2部分_过滤YY0567.2-2005医疗产品的无菌加工第2部分-过滤YY0567.2-2005医疗产品的无菌加工第2部分:过滤YY0569-2005YY0569-2005生物安全柜YY0570-2005医用电气设备第二部分:手术台安全专用要求YY0571-2005医用电气设备第2部分-医院电动床安全专用要求YY0572-2005YY0572-2005血液透析和相关治疗用水YY0573.3-2005一次性使用无菌注射器第3部分-自毁型固定剂量疫苗注射器YY0573.3-2005一次性使用无菌注射器第3部分_自毁型固定剂量疫苗注射器YY0573.3-2005一次性使用无菌注射器第3部分:自毁型固定剂量疫苗注射器YY0574.1-2005YY0574.1-2005麻醉和呼吸护理报警信号第1部分视觉报警信号YY0574.2-2005YY0574.2-2005麻醉和呼吸护理报警信号第2部分_听觉报警信号YY0574.3-2005麻醉和呼吸护理报警信号第3部分_报警应用指南YY0575-2005硫乙醇酸盐流体培养基YY0576-2005哥伦比亚血琼脂基础培养基YY0577-2005营养琼脂培养基YY0578-2005沙门、志贺菌属琼脂培养基YY0579-2005角膜曲率计YY0580-2005心血管植入物及人工器官—心肺转流系统—动脉管路血液过滤器YY0580-2005心血管植入物及人工器官心肺转流系统动脉管路血液过滤器。
预灌封注射器标准

预灌封注射器标准预灌封注射器是一种常用的医疗器械,用于将药物注射到人体内部。
为了确保预灌封注射器的安全和质量,制定一份关于预灌封注射器的标准是非常重要的。
本文将从材料、设计、生产、装配和质量控制等方面,详细介绍预灌封注射器的标准。
一、材料标准:1. 预灌封注射器的主要材质应为医用级聚合物材料,符合国家相关标准;2. 与药物接触的部分材料应符合药品包装材料的相关标准;3. 注射器和针头材料应具有良好的耐药性和耐溶剂性。
二、设计标准:1. 注射器应具有清晰易读的刻度,并有充分的容量;2. 注射器应具备良好的操作性能,包括注射器的推注力与使用手感,防滑设计;3. 注射器连接口的设计应符合国际上接口标准,确保与其他设备的连接的兼容性;4. 注射器应具备一次性使用,不可重复使用。
三、生产和装配标准:1. 生产线应符合GMP认证,并建立完善的生产流程和质量控制体系;2. 注射器的生产过程需要经过洁净室环境,确保无菌制造;3. 注射器的装配过程应符合操作规程,确保装配的准确性和安全性;4. 注射器的包装过程应符合相关标准,确保产品的完整性和清洁度。
四、质量控制标准:1. 注射器应进行严格的质量检测,包括外观检查、容量测试、灭菌验证等;2. 每批注射器应进行批次管理,标识清晰,并留存样本;3. 检测方法和检测设备应符合国家标准,并经过验证和校准;4. 注射器的质量控制过程应符合国家相关法律法规和标准。
总结:预灌封注射器的标准涵盖了材料、设计、生产、装配和质量控制等多个方面。
通过制定和执行这些标准,可以确保预灌封注射器的安全和质量,保护患者的健康。
相信随着医疗技术的进步,预灌封注射器的标准会进一步完善,为医疗行业提供更好的产品和服务。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
YBB30012012
预灌封注射器用氯化丁基橡胶活塞Yuguanfengzhusheqiyong Lühuadingjixiangjiao Huosai
Chlorobutyl Rubber Plungers for Prefilled Syringes
本标准适用于预灌封注射器用氯化丁基橡胶活塞。
活塞类型为扣合式(PSL)或螺纹式(PT)。
【外观】取本品数个,目视检测,表面色泽应均匀,不得有污点、杂质、气泡、裂纹、缺
胶、粗糙、胶丝、胶屑、海绵状、毛边;不得有除边造成的残缺或锯齿现象;不得有模具造成的明显痕迹。
如果有浇道口,不应凸出于活塞的表面。
【鉴别】*(1)称取本品2.0g,剪成小颗粒,置坩锅中,加碳酸氢钠2.0g 均匀覆盖试样,
置电炉上,缓缓加热至炭化,放冷,置马弗炉300℃加热至完全灰化,取出后,冷却至室温,加
水10ml 使溶解,滤过,取续滤液1.5ml,置于试管中,加硝酸酸化,加入硝酸银试液1 滴,应产生白色沉淀。
(2)取本品适量,照包装材料红外光谱测定法(YBB60012012)第四法测定,应与对照
图谱基本一致。
【活塞与推杆的配合性】、【活塞润滑性】、【活塞滑动性能】、【器身密合性】照预灌封注射器组合件(YBB40012012)项下的方法检查,应符合规定。
【灰分】取本品1.0g,照橡胶灰分测定法(YBB600212012)测定,不得过50%。
【挥发性硫化物】* 取本品,照挥发性硫化物测定法(YBB60052012)测定,应符合规
定。
【不溶性微粒】取本品10 个,加微粒检查用水50ml,照包装材料不溶性微粒测定法
(YBB60022012)药用胶塞项下测定,每1ml 中含10μm 以上的微粒不得过60 粒,含25μm 以上的微粒不得过6 粒。
【化学性能】供试品溶液的制备:取相当于表面积200cm2 的完整胶塞若干个,按样品外
表面积(cm2)与水(ml)的比例1:2,加水浸没,煮沸5 分钟,放冷,再用同体积水冲洗5 次。
移置于锥形瓶中,加同体积水,置高压蒸汽灭菌器中,升温至121℃±2℃,保持30 分钟,冷却至室温,移出,即得供试品溶液,备用;并同时制备空白对照溶液。
进行下列试验:
澄清度与颜色取供试品溶液,依法检查(中国药典2010 年版二部附录IX B 和附录IX A),
溶液应澄清无色。
如显浑浊,与2 号浊度标准液比较,不得更浓。
如显色,与黄绿色5 号标准比色液比较,不得更深。
pH 变化值取供试品溶液和空白对照溶液各20 ml,分别加入氯化钾溶液(1→1000)1 ml,
照pH 值测定法(中国药典2010 年版二部附录ⅥH)测定,两者之差不得过1.0。
吸光度取供试品溶液适量,用孔径0.45μm 的滤膜过滤,照紫外-可见分光光度法(中国
药典2010 年版二部附录IVA)测定,在220~360nm 波长范围内,吸光度不得大于0.2。
易氧化物精密量取供试品溶液20ml,精密加入0.002mol/L 高锰酸钾滴定液20ml 与稀硫酸
2ml,煮沸3 分钟,迅速冷却,加碘化钾0.1g,用硫代硫酸钠滴定液(0.01mol/L)滴定至浅棕色,再加入5 滴淀粉指示液后滴定至无色。
另取空白对照溶液同法操作,二者消耗硫代硫酸钠滴定液(0.01mol/L)之差不得过7.0 ml。
不挥发物精密量取供试品溶液及空白对照溶液100ml,分别置于已恒重的蒸发皿中,水浴
273
蒸干,在105℃干燥至恒重,两者之差不得过4.0mg。
重金属精密量取供试品溶液10ml,加醋酸盐缓冲液(pH3.5)2ml,依法检查(中国药典
2010 版二部附录ⅧH 第一法)测定,不得过百万分之一。
铵离子精密量取供试品溶液10 ml,加碱性碘化汞钾试液2ml,放置15 分钟,不得显色;
如显色,与氯化铵溶液(取氯化铵31.5mg 加无氯水适量使溶解并稀释至1000.0ml)2.0ml,加
空白提取液8ml 与碱性碘化汞钾试液2ml 制成的对照液比较,不得更深(0.0002%)。
锌离子取供试品溶液,用孔径0.45μm 的滤膜过滤,精密量取滤液10ml,加2 mol/L 盐酸
1ml 和亚铁氰化钾试液(称取4.2g 亚铁氰化钾三水化合物,用水溶解并稀释至100mL,摇匀,即得,本品应临用新制)3 滴混合,不得显色;如显色,与标准锌溶液(称取44.0mg 硫酸锌七水
化合物,用新煮沸并冷却的水溶解并稀释至1000.0ml,本品应临用新配)3.0ml,加空白对照液
7ml 与2 mol/L 盐酸1ml 和亚铁氰化钾试液3 滴对照液比较,不得更深(0.0003%)。
电导率在供试品溶液制备5 小时内,用电导率仪测定:用水冲洗测定电极(光亮铂电极或
铂黑电极)数次,取空白对照溶液冲洗电极至少2 次,测定空白对照溶液的电导率不得过3.0μS/cm (20℃±1℃)。
再用供试品溶液冲洗电极至少2 次,测定供试品溶液的电导率,应不得过
40.0μS/cm。
如果测定不是在20℃±1℃下进行,则应对温度进行校正。
【生物试验】热原* 取本品,按不规则形状比例加入氯化钠注射液,置高压蒸汽灭菌器中
采用115℃±2℃,保持30 分钟,依法检查(YBB60232012),应符合规定。
急性全身毒性试验** 取本品,按不规则形状比例加入氯化钠注射液,置高压蒸汽灭菌器中
采用115℃±2℃,保持30 分钟,依法检查(YBB60252012),应符合规定。
溶血** 取本品,依法检查(YBB60242012),溶血率应符合规定。
__。
