微生物室空气监测记录表
微生物安全自查记录表

微生物安全自查记录表一、引言微生物安全是指在实验室或生产环境中,针对微生物研究或生物制品生产过程中的生物安全问题进行自查和整改的过程。
本文将针对微生物安全自查记录表进行详细解读,以帮助读者更好地了解微生物安全自查的重要性和具体内容。
二、实验室环境1. 实验室安全实验室应具备良好的通风设施和消毒措施,保证实验室内空气质量符合相关标准。
实验室的进出口应有严格的管控措施,确保只有经过授权的人员才能进入实验室。
2. 仪器设备实验室仪器设备应定期维护和保养,确保其正常运行。
对于与微生物有关的仪器设备,应有专门的操作规范,操作人员应经过相应的培训和考核。
3. 储存条件微生物菌种的储存应符合相应的规范和标准,确保菌种的保存和传递过程中不发生污染和变异。
储存条件包括温度、湿度、pH值等,需进行严格的监控和记录。
三、微生物实验操作1. 个人防护在进行微生物实验操作时,操作人员应佩戴适当的个人防护装备,如实验服、手套、防护眼镜等,以防止微生物的直接接触和传播。
2. 操作规范微生物实验操作应按照标准的操作规范进行,包括实验前的准备工作、实验过程中的操作流程、实验后的清洁消毒等。
操作人员应定期进行培训和考核,确保操作规范的贯彻执行。
3. 消毒措施微生物实验操作过程中,对实验器皿、工作台面、操作工具等应进行适当的消毒处理,以防止微生物的交叉感染和传播。
消毒方法应选择适当的消毒剂,并按照标准的操作流程进行消毒。
四、生物制品生产过程1. 原料采购在生物制品生产过程中,对原料的采购应从合法渠道采购,确保原料的质量和安全性。
采购记录和供应商信息应妥善保存,以备查证。
2. 生产操作生物制品的生产操作应按照相关的操作规范进行,包括原料准备、发酵过程、分离和纯化等环节。
操作人员应定期进行培训和考核,以确保操作规范的执行。
3. 检测和质控生物制品生产过程中应进行相应的检测和质控,以确保产品质量和安全性。
检测方法应准确可靠,质控措施应严格执行,确保产品符合相关标准和规定。
微生物检验记录表

微生物检验原始记录
培养基配制:见培养基配制记录
样品制备:按GB/T 4789 的要求进行
□ 1.固体样品:无菌称取25g样品加225mL生理盐水,均质;稀释倍数:□1:10 □1:100 □1:1000 □ 2.液体样品:需稀释的,无菌称取25mL样品加225mL生理盐水,混匀;稀释倍数:□1:10 □1:100 □1:1000
□ 3.液体样品:不需要稀释的直接吸取样液检验
□菌落总数:检验依据:□GB 4789.2 -2010 □GB/T 5750.12-2006
检验时间:菌落总数:霉菌和酵母:
□大肠菌群:检验依据:GB/T4789.3-2003
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间:
□总大肠菌群:检验依据:GB/T 5750.12-2006
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间
□致病菌□沙门氏菌□志贺氏菌□金黄色葡萄球菌
□螨:检验依据 GB 317.4-.10-2006
检测人:复核人:
微生物限度检验记录(复合膜)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:
微生物限度检验记录(铝箔、PVC硬片)
检验人:复核人:
微生物限度检验记录(半成品、成品)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:。
生产过程微生物监控记录
填表说明:本表由质检部负责填写,按照企业生产过程微生物监测制度定期检验,填表汇总,存在为题的用红笔填写,并报告质
量负责人(质检部负责人)
ቤተ መጻሕፍቲ ባይዱ
编号:
生产过程微生物监控记录
取样日期 监控点 人 机 料 环 监控频率 5%总人数,每2天 1dm2;每2天 每2天 每周 注意事项 与食品或器皿、器皿直接接触操作人员手 部,人员要有代表性。 与食品表面直接接触的机器部位(传送带或 托 盘) 裸露于空气中的半成品或初级品 内包装间或生产过程中食品/半成品裸露的 空 间,单位可以CFU/皿*0.5小时计 菌落总数 大肠菌群 检验员 备注
空气微生物测定原始记录表

口撞击法
(撞击法)流量校准
主机插上电源(AC220V),按下“电源开关”,调节“流量调节”旋钮,使流量计转子稳定在min。
超净台杀菌:用75%的酒精把超净台实验操作台表面擦拭干净,开启紫外灯照射30min。
使用棉球或棉棒粘取75%酒精擦拭六级撞击器。放置在超净台上晾干。
检 测 人
检测日期
校 验 人
校验日期
第页, 共页
北京大学环境工程实验室
空气微生物测定原始记录表
续 表 样品批号:
组装采样器
保证圆盘上孔眼通畅,然后按顺序将撞击器-培养皿-撞击器装配好;一手从上部按住撞击器,另一只手挂在三个弹簧挂上挂钩。固定在选取的采样点位置得三角架上。培养皿盖用灭菌铝箔包好,待采样完后盖培养皿上。
采样
北京大学环境工程实验室
空气微生物测定原始记录表
样品名称
样品批号
样品数量
检测项目
细菌总数
环境条件
检测依据
口GB/T 公共场所卫生检验方法 第3部分:空气微生物 细菌总数 撞击法/自然沉降法
口HJ/T 167-2004室内环境空气质量监测技术规范 附录M 室内空气中细菌总数的测定方法 撞击法
原始记录:
1.试剂制备
灭菌铝箔,裁剪比平皿大一些的铝箔,然后灭菌 ,烘干备用。
琼脂平皿
配制灭菌后的琼脂培养基趁热(50℃-55℃)倾倒平皿,每皿24-30mL(不可超过,以免造成距离采样器吸气孔太近。),生化培养箱37℃倒置培养24h,观察有无杂菌生长,选取无杂菌生长平皿备用。
配置70-75%酒精一酒精壶。镊子棉球和棉棒若干。
注2.细菌总数报数时100以下报实数,大于等于100使用科学计数法记录。
微生物实验室环境监测制度

1 目的规范微生物实验室环境检测制度,以满足检验要求。
2 范围微生物实验室。
3 职责:3.1品管部负责微生物实验室的风速、照度、尘埃粒子数、沉降菌、换气次数等的检测,并及时将结果通知相关部门。
4内容4.1尘埃粒子数监测公司品管部应按附件图中监测点对微生物实验室洁净区进行尘埃粒子数检测,当测量数据超过表1标准要求最大值时,应及时通知设备部进行整改。
表1尘埃粒子数标准要求4.1.2 测试状态:测试人员不得多于2人.4.1.3 采样高度:采样点一般与操作面水平(离地面0.8m~1.5m高度)。
4.1.4 采样时,应避开回风口,测试人员应在采样口的下风侧。
4.2照度监测室内照度可用便携式照度计测定,室内照度必须在室温已趋稳定、光源光输出趋于稳定,测点平面离地面0.8m,按附件图中监测点进行测量,结果取平均值(照度≥300Lux),每季度监测一次。
4.3换气次数的检测在空调系统正常运转不少于30分钟后,检测人员按定点测量法要求,使用风速仪贴近风口处测量,然后根据公式计算出换气次数。
表3换气次数标准要求4.4沉降菌的检测按照GB16294-1996标准进行检测。
表3沉降菌标准要求4.6 微生物实验室的温度和湿度监测由实验室人员每天监测并留有记录。
要求实验室的温度条件为15℃-25℃,湿度条件为35%-65%。
4.7 环境指标超标状况的处理按照规定要求定期对洁净室的环境进行检测,根据检测数据,及时发现问题,并通知设备部以及相关负责人采取相应的措施。
在采取了相应的措施之后,品管部需要对环境进行二次监测,直至符合要求。
5.相关记录《照度检测记录》《风速检测记录》《温湿度记录》《洁净区沉降菌检测记录》《微生物室环境检测报告》微生物实验室监测点示意图三十万级洁净区:●表示监测点的位置受控文件发放回收记录表发放制表人:王晓华. .。
无菌室环境条件监控记录表

添加标题
添加标题
添加标题
添加标题
监控时长:每次记录时间应持续至 少30分钟
记录要求:记录时间、参数值、异 常情况及处理措施
监控位置
空气洁净度
微生物数量
温度和湿度
压差和换气次 数
温度值
温度范围:通常设 定在20-25℃
监测频率:每小时 记录一次
记录要求:准确记 录温度值和测量时 间
异常处理:温度超 出范围时,应立即 采取措施调整并记 录处理过程
湿度监控
湿度范围:通常 在30%RH60%RH之间
监控频率:每小 时记录一次
监控设备:温湿 度计
异常处理:当湿度 超出范围时,需立 即采取措施调整
洁净度监控
空气洁净度:无 菌室内空气的洁 净程度,以每立 方空气中含有的 颗粒数量表示
温度和湿度:无 菌室的温度和湿 度要求,以保证 微生物的生长和 实验的准确性
压差:无菌室与 相邻区域之间的 压力差,以保持 室内空气的流向 和防止污染
微生物监测:定 期对无菌室进行 微生物监测,以 确保室内环境的 无菌状态
微生物数量监控
监控目的:确保 无菌室内微生物 数量在控制范围 内,防止污染和
交叉污染。
监控方法:定期 对无菌室内空气、 表面、人员等进 行微生物采样, 通过培养计数等 方法进行检测。
定期对记录表进行分析和评估
记录表应定期进行 填写,确保数据的 准确性和及时性。
填写记录表时应按 照规定的格式和要 求进行,不得随意 更改或省略。
记录表的数据应真 实可靠,不得弄虚 作假或篡改数据。
记录表应定期进行 分析和评估,发现 问题及时处理和改 进。
无菌室环境条件 监控的频率和方 式
定期监测和随机监测相结合
细菌室温度、湿度、各种紫外线记录表
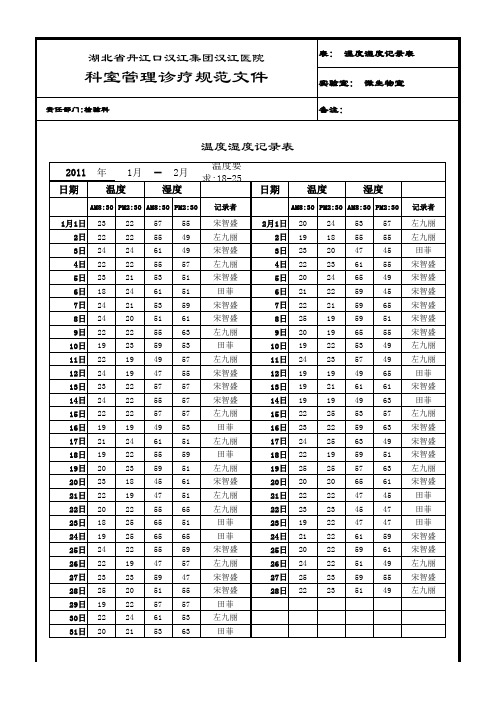
年 温度
23 22 24 22 23 18 24 24 22 19 22 24 23 24 22 19 21 19 20 23 22 20 18 19 24 22 23 25 19 22 20
1月
57 55 61 55 53 61 53 51 55 59 49 47 57 55 57 49 61 55 59 45 47 55 65 65 55 47 59 51 57 61 53
57 55 45 55 49 45 65 51 55 49 49 65 61 63 57 63 49 51 63 61 45 47 47 59 61 49 55 49
左九丽 左九丽 田菲 宋智盛 宋智盛 宋智盛 宋智盛 宋智盛 宋智盛 左九丽 左九丽 田菲 宋智盛 田菲 左九丽 宋智盛 宋智盛 宋智盛 左九丽 宋智盛 田菲 田菲 田菲 宋智盛 宋智盛 左九丽 宋智盛 左九丽
湖北省丹江口汉江集团汉江医院
表:
温度湿度记录表 微生物室
科室管理诊疗规范文件
责任部门:检验科
实验室: 备注:
温度湿度记录表
2011 日期
1月1日 2日 3日 4日 5日 6日 7日 8日 9日 10日 11日 12日 13日 14日 15日 16日 17日 18日 19日 20日 21日 22日 23日 24日 25日 26日 27日 28日 29日 30日 31日
55 49 49 57 51 51 59 61 63 53 57 55 57 57 57 53 51 59 51 61 51 65 51 65 59 57 47 55 57 53 63
宋智盛 左九丽 宋智盛 左九丽 宋智盛 田菲 宋智盛 宋智盛 左九丽 田菲 左九丽 宋智盛 宋智盛 宋智盛 左九丽 田菲 左九丽 田菲 左九丽 宋智盛 左九丽 左九丽 田菲 田菲 宋智盛 左九丽 宋智盛 宋智盛 田菲 左九丽 田菲
微生物检验记录簿表格
微生物检验原始记录
培养基配制:见培养基配制记录
样品制备:按GB/T 4789 的要求进行
□ 1.固体样品:无菌称取25g样品加225mL生理盐水,均质;稀释倍数:□1:10 □1:100 □1:1000 □ 2.液体样品:需稀释的,无菌称取25mL样品加225mL生理盐水,混匀;稀释倍数:□1:10 □1:100 □1:1000
□ 3.液体样品:不需要稀释的直接吸取样液检验
□菌落总数:检验依据:□GB 4789.2 -2010 □GB/T 5750.12-2006
检验时间:菌落总数:霉菌和酵母:
□大肠菌群:检验依据:GB/T4789.3-2003
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间:
□总大肠菌群:检验依据:GB/T 5750.12-2006
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间
□致病菌□沙门氏菌□志贺氏菌□金黄色葡萄球菌
□螨:检验依据 GB 317.4-.10-2006
检测人:复核人:
微生物限度检验记录(复合膜)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:
微生物限度检验记录(铝箔、PVC硬片)
检验人:复核人:
微生物限度检验记录(半成品、成品)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:。
微生物检验记录表

微生物检验原始记录
检测记录与结果
培养基配制:见培养基配制记录
样品制备:按GB/T 4789的要求进行
□1.固体样品:无菌称取25g样品加225mL生理盐水,均质:稀释倍数:口1:10 01:100 口1: 1000 □2.液体样品:需稀释的,无菌称取25mL样品加225mL生理盐水,混匀:稀释倍数:口1:10 01:100□ 1: 1000
□3.液体样品:不需要稀释的直接吸取样液检验
口大肠菌群:检验依据:GB/T4789. 3-2003
口大肠菌群:检验依据:GB 4789. 3-2010
口总大肠菌群:检验依据:GB/T 5750. 12-2006
口大肠埃希氏菌:检验依据:GB/T 5750. 12-2006
口致病菌口沙门氏菌□志贺氏菌□金黄色葡萄球菌
检验依据:DGB 4789. 4-2010 DGB 4789. 5-2012 OGB 4789. 10-2010
GB 317. 4-. 10-2006
检测人:复核人:
微生物限度检验记录(复合膜)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:
微生物限度检验记录(铝箔、PVC硬片)
检验人:复核人:
微生物限度检验记录(辅料)
微生物限度检验记录(半成品、成品)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:。
生产过程微生物监控记录
填表说明:本表由质检部负责填写,按照企业生产过程微生物监测制度定期检验,填表汇总,存在为题的用红笔填写,并报告质量负责
人(质检部负责人)
编号:
生产过程微生物监控记录
取样日期 监控点 监控频率
注意事项
菌落总数 大肠菌群 检验员
人
5%总人数,每2天
与食品或器皿、器皿直接接触操作人员手部, 人员要有代表性。
备注
机(传送带或托 盘)
料
每2天
裸露于空气中的半成品或初级品
环
每周
内包装间或生产过程中食品/半成品裸露的空 间,单位可以CFU/皿*0.5小时计
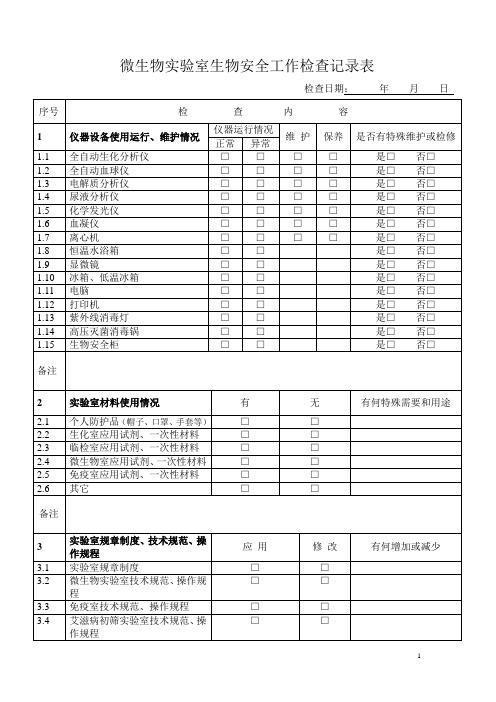
微生物实验室生物安全工作检查记录表
□
备注
注:请在检查表所选□内打“√”
检查人员签字:
有□
无□
4.3
实验室入口处张贴生物危险标志
有□
无□
4.4
个人意外伤害的紧急处理
有□
无□
是否需要特殊处理:是□否□
4.5
个人防护物品
有□
无□
5
医疗废物处置情况
分类
是/否
登记
是/否
消毒
是/否
其它
5.1
生化室医疗废物是否分类、登记、消毒处理
是□否□
是□否□
是□否□实验室生物安全工作检查记录表
检查日期:年月日
序号
检查内容
1
仪器设备使用运行、维护情况
仪器运行情况
维护
保养
是否有特殊维护或检修
正常
异常
1.1
全自动生化分析仪
□
□
□
□
是□否□
1.2
全自动血球仪
□
□
□
□
是□否□
1.3
电解质分析仪
□
□
□
□
是□否□
1.4
尿液分析仪
□
□
□
□
是□否□
1.5
化学发光仪
□
□
□
□
是□否□
是□否□
是□否□
5.3
微生物实验室医疗废物是否分类登记、消毒处理
是□否□
是□否□
是□否□
5.4
血清样品是否保存3至5天
是□否□
5.5
废弃物处置是否符合国家有关规定
符合□不符合□
6
实验室消毒
消毒
微生物检验记录表
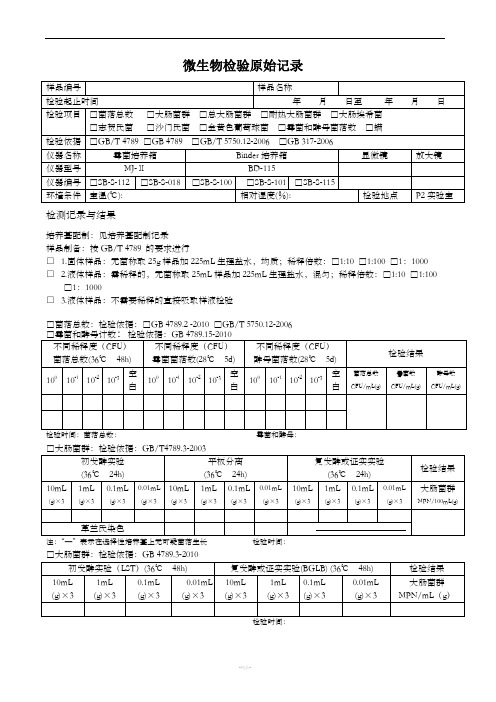
微生物检验原始记录
检测记录与结果
培养基配制:见培养基配制记录
样品制备:按GB/T 4789 的要求进行
□ 1.固体样品:无菌称取25g样品加225mL生理盐水,均质;稀释倍数:□1:10 □1:100 □1:1000
□ 2.液体样品:需稀释的,无菌称取25mL样品加225mL生理盐水,混匀;稀释倍数:□1:10 □1:100 □1:1000
□ 3.液体样品:不需要稀释的直接吸取样液检验
□菌落总数:检验依据:□GB 4789.2 -2010 □GB/T 5750.12-2006
□总大肠菌群:检验依据:GB/T 5750.12-2006
□耐热大肠菌群:检验依据:GB/T 5750.12-2006
□大肠埃希氏菌:检验依据:GB/T 5750.12-2006
□致病菌□沙门氏菌□志贺氏菌□金黄色葡萄球菌
检测人:复核人:
微生物限度检验记录(复合膜)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:
微生物限度检验记录(铝箔、PVC硬片)
微生物限度检验记录(半成品、成品)
微生物限度检验记录(辅料)。
洁净室监测记录表

洁净室监测报告书申检单位:检测单位:监测区域:洁净车间报告日期:报告编号:监测报告书报告书编号:检测区域名称:洁净室区域面积高度洁净度级别级监测状态静态气流方式非单向气流监测依据YY0033-2000《无菌医疗器具生产质量管理规范》监测日期2012年8月26日报告日期2012年8月26日房间名称房间编号温度(℃)换气次数(次/h)沉降菌(个/皿)静压差(Pa)与非洁净区间相对湿度结果判定生产车间二更1 18.3 79.3 2.5 7.5 53%符合规定消毒缓冲间2 18.6 102 0.5 对同级别二更:3 53%符合规定清洗间 3 18.5 90 0.5 对同级别消毒缓冲间:456%符合规定洁具间 4 18.3 96 2.0 对同级别消毒缓冲间:255%符合规定操作间 5 18.5 36 1.0 对同级别消毒缓冲间:353%符合规定内包间 6 18.4 32.5 3.0 对同级别消毒缓冲间:454%符合规定实验室二更7 18.8 96 3.0 8 52%符合规定洁净走廊8 18.7 53 3.0 对同级别二更:2 53%符合规定阳性对照室9 18.8 55 1.5对同级别洁净走廊:-452%符合规定微生物限度室10 18.7 41 1.5对同级别洁净走廊:254%符合规定无菌室11 18.9 83 1.0 对同级别洁净走廊:353%符合规定结论判定:悬浮粒子均符合规定(报告另附)换气次数均符合规定沉降菌均符合规定温度均符合规定相对湿度均符合规定静压差均符合规定检测人员:XX XX授权人签字:悬浮粒子测定报告报告编号:200901测定状态静态测试日期2012年8月26日测定依据YY0033-2000《无菌医疗器具生产质量管理规范》报告日期2012年8月26日测试人XX 复核人XX 确认人XX房间名称房间编号净化级别(级)检测结果≥5um ≥0.5um判定平均值置信上限平均值置信上限生产车间二更0 52036 符合规定消毒缓冲间 2 3 8973 符合规定清洗间 3 3 0175 符合规定洁具间 4 3 8308 符合规定操作间 5 3 3688 628769 664630 符合规定内包间 6 3 10310 符合规定实验室二更7 3 7370 符合规定洁净走廊8 3 8910 符合规定阳性对照室9 3 9829 符合规定微生物限度室 1 752507 符合规定无菌室 1 0 521325 符合规定标准规定5um粒子,平均值和置信上限均<60000,0.5um粒子,平均值和置信上限均<10500000 结论上述洁净室悬浮粒子测定结果符合GMP对300000级洁净级别要求。
