微生物检验记录表
微生物检验记录

;
28±2℃培养5天;
培养箱型号
;编号:
;
平皿1
10-1CFU/g 10-2CFU/g 10-3CFU/g
报告 10-1CFU/g 10-2CFU/g 10-3CFU/g
报告
平皿2
平均
耐热大肠菌群(不得检出)
金黄色葡萄球菌(不得检出)
检测项目
乳糖胆盐发 酵24h;继续 培养至48小
时
伊红美兰 24h
XX有限公司 微生物检验记录
□原料; □半成品; □半制品; □成品; □新样品;
订单号码
产品编号
ቤተ መጻሕፍቲ ባይዱ
检验日期: 批号
产品名称
生产/进料日期
取样人
检测标准:《化妆品安全技术规范》
细菌总数(应<100 CFU/ml)
霉菌和酵母菌总数(应<10 CFU/ml)
检测项目
36±1℃培养48±2h; 培养箱型号
;编号:
革兰氏 染色镜检
靛基质 试验
报告
菌落特征
溶血圈
革兰氏 染色镜检
血浆凝 固酶试
验
报告
管1
管2
管3
检测项目
菌落特征
铜绿假单胞菌(不得检出)
革兰氏染色镜检
氧化酶试验
绿脓菌素试 验
硝酸盐还原产气试验
明胶液 化 试验
报告
平皿1
平皿2
平皿3 综合判定: □合格; □不合格
审核:
检验:
微生物检验记录表

微生物检验原始记录
培养基配制:见培养基配制记录
样品制备:按GB/T 4789 的要求进行
□ 1.固体样品:无菌称取25g样品加225mL生理盐水,均质;稀释倍数:□1:10 □1:100 □1:1000 □ 2.液体样品:需稀释的,无菌称取25mL样品加225mL生理盐水,混匀;稀释倍数:□1:10 □1:100 □1:1000
□ 3.液体样品:不需要稀释的直接吸取样液检验
□菌落总数:检验依据:□GB 4789.2 -2010 □GB/T 5750.12-2006
检验时间:菌落总数:霉菌和酵母:
□大肠菌群:检验依据:GB/T4789.3-2003
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间:
□总大肠菌群:检验依据:GB/T 5750.12-2006
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间
□致病菌□沙门氏菌□志贺氏菌□金黄色葡萄球菌
□螨:检验依据 GB 317.4-.10-2006
检测人:复核人:
微生物限度检验记录(复合膜)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:
微生物限度检验记录(铝箔、PVC硬片)
检验人:复核人:
微生物限度检验记录(半成品、成品)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:。
微生物限度检验记录表
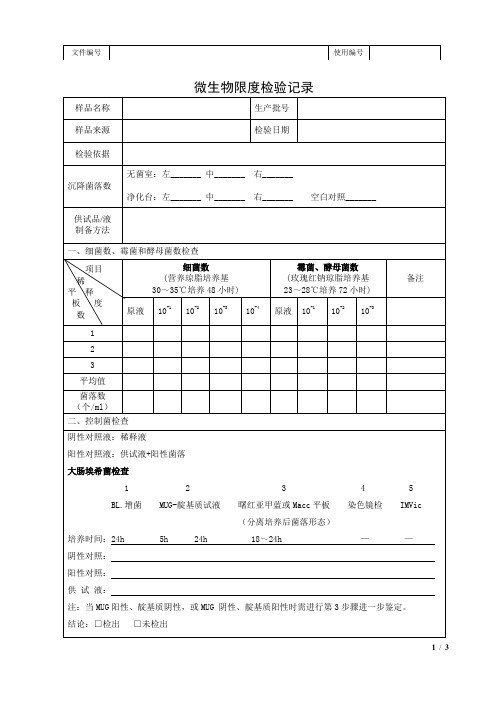
霉菌、酵母菌数
(玫瑰红钠琼脂培养基
23~28℃培养72小时)
备注
原液
10-1
10-2
10-3
10-4
原液
10-1
10-2
10-3
1
2
3
平均值
菌落数
(个/ml)
二、控制菌检查
阴性对照液:稀释液
阳性对照液:供试液+阳性菌落
大肠埃希菌检查
1 2 3 4 5
BL.增菌MUG-靛基质试液曙红亚甲蓝或Macc平板染色镜检IMVic
文件编号
使用编号
微生物限度检验记录
样品名称
生产批号
样品来源
检验日期
检验依据
沉降菌落数
无菌室:左_______中_______右_______
净化台:左_______中_______右_______空白对照_______
供试品/液
制备方法
一、细菌数、霉菌和酵母菌数检查
项目
基
结论:□检出□未检出
结果分析
结论
□(均)符合规定□(均)不符合规定
检验:审核:复核:日期:
阴性对照:
阳性对照:
供试品:
注:当第2步发现有菌落生长且形态与金黄色葡萄球菌疑似时需挑选2~3个菌落,分别接种于营养琼脂培养基斜面上,培养18~24小时,再进行第3步骤进一步鉴定。
结论:□检出□未检出
铜绿假单胞菌检查
1 2 3 4 5
BL增菌溴化十六烷基三甲铵平板革兰氏染色镜检氧化酶试验绿脓菌素试验
培养时间:24h24h———
阴性对照:
阳性对照:
供试品:
注:当第2步发现有菌落生长且形态与铜绿假单胞菌疑似时需挑选2~3个菌落,分别接种于营养琼脂培养基斜面上,培养18~24小时,再进行第3步骤进一步鉴定。
微生物限度检查原始记录表格

[编号]:
检品名称:批号:
检验编码:请检单位:固体车间软胶囊车间
请检日期:年 月 日检验日期:年 月 日
供试液制备:□1常规法 供试品 g (ml) 0.9%氯化钠溶液 ml
□2非水溶性供试品 供试品g(ml)加乳化剂 g(ml )
菌落总数(36℃±1℃,48h±2 h)
开始培养时间月 日 时结束培养时间月 日 时
稀释倍数
10-1
10-2
10-3
阴性对照
1
2
平均
结果
标准规定:
霉菌(28℃±1℃,120h±2h)
开始培养时间月 日 时结束培养时间月 日 时
稀释倍数
10-1
10-2
10-3
阴性对照
1
2
平均
结果
标准规定:
酵母菌(28℃±1℃,120h±2h)
开始培养时间月 日 时结束培养时间月 日 时
稀释倍数
10-1
10-2
10-3
阴性对照
1
2
平均
结果
标准规定:
大肠菌群测定
开始培养时间月 日 时结束培养时间月 时
初发酵(36℃±1℃,24h±2 h)
查(MPN)检
索表结果
大肠菌群总数(MPN/100g)
稀释倍数
10-1
10-2
10-3
阴性对照
1
2
3
结论:□符合规定□不符合规定
检验人: 复核人:
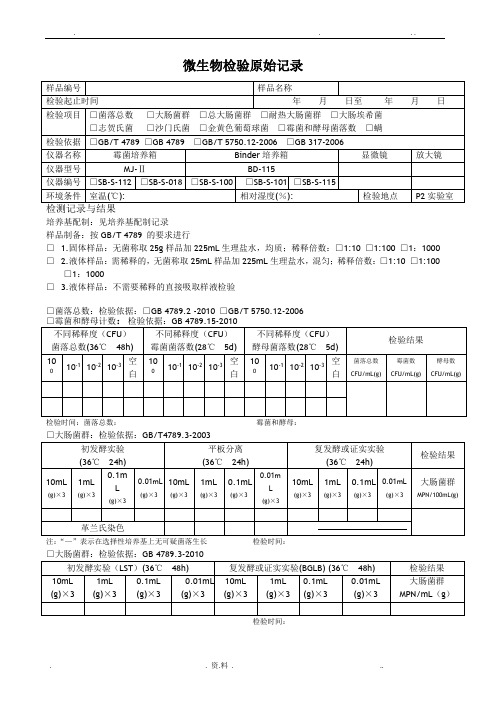
微生物检验记录表
微生物检验原始记录
培养基配制:见培养基配制记录
样品制备:按GB/T 4789 的要求进行
□ 1.固体样品:无菌称取25g样品加225mL生理盐水,均质;稀释倍数:□1:10 □1:100 □1:1000 □ 2.液体样品:需稀释的,无菌称取25mL样品加225mL生理盐水,混匀;稀释倍数:□1:10 □1:100 □1:1000
□ 3.液体样品:不需要稀释的直接吸取样液检验
□菌落总数:检验依据:□GB 4789.2 -2010 □GB/T 5750.12-2006
检验时间:菌落总数:霉菌和酵母:
□大肠菌群:检验依据:GB/T4789.3-2003
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间□致病菌□沙门氏菌□志贺氏菌□金黄色葡萄球菌
□螨:检验依据GB 317.4-.10-2006
检测人:复核人:
微生物限度检验记录(复合膜)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:
微生物限度检验记录(铝箔、PVC硬片)
检验人:复核人:
微生物限度检验记录(半成品、成品)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:。
微生物检验原始记录表
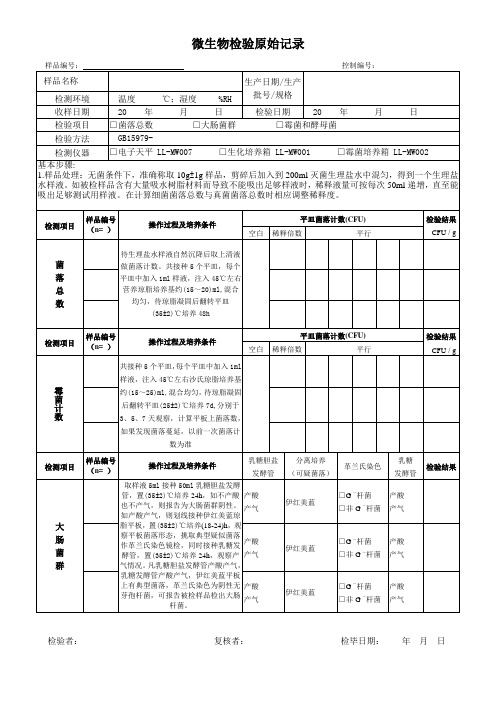
生产日期/生产批号/规格
检测环境
温度 ℃;湿度 %RH
收样日期
20 年 月 日
检验日期
20 年 月 日
检验项目
□菌落总数 □大肠菌群 □霉菌和酵母菌
检验方法
GB15979-
检测仪器
□电子天平LL-MW007□生化培养箱LL-MW001□霉菌培养箱LL-MW002
基本步骤:
1.样品处理:无菌条件下,准确称取10g±1g样品,剪碎后加入到200ml灭菌生理盐水中混匀,得到一个生理盐水样液。如被检样品含有大量吸水树脂材料而导致不能吸出足够样液时,稀释液量可按每次50ml递增,直至能吸出足够测试用样液。在计算细菌菌落总数与真菌菌落总数时相应调整稀释度。
检测项目
样品编号(n=)
操作过程及培养条件乳Fra bibliotek胆盐发酵管
分离培养
(可疑菌落)
革兰氏染色
乳糖
发酵管
检验结果
大
肠
菌
群
取样液5ml接种50ml乳糖胆盐发酵管,置(35±2)℃培养24h,如不产酸也不产气,则报告为大肠菌群阴性。如产酸产气,则划线接种伊红美蓝琼脂平板,置(35±2)℃培养(18-24)h,观察平板菌落形态,挑取典型疑似菌落作革兰氏染色镜检,同时接种乳糖发酵管,置(35±2)℃培养24h,观察产气情况。凡乳糖胆盐发酵管产酸产气,乳糖发酵管产酸产气,伊红美蓝平板上有典型菌落,革兰氏染色为阴性无芽孢杆菌,可报告被检样品检出大肠杆菌。
样品编号(n=)
操作过程及培养条件
平皿菌落计数(CFU)
检验结果
CFU/g
空白
稀释倍数
平行
霉菌计数
共接种5个平皿,每个平皿中加入1ml样液,注入45℃左右沙氏琼脂培养基约(15~25)ml,混合均匀,待琼脂凝固后翻转平皿(25±2)℃培养7d,分别于3、5、7天观察,计算平板上菌落数,如果发现菌落蔓延,以前一次菌落计数为准
微生物检验记录表
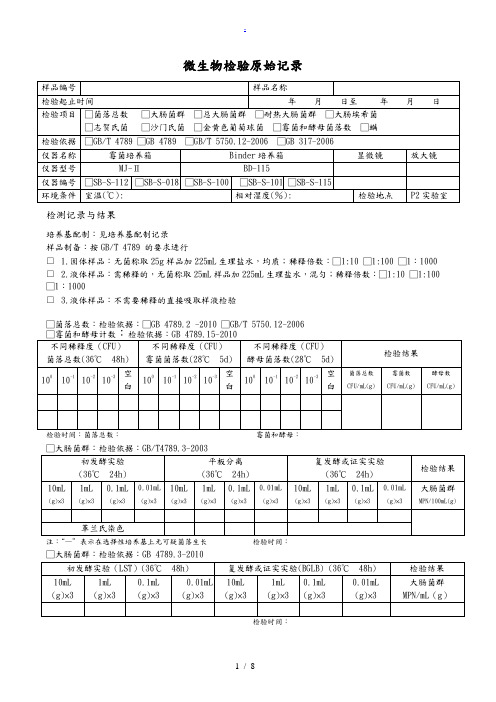
微生物检验原始记录
检测记录与结果
培养基配制:见培养基配制记录
样品制备:按GB/T 4789 的要求进行
□ 1.固体样品:无菌称取25g样品加225mL生理盐水,均质;稀释倍数:□1:10 □1:100 □1:1000 □ 2.液体样品:需稀释的,无菌称取25mL样品加225mL生理盐水,混匀;稀释倍数:□1:10 □1:100 □1:1000
□ 3.液体样品:不需要稀释的直接吸取样液检验
□菌落总数:检验依据:□GB 4789.2 -2010 □GB/T 5750.12-2006
检验时间:菌落总数:霉菌和酵母:
□大肠菌群:检验依据:GB/T4789.3-2003
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间:
□总大肠菌群:检验依据:GB/T 5750.12-2006
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
□耐热大肠菌群:检验依据:GB/T 5750.12-2006
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
□大肠埃希氏菌:检验依据:GB/T 5750.12-2006
检验时间:
□致病菌□沙门氏菌□志贺氏菌□金黄色葡萄球菌
检验依据 GB 317.4-.10-2006
检测人:复核人:
微生物限度检验记录(复合膜)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:
微生物限度检验记录(铝箔、PVC硬片)
微生物限度检验记录(半成品、成品)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:。
微生物检验记录簿表格
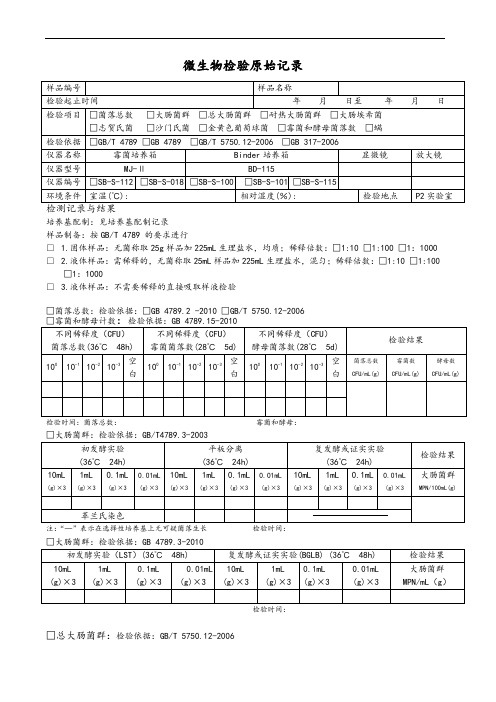
微生物检验原始记录
培养基配制:见培养基配制记录
样品制备:按GB/T 4789 的要求进行
□ 1.固体样品:无菌称取25g样品加225mL生理盐水,均质;稀释倍数:□1:10 □1:100 □1:1000 □ 2.液体样品:需稀释的,无菌称取25mL样品加225mL生理盐水,混匀;稀释倍数:□1:10 □1:100 □1:1000
□ 3.液体样品:不需要稀释的直接吸取样液检验
□菌落总数:检验依据:□GB 4789.2 -2010 □GB/T 5750.12-2006
检验时间:菌落总数:霉菌和酵母:
□大肠菌群:检验依据:GB/T4789.3-2003
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间:
□总大肠菌群:检验依据:GB/T 5750.12-2006
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间
□致病菌□沙门氏菌□志贺氏菌□金黄色葡萄球菌
□螨:检验依据 GB 317.4-.10-2006
检测人:复核人:
微生物限度检验记录(复合膜)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:
微生物限度检验记录(铝箔、PVC硬片)
检验人:复核人:
微生物限度检验记录(半成品、成品)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:。
微生物检验记录表

微生物检验原始记录
检测记录与结果
培养基配制:见培养基配制记录
样品制备:按GB/T 4789的要求进行
□1.固体样品:无菌称取25g样品加225mL生理盐水,均质:稀释倍数:口1:10 01:100 口1: 1000 □2.液体样品:需稀释的,无菌称取25mL样品加225mL生理盐水,混匀:稀释倍数:口1:10 01:100□ 1: 1000
□3.液体样品:不需要稀释的直接吸取样液检验
口大肠菌群:检验依据:GB/T4789. 3-2003
口大肠菌群:检验依据:GB 4789. 3-2010
口总大肠菌群:检验依据:GB/T 5750. 12-2006
口大肠埃希氏菌:检验依据:GB/T 5750. 12-2006
口致病菌口沙门氏菌□志贺氏菌□金黄色葡萄球菌
检验依据:DGB 4789. 4-2010 DGB 4789. 5-2012 OGB 4789. 10-2010
GB 317. 4-. 10-2006
检测人:复核人:
微生物限度检验记录(复合膜)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:
微生物限度检验记录(铝箔、PVC硬片)
检验人:复核人:
微生物限度检验记录(辅料)
微生物限度检验记录(半成品、成品)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:。
微生物限度检查记录表

(18~24h)
RV沙门选择培养
(18~24h)
木糖赖氨酸脱氧胆酸盐分离培养
(18~48h)
三糖铁琼脂斜面穿刺接种
(18~24h)
供试品
阴性对照
阳性对照
结果
□检出沙门菌□未检出沙门菌(规定:不得检出/10g)
五、耐胆盐革兰阴性菌检查
胰酪大豆胨液体培养基(配制批号:)、肠道菌增菌液体培养基(配置批号:)、紫红胆盐葡萄糖琼脂培养基(配置批号:)
2天
3天
4天
5天
6天
7天
均值
结果
cfu/gml(规定:≦8000cfu/gml)
cfu/gml(规定:≦80cfu/gml)
三、大肠埃希菌检查
胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配置批号:)、麦康凯琼脂培养基(配置批号:)
胰酪大豆胨液体培养基增菌培养
(30~35℃,18~24h)
麦康凯液体培养基选择培养
微生物限度检查记录(通用)
样品名称
检验编号
批号
规格
检品来源
数量
检验依据
消毒时间
紫外:
检验日期
完成日期
供
试
液
制
备
1.常规法:取供试品10gml,用胰酪大豆胨琼脂培养基稀释至100ml,用匀浆仪等适宜的方法混匀,制成1:10供试液。
2.薄膜过滤法:取本品用开口面积为20cm2的灭过菌的金属模板压在内层面上,将无菌棉签用pH7.0无菌氯化钠-蛋白胨缓冲液稍沾湿,在板孔范围内擦抹5次,换1支棉签再擦抹5次,每个位置用2支棉签共擦抹10次,共擦抹5个位置,擦拭总面积为100cm2。每支棉签擦抹完后立即用灭菌剪刀将棉签头剪断,将剪下的棉签头投入盛有30mlpH7.0无菌氯化钠-蛋白胨缓冲液的灭菌广口瓶(或大试管)中。全部擦抹棉签投入瓶中后,振摇1分钟,静置10分钟,即得供试液。
微生物检验记录表Word版

微生物检验原始记录
培养基配制:见培养基配制记录
样品制备:按GB/T 4789 的要求进行
□ 1.固体样品:无菌称取25g样品加225mL生理盐水,均质;稀释倍数:□1:10 □1:100 □1:1000 □ 2.液体样品:需稀释的,无菌称取25mL样品加225mL生理盐水,混匀;稀释倍数:□1:10 □1:100 □1:1000
□ 3.液体样品:不需要稀释的直接吸取样液检验
□菌落总数:检验依据:□GB 4789.2 -2010 □GB/T 5750.12-2006
检验时间:菌落总数:霉菌和酵母:
□大肠菌群:检验依据:GB/T4789.3-2003
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间:
□总大肠菌群:检验依据:GB/T 5750.12-2006
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间
□致病菌□沙门氏菌□志贺氏菌□金黄色葡萄球菌
□螨:检验依据 GB 317.4-.10-2006
检测人:复核人:
微生物限度检验记录(复合膜)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:
微生物限度检验记录(铝箔、PVC硬片)
检验人:复核人:
微生物限度检验记录(半成品、成品)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:。
食品企业微生物检验原始记录表

7.5氯化钠肉汤:
鉴别
分离
B-P平板:
血平板:
B-P平板:
血平板:
B-P平板:
血平板:
B-P平板:
血平板:
B-P平板:
血平板:
确证
试验
染色镜检:
血浆凝固酶:
染色镜检:
血浆凝固酶:
染色镜检:
血浆凝固酶:
染色镜检:
血浆凝固酶:
染色镜检:
血浆凝固酶:
原始检验记录人:
自凝性:
菌体抗原(O)鉴定:
鞭毛抗原(H)鉴定:
自凝性:
菌体抗原(O)鉴定:
鞭毛抗原(H)鉴定:
自凝性:
菌体抗原(O)鉴定:
鞭毛抗原(H)鉴定:
金黄色
葡
萄
球
菌cfu/g
增菌
胰胨大豆肉汤:
7.5氯化钠肉汤:
胰胨大豆肉汤:
7.5氯化钠肉汤:
胰胨大豆肉汤:
7.5氯化钠肉汤:
胰胨大豆肉汤:
7.5氯化钠肉汤:
包装完好、干净,符合香港食环署供港要求。
符合要求()
色泽
具有产品应有的色泽。
符合要求()
滋味、气味
具有产品应有的滋味和气味,无异味。
符合要求()
状态
具有产品庆有的状态,无正常视力可见外来异物。
符合要求()
菌
落
总
数cfu/g
取样
数量
样品1
样品2
样品3
样品4
样品5
稀释度
10-1
10-2
10-1
10-2
10-1
10-2
10-1
10-2
10-1
微生物检验记录表
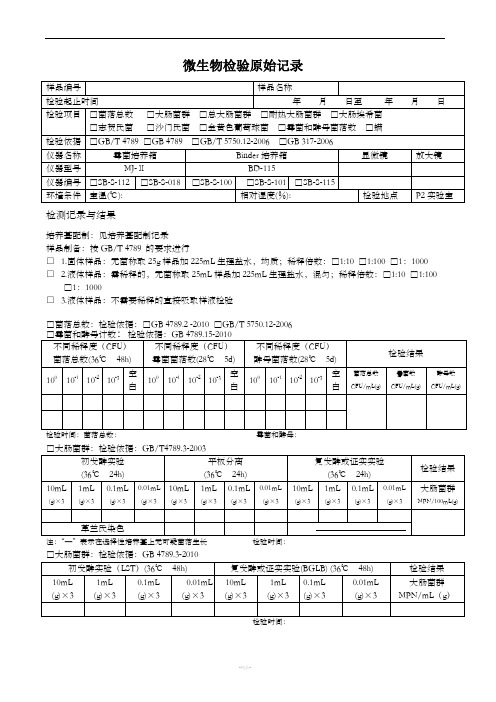
微生物检验原始记录
检测记录与结果
培养基配制:见培养基配制记录
样品制备:按GB/T 4789 的要求进行
□ 1.固体样品:无菌称取25g样品加225mL生理盐水,均质;稀释倍数:□1:10 □1:100 □1:1000
□ 2.液体样品:需稀释的,无菌称取25mL样品加225mL生理盐水,混匀;稀释倍数:□1:10 □1:100 □1:1000
□ 3.液体样品:不需要稀释的直接吸取样液检验
□菌落总数:检验依据:□GB 4789.2 -2010 □GB/T 5750.12-2006
□总大肠菌群:检验依据:GB/T 5750.12-2006
□耐热大肠菌群:检验依据:GB/T 5750.12-2006
□大肠埃希氏菌:检验依据:GB/T 5750.12-2006
□致病菌□沙门氏菌□志贺氏菌□金黄色葡萄球菌
检测人:复核人:
微生物限度检验记录(复合膜)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:
微生物限度检验记录(铝箔、PVC硬片)
微生物限度检验记录(半成品、成品)
微生物限度检验记录(辅料)。
微生物检测记录表

平皿号 平皿 1 平皿 2 平皿 3 平皿 4 平皿 5 平均数 结果数 检验结果判定应≤100cfu/g
7 真菌菌落检测
细菌菌落总数
沙氏琼脂培养基批号:
恒温培养箱编号:
设备校准状态:
琼脂凝固后翻转平皿置 25℃±2℃培养 7 天,分别于 3、5、7 天观察,计算平板上菌落数,如果发现菌落 蔓延,以前一次的菌落计数为准。
板 35℃±2℃,培养 24h
5 结果报告:报告结果为阴性结果填写“未检出”,结果未阳性填写“阳性”,检验结果均为“未检出”判定
合格
大肠菌群
绿脓杆菌
金黄色葡球菌
溶血性链球菌
A/0
6 细菌菌落检测
营养琼脂培养基批号:
恒温培养箱编号:
设备校准状态:
待琼脂凝固后翻转平皿置 35℃。培养成 48 小时后,计算平板上的菌落数。
SCDLP 培养基批号: 血琼脂批号:
恒温培养箱编号:
设备校准状态:
SCDLP 培养基 35℃±2℃, 培 养 24h ,血 琼脂 平 板 35℃±2℃,培养 24h 4 溶血性链球菌
葡萄肉汤培养基批号: 血琼脂批号:
恒温培养箱编号:
设备校准状态:
葡萄肉汤培养基 35℃±
2℃,培养 24h,血琼脂平
样品品名称 生产批号 检验依据
1 大肠菌群 乳糖胆盐发酵培养基批号: 35℃±2℃,培养 24h
微生物检测记录表
型号规格 取样数量 报告日期
恒温培养箱编号:
设备校准状态:
2 绿脓杆菌
SCDLP 培养基批号:
恒温培养箱编号:
十六烷三甲基溴化铵琼脂批号:
设备校准状态:
SCDLP 培养基 35℃±2℃, 培养 24h,十六烷三甲基 溴化铵琼脂 35℃±2℃, 培养 24h 3 金黄色葡萄球菌
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
微生物检验原始记录
培养基配制:见培养基配制记录
样品制备:按GB/T 4789 的要求进行
□ 1.固体样品:无菌称取25g样品加225mL生理盐水,均质;稀释倍数:□1:10 □1:100 □1:1000 □ 2.液体样品:需稀释的,无菌称取25mL样品加225mL生理盐水,混匀;稀释倍数:□1:10 □1:100 □1:1000
□ 3.液体样品:不需要稀释的直接吸取样液检验
□菌落总数:检验依据:□GB 4789.2 -2010 □GB/T 5750.12-2006
检验时间:菌落总数:霉菌和酵母:
□大肠菌群:检验依据:GB/T4789.3-2003
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间:
□总大肠菌群:检验依据:GB/T 5750.12-2006
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间
□致病菌□沙门氏菌□志贺氏菌□金黄色葡萄球菌
□螨:检验依据 GB 317.4-.10-2006
检测人:复核人:
微生物限度检验记录(复合膜)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:
微生物限度检验记录(铝箔、PVC硬片)
检验人:复核人:
微生物限度检验记录(半成品、成品)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:。
