微生物限度检查原始记录表
微生物检验记录表
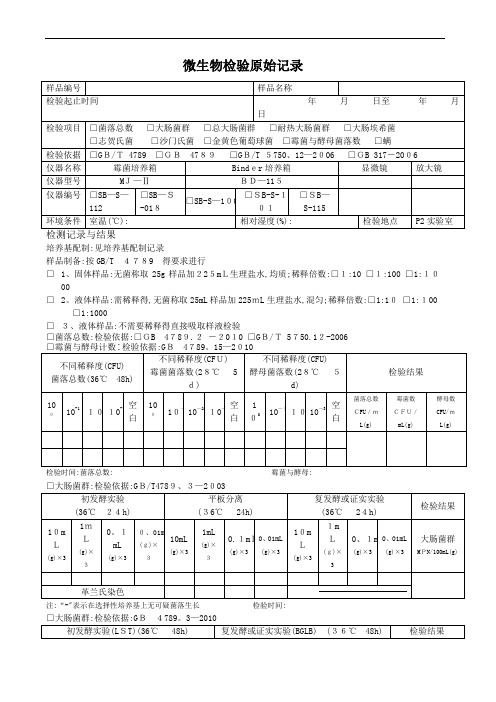
微生物检验原始记录
培养基配制:见培养基配制记录
样品制备:按GB/T 4789 得要求进行
□1、固体样品:无菌称取25g样品加225mL生理盐水,均质;稀释倍数:□1:10 □1:100 □1:10
00
□2。
液体样品:需稀释得,无菌称取25mL样品加225mL生理盐水,混匀;稀释倍数:□1:10□1:100 □1:1000
□3、液体样品:不需要稀释得直接吸取样液检验
□菌落总数:检验依据:□GB 4789.2-2010 □GB/T 5750.12-2006
检验时间:菌落总数: 霉菌与酵母:
注:“-"表示在选择性培养基上无可疑菌落生长检验时间:
检验时间:
注:“-”表示在选择性培养基上无可疑菌落生长检验时间:
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间□致病菌□沙门氏菌□志贺氏菌□金黄色葡萄球菌
□螨: 检验依据GB 317、4-、10-2006
ﻬ微生物限度检验记录(复合膜)
检验人: 复核人:
微生物限度检验记录(辅料)
检验人: 复核人:
微生物限度检验记录(铝箔、PVC硬片)
检验人: 复核人:
ﻬ微生物限度检验记录(半成品、成品)
检验人: 复核人:
ﻬ微生物限度检验记录(辅料)
检验人: 复核人:。
微生物限度检查原始记录

室温:℃湿度:%
供试液制备:
生产工具用无菌脱脂棉球蘸无菌生理盐水溶液,反复刷洗设备表面10 cm2,然后将带菌脱脂棉放入100 mL无菌生理盐水中,进行充分洗涤,即制成1:10含菌样液。
细菌总数:常规法30~35℃培养3天
大肠菌群检查:常规法30~35℃培养
结果判定:
本品按照《中国药典》2010年版二部附录XI J检验,结论为:□合格□不合格
复核人:检验人:
室温:℃湿度:%
供试液制备:
用无菌镊子取无菌脱脂棉签蘸无菌生理盐水溶液,反复刷洗人员手部和衣服表面10 cm2,然后将带菌脱脂棉放入100 mL无菌生理盐水中,进行充分洗涤,即制成含菌样液。
细菌总数:常规法30~35℃培养3天
大肠菌群检查:常规法30~35 ℃培养
结果判定:
本品按照《中国药典》2010年版二部附录XI J检验,结论为:□合格□不合格复核人:检验人:。
微生物检验原始记录范本
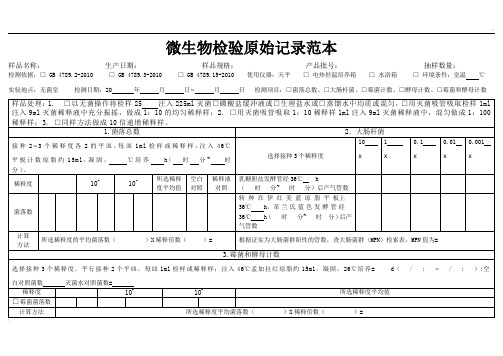
样品名称:生产日期:样品规格:产品批号:抽样数量:
检测依据:□ GB4789.2-2010□GB 4789.3-2010□GB 4789.15-2010使用仪器:天平□ 电热恒温培养箱 □ 水浴箱 □ 环境条件:室温℃
实验地点:无菌室检测日期:20年月日~月日检测项目:□菌落总数、□大肠杆菌、□霉菌计数、□酵母计数、□霉菌和酵母计数
菌落数
转 种 在 伊 红 美 蓝 琼 脂 平 板上36℃h,革兰氏蓝色发酵管经36℃h(时分~时 分)后产气管数
计算 方法
所选稀释度的平均菌落数( )X稀释倍数( )=
根据证实为大肠菌群阳性的管数,查大肠菌群(MPN)检索表,MPN值为=
3.霉菌和酵母计数
选择接种3个稀释度,平行接种2个平皿,每皿1ml检样或稀释样;注入46℃孟加拉红琼脂约15ml,凝固,26℃培养=d( / :~/ : );空白对照菌数灭菌水对照菌数=
1.菌落总数
2.大肠杆菌
接种2~3个稀释度各2的平皿,每皿1ml检样或稀释样,注入46℃平板计数琼脂约15ml,凝固,℃培养h(时分~时分)。
选择接种3个稀释度
10
x
1
x
0.1x
0.01x
0.001x
稀释度
ห้องสมุดไป่ตู้10-
10-
所选稀释度平均值
空白对照
稀释液对照
乳糖胆盐发酵管经36℃h
(时 分~时分)后产气管数
样品处理:1.□以无菌操作将检样25注入225ml灭菌□磷酸盐缓冲液或□生理盐水或□蒸馏水中均质或混匀,□用灭菌吸管吸取检样1ml注入9ml灭菌稀释液中充分振摇,做成1:10的均匀稀释样;2. □用灭菌吸管吸取1:10稀释样1ml注入9ml灭菌稀释液中,混匀做成1:100稀释样;3. □同样方法做成10倍递增稀释样。
微生物原始记录表填写

微生物原始记录表填写
微生物原始记录表是用来记录微生物培养实验过程中所观察到的各项
指标数据的一种表格形式。
下面是一个示范的微生物原始记录表,包括了
实验的基本信息以及观察到的各项指标数据。
请注意,根据实际情况,可
以根据需要添加或修改记录表的字段。
实验名称:微生物培养实验
实验日期:2024年1月1日
序号培养基组分(g/L)pH值温度(℃)培养时间(h)观察时间(h)观察指标A观察指标B观察指标C
1107.03724000
2107.0372411015
3107.0372421525
4107.0372432030
5107.0372442535
【说明】
1.序号:按照培养时间的顺序进行编号,方便对实验结果进行分析和
比较。
2.培养基组分:记录培养基的成分,以便后续对不同成分的培养基进
行比较。
3.pH值:记录培养基的酸碱性。
4.温度:记录培养的温度条件。
5.培养时间:记录培养的总时间,单位为小时。
6.观察时间:记录每次观察的时间点,以小时为单位。
7.观察指标A/B/C:根据实验需要,可以添加相应的观察指标,例如微生物生长曲线中的菌落数、菌液的浊度、菌液的酸碱度等等。
以上示范的记录表仅仅是一个参考样例,具体的填写内容和形式取决于实验的目的和方法。
实际操作中,可以根据具体的实验内容进行添加或修改。
在填写微生物原始记录表时应注意实验的准确性和可重复性,记录下实验过程中的每一个重要环节和观察结果,以便后续对实验结果进行分析和验证。
微生物限度检查记录 版

表:微生物限度检查记录(通用)三、大肠埃希菌检查胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)微生物限度检查记录(30~35℃,3~5天)20℃~25℃,5~7天)沙氏葡萄糖琼脂培养基(配制批号:)三、控制菌检查(30-35℃)表:胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)(30℃~35℃)胰酪大豆胨液体培养基(配制批号:)、RV沙门增菌液体培养基(配制批号:),木糖赖氨酸脱氧胆酸盐琼脂培养基(配制批号:)、三糖铁琼脂(配制批号:)五、耐胆盐革兰阴性菌检查胰酪大豆胨液体培养基(配制批号:)、肠道菌增菌液体培养基(配制批号:),紫红胆盐葡萄糖琼脂培养基(配制批号:)表:(含药材原粉的片剂)胰酪大豆胨液体培养基(配制批号: )、麦康凯液体培养基(配制批号: )麦康凯琼脂培养基(配制批号: )(30℃~35℃)胰酪大豆胨液体培养基(配制批号: )、RV 沙门增菌液体培养基(配制批号: ),木糖赖氨酸脱氧胆酸盐琼脂培养基(配制批号: )、三糖铁琼脂(配制批号: )五、耐胆盐革兰阴性菌检查胰酪大豆胨液体培养基(配制批号: )、肠道菌增菌液体培养基(配制批号: ),紫红胆盐葡萄糖琼脂培养基(配制批号: )表:微生物限度检查记录(蛇胆川贝液)三、大肠埃希菌检查胰酪大豆胨液体培养基(配制批号:)、RV沙门增菌液体培养基(配制批号:),木糖赖氨酸脱氧胆酸盐琼脂培养基(配制批号:)、三糖铁琼脂(配制批号:)表:微生物限度检查记录(30~35℃,3~5天)20℃~25℃,5~7天)沙氏葡萄糖琼脂培养基(配制批号:)胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)表:微生物限度检查记录(内包材)三、大肠埃希菌检查胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)。
微生物检验原始记录
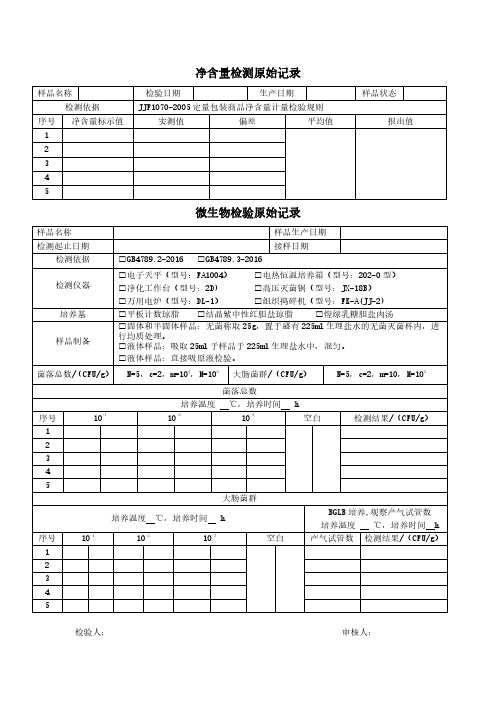
净含量检测原始记录
样品名称检验日期生产日期样品状态检测依据JJF1070-2005定量包装商品净含量计量检验规则
序号净含量标示值实测值偏差平均值报出值1
2
3
4
5
微生物检验原始记录
样品名称样品生产日期
检测起止日期接样日期
检测依据□GB4789.2-2016□GB4789.3-2016
检测仪器□电子天平(型号:FA1004)□电热恒温培养箱(型号:202-0型)□净化工作台(型号:2D)□高压灭菌锅(型号:JX-18B)
□万用电炉(型号:DL-1)□组织捣碎机(型号:FK-A(JJ-2)
培养基□平板计数琼脂□结晶紫中性红胆盐琼脂□煌绿乳糖胆盐肉汤
样品制备□固体和半固体样品:无菌称取25g,置于盛有225ml生理盐水的无菌灭菌杯内,进行均质处理。
□液体样品:吸取25ml于样品于225ml生理盐水中,混匀。
□液体样品:直接吸原液检验。
菌落总数/(CFU/g)N=5,c=2,m=104,M=105大肠菌群/(CFU/g)N=5,c=2,m=10,M=102
菌落总数
培养温度℃,培养时间h
序号10-110-210-3空白检测结果/(CFU/g)1
2
3
4
5
大肠菌群
培养温度℃,培养时间h
BGLB培养,观察产气试管数培养温度℃,培养时间h
序号10-110-210-3空白产气试管数检测结果/(CFU/g)1
2
3
4
5
检验人:审核人:。
微生物检测原始记录表(无菌检查)

标准菌种名称及编号
代数 菌液浓度(CFU/mL)
标准菌种名称及编号
代数
菌液浓度(CFU/mL)
培养基性能检查
方法适用性试验
供试品无菌检查
金黄色葡萄球菌 ATCC6538
3
□大肠埃希氏菌
培养周期(天)
1
FT ( 33℃ )
金黄色葡萄球菌
-
1
2
-
无菌试验用真菌培 养基( 23℃)
白色念珠菌 1 -
2
-
无菌试验用真菌培养基(白色念珠菌+ 供试品)
+
+
+
+
+
/
/
生长良好
无菌试验用真菌培养基(
)
/
/
/
无菌试验用真菌培养基(
)
/
/
/
FT(
*** )
--------------
/
/
无菌生长
FT (金黄色葡萄球菌+供试品)
+++++
/
/
生长良好
FT (
)
/
/
/
FT (
)
/
/
/阴性对照组ຫໍສະໝຸດ 果:阴性阳性对照组结果:阳性
受控编号: 检验日期
委托单编号 检测项目
培养基试剂批号 仪器及编号 样品前处理
测试菌种
测试项目
培养基性能检验
培养基无菌检查 阴性对照组
(0.85%无菌生理盐 水)
阳性对照组 (金黄色葡萄球菌)
供试品组
测试成立判断条件 中和剂配方 备注
微生物检测原始记录表(无菌检查)
微生物检验记录簿表格
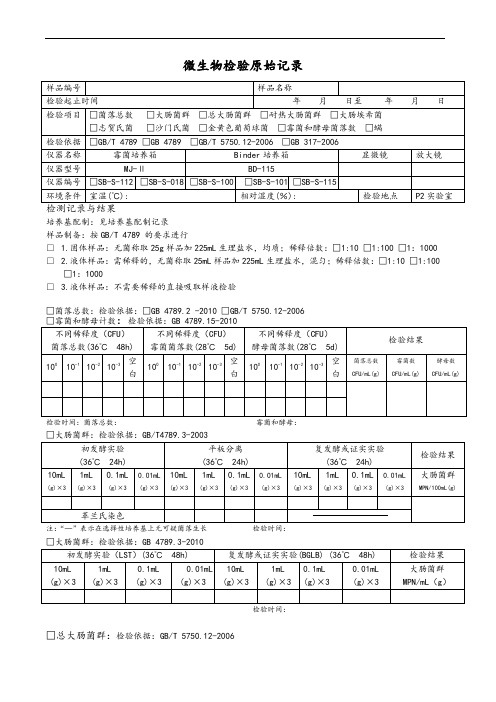
微生物检验原始记录
培养基配制:见培养基配制记录
样品制备:按GB/T 4789 的要求进行
□ 1.固体样品:无菌称取25g样品加225mL生理盐水,均质;稀释倍数:□1:10 □1:100 □1:1000 □ 2.液体样品:需稀释的,无菌称取25mL样品加225mL生理盐水,混匀;稀释倍数:□1:10 □1:100 □1:1000
□ 3.液体样品:不需要稀释的直接吸取样液检验
□菌落总数:检验依据:□GB 4789.2 -2010 □GB/T 5750.12-2006
检验时间:菌落总数:霉菌和酵母:
□大肠菌群:检验依据:GB/T4789.3-2003
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间:
□总大肠菌群:检验依据:GB/T 5750.12-2006
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间
□致病菌□沙门氏菌□志贺氏菌□金黄色葡萄球菌
□螨:检验依据 GB 317.4-.10-2006
检测人:复核人:
微生物限度检验记录(复合膜)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:
微生物限度检验记录(铝箔、PVC硬片)
检验人:复核人:
微生物限度检验记录(半成品、成品)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:。
微生物限度检查记录表

(18~24h)
RV沙门选择培养
(18~24h)
木糖赖氨酸脱氧胆酸盐分离培养
(18~48h)
三糖铁琼脂斜面穿刺接种
(18~24h)
供试品
阴性对照
阳性对照
结果
□检出沙门菌□未检出沙门菌(规定:不得检出/10g)
五、耐胆盐革兰阴性菌检查
胰酪大豆胨液体培养基(配制批号:)、肠道菌增菌液体培养基(配置批号:)、紫红胆盐葡萄糖琼脂培养基(配置批号:)
2天
3天
4天
5天
6天
7天
均值
结果
cfu/gml(规定:≦8000cfu/gml)
cfu/gml(规定:≦80cfu/gml)
三、大肠埃希菌检查
胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配置批号:)、麦康凯琼脂培养基(配置批号:)
胰酪大豆胨液体培养基增菌培养
(30~35℃,18~24h)
麦康凯液体培养基选择培养
微生物限度检查记录(通用)
样品名称
检验编号
批号
规格
检品来源
数量
检验依据
消毒时间
紫外:
检验日期
完成日期
供
试
液
制
备
1.常规法:取供试品10gml,用胰酪大豆胨琼脂培养基稀释至100ml,用匀浆仪等适宜的方法混匀,制成1:10供试液。
2.薄膜过滤法:取本品用开口面积为20cm2的灭过菌的金属模板压在内层面上,将无菌棉签用pH7.0无菌氯化钠-蛋白胨缓冲液稍沾湿,在板孔范围内擦抹5次,换1支棉签再擦抹5次,每个位置用2支棉签共擦抹10次,共擦抹5个位置,擦拭总面积为100cm2。每支棉签擦抹完后立即用灭菌剪刀将棉签头剪断,将剪下的棉签头投入盛有30mlpH7.0无菌氯化钠-蛋白胨缓冲液的灭菌广口瓶(或大试管)中。全部擦抹棉签投入瓶中后,振摇1分钟,静置10分钟,即得供试液。
微生物限度测定原始记录表(平皿倾注法)
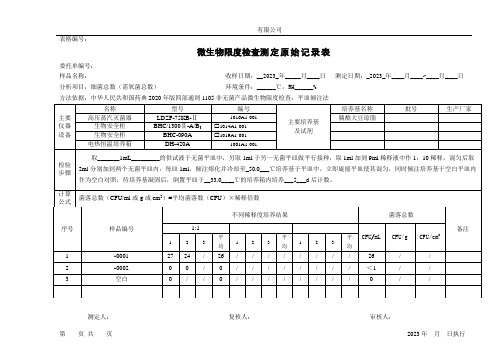
主要 仪器 设备
名称 高压蒸汽灭菌器
生物安全柜 生物安全柜 电热恒温培养箱
型号 LDZF-75KB-Ⅱ BHC/1300Ⅱ-A/B3
BHC-090A DH-420A
编号
1016A1-001
1014A1-001 1019A1-001
1001A1-001
主要培养基 及试剂
培养基名称 胰酪大豆琼脂
批号
生产厂家
计算 公式
菌落总数(CFU/ml 或 g 或 cm2)=平均菌落数(CFU)×稀释倍数
不同稀释度培养结果
菌落总数
序号
1 2 3
样品编号
-0001 -0002 空白
1:1
平
平
平 CFU/mL CFU/g CFU/cm2
1
2
3
均
1
2
3
均
1
2
3
均
27 24 / 26 / / / / / / / /
26
/
/
检验 步骤
取_______1mL_________的供试液于无菌平皿中,另取 1ml 于另一无菌平皿做平行接种,取 1ml 加到 9ml 稀释液中作 1:10 稀释,混匀后取 2ml 分别加到两个无菌平皿内,每皿 1ml,倾注熔化并冷却至_50.0___℃培养基于平皿中,立即旋摇平皿使其混匀,同时倾注培养基于空白平皿内 作为空白对照,待培养基凝固后,倒置平皿于__33.0____℃的培养箱内培养___5___d 后计数。
表格编号:
×××有限公司
微生物限度检查测 定 原 始 记 录 表
委托单编号:
样品名称:
收样日期:__2023_年_____月____日 测定日期:_2023_年____月____~____月____日
微生物限度检查原始记录表格

稀释倍数
10-1
10-2
-3
阴性对照
1
2
平均
结果
标准规定:
霉菌(28℃±1℃,120h±2h)
开始培养时间月 日 时结束培养时间月 日 时
稀释倍数
10-1
10-2
10-3
阴性对照
1
2
平均
结果
标准规定:
酵母菌(28℃±1℃,120h±2h)
开始培养时间月 日 时结束培养时间月 日 时
稀释倍数
10-1
10-2
10-3
阴性对照
1
2
平均
结果
标准规定:
大肠菌群测定
开始培养时间月 日 时结束培养时间月 日 时
初发酵(36℃±1℃,24h±2 h)
查(MPN)检
索表结果
大肠菌群总数(MPN/100g)
稀释倍数
10-1
10-2
10-3
阴性对照
1
2
3
结论:□符合规定□不符合规定
检验人: 复核人:
微 生 物 限 度 检 查 原 始 记 录
[编号]:
检品名称:批号:
检验编码:请检单位:固体车间软胶囊车间
请检日期:年 月 日检验日期:年 月 日
供试液制备:□1常规法 供试品 g (ml) 0.9%氯化钠溶液 ml
□2非水溶性供试品 供试品g(ml)加乳化剂 g(ml )
菌落总数(36℃±1℃,48h±2 h)
28微生物限度检测原始记录
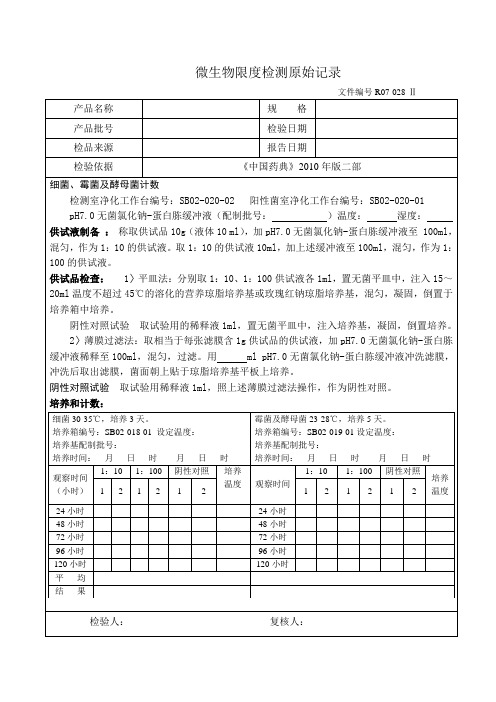
检验人:复核人:
微生物限度检测原始记录
文件编号R07-028-Ⅱ
产品名称
规格
产品批号
检验日期
试验方法
培养箱编号
培养温度
培养
时间
结果
供试品
培养
温度
观察时间
1:10
1:100
阴性对照
培养
温度
1
2
1
2
1
2
1
2
1
2
1
2
24小时
24小时
48小时
48小时
72小时
72小时
96小时
96小时
120小时
120小时
平均
结果
检验人:复核人:
微生物限度检测原始记录
文件编号R07-028-Ⅱ
产品名称
规格
产品批号
检验日期
控制菌检查:大肠埃希菌
大肠埃希菌批号:营养肉汤培养基配制批号:
阳性对照试验阳性对照试验方法同供试品的检查,对照菌加菌量为10-100cfu。
阴性对照试验取稀释液10ml照控制菌检查法检查。
试验方法
培养箱编号
培养温度
培养时间
结果
供试品
阳性对照
阴性对照
营养肉汤
编号:SB02-018-01
TTB
编号:SB02-018-01
DHL
编号:SB02-018-01
MacC
编号:SB02-018-01
细菌30-35℃,培养3天。
微生物限度检查记录表格

10^
10-4
阴性对照
10-1
10-2
阴性对照
1
2
平均
结果
cfu/g(规定:wcfu/g)
cfu/g(规定:wcfu/g)
大肠埃希菌检杳口培养条件:30〜35C18〜24h
胆盐乳糖培养基
(批号:)
MUG培养基
(批号:)
靛基质
(批号:)
EMB培养基
(批号:)
镜检、 生化试验
5h
24h
5h
24h
供试品
阴性对照
阳性对照
结果
□检出大肠埃希菌□未检出大肠埃希菌(规定:不得检出)
大肠菌群检查口培养条件:30〜35C
乳糖胆盐发酵培养基(18〜
24h)
EMB培养基(18〜24h)
(批号:)
乳糖发酵培养基(24〜
48h)
供
试
品
10-1
10-2
10-3
阴性对照
阳性对照
结果
个/g(规定:v个/
活螨检杳□
检杳方法
□直接法
□漂浮法□分离法
结果
□检出活螨
□未检出活螨
(规定不得检出)
结论
□符合规定
□不符合规定
(2
供试液制备
取供试品g,加入pH7.0无菌氯化钠-蛋白胨缓冲液至ml,混匀。
□研钵法□振摇法
细困、霉困和酵母困计数口
平皿
号
细菌数(30〜35°C3天)
营养琼脂培养基(批号:)
霉菌和酵母菌数(23〜28C5天) 玫瑰红钠琼脂培养基(批号:)
24h
供试品
阴性对照
阳性对照
结果
微生物检测原始记录

菌落总数与大肠菌群检验原始记录
主检:年月日校核:年月日
菌落总数和大肠菌群检测原始记录
主检:年月日校核:年月日
水质微生物检验原始记录
主检:年月日校核:年月日
乳酸菌与大肠菌群检测记录
主检:年月日校核:年月日
致病菌检验原始记录
主检:年月日校核:年月日
XXXX检测有限公司
霉菌和酵母菌检验原始记录
菌落计数:
培养温度:28±1℃培养时间:年月日时--- 年月日时
主检:年月日校核:年月日
XXXX检测有限公司
商业无菌检验原始记录
共页第页
主检:日期:校核:日期:。
