大肠菌群_菌落总数检验报告原始记录
大肠菌群_菌落总数检验报告原始记录

微生物实验原始记录
粤珍小厨餐饮管理有限公司
编号:
放入时培养
℃样品名称样品编号
箱温度
取出时培养
设备名称电热恒温培养箱(±1℃)设备编号DHP-9082
℃
箱温度
检验依据GB/T4789.2-2010 GB/T4789.3-2010样品状态
一、菌落总数(cfu/g)
以无菌操作将检样25g于225ml灭菌生理盐水中,均质后充分振摇做成1:10的均匀稀释
液。
取1ml灭菌吸管吸取上述稀释液1ml,加入9ml灭菌生理盐水中,混合均匀,做成1:100
的稀释液,按上述方法操作,做10倍递增稀释。
每个稀释度吸取1ml于灭菌培养皿内,注入凉至46℃的营养琼脂15ml,混匀。
待营养琼
脂凝固后,翻转平板于36℃培养48h。
同时做空白对照。
样品匀液
10-110-210-3(10-i)
观察结果(C)
计算结果N
报告结果
CFU/g
主检:审核:检验日期:年月日
邹平县产品质量监督检验所检验原始记录
共页第页
主检:校核:检验日期:年月日
邹平县产品质量监督检验所检验原始记录
共页第页
主检:校核:检验日期:年月日
如有侵权请联系告知删除,感谢你们的配合!。
大肠菌群测定原始记录

时间:检验地点:本厂化验室
检测样品名称:来源:
生理盐水的配制:8.5g氯化钠加1000ml蒸馏水溶解待用。
1.取225ml生理盐水于标签为1:10的300ml锥形瓶中,
取9ml生理盐水于标签为1:100的50ml锥形瓶中。
2.LST溶液的配制:取LST7.1g加水100ml(双料),溶解至透明,
取1:100的稀释样1ml于标有0.01g的3只试Байду номын сангаас中,
5.培养:放入36℃的培养箱中培养48h。时间起始:
24h产气管数:
48h产气管数:
6.BGLB溶液复发酵试验:配制BGLB溶液,称取BGLB4g溶液100ml水中,均分倒入对应产气标号的标有标示并放有聚气管的试管中,放入灭菌锅灭菌15min。用接种针粘一环产气管液于标有对应的以灭菌的BGLB溶液的试管中,于36℃的培养箱中培养48h。
倒入10ml于3只标有1g的并放有聚气管的试管中;剩余溶液加一倍水配成单料倒入标有0.01g,0.001ml的6只试管中,每只10ml,并放有聚气管(试管要求180×18mm)。
放入灭菌锅灭菌15min.
以上1;2;同时一起灭菌,灭菌起始时间(喷气开始计时):
压力表指针回零后打开放气阀,开盖取出,冷至常温。
培养起始时间:
48h产气管数:
7.检索MPN表结论:
备注:
3.样品稀释:于225ml灭菌的生理盐水中加入样品25g,混匀,配成1:10的稀释样;
从1:10的稀释样中取1ml到入标有1:100的9ml灭菌的生理盐水中混匀,配成1:100稀释样;
4.初发酵试验:取1:10的稀释样10ml于标有1g的3只试管中,
取1:10的稀释样1ml于标有0.1g的3只试管中,
大肠菌群原始记录

样品编号
LST肉汤初发酵试验培养温度℃,培养开始时间年月日点分,培养结束时间年月日点分。
用接种环从产气的LST肉汤管中分别取培养物1环,接种于煌绿乳糖胆盐肉汤(BGLB)管中,培养观察。
样
品
编
号
BGLB肉汤复发酵试验
培养温度℃,培养开始时间年月日点分,培养结束时间年月日点分。
结果报告
MPN/mL
备注:+:阳性-:阴性
绥芬河出入境检验检疫局综合技术中心密山实验室
ZJ-03-107大肠菌群检验原始记录
样品名称:样品号:
检验日期:验讫日期:标准物质Biblioteka 号检验依据设备编号
大肠菌群计数
第一法大肠菌群MPN计数法:取检样25g(ml)+225ml,用均质器均质1min,制成1:10的样品匀液。按10倍递增稀释,选取6个适宜的稀释倍数,接种LST肉汤管,每个稀释度接种三管,培养观察。
微生物检测原始记录
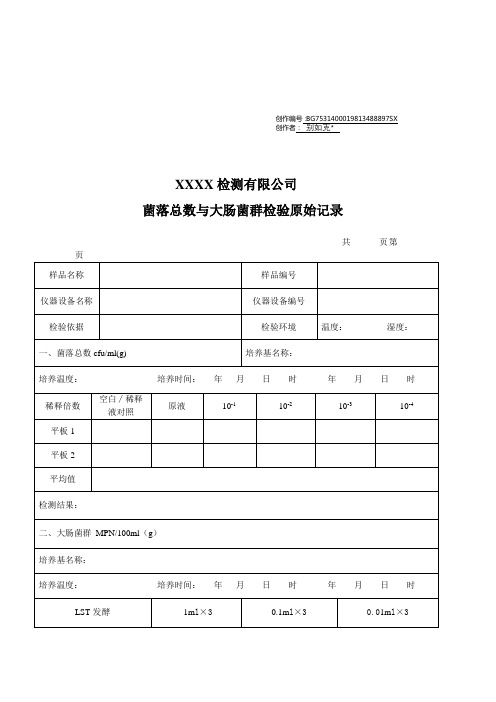
创作编号:BG7531400019813488897SX
创作者:别如克*
XXXX检测有限公司
菌落总数与大肠菌群检验原始记录
共页第
主检:年月日校核:年月日
XXXX检测有限公司
菌落总数和大肠菌群检测原始记录
共页第
主检:年月日校核:年月日
XXXX检测有限公司
水质微生物检验原始记录
共页第
主检: 年 月 日 校核: 年
月 日
XXXX 检测有限公司 乳酸菌与大肠菌群检测记录
共 页第
主检: 年 月 日 校核:
年 月 日
XXXX 检测有限公司 致病菌检验原始记录
共 页第
主检:年月日校核:年月日
XXXX检测有限公司
霉菌和酵母菌检验原始记录
共页第
培养温度:28±1℃培养时间:年月日时--- 年月日时:
菌落计数:
培养温度:28±1℃培养时间:年月日时--- 年月
主检:年月日校核:年月日
XXXX检测有限公司
商业无菌检验原始记录
共页第页
主检:日期:校核:日期:
创作编号:BG7531400019813488897SX
创作者:别如克*。
水质细总大肠菌群原始记录

水质细总大肠菌群原始记录1. 目的为确定本公司水质中菌落总数、大肠菌群测定使用方法,明确菌落总数、大肠菌群检测相关细则,指导人员正确作业,确保检测工作正常开展,根据《生活饮用水标准检验方法》GB5750.12-2006制订本方法作业指导书。
2. 适用范围适用于水质中菌落总数、大肠菌群的测定。
3. 职责检测人员严格按照本指导书要求开展检测工作。
4. 检测依据标准及检测方法《生活饮用水卫生标准》GB 5749-2006《生活饮用水标准检验方法》GB5750.12-20065. 标准值表1 二次供水菌落总数、大肠菌群6. 检验仪器及设备高压蒸汽灭菌器、恒温培养箱、冰箱、显微镜、PH试纸。
7. 试剂和材料营养琼脂培养基,三倍浓缩乳糖蛋白胨培养液,伊红美兰琼脂,革兰氏染色液。
8. 检测程序8.1 菌落总数:取采集的样品1mL于灭菌平皿内,倾入已融化冷却至45℃的营养琼脂15mL,同时做一个平行样和一个空白对照平皿,并立即摇匀。
冷却后,翻转平板,置于35℃~37℃恒温箱中,培养48h。
计数每个平板上的菌落数。
8.2 大肠菌群:在5支装有10mL双料乳糖蛋白胨培养液的试管各加水样10mL;在5支装有10mL单料乳糖蛋白胨的试管各加水样1mL,在5支装有10mL单料乳糖蛋白胨的试管各加稀释后的水样(1:10)1mL。
轻摇试管,是液体充分混匀,置35℃~37℃培养箱中24h。
观察是否产酸产气,若有,需进一步做证实试验。
8.3 取一环阳性管中的溶液接种到伊红美兰琼脂平板上,置35℃~37℃培养箱中18h~24h,观察菌落形态,典型的大肠菌群菌落为黑紫色或红紫色,具有金属光泽。
8.4 挑取可疑大肠菌群菌落1或2个进行革兰氏染色,同时接种乳糖发酵管,于36℃±1℃培养箱中,培养24h。
8.5 凡乳糖发酵管最终产酸、产气,革兰氏染色为阴性的无芽孢杆菌,为大肠菌群阳性。
记下证实试验的阳性管数,查总大肠菌群(MPN)检索表得出100mL水样中总大肠菌群的MPN值。
大肠菌群检验原始记录-平板计数法

-
阴性
报告人
报告日期
复核人
复核日期
将以上 VRBA 平板倒置于 36.0±1℃,培养 18h~24h(2022/xx/xx xx 时~2022/xx/xx xx 时) 并分别计数 可疑和典型菌落。 4.证实试验(接种 BGLB)
选取菌落数在 15~150CFU 之间的平板,从 VRBA 平板上挑取 10 个不同类型的典型和可疑菌落,少于 10 个 菌落的挑取全部典型和可疑菌落,分别移种于 BGLB 肉汤管内,36℃±1℃培养 24h~48h,观察产气情况。 5.结果与报告 5.1 按“四舍五入”原则修约,保留 2 位有效数字,无菌落生长以<1 乘以最低稀释倍数报告。 5.2 称重取样以 CFU/g 为单位报告,体积取样以 CFU/mL 为单位报告。
实验过程: 1.样品处理和稀释: 1.1 如需要,使用 0.1mol/L 氢氧化钠或 0.1mol/L 盐酸将样品调整 pH 在 6.5~7.5 之间。 1.2 制备样品稀释液
根据样品状态,无菌操作,称取/吸管吸取 25g(mL)样品,加入到 225mL 无菌磷酸盐缓冲液中均质(混 匀),制成 1:10 样品匀液。根据对样品污染情况的估计,按上述操作将样品稀释至所需浓度。 2.接种 VRBA
稀释度
10-1 稀释度
大肠菌群检验原始记录

初发酵(月桂基硫酸盐胰蛋白胨肉汤,)支)
产气管数(支)
复发酵(煌绿乳糖胆盐
肉汤,
37℃,,48h)
产气管数(支)
10-1
10-2
10-3
检验结果
(MPN/100g)
检验人:复核人:
大肠菌群检验检验原始记录
样品名称
明胶
样品编号
样品状态
生产日期
检验依据
GB4789.3-2010
检验日期
大肠菌群检验过程:
1、称取样品25g样品放入盛有225ml灭菌的生理盐水中,制成1:10的样品匀液,用1ml无菌吸管吸取1:10的样品匀液1ml,沿管壁缓缓注入盛有9ml生理盐水的无菌试管中,制成1:100的样品均液,用1ml无菌吸管吸取1:100的样品匀液1ml,沿管壁缓缓注入盛有9ml生理盐水的无菌试管中,制成1:1000的样品均液。
2、初发酵试验:大肠菌群每个样品,选择3个适宜的连续稀释度的样品匀液,每个稀释度接种3管月桂基硫酸盐胰蛋白胨(LST)肉汤(大肠菌群测定:如果超过1ml,则用双料LST肉汤),36℃±1℃培养24h±2h,观察倒管内产气情况。如未产气,培养至48h±2h,如产气着进行复发酵试验。
三、复发酵试验:(大肠菌群的测定)用接种环从产气的LST肉汤管中分别取培养物1环,移种于煌绿糖胆盐肉汤(BGLB)管中,36℃±1℃培养48h±2h,,观察产气情况。
大肠菌群检验原始记录-MPN法

检验单位
xxxx公司 检验室
检验员
张xx
检验日期
2022-xx-xx至2022-xx-xx
环境条件
温度xx℃,相对湿度(RH)xx%
检验依据
GB4789.2-2016 《食品安全国家标准食品微生物学检验 大肠菌群计数》第一法
检验编号
20220606xxx
样品名称
xxxx
样品批次
2022xxxx
仪器设备及耗材:
天平:(xxxx)洁净工作台: (xxxx)培养箱:ຫໍສະໝຸດ (xxxx)培养基及试剂:
月桂基硫酸盐胰蛋白胨肉汤(LST):xxxx配制日期2022/xx/xx
煌绿乳糖胆盐肉汤(BGLB):xxxx配制日期2022/xx/xx
磷酸盐缓冲液:xxxx配制日期2022/xx/xx
-
阴性
报告人
报告日期
复核人
复核日期
将以上 LST置于 36.0 ±1℃,培养24h±2h(2022/xx/xxxx时~2022/xx/xxxx时),观察导气管内是否有气泡产生。如产气,进行证实实验,如未产气继续培养至48h±2h(2022/xx/xxxx时~2022/xx/xxxx时),产气,进行复发酵实验,不产气报告结果为阴性。
4.证实试验(接种BGLB)
实验过程:
1.样品处理和稀释:
1.1如需要,使用0.1mol/L氢氧化钠或0.1mol/L盐酸将样品调整pH在6.5~7.5之间。
1.2 制备样品稀释液
无菌操作,称取/吸取 25g(mL)样品,加入到 225mL 无菌磷酸盐缓冲液中均质(混匀),制成 1:10 样品匀液。吸取1:10样品匀液1mL,沿试管壁注入盛有9mL无菌磷酸盐缓冲液的试管中, 涡旋混匀,制成1:100的样品匀液。根据对样品污染情况的估计,按上述操作将样品稀释至所需浓度。
微生物检验原始记录(大肠菌群)

微生物检验原始记录(大肠菌群)检验原始记录编号:报告类别:微生物共页项目:大肠菌群coliforms 检验地点:样品名称:样品编号:样品状态:符合检验要求;其他境条件:实验依据及步骤GB4789.3-2016样品稀释固体和半固体样品:称取25g样品置盛有225ml生理盐水或磷酸盐缓冲液的无菌均质容器内均质,或放入盛有225ml稀释液的无菌均质袋中拍击式均质器拍打,制成为1:10样品匀液。
依次进行10倍递增稀释。
液体样品:以无菌吸管吸取25ml样品置盛有225ml磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中混匀,为1:10样品匀液。
样品匀液的ph应在6.5-7.5之间,必要时分别用1mol/lNaOH或1mol/lHcL调节。
取1mL1∶10稀释匀液沿管壁缓缓注入9ml磷酸盐缓冲液或生理盐水的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用一支无菌吸管反复吹打,使其混合均匀,制成1:100样品匀液。
按上述操作顺序做10倍递增稀释液,每稀释一次,换用一支1mL灭菌吸量管。
从样品匀液制备到样品接种完毕,全过程不得超过15min。
初发酵试验(9管法)每个样品,选择3个适宜的连续稀释度的样品匀液(液体样品可以选择原液),每个稀释度接种3管月桂基硫酸盐胰蛋白胨(LST)肉汤(大肠菌群测定:如果超过1ml,则用双料LST肉汤)36℃±1℃培养24h±2h,观察倒管内是否有气泡产生。
产气者进行复发酵试验,未产气则继续培养至48±2h,产期进行复发酵试验。
未产气者为大肠菌群阴性。
复发酵试验(证实试验)用接种环从产气的LST肉汤管中分别取培养物1环,移种于煌绿糖胆盐肉汤(BGLB)管中,36℃±1℃培养48h±2h,,观察产气情况。
数据分析与结果一、菌落计数根据证实为大肠菌群的阳性管数,查MPN检索表,报告大肠菌群的最可能数。
菌落总数、大肠菌群检验原始记录
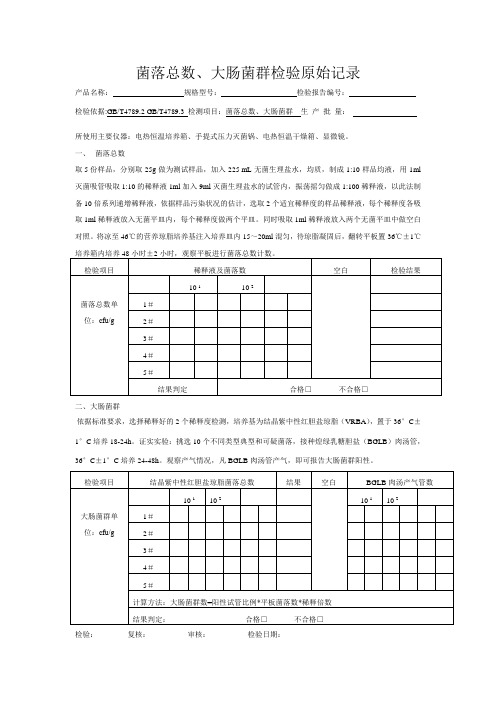
菌落总数、大肠菌群检验原始记录
产品名称:规格型号:检验报告编号:
检验依据:GB/T4789.2 GB/T4789.3 检测项目:菌落总数、大肠菌群生产批量:
所使用主要仪器:电热恒温培养箱、手提式压力灭菌锅、电热恒温干燥箱、显微镜。
一、菌落总数
取 5 份样品,分别取25g做为测试样品,加入225 mL无菌生理盐水,均质,制成1:10样品均液,用1ml 灭菌吸管吸取1:10的稀释液1ml加入9ml灭菌生理盐水的试管内,振荡摇匀做成1:100稀释液,以此法制备10倍系列递增稀释液,依据样品污染状况的估计,选取2个适宜稀释度的样品稀释液,每个稀释度各吸取1ml稀释液放入无菌平皿内,每个稀释度做两个平皿。
同时吸取1ml稀释液放入两个无菌平皿中做空白对照。
将凉至46℃的营养琼脂培养基注入培养皿内15~20ml混匀,待琼脂凝固后,翻转平板置36℃±1℃
二、大肠菌群
依据标准要求,选择稀释好的2个稀释度检测,培养基为结晶紫中性红胆盐琼脂(VRBA),置于36°C±1°C培养18-24h。
证实实验:挑选10个不同类型典型和可疑菌落,接种煌绿乳糖胆盐(BGLB)肉汤管,36°C±1°C培养24-48h。
观察产气情况,凡BGLB肉汤管产气,即可报告大肠菌群阳性。
检验:复核:审核:检验日期:。
大肠菌群-原始记录

检测项目:菌落总数大肠菌群
样品名称
样品编号
样品状态和特性
生产单位
型号规格
使用仪器设备及试验环境
生化培养箱;压力蒸汽消毒锅
菌落总数
GB4789.2-2010
操作过程:
培养基
100
10—1
10—2
10—3
10—4
空白
cfu/ml(g)
平板计数琼脂培养基
注解:为进行此项目测试;+:阳性—:阴性(不产气)
微生物检验原始记录
检测项目:菌落总数大肠菌群
样品名称样品编号样品状态和来自性生产单位型号规格
使用仪器设备及试验环境
生化培养箱;压力蒸汽消毒锅
菌落总数
GB4789.2-2010
操作过程:
1、配制200mL平板计数琼脂培养基于250mL三角烧瓶中,配制0.85%的生理盐水300mL,分别吸取9mL生理盐水置于2个试管中,将三角瓶、试管加塞棉塞,用报纸包好。
煌绿乳糖胆盐肉汤
月桂基硫酸盐胰蛋白胨肉汤
煌绿乳糖胆盐肉汤
月桂基硫酸盐胰蛋白胨肉汤
煌绿乳糖胆盐肉汤
MPN/ml(g)
注解:为进行此项目测试;+:阳性—:阴性(不产气)
主检:检验日期:年月日验讫日期:年月日
6、选择样品匀液10-1、10-2、10-3,分别吸取1ml加入无菌平皿内,分别吸取1mL稀释液(无菌生理盐水)加入平皿内做空白。
7、将15-20mL冷却至46℃的平板计数琼脂培养就倾注平板内,并转动平皿,使其混合均匀,待琼脂凝固后将平皿翻转。
8、将平皿于36±1℃的生化培养箱内培养48h±2h,计数。
培养基
100
10—1
食品大肠菌群检验原始记录表
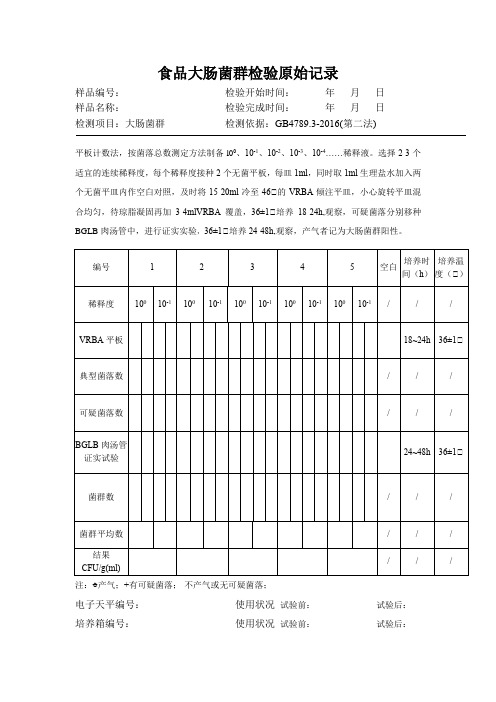
食品大肠菌群检验原始记录样品编号:检验开始时间:年月日样品名称:检验完成时间:年月日检测项目:大肠菌群检测依据:GB4789.3-2016(第二法)平板计数法,按菌落总数测定方法制备l00、10-1、10-2、10-3、10-4……稀释液。
选择2-3个适宜的连续稀释度,每个稀释度接种2个无菌平板,每皿1ml,同时取1ml生理盐水加入两个无菌平皿内作空白对照,及时将15-20ml冷至46℃的VRBA倾注平皿,小心旋转平皿混合均匀,待琼脂凝固再加3-4mlVRBA覆盖,36±1℃培养18-24h,观察,可疑菌落分别移种BGLB肉汤管中,进行证实实验,36±1℃培养24-48h,观察,产气者记为大肠菌群阳性。
注:○+产气;+有可疑菌落;-不产气或无可疑菌落;电子天平编号:使用状况试验前:试验后:培养箱编号:使用状况试验前:试验后:检测人:校核人:审核人:食品菌落总数检验原始记录样品编号:检验开始时间:年月日样品名称:检验完成时间:年月日检测项目:菌落总数检测依据:GB4789.2-2016无菌操作称(量)取样品25g或ml加入225ml的无菌生理盐水中,均质2分钟,做成1℃10样品液。
取1℃10稀释液1ml加入到9ml生理盐水中,混匀,做成1℃100样品均液。
以上法制备10倍系列稀释样品均液。
选择2-3个适宜稀释度的样品均液,吸取1ml样品均液于无菌平皿内,每个稀释度做2个平皿。
同时,分别吸取1ml空白稀释液加入两个无菌平皿内作空白对照,及时将15-20ml冷至46℃的平板计数培养基倾注平皿,转动平皿使其混合均计算及结果:菌落总数(CFU/g,ml):电子天平编号:使用状况试验前:试验后:培养箱编号:使用状况试验前:试验后:检测人:校核人:审核人:。
大肠菌群检验原始记录-平板计数法5样

10-1
24 26 10
10-2
3
2
0
10-3
0
0
0
BGLB 阳性管数
6
稀释度
第一稀释度 第二稀释度 第三稀释度
样
品 VRBA 疑似大肠菌群菌落数
5
接种 BGLB 管数
10-1
20 22 10
10-2
1
2
0
10-3
0
0
0
BGLB 阳性管数
7
VRBA 空白(仅 VRBA)
-
-
空 白
稀释液空白(稀释液+VRBA)
样品名称
xxxx
样品批次
2022xxxx
仪器设备及耗材: 天平:( xxxx) 培养箱: ( xxxx)
洁净工作台: (xxxx)
培养基及试剂: 结晶紫中性红胆盐琼脂培养基(VRBA): xxxx 煌绿乳糖胆盐肉汤(BGLB): xxxx 磷酸盐缓冲液:xxxx 0.1mol/L 氢氧化钠:
配制日期 2022/xx/xx 配制日期 2022/xx/xx 配制日期 2022/xx/xx 配制日期:2022/xx/xx
实验过程: 1.样品处理和稀释: 1.1 如需要,使用 0.1mol/L 氢氧化钠或 0.1mol/L 盐酸将样品调整 pH 在 6.5~7.5 之间。 1.2 制备样品稀释液
根据样品状态,无菌操作,称取/吸管吸取 25g(mL)样品,加入到 225mL 无菌磷酸盐缓冲液中均质(混 匀),制成 1:10 样品匀液。根据对样品污染情况的估计,按上述操作将样品稀释至所需浓度。 2.接种 VRBA
-
-
BGLB 空白(仅 BGLB)
-
-
微生物检测原始记录
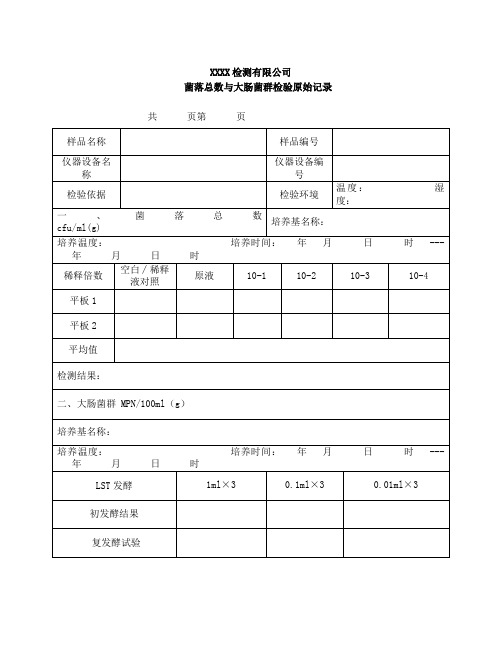
XXXX检测有限公司
菌落总数与大肠菌群检验原始记录共页第页
主检:年月日校核:年月日
XXXX检测有限公司
菌落总数和大肠菌群检测原始记录
共页
第页
主检:年月日校核:年月日
XXXX检测有限公司
水质微生物检验原始记录
共页第页
主检:年月日校核:年月日
XXXX检测有限公司
乳酸菌与大肠菌群检测记录
共页第页
主检:年月日校核:年月日
XXXX检测有限公司
致病菌检验原始记录
共页第页
主检:年月日校核:年月日
XXXX检测有限公司
霉菌和酵母菌检验原始记录
共页第页
培养温度:28±1℃培养时间:年月日时 ---年月日时:
菌落计数:
培养温度:28±1℃培养时间:年月日时 --- 年月日时
主检:年月日校核:年月日
XXXX检测有限公司
商业无菌检验原始记录
共页第页
主检:日期:校核:日期:。
大肠菌落测定原始记录(确定版)
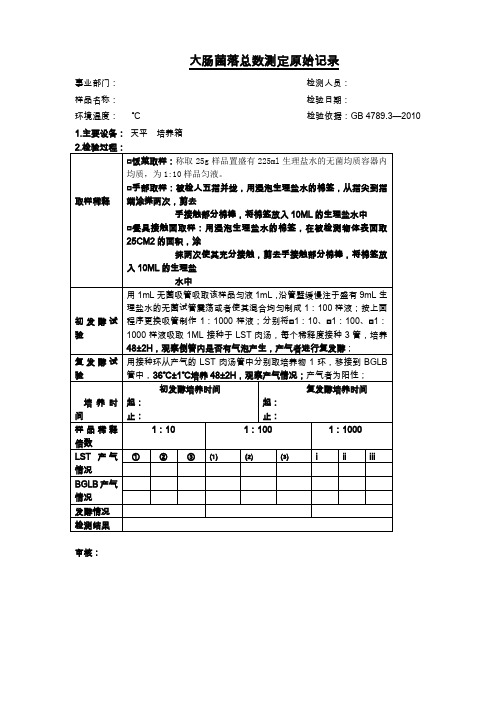
□餐具接触面取样:用浸泡生理盐水的棉签,在被检测物体表面取25CM2的面积,涂
抹两次使其充分接触,剪去手接触部分棉棒,将棉签放入10ML的生理盐
水中
初酵试验
用1mL无菌吸管吸取该样品匀液1mL,沿管壁缓慢注于盛有9mL生理盐水的无菌试管震荡或者使其混合均匀制成1:100样液;按上面程序更换吸管制作1:1000样液;分别将□1:10、□1:100、□1:1000样液吸取1ML接种于LST肉汤,每个稀释度接种3管,培养48±2H,观察倒管内是否有气泡产生,产气者进行复发酵;
大肠菌落总数测定原始记录
事业部门:检测人员:
样品名称:检验日期:
环境温度:℃检验依据:GB 4789.3—2010
1.主要设备:天平培养箱
2.检验过程:
取样稀释
□饭菜取样:称取25g样品置盛有225ml生理盐水的无菌均质容器内均质,为1:10样品匀液。
□手部取样:被检人五指并拢,用浸泡生理盐水的棉签,从指尖到指端涂搽两次,剪去
复发酵试验
用接种环从产气的LST肉汤管中分别取培养物1环,移接到BGLB管中,36℃±1℃培养48±2H,观察产气情况;产气者为阳性;
培养时间
初发酵培养时间
起:
止:
复发酵培养时间
起:
止:
样品稀释倍数
1:10
1:100
1:1000
LST产气情况
①
②
③
⑴
⑵
⑶
ⅰ
ⅱ
ⅲ
BGLB产气情况
发酵情况
检测结果
审核:
微生物检测原始记录模版

菌落总数与大肠菌群检验原始记录
主检:年月日校核:年月日
菌落总数和大肠菌群检测原始记录
主检:年月日校核:年月日
水质微生物检验原始记录
主检:年月日校核:年月日
乳酸菌与大肠菌群检测记录
主检:年月日校核:年月日
致病菌检验原始记录
主检:年月日校核:年月日
XXXX检测有限公司
霉菌和酵母菌检验原始记录
菌落计数:
培养温度:28±1℃培养时间:年月日时--- 年月日时
主检:年月日校核:年月日
XXXX检测有限公司
商业无菌检验原始记录
共页第页
主检:日期:校核:日期:。
大肠菌群计数(法一)原始记录

大肠菌群计数(法一)原始记录
第页共页
样品编号:环境温湿度:℃ %RH
检验依据:GB 4789.3-2016 检测地点:微生物室
检验日期:检毕日期:
培养开始时间:培养终止时间:
仪器设备:培养箱ZYXYJC/S- □天平ZYXYJC/S-
□pH计ZYXYJC/S-
检测过程:以无菌操作取样品□g或□mL,用□生理盐水或□磷酸盐缓冲液制成10倍梯度稀释液。
选择3个适宜连续稀释度的样品匀液(液体样品可包括原液),
每个稀释度接种3管月桂基硫酸盐胰蛋白胨(LST)肉汤,每管接种1mL(如接种
量超过1mL,则用双料LST肉汤),36℃培养h进行初发酵试验,未产气
者为大肠菌群阴性,产气者进行复发酵试验。
用接种环从产气试管中取培养物1
环,移种于BGLB内,36℃培养h,根据复发酵产气试管数查MPN表,
上报结果。
微生物检测原始记录

菌落总数与大肠菌群检验原始记录
主检:年月日校核:年月日
菌落总数和大肠菌群检测原始记录
主检:年月日校核:年月日
水质微生物检验原始记录
主检:年月日校核:年月日
乳酸菌与大肠菌群检测记录
主检:年月日校核:年月日
致病菌检验原始记录
主检:年月日校核:年月日
XXXX检测有限公司
霉菌和酵母菌检验原始记录
菌落计数:
培养温度:28±1℃培养时间:年月日时--- 年月日时
主检:年月日校核:年月日
XXXX检测有限公司
商业无菌检验原始记录
共页第页
主检:日期:校核:日期:。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
取出时培养 箱温度
C
检验依据
GB/T4789.2-2010GB/T4789.3-2010
样品状态
一、菌落总数 (cfu/g)
以无菌操作将检样25g于225ml火菌生理盐水中,均质后充分振摇做成1:10的均匀 稀释液。取1ml灭菌吸管吸取上述稀释液1ml,加入9ml灭菌生理盐水中,混合均匀,做 成1:100的稀释液,按上述方法操作,做10倍递增稀释。
每个稀释度吸取1ml于火困培养皿内,注入凉至46C的营养琼脂15ml,混匀。待营养琼 脂凝固后,翻转平板于36C培养48h。同时做空白对照。
样品匀液
(10-i)
10-1
10-2
10-3
观察结果(C)
计算结果N
报告结果
CFU/g
二、大肠菌群(MPN/100g)
以无菌操作将检样25g于225ml火菌生理盐水中,均质后充分振摇做成1:10的均匀稀 释液。取1ml火菌吸管吸取上述稀释液1ml,加入9ml火菌生理盐水中,混合均匀,做成1:100的稀释液,按上述方法操作,做10倍递增稀释。
每个稀释度吸取1ml于火困培养皿内,注入凉至46C的营养琼脂15ml,混匀。待营 养琼脂凝固后,翻转平板于36C培养48h。同时做空白对照。
稀释倍数
10
10
10
平行一
平行二
平均值
二、大肠菌群(MPN/100ml)
平行一
平行二
检验结果
备注
共页第页
主检:
校核:
检验日期:
年 月 日
邹平县产品质量监督检验所检验原始记录
每个稀释梯度取1ml注入9mlLST接种试管,36C培养48h。
样品匀液
(10-i)
10-1
10-2
10-3
观察结果
检测结果
报告结果
MPN/100g
备注
粤珍小厨餐饮管理有限公司编号:主Fra bibliotek:审核:
检验日期:
年 月 日
邹平县产品质量监督检验所检验原始记录
样品名称
样品编号
放入时培养 箱温度
C
设备名称
电热恒温培养箱(土1C)
每个稀释度吸取1ml于火困培养皿内,注入凉至46C的营养琼脂15ml,混匀。待营 养琼脂凝固后,翻转平板于36C培养48h。同时做空白对照。
稀释倍数
10
10
10
平行一
平行二
平均值
备注
共页第页
主检:
校核:
检验日期:
年 月 日
样品名称
样品编号
放入时培养 箱温度
C
设备名称
电热恒温培养箱(土1C)
设备编号
取出时培养 箱温度
C
检验依据
GB/T4789.2-2010GB/T4789.3-2010
样品状态
一、菌落总数 (cfu/g)
以无菌操作将检样25g于225ml火菌生理盐水中,均质后充分振摇做成1:10的均匀 稀释液。取1ml灭菌吸管吸取上述稀释液1ml,加入9ml灭菌生理盐水中,混合均匀,做 成1:100的稀释液,按上述方法操作,做10倍递增稀释。
O
样品名称
样品编号
放入时培养 箱温度
C
设备名称
电热恒温培养箱(土1C)
设备编号
DHP-9082
取出时培养 箱温度
C
检验依据
GB/T4789.2-2010GB/T4789.3-2010
样品状态
一、菌落总数 (cfu/g)
以无菌操作将检样25g于225ml火菌生理盐水中,均质后充分振摇做成1:10的均匀稀释 液。取1ml灭菌吸管吸取上述稀释液1ml,加入9ml灭菌生理盐水中,混合均匀,做成1:100的稀释液,按上述方法操作,做10倍递增稀释。
