微生物检测原始记录(表格模板、格式)
微生物检测原始记录文本

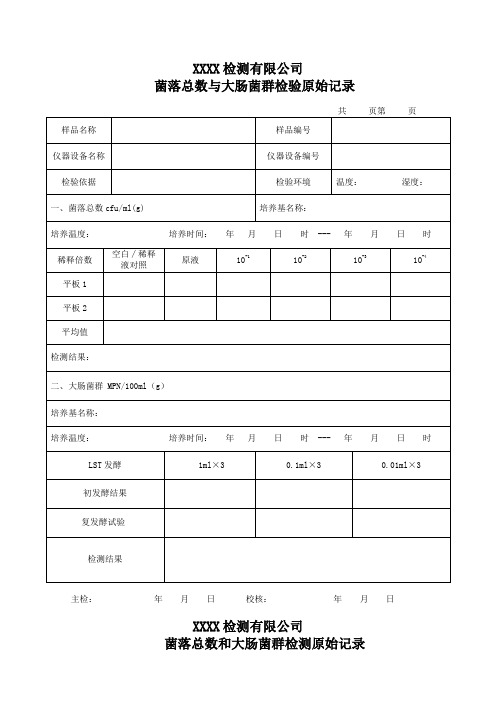
XXXX检测有限公司
菌落总数与大肠菌群检验原始记录
共页第页主检:
菌落总数和大肠菌群检测原始记录
共页第页
共页第页
主检:年月日校核:年月日
XXXX检测有限公司
水质微生物检验原始记录
共页第页
主检:年月日校核:年月日
XXXX检测有限公司
乳酸菌与大肠菌群检测记录
共页第页主检:
XXXX检测有限公司
致病菌检验原始记录
共页第页
XXXX 检测有限公司 主检:
年 月 日 校核:
主检: 年 月 日 校核: 年 月 日
XXXX 检测有限公司
霉菌和酵母菌检验原始记录
菌落计数:
商业无菌检验原始记录
共页第页
XXXX检测有限公司
主检日期校核日期。
微生物检测原始记录71484
XXXX检测有限公司
菌落总数与大肠菌群检验原始记录
主检:年月日校核:年月日
XXXX检测有限公司
菌落总数和大肠菌群检测原始记录
主检:年月日校核:年月日
XXXX检测有限公司
水质微生物检验原始记录
主检:年月日校核:年月日
XXXX检测有限公司
乳酸菌与大肠菌群检测记录
主检:年月日校核:年月日
XXXX检测有限公司
致病菌检验原始记录
主检:年月日校核:年月日
XXXX检测有限公司
霉菌和酵母菌检验原始记录
菌落计数:
主检:年月日校核:年月日
XXXX检测有限公司
商业无菌检验原始记录
共页第页
主检:日期:校核:日期:。
微生物原始记录(常规七项)
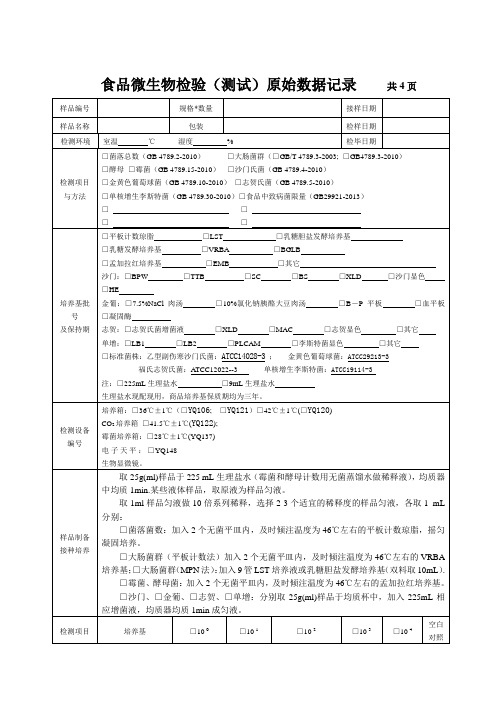
大肠菌群 □MPN/g(mL) □ cfu/g(mL) □MPN/100g(mL)
霉菌 cfu/g( mL)
酵母菌 cfu/g(mL
)
霉菌和 酵母菌 cfu/g(m
L)
沙门氏菌
□未检出 □检出
□沙门氏菌/25g(mL)
1 □未检出 □检出 2 □未检出 □检出 3 □未检出 □检出 4 □未检出 □检出 5 □未检出 □检出
0.3ml 0.3ml 0.4ml 1ml
0.3ml 0.3ml 0.4ml 1ml
空白 阳性
1:10
1:102
1:10
1:102
报告结果
菌落总数 cfu/g(mL)
□大肠菌群 cfu/g(mL)
1
cfu/g(mL)
2
cfu/g(mL)
3
cfu/g(mL)
4
cfu/g(mL)
5
cfu/g(mL)
备注
取 1ml 样品匀液做 10 倍系列稀释,选择 2-3 个适宜的稀释度的样品匀液,各取 1 mL 分别:
□菌落菌数:加入 2 个无菌平皿内,及时倾注温度为 46℃左右的平板计数琼脂,摇匀 凝固培养。
□大肠菌群(平板计数法)加入 2 个无菌平皿内,及时倾注温度为 46℃左右的 VRBA 培养基;□大肠菌群(MPN 法):加入 9 管 LST 培养液或乳糖胆盐发酵培养基(双料取 10mL).
□酵母 □霉菌(GB 4789.15-2010) □沙门氏菌(GB 4789.4-2010)
□金黄色葡萄球菌(GB 4789.10-2010) □志贺氏菌(GB 4789.5-2010)
□单核增生李斯特菌(GB 4789.30-2010)□食品中致病菌限量(GB29921-2013)
公共场所空气微生物检验原始记录

公共场所空气微生物检验原始记录日期:XXXX年XX月XX日地点:XXXX公共场所(如:商场/学校/医院等)检验目的:本次检验旨在对XXXX公共场所的空气中微生物进行检测,以评估其空气质量和卫生状况。
检验方法:1.采样器选择:使用一次性采样器进行操作,以避免交叉感染和污染。
2.采样时间:每次采样时间为15分钟,分为两个时间段,分别为上午XX时XX分至上午XX时XX分和下午XX时XX分至下午XX时XX分。
3.采样位置:根据公共场所的不同区域,选取代表性的区域进行采样。
包括但不限于入口处、办公区、卫生间、通道等区域。
4. 采样方法:将采样器放置在距离地面1.5米的位置,打开采样器电源并调整合适的流量(通常为1.0L/min),进行采样。
5.采样器编号:每个采样位置的采样器都标有唯一的编号,以避免混淆。
检验结果:上午采样结果:位置1(入口处):XXXCFU/m^3位置2(办公区):XXXCFU/m^3位置3(卫生间):XXXCFU/m^3位置4(通道):XXXCFU/m^3下午采样结果:位置1(入口处):XXXCFU/m^3位置2(办公区):XXXCFU/m^3位置3(卫生间):XXXCFU/m^3位置4(通道):XXXCFU/m^3结论与建议:1.根据检测结果,XXXX公共场所的空气中微生物的总数超出了标准范围,表明空气质量较差。
2.位置X(如:卫生间)的微生物数目明显高于其他位置,建议加强该区域的清洁和消毒工作。
3.建议在公共场所增加通风设施,以提高空气流通和减少微生物滋生的可能性。
4.对于公共场所,尤其是人员流通频繁的区域,定期进行微生物检测,并根据检测结果进行相应的清洁和卫生措施。
注意事项:1.检验前,确保采样器的清洁和消毒,以避免外部污染对结果的影响。
2.检验时,避免对采样器进行过度触摸,以防手部细菌污染采样器。
检验人员签名:____________________。
微生物检验记录簿表格
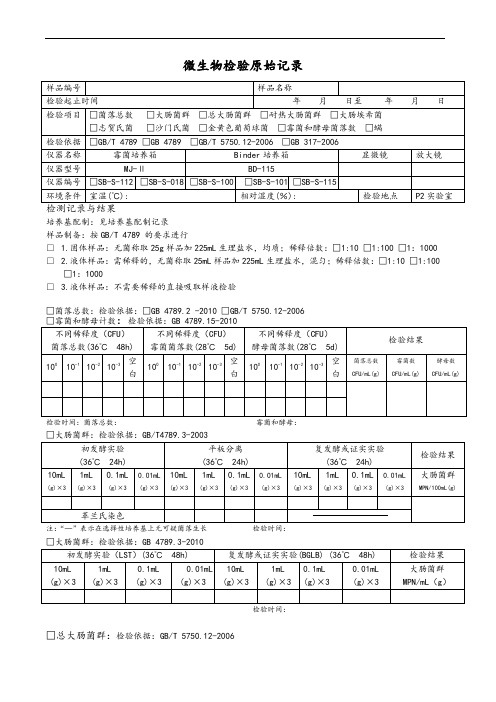
微生物检验原始记录
培养基配制:见培养基配制记录
样品制备:按GB/T 4789 的要求进行
□ 1.固体样品:无菌称取25g样品加225mL生理盐水,均质;稀释倍数:□1:10 □1:100 □1:1000 □ 2.液体样品:需稀释的,无菌称取25mL样品加225mL生理盐水,混匀;稀释倍数:□1:10 □1:100 □1:1000
□ 3.液体样品:不需要稀释的直接吸取样液检验
□菌落总数:检验依据:□GB 4789.2 -2010 □GB/T 5750.12-2006
检验时间:菌落总数:霉菌和酵母:
□大肠菌群:检验依据:GB/T4789.3-2003
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间:
□总大肠菌群:检验依据:GB/T 5750.12-2006
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间
□致病菌□沙门氏菌□志贺氏菌□金黄色葡萄球菌
□螨:检验依据 GB 317.4-.10-2006
检测人:复核人:
微生物限度检验记录(复合膜)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:
微生物限度检验记录(铝箔、PVC硬片)
检验人:复核人:
微生物限度检验记录(半成品、成品)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:。
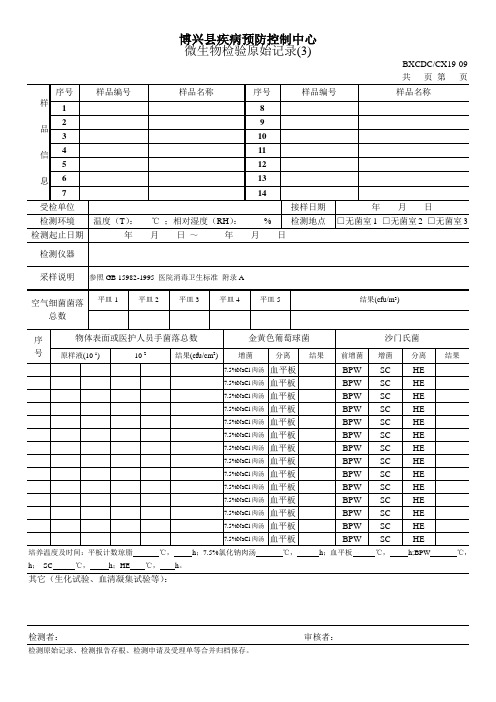
微生物检验原始记录(医院消毒)
BPW
SC
HE
7.5%NaCl肉汤
血平板
BPW
SC
HE
7.5%NaCl肉汤
血平板
BPW
SC
HE
7.5%NaCl肉汤
血平板
BPW
SC
HE
7.5%NaCl肉汤
血平板
BPW
SC
HE
7.5%NaCl肉汤
血平板
BPW
SC
HE
7.5%NaCl肉汤
血平板
BPW
SC
HE
7.5%NaCl肉汤
血平板
BPW
SC
HE
采样说明
参照GB 15982-1995医院消毒卫生标准附录A
空气细菌菌落总数
平皿1
平皿2
平皿3
平皿4
平皿5
结果(cfu/m3)
序
号
物体表面或医护人员手菌落总数
金黄色葡萄球菌
沙门氏菌
原样液(10-1)
10-2
结果(cfu/cm2)
增菌
分离
结果
前增菌
增菌
分离
结果
7.5%NaCl肉汤
血平板
BPW
SC
HE
7.5%NaCl肉汤
其它(生化试验、血清凝集试验等):
检测者:审核者:Байду номын сангаас
检测原始记录、检测报告存根、检测申请及受理单等合并归档保存。
7.5%NaCl肉汤
血平板
BPW
SC
HE
7.5%NaCl肉汤
血平板
BPW
SC
HE
7.5%NaCl肉汤
血平板
BPW
SC
微生物检测原始记录
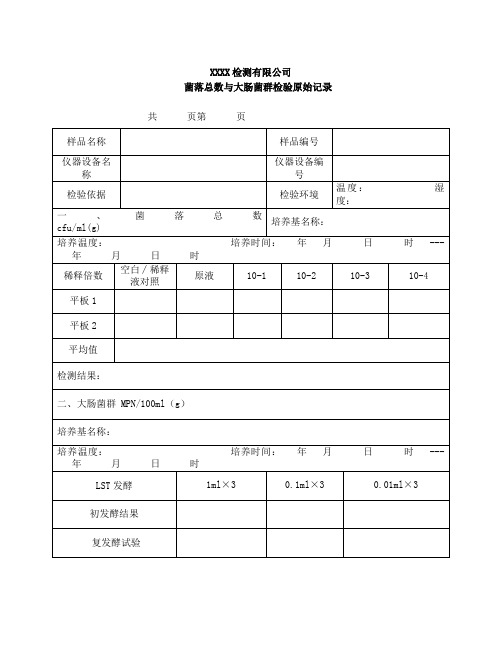
XXXX检测有限公司
菌落总数与大肠菌群检验原始记录共页第页
主检:年月日校核:年月日
XXXX检测有限公司
菌落总数和大肠菌群检测原始记录
共页
第页
主检:年月日校核:年月日
XXXX检测有限公司
水质微生物检验原始记录
共页第页
主检:年月日校核:年月日
XXXX检测有限公司
乳酸菌与大肠菌群检测记录
共页第页
主检:年月日校核:年月日
XXXX检测有限公司
致病菌检验原始记录
共页第页
主检:年月日校核:年月日
XXXX检测有限公司
霉菌和酵母菌检验原始记录
共页第页
培养温度:28±1℃培养时间:年月日时 ---年月日时:
菌落计数:
培养温度:28±1℃培养时间:年月日时 --- 年月日时
主检:年月日校核:年月日
XXXX检测有限公司
商业无菌检验原始记录
共页第页
主检:日期:校核:日期:。
微生物检测原始记录模版

菌落总数与大肠菌群检验原始记录
主检:年月日校核:年月日
菌落总数和大肠菌群检测原始记录
主检:年月日校核:年月日
水质微生物检验原始记录
主检:年月日校核:年月日
乳酸菌与大肠菌群检测记录
主检:年月日校核:年月日
致病菌检验原始记录
主检:年月日校核:年月日
XXXX检测有限公司
霉菌和酵母菌检验原始记录
菌落计数:
培养温度:28±1℃培养时间:年月日时--- 年月日时
主检:年月日校核:年月日
XXXX检测有限公司
商业无菌检验原始记录
共页第页
主检:日期:校核:日期:。
蜡样芽胞杆菌微生物检测原始记录表

受控编号:
蜡样芽胞杆菌检测原始记录表
检测项目:蜡样芽胞杆菌样品状态:□液态☑固态□完好□已开封□其他:存放条件:□冷藏☑冷冻□室温检测日期:2023.12.6 -2023.12.8 环境条件: 25 ℃ 48 %RH 检测仪器:□电热恒温培养箱☑生化培养箱
检测依据:☑GB/T 4789.14-2014 □其它:
样品处理:(1)按无菌操作称取样品 25 g(mL),加入 225 mL□灭菌生理盐水□其他,研成匀浆制成混悬液,并逐级稀释成所需稀释倍数的检测液。
(2)选择3个适宜稀释度,每个稀释度分别吸取 0.3 mL 0.3 mL 0.4 mL样品匀液,分别接种 1 个MYP平板并涂布均匀,平板于30℃培养48h.
(3)选择适宜的MYP平板,计数平板上的典型和可疑菌落,从典型或可疑菌落中挑取五个菌落进行证实试验。
备注: 1 “+”表示选择性平板上有可疑或典型菌落生长或生化试验呈阳性,“-”表示选择性平板上无可疑或典型菌落生长或生化试验呈阴性。
2.蜡样芽孢杆菌在MYP上的典型菌落特征:粉红色菌落,周围有粉红色晕;在营养琼脂上典型菌落特征:菌落不透明,表面粗糙,似毛玻璃状或融蜡状,边缘不整齐。
检验员:复核人:审核人:
第页,共页
2022年10月01日执行。
微生物检验原始记录
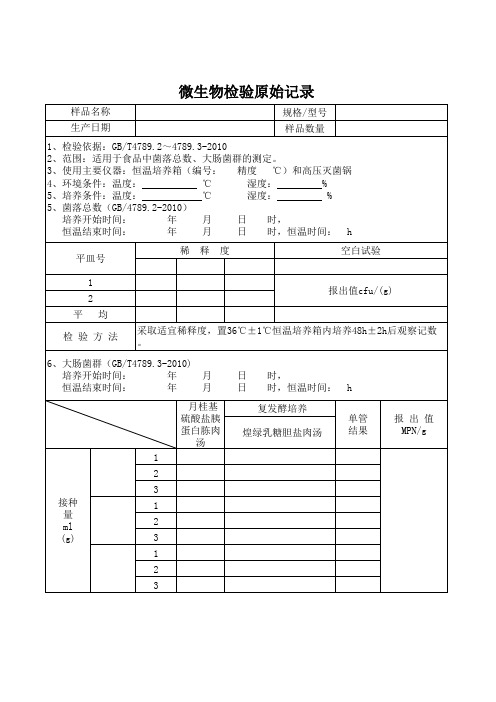
样品名称 生产日期 规格/型号 样品数量
1、检验依据:GB/T4789.2~4789.3-2010 2、范围:适用于食品中菌落总数、大肠菌群的测定。 3、使用主要仪器:恒温培养箱(编号: 精度 ℃)和高压灭菌锅 4、环境条件:温度: ℃ 湿度: % 5、培养条件:温度: ℃ 湿度: % 5、菌落总数(GB/4789.2-2010) 培养开始时间: 年 月 日 时, 恒温结束时间: 年 月 日 时,恒温时间: h 平皿号 1 2 平 均 采取适宜稀释度,置36℃±1℃恒温培养箱内培养48h±2h后观察记数 。 月 月 日 日 时, 时,恒温时间: 复发酵培养 煌绿乳糖胆盐肉汤 单管 结果 报 出 值 MPN/g 稀 释 度 空白试验
报出值cfu/(g)
检 验 方 法
6、大肠菌群(GB/T4789.3-2010) 培养开始时间: 年 恒温结束时间: 年
h
月桂基 硫酸盐胰 蛋白胨肉 汤 1 2 3 接种 量 ml (g) 1 2 3 1 2 3
选择三个适宜的稀释度,接种月桂基硫酸盐胰蛋白胨肉汤管,置36℃±1℃ 恒温度培养24h±2h后观察。观察倒管内是否有气泡产生,24 h±2 h产气者进行 复发酵试验,如未产气则继续培养至48 h±2 h,产气者进行复发酵试验。未产 检验 气者为大肠菌群阴性。用接种环从产气的LST肉汤管中分别取培养物1环,移种于 方法 煌 计为大肠菌群阳性管。根据确定大肠菌阳性管数检索MPN表,报告每g样品中大肠 菌群的MPN值。(注:“+”表示产气或大肠菌群阳性,“-”表示没有产气或大 肠菌群阴性。 检验(主检): 审核: 年 月 日
微生物检验记录表
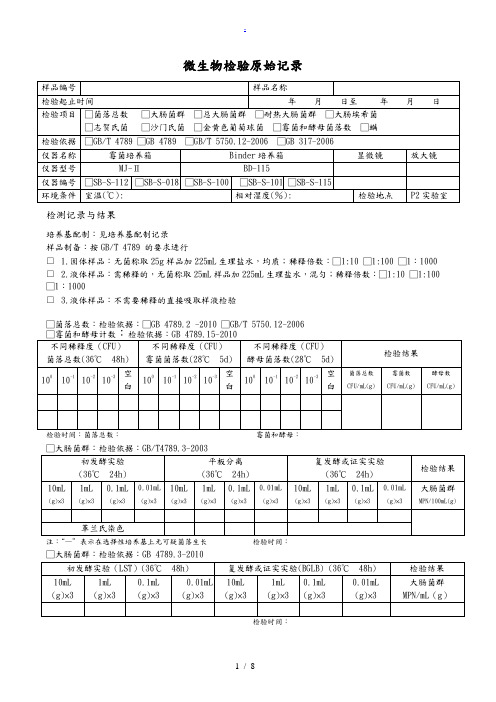
微生物检验原始记录
检测记录与结果
培养基配制:见培养基配制记录
样品制备:按GB/T 4789 的要求进行
□ 1.固体样品:无菌称取25g样品加225mL生理盐水,均质;稀释倍数:□1:10 □1:100 □1:1000 □ 2.液体样品:需稀释的,无菌称取25mL样品加225mL生理盐水,混匀;稀释倍数:□1:10 □1:100 □1:1000
□ 3.液体样品:不需要稀释的直接吸取样液检验
□菌落总数:检验依据:□GB 4789.2 -2010 □GB/T 5750.12-2006
检验时间:菌落总数:霉菌和酵母:
□大肠菌群:检验依据:GB/T4789.3-2003
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间:
□总大肠菌群:检验依据:GB/T 5750.12-2006
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
□耐热大肠菌群:检验依据:GB/T 5750.12-2006
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
□大肠埃希氏菌:检验依据:GB/T 5750.12-2006
检验时间:
□致病菌□沙门氏菌□志贺氏菌□金黄色葡萄球菌
检验依据 GB 317.4-.10-2006
检测人:复核人:
微生物限度检验记录(复合膜)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:
微生物限度检验记录(铝箔、PVC硬片)
微生物限度检验记录(半成品、成品)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:。
微生物检验记录表

微生物检验原始记录
检测记录与结果
培养基配制:见培养基配制记录
样品制备:按GB/T 4789 的要求进行
□ 1.固体样品:无菌称取25g样品加225mL生理盐水,均质;稀释倍数:□1:10 □1:100 □1:1000 □ 2.液体样品:需稀释的,无菌称取25mL样品加225mL生理盐水,混匀;稀释倍数:□1:10 □1:100 □1:1000
□ 3.液体样品:不需要稀释的直接吸取样液检验
□菌落总数:检验依据:□GB 4789.2 -2010 □GB/T 5750.12-2006
检验时间:菌落总数:霉菌和酵母:
□大肠菌群:检验依据:GB/T4789.3-2003
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间:
□总大肠菌群:检验依据:GB/T 5750.12-2006
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
□耐热大肠菌群:检验依据:GB/T 5750.12-2006
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
□大肠埃希氏菌:检验依据:GB/T 5750.12-2006
检验时间:
□致病菌□沙门氏菌□志贺氏菌□金黄色葡萄球菌
检验依据 GB 317.4-.10-2006
检测人:复核人:
微生物限度检验记录(复合膜)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:
微生物限度检验记录(铝箔、PVC硬片)
微生物限度检验记录(半成品、成品)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:。
微生物检验记录表

微生物检验原始记录
检测记录与结果
培养基配制:见培养基配制记录
样品制备:按GB/T 4789 的要求进行
□ 1.固体样品:无菌称取25g样品加225mL生理盐水,均质;稀释倍数:□1:10 □1:100 □1:1000 □ 2.液体样品:需稀释的,无菌称取25mL样品加225mL生理盐水,混匀;稀释倍数:□1:10 □1:100 □1:1000
□ 3.液体样品:不需要稀释的直接吸取样液检验
□菌落总数:检验依据:□GB 4789.2 -2010 □GB/T 5750.12-2006
检验时间:菌落总数:霉菌和酵母:
□大肠菌群:检验依据:GB/T4789.3-2003
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间:
□总大肠菌群:检验依据:GB/T 5750.12-2006
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
□耐热大肠菌群:检验依据:GB/T 5750.12-2006
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
□大肠埃希氏菌:检验依据:GB/T 5750.12-2006
检验时间:
□致病菌□沙门氏菌□志贺氏菌□金黄色葡萄球菌
检验依据 GB 317.4-.10-2006
检测人:复核人:
微生物限度检验记录(复合膜)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:
微生物限度检验记录(铝箔、PVC硬片)
微生物限度检验记录(半成品、成品)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:。
