电位分析法与离子选择性电极
化学实验中的常见电化学分析方法

化学实验中的常见电化学分析方法电化学分析是一种常见的化学分析方法,通过应用电化学原理,利用电流、电势、电解质溶液等参数来进行物质的检测和分析。
它能够快速、灵敏地检测出微量物质,并且具有较高的准确性和重现性。
本文将介绍几种在实验室中常见的电化学分析方法。
一、电解电位法电解电位法是最常见的电化学分析方法之一,它通过测量电极在电解质溶液中产生的电位变化来分析物质。
在实验中,通常采用参比电极和工作电极的组合,参比电极用于提供一个标准的电势参考,而工作电极用于与待测物质发生反应。
主要包括极谱法、库仑分析法和电势滴定法等。
1. 极谱法极谱法是通过控制电解质溶液中的电流,测量电极的电势变化来分析物质。
常见的极谱法包括阳极极谱和阴极极谱。
阳极极谱常用于有机化合物的分析,如药物、农药等,而阴极极谱常用于金属、合金等无机物质的分析。
2. 库仑分析法库仑分析法是通过测量电解质溶液中的电流大小和时间,计算出反应物质的含量。
它常用于分析氧化还原反应、电沉积和电解等过程中的物质。
3. 电势滴定法电势滴定法是利用电解电位的变化来进行滴定分析的方法。
它常用于测定银离子、溶氧量、氟离子等物质的含量。
二、电化学传感器法电化学传感器法是基于电化学原理的一种常见的快速检测方法,它通过改变电极电位来检测待测物质。
电化学传感器的结构一般由工作电极、参比电极和引用电极(或对电极)组成。
1. 离子选择电极离子选择电极通过选择性地与某种特定离子发生反应,从而改变电极电位来检测离子的浓度。
常见的离子选择电极包括氢离子选择电极、钠离子选择电极等。
2. 气体传感器气体传感器是使用气敏电极或半导体电极来检测气体成分的一种电化学分析方法。
它广泛应用于环境监测、工业安全等领域,能够快速、灵敏地检测气体的浓度。
三、电化学阻抗法电化学阻抗法是通过测量电化学电路中的阻抗变化来分析物质。
它主要用于表征电极界面的电化学过程,包括界面电容、界面电导、界面电阻等参数。
电化学阻抗法常用于金属腐蚀、电池性能评价、涂层质量检测等领域。
电位分析法(离子选择性电极)

参比电极 Ag/AgCl参比电极 电极套管 0.1mol/LNH4Cl溶液 溶液 透气膜
气敏氨电极结构示意图
以Ca 2+离子选择性电极为例
液膜 二癸基磷酸钙的苯基磷
酸二辛酯溶液
内 参 比 溶 液
Ca2+
| | | |
CaR | | | | | | ++++ +
Ca2+ 待 测 溶 液
++++++
X-
X-
带电荷流动载体膜作用示意图 X- 非响应离子 R 载体 CaR 离子型 缔合物
气敏电极
pH玻璃电极 玻璃电极
电位分析法
RT aM,内 RT aM,外 膜电位的产生ln 若敏感膜仅对阳离子 n+有选 若敏感膜仅对阳离子M ln E道 ,内 = k 2 + E道 ,外 = k1 + nF 择性相应 a′ ,内 nF a′ ,外 M M
E道内 E扩内 E扩外 E道外 内参 比溶 液
a内 a内/
待测 溶液 膜
a外/ a外
晶体膜电极 以F-选择性电极为例
内参比电极 Ag-AgCl
塑料管 内参比溶液 NaF-NaCl
RT EF = k − ln a F − 掺EuF 的LaF 单晶片 F F 电极电极结构示意图 = k − 0.059 lg a F −
2 3 −
流动载体电极: 流动载体电极:
• 其关键部分 是液体敏感 膜,它由三 部分组成: 部分组成: 载体 有机溶剂 惰性微孔膜。 惰性微孔膜。
RT aM,外 E膜 = E道 ,外 − E道 ,内 = ln nF aM,内
E膜 = k 3 +
电化学分析方法之一电位分析法

)
(K2
0.0592
lg
aH 内 aH 内表面
)
K
0.0592
lg
a H
外
K
0.0592
pH
C、PH玻璃电极的电极电位:
E玻 E内参 E膜 E内参 K 0.0592 pH试
E玻 K玻 0.0592 pH试
D、电位法测定溶液pH的基本原理 电位法测定溶液的pH,是以玻璃电
极作批示电极,饱和甘汞电极作参比电 极,浸入试液中构成原电池: E = E甘 – E玻
电位滴定法中拟定终点的办法重 要有下列几个:
第一种办法:以测得的电动势和 对应的体积作图,得到E~V曲线, 由曲线上的拐点拟定滴定终点。
第二种办法:作一次微商曲线, 由曲线的最高点拟定终点。具体 由△E/△V对V作图,得到△E/△V 对V曲线,然后由曲线的最高点拟 定终点。
第三种办法:由二次微商求终点
其中,批示电极是看待测离子的 浓度变化或对产物的浓度变化有 响应的电极,参比电极是含有固 定电位值的电极。
在滴定过程中,随着滴定剂的加 入,待测离子或产物离子的浓度 要不停地变化,特别是在计量点 附近,待测离子或产物离子的浓 度要发生突变,这样就使得批示 电极的电位值也要随着滴定剂的 加入而发生突变。
惯用的有Ag/AgCl、甘汞电极 (Hg/Hg2Cl2电极)。
对于甘汞电极,其电极反映为: Hg2Cl2+2e=2 Hg+2Cl-
3. 第三类电极:它由金属,该金属 的难溶盐、与此难溶盐含有相似阴离 子的另一难溶盐和与此难溶盐含有相 似阳离子的电解质溶液所构成。表达 为M (MX,NX,N+)。如: Zn| ZnC2O4(s),CaC2O4(s),Ca2+ Ca2+ + ZnC2O4 +2e CaC2O4+ Zn
电位分析及离子选择性电极分析

高选择性,需要在pH5~7之间使用,
pH高时:溶液中的OH-与氟化镧晶体膜中的F-交换; pH较低时:溶液中的F -生成HF或HF2 - 。
电位分析及离子选择性电极分析
2.玻璃膜电极
非晶体膜电极,玻璃膜的组成不同可 制成对不同阳离子响应的玻璃电极。
(敏感膜)
内参比电极的电位值固定,且内充溶液中离 子的活度也一定,则膜电极电位为:
IS E 内 参 膜 kR ZlF T n M
电位分析及离子选择性电极分析
离子选择电极的电位
导线
对MZ+产生响应时,
电极腔体 内参比电极 内参比溶液
内k2R ZFTln 'M M((内 内 )) 外k1R ZFTln 'M M((外 外))
电位分析及离子选择性电极分析
玻璃膜电位:
将浸泡后的玻璃电极放入待测溶液,水合硅胶层表面与溶液
中的H+活度不同,形成活度差,H+由活度大的一方向活度小的一 方迁移, 平衡时:
H+溶液==
H+ 硅胶
E内 = k1 + 0.059 lg( a2 / a2’ )
E外 = k2 + 0.059 lg(a1 / a1’ )
由于玻璃膜内、外表面的性质基本相同, 则: k1=k2 , a’1 = a’2
电极电位与溶液中给定离子活度的对数 呈线性关系。
电位分析及离子选择性电极分析
一、电极的基本构造
电极腔体――玻璃或高分子聚 合物材料做成
内参比电极――通常为 Ag/AgCl电极
内参比溶液――由氯化物及响 应离子的强电解质溶液组成
电位分析法习题解答

5.直接电位法的主要误差来源有哪些?应如何减免之? 解:误差来源主要有:
(1)温度,主要影响能斯特响应的斜率,所以必须在测定过程中保持 温度恒定.
(2)电动势测量的准确性.一般, 相对误差%=4nDE,因此必须要求测 量电位的仪器要有足够高的灵敏度和准确度.
(3)干扰离子,凡是能与欲测离子起反应的物质, 能与敏感膜中相关 组分起反应的物质,以及影响敏感膜对欲测离子响应的物质均可 能干扰测定,引起测量误差,因此通常需要加入掩蔽剂,必要时还须 分离干扰离子.
活动载体电极则是由浸有某种液体离子交换剂的惰性多孔膜 作电极膜制成的。通过液膜中的敏感离子与溶液中的敏感离 子交换而被识别和检测。
敏化电极是指气敏电极、酶电极、细菌电极及生物电极等。 这类电极的结构特点是在原电极上覆盖一层膜或物质,使得 电极的选择性提高。典型电极为氨电极。
以氨电极为例,气敏电极是基于界面化学反应的敏化电极, 事实上是一种化学电池,由一对离子选择性电极和参比电极 组成。试液中欲测组分的气体扩散进透气膜,进入电池内部, 从而引起电池内部某种离子活度的变化。而电池电动势的变 化可以反映试液中欲测离子浓度的变化。
2.何谓指示电极及参比电极?试各举例说明其作用. 解:指示电极:用来指示溶液中离子活度变化的电极,其电极电位值 随溶液中离子活度的变化而变化。在一定的测量条件下,当溶液 中离子活度一定时,指示电极的电极电位为常数.例如测定溶液pH 时,可以使用玻璃电极作为指示电极,玻璃电极的膜电位与溶液pH 成线性关系,可以指示溶液酸度的变化. 参比电极:在进行电位测定时,是通过测定原电池电动势来进行 的,电动势的变化要体现指示电极电位的变化,因此需要采用一 个电极电位恒定,不随溶液中待测离子活度或浓度变化而变化的 电极作为基准,这样的电极就称为参比电极.例如,测定溶液pH时, 通常用饱和甘汞电极作为参比电极.
离子选择性电极介绍

硫化银电极可测定 Ag+,其电极电位可表达为
E k ln t
(1-8)
硫化银电极除了测定 Ag+以外,还可以测定 S2-。当电极与试液接触时,存在以下平衡
Ag2S ═ 2Ag+ + S2-
由于氟离子活度梯度存在而引起的扩散电位。这些值均与它们各自相关的氟离子活度有关。可
得到:
ln
(1-3)
式中,R 为气体常数;T 为热力学温度;F 为法拉第常数;, , 分别为膜外测和内测溶液 与膜接触的界面溶液中氟离子的活度。由于膜内测的 式固定不变的,式(1-3)可写为
ln Ⅰ
(1-4)
式中, 为与膜内测氟离子活度有关的常数; 即为试液中氟离子活度 。
5×10-7~1×10-1
Cl-
AgCl+Ag2S
5×10-5~1×10-1
5~6.5 2~12
Br-
AgBr+Ag2S
5×10-6~1×10-1
2~12
(1-10)
主要干扰离子 OH-
Br-,S2O32-,I-,CN-,S2S2O32-,I-,CN-,S2-
ICNAg+,S2Cu2+ Pb2+ Cd2+
近年来,离子选择性薄膜电极得到了极大的发展,一大批粒子选择性电极倍研制出来。按 照 IUPAC 推荐,以敏感膜材料为基础对离子选择性电极进行分类:
原电极是指敏感膜直接与试液接触的离子选择性电极。敏化离子选择性电极是以原电极为 基础,利用复合膜界面敏化反应的一类离子选择性电极。下面主要介绍晶体膜电极和刚性基质 电极。
电解质检测的常用方法

电解质检测的常用方法1.引言1.1 概述电解质是指在水或其他溶剂中能够产生离子的化合物。
电解质的检测是一项重要的分析工作,它可以用于许多领域,如医学诊断、环境监测等。
常用的电解质检测方法可以分为电化学法和光谱法两大类。
在电化学法中,常用的电解质检测方法有电导率法、离子选择性电极法和电化学分析法等。
电导率法是通过测量电解质溶液的电导率来确定其中的离子浓度。
离子选择性电极法则是利用特定的电极对特定离子的选择性响应来检测电解质。
电化学分析法包括阴极极谱、阳极极谱和极化曲线法等,通过测量电解质溶液在电极表面发生的化学反应的电流或电位变化来分析电解质的浓度或性质。
另一种常用的电解质检测方法是光谱法,它利用电解质溶液对特定波长的光的吸收或发射来分析电解质成分。
常见的光谱法包括原子吸收光谱、紫外可见光谱和荧光光谱等。
这些方法不仅具有灵敏度高、分析速度快的特点,而且可以同时检测多种离子的浓度,因此在电解质检测中得到广泛应用。
电解质检测在医学领域具有重要意义。
临床上,电解质不平衡是许多疾病的早期指标之一。
通过电解质检测,医生可以及时发现和纠正电解质紊乱,保障患者的生命安全。
在环境监测领域,电解质检测可以帮助监测水体、大气中的离子浓度,评估环境质量,保护生态环境。
综上所述,电解质检测是一项重要的分析工作,在医学、环境等多个领域有着广泛的应用前景。
电化学法和光谱法是常用的电解质检测方法,它们分别通过电导率、离子选择性电极以及光的吸收或发射等原理来确定电解质的浓度和成分。
电解质检测的发展将为人们提供更多的分析手段和技术支持,促进医学诊断、环境保护等领域的进步。
文章结构是指整篇文章的组织和布局方式,它描述了文章的主要部分和各部分之间的逻辑关系。
本文按照以下结构进行组织:1. 引言1.1 概述在引言部分,我们对电解质检测进行了简要介绍,强调了其在科学研究和实际应用中的重要性。
1.2 文章结构本文将分为三个主要部分进行讨论。
电位分析及离子选择性电极分析法

第十二章
12.2 离子选择性电极 与膜电位
电位分析及离子选 12.3 离子选择性电极的
择性电极分析法
主要性能参数
12.4 离子选择性电极
的分析仪器
12.5 电位分析及离子
选择性电极分析
方法与应用
电位分析及离子
2021/3/6
选择性电极分析
法
1
12-1 概述
一、电位分析法 1.定义 利用电极的电极电位与待测试液中某种 离子的活度(或浓度)之间的关系,确定出 待测组分含量的电化学分析方法。
2021/3/6
电位分
析及离
子选择
性电极
分析法
10
2021/3/6
H+ + N电a位G分 I(固)
析及离
子选择
性电极
分析法
11
Na+ + HGI(固) (水合硅胶)
(4)玻璃膜电位的形成 玻璃电极在水溶液中浸泡,形成一个三
层结构,即中间的干玻璃层和两边的水化硅 胶层。
玻璃膜电位的产生是H+在玻璃内、外溶液和水化层 电位分
界间没有发生电子交换过程。表现为离子在 相界上的扩散。
2021/3/6
电位分
析及离
ห้องสมุดไป่ตู้
子选择
性电极
分析法
6
离子选择性电极(又称“膜电极”)组成: ★薄膜(敏感膜或传感膜)
—对特定离子有选择性响应。 ★内参比溶液
—含有与待测离子相同的离子 ★内参比电极
—Ag/AgCl电极。
2021/3/6
电位分
析及离
子选择
ln
α2 α 2
外
k2
电位分析法2_膜电极

电位分析法(二)三、离子选择电极(Membrane potential and ISE)和膜电位1. 膜电位及其产生膜电极(Membrane potential and ISE),具有敏感膜且能产生膜电位的电极。
膜电位产生于被分隔两边不同成分的溶液,测量体系为:参比电极1|溶液1|膜|溶液2|参比电极2膜电极特点:仅对溶液中特定离子有选择性响应(离子选择性电极)。
膜电极的关键:选择膜的敏感元件。
敏感元件构成:特殊组分的玻璃、单晶、混晶、液膜、高分子功能膜及生物膜等。
膜电极组成的半电池,没有电极反应;相界间没有发生电子交换过程。
表现为离子在相界上的扩散,造成双电层存在,产生界面电位差。
该类主指离子选择性电极。
•膜电位: = 膜内扩散电位和膜与电解质溶液形成的内外界面的Donnan电位的代数和。
膜电位=扩散电位(膜内) + Donnan电位(膜与溶液之间)(1)扩散电位:液液界面或固体膜内,因不同离子之间或离子相同而浓度不同而发生扩散即扩散电位。
其中,液液界面之间产生的扩散电位也叫液接电位。
特点:这类扩散是自由扩散,正负离子可自由通过界面,没有强制性和选择性。
(2)Donnan电位:选择性渗透膜或离子交换膜,它至少阻止一种离子从一个液相扩散至另一液相或与溶液中的离子发生交换。
这样将使两相界面之间电荷分布不均匀——形成双电层——产生电位差——Donnan 电位。
这类扩散具强制性和选择性。
2. 离子选择性电极ISE 原电极晶体膜均相膜如F-,Cl-,Cu2+非均相膜如硅橡胶膜非晶体膜刚性基质如PH,PNa流动载体带正电荷如NO3-,ClO4-,BF4-带负电荷如Ca2+, Mg2+中性如K+敏化电极气敏电极如CO2, NH4+电极生物电极如酶电极,生物组织电极1)玻璃膜电极玻璃电极构成:是一种特定配方的玻璃吹制成球状的膜电极,这种玻璃的结构为三维固体结构,网格由带有负电性的硅酸根骨架构成,Na+可以在网格中移动或者被其他离子所交换,而带有负电性的硅酸根骨架对H+有较强的选择性。
电位分析法

内、外参比电极的电位值固定,且内充溶液中离子的活度 也一定,则电池电动势为:
RT EK ln ai nF
离子选择性电极的类型和结构
1976年IUPAC基于膜的特征,推荐将其分为以下几类
离子选择性电极(又称膜电极)
注意:离子活度系数保持不变时,膜电位才与log ci
呈线性关系。
总离子强度调节缓冲溶液简称TISAB
TISAB的作用:
①保持较大且相对稳定的离子强度,使活度系数恒定; ②维持溶液在适宜的pH范围内,满足离子电极的要求; ③掩蔽干扰离子。 典型组成(测F-): 1mol/L的NaCl,使溶液保持较大稳定的离子强度; 0.25mol/LHAc和0.75mol/LNaAc, 使溶液pH在5左右; 0.001mol/L的柠檬酸钠, 掩蔽Fe3+、Al3+等干扰离子。
公式使用时注意:对阳
离子,△E不变;对阴离子,△E
前加负号或取△E的绝对值。
优点:
(1)无须绘制标准曲线
(仅需一种浓度标液) (2)无需配制或添加 TISAB (3)操作步骤简单、快 速
3、直读法--pH测定原理与方法 ⑴ 直读法:对于被测溶液中
的某种成分能够在仪器上直接读 出其浓度的方法称为直读法。如 在pH计或pNa计上就能测定pH值
影响电位测定准确性的因素
(1) 测量温度:影响主要表现在对电极的标准电极电位、 直线的斜率和离子活度的影响上。 仪器可对前两项进行校正,但多数仅校正斜率。 温度的波动可以使离子活度变化,在测量过程中应尽量 保持温度恒定。 (2) 线性范围和电位平衡时间:一般线性范围在10-1~10-6 mol / L;平衡时间越短越好。测量时可通过搅拌使待测离子 快速扩散到电极敏感膜,以缩短平衡时间。 测量不同浓度试液时,应由低到高测量。
电化学中电极的分类及应用概述

电化学中电极的分类及应用概述电化学分析是根据物质在溶液中或其它介质中的电化学性质及其变化规律来进行分析的方法。
电化学仪器在我们的生活及实际生产中发挥着重要的作用,例如在药品检验,油品质量检测方面都是不可或缺的,而在电化学仪器中,核心部件非电极莫属,电极在电化学分析仪器上起到连接待测样品与仪器的枢纽作用,并且作为接受信号或产生信号的传感器。
在电化学分析中只有选择合适的电极,才能保证实验的精确度与准确性。
现在根据电化学仪器的分类对电极进行详细的分类。
电化学仪器根据其原理主要分为电位滴定仪、库仑滴定仪(卡尔-费休水分测定仪及永停滴定仪)、重金属分析仪(伏安分析)等。
根据电极的作用可将电极分为工作电极、参比电极、辅助电极。
工作电极用来发生所需要的电化学反应或响应激发信号,在测量过程中溶液本体浓度发生变化的体系的电极。
如电解分析中的阴极等。
参比电极用来提供标准电位,电位不随测量体系的组分及浓度变化而变化的电极。
这种电极必须有较好的可逆性、重现性和稳定性。
常用的参比电极有标准氢电极(SHE)、Ag/AgCl、Hg/Hg2Cl2电极,尤以饱和甘汞电极(SCE)使用得最多。
辅助电极或对电极在电化学分析或研究工作中,常常使用三电极系统,除了工作电极,参比电极外,还需第三支电极,此电极所发生的电化学反应并非测示或研究所需要的,电极仅作为电子传递的场所,以便和工作电极组成电流回路,这种电极称为辅助电极或对电极。
例如溶出伏安法中的铂电极。
而我们通常研究的是工作电极,只有精确地测定工作电极的电位,才能够考察电位同电化学反应,吸附等界面反应的规律。
至于辅助电极和工作电极之间的联系,主要是在于构建电化学反应平衡,另外要保证辅助电极不要影响到工作电极。
三电极体系含两个回路,一个回路由工作电极和参比电极组成,用来测试工作电极的电化学反应过程,另一个回路由工作电极和辅助电极组成,起传输电子形成回路的作用。
电位滴定仪中,工作电极主要包括金属基指示电极中的某些电极、离子选择电极。
2.离子选择性电极分类及原理解析

1.晶体膜电极(氟电极)
结构:右图
敏感膜:(氟化镧单晶)
掺有EuF2 的LaF3单晶切片;
内参比电极:Ag-AgCl电极(管 内 )。 内参比溶液:0.1mol/L的NaCl和0.1mol/L的NaF混合溶液(F-用 来控制膜内表面的电位,Cl-用以固定内参比电极的电位)。
原理:
LaF3的晶格中有空穴,在晶格上的F-可以移 入晶格邻近的空穴而导电。离子的大小、形状 和电荷决定其是否能够进入晶体膜内。
当氟电极插入到F-溶液中时,F-在晶体膜 表面进行交换。25℃时:
RT lna F =K - 0.059 lgaF- = K + 0.059 pF E膜 = K nF
具有较高的选择性,需要在pH5~6之间使 用。 pH高时,溶液中的OH-与氟化镧晶体膜中 的F-交换。 pH较低时,溶液中的F -生成HF。
lg ci E
E E
nF
lnai
2、标准加入法
设某一试液体积为V0,其待测离子的浓度为cx, 往试
液中准确加入一小体积Vs(大约为V0的1/100)的用待测
离子的纯物质配制的标准溶液, 浓度为Cs(约为Cx的100 倍)。由于V0>>Vs,可认为溶液体积基本不变。则: 浓度增量为:⊿c = Cs Vs / V0
2.303 RT E1 K lg( xi i c x ) nF
2.303 RT E2 K lg( x2 2 c x x2 2 c) nF
可以认为γ 2≈γ 1,χ 2≈χ 1。则:
2.303 RT c E E2 E1 lg(1 ) nF cx
2.303 RT 令:S ; nF c 则: E S lg(1 ) cx c x c(10 E / s 1) 1
电位分析法离子选择性电极的选择性

2. 标准加入法
标准曲线法要求标准溶液与待测溶液具有相近的离子强 度和组成,否则将会因活度系数变化而引起误差。而标准 加入法则在一定程度上减免这一误差的产生。
设:未知液中待测离子浓度为cx,溶液体积为V0,测得电动 势为E1,则
E1
K '
2.303RT nF
lg(x1 1cx )
x1为游离的离子的摩尔分数。
EM
K
2.303RT nF
lg[ ai
K i, j(a j )ni
nj ]
式中第二项对阳离子为正号;对阴离子为负号。
离子选择性系数Ki,j的物理意义:
1.它是在其他相同条件下,同时提供相同的电位时的欲测 离子活度ai与干扰离子活度aj的比值:
Ki, j ai (a j )ni n j
Ki,j愈小,说明j离子的干扰愈小,即此电极对欲测离子的 选择性愈好。 Ki,j愈小愈好。 2. Ki,j值并非一真实的常数,其值与i和j例子的活度和实 验条件等有关,所以不能直接利用Ki,j的文献值作为分析 测定时的干扰校正。但可作为判断离子选择性电极在已 知杂质存在下时的干扰程度的一个指标,对拟定有关分 析方法时起参考作用。
E
K
2.303RT F
lg
a F
对各种离子选择性电极:
E电极
K
RT nF
ln
a离子
1.标准曲线法
配制出与试样组成相似的标准 溶液来制作标准曲线。即将离子 选择性电极与参比电极插入一系 列活(浓)度已知的标准溶液并测 定相应的电动势
注意:离子活度系数保持不变时, 膜电位才与log ci呈线性关系。-------------恒定背景法
相对误差的计算:
根据Ki,j的定义,利用下式可以估量在测定中的误差:
电位分析法的定义、分类和特点

电位分析法的定义、分类和特点1、电位分析法的定义、分类和特点定义:利用测得电极电位与被测物质离子浓度的关系求得被测物质含量的方法叫电位分析法。
分类:直接电位法――利用专用的指示电极――离子选择性电极,选择性地把待测离子的活度(或浓度)转化为电极电位加以测量,依据Nernst方程式,求出待测离子的活度(或浓度),也称为离子选择电极法。
这是二十世纪七十时代初才进展起来的一种应用广泛的快速分析方法。
·电位滴定法――利用指示电极在滴定过程中电位的变化及化学计量点相近电位的突跃来确定滴定尽头的滴定分析方法。
电位滴定法与一般的滴定分析法的根本差别在于确定尽头的方法不同。
特点:应用范围广――可用于很多阴离子、阳离子、有机物离子的测定,尤其是一些其他方法较难测定的碱金属、碱土金属离子、一价阴离子及气体的测定。
由于测定的是离子的活度,所以可以用于化学平衡、动力学、电化学理论的讨论及热力学常数的测定。
·测定速度快,测定的离子浓度范围宽。
·可以制作成传感器,用于工业生产流程或环境监测的自动检测;可以微型化,做成微电极,用于微区、血液、活体、细胞等对象的分析。
2.化学电池化学电池是由两组金属—溶液体系构成的。
每一个化学电池有两个电极。
分别浸入适当的电解质溶液中,用金属导线从外部将两个电极连接起来,同时使两个电解质溶液接触,构成电流通路。
电子通过外电路导线从一个电极流到另一个电极,在溶液中带正负电荷的离子从一个区域移动到另一个区域以输送电荷,*后在金属—溶液界面处发生电极反应,即离子从电极上取得电子或将电子交给电极,发生氧化—还原反应。
假如两个电极浸在同一个电解质溶液中,这样构成的电池称为无液体接界电池;假如两个电极分别浸在用半透膜或烧结玻璃隔开的或用盐桥连接的两种不同的电解质溶液中,这样构成的电池称为有液体接界电池。
用半透膜、烧结玻璃隔开或用盐桥连接两个电解质溶液,是为了避开两种电解质溶液的机械混合,同时又能让离子通过。
电位分析及离子选择电极
如H+,Na+,K+,Li+,Ag+离子响应电极(p139)。其中H+离子响 应电极(即pH玻璃电极)被最早最广泛应用。下面以pH玻璃 电极为例,详细阐述玻璃电极的工作原理。
18:14:39
pH玻璃电极
H+响应的玻璃膜电极:内充0.1mol/LHCl 溶液,敏感膜厚度约为0.10mm。
玻璃膜内、外表面的性质基本相同,则k外=k内 , a’1 = a’2
E 18:14:39
膜
=
E外
-
E内
=
0.059
lg(
a1
/
a2)
玻璃电极电位
作为玻璃电极的整体,玻璃电极的电位应包括内参比电极 的电位,即
E玻 = E内参比 + E膜 于是 E玻 = E内参比 + 0.059v lg( a1 / a2)
敏化电极(sensitized electrodes) 气敏电极:如氨电极 酶电极:如尿素电极
18:14:39
1.非晶体膜电极(玻璃电极)
玻璃膜电极,它的核心部分是玻璃 膜,是在SiO2基质中加入Na2O和少量 CaO烧制而成,膜厚0.5mm,呈球泡型。 球泡内充注内参比溶液(含有与待测离 子相同的离子),再插入一根AgCl-Ag电 极作内参比电极。
18:14:39
18:14:39
18:14:39
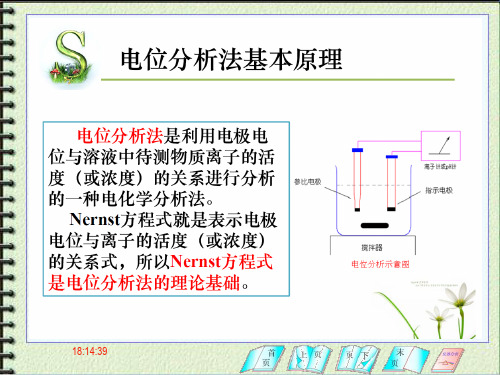
一、电位分析原理
principle of potentiometry analysis
电位分析是通过在零电流条件下测 定两电极间的电位差(电池电动势)所 进行的分析测定。
E 电池= E + - E 装置:参比电极、指示电极、电位
电位及离子选择性电极法

在于将膜电位引出。
ISE法的特点:
①选择性好,多数情况下共存离子的干扰小, 不需复杂处理待测液即可直接测定 ②灵敏度高。可达10-5- 10-8 mmol/L. ③实际测定的是溶液中离子活度,这是生物 学中一个重要的物理量。 ④溶血、脂血及黄疸不影响测定。 ⑤设备简单,分析速度快,易于自动化。 ⑥标本用量少而且应用广。
⑤NaN3可明显干扰Cl的测定。
电解质检测中各项的意义:
血清钾:3.5-5.5 mmol/L • 钾在参与蛋白质和糖的代谢,维持心肌和神经肌肉正常的应激性,维持酸碱
平衡等方面起重要作用。 降低: ①钾的摄入不足。 ②钾的过度丢失。如严重的呕吐、腹泻及胃肠引流、肾脏疾病(肾衰多尿期)等。 ③钾的细胞内转移。如家族性周期性四肢麻痹、肌无力症、给予大量葡萄糖等。 ④肾上腺皮质功能亢进。如醛固酮增多症。 ⑤碱中毒。 ⑥药物作用:a.长期使用大量肾上腺皮质激素,如可的松、地塞米松等;b.使用
降低 ①丢失过多。如严重呕吐和腹泻;大量使用利尿等 ②钠的摄入量不足。如饥饿、营养不良、低盐疗法等。 ③酸中毒 。
增高 ①肾上腺皮质功能亢进症。如柯兴综合征、原发性醛固酮增多症。 ②高渗性脱水症。 ③钠进量过多。如注射高渗盐水或进食过量钠盐,且伴有肾功能失常时。 ④潴钠性水肿。常见于心脏病、心力衰竭、肝硬化、肾病等。
和待测液(Es),根据以下公式计算:
Ex –Es = K 2.303RT
nF
lg a i
3. 标准加入法:适用于体系复杂,且与标准液浓度有较大
差异的待测液。先测定体积为Vx、浓度为Cx的待测液电动
势E,然后在此溶液中加入体积为Vs的标准液,测量电动势
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
RT E jSCE jm K'2.303 F pH
18:25:20
2. 实际测定
由于K′未知,所以在实际测定时采用的方法应能将K′消除 方法:酸度计校正
RT ES K'2.303 F pHS
EX
K'2.303
RT F
pH X
pH X
pH S
EX ES 2.303RT /
F
18:25:20
• 常用标准缓冲溶液(用于pH计校准)
缓冲溶液 饱和酒石酸氢钾 ( 0.034 mol·kg-1 ) 邻苯二甲酸氢钾 ( 0.050 mol·kg-1 )
0.025 mol·kg-1 KH2PO4 + 0.025 mol·kg-1 Na2HPO4 硼砂 ( 0.010 mol·kg-1 )
18:25:20
5. 电极电位的测量
基本的参比电极:标准氢电极 j 0 IUPAC规定:任何电极的电极电位,是它与标准氢
电极构成原电池,所测得得电动势作 为该电极的电极电位。
18:25:20
二、液│液接界电位(液接电位)
1.产生
CA CB(不同物质) 接触
CA1 CA2(同种物质不同浓度)
相间双电层
阳极:H2 2H++2e 阴极:AgCl Ag+ + Cl-
Ag+ + e Ag
阳极:发生氧化反应的电极
18:25:20
阳极:Zn Zn2++2e 阴极:Cu2++2e Cu
阴极:发生还原反应的电极
电池的电动势
Ecell = jc – ja jc阴极的电极电位 ja阳极的电极电位
Ecell>0 电池反应能自发进行(原电池) Ecell<0 电池反应不能自发进行(电解电池)
H+(水相)+ Na+Gl-(玻璃相) Na+(水相)+ H +Gl-(玻璃相) Gl-:玻璃相中不能迁移的硅酸基团,称为交换点位(定域体)
18:25:20
浸到待测pH的溶液中
H +Gl-(水化层) H+(溶液相)+ Gl-(水化层)
1. 膜电位 溶液中的H+与玻璃膜水化层中的H+发生交换作用而产生的电位
相间电位差jj
2. 基本原因 两相之间正负离子扩散速度不同
C1 0.1M
H+ Cl-
C2 0.01M
H+ Cl-
a
18:25:20
C1 0.1M
C2 0.01M
H+
-+
H+
Cl-
Cl-
b
产生的电场 会加速Cl-的 扩散速度
C1 0.1M H+
Cl-
C2 0.01M - + H+ -+ - + Clc
j
j
RT nF
ln
aaAabB apPaqQ
R:气体常数 8.314 J·mol-1·K-1; F:法拉第常数 96485C/mol
n:参加反应的电子数;
T:绝对温度,单位为K。
j:标准电极电位。 aA:A组分的活度,a=gC,g:活度系数
18:25:20
T=298.15 K时:
j
j
0.0591lg n
2.303RT a(H , 试)
2.303RT
jm F log a(H ,内) K F pH 试
18:25:20
T= 25℃ 时
jm K 0.0591pH
2. 存在碱金属离子
jm
K
RT F ln[aH
K
a Pot
H,M M
)
pH玻璃电极对M+的电位选择性系数
18:25:20
二、原理
1. 指示电极和参比电极
(自学)
第三类电极 离子选择性电极:电位值与溶液中给定离子活度的对数有线性关系。 (无电化学反应)
18:25:20
四、指示电极与参比电极
1. 指示电极
指示被测溶液中某一离子浓度的电极 如:pH玻璃电极(H+) F-选择电极(F-)
2.参比电极
电位不受试液组成变化的影响而且具有较恒定数值的电极 如:饱和甘汞电极(SCE),银-氯化银电极(Ag/AgCl)。
第八章 电位分析法与离子 选择性电极
Potentiometry and Selective Electrode
18:25:20
§1 概述
常用仪器:
毫伏计 指示电极 参比电极 电磁搅拌器 滴定管
18:25:20
§2 基本概念
一、电极电位
1.电极 :
由金属与溶液组成的两相体系。表示为(金属│溶液)
Cu│Cu2+
aaAabB apPaqQ
如:MnO4- + 8H+ + 5e Mn2+ + 4H2O
jMnO4 / Mn2
j
M
nO
4
/
Mn2
0.0591lg
a a8
M
nO
4
H
5
aMn2
18:25:20
5. 化学电池 由两个电极组合在一起构成一个回路
无液|液接界的电池
{ 分类 有液|液接界的电池
Pt│Fe3+,Fe2+
2. 电位j(potential) j W q
某一点的电位在数量上是单位正电荷在真空中从无限 远处缓慢地移动到该点所做的功
18:25:20
3. 电极电位
由于金属与溶液两相界面上存在双电层而产生的电位
4. 能斯特方程(Nernst Equation)
电极反应:aA + bB + …… +ne = pP + qQ + ……
pH>9 jm↑ → pHlab↓
18:25:20
2. 酸差
pH<1 时,pHlab> pHture 正偏差 pH<1 aH2O↓ → jm ↓ → E ↑ → pHlab ↑ 普通pH玻璃电极的适用范围为1~9
3.减小jj
使用盐桥:把KCl或NH4NO3的饱和溶液加入琼脂制成凝胶
盐桥能减小φj的原因:
(1)饱和KCl或NH4NO3的浓度高, Cl- K+ 阴、阳离子大量存在
Cl-K+
(2)阴、阳离子扩散速率接近。
18:25:20
三、电极的类型
基于电子交换反应的电极 (有电化学反应)
零类电极 第一类电极 第二类电极
18:25:20
§2. pH值的测定
指示电极:pH玻璃膜电极 参比电极:饱和甘汞电极
一、pH玻璃电极 <一>、构造
{ 玻璃膜:22% Na2O,6%CaO,72% SiO2 内参比电极:Ag/AgCl 电极 内参比溶液:一定pH值的缓冲液 (内充溶液) 18:25:20
<二> 电极电位
pH玻璃电极使用前必须在水中浸泡24小时以上, 使玻璃膜表面形成水化层
饱和氢氧化钙
pH (25oC)
3.557 4.008
6.865
9.180 12.454
标准缓冲溶液的pH是实验测定的,计算时应做活度校正.
18:25:20 19
三、碱差和酸差 1. 碱差
pH>9 时,pHlab< pHture 负偏差
E
jSCE
jm
K'
RT F ln[aH
K
a Pot
H,M M
]
