第四章 有色冶金动力学
最新整理、冶金原理(赵俊学主编)教案:第四章冶金熔体(加工制造类)钢铁冶炼)

最新整理、冶⾦原理(赵俊学主编)教案:第四章冶⾦熔体(加⼯制造类)钢铁冶炼)第四章冶⾦熔体4.1 概介许多⾼温冶⾦过程都是在熔融的反应介质中进⾏的——如炼钢、铝电解、粗铜的⽕法精炼等在很多冶炼过程中,产物或中间产品为熔融状态物质——如⾼炉炼铁、硫化铜精矿的造锍熔炼、铅烧结块的⿎风炉熔炼等冶⾦熔体——在⾼温冶⾦过程中处于熔融状态的反应介质或反应产物冶⾦熔体的分类——根据组成熔体的主要成分的不同→⾦属熔体→熔渣→熔盐⾮⾦属熔体→熔锍4.2⾦属熔体⾦属熔体——液态的⾦属和合⾦如铁⽔、钢⽔、粗铜、铝液等⾦属熔体不仅是⽕法冶⾦过程的主要产品,⽽且也是冶炼过程中多相反应的直接参加者。
例如,炼钢中的许多物理过程和化学反应都是在钢液与熔渣之间进⾏的。
⾦属熔体的物理化学性质对冶炼过程的热⼒学和动⼒学都有很重要的影响。
4.2.1 ⾦属熔体的结构基本事实⾦属的熔化潜热仅为汽化潜热的 3%~ 8%对于纯铁,熔化潜热为 15.2 kJ·mol-1,汽化潜热是 340.2 kJ·mol-1 →液态⾦属与固态⾦属的原⼦间结合⼒差别很⼩⾦属熔化时,熵值的变化也不⼤,约为 5~ 10 J·mol-1·K-1→熔化时⾦属中原⼦分布的⽆序度改变很⼩。
熔化时⼤多数⾦属的体积仅增加 2.5%~ 5%,相当于原⼦间距增加0.8%~ 1.6%→在液态和固态下原⼦分布⼤体相同,原⼦间结合⼒相近。
⾦属液、固态的⽐热容差别⼀般在 10%以下,⽽液、⽓态⽐热容相差为 20%~ 50%。
→⾦属液、固态中的原⼦运动状态相近。
⼤多数⾦属熔化后电阻增加,且具有正电阻温度系数。
→液态⾦属仍具有⾦属键结合结论 I在熔点附近液态⾦属和固态⾦属具有相同的结合键和近似的原⼦间结合⼒;原⼦的热运动特性⼤致相同,原⼦在⼤部分时间仍是在其平衡位(结点)附近振动,只有少数原⼦从⼀平衡位向另⼀平衡位以跳跃⽅式移动。
基本事实 II液态⾦属中原⼦之间的平均间距⽐固态中原⼦间距略⼤,⽽配位数略⼩,通常在 8~ l0 范围内→熔化时形成空隙使⾃由体积略有增加,固体中的远距有序排列在熔融状态下会消失⽽成为近距有序排列。
冶金动力学

冶金动力学 概述
五 冶金动力学的研究方法(建立动力学模型 的方法)
◆建立动力学模型需要注意的几个问题。 ◆建立动力学模型的通用规则。
冶金动力学 概述
六 冶金动力学的数据库的应用
◆国外:
KINDAS
◆国内:IDMSKM
( Intelledualiged database management system on kinetics of metallurgy ) 化学》P358-372
冶金反应动力学基础*
一、化学反应动力学
核心内容:反应速率和反应机理 主要内容:各级反应速率方程,阿氏方程,有关计算 1.反应速率定义和反应速率方程 (1)反应速率定义 dnB νB B 化学反应:0 ,反应进度:dξ
B
νB
转化速率:单位时间化学反应的反应进度的变化:
dξ 1 dnB ξ dt ν dt B
H 2 1 2O2 H 2O( l ) 点火,加温或催化剂
C + O2 = CO2(g)
点火,加温
冶金动力学 概述
•扩散与传质过程比化学反应慢,往往构成 冶金反应的限制环节。因此,冶金动力学 研究必然涉及动量传递、热量传递和质量 传递等问题。 •目的:找出影响反应速率因素,选择合适 的反应条件,控制反应使之按照人们期望 的速率进行。
微分法
cA
cA
t
由
c A t 图求反应速率 dc A / dt
t
有时反应产物对反应速率有影响,为了排除产物的 干扰,常采用初始浓度法(上右图)。
冶金反应动力学基础
温度对反应速率的影响 范特霍夫(van’t Hoff)规则 范特霍夫根据大量的实验数据总结出一条 经验规律:温度每升高10 K,反应速率近似增 加2∽4倍。这个经验规律可以用来估计温度对 kT 反应速率的影响。 10K
冶金过程动力学导论

冶金过程动力学导论
冶金过程动力学是一门研究冶金过程中反应动力学规律与机理的学科,它涉及多种领域,包括物理化学、材料科学、热力学等。
冶金过程动力学主要关注的是控制金属在冶炼过程中的变化过程,从而实现冶炼过程的优化和控制。
在冶金过程中,反应动力学起着至关重要的作用。
反应动力学研究的是反应速率和反应机理,以及反应条件对反应速率和反应机理的影响。
反应速率是指单位时间内反应物浓度变化的速率,其大小决定了反应的快慢。
而反应机理则是指反应过程中各个步骤和反应产物的形成路径,了解反应机理和速率对于冶金工艺优化和炉料控制极为重要。
常见的冶金过程动力学反应包括金属与非金属元素的化学反应、金属之间的化学反应、固态反应以及气相反应等。
在冶金过程中,重要的反应有铁矿石还原、碳酸钙分解、焦炭氧化等。
掌握这些反应的动力学规律,对于调节炉料组分、掌握反应动力学规律都有着极为重要的意义。
综上所述,冶金过程动力学的研究可以为冶金工艺提供基础支撑和科学指导。
冶金过程的优化和控制,离不开对反应动力学规律和机理的深入研究。
《冶金是怎样炼成的》每章主要内容

《冶金是怎样炼成的》每章主要内容冶金是怎样炼成的
第一章:冶金概述
本章主要介绍冶金的定义和基本原理。
冶金是一门研究金属的提取、加工和利用的科学。
它涉及了矿石的选矿、冶炼过程和金属制品的加工等内容。
第二章:矿石的选矿
本章主要讲述了矿石的选矿过程。
选矿是指通过物理或化学方法,将矿石中的有用矿物与无用矿物分离,以达到提取有用矿物的目的。
本章介绍了常用的选矿方法和设备,并简要介绍了选矿过程中的一些关键技术。
第三章:冶炼过程
本章主要介绍了冶炼过程。
冶炼是将选矿后的矿石通过加热、还原等方式,将其中的金属提取出来的过程。
本章详细描述了冶炼的几个主要步骤,包括矿石的熔炼、转炉炼钢和电解精炼等技术。
第四章:金属制品的加工
本章主要介绍了金属制品的加工过程。
金属制品的加工是指将冶炼后的金属通过锻造、轧制、焊接等方式,将其转化为各种需要的形状和尺寸的过程。
本章讲解了不同类型金属制品的加工方法和相关设备。
第五章:冶金应用与发展
本章主要探讨了冶金在现代社会中的应用和发展趋势。
在这个章节中,我们介绍了金属的广泛应用领域,如建筑、交通、航空航天等,并讨论了冶金技术的发展方向和未来可能的突破。
以上为《冶金是怎样炼成的》每章的主要内容概览,详细内容请参考原文。
冶金动力学

绪论
•氧化物(球团)还原过程动力学; •冶金反应器中的混合、流动和传质。
化学反应动力学
§1 化学反应速率与浓度关系
1.1基元反应
一个化学反应方程式仅仅表示反应的初态和末态,即只表明反应的 原始物是什么,产物是什么以及反应的计量系数。至于反应的机理如 何,由反应物变为产物的过程中,要经过什么步骤,这从反应式是看 不出来的。 事实上,化学反应一般多是由若干个简单步骤-基元反应组成的。
n 1
半衰期公式
t1/ 2
2 n 1 1 n 1 (n 1)kCA 0
n 1
注意:k量纲与反应级数有关, mol(1n ) m3( n 1) s 1
化学反应动力学
§2 反应级数的测定
反应级数要由实验确定。首先应通过物理或化学方法测出一系列 浓度和时间关系的实验数据,然后再按以下方法处理。 1)积分法 将几组实验数据分别代入零级、一级、二级、…等反应的积分式 中,计算出k值。如某公式计算得到的k值基本守常,则该公式的 级数就是反应级数。 如果不论哪一公式计算得到的k值都不守常,则该反应一定是不 能用整数级数表示的复杂反应。
k物理意义:单位反应物浓度时的化学反应速率。 k与浓度无关;但是温度的函数。
1/k:化学反应的阻力。
a b C 推动力 a b AC B r kCACB 1/ k 阻力
化学反应动力学
质量作用定律只能用于基元反应。而实际发生的大部分反应为非基元 反应,或不能确定为基元反应,怎么办? 处理方法:外推法(借助质量作用定律的数学形式) 对一般反应 可写成通式 化学反应级数: aA + bB gG
CA
CA
C A0
CA0 kt
特征1 t
有色冶金原理

表 4.1 各种气态硫在不同温度下及P总=101325 Pa时的分压(Pa)
图 4.1 各种硫化物的离解压对数与温度关系曲线
图 4.2 硫化物的吉布斯自由能图
表4.2 一般的Me-S-O系中的反应及平衡关系式
图4.3 Me-S-O系等温平衡图
表4.3 Cu-S-O系标准吉布斯自由能数据
硫化物比氧化物容易氯化
思考题
1、什么是氯化冶金,基本过程及主要方法有哪些? 2、理解氯化物的∆Gᶱ~T关系图意义; 3、金属氧化物氯化时为何需要加入还原剂?写出氯化时加C 反应的原理; 4、金属硫化物的氯化过程为何较其氧化物容易? 5、NaCl作为氯化剂时,对金属硫化物和金属氧化物的氯化程 度如何,工业上如何操作? 6、能否用碳、氢作还原剂来还原其他金属氯化物?
图4.8 S-O系吉布斯自由能图
着火温度并非一定值,而与硫化物的颗粒大小有关。 硫化物氧化过程影响因素: 1、温度; 2、颗粒外表面的固体反应物膜层的厚度及致密程度; 3、物料的物料化学性质。粒度、孔隙度; 4、气流中O2、SO2、SO3的浓度等。
表4.8 某些硫化物的着火温度与其颗粒大小的关系
方法及分类
方法: 第一步,使均匀的熔融粗金属中产生多相体系(如金 属-渣,金属-金属,金属-气体); 第二步,把上述产生的各两相体系用物理方法分离 。 分类: (l) 金属一法系; (2) 金属一金属系: (3) 全属一气体系。
• •
• • •
第五章 氧化物和硫化物的火法氯化
金属氯化物与相应金属的其它化合物比较,大都具有低熔 点、高挥发性和易溶于水等性质,因此将矿石中的金属氧化 物转变为氯化物,并利用上述性质将金属氯化物与一些其它 化合物和脉石分离。 氯化冶金 就是将矿石(或冶金半成品)与氯化剂混合,在一定条件下 发生化学反应,使金属变为氯化物再进一步将金属提取出来 的方法 氮化冶金主要包括氯化过程、氯化物的分离过程、从氯化 物中提取金属等三个基本过程。 • 在多数的冶金原料中,金属并非以氯化物形态存在,因此 从原料中制取金属氯化物的氯化过程,是氯化冶金最基本 和最重要的过程。
冶金动力学及习题

(2-1-8)
v是不依赖于反应空间大小的强度性质,单位为 。
由于 (2-1-9)
所以 (2-1-10)
为反应体系中B的物质的量浓度。(2-1-8)变为
(2-1-11)
若对体积一定的气相反应器和体积变化可以忽略的液相反应器
(2-1-12)
1.1.2
零级反应
反应方程 (2-1-13)
当t→∞,反应达平衡,x=a。由于反应平衡时,正、逆反应速率相等。由上式得出
k1(cA0-a)─k─1(cB0+a)=0(2-1-27)
解方程式(2-1-27)得
a= (2-1-28)
将(2-1-26)整理,得
(k1+k─1)( -x)(2-1-29)
将(2-1-28)代入,得
(k1+k─1)(a -x)(2-1-30)
k1
B
A(2-1-32)
C
k2
设反应开始时,t=0,A物质的起始浓度为cA0, B、C物质的起始浓度皆为零。
t=t时,A物质浓度变为cA=cA0-x(x为已消耗的A的浓度),按反应的独立性原理,反应速率以A的消耗速率表示时,得到
k1(cA0-x) +k2(cA0-x)(2-1-33)
= (k1+k2) (cA0-x)
阿累尼乌斯公式的微分形式为
(2-1-46)
阿累尼乌斯公式积分式为
(2-1-47)
式中,[k]表示k的单位,[A]为A的单位,故k/[k]、[A]/A皆为无因次数。
图2-1-1由阿累尼乌斯公式求活化能及指前因子
根据阿累尼乌斯的结论,对于如下简单的一级基元反应
AB(2-1-48)
在微观上也经历了如下两个步骤:
有色冶金化学热力学手册

,围绕“色冶金化学热力学手册”主题
色冶金化学热力学手册是专业的参考资料,其涵盖了有色金属的各种
化学和物理性质以及物理化学和热力学的基本原理。
它首先介绍有色
金属的形成及其各类成分的基本情况,然后根据有色金属的各类化学
及物理性质,利用相关生产技术对它们进行详细介绍,以教给技术人
员正确运用有色金属的知识。
有色金属化学热力学手册记载了有色金属在各种场合中的性质和特征,以及它们在几何结构、物质性质和化学结合方面的区别。
此外,它还
记载了有色金属的化学行为,及其材料的影响因素,这使技术人员更
好地了解有色金属中的各种元素,并预测更精确的性能。
有色金属化学热力学手册还讨论了热力学理论,其可以用来研究物质
反应过程中发生的物理和化学变化。
此外,它还提供了有关计算物性
参数的信息,从而可以帮助技术人员在计算机和电子字典中寻找更可
靠的信息。
总之,色冶金化学热力学手册是一本独特而全面的参考资料,可以帮
助技术人员更好更有效的利用和操作有色金属,使技术应用实现了优化。
有色金属冶金课件

智能化冶金的发展
智能冶金工厂
利用物联网、大数据、 人工智能等技术,构建 智能化的冶金工厂,实 现生产过程的自动化和 智能化。
智能化生产管理
通过智能化技术对生产 过程进行实时监控、分 析和优化,提高生产效 率和产品质量。
智能化设备与装备
研发智能化的冶金设备 和装备,提高设备的自 适应性和可靠性,降低 故障率。
采用高效除尘器、脱硫脱硝技术等手段处理冶金过程中的废气, 减少大气污染物的排放。
废水处理技术
采用物理、化学、生物等多种方法处理冶金废水,降低废水中有害 物质的含量,实现废水循环利用或达标排放。
固体废弃物资源化利用
通过回收、加工、再利用等手段,将冶金固体废弃物转化为有价值 的资源,减少对环境的压力。
可持续发展在有色金属冶金中的应用
有色金属冶金课件
目录 Contents
• 有色金属冶金概述 • 有色金属的提取与精炼 • 有色金属的加工与利用 • 有色金属冶金的环保与可持续发展 • 有色金属冶金的新技术与展望
01
有色金属冶金概述
定义与分类
定义
有色金属冶金是从矿石或精矿中提取 、纯化和加工有色金属的科学和技术 。
分类
根据金属的性质和用途,有色金属冶 金可以分为轻金属冶金、重金属冶金 、稀有金属冶金和贵金属冶金等。
冶金过程的基本原理
矿石的分解
01
通过物理或化学方法将矿石分解,使其中的金属与脉石分离。
金属的提取
02
采用还原、氧化或酸碱溶解等方法,将矿石中的金属从其化合
物中还原或溶解出来。
金属的精炼
03
通过电解、蒸馏、萃取等方法,将粗金属进一步提纯为高纯度
金属。
02
有色冶金概论复习

复习重点(绪论和有色金属冶金部分)重点章节【第四章3、4、7】、【第五章2】、【第六章1、2、3、4、6、7】【第七章(1-5、1-6)小节、(2-2、2-3 )、3、4】【第八章1-2、2-2】【第九章3、6】一、名词解释:1.拜耳法答:拜耳法是直接利用含有大量游离苛性碱循环母液处理铝土矿,溶出其中氧化铝得到铝酸钠溶掖,井用加氢氧化铝种子(晶种)分解的方法,使铝酸钠溶液分解析出氢氧化铝结晶。
种分一母液经蒸发后返回用于溶出铝土矿。
2.冰铜答:冰铜为金属硫化物的熔体,主要成分是Cu2S和Fe S,此外还有Pb S、Ni3S2、Zn S等以及少量的金属氧化物Fe3043.重金属答:一般指密度在5t/m3以上的金属。
4.矿石答:含有用矿物的矿物集合体,如其中金属的含量在现代技术经济条件下能够回收加以利用时,这个矿物集合体就叫做矿石。
5.有色金属:狭义的有色金属又称非铁金属,是铁、锰、铬以外的所有金属的统称。
广义的有色金属还包括有色合金。
6.铝硅比:指铝土矿中的氧化铝和二氧化硅的质量比,即A/S= AI2O3/ SiO2。
7•电解精炼;在直流电的作用下,阳极不断溶解,阴极不断析出,杂质被留在溶液中的电化学过程。
8•还原熔炼;在高温下,在还原气氛下所进行的熔炼。
9•造锍熔炼;在一台高温冶金设备中,含有硫的炉料及燃料和熔剂,在和氧的反应过程中,生成含二氧化硫的烟气、氧化物融合体的炉渣、以及金属硫化物的融合体的冰铜的过程。
10氧位、磷位、分解压、熔析精炼、萃取精炼、氧化精炼、硫化精炼、浸出、净化、沉积、简答题:1•什么是冶金,其目的是什么?冶金是研究如何经济地从矿石或其他原料中提取金属或金属化合物,并采用各种加工方法制成具有一定性能的金属材料的科学。
冶金的目的就是把所要提取的金属从成分复杂的矿物集合体中分离出来并加以提纯。
2.简述冶金(学科)的分类。
冶金学分类:提取冶金学和物理冶金学提取冶金学:研究提取金属,存在化学反应。
冶金过程动力学
p静=lgh
2 cos rmax gh
l
14
气液相部分主体思路
2[N] N2 2[H] H2 2[O] O2 [C]+[O] CO
N2 H2 O2 CO 钢液
气泡
[N] [O] [C] [H]
钢液边界层内扩 散是控制环节
(1)氧、碳等穿过钢液边界层扩 散到气泡表面,即
[O][O]s, [C][C]s, [H][H]s, [N][N]s等
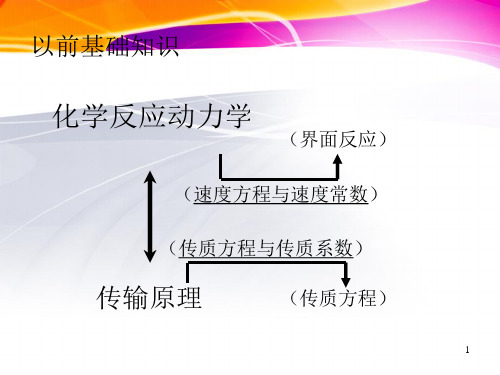
以前基础知识
化学反应动力学
(界面反应)
(速度方程与速度常数)
(传质方程与传质系数)
传输原理
(传质方程)
1
基本概念
化学反应: AA BB YY ZZ
反应物 i 0 ;生成物 i 0 。
反应进度:
ni nio i
反应速率:
•
d
dt
1
i
dni dt
or
v 1 • dci
i dt
• (1)[A] 由金属液内穿过金属液一侧边界层 向金属液-熔渣界面迁移;
• (2)(Bz+)由渣相内穿过渣相一侧边界层向熔 渣-金属液界面的迁移;
• (3)在界面上发生化学反应 ; • (4)(Az+)*由熔渣-金属液界面穿过渣相边界
层向渣相内迁移;
• (5)[B]* 由金属液/熔渣界面穿过金属液边界 层向金属液内部迁移。
C+O2=CO2
氧化物还原 反应
CO CO2
反 气层 生 应 体成界 边物面 界 层
MO+CO=M+CO2
10
抽象化--未反应核模型
(1)反应物致密的 ,产物层 多孔; (2) 扩散速度 << 化学反应速度。
冶金动力学研究方法

根据热力学分析,在还原性气 氛中,铁氧化物将逐级还原: Fe2O3→Fe3O4→FeO→ Fe
区域化学反应速率变化特征
一、收缩未反应核模型
◇ 完整的气(液)—固反应通式:
◇
aA(s) + bB(g, l) = eE(s) + dD(g, l)
◇ 收缩未反应核模型(图13-1)
◇ 反应物A为致密的固体;
二、水模型模拟研究方法
1.混匀时间的测定
(混匀时间的研究分为冷态和热态两类,冷态研究通常在水模型中进行,热态研究是在冶金容器 内的钢液中加入示踪剂来测量混匀情况。) (1)电导法 将KCl溶液瞬时注入水模型容器内的水中,连续测量水中的电导率变化,直至电导率稳定时即为 完全混匀时间。 (2)PH法 试验时在水中加入H2SO4做示踪剂,以确定混匀时间。
➢ 冶金过程速率及机 理的研究要求在化 学反应动力学基础 上,研究流体的流 动特性、传质和传 热的特点等对过程 速率的影响,这部 分内容又称为宏观 动力学。
3
反应阻力
◆ 冶金反应通常由一系列步骤组成。 ◆ 每一步骤都有一定的阻力。 ◆ 对于传质步骤,传质系数的倒数1/kd相当于这一步骤的
阻力。 ◆ 对于界面化学反应步骤,反应速率常数的倒数l/k,相当
冶金动力学研究方法
冶金反应动力学基础
研究方法
1
动 力 学
1
动力学研究的内容: 探讨反应的速率和机理
2
冶金动力学研究的目的:找出冶金传输问题对 反应速率的影响,以便选择合适的反应条件控
制反应,使之按照人们的期望进行。
2
冶金动力学包括:微观动力学和宏观动力学
微观动力学
宏观动力学
➢ 研究冶金动力学首先 要了解化学反应动力学 基础,如化学反应速率 与浓度的关系、与温度 的关系等。这种在理想 条件下(例如温度恒定) 研究化学反应进行的速 度和机理的内容称为化 学反应动力学或称为微 观动力学
有色金属冶金学(每章重点内容小结)..

第一章氧化铝的生产
衡量铝土矿的质量标准? 答:衡量铝土矿的质量标准是铝硅比,即铝土矿中的氧化 铝与氧化硅的重量比。 4. 单流法 双流法 答:单流法是指将循环母液和铝土矿一起磨制成原矿浆进行预 热溶出的方法。 双流法是指仅将一部分循环母液送去磨制原矿浆,大部分 循环母液单独预热到溶出温度,然后再于溶出器内与浓稠 原矿浆进行混合溶出的方法。 3.
22
第一章氧化铝的生产
25 简述二段脱硅的工艺流程?
粗液 一段常压脱硅 底流
合成含钙添加剂
分 离 溢流 二段常压脱硅 底流 分 离 溢流 去叶滤
ቤተ መጻሕፍቲ ባይዱ
去烧结法配料 或处理后弃之
返回晶种或去拜耳 法溶出系统
23
第一章氧化铝的生产
26铝酸钠溶液的碳酸化分解与加晶种分解有何区别?
其特点是什么?
答: 1)苛性碱中和: 2)氢氧化铝结晶过程:
铝土矿中部分氧化铁还原成FeO和FeS,可以减少配料中碱的配比, 无必要使Fe2O3全部与Na2O结合,故可降低碱耗。
加入还原剂能强化烧结过程,因为生料加入的煤在窑内燃烧带以前
燃烧,等于增加了窑的燃烧空间,提高窑的发热能力。
17
第一章氧化铝的生产
19 熟料回转窑内一般分几个带?各带的主要作
用是什么?
黄料、欠烧结、欠烧结温度
2
第一章氧化铝的生产
什么是铝土矿?铝土矿的主要化学成分有哪些?其中有害 的杂质有哪些? 答:铝土矿是一种以氢氧化铝矿物为主的成分复杂的岩石,主 要化学成分有Al2O3、SiO2、Fe2O3、TiO2 ,其中有害 的杂质有SiO2、Fe2O3、TiO2 。 2. 含铝矿物主要有哪些种类? 答:按铝土矿的矿物成分分:三水铝石型铝土矿、一水软铝石 型铝土矿、一水硬铝石型铝土矿、混合矿;按铝土矿矿石 结构特点分:粗糙状铝土矿、致密状铝土矿、豆鲕状铝土 矿;按铝土矿地质成因分:海相沉积型铝土矿、陆相沉积 型铝土矿、玄武岩风化壳型铝土矿。 1.
有色金属冶金原理(第四章)

有色金属冶金是将矿石中的金属元素提取出来的过程。在这个章节中,我们 将讨论有色金属冶金的基本原理、工艺流程、常见设备和技术,并展望未来 的发展趋势。来自 有色金属的分类和特点分类
有色金属由于具有强导电、 导热、韧性、延展性等特点, 被广泛应用于建筑、电子、 航空及航天等领域。
重要的冶炼设备和技术
冶炼设备
冶炼技术
常见的冶炼设备包括高炉、转炉、 电炉、热风炉等。
包括火法冶炼、湿法冶炼、电解 法冶炼等多种技术。
精炼技术
火法、湿法、电解、气体渗入法 等精炼技术可以将金属的纯度达 到99.9%以上。
有色金属冶金行业的发展与应用
1 经济发展
随着经济的发展,有色金属市场需求不断增长,在建筑、电子、汽车等行业的应用得到 广泛应用。
特点
与黑色金属相比,有色金属 的氧化、腐蚀较慢,这也使 得它们适合用于耐久性要求 较高的环境中。
应用
铜、铝、镁、镍、钴、锌等 常见有色金属在现代工业中 普遍应用。
有色金属冶炼的基本原理
1
提高金属纯度
利用还原剂和高温进行冶炼,提高金属
去除杂质
2
的纯度。
通过化学反应、重力分离等手段去除其
中的杂质成分。
产业升级
从单一产品制造,向绿色、高 效、多元化的方向发展。加强 能力水平提升,促进产业升级。
创新发展
在技术、设备、工艺等领域加 快创新步伐,推动有色金属冶 炼向更高水平发展。
2 绿色化发展
绿色、低碳的冶金技术将成为未来的趋势,有色金属冶炼将逐渐转向绿色、高效的方向。
3 新材料发展
有色金属的合金、复合材料等在医疗、航空航天等领域有广泛的应用前景。
未来有色金属冶金的趋势与展望
金属冶炼中的冶金反应动力学模型

优化资源利用
动力学模型有助于合理利用原材料、 能源和其他资源,提高资源利用效率 。
资源利用效率提升
提高金属回收率
通过优化冶金反应过程,可以更有效地提取和回收金属,降 低资源浪费。
降低副产品处理成本
动力学模型有助于优化副产品的处理和利用,降低处理成本 和提高经济效益。
05
冶金反应动力学模型的挑战 与解决方案
减少能耗和排放
动力学模型有助于优化能源消耗和减少废气、废水的排放,降低生产过程中的 环境污染。
过程控制
实时监测
利用动力学模型可以对冶金反应过程进行实时监测,及时发现异常情况并进行调 整。
自动化控制
基于动力学模型的算法可以用于自动化控制系统,实现冶金过程的自动优化控制 。
新工艺开发
探索新反应路径
通过模拟冶金反应的动力学过程,可 以探索新的反应路径和工艺条件,为 新工艺的开发提供理论支持。
参数。
02
在冶金反应中,通过实验测定反应级数可以了解反应
速率与各反应物浓度的关系。
03
根据反应级数,可以进一步分析反应机理和优化反应
条件,例如通过改变原料配比来提高冶炼效率。
阿累尼乌斯方程
01
阿累尼乌斯方程是一个用来描述化学反应速率与温度关系的数 学模型。
02
在冶金反应动力学模型中,阿累尼乌斯方程可以用来预测不同
发展趋势
未来,随着人工智能和大数据技术的应用,冶金反应动力学模型将更加智能化和自适应化。
02
冶金反应动力学模型的核心 概念
反应速率
1
反应速率描述了化学反应的快慢程度,通常用单 位时间内反应物浓度的减少或生成物浓度的增加 来表示。
2
在冶金反应中,反应速率决定了冶炼过程的速度 和效率,是反应动力学模型研究的重要内容。
冶金动力学绪论

冶金物理化学研究所 中南大学冶金科学与工程学院
冶金动力学研究的主要内容
讨论冶金生产中的某些类型反应的动力学规律。 主要是多相反应动力学。
但不局限于冶金方面,只是更多的以冶金为例。例 如:很多材料的制备(效能品质的改善)。 与冶金不同的是材料更强调性能,化学品则强 调纯度。 球形Ni(OH)2:NiSO4+NaOH→Ni(OH)2↓ 要达到Ni(OH)2的结构,主要是制备过程,而 制备过程与动力学有关。
③课程内容:
基元反应动力学(简)→建立动力学方程的方法 →传质和非均相反应 不局限于某一方程的求解及推导,而是怎样建立方程,为什么建立方 程?
涉及的参考书: 1. 莫鼎诚,冶金动力学(教材)(本讲义主要参考 书)。 2. 哈巴斯,冶金原理丛书
3. Wadsworth:Rate Phenomene
4. 北京钢铁学院,韩其勇,冶金过程动力学 5. Sohn H.Y.著,郑蒂基译,提取冶金速率过程 6. J Szekely Sohn H.Y. Gas-Solid Reaction
目的:高效实现冶金反应(强化冶金过程)
提高产品品质
Hale Waihona Puke ②分类:i.微观反应动力学 对象:原子 分子 手段:建立在理论基础行的统计力学、量子力学 实验研究:创造最理想条件(均相、充分接触、T、P、C 均 匀) ii.宏观反应动力学(多相反应动力学、工业反应动力学) 对象:多相的物质+反应器 手段:“三传(传质、传热和动量传递)”
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四章有色冶金动力学液—固反应的动力学的研究在有色冶金生产中占有非常重要的地位。
它包括凝固、区域熔炼、熔析精练,也包括湿法冶金中的浸出、净化、沉淀等过程。
它与气—固反应的动力学同属流—固反应动力学的范畴,因此气—固反应中的数学模型及某些动力学规律,在液—固反应动力学的研究中仍然适用,但也有本身固有的特点。
本章的主要内容是讨论在浸出和沉淀过程中的液—固反应动力学的若干规律。
4.1漫出过程动力学采用适当的溶剂,把金属从精矿中或矿石中提取出来,并且把所得的溶液从不需要的物料中分离开来的过程称之为浸取或浸出过程。
对于既不适于选矿,又不适于熔炼的低品位矿石特别适合。
表4-1列出了浸出过程的若干实例。
浸出是浸出溶剂与固相反应的复杂多相反应过程。
浸出的速度以单位时间内转移到溶液中的物质的量(或单位时间闪所消耗的反应物的量)来表示。
它与反应物的浓度、温度、搅拌速度、固相的表面积等许多因索有关,而这些因素在浸出过程中可能发生变化。
浸出过程的速度一般可用下式表示:dG/dt=—J S (4-1) G——固相中被浸出物质的量;J——单位时间内从单位固相表面积上转移到溶液中的被浸出物质的量;S——液相和固相组份交互反应的面积。
表4-1浸出过程的实例浸出过程的反应一般表示是:ɑA(固)+bB(液)⇌cC(固)+dD(液)例如用碳酸钠溶液对重钨酸钙的浸出:CaW04(固)+Na2C03(液)⇌Na2WO4(液)+ CaC03(固)过程包括了下列阶段:①经过固体表面上的液膜层,液相中的反应物向固相表面的扩散传质;②反应物经过固相产物层或残留的不被浸出的物料层的扩散传质;③在被浸出物表面上的化学反应;④被溶解物经固相产物层由反应表面向外扩散;⑤被溶解物经过固相表面上的液膜层向溶液内扩散。
这些过程如图7-l所示。
这里假设液-固相间的反应是由表面向中心发展。
在浸出完成之前,在颗粒小心有未反应核.而在其周围有固相产物层存在。
如果在浸出时没有固相产物形成,则阶段②与④就不复存在。
但当被浸出的固相反应物分散在惰性物料(如石英岩)中,即使没有新的固相产物生成,由交互反应所形成的溶解性产物还必须通过惰性物料层扩散,因此过程仍然包括了上述五个阶段。
和气-固反应销情况不一样,液-固反应中的非等分子逆向扩散中所产生的流体流动不影响到传质速度。
假设浸出过程的各个阶段是相互串联的,阻力加和定律仍然适用,即式中J 为固相反应物的比溶解速度;C 。
为反应物在液相体积中的浓度:C 0ˊ——溶解性产物在液相体积中的浓度; K 0 为反应的平衡常数;D 1和D 2为反应物穿过液膜和固相产物层时的扩散系数,δ1和δ2为液相反应物液膜层的厚度和液相产物液膜层的厚度。
把D 1/δ1=β1称为i 组份的传质系数,1/β1=δ1/D 1为i 组份的扩散阻力,1/k 称为反应阻力。
过程的总阻力等于各个阶段阻力的加和:总传质系数 (4-2)上式在湿法冶金中获得广泛运用,因为在湿法冶金中大多数反应均可看成不可逆反应。
如果界面上的化学反应对液相反应物浓度为一级,则在稳态时:β C。
=β1(C0-C1)=β2(C l-C2)= kC2 (7-6) 如果扩散阻力和化学反应阻力的数值相近,即β1=β2=k,则C0-C1=C l-C2=C2,把不可逆化学反应阶段的浓度减少看成是(C2-0),则各个阶段的浓度减少值大致相同。
如果某一阶段的阻力要比其它阻力大得多,则在相应的阶段浓度由C0降低到0。
如化学反应阻力1/k很大,即1/k 》1/β1,1/k》1/β2,则k《β1,k《β2。
则:把C2 = C0 代入原式,则J =β2 C0 = kC2 = kC0 (4-7)同样,若1/β2》1/β1,1/β2》1/k,即β2《β1,β2《k,则有:类似地,当1/β1》1/β2,1/β1》1/k,可以得到J = β1C0 (4-9)这样,如果多相过程中某一阶段的阻力要比其它的阻力大得多,则过程的速度可用最小的传质系数(或速度常数)与C。
的乘积求出。
而其它阶段对总速度实际上没有影响,因此,最慢的阶段控制着过程的总速度。
根据阻力的相对大小,可分为内扩散控制、化学反应控制、外扩散控制等。
如果各阶段的阻力可以相比较时,则存在着混合控制。
当浸出过程有气相反应物参加时,就有四个相(气相、液相、固相产物和固相反应物)存在。
属于这类过程的有采用氧气氧化的浸出过程;在酸和氰化物溶液小的金属溶解(如铜、金、银);在酸和碱的水溶液中铜、锌、铅、铁、钼等硫化物的氧化;低价氧化物氧化成高价氧化物的溶解,如UO2和U3O8的溶解。
在有气体参加反应时的浸出过程中,可分为下列几个阶段:①气体被溶液所吸收(气体的溶解);②被溶解的气体向固相表面的迁移(外扩敝);③经固相层的扩散(内扩散);④在固相表面上的化学反应;⑤反应产物进入溶液的体积相中。
如果反应为不可逆的,则过程的速度将由前四个阶段的速度所确定。
浸出的模型见图7-2。
一般可以认为在气-液相的界面上,液体被气体所饱和,即气体-液体界面上气体在液相的浓度C H与气相中该组份的分压P之间服从亨利定律,即P=HC H,H为亨利常数,单位时间内穿过气-液界面的气体量G气可用下式确定:此处D1为气体在溶液中的扩散系数,S气为气-液的界面面积,C0为溶解于溶液体积相中的气体浓度,δ气为在气-液界面上的溶液扩散层的厚度。
上式也可写为:以固相的单位面积计的气体溶解速度S固为固相的表面积。
被溶解的气体穿过固相表面的液膜层的扩散流J2,和经过固相产物层的扩散流J3可由下式求出:D2为被溶解的气体经固相产物层的扩散系数。
取J l=J2=J3=J4=J,经转换后:k界为界面反应的速度常数。
由上式可见反应速度在很大程度是由气体反应物的压力所确定。
如果控制步骤是气体的吸收,则即浸出速度正比于溶液与气相的接触面积。
在有气相反应物参与浸出过程时,气体是以气泡的形式穿过液层,气泡的大小对气体的溶解速度有很大的影响。
至于气泡与液相之间的传质是很复杂的,将在气-液反应动力学中讨论。
这里只简单地考虑一个气泡,而不考虑其它的复杂因素。
气-液相接触面积与气泡的大小有关,如果单位时间内鼓入的气体量为q,气泡的上升速度为v,假设气泡的半径相同并等于r,气泡上升的高度为h,则气泡上升的持续时间t=h/v。
上升气泡的总体积Q=qt=qh/v (7—17) 气泡的总表面积取决于气泡的数量和每一气泡的表面积,一个气泡的体积为4/(3πr3),面积为4πr2。
所有气泡的总面积各种大小的气泡的上升速度各不相同,最小气泡的上升速度与其直径的平方成正比,而较大的气泡(r=1毫米)都以同一速度上升(对于水中的空气气泡,此速度约为30厘米/秒)。
因为传质的条件与气泡的上升速度有关,所以传质系数D l/δ气也与气泡的大小有关。
对小气泡(r=0.1~l毫米),它与气泡直径的平方根成正比;而中等和大气泡,它实际上与r 无关。
这样对小气泡有J~Pqh/r2.5 (7—19)对大的气泡J~Pqh/r (7—20) 即浸出的速度随气体的压力的增大而增大,气体的供给速度、液层的增高和气泡尺寸的减小等,均有助于浸出速率的增加。
在推导上面的各个公式时,都假设交互反应的速度仅与气相成份有关,而与液相反应物的浓度无关,但与大多数实际情况是不相符的。
因此讨论所得的结论仅只有定性的意义,并且受到所采用假设的限制。
3.2外扩散过程控制的特征在浸出过程中,液体相对于固体表面运动,这种运动的情况与流体的性质基本上确定了外传质过程的速度,与气-固体系的情况相同。
当流体流过固体表面时产生扩散层,因为扩散层的厚度是变化的,在扩散层中浓度随厚度的变化也不是线性关系,当流体成层流流过平板时,其层流边界层的厚度(参见第四章):0〜D1/3v1/6v/(7—21)x此处v为运动粘度,在20℃时水的运动粘度V H2O=0.01厘米2/秒,x 为由板缘起算的距离,v0为液体的体积流速。
由于在表面上的各个点都不是处于同一扩放层的厚度,而使实验结果处理困难。
运用旋转圆盘来研究液—固相反应,可以避免这一困难,在旋转圆盘上,液体的流动请况见图7—3。
在远离圆盘处,液体作垂直于板面方向的运动,而在圆盘表面上的液层的液体在盘面旋转运动,其角速度与圆盘的角速度相近。
同时由于离心力的作用,液体同时具有径向的运动。
由于这几种运动的存在,在层流的情况下,液体相对于固体的运动速度,在圆盘上各个点都相同,这就保证了在圆盘上的任一点上都具有同一边界层的厚度,而与该点离开旋转轴的距离无关。
这种旋转圆盘技术,已广泛用于液—固反应动力学和电极过程动力学的研究。
圆盘上扩散层的厚度由下式确定:δ0=1.6 D1/3v1/6ω/1(7—22)式中ω——圆盘旋转的角速度,弧度/秒;向圆盘表面传递的扩散流(当固体表面的反废物的浓度C=0时):对整个圆盘面积上的通量:R为圆盘的半径。
把角速度以每分钟的转数n表示,则上面计算的扩散流的方程式只适用固体溶于极稀溶液的溶解过程。
当圆盘旋转速度很小时,(Re=ωR2/v<10),δ=R;当圆盘转速很大时,(Re>104~105),圆盘上液体流动的层流制度被破坏,在这二种情况上,上面各个方程式计算的结果都将不准确。
如果过程的速度被外扩散步骤所控制,则其规律性由方程式J=DC0/δ所确定,过程具有下列特征:①过程的速度与液体对固体所作的相对起动速度有关,因为δ=f(v)。
(如果搅拌对浸出速度有影响,证明了过程是被外扩散过程控制或者混合控制,如果这种影响不存在,证明外扩散步骤要比其它步骤来得快。
②过程的速度与反应物的浓度成线性关系。
③如果C0=常数,则过程的总阻力(1/βΣ)与时间无关,因为当v=常数时,δ=常数。
④过程的速度受温度的影响小,因为D与v随温度变化很小,所以实验确定的过程表观活化能小,约为8~16千焦耳/摩尔。
由图(7-4)可以看出,当液体的速度达到某一个数植时,过程的速度就与液体的运动速度无关了,即外扩散阻力已不再存在。
过程由内扩散或化学反应所控制,但要注意到δ与v的关系并非线性,而δ减少的速度随v的增加而逐渐减少。
因此必须在、当过程的速度不再随v的加大而变化之后继续把液体的速度增大到一定的程度,才可能认为过程的速度的确不受液体流速的影响,否则会引出一些错误的结论来。
§7.3内扩散步骤控制的特征浸出过程在内扩散区进行的可能性,首先取决于产物层的密度,密度愈大,孔隙率就愈小,通过产物层的阻力就越大,内传质的速度也就越小。
对于产物层的密度,我们采用在讨论气-固反应时的方法,用Z值来衡量:式中c/a --由一个摩尔的固体反应物所形成的固体产物的摩尔数;V产和V反分别表示反应产物与固相反应物的摩尔体积。
当Z<1时,产物层是疏松多孔的,因此对内扩散传质无阻力。
