氧族元素演示文稿
合集下载
最新第15章氧族ppt模版课件

As4O6 两性 As2O5 酸性
PbO 碱性 PbO2 两性
※ 这种氧化物的酸碱性因变价而发生递变
在d区过渡元素中更为常见
CrO
碱性
Cr2O3
两性
CrO3
酸性
C)衡量标准 通过同类型的相应自由能的变化来近似判断
碱性 MO + H2O → M(OH)2 酸性 2MO + H2O → 2HMO
rG
越负
O3 + 2KI + H2O = I2 + O2 + 2KOH c. O3 + Mn(NO3)2 = MnO2↓+ 2HNO3 + O2
棕褐色
此反应用于鉴别H2O2蒸气中混有O3
补充:
淀粉不是一个单纯分子,而是一种混合物 马铃薯:
可溶性→直链淀粉 20~30% 与I2形成兰色混合物
不可溶性→支链淀粉 70-80% 与I2相互作用很弱,紫红色产物
成键特点
1. 氧和非金属元素形成共价化合物时(除 OF2、H2O2等外)氧化数均为-II;
2. S、Se、Te的价电子层中均有有效空d轨 道,这些d轨道可以参加成链,当它们和电负性 比它们大的元素化合时,可显+II、+IV、+ VI氧化态,如SCl2、SeO2、SF6等。
但氧的氧化数不能大于+II。
自由基是含有一个或多个具有成键能力 的未成对电子的原子或离子,通常的自由基 具有较高活性,一般呈电中性,
如 •CH3、 •OH、 •Br等。
1. 制法
1)利用对氧无声放电来获得臭氧
放电
3O2
2O3
2)3BaO2 + 3H2SO4 (浓)→ O3 + 3BaSO4 + 3H2O
《氧族元素》课件

硫单质
总结词
化学性质不活泼,常温下稳定,加热 易燃烧
详细描述
硫单质包括硫磺和硫化物,它们在常 温下比较稳定,加热时易燃烧,发出 蓝紫色火焰。硫单质在自然界中广泛 存在,是重要的化工原料,可用于生 产硫酸、染料、橡胶等。
硒单质
总结词
化学性质与硫相似,有毒性
详细描述
硒单质包括硒粉、硒化物等,其化学性质与硫相似,在常温下比较稳定,加热时易燃烧。硒单质有毒性,对人和 动物有害,但也是一种重要的微量元素,对生物体具有保护作用。
麻醉剂
氧族元素中的一些化合物具有麻醉 作用,如氧化亚氮、氟代烃等,可 用于手术麻醉和牙科治疗。
在环保领域的应用
大气污染治理
氧族元素中的一些化合物可用于 大气污染治理,如二氧化硫、三 氧化硫等可用于脱硫脱硝处理, 减少燃煤烟气中的硫化物和氮氧
化物含量。
水处理
氧族元素中的一些化合物可用于 水处理,如臭氧、二氧化氯等可 用于消毒和杀菌,三氯化铁等可 用于混凝沉淀,去除水中的悬浮
催化剂பைடு நூலகம்
氧族元素在工业催化领域也有广泛应 用,如二氧化硫、三氧化硫等可用于 石油裂化催化剂,三氧化二砷可用于 合成氨催化剂等。
在农业上的应用
01
02
03
肥料
氧族元素中的磷是植物生 长必需的元素之一,磷肥 的施用能够提高农作物的 产量和品质。
杀虫剂
氧族元素中的硫和硒等具 有杀虫作用,可用于防治 农作物病虫害,如硫磺粉 、亚砷酸等。
硫化物合成
硫化物性质
具有不同的化学性质,如离子型硫化物、共 价型硫化物和配位型硫化物等。
可以通过热分解、硫化还原反应等方法合成 。
02
01
硫化物应用
第六章第一节氧族元素精选教学PPT课件

假如人生不曾相遇,我还是那个我,偶尔做做梦,然后,开始日复一日的奔波,淹没在这喧嚣的城市里。 我不会了解,这个世界还有这样的一个你,只有你能让人回味,也只有你会让我心醉。 假如人生不曾相遇,我不会相信,有一种人可以百看不厌,有一种人一认识就觉得温馨。明知不能相逢,为何魂牵梦系?我又怎能深刻地体会到什么样叫远,什么叫近,远是距离,近在心底。 假如人生不曾相遇,不曾想过会牵挂一个远方的人。我有深切的愿望,愿你快乐每一天。淡淡的情怀很真,淡淡的问候很纯,淡淡的思念很深,淡淡的祝福最真。虽然一切只能给虚幻中的你。 假如人生不曾相遇,我不知道自己有那样一个习惯,收集你的欢笑,收集你的感情,收集你的一切一切。 假如人生不曾相遇,我不能深刻的体会孤独和忧伤,有着莫名的感动,激荡着热泪盈眶的心情入眠。 假如人生不曾相遇,我不会保持着一个人的想象,即使这想象难免寂寞无奈,但我仍然坚持着这样的梦想。 假如人生不曾相遇,我怎会理解一个人的孤独是那样铭心,但却可以释放自我的彷徨与无助。含泪的沧桑,无限的困惑,因为遇见了你,才会有更深的意义。可为什么在爱的时候,总伴着淡淡的心伤? 假如人生不曾相遇,我怎么能知道爱情存在的真正意义。必须有缘才能共舞,珍惜今天所爱方能同步。不能和你同途,也不能与你同步。 假如人生不曾相遇,我还是我,你依然是你,只是错过了人生最绚丽的奇遇。
D
)
3根据氧族元素性质推断,硒不可能具有的性质是( C ) A.在通常情况下是固体 B.SeO3对应的水化物是一种酸
C.H2Se比H2S稳定
D.有-2,+4,+6三种化合物
4.用事实说明氧的非金属性比硫强
A.硫在氧气中燃烧
B.硫与铁反应生成硫化亚铁,氧气与铁 反应生成四氧化三铁 C. 2H2S + O2 == S +2H2O
第十六章-氧族元素PPT课件
O3分子释放出热量,说明O3比O2有更大的化学活性, 无论在酸性或碱性条件下,都比O2有更强的氧化性。
11
第11页/共78页
第十六章 氧族元素
性质二:强氧化性
§16.2 氧、臭氧
O3是一种极强的氧化剂,氧化能力仅次于F2。
O3 2H 2e O2 H2O EA 2.08V
O3 H2O 2e
性质 性质一:强氧化性
性质二:还原性
性质三:不稳定性
性质四:二元弱酸
21
第21页/共78页
第十六章 氧族元素
性质一:强氧化性 • 酸性溶液
§16.3 H2O2O2 来自.6824 H2O2 1.776 H2O
• 碱性溶液
O2 0.076 HO2 0.878 OH
H2O2无论在酸性溶液还是在碱性溶液中都是强氧 化剂。
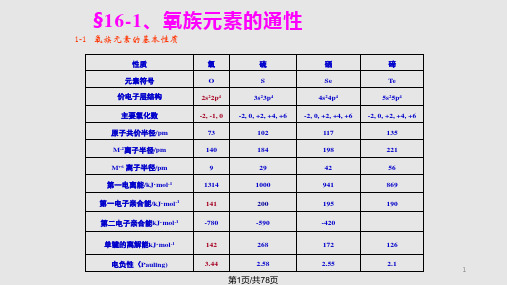
§16-1、氧族元素的通性
1-1 氧族元素的基本性质
性质 元素符号 价电子层结构 主要氧化数 原子共价半径/pm M-2离子半径/pm M+6 离子半径/pm 第一电离能/kJ·mol-1 第一电子亲合能/kJ·mol-1 第二电子亲合能kJ·mol-1
氧 O 2s22p4 -2, -1, 0 73 140 9 1314 141
-420
单键的离解能kJ·mol-1
142
268
172
126
电负性(Pauling)
3.44
2.58
2.55
2.1
1
第1页/共78页
第十六章 氧族元素
§16.1 通性
1-2 氧族元素的成键特征
• 能结合两个电子形成氧化数为-2的阴离子,表现出非 金属元素特性。
• 非金属活泼性弱于卤素。
11
第11页/共78页
第十六章 氧族元素
性质二:强氧化性
§16.2 氧、臭氧
O3是一种极强的氧化剂,氧化能力仅次于F2。
O3 2H 2e O2 H2O EA 2.08V
O3 H2O 2e
性质 性质一:强氧化性
性质二:还原性
性质三:不稳定性
性质四:二元弱酸
21
第21页/共78页
第十六章 氧族元素
性质一:强氧化性 • 酸性溶液
§16.3 H2O2O2 来自.6824 H2O2 1.776 H2O
• 碱性溶液
O2 0.076 HO2 0.878 OH
H2O2无论在酸性溶液还是在碱性溶液中都是强氧 化剂。
§16-1、氧族元素的通性
1-1 氧族元素的基本性质
性质 元素符号 价电子层结构 主要氧化数 原子共价半径/pm M-2离子半径/pm M+6 离子半径/pm 第一电离能/kJ·mol-1 第一电子亲合能/kJ·mol-1 第二电子亲合能kJ·mol-1
氧 O 2s22p4 -2, -1, 0 73 140 9 1314 141
-420
单键的离解能kJ·mol-1
142
268
172
126
电负性(Pauling)
3.44
2.58
2.55
2.1
1
第1页/共78页
第十六章 氧族元素
§16.1 通性
1-2 氧族元素的成键特征
• 能结合两个电子形成氧化数为-2的阴离子,表现出非 金属元素特性。
• 非金属活泼性弱于卤素。
第十六章-氧族元素PPT课件

1.2V 3
(O2/OH )
0.4V 0
.
5
O2 + NH3 → Fe S H2S HI CH4
H2O + N2 或 NO Fe3O4, FeO, Fe2O3 SO2(g) S 或 SO2(g) I2 CO2、CO 或 C
配位性 人血红蛋白中的血红素Hb是卟啉衍生物与Fe(II)形成的
配合物,具有与O2络合的功能: HbFe(II) + O2 = HbFe(II) O2
H2S的代用品——硫代乙酰胺(TAA)
CH3CSNH2 + H2O = CH3COO- + NH4+ + H2S↑
.
28
硫化物
金属硫化物
M 2S2(H 2S) MS MS MS
颜色:(大多数为黑色,少数需要特殊记忆) SnS 棕, SnS2 黄,As2S3 黄,As2S5 黄, Sb2S3橙,Sb2S5橙,MnS 肉,ZnS 白,CdS 黄
(NH4)2S2O8 + 2H2O = 2NH4HSO4 + H2O2
.
20
16.3 硫及其化合物
16.3.1 单质硫
结构
S:sp3杂化,形成环状S8分子。
S8分子为分子晶体,不溶 于水,溶于CS2。
.
21
同素异形体
斜方硫
密度/gcm-3 2.06
颜色
黄色
稳定性
< 94.5℃
单斜硫 1.99 H [2 H S x ] H 2 S ( (- g 1 x) )
氧化性
SnSS2 2- Sn3 2-S
还原性 3 F2 e S 82 O F3O e46S 2 O
.
氧族元素一精品PPT教学课件

氧族元素
第一课时
2020/12/6
1
氧族元素
包含元素
氧族元素包括
氧( 8O)、硫( 16 S)、硒( 34Se)、碲( 52Te)、钋( 84Po)等 它们的最外层电子、化学性质相似统称为氧族元素。
2020/12/6
2
氧原子结构特点:核外有2个电子层,最外层有6个电子
2020/12/6
3
硫原子结构特点:核外有3个电子层,最外层有6个电子
元素原子结构的异同决定其化学性 质上具有哪些特点?
} 非金属性
氧化性
减
弱
得电子能力
氧( O)、硫( S)、硒( Se)、碲(Te)、钋( Po)
金属性 还原性
}
失电子能力
增
强
主要化合价: -2、+4、+6 (O只有-2价)
2020/12/6
18
根据各元素的化学性质,你 能推断出元素最高价氧化物 对应的水化物的酸、碱性的 强弱吗?气态氢化物的稳定 性又怎样?
元素符号 状态
O 气态
S 固态
Se 固态
Te 固态
颜色
无
淡黄色
灰色
银白色
溶解性
难溶
难溶
难溶
难溶
导电性 不导电 不导电 半导体
导体
熔沸点 密度
2020/12/6
逐
渐升
高
逐 渐 增大
16
分析氧族元素的原子结构及其在 元素周期表中的位置,预测它们 的化学性质有何相似性和递变规 律?
2020/12/6
17
2020/12/6
O
S Se Te Po
10
氧族元素的性质
原子半径 氧 O 实物图片 硫 S 实物图片 硒 Se 实物图片 碲 Te 实物图片
第一课时
2020/12/6
1
氧族元素
包含元素
氧族元素包括
氧( 8O)、硫( 16 S)、硒( 34Se)、碲( 52Te)、钋( 84Po)等 它们的最外层电子、化学性质相似统称为氧族元素。
2020/12/6
2
氧原子结构特点:核外有2个电子层,最外层有6个电子
2020/12/6
3
硫原子结构特点:核外有3个电子层,最外层有6个电子
元素原子结构的异同决定其化学性 质上具有哪些特点?
} 非金属性
氧化性
减
弱
得电子能力
氧( O)、硫( S)、硒( Se)、碲(Te)、钋( Po)
金属性 还原性
}
失电子能力
增
强
主要化合价: -2、+4、+6 (O只有-2价)
2020/12/6
18
根据各元素的化学性质,你 能推断出元素最高价氧化物 对应的水化物的酸、碱性的 强弱吗?气态氢化物的稳定 性又怎样?
元素符号 状态
O 气态
S 固态
Se 固态
Te 固态
颜色
无
淡黄色
灰色
银白色
溶解性
难溶
难溶
难溶
难溶
导电性 不导电 不导电 半导体
导体
熔沸点 密度
2020/12/6
逐
渐升
高
逐 渐 增大
16
分析氧族元素的原子结构及其在 元素周期表中的位置,预测它们 的化学性质有何相似性和递变规 律?
2020/12/6
17
2020/12/6
O
S Se Te Po
10
氧族元素的性质
原子半径 氧 O 实物图片 硫 S 实物图片 硒 Se 实物图片 碲 Te 实物图片
《氧族元素》ppt课件 人教版

氢化物形 成的条件
点燃或放电
S
Se
-2,+4,+6
H2S
H2Se
加热
高温
Te
H2Te
不直接化合
氢化物稳定性
稳定 ——————→极不稳定
氧化物
最高价氧化 物对应水化 物 (H2RO4)
——
SO2,SO3
SeO2,SeO3
TeO2,TeO3
具有酸性 酸性逐渐减弱
非金属性依次减弱 ;金属性依次增强。
思维方式和研究方法
3.现在含硒元素的保健品已开始进 入市场。已知硒元素与氧同主族、
与钾同周期,则下列关于硒的C叙D述
正确的是
▪ A.原子序数为24
▪ B.非金属性比溴强
▪ C.最高价氧化物的化学式为SeO3 ▪ D.气态氢化物的稳定性较H2S弱
O
S
Se
Te
Po
同周期氧族元素和卤素的性质比较
(以S,Cl为例推演)
▪ B.Te的化合物有+4,+6, -2价
▪ C.Te的最高价氧化物对应的水化物是强酸
▪ D. 单质碲为银白色,且能导电
2.下列有关氧族元素的叙述不正 B D 确的是-------
▪ A.随着原子序数的递增,单质熔沸点升高 ▪ B.都能形成+4价和+6价化合物 ▪ C.能跟大多数金属化合 ▪ D.通常都能跟氢气直接化合生成氢化物.
▪
7.从自然生态的角度来看,生态平衡 的维护 就是要 维护其 生物物 种的多 样性, 所以维 护社会 和谐的 基础也 就是文 化的多 样性。
▪
8.作为最深层次的认同,文化的认同 在维护 民族团 结和和 睦之中 具有最 根本的 作用, 因此就 要建设 好各民 族共同 的精神 家园, 培养中 华民族 的共同 体意识 。
《高二化学氧族元素》课件

氧族元素的性质特点
非金属性
氧族元素属于非金属元素,表 现出强烈的非金属性,具有较
高的电负性和氧化态。
氧化还原反应
氧族元素在氧化还原反应中表 现出多种氧化态,可以发生得 失电子的氧化还原反应。
化学键
氧族元素易形成共价键,特别 是在含氧酸中,表现出较强的 配位键合共价键。
物理性质
氧族元素在固态时具有较高的 熔点和沸点,但在液态和气态 时较为活泼,易与其它物质发
总结词
随着原子序数的递增,氧族元素单质的还原性逐渐增强。
详细描述
与氧化性相反,氧族元素的还原性随着原子序数的递增而逐渐增强。这是因为随 着原子序数的递增,电子的填充使得原子更倾向于失去电子而不是获得电子。
氧族元素的酸碱性质
总结词
氧族元素的酸碱性质呈现周期性变化。
详细描述
在氧族元素中,随着原子序数的递增,元素的酸性和碱性呈现周期性变化。例如,氧、硫、硒和碲分别呈现强酸 、中强酸、弱酸和两性的性质。这是因为随着原子序数的递增,元素的电子构型发生变化,导致其酸碱性质也随 之改变。
04
氧族元素的重要化合物
氧化物
氧化钠
化学式为Na2O,是一种常见的氧化 物,呈白色,易溶于水,与酸反应生 成对应的盐和水。
氧化镁
化学式为MgO,是一种白色或淡黄色 的氧化物,难溶于水,但能与酸反应 生成对应的盐和水。
硫化物
硫化氢
化学式为H2S,是一种无色、易燃的剧毒气体,具有臭鸡蛋气味,是硫化物中的一种。
生反应。
02
氧族元素的物理性质
氧族元素的原子结构
原子结构相似性
氧族元素具有相似的原子结构,最外 层电子数均为6个,具有相似的电子 排布。
原子半径递变性
氧族元素,环境保护PPT课件

H2S FeS Cu2S Na2S S H2SO3 SO2 Na2SO3 H2SO4 SO3 BaSO4 CuSO4
二、用“对比法”研究元素化合物知 识
1 、 SO2和CO2的比较
2 、 浓硫酸和稀硫酸的比较 3 、 SO42-的检验方法
对比1 SO2和CO2的比较
SO2 化学性质 都是酸性氧化物 似 物理性质 有刺激性气味,易溶水 CO2
(1)结构: 原子半径逐渐增大 (2)性质: ①物理性质:密度、熔沸点、导电性等 ②化学性质:非金属性渐弱、金属性渐强
单质与氢气化合____ 渐难 氢化物的稳定性____ 渐弱 最高价氧化物对应水化物的酸性渐弱 ____
O
S
Se
Te
ⅣA
C Si
ⅥA ⅦA
O S F Cl
Ge Sn Pb
Se Br
章氧族元素环境保护
第一节 氧族元素(氧族元素的结构和
性质; O3 ;H2O2
、H2S
)
第二节 二氧化硫(性质、用途、环保) 第三节 硫酸(性质、用途;SO42-的检验) 第四节 环境保护(了解环境知识、增强 环保意识)
(一)物质结构、元素周期律的应用
ⅥA O S Se Te Po
1、氧族元素的相似性
(1)原子结构:最外层有6个电子; 主要化合价-2、+4、+6 (2) 化学性质:具有较强的非金属性
①单质能与大多数金属直接反应 ②单质(碲除外)能直接与氢气 化合生成氢化物(H2R) ③氧化物及其对应水化物(氧除外) +4 (RO2---H2RO3) +6 (RO3---H2RO4)
2、氧族元素的递变性
(1)这些装置的连接顺序按产物气流从左至右 的方向是(填装置的编号):___________ 4213 。
二、用“对比法”研究元素化合物知 识
1 、 SO2和CO2的比较
2 、 浓硫酸和稀硫酸的比较 3 、 SO42-的检验方法
对比1 SO2和CO2的比较
SO2 化学性质 都是酸性氧化物 似 物理性质 有刺激性气味,易溶水 CO2
(1)结构: 原子半径逐渐增大 (2)性质: ①物理性质:密度、熔沸点、导电性等 ②化学性质:非金属性渐弱、金属性渐强
单质与氢气化合____ 渐难 氢化物的稳定性____ 渐弱 最高价氧化物对应水化物的酸性渐弱 ____
O
S
Se
Te
ⅣA
C Si
ⅥA ⅦA
O S F Cl
Ge Sn Pb
Se Br
章氧族元素环境保护
第一节 氧族元素(氧族元素的结构和
性质; O3 ;H2O2
、H2S
)
第二节 二氧化硫(性质、用途、环保) 第三节 硫酸(性质、用途;SO42-的检验) 第四节 环境保护(了解环境知识、增强 环保意识)
(一)物质结构、元素周期律的应用
ⅥA O S Se Te Po
1、氧族元素的相似性
(1)原子结构:最外层有6个电子; 主要化合价-2、+4、+6 (2) 化学性质:具有较强的非金属性
①单质能与大多数金属直接反应 ②单质(碲除外)能直接与氢气 化合生成氢化物(H2R) ③氧化物及其对应水化物(氧除外) +4 (RO2---H2RO3) +6 (RO3---H2RO4)
2、氧族元素的递变性
(1)这些装置的连接顺序按产物气流从左至右 的方向是(填装置的编号):___________ 4213 。
氧族元素课件4

D、O4、O3与O2都是氧元素的同素异形体
2、 臭 氧 氧气(O2) 臭氧 (O3) 色 态 味 无色、无味气体 淡蓝色、鱼腥臭味气体
大于氧气 三 态 无色气体 →淡蓝色 淡蓝色气体 →深蓝色 变 化 液体 →淡蓝色固体 液体 →紫黑色固体 不稳定 2O3=3O2 稳定性 化学 稳 定 (高温时迅速分解) 性质 氧化性 极强 强
点燃
练习
1、不能说明氯的非金属性比硫强的事实是( C ) A、HCl受热不分解,H2S受热易分解 B、向H2S的水溶液中通入氯气有单质硫析出 C、与Na化合时,硫显-2价,氯显-1价 D、与Fe化合时,硫将Fe氧化成+2价,氯将Fe氧化成+3价 2、钋是原子半径最大的氧族元素,下列推测钋及钋的化合物 的性质错误的是( C ) A、钋是能导电的固体 B、钋与氢气不能直接化合 C、钋的氢化物很稳定 D、钋的熔点较高 3、不能由单质与单质直接化合而生成的化合物是( C D ) A、SO2 B、H2S C、FeCl2 D、CuS
讨论:试根据F、Cl、O、S的 单质及化合物相关化学性质
说明同周期、同主族元素非金属性的变化规律。 氧族元素的非金属性比同周期卤素的非金属性弱。 金榜:P40 4、用途: 生产硫酸,是制橡胶的原料 三药(火药、农药、医药)一柴(火柴) 黑火药:S + 2KNO3 + 3C === 3CO2 + N2 + K2S
同位素的是( A )。 A.16O 与 18O C.S2 与 S8 B.K 与 K+ D.DT 与 HT
2、据报道:科学家已成功合成了少量O4(其结构式 是 O—O ),有关O4的说法正确的是( D ) O—O A、O4的摩尔质量为64 g B、O4与O2互为同位素
2、 臭 氧 氧气(O2) 臭氧 (O3) 色 态 味 无色、无味气体 淡蓝色、鱼腥臭味气体
大于氧气 三 态 无色气体 →淡蓝色 淡蓝色气体 →深蓝色 变 化 液体 →淡蓝色固体 液体 →紫黑色固体 不稳定 2O3=3O2 稳定性 化学 稳 定 (高温时迅速分解) 性质 氧化性 极强 强
点燃
练习
1、不能说明氯的非金属性比硫强的事实是( C ) A、HCl受热不分解,H2S受热易分解 B、向H2S的水溶液中通入氯气有单质硫析出 C、与Na化合时,硫显-2价,氯显-1价 D、与Fe化合时,硫将Fe氧化成+2价,氯将Fe氧化成+3价 2、钋是原子半径最大的氧族元素,下列推测钋及钋的化合物 的性质错误的是( C ) A、钋是能导电的固体 B、钋与氢气不能直接化合 C、钋的氢化物很稳定 D、钋的熔点较高 3、不能由单质与单质直接化合而生成的化合物是( C D ) A、SO2 B、H2S C、FeCl2 D、CuS
讨论:试根据F、Cl、O、S的 单质及化合物相关化学性质
说明同周期、同主族元素非金属性的变化规律。 氧族元素的非金属性比同周期卤素的非金属性弱。 金榜:P40 4、用途: 生产硫酸,是制橡胶的原料 三药(火药、农药、医药)一柴(火柴) 黑火药:S + 2KNO3 + 3C === 3CO2 + N2 + K2S
同位素的是( A )。 A.16O 与 18O C.S2 与 S8 B.K 与 K+ D.DT 与 HT
2、据报道:科学家已成功合成了少量O4(其结构式 是 O—O ),有关O4的说法正确的是( D ) O—O A、O4的摩尔质量为64 g B、O4与O2互为同位素
《氧族元素》幻灯片PPT

Cl2 + SO2 + 2H2O=H2SO4+2HCl (Br2、I2 类似) Na2SO3+ H2O +Cl2= Na2SO4 +2HCl
3、实验室制法 Na2SO3+H2SO4=Na2SO4+SO2+H2O
四、硫酸
1、物理性质 纯硫酸是一种无色油状液体。H2SO4 的质量分数为98.3%的浓硫酸的沸点 是338℃。硫酸是一种难挥发的强酸, 易溶于水,能以任意比与水混溶。浓 硫酸溶解时放出大量的热。
思考:如何检验碳与浓硫酸反响的产物?
混合气体
无水CuSO4
高锰酸钾 〔浓溴水〕
品红
品红 澄清石灰水
在常温下,浓硫酸跟某些金属,如铁、铝 等接触时,能够使金属外表生成一薄层致 密的氧化物薄膜,从而阻止内部的金属继 续跟硫酸发生反响。因此,冷的浓硫酸可 以用铁或铝的容器贮存。但是,在受热的 情况下,浓硫酸不仅能够跟铁、铝等起反 响,还能够跟绝大多数金属起反响。
〔3〕硫酸锌
带七分子结晶水的硫酸锌〔ZnSO4·7H2O〕 是无色的晶体,俗称皓矾。硫酸锌在医疗 上用作收敛剂,它可使有机体组织收缩, 减少腺体的分泌。硫酸锌还可作为木材的 防腐剂,用硫酸锌溶液浸泡过的枕木,可 延长使用时间。在印染工业上用硫酸锌作 媒染剂,能使染料固着于纤维上。硫酸锌 还可用于制造白色颜料〔锌钡白等〕。
3、用途
4、硫酸盐
〔1〕硫酸钙〔CaSO4〕
硫酸钙是白色固体。带两分子结晶水的 硫酸钙〔CaSO4·2H2O〕叫做石膏。石 膏在自然界以石膏矿形式存在。将石膏 加热到150℃~170℃时,就会失去所含 大局部结晶水而变成熟石膏 〔2CaSO4·H2O〕。熟石膏跟水混合成 糊状物后会很快凝固,重新变成石膏。
第15章氧族元素ppt课件

SO2 + H2S == S↓+2 H2O 还原性: SO2<H2SO3<亚硫酸盐 SO2能和一些有机色素结合成为无色的化 合物。
SO3 是一种强氧化剂。
SO2是大气中一种主要的气态污染物。含 有SO2的空气不仅对人类及动植物有毒害, 还会腐蚀金属制品,损坏油漆颜料,织物和
皮革、形成酸雨等。
15-3-3 硫 的 含 氧 化 合 物
3.硫酸盐有哪些主要性质? ❖ 易溶性。除Ca2+、Sr2+、Ba2+、Pb2+、Ag+、Hg2+
外,一般硫酸盐都易溶于水。 ❖ 热稳定性大。8e-构型的阳离子的盐通常
1273K不分解。18e-、(18+2)e-、9-17e-构 型热稳定性略差。 ❖ 易形成复盐(成矾)。多数硫酸盐有形成复 盐的趋势。
3.硫酸盐有哪些主要性质?
4.S2O32-中S的氧化数为+Ⅱ,处于中间氧化 态,为什么S2O32-只表现出还原性,而不表 现出氧化性?S2O32-有哪些主要性质? 5.S2O42-、H2S2O7、S2O82-均含有两个S, 它们的主要性质有何不同,为什么?(从结
构角度理解说明
15-3-3 硫 的 含 氧 化 合 物
15-2-4 过 氧 化 氢
1.H2O2有哪几种制备方法? ❖ 复分解法:
用稀硫酸与BaO2或Na2O2反应来制备过氧化氢
❖ 电解法: 电解硫酸氢盐溶液,将电解产物过二硫酸 盐进行水解,得到H2O2溶液
❖ 乙基蒽醌法
O
C2H5
Pd
+ H2
O 乙基蒽醌
OH
C2H5 + O2
OH
OH C2H5
OH 乙基蒽醇 O
SO3 是一种强氧化剂。
SO2是大气中一种主要的气态污染物。含 有SO2的空气不仅对人类及动植物有毒害, 还会腐蚀金属制品,损坏油漆颜料,织物和
皮革、形成酸雨等。
15-3-3 硫 的 含 氧 化 合 物
3.硫酸盐有哪些主要性质? ❖ 易溶性。除Ca2+、Sr2+、Ba2+、Pb2+、Ag+、Hg2+
外,一般硫酸盐都易溶于水。 ❖ 热稳定性大。8e-构型的阳离子的盐通常
1273K不分解。18e-、(18+2)e-、9-17e-构 型热稳定性略差。 ❖ 易形成复盐(成矾)。多数硫酸盐有形成复 盐的趋势。
3.硫酸盐有哪些主要性质?
4.S2O32-中S的氧化数为+Ⅱ,处于中间氧化 态,为什么S2O32-只表现出还原性,而不表 现出氧化性?S2O32-有哪些主要性质? 5.S2O42-、H2S2O7、S2O82-均含有两个S, 它们的主要性质有何不同,为什么?(从结
构角度理解说明
15-3-3 硫 的 含 氧 化 合 物
15-2-4 过 氧 化 氢
1.H2O2有哪几种制备方法? ❖ 复分解法:
用稀硫酸与BaO2或Na2O2反应来制备过氧化氢
❖ 电解法: 电解硫酸氢盐溶液,将电解产物过二硫酸 盐进行水解,得到H2O2溶液
❖ 乙基蒽醌法
O
C2H5
Pd
+ H2
O 乙基蒽醌
OH
C2H5 + O2
OH
OH C2H5
OH 乙基蒽醇 O
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氧族元素
ⅢA B 硼 Al 铝 Ga 镓 In 铟 Tl 铊 ⅣA C 碳 Si 硅 Ge 锗 Sn 锡 Pb 铅 ⅤA N 氮 P 磷 As 砷 Sb 锑 Bi 铋 0 ⅥA ⅦA He 氦 O 氧 F 氟 Ne 氖 S 硫 Cl 氯 Ar 氩 Se 硒 Br 溴 Kr 氪 Te 碲 I 碘 Xe 氙 Po At 砹Rn 氡
氟利昂(CCl2F2)可在光的作用下分解产生Cl 原子,Cl原子会对臭氧(O3)层产生长久的破 坏作用
O3
光
O2+O,
Cl+O3→ ClO+O2,
ClO+O → Cl+O2
总反应为:2O3 → 3O2。
臭氧是比氧气更强的氧化剂。
O3+2I-+2H+=I2+O2+H2O PbS+2O3=PbSO4+O2 臭氧可以分解不易降解的多种芳烃化合物和不 饱和链烃化合物、是一种优良的污水净化剂和 脱色剂。臭氧与活性炭相结合的工艺路线,已 成为饮用水和污水深度处理的主要手段之一。
2S2 2S5 2-
[S
S]
2-
[S
S S
S
2-
S
[
多硫化物在酸性溶液中很不稳定,会生成硫 化氢和硫单质。
2S5
+ 2H+ =H2S↑+4S↓
(NH4)2S溶液应现用现配,因为溶液久置时 颜色由无色-黄-橙-红,发生:
2(NH4)2S+O2+2H2O→2S↓ +4NH3· 2O H (NH4)2S + (x-1)S → (NH4)2Sx
溶于 浓盐酸 SnS Sb2S3 (褐) (橙) SnS2 Sb2S5 (黄) (橙) PbS CdS (黑) (黄) Bi2S3(暗棕)
多硫化物
在可溶硫化物的浓溶液中加入硫粉时
Na2S + (x-1)S → Na2Sx x=2~6 随着x的增加,其颜色从黄-橙黄-红
Sx 叫做多硫离子,其结构示意图如下
-3价
测定O3的含量
CN-
→
O3
OCN-
→ CO2 + N2 + O2
O3
2、氧化物 (1)氧化物与水的作用,可分为四种类型: • • • • ⑴ 溶于水但无显著化学作用. 如:RuO4 ;OsO4等 ⑵ 与水作用生成可溶性氢氧化物。如: Na2O;BaO;CO2;P2O5 ;SO3等 ⑶ 与水作用生成不溶性氢氧化物。如: BeO;MgO;Sc2O3;Sb2O3等 ⑷ 既难溶于水又不与水作用。如:
66
104
117
137
153
金属性增强,非金属性减弱
二、氧在自然界的分布 同位素 ─ O16 , O17 , O18
(99.76%)(0.04%)(0.2%)
2H 16O重水;H 18O 1 2 2
─ 重氧水
同素异形体─ O2 ,O3 1、O3
O3在地面附近的大气层中含量极少,仅占0.001ppm。 在离地面20~40km处有个臭氧层,臭氧浓度高达 0.2ppm。它是氧气吸收太阳的紫外线后形成的,其
除去沉淀后的溶液含有6~8%的H2O2
4、硫
• • • 元素周期表位置: 原子结构示意图: 第三周期,ⅥA族
• 硫元素
• • •
自然界中的存在形式:游离态和化合态
主要化合价: -2 0 +4 +6 对应物质: H2S S SO2 H2SO4
黄铁矿(FeS2) 黄铜矿(CuFeS2)
硫的物理性质: 淡黄色晶体,不溶于水,微溶于酒精,
硫化物
溶于 稀盐酸 (0.3mol· -1) L MnS CoS (肉色) (黑) ZnS NiS (白) (黑) FeS(黑)
大多数难溶于水,并具有特征颜色
难溶于稀盐酸 难溶于浓盐酸 溶于浓硝酸 溶于王水 CuS As2S3 (黑) (浅黄) Cu2S As2S5 (黑) (浅黄) Ag2S(黑) HgS (黑) Hg2S (黑)
④弱还原性
5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O
(4)用途:作为漂白剂、消毒剂。
绿色氧化剂:还原产物为水,过量可分解 (5)制备
实验室里可用稀硫酸与BaO2或Na2O2反应来制备过 氧化氢: BaO2+H2SO4===BaSO4+H2O2 Na2O2+H2SO4+10H2O===Na2SO4· 2O+H2O2 10H
无色粘稠液体,极性比水强,分子间存在氢键。 在固态和液态时分子易发生缔合,沸点(150C)比水高 与水可以任何比例互混
常用的双氧水为过氧化氢水溶液,浓度有30%和3%
(3)化学性质
①不稳定性 2H2O2 (l) = 2H2O (l) + O2 (g)
某些金属离子和碱可催化分解
2Fe2+ +H2O2 + 2Hư= 2Fe2+ +O2 + 2H+ 总反应:2H2O2 = O2 +2H2O
空气充足 2H2S+3O2 → 2SO2 +2H2O 空气不足 2H2S + O2 → 2S +2H2O
氢硫酸
H2S
二元弱酸
H+ + HS-
HS-
H+ + S2碱性介质>酸性介质
具有较强还原性
在酸性和碱性介质中均有还原性
产物视氧化剂强度而定,一般为S
① 易被空气中氧气氧化, 使溶液变浑浊 2H2S + O2 → 2S + 2H2O ② H2S + 2FeCl3 → S +2FeCl2+2HCl ③ H2S + H2O2 → S + 2H2O ④ H2S +4Cl2 +4H2O → H2SO4+8HCl
•
SiO2;Fe2O3 ; MnO2等
(2)酸碱氧化物的分类:
• ⑴ 酸性氧化物。大多数非金属氧化物,高 氧 化态的金属氧化物。如:CO2;Mn2O7 ⑵ 碱性氧化物。大多数金属氧化物。如: Na2O,MgO,Fe2O3,CuO
• •
⑶ 两性氧化物。部分金属氧化物 (BeO;AI2O3;ZnO;Cr2O3等)及少数非金属 氧化物(As4O6;Sb4O6;TeO2等)
例、多硫化钠Na2Sx(x>2)在结构上与Na2O2、 FeS2、CaC2等有相似之处。Na2Sx在碱性溶液 中可被NaClO氧化为Na2SO4,而NaClO被还原 为NaCl,反应中Na2Sx与NaClO的物质的量之 比为1︰16,则x是?
FeS + 2H+ → Fe2+ + H2S
(2)性质
毒性:无色有腐蛋臭味的有毒气体,有麻醉中枢神 经作用,吸入大量H2S会造成昏迷甚至死亡。 含H2S的工业尾气和实验室废气不允许直接放空,可 通入NaOH溶液
H2S + 2NaOH → Na2S + 2H2O
为极性分子,极性比水弱
有较强还原性 能溶于水,其水溶液叫氢硫酸 H2S在空气中燃烧
•
⑷ 中性氧化物。不显酸碱性的氧化物。如: CO;NO;N2O
•
⑸ 复杂氧化物。Fe3O4;Pb3O4
⑶ 同一元素不同氧化态的氧化物,其酸性随 氧化数的升高而增强 SO2 弱酸性; SO3 强酸性
As4O10 酸性
As4O6 两性 ;
PbO
碱性 ;
PbO2
两性
3、过氧化氢 (1)结构
(2)物理性质
2 3 4 5 6
称为氧族元素
一、氧族元素概述 ⅥA 氧(O) 硫(S) 硒(Se) 碲(Te) (Po)
典型非金属
原子序数 8 16
准金属
34 52
金属
84
-1 -2 -2 、0 、 -2 、 0 、 -2 、 0 、 +2 、+4 +2 、+4 主要化合价 0 +4 、+6+6 +6
、 、
-
原子半径/pm
②弱酸性
2H2O2 ⇌ H++HO2-
例如:H2O2 + Ba(OH)2 →BaO2 + 2H2O
BaO2 可视为H2O2的盐
③ 氧化性 SO2 + H2O2 = H2SO4 2Fe2+ + H2O2 +H+ = 2Fe3+ + H2O H2O2+ 2I- + 2H+ → I2+ 2H2O PbS + 4H2O2 → PbSO4 + 4H2O 酸性和碱性介质中均有氧化性 氧化性 酸性介质>碱性介质
易溶于二硫化碳。 硫的化学性质:
Fe + S = FeS
2Cu + S = Cu2S
硫与金属反应生成金属硫化物。 若是变价金属 一般生成低价金属硫化物。
点燃
S + O2
S O2
H2 + S
H2 S
3S + 6KOH = K2SO3 + 2K2S + 3H2O
5、硫化氢、硫化物和多硫化物
硫化氢
(1)制取:实验室常用硫化亚铁和稀盐酸反应
作用滤掉约99%的太阳辐射。
臭氧是淡蓝色的气体,有一种 鱼腥臭味,易溶于水。臭氧分 子为V型。
O3不稳定,但在常温下分解较慢,437K以上迅 速分解。二氧化锰、二氧化铅、铂黑等催化剂 的存在或经紫外辐射都会促使臭氧分解, 2O3===3O2
近年来,由于大气中氮氧化物和氯氟代烃 (CFCl3、CF2Cl2)等含量过多,会破坏臭氧层。
ⅢA B 硼 Al 铝 Ga 镓 In 铟 Tl 铊 ⅣA C 碳 Si 硅 Ge 锗 Sn 锡 Pb 铅 ⅤA N 氮 P 磷 As 砷 Sb 锑 Bi 铋 0 ⅥA ⅦA He 氦 O 氧 F 氟 Ne 氖 S 硫 Cl 氯 Ar 氩 Se 硒 Br 溴 Kr 氪 Te 碲 I 碘 Xe 氙 Po At 砹Rn 氡
氟利昂(CCl2F2)可在光的作用下分解产生Cl 原子,Cl原子会对臭氧(O3)层产生长久的破 坏作用
O3
光
O2+O,
Cl+O3→ ClO+O2,
ClO+O → Cl+O2
总反应为:2O3 → 3O2。
臭氧是比氧气更强的氧化剂。
O3+2I-+2H+=I2+O2+H2O PbS+2O3=PbSO4+O2 臭氧可以分解不易降解的多种芳烃化合物和不 饱和链烃化合物、是一种优良的污水净化剂和 脱色剂。臭氧与活性炭相结合的工艺路线,已 成为饮用水和污水深度处理的主要手段之一。
2S2 2S5 2-
[S
S]
2-
[S
S S
S
2-
S
[
多硫化物在酸性溶液中很不稳定,会生成硫 化氢和硫单质。
2S5
+ 2H+ =H2S↑+4S↓
(NH4)2S溶液应现用现配,因为溶液久置时 颜色由无色-黄-橙-红,发生:
2(NH4)2S+O2+2H2O→2S↓ +4NH3· 2O H (NH4)2S + (x-1)S → (NH4)2Sx
溶于 浓盐酸 SnS Sb2S3 (褐) (橙) SnS2 Sb2S5 (黄) (橙) PbS CdS (黑) (黄) Bi2S3(暗棕)
多硫化物
在可溶硫化物的浓溶液中加入硫粉时
Na2S + (x-1)S → Na2Sx x=2~6 随着x的增加,其颜色从黄-橙黄-红
Sx 叫做多硫离子,其结构示意图如下
-3价
测定O3的含量
CN-
→
O3
OCN-
→ CO2 + N2 + O2
O3
2、氧化物 (1)氧化物与水的作用,可分为四种类型: • • • • ⑴ 溶于水但无显著化学作用. 如:RuO4 ;OsO4等 ⑵ 与水作用生成可溶性氢氧化物。如: Na2O;BaO;CO2;P2O5 ;SO3等 ⑶ 与水作用生成不溶性氢氧化物。如: BeO;MgO;Sc2O3;Sb2O3等 ⑷ 既难溶于水又不与水作用。如:
66
104
117
137
153
金属性增强,非金属性减弱
二、氧在自然界的分布 同位素 ─ O16 , O17 , O18
(99.76%)(0.04%)(0.2%)
2H 16O重水;H 18O 1 2 2
─ 重氧水
同素异形体─ O2 ,O3 1、O3
O3在地面附近的大气层中含量极少,仅占0.001ppm。 在离地面20~40km处有个臭氧层,臭氧浓度高达 0.2ppm。它是氧气吸收太阳的紫外线后形成的,其
除去沉淀后的溶液含有6~8%的H2O2
4、硫
• • • 元素周期表位置: 原子结构示意图: 第三周期,ⅥA族
• 硫元素
• • •
自然界中的存在形式:游离态和化合态
主要化合价: -2 0 +4 +6 对应物质: H2S S SO2 H2SO4
黄铁矿(FeS2) 黄铜矿(CuFeS2)
硫的物理性质: 淡黄色晶体,不溶于水,微溶于酒精,
硫化物
溶于 稀盐酸 (0.3mol· -1) L MnS CoS (肉色) (黑) ZnS NiS (白) (黑) FeS(黑)
大多数难溶于水,并具有特征颜色
难溶于稀盐酸 难溶于浓盐酸 溶于浓硝酸 溶于王水 CuS As2S3 (黑) (浅黄) Cu2S As2S5 (黑) (浅黄) Ag2S(黑) HgS (黑) Hg2S (黑)
④弱还原性
5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O
(4)用途:作为漂白剂、消毒剂。
绿色氧化剂:还原产物为水,过量可分解 (5)制备
实验室里可用稀硫酸与BaO2或Na2O2反应来制备过 氧化氢: BaO2+H2SO4===BaSO4+H2O2 Na2O2+H2SO4+10H2O===Na2SO4· 2O+H2O2 10H
无色粘稠液体,极性比水强,分子间存在氢键。 在固态和液态时分子易发生缔合,沸点(150C)比水高 与水可以任何比例互混
常用的双氧水为过氧化氢水溶液,浓度有30%和3%
(3)化学性质
①不稳定性 2H2O2 (l) = 2H2O (l) + O2 (g)
某些金属离子和碱可催化分解
2Fe2+ +H2O2 + 2Hư= 2Fe2+ +O2 + 2H+ 总反应:2H2O2 = O2 +2H2O
空气充足 2H2S+3O2 → 2SO2 +2H2O 空气不足 2H2S + O2 → 2S +2H2O
氢硫酸
H2S
二元弱酸
H+ + HS-
HS-
H+ + S2碱性介质>酸性介质
具有较强还原性
在酸性和碱性介质中均有还原性
产物视氧化剂强度而定,一般为S
① 易被空气中氧气氧化, 使溶液变浑浊 2H2S + O2 → 2S + 2H2O ② H2S + 2FeCl3 → S +2FeCl2+2HCl ③ H2S + H2O2 → S + 2H2O ④ H2S +4Cl2 +4H2O → H2SO4+8HCl
•
SiO2;Fe2O3 ; MnO2等
(2)酸碱氧化物的分类:
• ⑴ 酸性氧化物。大多数非金属氧化物,高 氧 化态的金属氧化物。如:CO2;Mn2O7 ⑵ 碱性氧化物。大多数金属氧化物。如: Na2O,MgO,Fe2O3,CuO
• •
⑶ 两性氧化物。部分金属氧化物 (BeO;AI2O3;ZnO;Cr2O3等)及少数非金属 氧化物(As4O6;Sb4O6;TeO2等)
例、多硫化钠Na2Sx(x>2)在结构上与Na2O2、 FeS2、CaC2等有相似之处。Na2Sx在碱性溶液 中可被NaClO氧化为Na2SO4,而NaClO被还原 为NaCl,反应中Na2Sx与NaClO的物质的量之 比为1︰16,则x是?
FeS + 2H+ → Fe2+ + H2S
(2)性质
毒性:无色有腐蛋臭味的有毒气体,有麻醉中枢神 经作用,吸入大量H2S会造成昏迷甚至死亡。 含H2S的工业尾气和实验室废气不允许直接放空,可 通入NaOH溶液
H2S + 2NaOH → Na2S + 2H2O
为极性分子,极性比水弱
有较强还原性 能溶于水,其水溶液叫氢硫酸 H2S在空气中燃烧
•
⑷ 中性氧化物。不显酸碱性的氧化物。如: CO;NO;N2O
•
⑸ 复杂氧化物。Fe3O4;Pb3O4
⑶ 同一元素不同氧化态的氧化物,其酸性随 氧化数的升高而增强 SO2 弱酸性; SO3 强酸性
As4O10 酸性
As4O6 两性 ;
PbO
碱性 ;
PbO2
两性
3、过氧化氢 (1)结构
(2)物理性质
2 3 4 5 6
称为氧族元素
一、氧族元素概述 ⅥA 氧(O) 硫(S) 硒(Se) 碲(Te) (Po)
典型非金属
原子序数 8 16
准金属
34 52
金属
84
-1 -2 -2 、0 、 -2 、 0 、 -2 、 0 、 +2 、+4 +2 、+4 主要化合价 0 +4 、+6+6 +6
、 、
-
原子半径/pm
②弱酸性
2H2O2 ⇌ H++HO2-
例如:H2O2 + Ba(OH)2 →BaO2 + 2H2O
BaO2 可视为H2O2的盐
③ 氧化性 SO2 + H2O2 = H2SO4 2Fe2+ + H2O2 +H+ = 2Fe3+ + H2O H2O2+ 2I- + 2H+ → I2+ 2H2O PbS + 4H2O2 → PbSO4 + 4H2O 酸性和碱性介质中均有氧化性 氧化性 酸性介质>碱性介质
易溶于二硫化碳。 硫的化学性质:
Fe + S = FeS
2Cu + S = Cu2S
硫与金属反应生成金属硫化物。 若是变价金属 一般生成低价金属硫化物。
点燃
S + O2
S O2
H2 + S
H2 S
3S + 6KOH = K2SO3 + 2K2S + 3H2O
5、硫化氢、硫化物和多硫化物
硫化氢
(1)制取:实验室常用硫化亚铁和稀盐酸反应
作用滤掉约99%的太阳辐射。
臭氧是淡蓝色的气体,有一种 鱼腥臭味,易溶于水。臭氧分 子为V型。
O3不稳定,但在常温下分解较慢,437K以上迅 速分解。二氧化锰、二氧化铅、铂黑等催化剂 的存在或经紫外辐射都会促使臭氧分解, 2O3===3O2
近年来,由于大气中氮氧化物和氯氟代烃 (CFCl3、CF2Cl2)等含量过多,会破坏臭氧层。
