中考化学化学质量守恒定律(大题培优 易错 难题)含答案
中考化学考前冲刺专题——质量守恒定律

中考化学考前冲刺专题——质量守恒定律
一、中考考查知识点
1、质量守恒定律
2、化学反应现象
二、中考试题回顾
1. 化学反应前后肯定发生变化的是( )。
A. 原子数目
B. 元素种类
C. 物质总质量
D. 分子种类
2.在催化剂、加热的条件下,氨能和氧气发生反应:4NH
3
+5O2错误!未找到
引用源。4X+6H
2
O,则X的化学式为( )。
A.N
2
B.NO
C.NO
2 D.N
2
O
3.下列观点符合质量守恒定律的是()。
A.煤燃烧后剩余残渣的质量减轻了
B.一定条件下,SO2和O2生成SO3,反应前后分子总数不变
C.8g CH4完全燃烧生成8g CO2
D.某有机物在空气中燃烧只生成CO2和H2O,则该有机物一定含有碳、氢、氧元素
4. 在一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如下表所示。关于此反应下列认识不正确的是() A、m的值是1 B、甲可能是该反应的催化剂
C、该反应是分解反应
D、反应中乙、丁的质量比是29:8 5.下面对某些实验现象的描述,不正确的是()。
A.镁条在空气中燃烧,发出耀眼白光
B.氢气在空气中燃烧,产生淡蓝色火焰
C.醋酸溶液滴入酚酞试剂,变红色
D.氢氧化钠溶液滴入氯化铁溶液,出现红褐色沉淀
6.下列对实验现象的描述,错误
..的是()。
A.镁条在空气中剧烈燃烧,发出耀眼白光
B.硫在空气中燃烧产生微弱的淡蓝色火焰,并生成无色有刺激性气味的气体
C.向稀硫酸中滴加紫色石蕊试液.溶液变成红色
D.向氯化钙溶液中通入二氧化碳,出现大量白色沉淀
7.下列有关实验现象的描述正确的是( )
中考化学计算题(大题培优 易错 难题)附答案

(1)NaOH的化学式量为_________。
(2)硫酸铜刚好完全反应时,所得溶液的质量为_____g(保留一位小数)。
(3)硫酸铜溶液中溶质的质量分数是________?(写出计算过程)
[进一步探究]图甲、图乙为利用数字化仪器测得的室温下足量的三种金属片分别与200ml100℅的稀盐酸反应产生氢气的量。(产生氢气的量由气体压强表示,在等温条件下,产生氢气体积与装置内压强成正比)。
①实验中你认为,还要控制的变量是_________________________。
②由图乙,你得出的反应物的量与生成的气体体积的关系是____________。
60
3.3
62.5
(1)生成氧气的质量为___________g。
(2)反应后烧杯中溶液溶质的质量分数为____________。(写出计算过程,结果精确到0.1%)
【答案】0.82.2%
【解析】
【分析】
【详解】
(1)根据质量守恒定律,氧气的质量=(60g+3.3g)﹣62.5g=0.8g;
(2)根据题意,过氧化氢完全分解后,溶液中的溶质是硫酸铜,因为硫酸铜是催化剂,反应前后质量不变,所以溶液中硫酸铜的质量=3.3g×15%=0.495g,只要求出反应后溶液的质量就可求出反应后溶液中溶质的质量分数。
中考化学专题练习 质量守恒定律(含解析)

质量守恒定律
一、选择题
1.下列现象不能用质量守恒定律解释的是()
A.纸燃烧化为灰烬,灰烬的质量比纸的质量小
B.铁丝在氧气中燃烧,生成物的质量比铁丝的质量大
C.湿衣服凉晒后变轻了
D.蜡烛燃烧后质量减小
2.下列“化学反应前后”的叙述不正确的是()
A.物质的质量总和相同B.元素的种类相同
C.物质分子的个数相同D.原子的个数相同
3.目前有关部门做出决定,司机酒后驾车会受到严惩.交警常用一种“酒精检测仪”检查司机是否酒后驾车.其反应原理为C2H5OH+4CrO3+6H2SO4═2X+2CO2↑+9H2O,反应中红色的CrO3转变为绿色的化合物X,则X的化学式为()
A.Cr2O3 B.CrSO3C.Cr2(SO4)3D.Cr2S
4.在一密闭容器中,有甲、乙、丙、丁四种物质,在一定的条件下,充分反应,测得反应前后各物质质量如下表:
物质甲乙丙丁
反应前质量(g) 4 1 42 10
反应后质量(g)待测20 6 31
反应后,甲的“待测”值应为()
A.10 B.8 C.4 D.0
二、非选择题
5.磷在氧气中完全燃烧生成五氧化二磷.磷、氧气、五氧化二磷的质量比是.
6.若要制取10g铜,至少需要用g氧化铜跟过量氢气反应.(保留一位小数)
7.用氢气还原氧化铜,如果氢气的利用率为50%,要得到3.2g铜,需要氢气g.(保留一位小数)
8.12g碳和34g氧气反应后,可得到 g二氧化碳.
9.已知A+B→C+D,现将A、B两种物质各15g,混合后加热,生成16g C和9g D测得B已完全反应,
则A与B反应物的质量比.
10.11.2g铁与稀盐酸反应,生成的气体恰好能跟g氯气反应生成氯化氢(保留一位小数)11.19.5g金属锌与足量的盐酸反应生成的氢气,全部用来与氧化铜反应,可还原出 g铜(保留一位小数)
2024年中考化学专题训练——有关质量守恒定律的计算 (1)

2024年中考化学专题训练——有关质量守恒定律的计算一、选择题
1.现有8gA 和足量B 在一定条件下充分反应,生成22gC 和18gD,则参加反应的A 和B 的质量比是
A.4:11B.1 :2C.1 :4D.11 :9 2.在反应2A+B2=2C中,21gA和足量B2在一定条件下充分反应生成33gC,已知B的相对原子质量为16,则A的相对分子质量是
A.26B.28C.30D.32
3.化学反应:A+2B=C+D,5.6克A跟7.3克B恰好完全反应,生成12.7克C。现要制得0.4D,则所需A的质量为
A.5.6克B.11.2克C.14.6克D.无法计算4.乙醇不完全燃烧时产生CO、CO2和H2O。依据下表数据分析得出的结论中,正确的是
物质乙醇氧气二氧化碳水一氧化碳
反应前质量/g 6.68.8000
反应后质量/g20 6.6 5.4a
A.表中的a值为2.4B.生成的CO和CO2分子个数比为1:3 C.参加反应的乙醇和氧气的质量比为3:4D.在化学反应前后碳元素质量不一定相等
5.将一定质量的a,b,c,d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得各物质的质量如表:
物质a b c d
反应前的质量/g 6.014.0 3.2 1.0
反应一段时间后的质量/g10.07.2X 1.0
下列有关说法正确的是
A.该反应属于分解反应
B.x=3.2
C.d一定是催化剂
D.a和b是反应物
6.在一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如表
A.上表中m的值为3
B.a、b两种物质中元素种类一定与c物质中元素种类相同
2020-2021备战中考化学计算题(大题培优 易错 难题)及详细答案

一、中考初中化学计算题
1.工业生产的纯碱中常含有少量氯化钠杂质,现称取12 g 纯碱样品于烧杯中,加入水使其完全溶解,逐渐加入氯化钙溶液至过量,测得加入氯化钙溶液的质量与生成沉淀的关系如下图所示。(反应的化学方程式:CaCl 2+Na 2CO 3=CaCO 3↓+2NaCl)
(1)计算样品中碳酸钠的质量分数________(要求写出计算过程,精确到0.1%)。 (2)若要计算氯化钙溶液中溶质的质量分数,可使用上图中_____点的一组数据(填标号)。 【答案】(1)88.3%;(2)a (或 b ) 【解析】
由图可以看出生成的碳酸钙的质量为10g ,设碳酸钠的质量为x
2233CaCl +Na CO ==CaCO 2NaCl ↓+
106 100 x 10g
106100
10x g = x =10.6g
样品中碳酸钠的质量分数为
10.6100%88.3%12.0g
g
⨯≈,当求算氯化钙溶液中质量分数时,由于50g 氯化钙溶液对应的沉淀为4g ,125g 氯化钙溶液对应的沉淀为10g 都是氯化钙完全反应,所以可以根据a 点或者b 点数据计算。
答:(1)计算样品中碳酸钠的质量分数约为88.3%;(2)若要计算氯化钙溶液中溶质的质量分数,可使用图中曲线上示出的点a 或者b 所对应的数据。
2.实验室有一瓶未知浓度的BaCl 2溶液,某同学取出150g 该溶液于烧杯中,向其中逐滴加入溶质质量分数为26.5%的Na 2CO 3溶液。反应过程中生成沉淀的质量与所用Na 2CO 3溶液质量的关系如图所示。已知:BaCl 2+Na 2CO 3=BaCO 3↓+2NaCl 。请计算:
初三化学化学质量守恒定律的专项培优练习题(含答案)含答案
初三化学化学质量守恒定律的专项培优练习题(含答案)含答案
一、初中化学质量守恒定律
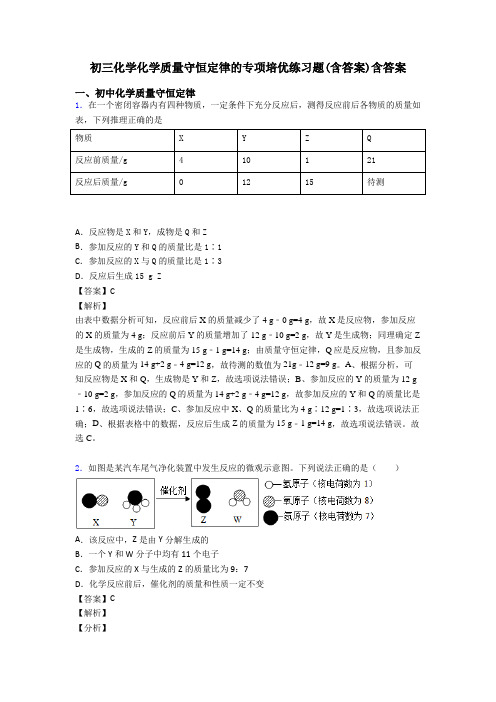
1.在一个密闭容器内有四种物质,一定条件下充分反应后,测得反应前后各物质的质量如表,下列推理正确的是
物质X Y Z Q
反应前质量/g410121
反应后质量/g01215待测
A.反应物是X和Y,成物是Q和Z
B.参加反应的Y和Q的质量比是1∶1
C.参加反应的X与Q的质量比是1∶3
D.反应后生成15 g Z
【答案】C
【解析】
由表中数据分析可知,反应前后X的质量减少了4 g﹣0 g=4 g,故X是反应物,参加反应的X的质量为4 g;反应前后Y的质量增加了12 g﹣10 g=2 g,故Y是生成物;同理确定Z 是生成物,生成的Z的质量为15 g﹣1 g=14 g;由质量守恒定律,Q应是反应物,且参加反应的Q的质量为14 g+2 g﹣4 g=12 g,故待测的数值为21g﹣12 g=9 g。A、根据分析,可知反应物是X和Q,生成物是Y和Z,故选项说法错误;B、参加反应的Y的质量为12 g ﹣10 g=2 g,参加反应的Q的质量为14 g+2 g﹣4 g=12 g,故参加反应的Y和Q的质量比是1∶6,故选项说法错误;C、参加反应中X、Q的质量比为4 g∶12 g=1∶3,故选项说法正确;D、根据表格中的数据,反应后生成Z的质量为15 g﹣1 g=14 g,故选项说法错误。故选C。
2.如图是某汽车尾气净化装置中发生反应的微观示意图。下列说法正确的是()
A.该反应中,Z是由Y分解生成的
B.一个Y和W分子中均有11个电子
C.参加反应的X与生成的Z的质量比为9:7
部编版2020年中考化学大题狂做系列专题10质量守恒定律含解析10

专题10 质量守恒定律
1.【河南省平顶山市2018届九年级上学期期末】请用学过的化学知识解释下列现象。
(1)将变瘪的乒乓球放在热水中能重新鼓起。______
(2)铝是活泼金属,为什么却有较好的抗腐蚀性?______
(3)为验证质量守恒定律,某同学设计了如图进行实验,结果没有达到实验目的。请帮助该同学分析原因。
______
【答案】温度升高,分子间隔变大铝在常温下与空气中的氧气反应,生成了一层致密的氧化铝薄膜,阻止了铝进一步被氧化它们反应产生的二氧化碳逸散到空气中了
2.【广东省东莞市中堂星晨学校2018届九年级下学期开学考试】氢气是一种清洁能源,以氢燃料电池为动力的汽车已在北京试运行。
(1)氢气燃烧的化学方程式是____________________________________________。
(2)从质量守恒定律观点看,水可作为制取氢气的原料,其原因是______________。
(3)目前,开发利用氢能源的困难之一是___________________________________。
【答案】 2H2 + O2 2H2O 水中含有氢元素制取成本高(其他答案合理得分)
【解析】本题考查了氢气的性质和氢能的优缺点和质量守恒定律。(1)氢气与氧气在点燃时生成了水。氢
气燃烧的化学方程式是:2H2 + O2 2H2O;(2)从质量守恒定律观点看,水可作为制取氢气的原料,是因为水中含有氢元素;(3)目前,开发利用氢能源的困难是制取成本高、不容易贮存等。
3.【重庆育才初中2018级九年级上第二次月考】小明为验证质量守恒定律,做了镁粉在空气燃烧的实验(如图1),该反应的化学方程式是__。实验结束,他发现镁粉在空气中充分燃烧后,产物中还有少量黄色固体。为了弄清黄色固体的成分,小明进行了如下实验探究:
2020-2021中考化学培优 易错 难题(含解析)之计算题附详细答案

一、中考初中化学计算题
1.为测定石灰石样品中碳酸钙的含量,小明取25g 石灰石样品与一定质量的14.6%的稀盐酸恰好完全反应,将反应所得混合物蒸干得到固体27.2 g (不含结晶水,假设样品中的杂质既不与稀盐酸反应)。试计算: (1)参加反应的盐酸的质量______。 (2)石灰石样品中碳酸钙的含量______。 【答案】100g 80% 【解析】 【分析】 【详解】
设样品中杂质的质量为x ,反应消耗盐酸的为y
3222CaCO +2HCl =CaCl +CO +H O
1007311125g-x
14.6%y 27.2g-x
↑⨯ 10073111
==25g-x 14.6%y 27.2g-x ⨯ x=5g y=100g
石灰石样品中碳酸钙的质量分数为
25g-5g
100%=80%25g
⨯ 答:样品中碳酸钙的含量为80%,反应消耗盐酸的为100g 考点:根据化学方程式的计算
2.在我国青海湖地区有一种说法,冬天捞碱,夏天晒盐。这里的碱是指Na 2CO 3,盐是指NaCl 。人们从盐湖中捞得的碱会含有少量的NaCl 。某研究性学习小组称取含NaCl 的Na 2CO 3固体25.0g ,将其配制成溶液,再向其中逐滴加入足量的溶质质量分数为7.3%的稀盐酸,使气体完全放出,共收集到8.8gCO 2气体。 试计算:(1)原固体中Na 2CO 3的质量分数________。 (2)反应中消耗盐酸的总质量______。 【答案】(1)84.8%.(2)200g . 【解析】
解:(1)设碳酸钠的质量为x ,盐酸溶液中溶质的质量为y Na 2CO 3+2HCl=2NaCl+H 2O+CO 2↑ 106 73 44 x y 8.8g
中考化学培优 易错 难题(含解析)之利用化学方程式的简单计算附答案解析

中考化学培优易错难题(含解析)之利用化学方程式的简单计算附
答案解析
一、初中化学利用化学方程式的简单计算
1.纳米级TiO2有广泛的应用,制备的一步反应为2FeTiO3+7Cl2+6C=2TiClx+2FeCl3+6CO。该化学方程式中,x的值为
A.2 B.4 C.8 D.14
【答案】B
【解析】
【详解】
根据质量守恒定律,化学反应前后原子的数目不变,反应前氯原子的个数为14个,反应后氯原子的个数为2x+6个,则2x+6=14,得x=4。
故选B。
2.物质X的化学式为H2C2O4,可发生如下反应:aH2C2O4 bH2O↑+cCO2↑+dY↑取45g X,在t℃完全分解,产物通过足量浓硫酸,浓硫酸增重9g,另取45gX,在t℃完全分解,产物通过足量碱石灰(CaO和NaOH的固体混合物),碱石灰增重31g,则下列说法错误的是(已知气体Y不与浓硫酸或碱石灰发生反应)()
A.CO2的质量为22g B.气体Y的质量为14g
C.化学方程式中b∶c=1∶1D.气体Y可能为甲烷
【答案】D
【解析】
A、浓硫酸能吸收反应生成的水,碱石灰既能吸水又能吸收二氧化碳故完全反应分解X生成的二氧化碳的质量为31g﹣9g=22g,正确;
B、根据质量守恒定律,反应物X的质量等于生成的水、二氧化碳和Y的质量总和,故生成气体Y的质量为45g﹣31g=14g,正确;
C、根据反应的方程式可知,反应中生成水和二氧化碳的质量比为18b:44c=9g:22g,可得b:c=1:1;正确;
D、X中H、C原子个数比为1:1,反应生成的水和二氧化碳的分子个数比为1:1,其中氢、碳原子个数比为2:1,则生成y分子中C原子的个数应大于H原子的个数,甲烷中碳原子的个数小于氢原子的个数,错误。故选D。
中考化学计算题(大题培优 易错 难题)含答案解析

一、中考初中化学计算题
1.工业生产的纯碱中常含有少量氯化钠杂质,现称取12 g 纯碱样品于烧杯中,加入水使其完全溶解,逐渐加入氯化钙溶液至过量,测得加入氯化钙溶液的质量与生成沉淀的关系如下图所示。(反应的化学方程式:CaCl 2+Na 2CO 3=CaCO 3↓+2NaCl)
(1)计算样品中碳酸钠的质量分数________(要求写出计算过程,精确到0.1%)。
(2)若要计算氯化钙溶液中溶质的质量分数,可使用上图中_____点的一组数据(填标号)。
【答案】(1)88.3%;(2)a (或 b )
【解析】
由图可以看出生成的碳酸钙的质量为10g ,设碳酸钠的质量为x
2233CaCl +Na CO ==CaCO 2NaCl ↓+
106 100
x 10g
10610010x g
= x =10.6g 样品中碳酸钠的质量分数为10.6100%88.3%12.0g g
⨯≈,当求算氯化钙溶液中质量分数时,由于50g 氯化钙溶液对应的沉淀为4g ,125g 氯化钙溶液对应的沉淀为10g 都是氯化钙完全反应,所以可以根据a 点或者b 点数据计算。
答:(1)计算样品中碳酸钠的质量分数约为88.3%;(2)若要计算氯化钙溶液中溶质的质量分数,可使用图中曲线上示出的点a 或者b 所对应的数据。
2.0g 样品中杂质CaCO 3的质量为4.0g-3.7g=0.3g
(3)设反应的二氧化碳的质量为m ,生成的碳酸氢钙的质量为n
()32232
CaCO +H O +CO =Ca HCO 10044162 5.3g
m n
10044162==5.3g m n
2019中考化学真题 知识点9 质量守恒定律(精确排版+中考真题+难题精粹)

2019中考真题知识点9 质量守恒定律
1.【2019年湖南怀化市】化学反应前后一定发生变化的是
A.原子数目B.分子数目
C.物质种类D.反应前后物质的总质量
2.【2019年湖南省邵阳市】某纯净物X在氧气中高温煅烧的化学方程式为:4X+11O22Fe2O3+8SO2,则X的化学式是
A.FeS B.FeSO4C.FeS2D.Fe2O3
3.【2019年河南省】钠着火不能用二氧化碳灭火。钠在二氧化碳中燃烧生成炭黑和一种白色固体,它可能是
A.碳酸钠B.硫酸钠C.碳酸氢钠D.氢氧化钠
4.【2019年安徽省】如图是一种处理汽车尾气的反应微观示意图,有关说法正确的是
A.反应前后分子总数不变B.反应前后原子种类发生变化
C.反应前后均为纯净物D.该反应可以减少二氧化氮的排放
5.【2019年辽宁省辽阳市】一定条件下,甲、乙、丙、丁四种物质在密闭容器中发生反应,测得反应前后各物质的质量如下表所示。下列说法正确的是
物质甲乙丙丁
反应前质量/g 26 8 2 4
反应后质量/g 1 X 16 15 A.上表中X的值是0 B.该反应的基本反应类型是化合反应
C.乙一定是该反应的催化剂D.丙和丁变化的质量比为14∶11
6.【2019年云南省】在一定条件下,一密闭容器内发生某反应,测得反应前后各物质的质量如下表所示。下列说法不正确的是
物质 a b c d
反应前的质量/g 40 5 16 15
反应后的质量/g X 5 30 26 A.b可能是催化剂B.X的值等于15
C.该反应是分解反应D.参加反应的c与d的质量比为15∶13
人教版初三化学质量守恒定律培优课堂达标练习附答案
人教版初三化学质量守恒定律培优课堂达标练习附答案
一、初中化学质量守恒定律选择题
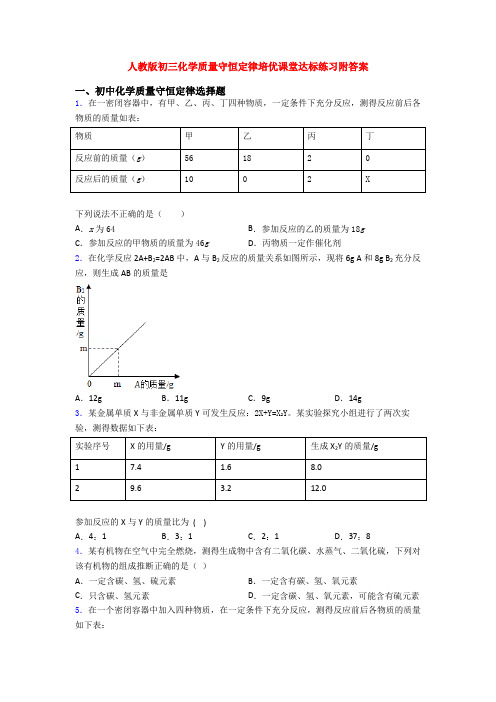
1.在一密闭容器中,有甲、乙、丙、丁四种物质,一定条件下充分反应,测得反应前后各物质的质量如表:
物质甲乙丙丁
反应前的质量(g)561820
反应后的质量(g)1002X
下列说法不正确的是()
A.x为64B.参加反应的乙的质量为18g
C.参加反应的甲物质的质量为46g D.丙物质一定作催化剂
2.在化学反应2A+B2=2AB中,A 与B2反应的质量关系如图所示,现将6g A和8g B2充分反应,则生成AB的质量是
A.12g B.11g C.9g D.14g
3.某金属单质 X与非金属单质Y可发生反应:2X+Y=X2Y。某实验探究小组进行了两次实验,测得数据如下表:
实验序号X的用量/g Y的用量/g生成X2Y的质量/g
17.4 1.68.0
29.6 3.212.0
参加反应的X与Y的质量比为 ( )
A.4:1 B.3:1 C.2:1 D.37:8
4.某有机物在空气中完全燃烧,测得生成物中含有二氧化碳、水蒸气、二氧化硫,下列对该有机物的组成推断正确的是()
A.一定含碳、氢、硫元素B.一定含有碳、氢、氧元素
C.只含碳、氢元素D.一定含碳、氢、氧元素,可能含有硫元素5.在一个密闭容器中加入四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表:
物质甲乙丙丁
反应前质量/g22215
反应后质量/g1029待测
通过分析,判断下列说法不正确的是
A.甲是生成物B.测得反应后丁的质量为4g
C.乙可能是催化剂D.该反应是分解反应
中考化学专题复习:质量守恒定律和化学方程式(含答案)

质量守恒定律和化学方程式
一、选择题
1.自然科学的发展使我们的生活变得丰富多彩。通过化学的学习,你觉得下列情况中不可能实现的是( )
A .通过化学反应使水直接变成汽油
B .用点燃闻气味法区分聚乙烯和聚氯乙烯
C .用人工的方法合成结晶牛胰岛素
D .用高温煅烧法除去氧化钙中的碳酸钙
2.根据化学方程式A +NaOH== B 十H20推断,B,A 的相对分子质量相差( ) A. 12 B. 18 C .22 D.40 3.下列化学反应可用右图表示的是( ) A .H 2CO 3 △ CO 2↑+H 2O B .2H 2SO 3 + O 2 ===2H 2SO 4 C .2HClO 光照 2HCl+O 2↑ D .CaCO 3 高温 CaO+CO 2↑
4.据报道,美国宇航局的专家发明了“月球制氧机”,这种“月球制氧机”利用聚焦太阳能产生的高温使月球土壤发生化学反应制取氧气,据此可推测月球土壤中一定含有( ) A.氧元素 B.氧气 C.水 D.氯酸钾
5.如图所示的微观变化与下列反应及反应类型对应正确的是( )
A .2CO + O 2 ===== 2CO 2 化合反应
B .2HI + Cl 2 ==== 2HCl + I 2 置换反应
C .2H 2O ===== 2H 2↑ + O 2↑ 分解反应
D .2HCl + CuO ==== CuCl 2 + H 2O 复分解反应 6.下列叙述完全符合质量守恒定律的是( )21世纪教育网 A .水结成冰前后,质量保持不变21世纪教育网
B .50mL 水和50 mL 乙醇混合后总体积小于100 mL21世纪教育网
压轴题01 质量守恒定律及其应用-【蝶变中考】2023年中考化学压轴题突破(全国通用)(解析版)

压轴题01质量守恒定律及其应用
题型一:密闭容器中质量变化的数据处理
题型二:化学反应微观示意图类
题型三:推断化学方程式中未知物质的化学式
题型四:守恒法分析化学反应(文字描述型)
题型五:守恒法分析化学反应(图像描述型)
质量守恒定律
1.概念:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
2.化学反应前后的“变”与“不变”:
①六个一定不变:
宏观:元素的种类不变、元素的种类不变、物质的总质量不变
微观:原子的种类不变、原子的数目不变、原子的质量不变
②两个一定变:
宏观:物质的种类一定改变
微观:分子的种类一定改变
③两个可能变:
宏观:元素的化合价可能改变
微观:分子的数目可能改变
题型一:密闭容器中质量变化的数据处理
1.(2022秋·山东枣庄·九年级期末)一定条件下,在一个密闭容器内发生某反应,测得反应前后各物质的质量如图所示,下列说法正确的是
题型二:化学反应微观示意图类
A.反应Ⅰ中反应物是水,生成物是氢气和氧气
B.反应中保持不变的微粒是氢、氧原子
C.反应Ⅰ、Ⅱ中两种催化剂的质量都减小
D.反应实现了电能向化学能的转化
【答案】B
【详解】A、由图可知,反应Ⅰ中,反应物为水,生成物为氢气和H2O2,该选项说法不正确;
B、化学反应前后,原子的种类和个数不变,该反应涉及的原子只有氢、氧元素,则反应中保持不变的微粒是氢、氧原子,该选项说法正确;
C、反应前后,催化剂的质量不变,该选项说法不正确;
D、该反应是在太阳光的作用下进行,则实现了由太阳能转化为化学能的转化,该选项说法不正确。
故选B。
9.(2023·江苏扬州·统考一模)据文献报道,利用电催化反应可将CO2还原为清洁燃料CO,部分反应机理如图(吸附在催化剂表面上的物种用*标注)。下列说法正确的是
备战中考化学专项真题训练——质量守恒定律及应用(含答案)
备战中考化学专项真题训练——质量守恒定律及应用
一、选择题(每小题只有一个最符合题目要求的选项)
1.(2021贵州安顺)下列四个实验不能达到实验目的的是()
A. 探究甲烷中含有碳元素
B. 探究质量守恒定律
C. 探究不同物质在同种溶剂中的溶解性
D. 探究木炭的还原性
2.(2021南通)取24.8g过氧化银(Ag2O2)在真空条件下加热至固体质量不再发生变化,产生
3.2gO2,固体质量随温度的变化如图所示(图中各点对应固体均为纯净物)。下列说法正确的是()
A. X→Y过程中,固体中银元素的质量分数逐渐减小
B. Y 点对应的固体中银元素和氧元素的质量比为27:4
C. Z →W 过程中产生的氧气质量为2.4g
D. Z →W 过程中发生的反应为222Ag O 4Ag ΔO +↑
3.(2021湖南益阳)工业生产硫酸的过程中,SO 2催化氧化反应前后的微观示意图如图。下列说法正确的是( )
A. 反应后分子数目减少
B. 反应后催化剂质量减少
C. 示意图中共有2种单质
D. 参加反应的两种分子个数比为1:1
4.(2021青海西宁)某化学反应的反应物和生成物的微观示意图及反应前后的质量如下表所示。下列有关该反应的说法不正确的是( ) 物质 甲 乙 丙 丁
微观示意图
反应前质量/g 16 32 0 0
反应后质量/g 8 0 22 X
A. X 的值为18
B. 反应过程中共涉及三种氧化物
C. 反应前后原子的种类、数目均不变
D. 反应中甲和乙变化的质量比为1:4
5.(2021湖北)化学学习常用化学思维去认识和理解世界,下列说法错误的个数有( )
中考化学计算题(大题培优 易错 难题)含答案

一、中考初中化学计算题
1.为测定石灰石样品中碳酸钙的含量,小明取25g 石灰石样品与一定质量的14.6%的稀盐酸恰好完全反应,将反应所得混合物蒸干得到固体27.2 g (不含结晶水,假设样品中的杂质既不与稀盐酸反应)。试计算: (1)参加反应的盐酸的质量______。 (2)石灰石样品中碳酸钙的含量______。 【答案】100g 80% 【解析】 【分析】 【详解】
设样品中杂质的质量为x ,反应消耗盐酸的为y
3222CaCO +2HCl =CaCl +CO +H O
1007311125g-x
14.6%y 27.2g-x
↑⨯ 10073111
==25g-x 14.6%y 27.2g-x ⨯ x=5g y=100g
石灰石样品中碳酸钙的质量分数为
25g-5g
100%=80%25g
⨯ 答:样品中碳酸钙的含量为80%,反应消耗盐酸的为100g 考点:根据化学方程式的计算
2.将Na 2CO 3和NaCl 固体混合物32.9g 放入烧杯中,此时总质量为202.9g ,加入326.9g 盐酸,恰好完全反应,待没有气泡逸出后再次称量,总质量为521.0g .计算所得溶液中溶质的质量分数______(CO 2的溶解忽略不计). 【答案】10 【解析】 【分析】
首先根据质量守恒定律:化学反应前后,物质的质量不变,可先求出产生的气体二氧化碳的质量=202.9g+326.9g-521.0g=8.8g ,再根据化学反应方程式:
Na 2CO 3+2HCl=2NaCl+H 2O+CO 2↑可知,反应后所得溶液中溶质是NaCl ,但NaCl 来自两部分,一是反应生成的,二是原固体混合物中含有的,生成的NaCl 可通过化学方程式来求解,原固体混合物中含有的NaCl 可通过混合物32.9g 减去Na 2CO 3的质量 【详解】
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5、7、38、8,根据反应前后原子种类、数目不变,则 3R 分子中含有 3 个钙原子、3 个碳
原子和 9 个氧原子,则每个 R 分子由 1 个钙原子、1 个碳原子和 3 个氧原子构成,则物质
X 的化学式为 CaCO3。 故选:A。
【点睛】
本题难度不大,掌握质量守恒定律,根据化学反应前后原子种类、原子个数均不变解答即
的质量是 16g-15g=1g,该反应是 Y+W+Z==X。
【详解】
A.该反应不是分解反应,错误;B.该反应为化合反应,正确;C.m=1-1=0,错误;D.反应后
容器中 Z 与 Y 的质量比为 6:0,错误。故选 B。
14.蛋白质是由丙氨酸(C3H7NO2)等多种氨基酸构成的。以下说法错误的是
A.丙氨酸由四种元素组成
催化剂
根据图中的微粒模拟图,可推测其反应的化学方程式为: CH2O+O2
CO2 +H2O
CH2O+O2CO2+H2O。 【详解】 A、置换反应是指由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反 应,该反应的生成物是两种化合物,错误; B、根据 O2、CO2、H2O 都无毒,可推测这种有毒气体的化学式为 HCHO,正确; C、四种物质中,只有 CO2、H2O 两种物质属于氧化物,其余物质不是氧化物,错误; D、根据化学方程式可知,该反应中 A 与 C 的质量比=30:44,错误。 故选 B。
4.托盘天平两边放两个等质量的烧杯、内装浓度和质量都相同的稀盐酸,若左杯中投入一 块生石灰,向右边杯中投入一块石灰石,且两块固体质量相等,则反应后天平的指针将 () A.偏向左边 B.偏向右边 C.仍指零处 D.无法确定 【答案】A 【解析】 【详解】 生石灰即氧化钙,虽与盐酸反应,但无气体生成;石灰石主要成分是碳酸钙,与盐酸反应 会产生二氧化碳气体,两固体质量相等,由于石灰石一侧产生气体,故质量减小,天平指 针偏向另一侧。选 A。
1:12,故选项错误。故选 B。
10.学习化学需要使用化学符号。下列叙述正确的是 A.NH3 中的 3 表示 3 个氨气分子 B.铝片表面氧化物的化学式为 AlO C.2N 表示 2 个氮原子或 2 个氮元素 D.氯化钠溶液中含有 Na+和 Cl﹣ 【答案】D 【解析】 【详解】 A. NH3 中的 3 表示 1 个氨气分子中有 3 个氢原子,此选项错误; B. 铝片表面氧化物的化学式为 Al2O3,此选项错误; C. 由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前
3.一定条件下,某装置中发生了化学反应,测得反应前后各物质的质量变化如下表所示。
下列说法中,正确的是( )
物质
甲
乙
丙
丁
反应前的质量/g
60
1.5
0
0
反应后的质量/g
33
x
24
3
A.x 的值等于 0.5 B.丙和丁的质量变化比为 8:1 C.乙一定是催化剂 D.该反应是化合反应 【答案】B 【解析】 【分析】 由表中数据分析可知,反应前后甲的质量减少了 60g﹣33g=27g,故是反应物,参加反应 的质量为 27g;同理可以确定丙是生成物,生成的质量为 24g﹣0g=24g;丁是生成物,生 成的质量为 3g﹣0g=3g;由质量守恒定律,乙的质量不变,可能作该反应的催化剂,也可 能没有参加反应。 【详解】 A、乙的质量不变,x 的值等于 1.5,故选项说法错误; B、丙和丁的质量变化比为 24g:3g=8:1,故选项说法正确; C、乙的质量不变,可能作该反应的催化剂,也可能没有参加反,故选项说法错误; D、该反应的反应物为甲,生成物是丙和丁,符合“一变多”的形式,属于分解反应,故 选项说法错误。 故选 B。
=
×100% =31.6%,错误。故选 B。
点睛:结合新信息,灵活运用化学式的意义是解题的关键。
6.软玉也称“中国玉”,以新疆“和田玉”为代表,生成“和田玉”矿床的反应方程式是
5CaMg(CO3)2+8SiO2+H2O=Ca2Mg5(Si4O11)2(OH)2+7CO2↑+3R,则 R 的化学式为( )
16.下图为某化学反应的微观模拟示意图,下列说法中,不正确的是
A.该反应不属于置换反应 B.图示中 x 的数值为 3
点睛:
化学反应的实质一般是指在化学变化中,分子分成原子,原子重新组合成新的分子(或直
接聚集构成新物质)。
12.我国科学家研制出一种催化剂,能在室温下高效催化空气中一种有毒气体,其反应如 图:下列说法,正确的是( )
A.该反应属于置换反应 B.这种有毒气体的化学式为 HCHO C.其中有三种物质属于氧化物 D.该反应中 A 与 C 的质量比为 1:1 【答案】B 【解析】 【分析】
2.工业制钛反应为:TiF4+2H2SO4 Δ 4HF+2X+TiO2,X 的化学式为
A.H2S 【答案】D
B.P4
C.SO2
D.SO3
【解析】
【详解】
加热
由 TiF4+2H2SO4
4HF+2X+TiO2 可知,反应前后钛原子都是 1 个,氟原子都是 4 个,氢
原子都是 4 个,反应前硫原子是 2 个,反应后应该是 2 个,包含在 2X 中,反应前氧原子是 8 个,反应后应该是 8 个,其中 6 个包含在 2X 中,X 的化学式是 SO3。 故选:D。
15.下图为某反应的部分微观示意图,其中不同的球代表不同元素的原子。下列说法正确 的是( )
A.该反应属于置换反应 B.参加反应的两种分子个数比为 1:1 C.1 个 X 分子中含有 3 个原子 D.1 个 X 分子中含有 3 种不同的原子 【答案】C 【解析】 【分析】 由图可知,不同球代表不同元素的原子,两种化合物反应生成单质与化合物,由原子守恒 可知,X 中含 1 个大黑球和 2 个小白球,以此来解答。 【详解】 A.反应物无单质,不属于置换反应,故 A 错误; B.由图可知,参加反应的两种分子个数比为 1:2,故 B 错误; C.原子守恒可知,X 中含 1 个大黑球和 2 个小白球,即 1 个 X 分子中含有 3 个原子,故 C 正确; D.X 中含 1 个大黑球和 2 个小白球,有 2 种不同原子,故 D 错误; 故选:C。
加上相应的数字,2N 表示 2 个氮原子,元素是一个宏观概念,无数量的意义,此选项错 误; D. 氯化钠溶液中含有 Na+和 Cl﹣,此选项正确。 故选 D。
11.如图为某反应的微观示意图,下列说法正确的是( )
A.该反应属于分解反应
B.反应前后分子种类没有改变
C.反应前后原子数目发生改变
D.参加反应的两种分子个数比为 1:1
A.CaCO3
B.Ca(OH)2
C.Mg(OH)2
D.MgCO3
【答案】A
【解析】
【分析】
根据质量守恒定律,反应前后元素种类及原子个数均不变。
【详解】
由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式
5CaMg(CO3)2+8SiO2+H2O=Ca2Mg5(Si4O11)2(OH)2+7CO2↑+3R,反应前钙、镁、碳、氧、硅原子 个数分别为 5、5、10、47、8,反应后的生成物中钙、镁、碳、氧、硅原子个数分别为 2、
5.过氧乙酸(C2H4O3)是常见的消毒剂。下列有关过氧乙酸的说法正确的是 A.分子中含 O3 分子 B.氢、氧原子的个数比为 4:3 C.分子中有 9 种元素 D.碳的质量分数为 24% 【答案】B 【解析】A.分子是由原子构成的,过氧乙酸分子中含有氧原子,不是 O3 分子,错误; B.由化学式可知,过氧乙酸(C2H4O3)中氢、氧原子的个数比为 4:3,正确;C.分子是 由原子构成的,不是由元素组成的,错误;D.过氧乙酸(C2H4O3)中碳元素的质量分数
【答案】B
【解析】
【分析】
反应后质量减少的物质是反应物,减少的质量是参加反应的质量,反应后质量增多的物质
是生成物,增多的质量是生成的质量。X 反应后质量增多,是生成物,生成的质量是 18g-
2g=16g,Z 反应后质量减少,是反应物,参加反应的质量是 16g-6g=10g,W 反应后质量减
少,是反应物,参加反应的质量是 16g-11g=5g,5g+10g<16g,所以 Y 是反应物,参加反应
可。
7.质量守恒定律是帮助我们认识化学反应实质的重要理论.某物质与水和氧气反应的化学
方程式为 2R+2H2O+7O2 =2FeSO4 +2H2SO4 :则 R 的化学式应为
A.FeS
B.Fe2S3
C.FeO
D.FeS2
【答案】D
【解析】
【分析】
根据质量守恒定律,反应前后原子个数不变。
【详解】
根据质量守恒定律,反应前后原子个数不变,反应物中氢、氧原子个数分别为 4、16,反 应后的生成物中氢、硫、氧、铁原子个数分别为 4、4、16、2,根据反应前后原子种类、
9.过氧乙酸(C2H4O3)是常见的消毒剂。下列有关过氧乙酸的说法正确的是
A.过氧乙酸中含有 O3 分子
B.过氧乙酸中碳元素的质量分数为 31.6%
C.过氧乙酸的相对分子质量为 76g
D.过氧乙酸中碳、氢、氧元素质量比为
2:4:3
【答案】B
【解析】
【详解】
A、过氧乙酸(C2H4O3)是由分子构成的,分子是由原子构成的,过氧乙酸分子中含有氧 原子而不是 O3 分子,故选项错误;
13.在一个密闭容器中放入 X、Y、Z、W 四种物质,在一定条件下发生化学反应,一段时 间后,测得有关数据如下表。则关于此反应的认识正确的是()
物质
X
Y
Z
W
反应前的质量(g)
2
1
16
16
反应后的质量(g)
18
m
6
11
A.该反应为分解反应
B.该反应为化合反应
C.m=1
D.反应后容器中 Z 与 Y 的质量比为 1:6
数目不变,则 2R 中含有 2 个铁原子和 4 个硫原子,则化学式为 FeS2 ,故选 D。
8.常温下,氯气与苛性钠溶液反应产物是氯化钠、次氯酸钠(NaClO)和水。次氯酸钠中氯 元素的化合价为 A.-1 B.+1 C.-2 D.+2 【答案】B 【解析】NaClO 中钠元素的化合价为+1 价,氧元素的化合价为-2 价,设氯元素的化合价为 x ,根据化合价的代数和为 0,+1+x+(-2)=0,得 x=+1,故选 B。
中考化学化学质量守恒定律(大题培优 易错 难题)含答案
一、初中化学质量守恒定律
1.图反映了某个化学反应各物质质量与时间的关系。下列描述正确的是
A.该反应是化合反应 B.甲的相对分子质量大于乙 C.丙是反应物,甲和乙是生成物 D.t1 时,丙的质量一定等于甲、乙的质量之和 【答案】C 【解析】 【分析】 【详解】 A、由图知从 0 到 t1 时间内丙物质逐渐减少,甲乙两物质逐渐增加。所以,丙为反应物, 甲、乙为生成物,该反应分解反应,描述错误; B、甲的生成量比乙多,但分子个数不知,相对分子质量甲不一定比乙大,描述错误; C、 丙是反应物,甲和乙是生成物,描述正确; D、t1 时,参加反应的丙质量一定等于甲、乙的质量之和,描述错误。 故选 C。
B.一个丙氨酸分子中含有 13 个原子
C.丙氨酸中氮、氢元素的质量比为 2:1 D.丙氨酸中氮元素的质量分数最小
【答案】D
【解析】 【详解】 A、丙氨酸是由碳、氢、氧、氮四种元素组成的,故选项说法正确; B、1 个丙氨酸分子是由 3 个碳原子、7 个氢原子、2 个氧原子和 1 个氮原子构成的,则一 个丙氨酸分子中含有 13 个原子,故选项说法正确; C、丙氨酸中氮元素与氢元素的质量比为 14:(1×7)=2:1,故选项说法正确; D、丙氨酸中各元素的质量比为 C:H:N:O=36:7:14:32,故氢元素的质量分数最小 ,故选项说法错误。 故选:D。
【答案】D
【解析】
A、根据图可知:两种单质生成一种化合物,属于化合反应,不属于分解反应,故错误;
B、根据图可知:氢分子和氯分子变化成了氯化氢分子,反应前后分子种类发生了改变,故
错误;
C、由微粒的变化可知,反应前后原子数目没有发生改变,故错误;
D、由微粒的变化可知,参加反应的两种分子个数比为 1:1,故正确。
B、过氧乙酸(C2H4O3)中碳元素的质量分数为:
12 2
×来自百度文库00%=31.6%,故
12 2 1 4 163
选项正确;
C、过氧乙酸的相对分子质量为122 14 163 =76,相对分子质量的单位为 1,常省
略,故选项错误;
D、过氧乙酸中,碳、氢、氧三种元素的质量比为(12×2):(1×4):(16×3)=6:
