生物化学期末总复习资料(双语)
生物化学期末复习资料:生化英文名词解析.docx

生化英文名词解析这是旭哥整理的〜一.糖代谢1.glycolysis:糖酵解,在缺氧条件下,葡萄糖分解成乳酸并释放能量的过程。
称糖酵解。
2.gluconeogenesise:糖界牛,从非糖物质形成葡萄糖称为糖界牛作用。
3.pentose phosphate pathway:磷酸戊糖途径,是除糖酵解生成丙酮酸进入TCA循环氧化供能的糖代谢主要途径外的另一主要途径。
这条途径产生磷酸戊糖和NADPH O(书上我自己总结的话。
)葡萄糖在动物组织中降解代谢的重要途径之一。
其循环过程中,磷酸己糖先氧化脱竣形成磷酸戊糖及NADPH,磷酸戊糖又可重排转变为多种磷酸糖酯;NADPH则参与脂质等的合成,磷酸戊糖是核糖来源,参与核苜酸等合成。
(another百度百科)4.glycogenolysis:®原分解,糖原先分解成6■磷酸葡萄糖,在肌肉中进入酵解途径,在肝中经6■磷酸葡萄糖磷酸酶催化水解为葡萄糖,释放至血液的过程称为糖原分解。
(表信我==)5.glycogenesis:糖原合成,由很多磷酸化的葡萄糖经过一步步酶促反应最后生成糖原的过程叫糖原合成。
(一定表信我二二)6.Oxidative Phosphorylation:氧化磷酸化,代谢物氧化脱氢,经呼吸链传递给氧牛成水,同时释放能量,使ADP磷酸化生成ATP,氧化与磷酸化偶联。
7.aerobic oxidation:糖的有氧氧化,葡萄糖或糖原在有氧条件下彻底氧化成出0和C02,同时释放出能量的过程,这是糖氧化的主要方式。
8.tricarboxylic acid cycle:三竣酸循环,又称柠檬酸循环或Kreb循环,rti—系列反应组成。
因反应途径以生成三个竣基的柠檬酸开始,故名三竣酸循环。
ctate cycle (Cori cycle):乳酸循环,肌肉收缩通过糖酵解主成乳酸,乳酸经血液入肝,在肝内异生为葡萄糖,葡萄糖进入血液后又可被肌肉摄取,此循坏称为乳酸循坏(Cori循环)。
生化复习重点

中英文转译:开放读码框架(open reading frame) ORM脱氧核糖核酸(deoxyribonucleic acid) DNA聚合酶链式反应(polymerase chain reaction) PCR腺嘌呤核糖三磷酸(adenosine triphosphate) ATP三羧酸循环(tricarboxylic acid cycle) TCA转录(transcription)辅酶(coenzyme)氨基酸(amino acid)糖酵解(glycolysis)内含子(intron)外显子(exon)以下是跟重点有关的知识:哺乳动物肌糖原降解可以提高血糖水平氨基酸不可以用酸碱滴定法滴定真核生物不能同时转录和翻译,而原核生物可以嘌呤核苷酸从头合成顺序是先合成次黄苷酸(IMP),再转变成AMP和GMP端粒酶由蛋白质RNA组成的复合物米氏常数与酶的浓度无关,但与酶的性质有关真核生物胞液中产生的NADH是通过甘油-α-磷酸穿梭系统和苹果酸穿梭系统进入线粒体的解偶联剂的作用是把呼吸链和ADP磷酸化分开,但不能阻止呼吸链中电子的传递脂肪酸的合成过程不是β氧化的逆过程戊糖不是合成核酸的原料糖酵解的起始物是葡萄糖,终止物是丙酮酸,乳酸在肝脏中转变为葡萄糖(糖异生)糖酵解的反应场所是胞液,TCA的反应场所是线粒体,脂肪酸β氧化是在线粒体进行三羧酸循环中唯一一个底物水平磷酸化的反应是琥珀酰CoA转化为琥珀酸的反应(GTP)合成脂肪酸所需要的NADH来源于戊糖磷酸途径氨基酸代谢中的转氨酶和脱羧的辅酶分别是磷酸吡哆醛和磷酸吡哆胺(吡哆醛-5’-磷酸)β氧化中生成的脑可利用的物质是酮体(β氧化又产生酮体么?)在鸟氨酸循环中,尿素最终由精氨酸水解而产生痛风症是X连锁隐性遗传大多数转氨酶需要α-酮戊二酸作为氨基酸受体GOT(谷草转氨酶)在心脏中活性最高鸟氨酸循环中,合成尿素的氨,一分子来源于谷氨酸的氧化脱氨(游离的氨,与二氧化碳、A TP、水生成氨甲酰磷酸),一分子来自于天冬氨酸哺乳动物合成尿素的主要器官是肝脏,在肾中排泄(某些蛋白质)在蛋白质合成中,有一个N-末端信号序列,,即信号肽,引导蛋白质进入内质网腔DNA和RNA合成链的延长方向都是5`-3`DNA加热变性,对紫外线吸收增加,这叫增色效应DNA聚合酶的大片段没有5`-3`的外切酶(切除引物的功能)大肠杆菌DNA复制中,冈崎片段中的RNA引物是由DNA聚合酶I切除的内含子是可以自我剪接的,由此发现了核酶多肽链合成时,核糖体的移动方向为5`-3`tRNA的摆动性反映在反密码子的第1位,密码子的第3位mRNA的前体是hnRNA稀有碱基存在于mRNA中(似乎是tRNA才对)问答(只是猜测题)(好像有这三道题)蛋白质分离过程方法对比(包括特点,原理,优缺点)可逆性抑制的机理,影响,特点TCA循环与乳酸,糖,脂肪酸,蛋白质转化的关联RNA病毒容易突变的原因茚三酮蛋白质一级测序原理(异硫氰酸苯脂)DNA测序的引物标记酶的调节方式等电点性质米氏方程酶分子活性中心重点范围:P21氨基酸的结构通式:从蛋白质水解得到的均为L-α-氨基酸,不过,某些抗生素中存在D型氨基酸P22~24非极性,极性不带电荷,带负电荷,带正电荷氨基酸.有特殊官能团的要着重(如色氨酸,脯氨酸,酪氨酸,丝氨酸等)P25等电点性质,溶解度,沉淀的方法P26茚三酮的反应,注意脯氨酸和羟脯氨酸P29异硫氰酸苯脂反应P51最后一段,蛋白质在等电点时,以两性离子形式存在,其总静电荷为零P56蛋白质的分离和分析技术.优缺点,特点,原理P66核苷的组成,戊糖和碱基是用3’-5’磷酸二酯键连接P88mRNA的前体是hnRNAP91紫外线吸收性质,增色效应P92~P93核酸的变性和复性P147酶的专一性P150酶的活性部位P160米氏方程.双倒数法的图.另外把这个也记了[ES]=[E][S]/([S]+Km)P163抑制剂的影响作用,双倒数的三个图,Km,Vmax将如何变化P169理解”ATP与CTP对ATCase活力的影响”这个图第七章无重点P220氧化磷酸化的抑制剂,作用原理P221胞液中NADH的跨膜运转两个穿梭系统:甘油-α-磷酸穿梭系统和苹果酸穿梭系统.第九章糖类和第十章脂质代谢全是重点(除磷脂等老师说删去的地方)P291谷草转氨酶(GOT/AST),谷丙转氨酶(GPT/ALT)的转氨作用.其中,GOT在心脏的活力最大,而GPT在肝中的活力最大转氨酶的辅酶是吡哆醛-5-磷酸P298尿素是从精氨酸上水解而得,尿素的两个氨,一分子来源于谷氨酸的氧化脱氨,一分子来源于天冬氨酸P316痛风症的形成原因.原发性痛风症是X连锁隐性遗传病,多见于男性P318嘌呤核苷酸的从头合成(先合成IMP,再由IMP转化为AMP和GMP)P328整面.嘌呤类似物或嘧啶类似物或核苷类似物的抗癌原理.P338Klenow片段.是什么,有什么功能(DNA聚合酶Ⅰ的大片段,有校正功能)P345一旦冈崎片段被合成完毕……由DNA连接酶连接P353RNA病毒不稳定的原因:RT无3’-外切核酸酶活性…..主要原因P377最后一句话,核酶发现的原因P393起始密码子和终止密码子P394tRNA的摆动性体现在哪里?即P395第一句P407信号肽.及功能。
期末生物化学中英单词

11.binding group结合集团
12.activator激活剂
13.inhibitor抑制剂
1.nucleic acid核酸
2.ribonucleic acid核糖核酸
3.deoxy-脱氧-
4.nucleotide核苷酸
5.nucleoside核苷
6.base碱基
7.base pair (bp)碱基对
8.ribonuclease(RNase)核糖核酸酶
9.deoxy- (DNase)脱氧核糖核酸酶
1.lipid脂质
2.triacylglycerol三酰甘油
3.mono-单酰甘油
4.di-二酰甘油
5.glycerol甘油
6.fatty acid脂肪酸
16. membrane protein
1.glycolysis糖酵解
2.fermentation发酵
4.alcohol乙醇
5.ethanol乙醇
6.tricarboxylic acid cycle三羧酸循环
7.citrate cycle柠檬酸循环
8.glyconeogenesis糖异生
9.metabolism新陈代谢
9.β-hydroxybutyricacidβ-羟基丁酸
1.DNA polymeraseDNA聚合酶
2.primer引物
3.template模板
4.DNA ligaseDNA连接酶
5.leading strand前导链
gging strand后随链
7.promoter启动子
8.transcription转录
3.amino acid (AA)氨基酸
生物化学英汉双语名词解释

生物化学期末复习资料

生化下期末复习资料一、蛋白质与氨基酸的分解代谢与合成1、脱氨基作用的种类?(转氨基作用与联合脱氨基作用)分类:氨基酸的转氨基作用、氧化脱氨基作用、其他的脱氨基作用、联合脱氨基作用。
氨基酸的转氨基作用:酮酸间的氨基转移反应。
除赖氨酸、苏氨酸和甘氨酸外,其-氨基酸和α转氨基作用是α余α-氨基酸均可参加转氨基作用,且各有其特异的转氨酶。
转氨酶中,以谷丙转氨酶GPT和谷草转氨酶GOT最为重要。
GOT 和 GPT 人体中,GOT在心脏中活力最大,其次是肝脏中;GPT则在肝脏中活力最大。
当肝细胞受损时,GPT释放到血液中,使血液中GPT酶活力上升。
所以临床上将其作为推断肝功能正常与否的一项指标。
转氨酶种类很多,但辅酶只有一种:磷酸吡哆醛。
转氨基作用为可逆反应。
联合脱氨基作用:一般认为,氨基酸在体内不是直接氧化脱氨基,而是先与α-酮戊二酸经转氨基作用转变为相应的α-酮酸和谷氨酸,谷氨酸再通过2种方式氧化脱氨基。
1.转氨酶-谷氨酸脱氢酶的联合脱氨基作用:过程:α-氨基酸先与α-酮戊二酸在转氨酶的催化下,经转氨基作用,生成相应的α-酮酸和谷氨酸;谷氨酸再经谷氨酸脱氢酶的作用,进行氧化脱氨基,重新生成α-酮戊二酸,并释放出氨。
2.转氨酶-嘌呤核苷酸循环联合脱氨基作用:α-酮戊二酸先接受来自其他氨基酸的氨基,生成谷氨酸;谷氨酸再与草酰乙酸经转氨基生成天冬氨酸。
之后便与嘌呤核苷酸联合作用:次黄嘌呤核苷酸与天冬氨酸作用,生成中间产物:腺苷酸代琥珀酸。
此物在裂合酶催化下,分裂成腺苷酸和延胡索酸。
腺苷酸水解后产生游离氨和次黄嘌呤核苷酸。
2种联合脱氨基作用在如:肝脏、肾脏等组织处,以转氨酶-谷氨酸脱氢酶的联合脱氨基作用为主。
在心肌、骨骼肌和脑组织中,以转氨酶-嘌呤核苷酸循环联合脱氨基作用为主。
如:脑组织中有50%的氨是由转氨酶-嘌呤核苷酸循环联合脱氨基作用产生的。
2、尿素循环?主要机理:排尿素动物在肝脏中合成尿素。
由2分子α-氨基酸脱下的氨基,即2分子氨,和1分子CO2经鸟氨酸循环,生成1分子尿素,反应需3分子ATP参与。
生物学专业英语期末考试知识点总结
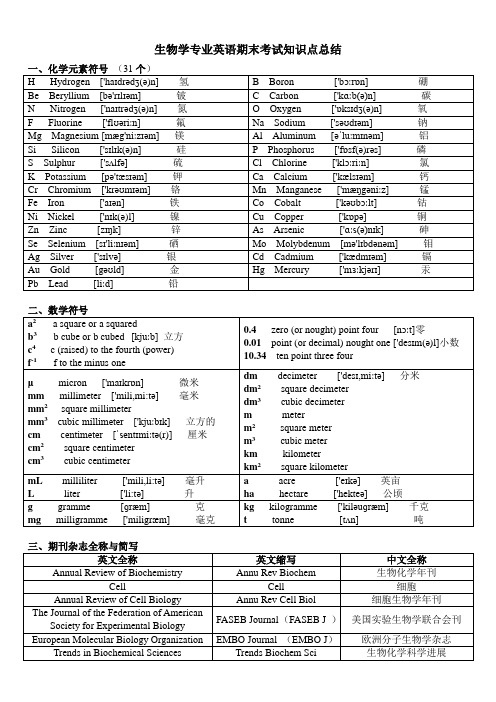
生物学专业英语期末考试知识点总结一、化学元素符号(31个)HHydrogen ['haɪdrədʒ(ə)n] 氢 B Boron ['bɔːrɒn]硼Be Beryllium [bə'rɪlɪəm] 铍 C Carbon ['kɑːb(ə)n]碳N Nitrogen ['naɪtrədʒ(ə)n] 氮OOxygen ['ɒksɪdʒ(ə)n] 氧F Fluorine ['flʊəriːn]氟Na Sodium ['səʊdɪəm] 钠Mg Magnesium[mæg'niːzɪəm] 镁Al Aluminum [əˈluːmɪnəm] 铝Si Silicon ['sɪlɪk(ə)n] 硅P Phosphorus['fɒsf(ə)rəs] 磷S Sulphur['sʌlfə] 硫Cl Chlorine['klɔːriːn]氯K Potassium [pə'tæsɪəm]钾Ca Calcium ['kælsɪəm]钙Cr Chromium['krəʊmɪəm]铬Mn Manganese['mæŋgəniːz]锰Fe Iron ['aɪən]铁Co Cobalt['kəʊbɔːlt]钴Ni Nickel['nɪk(ə)l] 镍Cu Copper['kɒpə] 铜Zn Zinc[zɪŋk]锌As Arsenic ['ɑːs(ə)nɪk]砷Se Selenium[sɪ'liːnɪəm]硒Mo Molybdenum[mə'lɪbdənəm]钼Ag Silver['sɪlvə]银Cd Cadmium ['kædmɪəm]镉Au Gold[gəʊld] 金Hg Mercury ['mɜːkjərɪ] 汞Pb Lead [liːd] 铅二、数学符号a2a square or a squaredb3 b cube or b cubed[kjuːb]立方c4 c (raised) to the fourth (power) f-1 f to the minus one 0.4 zero (or nought) point four[nɔːt]零0.01point (or decimal) nought one['desɪm(ə)l]小数10.34ten point three fourμ micron ['maɪkrɒn] 微米mm millimeter ['mili,mi:tə]毫米mm2 square millimetermm3cubic millime ter ['kjuːbɪk]立方的cm centimeter [ˈsentɪmiːtə(r)] 厘米cm2square centimetercm3cubic centimeter dm decimeter ['desɪ,miːtə]分米dm2square decimeterdm3 cubic decimeterm meterm2 square meterm3cubic meterkm kilometerkm2 square kilometermL milliliter['mili,li:tə]毫升L liter ['li:tə] 升a acre ['eɪkə] 英亩ha hectare ['hekteə]公顷g gramme [ɡræm] 克mg milligramme ['miligræm]毫克kg kilogramme ['kiləuɡræm]千克t tonne [tʌn]吨三、期刊杂志全称与简写英文全称英文缩写中文全称Annual Review of Biochemistry Annu Rev Biochem 生物化学年刊Cell Cell 细胞Annual Review of Cell Biology Annu Rev Cell Biol 细胞生物学年刊The Journal of the Federation of AmericanSociety for Experimental BiologyFASEB Journal (FASEB J )美国实验生物学联合会刊European Molecular Biology Organization EMBO Journal (EMBO J)欧洲分子生物学杂志Trends in Biochemical Sciences Trends Biochem Sci 生物化学科学进展Molecular and Cellular Biology MolCell Biol 分子与细胞生物学杂志Journal of Biological Chemistry J Biol Chem 生物化学期刊Plant Cell Plant Cell 植物细胞Molecular Pharmacology Mol Pharmacol 分子药理学DNA Cell Biology DNA Cell Biol DNA细胞生物学Journal of Molecular Biology J Mol Biol 分子生物学期刊Biochemistry Biochemistry 生物化学Cell Growth and Differentiation CellGrowthDiffer 细胞生长与分化Methods in Enzymology Method Enzymol 酶学方法Molecular Microbiology Mol Microbiol 分子微生物学Journal of Neurochemistry J Neurochem 神经化学杂志Progress in Biophysics & MolecularBiologyProgBiophysMolBiol 生物物理和分子生物学进展Advances in Microbial Physiology Adv Microb Physiol 微生物生理学进展Molecular Biology and Evolution MolBioEvol 分子生物学与进化Journal of Cellular Biochemistry J Cell Biochem 细胞生物化学杂志Molecular Biology and Medicine Mol BiolMed 分子生物学与药学Federation of European BiochemistrySociety FEBS Letters ( FEBS Lett)欧洲生物化学学会联合会杂志Plant Molecular Biology Plant Mol Biol 植物分子生物学Journal of Molecular Evolution J Mol Evol 分子进化杂志Analytical Biochemistry Anal Biochem 分析生物化学Molecular Immunology MolImmunol 分子免疫学Neurochemical Research NeurochemRes 神经化学研究Molecular and Cellular Biochemistry MolCellBiochem 分子与细胞生物化学Molecular Biology Report Mol Biol Rep 分子生物学报告Proceedings of National Academy ofsciences USA PROC NATL ACADSCI USA美国国家科学院院刊四、作文1. Topic or title or head.2. Authors and their institutes.3. Abstract4. Introduction5. Materials and Methods6. Results7. Discussion8. References or literatures cited.How to write a report or paperA paperconsists of 8partsEnglish description英文叙述Chinese narrative中文叙述Part1.Topic or titleor head.(主题/标题/头)Concise and informative 简洁而信息量丰富Part2.Authors and their institutes. (作者及其所在研究机构)The name(s) of the auther(s)The affiliation(s) and address(es) of the auther(s)The e-mail address,telephone and fax numbers of the corresponding auther作者姓名作者的隶属机构和地址通讯作者的电子邮件地址,电话号码以及传真号。
生物化学期末复习资料

而被迫减慢速度甚至停顿下来,使与柠檬酸循环紧密联系的呼吸链也受 影响,从而使对O2浓度最敏感的中枢神经系统表现出缺氧。在病人肝脏 中,因柠檬酸循环的停顿而使脂类代谢中产生的乙酰辅酶A无法彻底氧 化分解,只能转变为酮体。酮体中多为酸性物质,若在血液中过量积 累,会使血液pH值下降,出现酸中毒现象。若将病人膳食中的蛋白质换 成必需氨基酸相应的α-酮酸,便可得到治疗。原因:α-酮酸与血液中 积累的氨结合,生成α-氨基酸,从而缓解了氨的高浓度积累。
基作用产生的。
2、尿素循环?
主要机理:排尿素动物在肝脏中合成尿素。由2分子α-氨基酸脱下的氨 基,即2分子氨,和1分子CO2经鸟氨酸循环,生成1分子尿素,反应需3 分子ATP参与。 尿素是无毒的近中性化合物,且为水溶性,可由血液循环经肾脏随尿排 出。
1. 合成氨甲酰基磷酸: 进入尿素循环的第1分子氨,一部分来自于肝脏线粒体中谷氨酸的氧化 脱氨基。 NH3与经柠檬酸循环生成的CO2在线粒体内氨甲酰磷酸合成酶的催化下, 生成氨甲酰磷酸。每生成1分子氨甲酰磷酸,需2分子ATP供能,所以反 应不可逆。 催化此反应的是位于线粒体内的氨甲酰磷酸合成酶Ⅰ。该酶属于调节 酶,N-乙酰谷氨酸为其正调节物。 2.形成瓜氨酸: 氨甲酰磷酸极不稳定,易将氨甲酰基供给鸟氨酸,生成瓜氨酸。鸟氨酸 本在胞液中生成,经特殊内膜传递系统传递,进入线粒体内。瓜氨酸又 离开线粒体进入胞液。 3. 形成精氨琥珀酸: 第2分子氨由天冬氨酸的氨基提供。天冬氨酸在有ATP供能的条件下,以 其氨基与瓜氨酸的氨甲酰碳原子上烯醇式的羟基缩合且脱水,产生精氨 琥珀酸。 4. 形成精氨酸: 在精氨琥珀酸裂解酶作用下,精氨琥珀酸裂解生成精氨酸和延胡索酸。 以上四步反应在所有生物体内均可进行。 5.形成尿素: 排尿素动物体内含大量精氨酸酶,此酶可将尿素从精氨酸分子上水解下 来,生成鸟氨酸。 鸟氨酸可重复进入鸟氨酸循环反应2,从而形成循环。 为何缺乏尿素循环酶类无法应用蛋白质:其蛋白质代谢中产生的氨无 法转化为尿素排出,只能以氨的形式积累在体内。 为何患者的中枢神经系统及肝脏易受到毒害:氨浓度较高时,线粒体 中发生:NH3+α-酮戊二酸+NADH+H+←→谷氨酸+NAD++H2O;α-酮戊二酸 同时又是柠檬酸循环中反应(6)的底物。所以游离氨与柠檬酸循环争 夺α-酮戊二酸并占优势,使柠檬酸循环因缺乏中间产物:α-酮戊二酸
生物化学复习资1料

生物化学复习资料一.名词解释1.等电点:(pI,isoelectric point):使氨基酸处于兼性离子状态,在电场中不迁移(分子的静电荷为零)的pH值。
缩写pI或等电pH(pHi)=1/2(pKa1+pKa2) (P133)2.等离子点:isoionic point 蛋白质或两性电解质(如氨基酸)在纯水溶液中所带净电荷为零时溶液的pH3.激素:hormone是生物体内特殊组织或腺体产生的,直接分泌到体液中,通过体液运送到特定作用部位,从而引起特殊激动效应(调节控制各种物质代谢或生理功能)的一群微量的有机化合物(P550)4.旋光性:当光通过含有某物质的溶液时,使经过此物质的偏振光平面发生旋转的现象。
可通过存在镜像形式的物质显示出来,这是由于物质内存在不对称碳原子或整个分子不对称的结果。
由于这种不对称性,物质对偏振光平面有不同的折射率,因此表现出向左或向右的旋光性。
利用旋光性可以对物质(如某些糖类)进行定性或定量分析。
(P3)5.旋光异构:两个异构化合物具有相同理化性质,但其异构现象而使偏振光的旋转方向不同的现象。
6.异头物与异头效应:单糖形成环状结构时,原来的羰基转变成羟基时形成的两种不同构型(α或β)的同分异构体。
(P9)7.糖苷:环状单糖通过半缩醛羟基与另一个化合物或基团缩合形成的缩醛(或醛酮);单糖或寡糖的半缩醛羟基与另一分子中的羟基、氨基或硫羟基等失水而产生水合物。
因此一个糖苷可分为两部分。
一部分是糖的残基(糖去掉半缩醛羟基),另一个部分是配基(非糖部分),其键称为糖苷键。
(P19)8.构型与异构(顺反异构):构型:有机分子中各个原子特有的固定的空间排列。
这种排列过共价键的断裂和重新形成是不会改变的。
构型的改变往往使分子的光学活性发生变化。
(P3下)构象:由于单键旋转引起的组成原子的不同排列。
一种构象改变为另一种构象时,不要求共价键的断裂和重新形成。
构象改变不会改变分子的光学活性。
(P11)异构:两种或多种化合物分子的组成相同,但结构和性质不同的现象。
生物化学(双语)
Protein
Contents
1. Chemical components 2. Molecular structures 3. Biological functions 4. Structure-function relationship 5. Physical and chemical properties 6. Exploration of proteins 7. Proteomics: a new frontier
• Repeating units of N(-H), C, and C(=O) constitute the backbone.
• H-bonds are responsible for stabilizing the secondary structure.
• The side chains are not considered.
Peptides can be extended by adding multiple AAs through multiple peptide bonds in a sequential order.
dipeptide, tripeptide, oligopeptide, polypeptide
Ile C6NO2H13
131
Amino acid Classification
• The R groups, also called side chains, make each AA unique and distinctive.
• R groups are different in their size, charge, hydrogen bonding capability and chemical reactivity.
生物化化学期末复习必备

生化复习:名词解释:Biochemistry(生物化学):主要是应用化学的理论和方法来研究生命现象,阐明生命现象的化学本质。
Acidic amino acid酸性氨基酸:(天冬氨酸Glu,谷氨酸Asp)侧链基团在中性溶液中解离后带负电荷的氨基酸。
Basic amino acids碱性氨基酸:(组氨酸His,精氨酸Arg,赖氨酸Lys;)侧链基团在中性溶液中解离后带正电荷的氨基酸。
Neutral polar amino acids中性氨基酸:侧链基团在中性溶液中不发生解离,因而不带电荷的氨基酸。
isoelectric point\ pI等电点:氨基酸分子带有相等正、负电荷时,溶液的pH值称为该氨基酸的等电点.蛋白质的一级结构(primary structure):是指蛋白质多肽链中通过肽键连接起来的氨基酸的排列顺序,即多肽链的线状结构。
(靠肽键维持)蛋白质的二级结构(secondary structure):是指蛋白质多肽链主链原子局部的空间结构,但不包括与其他肽段的相互关系及侧链构象的内容。
(主要化学键:氢键)蛋白质的三级结构(tertiary structure):是指蛋白质分子或亚基内所有原子的空间排布,也就是一条多肽链的完整的三维结构。
(维系三级结构的化学键主要是非共价键(次级键),如疏水键、氢键、盐键、范氏引力等,但也有共价键,如二硫键等。
)蛋白质的四级结构(quaternary structure):就是指蛋白质分子中亚基的立体排布,亚基间的相互作用与接触部位的布局。
(维系蛋白质四级结构的是氢键、盐键、范氏引力、疏水键等非共价键。
)蛋白质的变性(denaturation):在某些物理或化学因素的作用下,蛋白质严格的空间结构被破坏(不包括肽键的断裂),从而引起蛋白质若干理化性质和生物学性质的改变。
DNA的变性(denaturation):在理化因素作用下,DNA双螺旋的两条互补链松散而分开成为单链,从而导致DNA的理化性质及生物学性质发生改变。
生物化学期末复习资料

生物化学期末复习资料期末考试试题生物化学期末复习资料一、是非判断:1.edman降解反应中苯异硫**(pitc)是与氨基*的α-氨基形成ptc-氨基*。
()2.蛋白质由于带有电荷和水膜,因此在水溶液中形成稳定的胶体。
蛋白质变*后沉淀都是因为中和电荷和去水膜所引起的。
()3.如动物长期饥饿,就要动用体内的脂肪,这时分解*体速度大于生成*体速度。
()4.在天然氨基*中只限于α–nh2能与亚**反应,定量放出氮气。
脯氨*、羟脯氨*环中的亚氨*,精氨*、组氨*和*氨*环中的结合n皆不与亚**作用。
()5.使用诱导契合假说可以解释许多酶的催化机制。
()6.若双链dna中的一条碱基顺序为:pcptpgpgpapc,则另一条链的碱基顺序为:pgpapcpcptpg。
()7.技术碳原子的饱和脂肪*经β-氧化后全部生成乙酰coa。
()8.增加不可逆抑制剂的浓度,可以实现酶活*的完全抑制。
()9.酶被固定后,一般稳定*增加。
()10.所有的*脂分子中都含有甘油基。
()11.胆固醇分子中无双键,属于饱和固醇。
()12.在三羧*循环中,琥珀*脱*酶催化琥珀*氧化成延胡索*时,电子受体为ead。
()13.蛋白质变*后,其氨基*排列顺序并不发生变化。
()14.1mol葡萄糖经糖酵解途径生成乳*,需经一次脱*,两次底物水平**化过程,最终净生成2molatp分子。
()15.若没氧存在时,糖酵解途径中脱*反应产生的nadh+h+交给***生成乳*,若有氧存在下,则nadh+h+进入线粒体氧化。
()二、单项选择1.维生素pp是下列那种辅酶的组成成分?()a.nadb.coa–shc.tppd.fh2.用edman降解法测某肽的n端残基时,未发现有游离的pth–氨基*产生,问下述四种推测中,哪一种是不正确的?()a.其n端氨基*被乙酰化b.被n端氨基*是proc.此肽是环肽d.其n端氨基*是gln3.1mol葡萄糖经糖的有氧氧化过程可生成的乙酰coa(b)a.1molb.2molc.3mold.4mole.5mol4.dna经紫外线照*后会产生嘧啶二聚体,其中主要的是(c)ab.ctc.tt5.在缺氧的情况下,糖酵解途径生成的nadh+h+的去路是(b)a.进入呼吸链氧化供应量b.***还原为乳*c.3-**甘油*还原为3-**甘油醛d.醛缩酶的辅助因子合成1,6-双**果糖e.醛缩酶的辅助因子分解1,6-双**果糖6.脂肪*分解产生的乙*coa去路(b)a.合成脂肪*b.氧化功能c.合成*体d.合成胆固醇e.以上都是7.不属于两*分子的脂是(c)a.胆固醇b.*脂*c.甘油三酯d.甘油二酯e.甘油单酯8.一碳单位的载体是(b)a.二*叶*b.四*叶*c.生物素d.焦**硫*素e.硫**9.鸟氨*循环的主要生理意义是(a)a.把有毒的氨转变为无毒的主要途径b.合成非必需氨基*c.产生精氨*的主要途径d.产生鸟氨*的主要途径e.产生瓜氨*的主要途径10.在一反应体系中,[s]过量,加入一定量的i,测v~[e]曲线,改变[i],得一系列平行曲线则加入的i的是(d)a.竞争*可逆抑制剂b.非竞争*可逆抑制剂c.反竞争*可逆抑制剂d.不可逆抑制剂e.无法确定11.由w、x、y和四种蛋白质组成的混合样品,经sephsdex-g100凝胶过滤层析后,得到的层析结果如下图所示,这四种组分中相对分子质量最大的是:A.zb.wc.yd.x12.下列有关mrna的论述,哪一项是正确的?a.mrna是基因表达的最终产物b.mrna遗传密码的方向是3’→5’c.mrna遗传密码的方向是5’→3’d.mrna密码子与trna反密码子通过a-t,g-c配对结合e.每分子mrna有3个终止密码子13.不能产生乙酰coa的是a.*体b.酯*c.胆固醇d.glc14.人尿中嘌呤代谢产物主要是a.尿素b.尿*c.尿囊*d.尿囊素15.利用**来修饰酶的活*,其修饰位点通常在下列哪个氨基*残基上?a.cysb.hisc.lysd.ser16.酶的非竞争*抑制使()A.km增加b.km减少c.vmax增加d.vmax减少17.lys—ala—gly在ph7.0时所带的静电荷为()a.+2b.+1c.0d.-118.可用下列哪种方法打开蛋白质分子中的二硫键()a.用b—疏基乙醇b.用8mol/l尿素c.用水解的方法19.在厌氧条件下,下列哪一种化合物在哺乳动物肌肉组织中积累?()a.葡萄糖b.***c.乙醇d.乳*20联合脱*作用所需的酶有()a.转氨酶和d-氨基*氧化酶b.转氨*和腺苷*脱*酶c.转氨*和l-glu脱*酶d.l-glu脱*酶和腺苷*脱*酶四.简答:1.为什么说三羧*循环是糖、脂和蛋白质三大物质代谢的共同通路?答:三羧*循环的底物是乙酰辅酶a,而糖和脂类在进行分解时的最终底物正是这个乙酰辅酶a。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
生物化学复习资料Amino acid(氨基酸): All proteins are made up from the same set of 20 standard amino acids. A typical amino acid has a primary amino group, a carboxyl group, a hydrogen atom and a side-chain(R group) attached to a central α-group atom(Cα). Proline(脯氨酸)is the exception to the rule in that it has a secondary amino group.Primary structure(一级结构): The linear(线状的)sequence of amino acids joined together by peptide bonds is termed(被称为)the primary structure of the protein. The position of covalent disulfide bonds between cysteine(半胱氨酸)residues is also included in the primary structure.Secondary structure(二级结构): Secondary structure is a protein refers to the regular folding of regions of the polypeptide chain. The two most common types of secondary structure are the αhelix and βpleated sheet(β折叠).Tertiary structure(三级结构): Tertiary structure in a protein refers to the three-dimensional(三维的)arrangement of all the amino acids in the polypeptide chain. This biologically active, native conformation(构造;形态)is maintained by multiple(多重的;多样的)noncovalent (非共价的)bonds.Quaternary structure(四级结构): if a protein is made up of more than one polypeptide chain it is said to have quaternary structure. This refers to the spatial(空间的)arrangement of the polypeptide subunits(亚基;亚单位)and the nature of the interactions between them.Protein stability(蛋白质稳定性): In addition to the peptide bonds between individual amino acid residues, the three-dimensional structure of a protein is maintained by a combination of noncovalent interactions(electrostatic forces(静电力), van derWaals forces(范德华力),hydrogen bonds(氢键), hydrophobic forces(疏水作用力)) and covalent interactions(disulfide bonds(二硫键)).The Bohr effect(波尔效应): H+, CO2and 2,3-bisphosphoglycerate(2,3-二磷酸甘油酸)are allosteric effectors(变构效应剂), promoting the release of O2 from hemoglobin(血红蛋白). H+ and CO2 bind to different parts of the polypeptide chains, while 2,3-bisphosphoglycerate binds in the central cavity(凹穴)between the four subunits.Dialysis(透析): Proteins can be separated from small molecules by dialysis through asemi-permeable membrane(半透膜)which has pores that allow small molecules to pass through but not proteins.Function and diversity of collagen(胶原蛋白): Collagen is the name given to a family of structurally related proteins that form strong insoluble(不可溶的)fibers. Collagens consist of three polypeptide chains, the identity and distribution of which vary between collagen types.Gel filtration chromatography(凝胶过滤层析)Ion exchange chromatography(离子交换层析)Affinity chromatography(亲和层析)Enzymes as catalysts(作为催化剂的酶): Enzymes are catalysts(催化剂)that change the rate of a reaction without being changed themselves. Enzymes are highly specific and their activity can be regulated. Virtually all enzymes are proteins, although some catalytically active RNAs have been identified.Active site(活性位点): The active site is the region of the enzyme that binds the substrate, to form an enzyme-substrate complex, and transforms it into product. The active site is a three-dimensional entity(实体), often a cleft(裂口)of crevice(缺口)on the surface of the protein, in which the substrate is bound by multiple weak interactions. Two models have been proposed to explain how an enzyme binds its substrate: the lock-and-key model and the induced-fit model(诱导契合模型).Enzyme classification(酶的分类): Enzymes are classified into six major groups on the basis of the type of reaction that they catalyze. Each enzyme has a unique four-digit classification number.Enzyme assays(酶的测定): An enzyme assay measures the conversion of substrate to product, under conditions of cofactors, pH and temperature at which the enzyme is optimally active(最佳活性的).Coenzymes(辅酶)and prosthetic group(辅基): Some enzymes require the presence of cofactors, small nonprotein units, to function. Cofactors may be inorganic ions or complex organic molecules called coenzymes. A cofactor that is covalently attached to the enzyme is called a prosthetic group. A holoenzyme is the catalytically active form of the enzyme with its cofactor, whereas an apoenzyme(脱辅基酶蛋白)is the protein part on its own.Isoenzymes(同工酶): Isoenzymes are different forms of an enzyme which catalyze the same reaction, but which exhibit different physical of kinetic(动力学的)properties(性质).Activation energy and transition state: For a biochemical reaction to proceed, the energy barrierneeded to transform the substrate molecules into the transition state has to be overcome. The transition state has the highest free energy in the reaction pathway. The different in free energy between the substrate and the transition state is termed the Gibbs free energy of activation. An enzyme stabilizes the transition state and lowers Gibbs free energy(吉布斯自由能), thus increasing the rate at which the reaction occurs.Michaelis-Menten equation(米氏方程): v=Vmax[S]/ (Km+[S])It describe these observations and predicts a hyperbolic curve(双曲线)of V0 against [S]. The Michaelis constant, Km, is equal to the sum of the rates of breakdown of the enzyme-substrate complex over its rate of formation, and is a measure of the affinity(亲和性)of an enzyme for its substrate.Enzyme inhibition(酶的抑制): The catalytic rate of an enzyme can be lowered by inhibitor molecules. Many inhibitors exist, including normal body metabolites, foreign drugs and toxins. Enzyme inhibition can be of two main types: irreversible or reversible. Reversible inhibition can be subdivided into competitive and noncompetitive.Irreversible inhibition(不可逆抑制): An irreversible inhibition binds tightly, often covalently, to amino acid residues at the active site of the enzyme, permanently inactivating the enzyme.Reversible competitive inhibition(可逆竞争抑制): A competitive inhibitor competes with the substrate molecules for binding to the active site of the enzyme. At high substrate concentration, the effect of a competitive inhibitor can be overcome. the type of the inhibition can increase the Km ,but leave the Vmax unchanged.(Km变大,Vmax不变)Reversible noncompetitive inhibition(可逆非竞争性抑制): A noncompetitive inhibitor binds at a site other than the active site of the enzyme and decreases its catalytic rate by causing a conformational change in the three-dimensional shape of the enzyme. The effect of a noncompetitive inhibitor cannot be overcome at high substrate concentrations. This type of the inhibition can decrease Vmax ,but leave the Km unchanged.(Km不变,Vmax变小)Reversible uncompetitive inhibition(可逆反竞争性抑制): A uncompetitive inhibition binds at a site located in the substrate-enzyme complex. Thus, the type of the inhibition can decrease both the Vmax and the Km.(Km和Vmax都变小)Allosteric enzymes: A plot(绘制成的坐标图)of V0 against [S] for an allosteric enzyme gives a sigmoidal-shaped curve(S形的曲线). Allosteric enzymes usually have more than one active site which cooperatively bind substrate molecules, such that the binding of substrate at one active site induces a conformational change in the enzyme which alters the affinity of the other active sites for substrate. Allosteric enzymes are often multisubunit proteins(多亚基蛋白质), with an active site on each subunit. Two models have been proposed to explain the allosteric behavior of enzyme, the concerted or the symmetry model(齐变模型)and the sequential model(序变模型).Reversible covalent modification: The activity of many enzymes is altered by the reversiblemaking and breaking of a covalent bond between the enzyme and a small nonprotein group. The most common such modification is the addition and removal of a phosphate group(磷酸基); phosphorylation(磷酸化)and dephosphorylation(去磷酸化), respectively. Phosphorylation is catalyzed by protein kinases(蛋白激酶), often using A TP as the phosphate donor, whereas dephosphorylation is catalyzed by protein phosphatases.(蛋白磷酸酯酶或蛋白磷酸化酶)Proteolytic activation(酶原激活): Some enzymes are synthesized as larger inactive precursors (前体)called proenzymes or zymogens(酶原). These are activated by the irreversible hydrolysis(水解)of one or more peptide bonds.DNA double helix(DNA双螺旋结构): In a DNA double helix, the two strands(串;条)of DNA are wound round each other with the bases(碱基)on the inside and the sugar-phosphate backbones(磷酸糖主干)on the outside. The two DNA chains are held together by hydrogen bonds between pairs of bases; adenine(A)always pairs with thymine(T)and guanine(G)always pairs with cytosine(C). In the double helix, the two strands are organized in an antiparallel arrangement(反平行的排布)(one is oriented in the 5’→3’ , the other is in the 3’→5’).Between the sugar-phosphate strand is the gap which could be divided into two types, that is, the wide named major groove(大沟)and the narrow named minor groove(小沟).Glycogen(糖原): glycogen is a branched-chained polysaccharide containing glucose residues linked by α-1-4 bonds(α-1,4糖苷键)with α1-6 branchpoints(α-1,6糖苷键分支点). The branched nature of glycogen makes it more accessible to glycogen phosphorylase(糖原磷酸化酶)during degradation(降解), since this enzyme degrades the molecule by sequential removal of glucose residues from the nonreducing ends.Starch(淀粉): Starch is a mixture of unbranched amylase(glucose residues joined by α1-4 bonds) and branched amylopectin(glucose residues joined α1-4 but with some α1-6 branchpoints).Overview of pentose phosphate pathway(磷酸戊糖途径综述): The two major products of the pathway are nicotinamide adenine dinucleotide and ribose 5-phosphate(核糖-5-磷酸酯). Ribose 5-phosphate and its derivatives are components of important cellular molecules such as RNA, DNA, NAD+,flavine adenine dinucleotide(FAD), A TP and coenzyme A(CoA). NADPH is required for many biosynthetic pathways and particularly for synthesis of fatty acids and steroids (类固醇).Four Biological roles of fatty acids(脂肪酸的四个生理功能):1.They are components of membranes(sphingolipids and glycerophospholipids)2.Several proteins are covalently modified by fatty acids;3.They act as energy stores(triacylglycerols) and fuel molecules;4.Fatty acid derivatives serve as hormones and intracellular second messengers.Role of Citric acid cycle(柠檬酸循环,又名tricarboxylic acid cycle(三羧酸循环),简称TAC): The cycle oxidizes pyruvate(formed during the glycolytic breakdown of glucose) to CO2andH2O,with the concomitant production of energy. Acetyl CoA from fatty acid breakdown and amino acid degradation products are also oxidaized. In addition, the cycle has a role in producing precursors for biosynthetic pathways.Energy yield of Citric acid cycle(柠檬酸循环的能量产出): For each turn of the cycle,10 ATP molecules are produced, one directly from the cycle and 9 from the re-oxidation of the three NADH and one FADH2 molecules produced by the cycle by oxidative phosphorylation(氧化磷酸化).20种常见氨基酸的名称和结构式名称英文缩写结构式甘氨酸(α-氨基乙酸)Glycine Gly GCH2COONH3丙氨酸(α-氨基丙酸)Alanine Ala ACH COONH3CH3亮氨酸(γ-甲基-α-氨基戊酸)*Leucine Leu LCHCOONH3(CH3)2CHCH2异亮氨酸(β-甲基-α-氨基戊酸)* Isoleucine Ile ICHCOONH3CH3CH2CHCH3缬氨酸(β-甲基-α-氨基丁酸)*Valine Val VCHCOONH3(CH3)2CH脯氨酸(α-四氢吡咯甲酸)Proline Pro P COONH H苯丙氨酸(β-苯基-α-氨基丙酸)* Phenylalanine Phe FCHCOONH3CH2蛋(甲硫)氨酸(α-氨基-γ-甲硫基戊酸) * Methionine Met MCHCOONH3CH3SCH2CH2色氨酸[α-氨基-β-(3-吲哚基)丙酸]* Tryptophan Trp WNCH2CH COONH3H丝氨酸(α-氨基-β-羟基丙酸)Serine Ser SCHCOONH3HOCH2谷氨酰胺(α-氨基戊酰胺酸)Glutamine Gln Q CH2CH2CHCOONH3H2N CO苏氨酸(α-氨基-β-羟基丁酸)*Threonine Thr TCHCOONH3CH3CHOH半胱氨酸(α-氨基-β-巯基丙酸)Cysteine Cys CCHCOONH3HSCH2天冬酰胺(α-氨基丁酰胺酸)Asparagine Asn N CH2CHCOONH3H2N CO酪氨酸(α-氨基-β-对羟苯基丙酸) Tyrosine Tyr YCHCOONH3CH2HO天冬氨酸(α-氨基丁二酸) Aspartic acid Asp DNH3HOOCCH2CHCOO谷氨酸(α-氨基戊二酸) Glutamic acid Glu ECHCOONH3HOOCCH2CH2赖氨酸(α,ω-二氨基己酸)*Lysine Lys KCHCOONH2CH2CH2CH2CH2NH3精氨酸(α-氨基-δ-胍基戊酸)Arginine Arg RH2N C CHCOONH2NHCH2CH2CH2NH2组氨酸[α-氨基-β-(4-咪唑基)丙酸] Histidine His H NCH2CH COONH3HN* 为必需氨基酸中性脂肪族氨基酸:Gly (Gly也是二十种中唯一不含手性碳原子的氨基酸,不具有旋光性)Ala Val Lue Ile含羟基或者巯基:Ser Thr Cys Met酸性氨基酸及其酰胺:Asp Asn Glu Gln碱性氨基酸和杂环氨基酸:Lys Arg His Pro芳香族氨基酸:Phe Tyr Trp非极性R基氨基酸:Ala V al Leu Ile Pro Phe Trp Met带正电荷(碱性)R基氨基酸:Lys Arg His不带电荷的极性R基氨基酸:Gly Ser Thr Cys Tyr Asn Gln带负电(酸性)的R基氨基酸:Asp Glu在280nm附近有吸收峰的氨基酸是:Phe Tyr Trp ,其中Trp的吸收峰在280nm处最强等电点:在某一pH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,所带净电荷为零,呈电中性,此时溶液的pH称为该氨基酸的等电点。
